Method Article
Экстракорпоральное возобновлении деятельности светособирающих комплексов растений и зеленых водорослей
В этой статье
Резюме
This protocol details the reconstitution of light-harvesting complexes in vitro. These integral membrane proteins coordinate chlorophylls and carotenoids and are responsible for harvesting light in higher plants and green algae.
Аннотация
В растениях и зеленых водорослей, свет захватывается светособирающих комплексов (ВД), семейства интегральных мембранных белков, которые координируют хлорофиллов и каротиноидов. В естественных условиях, эти белки сложил с пигментами образуют комплексы, которые вставляются в мембрану тилакоида хлоропласта. Высокое сходство в химических и физических свойств членов семьи, вместе с тем, что они могут легко потерять пигменты в процессе выделения, делает их очистки в нативном состоянии сложной. Альтернативный подход для получения гомогенных препаратов ВД был разработан Plumley и Шмидта в 1987 году 1, который показал, что можно было восстановить эти комплексы в пробирке, исходя из очищенного пигментов и развернутых апопротеинов, в результате комплексов, обладающих свойствами, очень похожих на что из родной комплексы. Это открыло путь к использованию бактериальных выраженных рекомбинантных белков для в пробирке (например, пигментные сайты связывания) или домена белка (например, белок-белковое взаимодействие, складывающиеся). Этот метод был оптимизирован в нескольких лабораториях и применяется в большинстве из светособирающих комплексов. Протокол, описанный здесь подробности метода воссоздания светособирающих комплексов в пробирке в настоящее время используются в нашей лаборатории, и примеры, описывающие применение метода предусмотрены.
Введение
Фотосинтетический аппарат растений и водорослей включают интегральные мембранные белки, которые связываются хлорофилла а (хл), B (хл б) и каротиноиды (CAR). Эти пигмент-белковых комплексов активны в сбор световой энергии и передачи этой энергии возбуждения в реакционных центров, где он используется для продвижения разделение зарядов 2. Они также участвуют в регуляторных механизмов обратной связи, которые защищают фотосинтетический аппарат от высокого легкого вреда 3,4. Комплексы свет уборки (ВД) состоят из большого семейства родственных белков в растениях и водорослях 5.
Однородная очистка каждого члена семьи была осложнена высокой аналогичных химических и физических свойств комплексов. Кроме того, процедуры очистки часто приводит к потере пигментов или других потенциальных кофакторов, таких как липиды. В пробирке восстановление представиTS мощный метод для решения этих проблем. БАК, связанный с фотосистемы II (LHC-II) был впервые восстанавливали в пробирке Plumley и Шмидта в 1987 году 1. Исследователи экстрагировали очищенная от липидов и пигментов белок отдельно от хлоропластах растений, а затем в сочетании тепловой денатурированного белка с пигментами в присутствии литий додецилсульфата (СПД), а затем с помощью трех циклов замораживания и оттаивания 1. Они показали, что спектральные свойства восстановленного LHC комплексов были очень похожи на комплексов, выделенных из растений. Легкость воссоздания LHC пигмент-белковых комплексов, вероятно, связано с некоторой присущей функцией самосборки, наряду с трудностями в изоляции очищенные комплексы из организмов, привели к быстрому принятию метода другими исследователями. Восстановление фотосинтезирующих белков экспрессия в Escherichia coli (кишечная палочка) было достигнуто Полсен и коллегами в 1990 году 6. У Е.палочки, сверхэкспрессированный мембранные белки, как правило, содержится в телец включения, какие объекты их очистки. Восстановление достигается за счет тепловой денатурации из телец включений, содержащих рекомбинантный белок в присутствии LDS, с последующим добавлением пигментов который инициирует свертывание белка. Складные из LHCII комплекса состоит из двух этапов: первый, хлорофилл связан менее чем за 1 мин; Второй, хлорофилл б связан и стабилизируется в течение нескольких минут 7.
В дополнение к предоставлению понимание динамики складных, в пробирке восстановления в сочетании с сайт-направленного мутагенеза позволило выявить специфических аминокислот, важных для стабильности (например, 8,9) или координации пигмента (например, 10). Манипуляция рефолдинга условия от регулировки таких параметров, как пигментного состава или моющих средств также определили элементы Criticaл для правильного складывания, например, требование ксантофиллов для LHCII комплекса (например, 1,11). Кроме того, исследование свойств отдельных пигментов, связанных с комплексов стало возможным с помощью комплексов восстанавливают в естественных условиях (например, 10).
Метод, описанный здесь начинается с выделения пигментов (хлорофиллов и каротиноидов) из шпината и зеленой водоросли Chlamydomonas reinhardtii. Выражение и очистки LHC белка из Е. палочка в форме телец включения затем подробно, с последующим восстановлением из LHC и последующей очистки методом аффинной колонке Ni. На конечной стадии, восстановленные комплексы дополнительно очищали центрифугированием в градиенте сахарозы, чтобы удалить свободные пигменты и развернутую апобелка. Этот протокол представляет собой оптимизированный процедуру, включающую несколько модификаций, которые были введены различными лабораториями болееВремя 1,6,10,12 -14.
протокол
1 Всего Пигмент Извлечение из листьев шпината
- Однородный один небольшое количество листьев шпината (~ 20 г) в 100 мл холодной шлифовальных буфера (таблица 1) с помощью блендера в течение 20 сек.
- Раствор фильтруют через два слоя нейлоновую ткань с диаметром пор 20 мкм и фильтрат центрифуге при 1500 х г в течение 10 мин при 4 ° С.
- Ресуспендируют осадок, содержащий хлоропласты мягкой художников рисовать кистью в 1 мл холодной промывочного раствора (таблица 1). После того, как осадок ресуспендируют, добавить 50 мл промывочного буфера и центрифуге раствора при 10000 х г в течение 10 мин при 4 ° С.
- Удалить супернатант и осторожно ресуспендируют осадок (тилакоидами) в 50 мл промывочного буфера (таблица 1).
- Центрифуга раствора при 10000 х г в течение 10 мин при 4 ° С и удалить супернатант полностью. В этот момент, выполните следующие шаги в темноте, чтобы избежать окисления пигмента.
- Добавить ~ 20 мл 80% ацетона забуференной Na 2 CO 3 (см таблицу 1) для извлечения пигментов. Оставьте раствор на льду в течение 10 мин, время от времени встряхивая.
- Гранул клеточные компоненты центрифугированием при 12000 х г в течение 15 мин при 4 ° С.
Примечание: Если пигменты не полностью извлечен, а осадок будет иметь зеленый цвет и шаг 1,6 должна быть повторена. - Собирают супернатант в делительную воронку. Добавить 0,4 объемов диэтилового эфира, энергично встряхивают и открыть клапан, чтобы выразить газ.
- Добавить 0,8 объемы 0,33 М NaCl и перемешать энергично. Разрешить ~ 10 мин для слоев отделить. Эфирную фазу в верхней содержит извлеченные пигменты. Снимите прозрачную нижнюю фазу.
ПРИМЕЧАНИЕ: Если разделение не ясно, размораживать решение для улучшения разделения фаз. - Извлеките эфир путем заливки его из верхней части делительную воронку в подходящий стеклянный контейнер. Сухой, добавив ложку бабушкиулар безводным сульфатом натрия. Вихревой решение и позволить ~ 5 мин для осушителем, чтобы поглощать воду из эфира.
ПРИМЕЧАНИЕ: Повторите этот шаг, если сульфат натрия становится полностью слипаются вместе; должны быть некоторые свободно плавающие кристаллы, когда эфир достаточно сушат. Если водный слой формы, удалить это с помощью пипетки Пастера перед добавлением дополнительного безводным сульфатом натрия. - Декантировать эфир на новый стеклянного контейнера, в результате чего сульфат натрия твердое позади.
- Выпарить эфир на ротационном SpeedVac или в потоке N 2.
- Растворить пигменты полностью в 10 мл 100% ацетона.
- Развести небольшое количество (~ 3 мкл) в 1 мл 80% ацетона и измерения спектров поглощения и определить отношение Chl / B и концентрацию Chl с методом, описанным Porra и соавт. (1989) 15.
- Аликвоты и высушить пигменты на роторном SpeedVac или в атмосфере N2 потока до тех пор, пока ацетонполностью испарится. Хранить высушенные пигменты при -80 ° С.
2 Добыча Каротиноиды из шпината
- Выполните шаги 1,1 до 1,5. В этот момент, выполните следующие шаги в темноте, чтобы избежать окисления пигмента.
- Ресуспендируют тилакоидной осадок в ~ 50 мл 96% этанола забуференной Na 2 CO 3 (см таблицу 1) для извлечения пигментов. Оставьте раствор на льду в течение 5 мин.
- Гранул клеточные компоненты центрифугированием при 12000 х г в течение 15 мин при 4 ° С.
Примечание: Если пигменты не полностью извлечен, а осадок будет иметь зеленый цвет и шаг 2,2 должна быть повторена. - Собирают супернатант и добавить 0,1 объема 80% КОН (вес / объем), чтобы инициировать омыление.
- Оставьте раствор при 4 ° CO / N, плотно закрывают и защищенном от света.
- Собирают раствор в делительную воронку. Добавить 1 объем диэтилового эфира и аккуратно перемешать.
- Добавить 0,8 Volмов 0,33 М NaCl и аккуратно перемешать. Разрешить ~ 10 мин для слоев отделить. Оранжевый эфирную фазу сверху содержит омыленные каротиноиды. Извлеките нижний зеленый фазы путем ее слива через запорный кран воронки.
- Добавить 3 объемами воды и осторожно перемешать, чтобы удалить гидроксид калия. Разрешить слои отделить. ПРИМЕЧАНИЕ: Если верхняя фаза мутная, добавьте небольшое количество NaCl (например, 3 г NaCl в 200 мл раствора) и вихревой нежно распустить.
- Извлеките нижний фазы путем ее слива через запорный кран воронки.
- Выполните шаги 1,10 до 1,13.
- Развести небольшое количество (~ 3 мкл) в 1 мл 80% ацетона и измерения спектров поглощения при 440 нм в 80% ацетона. Для определения концентрации, использовать средний коэффициент ослабления для каротиноидов (ε 440 = 255) 16 в следующей формуле: Автомобиль [мг / мл] = (Abs 440 нм / 225) х 11 (оптического пути) = 1 см.
- Алиготе и высушите carotenoiDS в SpeedVac или под N 2 потока до всех диэтилэфире была выпаривают. Хранить высушенные пигменты при -80 ° С.
3 Всего Пигменты и каротиноидов Извлечение из Chlamydomonas reinhardtii
- Вырастить C. reinhardtii на твердой среде TAP 17 в чашке Петри, распространяя небольшое количество жидкой культуры на поверхность. Растут под непрерывным потоком освещенности 20 мкмоль фото PSA м -2 с -1 до зеленый слой клеток не видно.
- Используя стерильный прививки петли, собрать небольшое количество С. reinhardtii из твердого TAP среды и поместить клетки в 500 мл TAP среды 17 в колбе объемом 1 л. Grow культуру при 25 ° С с 170 оборотов в минуту перемешивании при непрерывном потоке освещенности 20 мкмоль фотографии PSA м -2 сек -1.
- Через 5-6 дней, культура должна дойти до конца логарифмической фазы (6 х 10 6 клеток / млили 2-2,5 оптическую плотность при 750 нм). Центрифуга культуры в 4000 х г в течение 15 мин при 4 ° С.
- Для полного извлечения пигмента, выполните шаги 1,6 до 1,15.
- Выход общего экстракта пигмента, начиная с 500 мл полной культуры роста C. reinhardtii составляет около 5 мл раствора с концентрацией 0,5 мг Хл + B / мл.
- Для извлечения каротиноидов, выполните шаги 2,2 до 2,12.
4 Очистка телец включения
- Клон кодирующую последовательность в LHC интерес белка в вектор экспрессии, который приводит в расплавленных С-концевой Его тега с использованием стандартных процедур молекулярной биологии. Transform эту конструкцию в E. Штамм хоста, например, BL21 (DE3).
- Подготовка буфера для лизиса, детергентов буфера, Тритон буфера, Т. (таблица 1), 1 М изопропиловые β-D-1-тиогалактопиранозид (IPTG) и LB среды 18 с соответствующими антибиотиками.
- Выберите оде Е. палочка колонию, содержащую выражение клона из свеже прожилками пластины в ~ 5 мл LB среды с соответствующими антибиотиками, используя стандартные процедуры 6. Расти при 37 ° С с перемешиванием 220 оборотов в минуту в течение по крайней мере 16 часов.
- Добавить 2,5 мл на O / N культура в колбу 1 л Эрленмейера с 250 мл LB, дополненной соответствующий антибиотик.
- Grow клеток в течение 2-3 часов (или до OD 600 не является ~ 0,6) при 37 ° С при 220 оборотах в минуту.
- Добавить IPTG до конечной концентрации 1 мМ. Продолжают расти клетки при 37 ° С с 220 оборотов в минуту 3-4 час.
- Центрифуга культуре в течение 10 мин при 5000 х г при 4 ° С в предварительно взвешивали центрифужную пробирку. Удалите супернатант тщательно и определить вес гранул путем взвешивания снова и вычитания веса центрифуги трубки.
- Ресуспендируют E. палочка осадок клеток в 0,8 мл / г буфера для лизиса энергичным встряхиванием.
Примечание: В качестве альтернативы, осадок клеток могут быть заморожены при -80С для последующего использования. Если, начиная с замороженной гранулы, позволяют полностью разморозить, прежде чем добавлять буфер для лизиса. - Добавить 2 мг лизоцима на грамм клеток, и инкубировали на льду при периодическом вортексе в течение 30 мин.
- Добавить 20 мкг / мл ДНКазы, 10 мМ MgCl 2, 1 мМ NaCl, 20 мкг / мл РНКазы. Vortex и поставить на льду в течение 30 мин.
- Добавить 2 мл холодного буфера для моющего средства на грамм клеток. Хорошо перемешайте и держите RT в течение 5 мин.
- Перевод в 2 мл центрифужные пробирки (разделить на две трубки, если это необходимо). Центрифуга в течение 10 мин при 12000 х г при 4 ° С для осаждения телец включения.
- Добавьте 1 мл холодной Triton буфер и полностью ресуспендируют осадок обработкой ультразвуком (3 импульса х 5 сек х 50% мощности с 20-секундными интервалами). ПРИМЕЧАНИЕ: Имейте трубку в небольшой стакан, окруженный ледяной водой, чтобы держать его холодным в течение ультразвуком. В случае нескольких трубок, объединить ресуспендированные тельца включения в одну трубу после ресуспендированием.
- Центрифуга течение 10 мин при 12000XG при 4 ° С для осаждения телец включения.
- Повторите шаг 4.13 и 4.14 в два раза.
- Ресуспендируют телец включения в 1 мл холодного TE с ультразвуком в течение последней промывки, чтобы удалить буфер Triton. Центрифуга в течение 10 мин при 12000 х г при 4 ° С для осаждения телец включения.
- Ресуспендируют гранул в 1 мл холодной TE обработкой ультразвуком.
- Оценка концентрации белка стандартными методами, такими как Бредфорда 19. Магазин аликвоты телец включения при -20 ° С.
5 Восстановление
Этот протокол обычно дает 1-2 мл восстановленного белка с наружным диаметром 4, когда измеряют поглощение в области Qy (600-750 нм). Количество можно регулировать по желанию, хотя следует позаботиться, чтобы поддерживать надлежащие отношения во время процедуры.
- Подготовьте следующие решения, как описано в таблице 1: 2x восстанавливающий буфер, 20% О.Г., 2 М KCl, TE. Выполните следующую секТЭЦ в тусклом свете.
- Ресуспендируют 800 мкг LHC телец включения в общей сложности 400 мкл ТЕ в 2 мл пробирке. Добавить 400 мкл 2х восстанавливающий буфер и вихревой кратко.
- Добавить 0,6 мкл β-меркаптоэтанол (складочном 14,8 M), чтобы иметь конечную концентрацию 10 мМ. Нагреть белок в течение 1 мин при 98 ° С. Vortex кратко и место при комнатной температуре в течение 3 мин.
- Ресуспендируют 500 мкг общего сушеных хлорофилла пигментов плюс 80 мкг каротиноидов пигментов в 30 мкл 100% этанола путем энергично встряхивая в течение 1 мин или место в ванной для обработки ультразвуком в течение 1-2 мин.
- Крутить пигмента микс ~ 30 сек на 15 800 мкг при 4 ° С и подтвердить, что нет осадок. Если есть осадок, повторите вортексе и / или обработка ультразвуком. ВАЖНО: После ресуспендированием и спина, сразу добавить пигмент с белком, или он может объединять и должны быть ресуспендировали снова.
- Медленно добавить пигмент смесь в охлажденный белок в то время встряхивания. Продолжайте вихря 5-10 секес и место трубки на льду. Будьте осторожны, чтобы не вихрь слишком энергично, как белок может переполнить верхней части трубки.
- Добавить 94 мкл 20% октилового β-D-глюкопиранозид (OG) (конечная концентрация 2%), вихревой кратко и держать на льду 10 мин.
- Добавить 90 мкл KCl 2 М (конечная концентрация 150-200 мм), вихря кратко и держать на льду 20 мин. ПРИМЕЧАНИЕ: Подготовку колонки (раздел 6) может быть инициирован в это время.
- Спин течение 10 мин при 15 800 мкг при 4 ° С. Удалить супернатант, не нарушая гранул (LDS) осаждают в 10 мл пробирку. Держите холод и защищенном от света месте.
6 никель Колонка Очистка
- Подготовьте следующие решения, как описано в таблице 1: О.Г. буфера, О. полоскания буфера, буфера для элюции.
- Подключите колонку Ni-сефарозу (1 мл) или эквивалент перистальтического насоса, обеспечивающего, чтобы воздух не попадает внутрь колонны во время этого шага и следующие шаги.
- Установите скорость тОн насос, чтобы 1 мл / мин и промыть колонку с 5-10 мл воды, чтобы удалить решение для хранения данных.
- Равновесие колонку с 3-4 мл буфера OG.
- Добавить 3-4 мл буфера OG в образце белка и нагрузки на колонку. ПРИМЕЧАНИЕ: если белок был, сидя на льду в течение больше чем 10 мин после удаления LDS, спина снова в 15800 мкг при 4 ° С в течение 1 мин, чтобы удалить любые дополнительные осадков LDS.
- Промыть колонку с 5 мл буфера OG.
- Промойте колонку с 2 мл О.Г. полоскания буфера.
- Элюции связанного белка с 3 мл буфера для элюции. Соберите зеленую элюата, который содержит восстановленные белок. ПРИМЕЧАНИЕ: Это, как правило, около 1 мл в общей сложности.
7 центрифугированием в градиенте сахарозы
- Подготовьте следующие решения, как описано в таблице 1: раствор сахарозы, 0,06% β-DM, 0,01 М HEPES, рН 7,6.
- Заполните Ультрацентрифуга трубки с раствором сахарозы и замораживания при температуре -20 ° СО / Н Ог -80 ° C в течение не менее 1 часа.
- Извлеките трубку из морозильной камеры и позволить, чтобы растопить в покое при 4 ° С. Примечание: Процесс замораживания / оттаивания создает градиент от 0,1 до 1 М сахарозы. 15 мл трубки обычно тает примерно 3 часа.
- Тщательно удалить из верхней и тот же объем, что и зеленой фракции, элюированной из никелевого Sepharose колонку на шаге 6.8. Затем загрузите водостойких образец сверху медленно, чтобы не потревожить градиент.
- Баланс трубы и спин на 200 000 мкг при 4 ° С в ультрацентрифуги помощью ведро ротор SW-41 или SW-60 качающуюся в течение 18 часов, установить, чтобы замедлить разгон и остановку без тормозов.
- Осторожно вынуть градиент от держателя трубки щипцами. С помощью шприца с длинной иглой, которая имеет тупой отверстие для сбора фракции из верхней части. ПРИМЕЧАНИЕ: С другой стороны, сбора фракций со дна, прокалывая трубку с иглой и сбора капель.
Результаты
Этот протокол детали метод по воссозданию chorophyll / B связывающих белков в лабораторных условиях. Этот метод позволяет складывание этих пигмент-белковых комплексов в пробирке, начиная с апобелка, которые могут быть получены путем избыточной экспрессии в гетерологичной системе, и пигменты, извлеченные из растений или водорослей. После восстановления, отогнутый пигмент-белковый комплекс очищают от избытка пигментов и разложенном апобелка в два этапа. Первый шаг (Рисунок 1 АВ) основан на присутствии His-меткой на С-конце белка, что позволяет удаление значительной части несвязанных пигментов. Вторая стадия очистки использует плотности центрифугированием в градиенте сахарозы, (рисунок 2), где развернутый белок обычно мигрирует медленнее, чем зеленой полосы, содержащей восстановленный белок. Целью восстановления в пробирке, чтобы получить комплексы с такой же собственносвязи как родные. Для иллюстрации этого результата, спектроскопические свойства в естественных условиях светособирающего комплекса по сравнению с аналогичным LHC комплекса восстановленного в пробирке 13,20,21. Спектр поглощения в ВД в видимом диапазоне (350 нм и 750 нм) в зависимости от состава пигмента комплекса, а также на окружающую среду пигмента (который включает в себя белок), и это, таким образом, чувствительным инструментом для проверки качества из разведения. На рисунке 3, в спектре поглощения CP24, хлорофилл а / б связывающий белок от Arabidopsis THALIANA, восстановленного в пробирке, сравнивается со спектром тот же комплекс очищенный от Arabidopsis тилакоиды 21. В спектрах, можно признать Qy и переход Сорэ из Chl A (пики при 671/439 нм) и B (Chl пики при 649/466 нм). Родные и восстановленные комплексы показать идентичный ABSOrption спектры, что указывает на практически идентичную композицию пигмента, и организацию. Флуоресцентной спектроскопии может быть использован для оценки качества восстановленного комплекса. Спектры флуоресценции измеряется при возбуждении на разных длинах волн, которые волнуют преимущественно различные пигменты: Хл при 440 нм, Хл б при 475 нм, и ксантофиллов при 500 нм. В правильно уложенного белка-пигмента комплекса, CHL В и ксантофиллы передают свою энергию возбуждения в первую очередь Chl а через несколько пикосекунд, и флуоресценцию происходит из термически уравновешенной системы, в результате чего один пик с тем же формы и максимумами при всех трех возбуждения Длины волн (Фиг.4А-В). Наличие Хл б не согласованы с белком могут быть признаны дополнительного пика или плеча вокруг 650 нм при 475 нм возбуждения (Рисунок 4C). Наличие свободного Chl вместо приводитв допэмиссии вокруг 675 нм, которая является главным присутствует при возбуждении 440 нм. Спектры флуоресценции при 475 нм возбуждения как восстановленный и родных CP24 комплексов (Рисунок 4D) показывают один пик при 681 нм, что свидетельствует последующим восстановлением комплекс правильно сложить. Дополнительным подтверждением того, что пигмент-белковый комплекс правильно восстановленный происходит от кругового дихроизма (КД) измерений. Сигнал CD в видимой области зависит от экситонных взаимодействий между пигментов и, таким образом очень чувствительны даже к небольшим изменениям в организации хромофоров 22. Рисунок 5 показывает CD спектры восстановленного и родной CP24, с типичными пиками отпечатков пальцев на 681 нм, 650 нм и 481 нм. В заключение, высокое сходство между спектроскопических свойств родной и восстановленный CP24 подтверждает, что доходность процедура восстановление родной-как комплексы SUITA BLE для исследования в пробирке белков светособирающих.
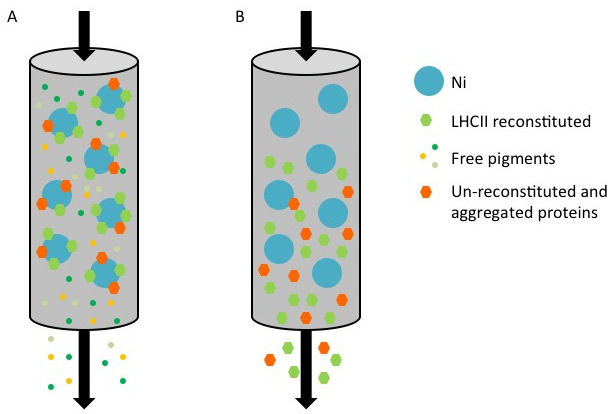
Рис.1 Представление очистки рекомбинантных белков LHC с Его тега, используя колонку никеля. (A) В процессе очистки, Его-меченого белка, состоящего из двух реконструированных комплексов (зеленый шестиугольник) и не-воссоздана / агрегированного белка (оранжевый шестиугольник) привязаны к поверхности Ni-сефарозе (голубое пятно), в то время как несвязанные пигменты (небольшие цветные пятна) течь через. (B) Когда колонна промывают элюирующий буфер, содержащий имидазола, восстановленные и ООН-воссоздана белки собираются в потоке через.
hres.jpg "ширина =" 500 "/>
Рисунок 2 градиенте сахарозы восстановленного LHCII после очистки колоночной никеля. Восстановленные комплексы отделяют от свободного пигмента по градиенту плотности. Темно-зеленый группа представляет водостойких LHCII и бледно-зеленый фон состоит из свободных пигментов.
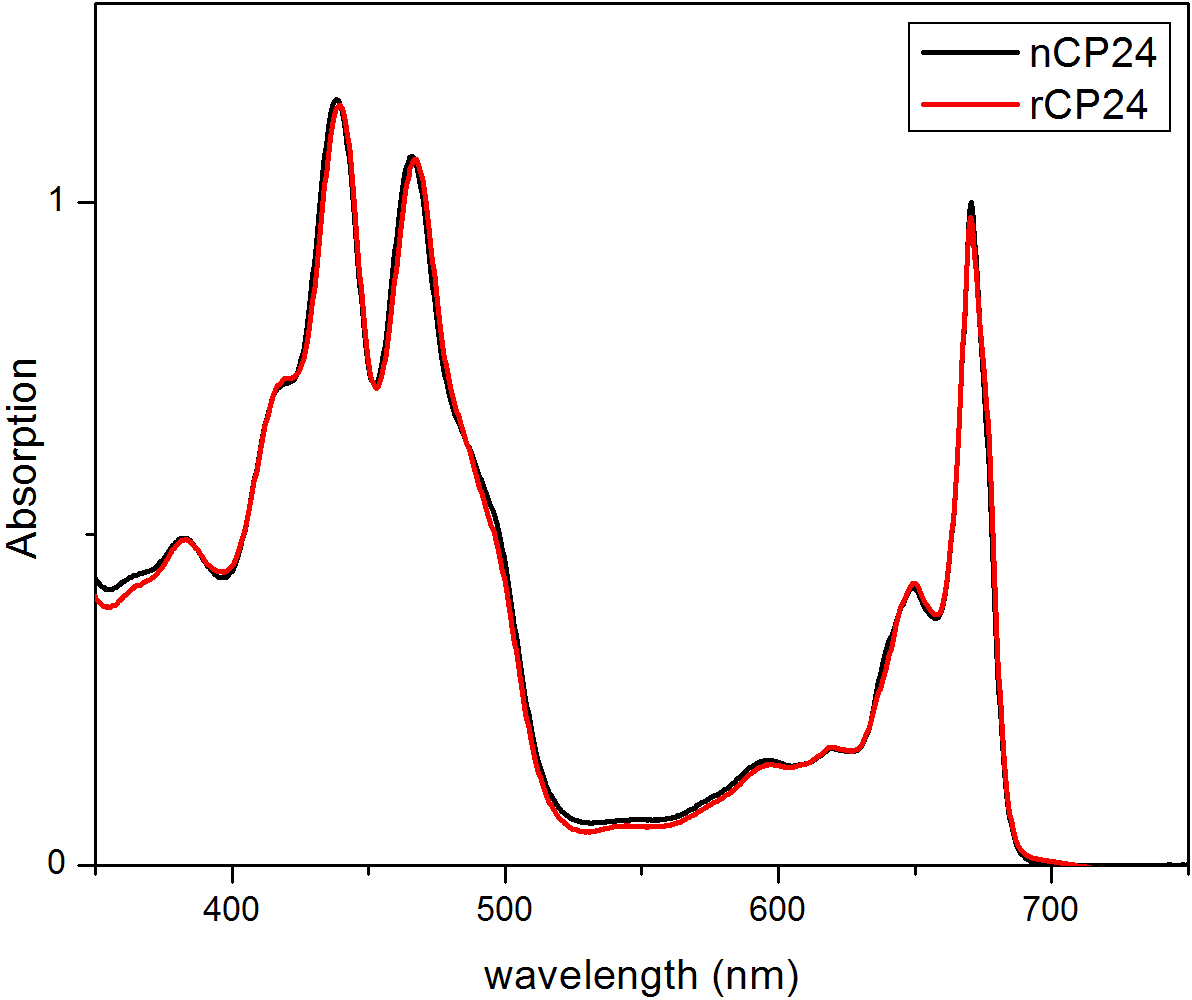
Рисунок 3 Спектры поглощения восстановленного белка CP24 (rCP24, красная линия) и нативной (nCP24, черная линия), выделенного из Arabidopsis THALIANA. В обоих спектров, можно признать Qy и переход Сорэ КХЛ в (пики в 671/439 нм) и хлорофилла Ь (пики при 649/466 нм). Эта цифра была изменена с Passarini соавт. 2014 21.
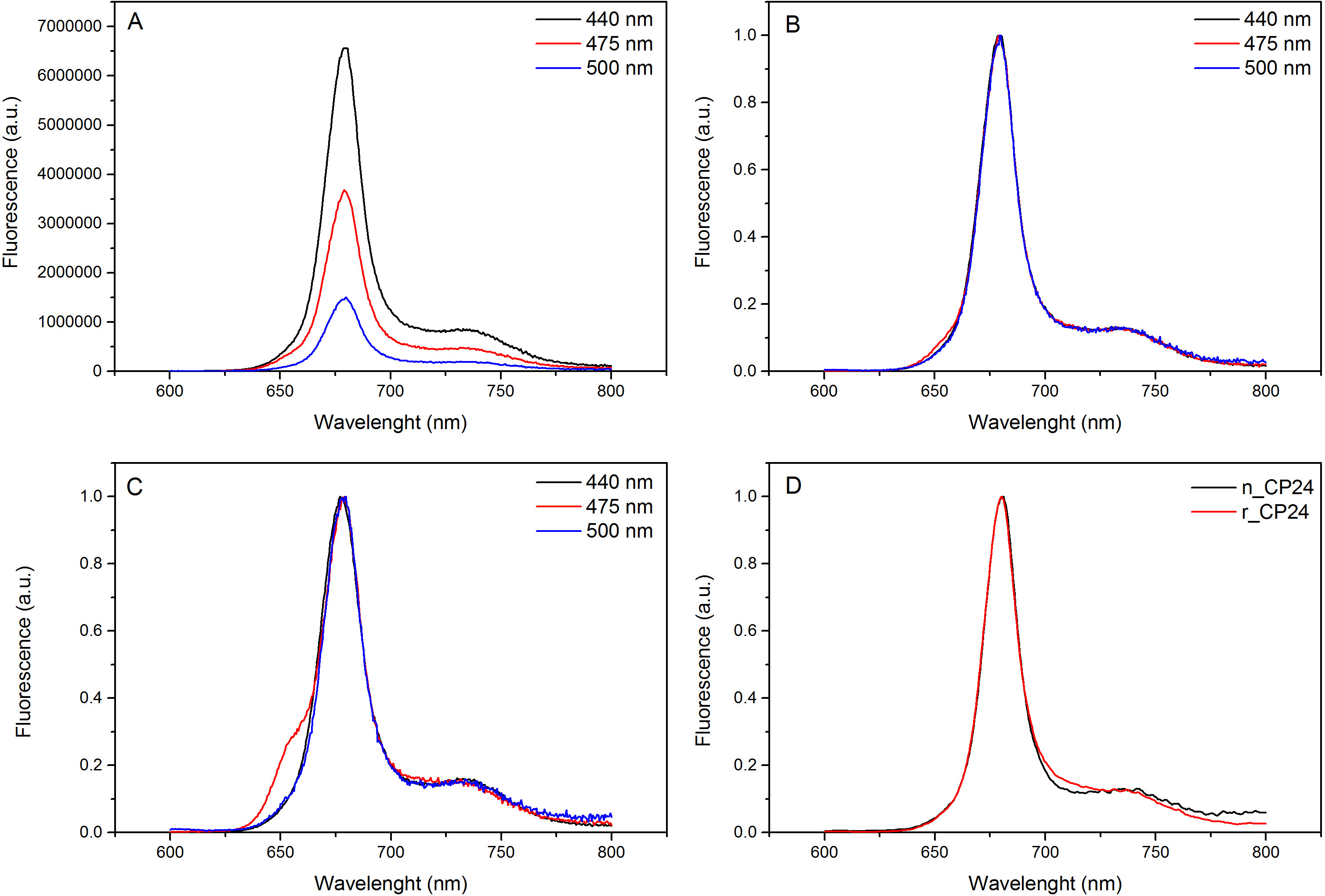
Рисунок 4 спектры излучения флуоресценции. Спектры флуоресценции восстановленного дикого типа комплекса CP24 (А) и нормированные на максимальное (B) показывает эффективную передачу энергии от хлорофилла Ь и Xanthophyls в КХЛ. (C) Спектры флуоресценции выбросов восстановленного CP24 (rCP24) и родной комплекс (nCP24), выделенных из Arabidopsis THALIANA. Спектры нормированы на максимум пика (D). Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
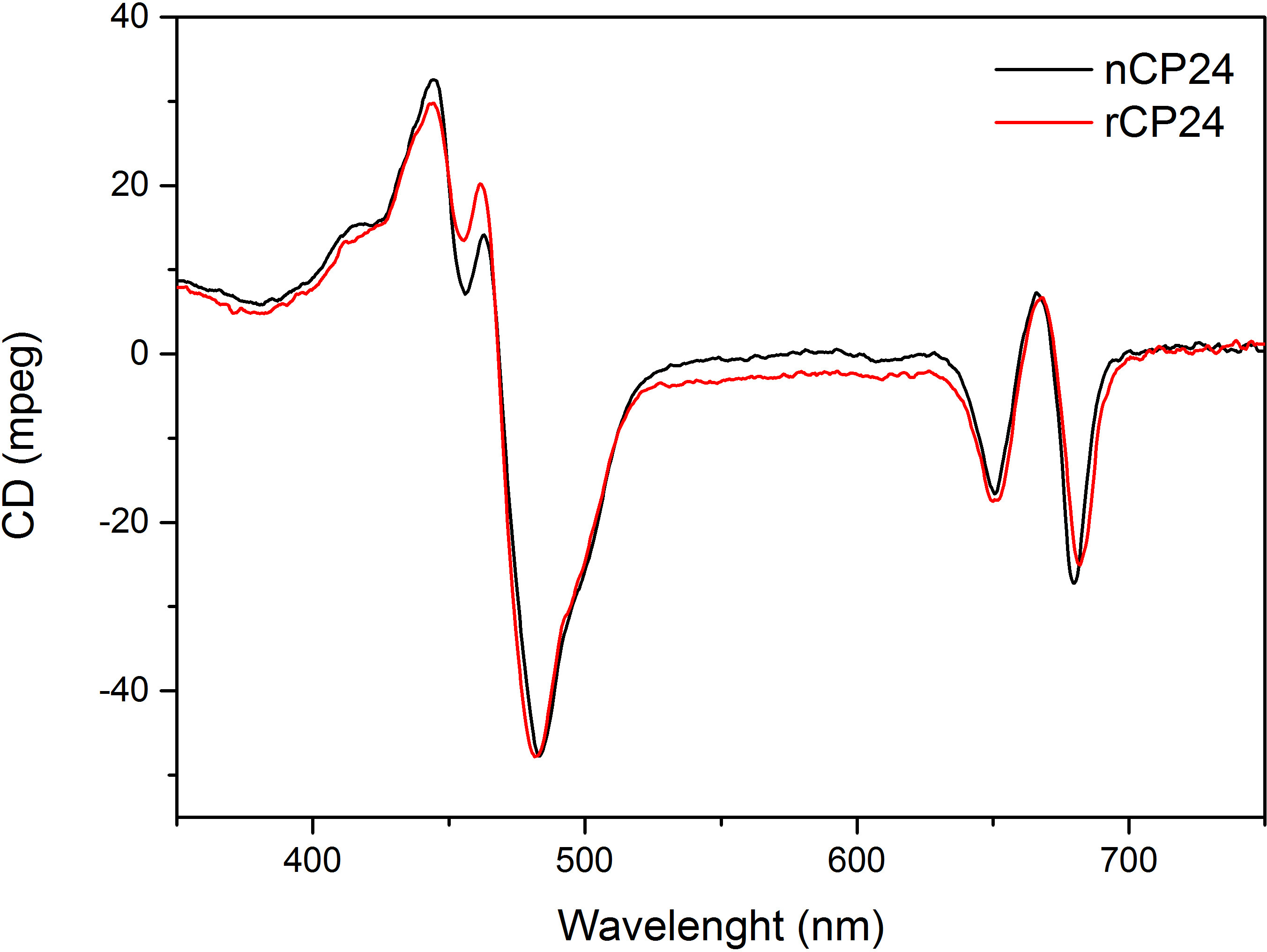
Рисунок 5 спектров кругового дихроизма. Разведенная CP24 (rCP24, красная линия) и родной комплекс (nCP24, черная линия), выделенных из Arabidopsis THALIANA показывает очень сходные спектры.

Рисунок 6 Спектры поглощения CP29 дикого типа (CP29_WT) и мутантным CP29 (CP29_A2). Зеленая линия показывает различия между двумя участками.
| Все буферы можно хранить при температуре 4 ° С. | |||
| Компоненты | Конечная концентрация | Дополнительные примечания | |
| Шлифовальные буфера | Сорбит | 0,4 М | |
| Трицин | 0,1 М | рН 7,8 | |
| NaCl | 10 мм | ||
| MgCl 2 | 5 мМ | ||
| Сухое молоко | 0,5% вес / об | ||
| Промывочного буфера | Сорбит | 50 мм | |
| Трицин | 5 мМ | рН 7,8 | |
| ЭДТА | 10 мм | рН 8 | |
| Буфера для лизиса | Трис | 50 мм | рН 8 |
| Сахароза | 2,5% вес / об | ||
| ЭДТА | 1 мм | рН 8 | |
| Моющее средство буфер | NaCl | 200 мМ NaCl | |
| Дезоксихолевой кислоты | 1% вес / об | ||
| NONIDET P-40 | 1% вес / об | ||
| Трис | 20 мМ | рН 7,5 | |
| ЭДТА | 2 мМ | рН 8 | |
| бета-меркаптоэтанола | 10 мм | ||
| Тритон буфера | Тритон Х-100 | 0,5% вес / об | |
| Трис | 20 мМ | рН 7,5 | |
| бета-меркаптоэтанола | 1 мм | ||
| Буфер TE | Трис | 50 мм | рН 8 |
| ЭДТА | 1 мм | рН 8 | |
| Восстановление буфера | HEPES | 200 мм | |
| Сахароза | 5% вес / об | ||
| Lithiumdodecylsulfate (LDS) | 4% вес / об | ||
| Бензамидина | 2 мМ | ||
| Аминокапроновая кислота | 10 мм | ||
| О.Г. буфера | Октилглюкозида | 1% вес / об | |
| 12,5% вес / об | |||
| NaCl | 0,2 М | ||
| HEPES | 20 мМ | ||
| Имидазола | 10 мм | ||
| О.Г. Промыть буфера | н-додецил-бета-D-мальтозид (β-ДМ) | 0,06% вес / об | |
| HEPES | 40 мм | рН 7,5-9 | |
| NaCl | 0,2 М | ||
| Буфера для элюции | Имидазола | 0,5 М | |
| н-додецил-бета-D-мальтозид (β-ДМ) | 0,06% вес / об | ||
| HEPES | 40 мм | рН 8 | |
| NaCl | 0,2 М | ||
| Раствор сахарозы | Сахароза | 20% вес / об | |
| н-додецил-бета-D-мальтозид (β-ДМ) | 0,06% вес / об | ||
| HEPES | 0,01 М | рН 7,6 | |
| Ацетон 80% буфером с карбонатом натрия | Ацетон | 80% об / об | |
| Карбоната натрия | 1 М | ||
| Этанол 96% забуференный с карбонатом натрия | Этанол | 96% об / об | |
| Карбоната натрия | 1 М | ||
Таблица 1 Список буферов и растворов, используемых в данном протоколе.
rCP26| Chla / б смеси | Chla / б | Хл | Хл б | Neo | Виола | Лут | Хл малыш | Хл / автомобилей | |
| nCP26 | - | 2,2 ± 0,05 | 6.2 | 2.8 | 0.61 | 0.38 | 1.02 | 9 | 4,5 ± 0,1 |
| rCP26 | 8 | 2.71 ± 0.05 | 6.57 | 2.43 | 0.72 | 0,32 | 0.97 | 3.9 ± 0.04 | |
| rCP26 | 5.5 | 2.25 ± 0.05 | 6.23 | 2.77 | 0.77 | 0.3 | 0.96 | 9 | 4.0 ± 0.1 |
| rCP26 | 3 | 2.08 ± 0.04 | 6.08 | 2.92 | 0.76 | 0.3 | 1.04 | 9 | 4.1 ± 0.1 |
| rCP26 | 1 | 1,7 ± 0,05 | 5.7 | 3.3 | 0.7 | 0.3 | 0.9 | 9 | 4,3 ± 0,05 |
| rCP26 | 0.3 | 1.11 ± 0.04 | 4.7 | 4.28 | 0.7 | 0.3 | 0.9 | 9 | 4.2 ± 0.2 |
| 0.05 | 0,23 ± 0,01 | 1.4 | 5.6 | 0.58 | 0.24 | 1.11 | 7 | 3,1 ± 0,06 | |
| rCP26 | <0.01 | 0.11 ± 0.01 | 0.7 | 6.3 | 0,64 | 0.3 | 1.08 | 7 | 3.06 ± 0.06 |
Таблица 2 Содержание пигмента из CP26 родной сложной по сравнению с восстановленным белок-пигментных комплексов с различными Chl нормативах 39 / б.
Обсуждение
Мембранные белки не так легко учиться. Выделение нативных белков мембран затруднено необходимостью для растворения липидный бислой с моющими средствами, которые могут повредить белок и удалить основные кофакторов. Эти белки также могут присутствовать на низком уровне в биологических мембранах, или смешивать с тесно связанных белков, как и в случае с легкими комплексов заготовки, что делает очистку отдельных комплексов сложных. Гетерологическая экспрессии белка в E. палочка и в пробирке восстановления дает возможность избежать этих проблем. В пробирке восстановление и очистка свернутых белков приводит к комплексам, которые обладают характеристиками, очень похожие на те, из нативных комплексов 20,21,23 и, следовательно, может быть использован для изучения комплексов, которые не могут быть очищены до гомогенности 24 - 27.
Этот метод использует шпинат, который легко attainabле круглый год, в качестве источника для общего пигментных и каротиноидов препаратов. Для некоторых reconstitutions белков родных к морским водорослям, использование пигментов, выделенных из водорослей является предпочтительным в силу различных композиций пигмента. КХЛ соотношение / б и Хл отношение / автомобиль остается тем же, независимо от источника пигмента.
Важно понимать, что эффективность восстановления, как правило, около 35% 28. При этом необходимо, чтобы удалить не связанный пигменты и развернутую апопротеина из раствора после восстановления. Протокол очистки двухступенчатый представлена в этом протоколе (см также приводит). Тем не менее, следует отметить, что ступенчатый градиент сахарозы не допускает полное разделение апо- и голо-белка. Для большинства анализов, это не является проблемой, так как апопротеин не содержит пигментов и, таким образом, не мешает функциональных измерений. Тем не менее, в случае, если необходимо полностью удалить апопротеина от фрдействия, содержащий восстановленный комплекс (например, для расчета пигмент к белковой стехиометрии), анионные обменная колонна может использоваться (см Passarini др., 2009 29 для более подробной информации).
Способность сложите рекомбинантных белков свет уборки с изолированными пигментов в пробирке дает возможность "манипулировать" комплексы, изменив реконституции «окружение» различными способами, изменяя тем самым характеристики полученного комплекса. Например, изменение состава пигмента во время восстановления может привести в комплексе с измененной композиции пигмента. Эта функция может быть использована для изучения влияния различных пигментов на структуру и стабильность комплекса. Обычно подготовка пигментом, полученным из шпината имеет A / B соотношение Хл 3: 1 и / автомобиль соотношение Хл 2,9: 1. Это отношение обычно производит восстановленный белок с теми же свойствами, что и птельной один. Тем не менее, регулировка отношение A / B Chl при добавлении очищенной Chl А или В могут влиять на связывание различных пигментов в связи с изменением селективности сайтов связывания 30 - 33. Это возможно потому, что большинство пигментов сайтов связывания не полностью селективным в отношении Chl A или B Chl, но совместимо с обоими, хотя и с различной аффинностью 10,30,34. Аналогичным образом, сайты связывания каротиноидов также показали, чтобы иметь возможность разместить более одного вида ксантофилл 8,35 - 38. Различные reconstitutions из CP26, другой пигмент-белкового комплекса высших растений, с использованием различных композиций пигментов приведены в таблице 2 39. Эти reconstitutions были использованы для оценки сродства связывающих сайтов для конкретных пигментов 39. Интересно отметить, что для того, чтобы получить комплекс с тем же пигментом сomposition как нативной, отношение Chl A / B из смеси пигмента должно быть 3: 1. Это, кажется, место для всех LHC комплексов высших растений 20,40.
Сочетание молекулярной биологии с техникой реконституции позволяет свойства Хл-связывающего комплекса, который будет изучаться более подробно. Важность различных белковых доменов на стабильность и складывания комплексов или их участие в белок-белковых взаимодействий, были определены путем усечения апопротеина или выполнение случайного мутагенеза 8,41 - 44. Остатки одной аминокислоты, важные для координации различных пигментов может быть изменено с помощью сайт-направленного мутагенеза для анализа свойств отдельных пигментов или оценить их вклад в функции и устойчивости комплексной 10,28,29,45 - 52. На рисунке 6 показан восстановленный Lhcb4 (CP29) смутация гистидин в положении 216 53. Сравнение пигментного состава дикого типа и мутантных комплексов показывает, что мутация вызывает потерю одного Хл молекула, указывая, что целевой сайт размещает Хл в комплексе WT. Различия спектров поглощения WT и мутанта, на нормализации к содержанию пигмента, также показывает, поглощающие свойства утраченного пигмента. В этом случае, разница можно увидеть в главном пика при 680 нм, что свидетельствует о КХЛ координируется His216 поглощает на этой длине волны (для более подробной информации об этом мутанта и спектроскопические свойства см Mozzo др. 2008 53). Анализ мутаций также может быть использован для определения влияния окружающей среды на спектроскопических свойств пигментов 54.
В заключение, легкие белки уборки легко могут быть восстановлены в пробирке в результате пигмента-Proteiп комплексы с очень похожими свойствами в родных комплексов. Таким образом, трудности выделения нативных белков устранены, в то же время обеспечивая белковый препарат с высоким выходом и чистотой для дальнейшего исследования. Важность соотношении 3: 1 Хл а / б в производстве аутентичный комплекс подчеркивается, и примеры восстановленного дикого типа и мутантных ВД приведены для иллюстрации применения техники.
Раскрытие информации
The authors declare no conflict of interest
Благодарности
This work was supported by the European research council by a ERC starting/consolidator grant to RC and by the Dutch Foundation for research on matter (FOM) via a FOM program (10TM01).
Материалы
| Name | Company | Catalog Number | Comments |
| HisTrap HP | GE Healthcare | 17-5247-01 | |
| Nylon cloth | 20 μm pores | ||
| Soft artists paint brush | |||
| NONIDET P-40 | Sigma | 74385 | |
| Beta-DM | Sigma | D4641 | |
| DNAase | ThermoScientific | EN0525 | |
| Milk Powders | |||
| RNAase | ThermoScientific | EN0531 | |
| Sonicator | |||
| Octyl β-D-glucopyranoside | Sigma | O8001 | |
| Ultracentrifuge XL | Beckman-Coulter | ||
| TAP medium | see reference 17 | ||
| LB medium | see reference 19 |
Ссылки
- Plumley, F. G., Schmidt, G. W. Reconstitution of chlorophyll a/b light-harvesting complexes: Xanthophyll-dependent assembly and energy transfer. Proceedings of the National Academy of Sciences of the United States of America. 84, 146-150 (1987).
- Croce, R., van Amerongen, H. Light-harvesting and structural organization of Photosystem II from individual complexes to thylakoid membrane. Journal of photochemistry and photobiology B Biology. 104 (1-2), 142-153 (2011).
- Li, Z., Wakao, S., Fischer, B. B., Niyogi, K. K. Sensing and responding to excess light. Annual review of plant biology. 60, 239-260 (2009).
- De Bianchi, S., Ballottari, M., Dall’osto, L., Bassi, R. Regulation of plant light harvesting by thermal dissipation of excess energy. Biochemical Society transactions. 38 (2), 651-660 (2010).
- Neilson, J. A. D., Durnford, D. G. Structural and functional diversification of the light-harvesting complexes in photosynthetic eukaryotes. Photosynthesis research. 106 (1-2), 57-71 (2010).
- Paulsen, H., Rümler, U., Rüdiger, W. Reconstitution of pigment-containing complexes from light-harvesting chlorophyll a/b-binding protein overexpressed in Escherichia coli. Planta. 181 (2), 204-211 (1990).
- Horn, R., Grundmann, G., Paulsen, H. Consecutive binding of chlorophylls a and b during the assembly in vitro of light-harvesting chlorophyll-a/b protein (LHCIIb). Journal of molecular biology. 366 (3), 1045-1054 (2007).
- Cammarata, K. V., Schmidt, G. W. In vitro reconstitution of a light-harvesting gene product: deletion mutagenesis and analyses of pigment binding. Biochemistry. 31 (10), 2779-2789 (1992).
- Paulsen, H., Hobe, S. Pigment-binding properties of mutant light-harvesting chlorophyll-a/b-binding protein. European journal of biochemistry / FEBS. 205 (1), 71-76 (1992).
- Bassi, R., Croce, R., Cugini, D., Sandonà, D. Mutational analysis of a higher plant antenna protein provides identification of chromophores bound into multiple sites. Proceedings of the National Academy of Sciences of the United States of America. 96 (18), 10056-10061 (1999).
- Paulsen, H., Finkenzeller, B., Kühlein, N. Pigments induce folding of light-harvesting chlorophyll a/b-binding protein. European journal of biochemistry / FEBS. 215 (3), 809-816 (1993).
- Caffarri, S., Croce, R., Cattivelli, L., Bassi, R. A look within LHCII differential analysis of the Lhcb1-3 complexes building the major trimeric antenna complex of higher-plant photosynthesis. Biochemistry. 43 (29), 9467-9476 (2004).
- Giuffra, E., Cugini, D., Croce, R., Bassi, R. Reconstitution and pigment-binding properties of recombinant CP29. European journal of biochemistry / FEBS. 238 (1), 112-120 (1996).
- Rogl, H., Kosemund, K., Kühlbrandt, W., Collinson, I. Refolding of Escherichia coli produced membrane protein inclusion bodies immobilised by nickel chelating chromatography. FEBS letters. (1-2), 21-26 (1998).
- Porra, R. J., Thompson, W. A., Kriedemann, P. E. Determination of accurate extinction coefficients and simultaneous equations for assaying chlorophylls a and b extracted with four different solvents: verification of the concentration of chlorophyll standards by atomic absorption spectroscopy. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 975 (3), 384-394 (1989).
- Davies, B. H. Identification of carotenoids by their absorption characteristics. Biochem J. 103 (2), (1967).
- Gorman, D. S., Levine, R. P. Cytochrome f and plastocyanin their sequence in the photosynthetic electron transport chain of Chlamydomonas reinhardi. Proceedings of the National Academy of Sciences of the United States of America. 54 (6), 1665-1669 (1965).
- Bertani, G. Studies on lysogenesis. I. The mode of phage liberation by lysogenic Escherichia coli. Journal of bacteriology. 62 (3), 293-300 (1951).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical biochemistry. 72, 248-254 (1976).
- Wientjes, E., Croce, R. The light-harvesting complexes of higher-plant Photosystem I Lhca1/4 and Lhca2/3 form two red-emitting heterodimers. The Biochemical journal. 433 (3), 477-485 (2011).
- Passarini, F., Xu, P., Caffarri, S., Hille, J., Croce, R. Towards in vivo mutation analysis knock-out of specific chlorophylls bound to the light-harvesting complexes of Arabidopsis thaliana - the case of CP24 (Lhcb6). Biochimica et biophysica acta. , (2014).
- Georgakopoulou, S., van der Zwan, G., Bassi, R., van Grondelle, R., van Amerongen, H., Croce, R. Understanding the changes in the circular dichroism of light harvesting complex II upon varying its pigment composition and organization. Biochemistry. 46 (16), 4745-4754 (2007).
- Croce, R., Müller, M. G., Caffarri, S., Bassi, R., Holzwarth, A. R. Energy transfer pathways in the minor antenna complex CP29 of photosystem II a femtosecond study of carotenoid to chlorophyll transfer on mutant and WT complexes. Biophysical journal. 84 (4), 2517-2532 (2003).
- Schmid, V. H., Cammarata, K. V., Bruns, B. U., Schmidt, G. W. In vitro reconstitution of the photosystem I light-harvesting complex LHCI-730 heterodimerization is required for antenna pigment organization. Proceedings of the National Academy of Sciences of the United States of America. 94 (14), 7667-7672 (1997).
- Castelletti, S., Morosinotto, T., Robert, B., Caffarri, S., Bassi, R., Croce, R. Recombinant Lhca2 and Lhca3 subunits of the photosystem I antenna system. Biochemistry. 42 (14), 4226-4234 (2003).
- Storf, S., Jansson, S., Schmid, V. H. R. Pigment binding, fluorescence properties, and oligomerization behavior of Lhca5, a novel light-harvesting protein. The Journal of biological chemistry. 280 (7), 5163-5168 (2005).
- Mozzo, M., Mantelli, M., Passarini, F., Caffarri, S., Croce, R., Bassi, R. Functional analysis of photosystem I light-harvesting complexes (Lhca) gene products of Chlamydomonas reinhardtii. Biochimica et biophysica acta. 1797 (2), 212-221 (2010).
- Remelli, R., Varotto, C., Sandonà, D., Croce, R., Bassi, R. Chlorophyll binding to monomeric light-harvesting complex. A mutation analysis of chromophore-binding residues. The Journal of biological chemistry. 274 (47), 33510-33521 (1999).
- Passarini, F., Wientjes, E., Hienerwadel, R., Croce, R. Molecular basis of light harvesting and photoprotection in CP24 unique features of the most recent antenna complex. The Journal of biological chemistry. 284 (43), 29536-29546 (2009).
- Giuffra, E., et al. Analysis of some optical properties of a native and reconstituted photosystem II antenna complex, CP29 pigment binding sites can be occupied by chlorophyll a or chlorophyll b and determine spectral forms. Biochemistry. 36 (42), 12984-12993 (1997).
- Pagano, A., Cinque, G., Bassi, R. In vitro reconstitution of the recombinant photosystem II light-harvesting complex CP24 and its spectroscopic characterization. The Journal of biological chemistry. 273 (27), 17154-17165 (1998).
- Kleima, F. J., et al. Decreasing the chlorophyll a/b ratio in reconstituted LHCII structural and functional consequences. Biochemistry. 38 (20), 6587-6596 (1999).
- Croce, R., Morosinotto, T., Castelletti, S., Breton, J., Bassi, R. The Lhca antenna complexes of higher plants photosystem I. Biochimica et biophysica acta. 1556 (1), 29-40 (2002).
- Hobe, S., Trostmann, I., Raunser, S., Paulsen, H. Assembly of the major light-harvesting chlorophyll-a/b complex Thermodynamics and kinetics of neoxanthin binding. The Journal of biological chemistry. 281 (35), 25156-25166 (2006).
- Croce, R., Weiss, S., Bassi, R. Carotenoid-binding sites of the major light-harvesting complex II of higher plants. The Journal of biological chemistry. 274 (42), 29613-29623 (1999).
- Hobe, S., Niemeier, H., Bender, A., Paulsen, H. Carotenoid binding sites in LHCIIb. Relative affinities towards major xanthophylls of higher plants. European journal of biochemistry / FEBS. 267 (2), 616-624 (2000).
- Jahns, P., Depka, B., Trebst, A. Xanthophyll cycle mutants from Chlamydomonas reinhardtii indicate a role for zeaxanthin in the D1 protein turnover. Plant Physiology and Biochemistry. 38 (5), 371-376 (2000).
- Wehner, A., Grasses, T., Jahns, P. De-epoxidation of violaxanthin in the minor antenna proteins of photosystemII, LHCB4, LHCB5, and LHCB6. The Journal of biological chemistry. 281 (31), 21924-21933 (2006).
- Croce, R., Canino, G., Ros, F., Bassi, R. Chromophore organization in the higher-plant photosystem II antenna protein CP26. Biochemistry. 41 (23), 7334-7343 (2002).
- Caffarri, S., Passarini, F., Bassi, R., Croce, R. A specific binding site for neoxanthin in the monomeric antenna proteins CP26 and CP29 of Photosystem II. FEBS letters. 581 (24), 4704-4710 (2007).
- Hobe, S., Förster, R., Klingler, J., Paulsen, H. N-proximal sequence motif in light-harvesting chlorophyll a/b-binding protein is essential for the trimerization of light-harvesting chlorophyll a/b complex. Biochemistry. 34 (32), 10224-10228 (1995).
- Kuttkat, A., Hartmann, A., Hobe, S., Paulsen, H. The C-terminal domain of light-harvesting chlorophyll-a/b-binding protein is involved in the stabilisation of trimeric light-harvesting complex. European journal of biochemistry / FEBS. 242 (2), 288-292 (1996).
- Rupprecht, J., Paulsen, H., Schmid, V. H. Protein domains required for formation of stable monomeric Lhca1- and Lhca4-complexes. Photosynthesis research. 63 (3), 217-224 (2000).
- Yang, C., et al. The negatively charged amino acids in the lumenal loop influence the pigment binding and conformation of the major light-harvesting chlorophyll a/b complex of photosystem II. Biochimica et biophysica acta. 1777 (11), 1463-1470 (2008).
- Rogl, H., Kühlbrandt, W. Mutant trimers of light-harvesting complex II exhibit altered pigment content and spectroscopic features. Biochemistry. 38 (49), 16214-16222 (1999).
- Yang, C., Kosemund, K., Cornet, C., Paulsen, H. Exchange of pigment-binding amino acids in light-harvesting chlorophyll a/b protein. Biochemistry. 38 (49), 16205-16213 (1999).
- Morosinotto, T., Castelletti, S., Breton, J., Bassi, R., Croce, R. Mutation analysis of Lhca1 antenna complex. Low energy absorption forms originate from pigment-pigment interactions. The Journal of biological chemistry. 277 (39), 36253-36261 (2002).
- Morosinotto, T., Breton, J., Bassi, R., Croce, R. The nature of a chlorophyll ligand in Lhca proteins determines the far red fluorescence emission typical of photosystem I. The Journal of biological chemistry. 278 (49), 49223-49229 (2003).
- Ballottari, M., Mozzo, M., Croce, R., Morosinotto, T., Bassi, R. Occupancy and functional architecture of the pigment binding sites of photosystem II antenna complex Lhcb5. The Journal of biological chemistry. 284 (12), 8103-8113 (2009).
- Croce, R., et al. Origin of the 701-nm fluorescence emission of the Lhca2 subunit of higher plant photosystem I. The Journal of biological chemistry. 279 (47), 48543-48549 (2004).
- Morosinotto, T., Mozzo, M., Bassi, R., Croce, R. Pigment-pigment interactions in Lhca4 antenna complex of higher plants photosystem I. The Journal of biological chemistry. 280 (21), 20612-20619 (2005).
- Mozzo, M., Morosinotto, T., Bassi, R., Croce, R. Probing the structure of Lhca3 by mutation analysis. Biochimica et biophysica acta. 1757 (12), 1607-1613 (2006).
- Mozzo, M., Passarini, F., Bassi, R., van Amerongen, H., Croce, R. Photoprotection in higher plants the putative quenching site is conserved in all outer light-harvesting complexes of photosystem II. Biochimica et biophysica acta. 1777 (10), 1263-1267 (2008).
- Wientjes, E., Roest, G., Croce, R. From red to blue to far-red in Lhca4 how does the protein modulate the spectral properties of the pigments. Biochimica et biophysica acta. 1817 (5), 711-717 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены