A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
طائرة واحدة ومنهج وحدة الإضاءة الجزئي الشعرية لالمجهر حقل واسع
In This Article
Summary
ووصف وحدة لطائرة واحدة إضاءة المجهر (SPIM) التي تتكيف بسهولة مع المجهر واسعة المجال المقلوب والأمثل لمزارع الخلايا 3 الأبعاد. يقع ضمن العينة الشعرية مستطيلة، وعبر نظام ميكروفلويديك الأصباغ الفلورية، وكلاء الصيدلانية أو المخدرات يمكن تطبيقها بكميات صغيرة.
Abstract
وحدة نمطية لورقة خفيفة أو طائرة واحدة إضاءة المجهر (SPIM) يوصف التي تتكيف بسهولة مع المجهر واسعة المجال المقلوب والأمثل لمزارع الخلايا 3 الأبعاد، على سبيل المثال، الأجسام الشبه الكروية ورم متعددة الخلايا (MCTS). وحدة الأشكال SPIM الإثارة وينحرف ضوء بحيث يضيء عينة بواسطة ورقة الخفيفة عمودي على مسار اكتشاف المجهر. يتميز النظام عن طريق استخدام الشعرية مستطيلة لعقد (وفي نسخة متقدمة أيضا نهج الشعرية الصغيرة لالدورية) العينات، قبل تعديل متزامن من الورقة إلقاء الضوء على ضوء وعدسة الهدف تستخدم للكشف عن مضان وكذلك عن طريق التكيف نظام ميكروفلويديك لتطبيق الأصباغ الفلورية، وكلاء الصيدلانية أو المخدرات بكميات صغيرة. ويرد بروتوكول للعمل مع هذا النظام، ويتم الإبلاغ عن بعض التفاصيل التقنية. وتشمل نتائج ممثلة (1) قياسات تصلتأخذ دواء تثبيط الخلايا (دوكسوروبيسين) وتحويل جزئي لمنتج تدهور، (2) قياسات الأكسدة باستخدام جهاز استشعار الجلوتاثيون المشفرة وراثيا على إضافة عامل مؤكسد، و (3) بدء ووضع العلامات من نخر الخلية على تثبيط السلسلة التنفسية الميتوكوندريا. وتناقش الخلافات ومزايا وحدة SPIM الحالية بالمقارنة مع النظم القائمة.
Introduction
بالإضافة إلى أساليب راسخة (مبائر أو متعدد الفوتون المسح المجهري بالليزر 1-4، منظم إضاءة المجهر 5،6) ورقة خفيفة أو طائرة واحدة إضاءة المجهر (SPIM) وقد ثبت أن طريقة قيمة ل3D التصوير 7،8، 9. أهمية خاصة هو تطبيقه على مزارع الخلايا 3 الأبعاد، على سبيل المثال، الأجسام الشبه الكروية ورم متعددة الخلايا (MCTS)، والتي تستخدم بشكل متزايد للبحوث اكتشاف الأدوية 10،11. وعلاوة على ذلك، SPIM هي طريقة تفضيلية عندما حتى عند التعرض على المدى الطويل أو القياسات المتكررة ويطلب جرعات الإضاءة الخافتة للمحافظة على سلامة العينة، منذ لقياس كل طائرة من العينة يتعرض فقط هذه الطائرة للضوء. هذا هو على النقيض من تقنيات الفحص المجهري الأخرى، حيث للكشف عن كل البؤري يضيء العينة كلها، حتى أنه عند تسجيل العديد من الطائرات المبالغ جرعة ضوء صعودا وقد يؤدي إلى تلف العينة 12.
ويستند المجهري ورقة خفيفة أو SPIM على إضاءة العينة في اتجاه عمودي على مسار المراقبة إما عن طريق استخدام عدسة اسطوانية أو عن طريق مسح شعاع الليزر مثيرة (لمراجعة رؤية المرجع 8). هذا غالبا ما يتطلب عينة 13،14 غرف خاصة أو المصفوفات، على سبيل المثال، الاغاروز 7،15، نفذت في المجاهر الخاصة ذات الكلفة العالية. كبديل لتلك الأنظمة وقد تم تطوير جهاز إضاءة بسيطة نسبيا لSPIM وتكييفها مع مجهر التقليدي مقلوب 16 (انظر الشكل 1). وهو يتألف من شعاع الليزر توسعت ليبلغ قطرها 8 مم وتركزت بواسطة عدسة اسطوانية (البعد البؤري: 50 مم، الفتحة العددية: 0.08) إلى ورقة الخفيفة من 6-10 ميكرون سمك على عمق الميدان من حوالي 100 ميكرون . وتقع العينات في شعري مستطيلة من 600-900 ميكرون القطر الداخلي ضعت أمام المجهر يون موضوعيق للكشف عن مضان. يتم الانتهاء من هذه الميزات الرئيسية في الوقت الحاضر والأمثل عن طريق استخدام نهج الصغيرة الشعرية المتقدمة لعقد والدورية للعينات، وتعديل متزامن من ورقة ضوء توهج (في اتجاه محوري) وعدسة الهدف تستخدم للكشف عن مضان (مسار بصري متطابقة أطوال النزوح تتطلب تصحيح العلف الميكانيكية)، وتكييف نظام ميكروفلويديك لتطبيق الأصباغ الفلورية، وكلاء الصيدلانية أو المخدرات، وبالتالي التقليل من كميات والمصاريف المطلوبة.
Protocol
1. خلية المتزايد كروي والحضانة
- التجربة 1: خلية الأجسام الشبه الكروية حضنت بعقار العلاج الكيميائي
- إعداد الاغاروز 1.5٪ في مستنبت بإضافة 0.45 غرام من الاغاروز إلى 30 مل مستنبت (يكفي لمدة 6 لوحات).
- تسخين خليط من الخطوة 1.1.1 إلى 80 درجة مئوية على الأقل مع التحريك من وقت لآخر.
- ملء 50 ميكرولتر من خليط ساخن من الخطوة 1.1.2 في كل بئر من لوحة 96 جيدا والسماح لها ترسيخ غضون 1-2 ساعة. تخزين لوحات مغلقة ومغطاة في الثلاجة عند 5 درجات مئوية حتى الاستخدام.
- البذور حوالي 150 قدم مكعبة-7 خلايا سرطان الثدي في كل بئر من إعداد لوحة 96 جيدا في التعديل المتوسطة النسر Dulbecco ل(DMEM) مع F-12 مستنبت هام لتستكمل مع المصل 10٪ العجل الجنين (FCS) و 1٪ البنسلين / الستربتومايسين .
- تنمو الأجسام الشبه الكروية لمدة 5-7 أيام حتى يبلغ قطرها حوالي 200-300 ميكرون في حاضنة في 5٪ CO 2 و 3776، C.
- احتضان الخلايا الكروية مع أنثراسيكلين هيدروكلوريد دوكسوروبيسين المضادات الحيوية لمدة 6 ساعة بتركيز يتراوح بين 2 و 8 ميكرومتر ميكرومتر (في مستنبت) في حاضنة عند 5٪ CO 2 و 37 درجة مئوية.
- غسل الخلايا الكروية مع مستنبت أو محلول ملح ايرل المتوازن (EBSS) قبل المجهري.
- التجربة 2: عملية الأكسدة في الأجسام الشبه الكروية تعبر عن استشعار الأكسدة
- البذور حوالي 400 خلايا ورم أرومي دبقي U251-MG-L106 transfected بشكل دائم مع الجلوتاثيون حساس استشعار الخضراء الأكسدة الفلورسنت Grx1-roGFP2 في الآبار المغلفة هلام الاغاروز (الإجراء الموضح في الخطوات 1.1.1-1.1.3) من 96 لوحة جيدا في DMEM مستنبت تستكمل مع FCS 10٪، 1٪ البنسلين / الستربتومايسين وهيغروميسين B (150 ميكروغرام / مل).
- تنمو الأجسام الشبه الكروية لمدة 5-7 أيام حتى يبلغ قطرها حوالي 200-300 ميكرون في حاضنة في 5٪ CO 2 و 37 درجة مئوية.
- إضافة 10 & #181؛ ل من محلول بيروكسيد الهيدروجين (purum سنويا، ≥ 30٪) إلى 990 الماء المقطر ثنائية ميكرولتر لإنشاء 100 ملي محلول المخزون لاستخدامها في غضون 12 ساعة.
- تمييع الحل الأسهم من الخطوة 1.2.3 إلى 50 ميكرومتر في EBSS الحق قبل التجربة.
- احتضان الخلايا الكروية عبر نظام ميكروفلويديك خلال قياس مع بيروكسيد الهيدروجين 50 ميكرومتر في EBSS للأكسدة استشعار الأكسدة.
- تجربة 3: بدء وضع العلامات ونخر خلوي داخل الكروية
- البذور حوالي 400 الخلايا (مثل خلايا ورم أرومي دبقي U251-MG-L106-Grx1-roGFP2) في الآبار المغلفة هلام الاغاروز (الإجراء الموضح في الخطوات 1.1.1-1.1.3) من 96 لوحة جيدا في DMEM مستنبت تستكمل مع 10٪ FCS، 1٪ البنسلين / الستربتومايسين وهيغروميسين B (150 ملغ / مل).
- تنمو الأجسام الشبه الكروية لمدة 5-7 أيام حتى يبلغ قطرها حوالي 200-300 ميكرون في حاضنة في 5٪ CO 2 و 37 درجة مئوية.
- احتضان الخليةالأجسام الشبه الكروية مع الميتوكوندريا نقل الإلكترون المانع روتينون لمدة 3 ساعة بتركيز من 1 ميكرومتر في مستنبت للحث نخر خلوي. بالإضافة إلى ذلك، شارك في احتضان مع سمية الخلايا الصبغة الخضراء لمدة 3 ساعة بتركيز 1 ميكرولتر في 1 مل مستنبت لتسمية الخلايا الميتة.
- غسل الخلايا الكروية مع مستنبت أو EBSS قبل المجهري.
2. خفيفة ورقة التعديل
ملاحظة: لتحقيق أفضل النتائج أنه لابد من التأكد من أن الخصر شعاع من ورقة الخفيفة في الطائرة بؤرة العدسة موضوعية. موقف الخصر شعاع لا يمكن إلا أن تكون محاذاة من خلال مراقبة ورقة الخفيفة في وضع عمودي بالنسبة لشعري (انظر الخطوات 2،5-2،8).
- استخدام مجهر مقلوب وتركيب وحدة الإثارة SPIM، كما هو موضح في المرجع. 16، إلى اللوح الأساس من الجدول تحديد المواقع (انظر الشكل 1A).
- تجهيز المجهر مع 10X / أو 20X 0.3 / 0.5 عدسة المجهر موضوعية ومرشح المناسب تمريرة طويلة (على سبيل المثال، λ ≥ 515 نانومتر) في مسار الكشف عن المجهر.
- جبل كاميرا دمج إلى ميناء كشف المجهر.
- استخدام شعاع موازى مواز ليزر أو ليزر ديود مع الطول الموجي من الإثارة تفضيلي 470 نانومتر وتطبيقه على وحدة SPIM.
- تدوير العدسة الأسطوانية بمقدار 90 درجة، والذي ينقل ورقة الخفيفة إلى الوضع الرأسي للتعديل المحوري الخصر شعاع من ورقة الخفيفة.
- وضع الشعرية التي تحتوي على السائل مع صبغة الفلورسنت في حامل العينة.
- إرفاق صاحب العينة مع الشعرية إلى طاولة المواقع من المجهر ومحاذاة موقف الشعرية بحيث يتم توسيط والخصر شعاع من ضوء ورقة هو في التركيز.
- ضبط الخصر شعاع من تباين الموقف المحوري للعدسة اسطوانية نفسها. العودة الى الوراء عدسة بعد الإعلانjustment.
كروي 3. خلية التطبيق والتزامن تغذية المجهر
- وضع الكروية خلية على حدة أو في مجموعات داخل الشعيرات الدموية الزجاج البورسليكات مستطيلة 16 مع المقطع العرضي الداخلي من 600 × 600 ميكرون ميكرون وسمك الجدار من 120 ميكرون. أثبتت اثنين من التقنيات لتطبيق كروي الخلية لتكون ناجحة.
- اتخاذ الشعرية فارغة تستقيم مع الإبهام والإصبع الوسطى وختم الافتتاح العلوي مع السبابة الخاص بك. جلب أقل افتتاح مقربة من خلية كروي في السائل المحيطة بها (EBSS أو مستنبت). الافراج عن السبابة من افتتاح العلوي. سوف تكون غارقة السائل مع كروي خلية في ذلك على الفور من قبل قوات الشعرية. ضبط موقف كروي داخل الشعرية يشغلها الجاذبية في وضع رأسي بكل من الشعرية.
- بدلا من ذلك، تطبيق كروي الخلية إلى الشعرية عبر pipetting ل. تأخذ ثا الرعايةر افتتاح غيض من ماصة هو، من جهة، كبيرة بما يكفي لحجم كروي و، من ناحية أخرى، أقل أو تساوي في حجمها إلى القطر الداخلي للالشعري.
- وضع شعري مع كروي في ذلك في حامل العينة خاص للفحص المجهري.
- إرفاق صاحب العينة مع الشعرية إلى طاولة المواقع من المجهر ومحاذاة موقف كروي الخلية بحيث يتم توسيط ومركزة.
- تعيين المطابقة بين الخفيفة ورقة البؤري للعدسة المجهر موضوعية في مسار الكشف عن طريق ضبط الموقف من انعكاس مرآة وعدسة الاسطوانية (انظر المسمار تعديل في الشكل 1B).
- ضبط المسمار ميكرومتر (انظر الشكل 1B) وفقا لمؤشرات الانكسار والفتحة العددية للعدسة الهدف لتعويض تأثير fishtank.
ملاحظة: مؤشرات الانكسار مختلفة من عينة وسائل الإعلام المحيطة رانه الرصاص العدسة الشيئية إلى الفرق بين التحول للعدسة موضوعية والتحول من المستوى البؤري. منذ يتم نقل ورقة الخفيفة برج موضوعي، وتعويض عدم تطابق بين التحول من ورقة الخفيفة (الموافق التحول من عدسة الهدف) والتحول من الطائرة التنسيق من قبل ذراع الرافعة (انظر الشكل 1B). يستخدم المسمار ميكرومتر على التكيف مع المسافة بين العلوي والسفلي دبوس لضبط التحول من ورقة الخفيفة وفقا لالفتحة العددية للعدسة موضوعية ومؤشرات الانكسار.
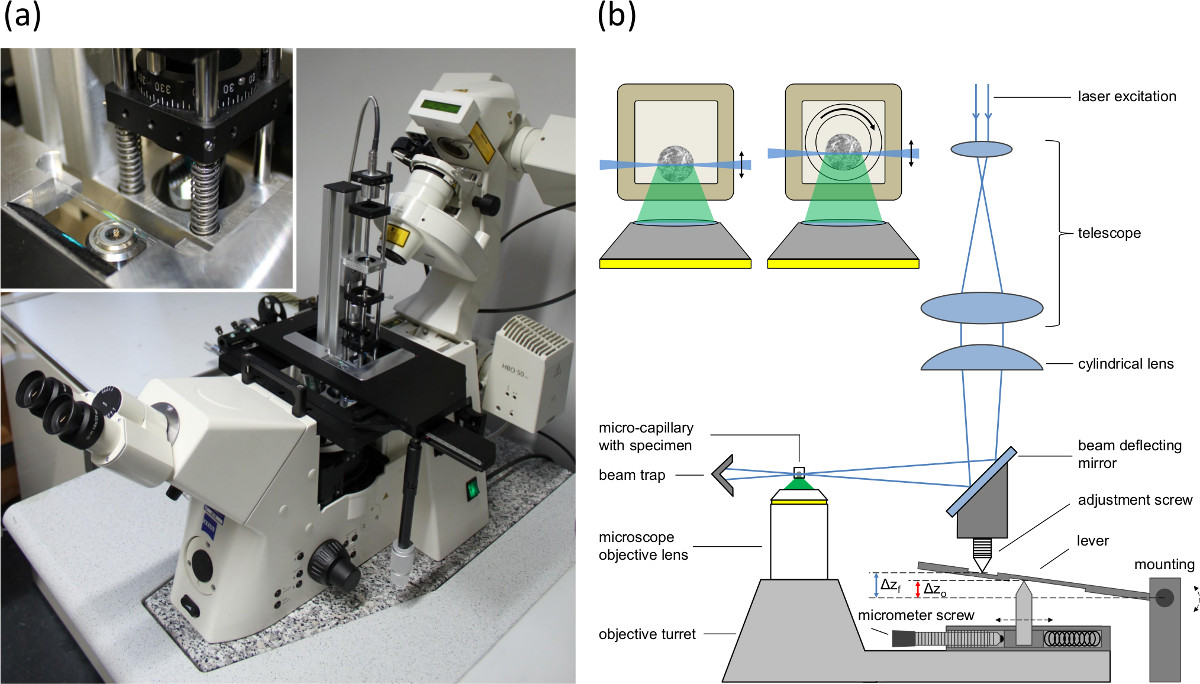
الرقم 1. (A) صورة من وحدة إضاءة طائرة واحدة شنت على اللوح الأساس من الجدول المواقع من مجهر مقلوب، (B) الإعداد للإضاءة طائرة واحدةوحدة التزامن تغذية المجهر لتعويض رفع، فمنها (تأثير fishtank) بين البؤري والطائرة الإضاءة. Δz س يشير إلى التحول للعدسة موضوعية وΔz و التحول من الطائرة الاتصال ورقة الخفيفة. يظهر ترصيع المقاطع العرضية من كروي تحتوي على الشعيرات الدموية. اليسار: الشعرية مستطيلة مع القطر الداخلي من 600 ميكرون (جدار 120 ميكرون). الحق: الإعداد المستخدمة في التناوب. وتناوب على شعري الداخلي جولة (القطر الداخلي 400 ميكرون، 550 ميكرون القطر الخارجي) داخل مستطيل الشعرية الخارجي. يملأ الفضاء بين اثنين الشعيرات الدموية مع السائل الغمر.
4. قياس السائل الحيوي في البيئة
ملاحظة: يتم استخدام البروتوكول السابق للحضانة ثابتة قبل القياس حيث سبق حضنت كروي خلية ثم عقد في مكان في شعري بواسطة الجاذبية بسيطة. ليست هناك حاجة لمزيد من fixatiعلى. ومع ذلك، لقياس التدفق في وسائل الإعلام حيث الحضانة ديناميكية، وبالتالي بيئة ديناميكية أمر مرغوب فيه لقياس حركية امتصاص، يمكن للمرء تحقيق هذا البروتوكول الفرعي. الخطوات 4،5-4،9 تعتبر بالغة الأهمية لتجنب فقاعات الهواء الوصول إلى العينة.
- ملء الشعرية مع FCS لمدة 30 دقيقة لدعم التصاق الخلية في وقت لاحق من خلية كروي على سطح الزجاج الداخلي.
- السماح للFCS الطلاء المتبقية في شعري المنضب تجف لمدة 12 ساعة على الأقل.
- إدخال كروي الخلية إلى الشعرية المغلفة FCS كما هو موضح في الخطوة 3.2.
- ترك الشعرية في الحاضنة عند 5٪ CO 2 و 37 درجة مئوية لمدة 2-4 ساعة إضافية للتسبب التصاق الخلوي للكروي.
- إعداد جزء تدافق النظام ميكروفلويديك (انظر الشكل 2). استخدام مضخة تحوي لملء تدافق من الأنبوب (القطر الداخلي: 0.89 ملم) مع الثقافة المتوسطة التي تحتوي على صبغة الفلورسنت، المخدرات أو وكيل.
- Conneط م الجزء تدافق النظام ميكروفلويديك إلى فخ فقاعة (انظر الشكل 2).
- أولا المشبك الشعرية فقاعة خالية لأنابيب تدافق ثم المشبك الجانب الآخر من الشعيرات الدموية إلى أنابيب التصريف.
- ضبط درجة حرارة السائل في حمام مائي إلى القيمة المطلوبة (على سبيل المثال، 37 ° C).
- ضبط مضخة تمعجية إلى المضخة السرعة المطلوبة (على سبيل المثال، معدل التدفق: 9 ميكرولتر / دقيقة، مضخة السرعة في الشعرية: 25 مم / دقيقة).
- جمع السائل ضخ إما في المتلقي (الإعداد حلقة مفتوحة)، وإطعام مرة أخرى إلى مصدره (الإعداد حلقة مغلقة) أو إطعام مباشرة في أنابيب المضخة تحوي (الإعداد ضيق حلقة مغلقة).
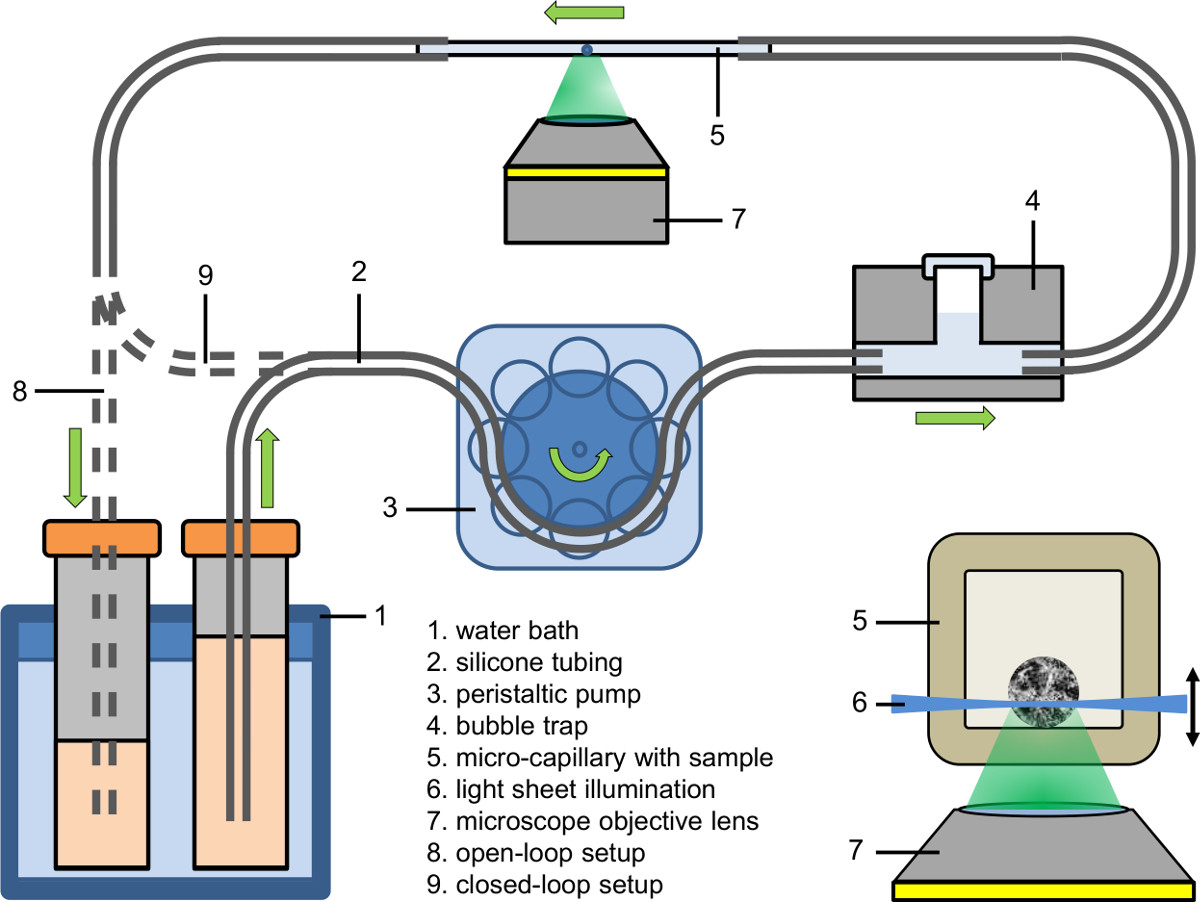
الشكل 2. الإعداد ميكروفلويديك (حلقة مفتوحة وضيق حلقة مغلقة). البطانة: الإضاءة من SPHeroid داخل الشعيرات الدموية الصغيرة باستخدام ضوء ورقة تستند المجهري مضان بالإضافة إلى مجهر مقلوب.
5. اقتناء وتحليل البيانات
- تعيين قوة الليزر والوقت التكامل لاقتناء الصورة.
- الحرص على أن المعايير المحددة في الخطوة 5.1 لا تتجاوز ضوء القيم جرعة حول 50-100 J / سم 2 للخلايا الأم أو 10-20 J / سم 2 للخلايا حضنت مع صبغة الفلورسنت أو transfected مع البلازميد ترميز بروتين فلوري ل تجنب الضيائية (لمزيد من التفاصيل انظر المرجع 12).
- تعيين الاضافة للض المكدس لΔz = 5-10 ميكرون وهي الأفضل لتحليل البيانات 3 الابعاد وسمك ورقة خفيفة حوالي 10 ميكرون.
- أداء قياسات الصور واحدة أو ض أكوام من الاختلاف في المستوى البؤري كروي داخل الخلية.
النتائج
التجربة 1: خلية الأجسام الشبه الكروية حضنت بعقار العلاج الكيميائي
وصفت تفحص ض المكدس من المحتضنة سابقا MCF-7 كروي الخلية (8 ميكرومتر دوكسوروبيسين، 6 ساعة) في الشكل 3، ويعطي معلومات مفصلة عن امتصاص الخلوية وتوزيع دو?...
Discussion
يصف المخطوطة الحالية ورقة خفيفة أو واحد المجهري إضاءة الطائرة (SPIM) الجهاز الذي هو الأمثل لأنظمة الخلايا 3 الأبعاد، على سبيل المثال، الأجسام الشبه الكروية ورم متعددة الخلايا (MCTS). وتشمل ثلاثة تطبيقات مثالية (1) امتصاص الدواء تثبيط الخلايا وتحويل جزئي لمنتج التحلل (...
Disclosures
أعلنت أي تضارب في المصالح.
Acknowledgements
وقد تم تمويل هذا المشروع من قبل لاند بادن فورتمبيرغ فضلا عن الاتحاد الأوروبي، فندق Europäischer FONDS FÜR يموت الجهوية ENTWICKLUNG. المؤلفان بالشكر راينر فيتيغ (ILM أولم) لتوفير خط خلية U251-MG-L106-Grx1-roGFP2 وكلوديا هينتز للمساعدة التقنية ماهرا.
Materials
| Name | Company | Catalog Number | Comments |
| Microtiter plate | Orange Scientific | 4430100 | For cell spheroid growing |
| Agarose | Carl Roth GmbH | 3810.1 | For cell spheroid growing |
| MCF-7 cell line | CLS Cell Lines Service GmbH | 300273 | Cell line |
| U251-MG-L106 cell line | Cell line | ||
| DMEM | Biochrom AG (Merck Millipore) | FG0435 | Culture medium |
| DMEM/Ham's F-12 | Biochrom AG (Merck Millipore) | FG4815 | Culture medium |
| FCS | Biochrom AG (Merck Millipore) | S0615 | Cell culture supplement |
| Penicillin/streptomycin | Biochrom AG (Merck Millipore) | A 2213 | Antibiotics |
| Hygromycin B | PAA Laboratories | P02-015 | Antibiotic |
| EBSS | Sigma-Aldrich Inc. | E3024 | Cell culture supplement |
| Doxorubicin | Sigma-Aldrich Inc. | D1515 | Fluorescent dye (CAUTION: acute toxicity) |
| Green cytotoxicity dye | Promega GmbH | G8742 | CellTox - fluorescent cytotoxicity dye |
| Rotenone | Sigma-Aldrich Inc. | R8875 | Cellular inhibitor (CAUTION: acute toxicity) |
| Hydrogen peroxide (H2O2) | Sigma-Aldrich Inc. | 95302 | Reagent for oxidation (CAUTION: acute toxicity) |
| Capillary | VitroCom | 8260-050 | Sample preparation |
| Microscope | Carl Zeiss Jena | Axiovert 200M | |
| AxioCam MRc CCD-camera | Carl Zeiss MicroImaging GmbH | 426508-9901-000 | CCD-camera |
| AxioVision data aquisition software | Carl Zeiss MicroImaging GmbH | version 4.8.2. | |
| Laser diode | Pico Quant GmbH | LDH-P-C-470 | Used with driver PDL800-B |
| Peristaltic pump | Ismatec Labortechnik | MS-1 Reglo | Re-calibrated to reduce the minimum pump speed by 1/10 |
| Silicone tubes | IDEX Health & Science GmbH | TYGON R3607 |
References
- Pawley, J. . Handbook of biological confocal microscopy. , (1990).
- Webb, R. H. Confocal optical microscopy. Rep. Prog. Phys. 59, 427-471 (1996).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- König, K. Multiphoton microscopy in life sciences. J. Microsc. 200 (2), 83-104 (2000).
- Neil, M. A., Juskaitis, R., Wilson, T. Method of obtaining optical sectioning by using structured light in a conventional microscope. Opt. Lett. 22 (24), 1905-1907 (1997).
- Gustafsson, M. G. L., et al. Three-dimensional resolution doubling in wide-field fluorescence microscopy by structured illumination. Biophys. J. 94 (12), 4957-4970 (2008).
- Huisken, J., Swoger, J., del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical sectioning deep inside live embryos by SPIM. Science. 305 (5686), 1007-1009 (2004).
- Huisken, J., Stainier, D. Y. R. Selective plane illumination microscopy techniques in development biology. Development. 136 (12), 1963-1975 (2009).
- Santi, P. A. Light sheet fluorescence microscopy: a review. J. Histochem. Cytochem. 59 (2), 129-138 (2011).
- Kunz-Schughart, L. A., Freyer, J. P., Hofstaedter, F., Ebner, R. The use of 3-D cultures for high throughput screening: the multi-cellular spheroid model. J. Biomol. Screen. 9 (4), 273-285 (2004).
- Schneckenburger, H., et al. Multi-dimensional fluorescence microscopy of living cells. J. Biophotonics. 4 (3), 143-149 (2011).
- Schneckenburger, H., et al. Light exposure and cell viability in fluorescence microscopy. J. Microsc. 245 (3), 311-318 (2012).
- Ritter, J. G., Veith, R., Veenendaal, A., Siebrasse, J. P., Kubitschek, U. Light sheet microscopy for single molecule tracking in living tissue. PLoS One. 5 (7), e11639:1-e11639:7 (2010).
- Mertz, J., Kim, J. Scanning light-sheet microscopy in the whole mouse brain with HiLo background rejection. J. Biomed. Opt. 15 (1), 016027 (2010).
- Fahrbach, F. O., Rohrbach, A. A line-scanned light-sheet microscope with phase shaped self-reconstructing beams. Opt. Express. 18 (23), 24229-24244 (2010).
- Bruns, T., Schickinger, S., Wittig, R., Schneckenburger, H. Preparation strategy and illumination of 3D cell cultures in light-sheet based fluorescence microscopy. J. Biomed. Opt. 17 (10), 101518 (2012).
- Ma, H. L., et al. Multicellular tumor spheroids as an in vivo-like tumor model for three-dimensional imaging of chemotherapeutic and nano material cellular penetration. Mol. Imaging. 11 (6), 487-498 (2012).
- Weber, P., Wagner, M., Schneckenburger, H. Cholesterol dependent uptake and interaction of doxorubicin in MCF-7 breast cancer cells. Int. J. Mol. Sci. 14 (4), 8358-8366 (2013).
- Hovorka, O., et al. Spectral analysis of doxorubicin accumulation and the indirect quantification of its DNA intercalation. Eur. J. Pharm. Biopharm. 76 (3), 514-524 (2010).
- Schickinger, S., Bruns, T., Wittig, R., Weber, P., Wagner, M., Schneckenburger, H. Nanosecond ratio imaging of redox states in tumor cell spheroids using light sheet-based fluorescence microscopy. J. Biomed. Opt. 18 (12), 126007 (2013).
- Lippert, H., Wald, M., Radt, B. Optical arrangement for the production of a light sheet. U.S. Patent. , (2010).
- Lorenzo, C., et al. Live cell division dynamics monitoring in 3D large spheroid tumor models using light sheet microscopy. Cell Division. 6 (22), 1-8 (2011).
- Bruns, T., Schneckenburger, H., Schickinger, S. Sample holder for rotation of three-dimensional specimens in microscopy. European Patent Application. , (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved