É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Único plano Iluminação Módulo e Abordagem Micro-capilar por um microscópio Wide-campo
Neste Artigo
Resumo
Um módulo para microscopia de iluminação plano único (SPIM) está descrito que é facilmente adaptado a um microscópio de campo amplo invertido e optimizado para culturas de células de 3-dimensionais. A amostra está localizado dentro de um capilar rectangular, e através de um sistema de microfluidos corantes fluorescentes, agentes farmacêuticos ou de drogas pode ser aplicada em pequenas quantidades.
Resumo
Um módulo de folha de luz ou microscopia de iluminação plano único (SPIM) está descrito que é facilmente adaptado a um microscópio de campo amplo invertido e optimizado para culturas de células de 3-dimensional, por exemplo, esferóides multicelulares tumorais (TCM). As formas de módulos SPIM excitação e deflecte a luz de tal modo que a amostra é iluminada por uma folha de luz perpendicular ao percurso de detecção do microscópio. O sistema é caracterizado pela utilização de um capilar para a realização rectangular (e em uma versão avançada também por uma abordagem de micro-capilar para rotação) das amostras, através de ajuste da folha síncrono de luz que ilumina a lente objectiva e usado para a detecção de fluorescência, bem como , por adaptação de um sistema de microfluidos para a aplicação de corantes fluorescentes, agentes farmacêuticos ou drogas em pequenas quantidades. Um protocolo para trabalhar com este sistema é dado, e alguns detalhes técnicos são relatados. Os resultados representativos incluem (1) medição da acimater de uma droga citostática (doxorrubicina) e a sua conversão parcial para um produto de degradação, (2) as medições redox por utilização de um sensor de glutationa geneticamente codificado por adição de um agente oxidante, e (3) a iniciação e rotulagem de necrose celular da inibição da a cadeia respiratória mitocondrial. Diferenças e vantagens da presente módulo SPIM em comparação com os sistemas existentes são discutidos.
Introdução
Além de métodos bem estabelecidos (confocal ou multi-fotão microscopia de varredura a laser 1-4, estruturado de microscopia de iluminação 5,6) folha de luz ou de microscopia de iluminação plano único (SPIM) tem provado ser um método valioso de imagens 3D 7,8, 9. De particular interesse é a sua aplicação a culturas de células de 3 dimensões, como por exemplo, esferóides multicelulares tumorais (TCM), que são cada vez mais utilizados para a investigação de descoberta de fármacos 10,11. Além disso, o SPIM é um método preferencial quando mesmo após a exposição a longo prazo ou medidas repetidas doses de pouca luz são necessárias para manter a viabilidade da amostra, uma vez que para a medição de cada plano da amostra somente este plano será exposto à luz. Isto está em contraste com outras técnicas de microscopia, em que para a detecção de cada plano focal toda a amostra é iluminado, de modo que após a gravação de numerosos aviões as somas de dose de luz e podem danificar-se a amostra 12.
A microscopia de luz ou SPIM folha baseia-se na iluminação da amostra no sentido perpendicular à linha de observação ou pela utilização de uma lente cilíndrica, ou através da leitura do feixe de laser excitante (para uma revisão ver ref. 8). Isso muitas vezes requer câmaras de amostras especiais 13,14 ou matrizes, por exemplo, agarose 7,15, implementado em microscópios especiais de alto custo. Como uma alternativa aos sistemas de um dispositivo de iluminação para comparavelmente simples SPIM foi desenvolvido e adaptado para um microscópio invertido convencional 16 (ver Figura 1). É constituída por um feixe laser expandido até um diâmetro de 8 mm e focada por uma lente cilíndrica (distância focal: 50 mm, abertura numérica: 0,08) para uma folha de luz de espessura 6-10 uM sobre uma profundidade de campo de cerca de 100 pm . As amostras estão situadas num capilar rectangular de 600-900 um de diâmetro interno colocado em frente do len objectivo microscópios para a detecção de fluorescência. Estas características principais são actualmente preenchido e optimizado pelo uso de avançadas abordagens de micro-capilares para segurar e para fazer rodar as amostras, o ajustamento síncrono da folha de luz iluminante (na direcção axial) e a lente objectiva utilizados para a detecção de fluorescência (caminho óptico idêntico comprimentos de deslocamento exigem uma correcção do arrastamento mecânico), bem como a adaptação de um sistema de microfluídica para aplicação de corantes fluorescentes, agentes farmacêuticos ou drogas, minimizando, assim, as quantidades e as despesas necessárias.
Protocolo
1. celular em crescimento esferóide e Incubação
- Experimento 1: celulares esferóides incubadas com um quimioterápico
- Prepare de agarose a 1,5% em meio de cultura pela adição de 0,45 g de agarose de 30 ml de meio de cultura (suficiente para 6 placas).
- Aquece-se a mistura a partir do passo 1.1.1 a, pelo menos, 80 ° C, com agitação de vez em quando.
- Encher 50 ul da mistura aquecida do passo 1.1.2 em cada poço de uma placa de 96 poços e deixar solidificar dentro de 1-2 horas. Armazene as placas fechado e coberto na geladeira a 5 ° C até o uso.
- Semente de cerca de 150 células MCF-7 de cancro da mama em cada poço do preparado placa de 96 poços em Meio de Eagle Modificado por Dulbecco (DMEM) com meio F-12 de cultura de Ham suplementado com 10% soro fetal de vitelo (FCS) e 1% de penicilina / estreptomicina .
- Grow esferóides de 5-7 dias até um diâmetro de cerca de 200-300 um numa incubadora a 5% de CO 2 e 3776; C.
- Incubar os esferóides de células com o antibiótico antraciclina doxorubicina cloridrato de 6 horas a uma concentração que varia entre 2 um e 8 uM (em meio de cultura) em uma incubadora a 5% de CO 2 e 37 ° C.
- Lavar os esferóides de células com meio de cultura ou solução salina equilibrada de Earle (EBSS) antes da microscopia.
- Experimento 2: processo de oxidação em esferóides expressando um sensor redox
- Semente de cerca de 400 células de glioblastoma U251-MG-L106 permanentemente transfectadas com a glutationa sensível do sensor redox fluorescente verde Grx1-roGFP2 em poços revestidos com gel de agarose (procedimento descrito nos passos itens 1.1.1-1.1.3) de uma placa de 96 poços em DMEM meio de cultura suplementado com 10% de FCS, 1% de penicilina / estreptomicina e higromicina B (150 ug / ml).
- Grow esferóides de 5-7 dias até um diâmetro de cerca de 200-300 um numa incubadora a 5% de CO 2 e 37 ° C.
- Adicionar 10 & #181; litros de uma solução de peróxido de hidrogénio (purum aa, ≥ 30%) a 990 ul de água bi-destilada para criar uma solução de estoque de 100 mM para ser usado no prazo de 12 horas.
- Dilui-se a solução-mãe a partir do passo 1.2.3 a 50 uM em EBSS direita antes da experiência.
- Incubar os esferóides de células através do sistema de microfluidos durante a medição de peróxido de hidrogénio com 50 ^ M em EBSS para a oxidação do sensor redox.
- Experimento 3: Iniciação e rotulagem de necrose celular dentro de esferóides
- Semente de cerca de 400 células (por exemplo, células de glioblastoma U251-MG-L106-Grx1-roGFP2) em poços revestidos com gel de agarose (procedimento descrito nos passos itens 1.1.1-1.1.3) de uma placa de 96 poços em meio de cultura DMEM suplementado com 10% de FCS, 1% de penicilina / estreptomicina e higromicina B (150 mg / ml).
- Grow esferóides de 5-7 dias até um diâmetro de cerca de 200-300 um numa incubadora a 5% de CO 2 e 37 ° C.
- Incubar a célulaesferóides com o inibidor de transporte de electrões mitocondrial rotenona durante 3 horas a uma concentração de 1 uM em meio de cultura para induzir a necrose celular. Além disso, a co-incubação com um corante verde citotoxicidade durante 3 horas a uma concentração de 1 ml em 1 ml de meio de cultura de modo a marcar células necróticas.
- Lave os esferóides de células com meio de cultura ou EBSS antes de microscopia.
2 Ajuste folha de luz
NOTA: Para alcançar melhores resultados tem que ser assegurado que a cintura do feixe da folha de luz está no plano de foco da lente objetiva. A posição do feixe de cintura apenas podem ser alinhadas por meio da observação da folha de luz na posição vertical relativamente ao capilar (ver passos 2,5-2,8).
- Usar um microscópio invertido e montar o módulo de excitação SPIM, como descrito na referência. 16, para a placa de base da mesa de posicionamento (ver a Figura 1A).
- Equipar o microscópio com um 10X / 0,3 ou 20X / lente objectiva de microscópio de 0,5 e um filtro de passagem longa apropriado (por exemplo, λ ≥ 515 nm) no caminho de detecção do microscópio.
- Montar uma câmara integrando para o orifício de detecção do microscópio.
- Usar um feixe colimado paralelo de um laser ou de um díodo de laser com um comprimento de onda de excitação de 470 nm, preferencialmente, e aplicá-lo ao módulo SPIM.
- Gire a lente cilíndrica de 90 graus, o que transfere a folha de luz em uma posição vertical para um ajuste axial da cintura do feixe da folha de luz.
- Coloque um capilar contendo um líquido com um corante fluorescente no suporte da amostra.
- Montar o suporte da amostra, com o capilar para a mesa de posicionamento do microscópio e alinhar a posição do capilar de tal forma que ele é centrado e a cintura do feixe de luz da folha está em foco.
- Ajustar a cintura do feixe por variação da posição axial da própria lente cilíndrica. Volte a lente após anúncioajusta-.
Aplicação Esferóide 3. celular e sincronização de alimentação Microscópio
- Colocar os esferóides de células separadamente ou em grupos dentro de borosilicato rectangular capilares de vidro 16 com uma secção transversal interna de 600 um x 600 ^ m e uma espessura de parede de 120 um. Duas técnicas de aplicação de um esferóide das células provaram ser bem sucedidas.
- Leve o capilar vazio na posição vertical com o polegar eo dedo médio e selar a abertura superior com o dedo indicador. Traga a abertura inferior perto do esferóide de células em seu líquido circundante (EBSS ou meio de cultura). Solte o dedo indicador da abertura superior. Líquido com o esferóide de células em que vai ser embebido em imediatamente por forças capilares. Ajustar a posição do esferóide dentro do capilar cheio pela gravidade na respectiva posição vertical do capilar.
- Alternativamente, aplicam-se os esferóides de células para o capilar por meio de pipetagem. Tome cuidado that da abertura da ponta da pipeta é, por um lado, suficientemente grande para o tamanho do esferóide e, por outro lado, inferior ou igual em tamanho que o diâmetro interno do capilar.
- Colocar o tubo capilar com o esferóide nele num suporte de amostras para a microscopia especial.
- Montar o suporte da amostra, com o capilar para a mesa de posicionamento do microscópio e alinhar a posição do esferóide de células de tal modo que é centrada e focada.
- Definir a correspondência entre a folha de luz e o plano focal da lente objectiva de microscópio, no caminho de detecção através do ajuste da posição da reflexão de espelho e a lente cilíndrica (ver parafuso de ajuste na Figura 1B).
- Ajustar o parafuso micrométrico (ver Figura 1B) de acordo com os índices de refracção e a abertura numérica da lente objectiva para compensar o efeito de aquário.
NOTA: Diferentes índices de refração da amostra e os meios de comunicação ao redor tele chumbo lente objetiva para a diferença entre o deslocamento da lente objetiva ea mudança do plano focal. Uma vez que a folha de luz é movida pela torre objectivo, a incompatibilidade entre o deslocamento da folha de luz (que corresponde ao deslocamento da lente objectiva) e o deslocamento do plano focal é compensado por um braço de alavanca (ver Figura 1B). O parafuso micrométrico é usado para adaptar a distância entre a parte superior e inferior do pino para ajustar o deslocamento da folha de luz de acordo com a abertura numérica da lente objectiva e os índices de refracção.
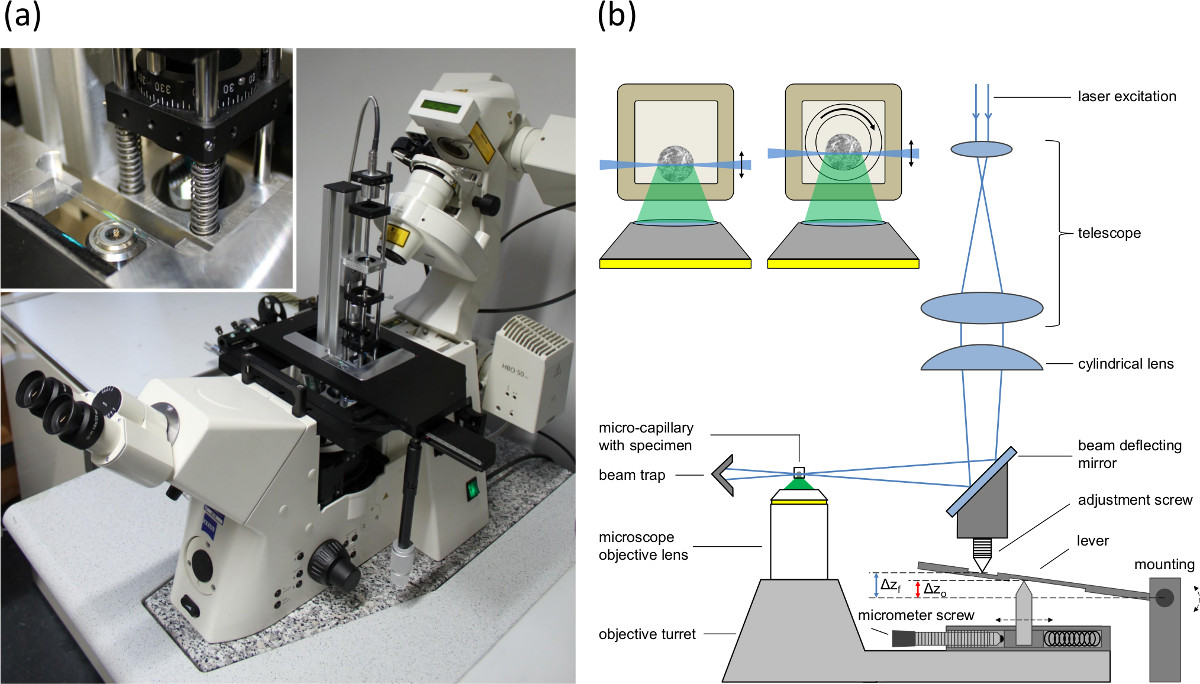
A Figura 1 (A) Imagem do módulo de iluminação plano único montado na placa de base da mesa de posicionamento de um microscópio invertido, (B) a instalação da iluminação único planomódulo ea sincronização de alimentação microscópio para compensar a elevação-incompatibilidade (efeito aquário) entre o plano focal eo plano de iluminação. Δz o indica o deslocamento da lente objetiva e Δz f a mudança do plano focal ea folha de luz. A capa mostra seções transversais de esferóides contendo capilares. Esquerda: capilar rectangular com diâmetro interior de 600 um (parede 120 um). Direita: Setup utilizado para a rotação. Um capilar interna redonda (diâmetro interno 400 um, diâmetro externo de 550 mm) é rodado dentro do capilar rectangular exterior. O espaço entre os dois capilares é enchido com um fluido de imersão.
4. Medição em Dinâmica meio líquido
NOTA: O protocolo anterior é usado para incubação estática antes de uma medição onde o esferóide de células tenha sido previamente incubadas e mantido no lugar no capilar pela gravitação simples. Não há necessidade de mais FIXAÇÃOna. No entanto, para as medições em meios em que uma incubação dinâmico e, por conseguinte, um ambiente dinâmico é desejável medir a cinética da captação de fluxo, pode-se realizar este sub-protocolo. Passos 4,5-4,9 são fundamentais para evitar bolhas de ar que atingem a amostra.
- Encher o capilar com FCS durante 30 min para suportar a adesão celular, depois de um esferóide célula para a superfície de vidro interior.
- Deixe o revestimento FCS remanescente no capilar empobrecido secar durante pelo menos 12 horas.
- Introduzir o esferóide de células para o capilar revestido de FCS, tal como descrito na etapa 3.2.
- Deixar o capilar na incubadora a 5% de CO 2 e 37 ° C durante 2-4 horas adicionais para fazer com que a adesão celular do esferóide.
- Configure o afluxo parte do sistema de microfluídica (ver Figura 2). Usar uma bomba peristáltica para preencher o afluxo da tubagem (diâmetro interno: 0,89 mm) com meio de cultura contendo o corante fluorescente, fármaco ou agente.
- Connect o afluxo parte do sistema de microfluidos de uma armadilha de bolhas (ver Figura 2).
- Em primeiro lugar prender o capilar livre de bolhas para a tubagem de afluxo e, em seguida, apertar o outro lado do capilar para o tubo de drenagem.
- Ajustar a temperatura do líquido do banho de água para o valor desejado (por exemplo, 37 ° C).
- Ajustar a bomba peristáltica para a velocidade da bomba desejado (por exemplo, taxa de fluxo: 9 mL / min, velocidade de bomba no capilar: 25 mm / min).
- Recolha o líquido bombeado ou em uma (instalação de circuito aberto) destinatário, alimentá-lo de volta à sua fonte (instalação de circuito fechado) ou alimentá-lo diretamente para o tubo da bomba peristáltica (instalação de circuito fechado apertado).
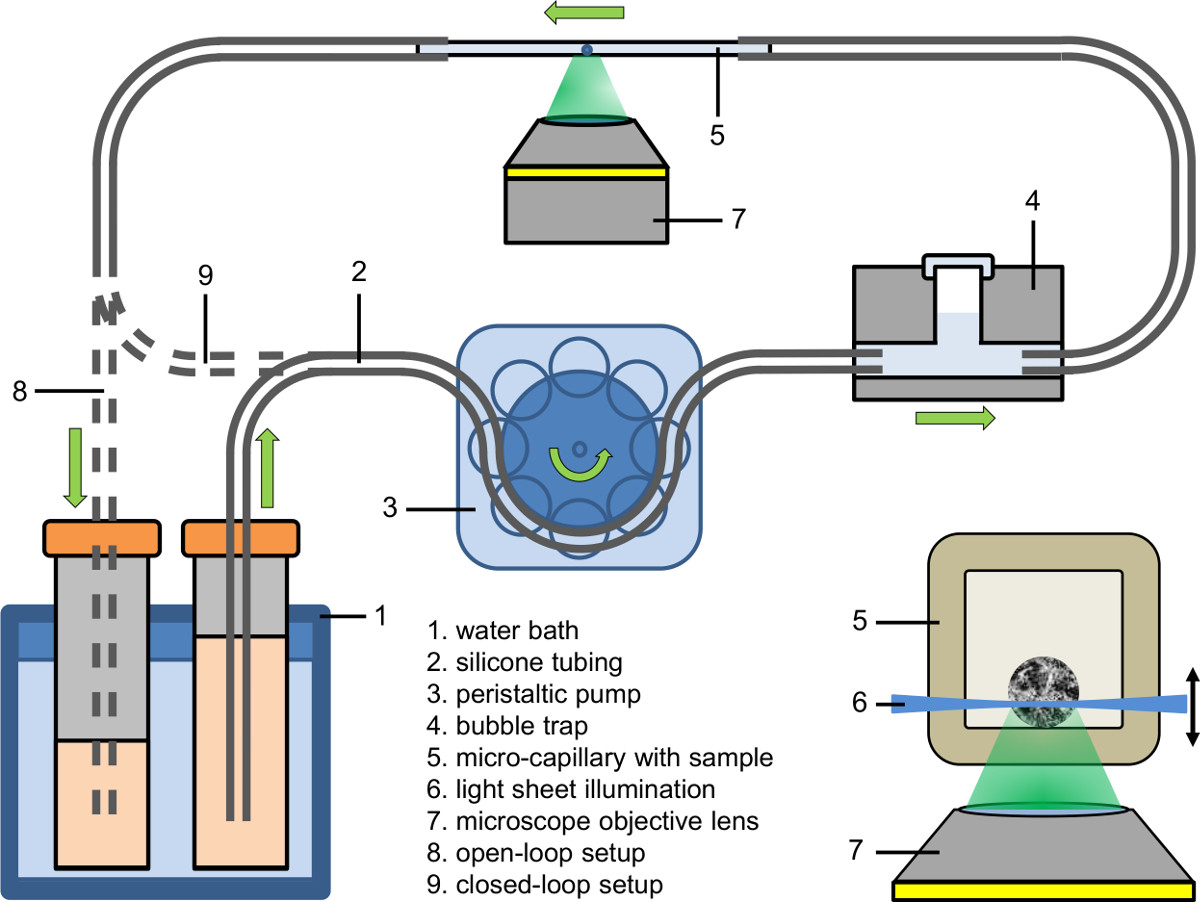
Figura 2 configuração microfluídicos (open-loop e apertado em circuito fechado); inlay: Iluminação de um spheroid dentro de um micro-capilar usando microscopia de fluorescência de luz folha de base acoplado a um microscópio invertido.
5 Aquisição de Dados e Análise
- Defina a potência do laser e do tempo de integração para a aquisição de imagem.
- Ter cuidado para que os parâmetros definidos na etapa 5.1 não excedam os valores de dose de luz sobre 50-100 J / cm 2, para as células nativas ou 10-20 J / cm 2, para as células incubadas com um corante fluorescente ou transfectadas com um plasmídeo que codifica para a proteína fluorescente evitar fototoxicidade (ver detalhes Ref. 12).
- Definir o incremento para a z-pilha de Δz = 5-10 uM que é preferível para a análise de dados em 3 dimensões, como a espessura da folha de luz é de cerca de 10 um.
- Realizar medições de imagens individuais ou Z-stacks pela variação do plano focal dentro do esferóide celular.
Resultados
Experimento 1: celulares esferóides incubadas com um quimioterápico
Uma varredura z-pilha de uma previamente incubadas células MCF-7 de células esferóide (8 uM de doxorrubicina, 6 horas) está descrito na Figura 3. Ele fornece informações detalhadas sobre a absorção celular e a distribuição de 17 doxorrubicina e do seu produto de degradação 18,19. Dentro da camada celular externa da doxorrubicina fluorescente vermelho esfer...
Discussão
O presente manuscrito descreve uma folha de luz ou microscopia de iluminação plano único (SPIM) dispositivo que é otimizado para sistemas de células em 3 dimensões, por exemplo, tumores esferóides multicelulares (MCTS). Três aplicações exemplares incluem (1) absorção de uma droga citostática e sua conversão parcial para um produto de degradação (cuja contribuição para a eficácia quimioterapêutica ainda a ser avaliada), (2) as medições do estado redox de utilização de um sensor de glutati...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este projecto foi financiado pelo Land Baden-Württemberg, bem como pela União Europeia, Europäischer Fonds für die Entwicklung Regionale. Os autores agradecem Rainer Wittig (ILM Ulm) para fornecer a linha de células U251-MG-L106-Grx1-roGFP2 e Claudia Hintze para assistência técnica hábil.
Materiais
| Name | Company | Catalog Number | Comments |
| Microtiter plate | Orange Scientific | 4430100 | For cell spheroid growing |
| Agarose | Carl Roth GmbH | 3810.1 | For cell spheroid growing |
| MCF-7 cell line | CLS Cell Lines Service GmbH | 300273 | Cell line |
| U251-MG-L106 cell line | Cell line | ||
| DMEM | Biochrom AG (Merck Millipore) | FG0435 | Culture medium |
| DMEM/Ham's F-12 | Biochrom AG (Merck Millipore) | FG4815 | Culture medium |
| FCS | Biochrom AG (Merck Millipore) | S0615 | Cell culture supplement |
| Penicillin/streptomycin | Biochrom AG (Merck Millipore) | A 2213 | Antibiotics |
| Hygromycin B | PAA Laboratories | P02-015 | Antibiotic |
| EBSS | Sigma-Aldrich Inc. | E3024 | Cell culture supplement |
| Doxorubicin | Sigma-Aldrich Inc. | D1515 | Fluorescent dye (CAUTION: acute toxicity) |
| Green cytotoxicity dye | Promega GmbH | G8742 | CellTox - fluorescent cytotoxicity dye |
| Rotenone | Sigma-Aldrich Inc. | R8875 | Cellular inhibitor (CAUTION: acute toxicity) |
| Hydrogen peroxide (H2O2) | Sigma-Aldrich Inc. | 95302 | Reagent for oxidation (CAUTION: acute toxicity) |
| Capillary | VitroCom | 8260-050 | Sample preparation |
| Microscope | Carl Zeiss Jena | Axiovert 200M | |
| AxioCam MRc CCD-camera | Carl Zeiss MicroImaging GmbH | 426508-9901-000 | CCD-camera |
| AxioVision data aquisition software | Carl Zeiss MicroImaging GmbH | version 4.8.2. | |
| Laser diode | Pico Quant GmbH | LDH-P-C-470 | Used with driver PDL800-B |
| Peristaltic pump | Ismatec Labortechnik | MS-1 Reglo | Re-calibrated to reduce the minimum pump speed by 1/10 |
| Silicone tubes | IDEX Health & Science GmbH | TYGON R3607 |
Referências
- Pawley, J. . Handbook of biological confocal microscopy. , (1990).
- Webb, R. H. Confocal optical microscopy. Rep. Prog. Phys. 59, 427-471 (1996).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- König, K. Multiphoton microscopy in life sciences. J. Microsc. 200 (2), 83-104 (2000).
- Neil, M. A., Juskaitis, R., Wilson, T. Method of obtaining optical sectioning by using structured light in a conventional microscope. Opt. Lett. 22 (24), 1905-1907 (1997).
- Gustafsson, M. G. L., et al. Three-dimensional resolution doubling in wide-field fluorescence microscopy by structured illumination. Biophys. J. 94 (12), 4957-4970 (2008).
- Huisken, J., Swoger, J., del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical sectioning deep inside live embryos by SPIM. Science. 305 (5686), 1007-1009 (2004).
- Huisken, J., Stainier, D. Y. R. Selective plane illumination microscopy techniques in development biology. Development. 136 (12), 1963-1975 (2009).
- Santi, P. A. Light sheet fluorescence microscopy: a review. J. Histochem. Cytochem. 59 (2), 129-138 (2011).
- Kunz-Schughart, L. A., Freyer, J. P., Hofstaedter, F., Ebner, R. The use of 3-D cultures for high throughput screening: the multi-cellular spheroid model. J. Biomol. Screen. 9 (4), 273-285 (2004).
- Schneckenburger, H., et al. Multi-dimensional fluorescence microscopy of living cells. J. Biophotonics. 4 (3), 143-149 (2011).
- Schneckenburger, H., et al. Light exposure and cell viability in fluorescence microscopy. J. Microsc. 245 (3), 311-318 (2012).
- Ritter, J. G., Veith, R., Veenendaal, A., Siebrasse, J. P., Kubitschek, U. Light sheet microscopy for single molecule tracking in living tissue. PLoS One. 5 (7), e11639:1-e11639:7 (2010).
- Mertz, J., Kim, J. Scanning light-sheet microscopy in the whole mouse brain with HiLo background rejection. J. Biomed. Opt. 15 (1), 016027 (2010).
- Fahrbach, F. O., Rohrbach, A. A line-scanned light-sheet microscope with phase shaped self-reconstructing beams. Opt. Express. 18 (23), 24229-24244 (2010).
- Bruns, T., Schickinger, S., Wittig, R., Schneckenburger, H. Preparation strategy and illumination of 3D cell cultures in light-sheet based fluorescence microscopy. J. Biomed. Opt. 17 (10), 101518 (2012).
- Ma, H. L., et al. Multicellular tumor spheroids as an in vivo-like tumor model for three-dimensional imaging of chemotherapeutic and nano material cellular penetration. Mol. Imaging. 11 (6), 487-498 (2012).
- Weber, P., Wagner, M., Schneckenburger, H. Cholesterol dependent uptake and interaction of doxorubicin in MCF-7 breast cancer cells. Int. J. Mol. Sci. 14 (4), 8358-8366 (2013).
- Hovorka, O., et al. Spectral analysis of doxorubicin accumulation and the indirect quantification of its DNA intercalation. Eur. J. Pharm. Biopharm. 76 (3), 514-524 (2010).
- Schickinger, S., Bruns, T., Wittig, R., Weber, P., Wagner, M., Schneckenburger, H. Nanosecond ratio imaging of redox states in tumor cell spheroids using light sheet-based fluorescence microscopy. J. Biomed. Opt. 18 (12), 126007 (2013).
- Lippert, H., Wald, M., Radt, B. Optical arrangement for the production of a light sheet. U.S. Patent. , (2010).
- Lorenzo, C., et al. Live cell division dynamics monitoring in 3D large spheroid tumor models using light sheet microscopy. Cell Division. 6 (22), 1-8 (2011).
- Bruns, T., Schneckenburger, H., Schickinger, S. Sample holder for rotation of three-dimensional specimens in microscopy. European Patent Application. , (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados