È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Singolo Aereo Illuminazione Module e approccio micro-capillare per un microscopio a largo campo
In questo articolo
Riepilogo
Un modulo per singolo piano di illuminazione microscopia (SPIM) è descritto, che si adatta facilmente ad un microscopio a largo campo invertito e ottimizzato per colture cellulari 3-dimensionale. Il campione si trova all'interno di un capillare rettangolare, e tramite un sistema di microfluidica coloranti fluorescenti, agenti farmaceutici o farmaci può essere applicato in piccole quantità.
Abstract
Un modulo per foglio leggero o solo piano di illuminazione microscopia (SPIM) è descritto, che si adatta facilmente ad un microscopio a largo campo invertito e ottimizzato per colture cellulari in 3 dimensioni, ad esempio, sferoidi tumorali multicellulari (MCTS). Il modulo SPIM eccitazione forme e devia la luce in modo tale che il campione è illuminato da un foglio leggero perpendicolare al percorso rilevamento del microscopio. Il sistema è caratterizzato dall'uso di un capillare rettangolare per la tenuta (e in una versione avanzata anche da un approccio micro-capillare per ruotare) i campioni, regolando sincrono del foglio leggero illuminante e la lente obiettivo utilizzato per la rilevazione della fluorescenza e da adattamento di un sistema microfluidica per l'applicazione di coloranti fluorescenti, agenti farmaceutici o farmaci in piccole quantità. Un protocollo per lavorare con questo sistema è dato, e alcuni dettagli tecnici sono riportati. Risultati rappresentativi includono (1) misure del pianoprendere di un farmaco citostatico (doxorubicina) e la sua conversione parziale di un prodotto di degradazione, (2) misure redox mediante l'uso di un sensore di glutatione geneticamente codificato dopo l'aggiunta di un agente ossidante, e (3) l'inizio e l'etichettatura di necrosi cellulare su inibizione di la catena respiratoria mitocondriale. Differenze e vantaggi del presente modulo SPIM in confronto con i sistemi esistenti sono discussi.
Introduzione
Oltre ai metodi ben consolidati (confocale o multi-fotone microscopia a scansione laser 1-4, strutturato illuminazione microscopia 5,6) foglio di luce o di solo piano di microscopia illuminazione (SPIM) ha dimostrato di essere un metodo valido di imaging 3D 7,8, 9. Di particolare interesse è la sua applicazione di colture cellulari 3-dimensionale, ad esempio, sferoidi tumorali multicellulari (MCTS), che vengono utilizzati sempre più per la ricerca di scoperta della droga 10,11. Inoltre, SPIM è un metodo preferenziale in cui anche in caso di esposizione a lungo termine o misurazioni ripetute dosi di scarsa luminosità sono tenuti a mantenere la vitalità del campione, dal momento che per la misura di ogni piano del campione solo questo piano è esposto alla luce. Questo è in contrasto con altre tecniche di microscopia, dove per la rilevazione di ciascun piano focale è illuminato l'intero campione, in modo che dopo la registrazione di numerosi piani somme dose di luce e può danneggiare il campione 12.
Microscopia foglio leggero o SPIM si basa sulla illuminazione del campione in direzione perpendicolare al percorso osservazione mediante l'uso di una lente cilindrica o effettuando la scansione del fascio laser eccitante (per una rassegna vedi cod. 8). Questo spesso richiede camere di campioni speciali 13,14 o matrici, ad esempio, agarosio 7,15, realizzato in microscopi speciali ad alto costo. In alternativa a tali sistemi è stato sviluppato un semplice dispositivo di illuminazione comparabilmente per SPIM e adattato ad un microscopio invertito convenzionale 16 (vedi Figura 1). È costituita da un fascio laser espanso ad un diametro di 8 mm e focalizzato da una lente cilindrica (lunghezza focale: 50 mm, apertura numerica: 0.08) per un foglio leggero spessore di 6-10 micron su una profondità di campo di circa 100 micron . I campioni sono situati in un capillare rettangolare di 600-900 micron di diametro interno posizionato davanti al microscopio len obiettivos per il rilevamento della fluorescenza. Queste caratteristiche principali sono attualmente completate e ottimizzati mediante l'uso di approcci micro-capillari avanzata per la tenuta e per ruotare i campioni, la regolazione sincrona del foglio leggero illuminante (in direzione assiale) e la lente obiettivo utilizzati per il rilevamento di fluorescenza (cammino ottico identico lunghezze di spostamento richiedono una correzione del trascinamento meccanico), e l'adattamento di un sistema microfluidica per l'applicazione di coloranti fluorescenti, agenti farmaceutici o farmaci, minimizzando così i quantitativi e le spese richieste.
Protocollo
1 Cella Coltivazione Spheroid e incubazione
- Esperimento 1: Cellulari sferoidi incubate con un farmaco chemioterapico
- Preparare agarosio 1,5% in terreno di coltura con l'aggiunta di 0,45 g di agarosio a 30 ml di terreno di coltura (sufficiente per 6 piastre).
- Scaldare la miscela dal punto 1.1.1 ad almeno 80 ° C agitando di tanto in tanto.
- Riempire 50 ml di miscela riscaldata dal punto 1.1.2 in ciascun pozzetto di una piastra a 96 pozzetti e lasciare solidificare in 1-2 ore. Conservare le piastre chiuse e coperte in frigorifero a 5 ° C fino al momento dell'uso.
- Seed circa 150 MCF-7 cellule di cancro al seno in ciascun pozzetto della piastra preparata a 96 pozzetti in Modified mezzo di Eagle Dulbecco (DMEM) con mezzo di F-12 cultura del prosciutto supplementato con 10% di siero fetale bovino (FCS) e 1% di penicillina / streptomicina .
- Crescere sferoidi per 5-7 giorni fino ad un diametro di circa 200-300 micron in un incubatore al 5% di CO 2 e 3776; C.
- Incubare le sferoidi di cellule con antracicline doxorubicina cloridrato antibiotico per 6 ore ad una concentrazione compresa tra 2 e 8 mM mM (in terreno di coltura) in un incubatore al 5% di CO 2 e 37 ° C.
- Lavare gli sferoidi cellulari con terreno di coltura o di soluzione salina bilanciata di Earle (EBSS) prima di microscopia.
- Esperimento 2: processo di ossidazione in sferoidi che esprimono un sensore di redox
- Seed circa 400 cellule di glioblastoma U251-MG-L106 trasfettate stabilmente con il glutatione sensore redox verde fluorescente sensibile GRX1-roGFP2 in pozzi gel-rivestito agarosio (procedura descritta nei passaggi 1.1.1-1.1.3) di una piastra a 96 pozzetti in DMEM mezzo di coltura supplementato con 10% FCS, 1% di penicillina / streptomicina e igromicina B (150 mcg / ml).
- Crescere sferoidi per 5-7 giorni fino ad un diametro di circa 200-300 micron in un incubatore al 5% di CO 2 e 37 ° C.
- Aggiungere 10 & #181, l di soluzione di perossido di idrogeno (purum pa, ≥ 30%) per 990 ml di acqua bi-distillata per creare una soluzione madre di 100 mM per essere utilizzato entro le 12 ore.
- Diluire la soluzione stock a partire dal punto 1.2.3 a 50 micron di EBSS destra prima dell'esperimento.
- Incubare le sferoidi di cellule attraverso il sistema di microfluidica durante la misurazione con acqua ossigenata 50 micron di EBSS per l'ossidazione del sensore di redox.
- Esperimento 3: Iniziazione e l'etichettatura di necrosi cellulare all'interno di sferoidi
- Seed circa 400 cellule (ad esempio, U251-MG-L106-GRX1-roGFP2 cellule di glioblastoma) in pozzetti di gel-rivestito agarosio (procedura descritta nei passaggi 1.1.1-1.1.3) di una piastra a 96 pozzetti in terreno di coltura DMEM supplementato con 10% FCS, 1% di penicillina / streptomicina e igromicina B (150 mg / ml).
- Crescere sferoidi per 5-7 giorni fino ad un diametro di circa 200-300 micron in un incubatore al 5% di CO 2 e 37 ° C.
- Incubare la cellasferoidi con l'mitocondriale di trasporto degli elettroni inibitore rotenone per 3 ore ad una concentrazione di 1 mM in mezzo di coltura per indurre necrosi cellulare. Inoltre, co-incubare con una citotossicità colorante verde per 3 ore ad una concentrazione di 1 ml in 1 ml di terreno di coltura per etichettare le cellule necrotiche.
- Lavare gli sferoidi di cellule con terreno di coltura o EBSS prima di microscopia.
2 Regolazione foglio leggero
NOTA: Per ottenere i migliori risultati che è necessario garantire che la vita fascio del foglio luce è nel piano di messa a fuoco della lente dell'obiettivo. La posizione della cintura fascio può essere allineato soltanto in base al foglio leggero in posizione verticale rispetto al capillare (vedi i punti 2,5-2,8).
- Utilizzare un microscopio invertito e montare il modulo di eccitazione SPIM, come descritto in rif. 16, alla piastra di base della tabella di posizionamento (vedere Figura 1A).
- Dotare il microscopio con un 10X / o 20X 0,3 / 0,5 microscopio lente obiettivo e un appropriato filtro passa-lunga (ad esempio, λ ≥ 515 nm) nel percorso rilevamento del microscopio.
- Montare una telecamera integrazione alla porta di rivelazione del microscopio.
- Utilizzare un fascio collimato parallelo di un laser o un diodo laser con una lunghezza d'onda di eccitazione di 470 nm e preferenzialmente applicarlo al modulo SPIM.
- Ruotare la lente cilindrica di 90 gradi, che trasferisce il foglio leggero in una posizione verticale per una regolazione assiale del fascio vita del foglio leggero.
- Inserire un capillare contenente un liquido con un colorante fluorescente nel portacampioni.
- Fissare il supporto del campione con il capillare al tavolo di posizionamento del microscopio e allineare la posizione del capillare tale che sia centrato e la vita fascio del foglio leggero è a fuoco.
- Regolare la vita fascio tramite la variazione della posizione assiale della lente cilindrica stessa. Tornare indietro l'obiettivo dopo annuncioalcuna regolazione.
3. cellulare Spheroid Applicazione e sincronizzazione feed Microscopio
- Posizionare le sferoidi di cellule separatamente o in gruppi all'interno di borosilicato capillari di vetro rettangolare 16 con una sezione trasversale interna di 600 micron x 600 micron ed uno spessore di 120 micron. Due tecniche per l'applicazione di uno sferoide cellule hanno dimostrato di avere successo.
- Prendete il capillare vuoto in posizione verticale con il pollice e il dito medio e sigillare l'apertura superiore con il dito indice. Portare l'apertura inferiore vicino al sferoide cellulare nel suo liquido circostante (EBSS o terreno di coltura). Rilasciare il dito indice dall'apertura superiore. Liquido con la sferoide cellule in esso sarà messo a bagno in subito da forze capillari. Regolare la posizione dello sferoide all'interno del capillare riempito da gravitazione nella rispettiva posizione verticale del capillare.
- In alternativa, applicare il sferoide cella alla capillare mediante pipettaggio. Fate attenzione that l'apertura della punta della pipetta è, da un lato, abbastanza grande per la dimensione sferoide e, dall'altro, minore o uguale di dimensioni al diametro interno del capillare.
- Posizionare il capillare con la sferoide in in un supporto speciale campione per la microscopia.
- Fissare il supporto del campione con il capillare al tavolo di posizionamento del microscopio e allineare la posizione dello sferoide cella tale che sia centrata e focalizzata.
- Impostare la corrispondenza tra il foglio leggero ed il piano focale del microscopio lente obiettivo nel percorso rilevamento regolando la posizione dello specchio di riflessione e la lente cilindrica (vedi vite di regolazione nella Figura 1B).
- Regolare la vite micrometrica (vedi Figura 1B) secondo gli indici di rifrazione e l'apertura numerica della lente dell'obiettivo per compensare l'effetto di acquario.
NOTA: diversi indici di rifrazione del campione e dei media t circostantiegli lente piombo obiettivo di una differenza tra lo spostamento della lente dell'obiettivo e lo spostamento del piano focale. Poiché il foglio leggero viene spostato dalla torretta obiettivo, la mancata corrispondenza tra lo spostamento del foglio leggero (corrispondente allo spostamento della lente dell'obiettivo) e lo spostamento del piano focale è compensata da un braccio di leva (vedere Figura 1B). La vite micrometrica viene utilizzata per adattare la distanza tra la parte superiore e il perno inferiore per regolare lo spostamento del foglio leggero secondo l'apertura numerica della lente obiettivo e gli indici di rifrazione.
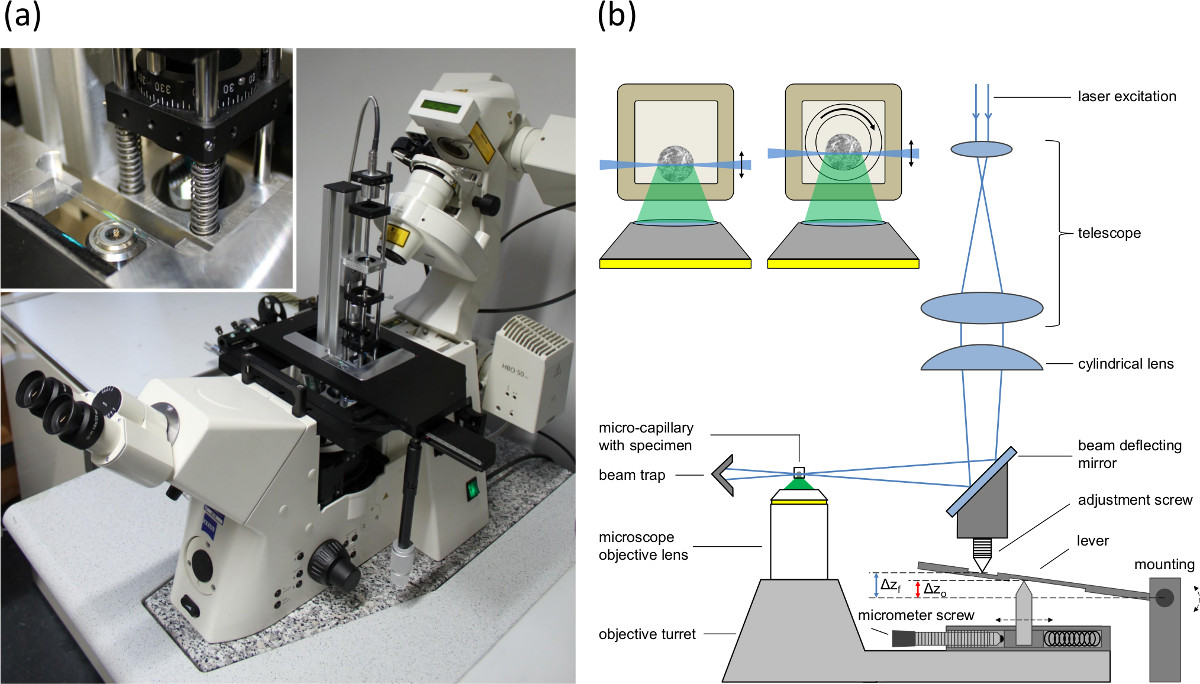
Figura 1 (A) Immagine del singolo modulo illuminazione aereo montato sul basamento del tavolo di posizionamento di un microscopio invertito, (B) la configurazione del singolo piano di illuminazionemodulo e la sincronizzazione dei mangimi microscopio per compensare il sollevamento-mancata corrispondenza (effetto acquario) tra il piano focale e il piano di illuminazione. Az o indica lo spostamento della lente obiettivo e Az f lo spostamento del piano focale e il foglio leggero. L'intarsio mostra sezioni di sferoidali contenenti capillari. A sinistra: capillare rettangolare con diametro interno di 600 micron (parete 120 micron). A destra: il programma di installazione utilizzato per la rotazione. Una capillare interno rotondo (diametro interno 400 micron, diametro esterno 550 micron) viene ruotato all'interno del capillare rettangolare esterno. Lo spazio tra i due capillari è riempito con un liquido di immersione.
4 Misura in liquido dinamico Ambiente
NOTA: Il precedente protocollo viene utilizzato per l'incubazione statica prima di una misurazione in cui il sferoide cella è già stato incubato e poi tenuto in posto nel capillare per semplice gravità. Non vi è alcuna necessità di ulteriori fixatisu. Tuttavia, per misure in flusso multimediale in cui una incubazione dinamico e, quindi, un ambiente dinamico è auspicabile per misurare la cinetica di assorbimento, si può raggiungere questo sub-protocollo. I passaggi 4,5-4,9 sono fondamentali per evitare bolle d'aria che raggiungono il campione.
- Riempire il capillare con FCS per 30 min a sostenere l'adesione successiva cellulare di uno sferoide cella alla superficie del vetro interno.
- Lasciate il rivestimento FCS rimanente nel capillare impoverito asciugare per almeno 12 ore.
- Introdurre il sferoide cella alla capillare rivestito FCS come descritto al punto 3.2.
- Lasciare il capillare in incubatore al 5% di CO 2 e 37 ° C per ulteriori 2-4 ore a causare adesione cellulare della sferoide.
- Impostare la parte afflusso del sistema microfluidica (vedere Figura 2). Utilizzare una pompa peristaltica per riempire l'afflusso del tubo (diametro interno: 0,89 millimetri) con mezzo di coltura contenente il colorante fluorescente, droga o l'agente.
- Connect parte afflusso del sistema microfluidica ad un gorgogliatore (vedi figura 2).
- Innanzitutto serrare il capillare senza bolle al tubo afflusso e quindi serrare l'altro lato del capillare al tubo di scarico.
- Tune la temperatura del liquido della vasca dell'acqua al valore desiderato (ad esempio, 37 ° C).
- Regolare la pompa peristaltica alla velocità della pompa desiderata (ad esempio, portata: 9 ml / min; velocità pompa nel capillare: 25 mm / min).
- Raccogliere il liquido pompato o in un recipiente (configurazione ad anello aperto), dargli da mangiare alla sua fonte (configurazione a circuito chiuso) o alimentarlo direttamente nel tubo della pompa peristaltica (configurazione a circuito chiuso a tenuta).
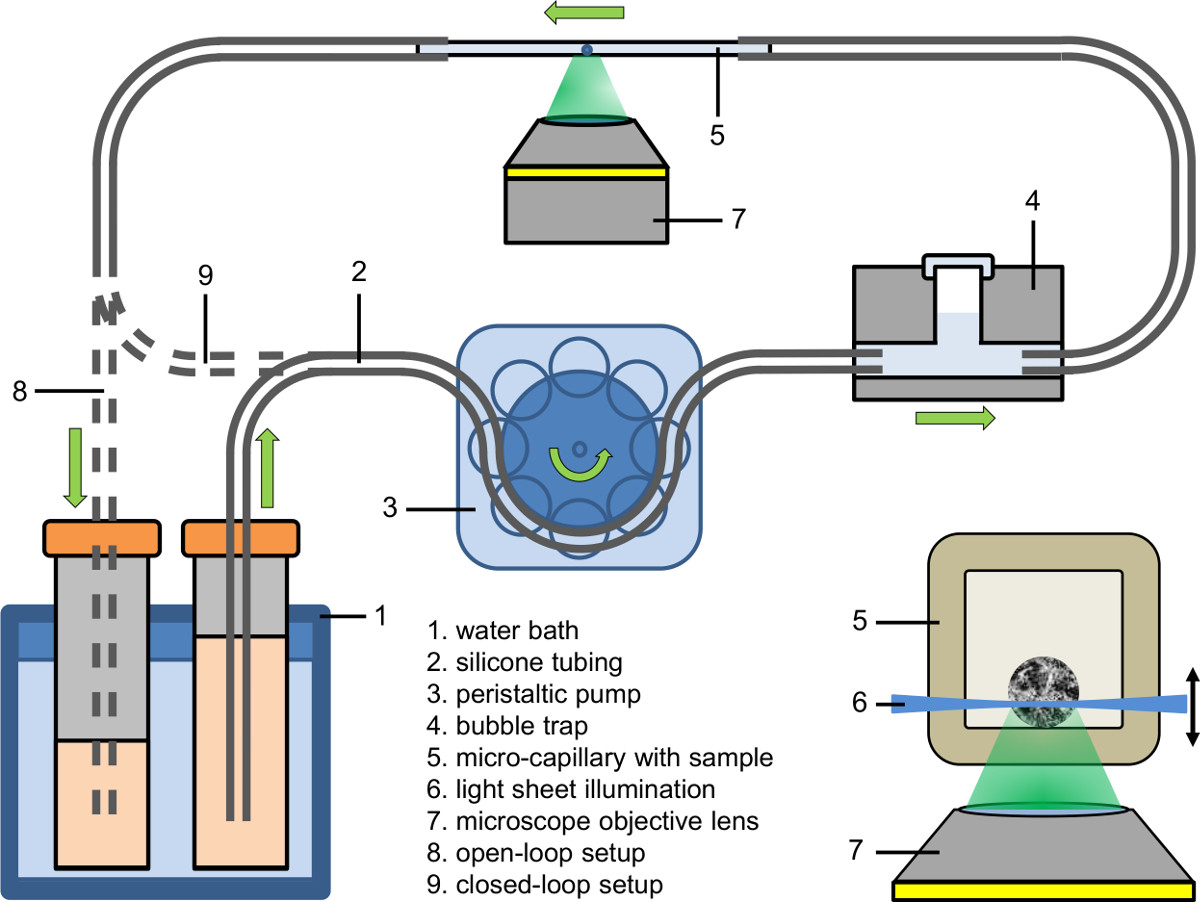
Figura 2 impostazione Microfluidic (anello aperto e stretto a circuito chiuso); intarsio: Illuminazione di un spheroid all'interno di un micro-capillare mediante foglio leggero microscopia a fluorescenza basato accoppiato ad un microscopio invertito.
5. acquisizione dati e analisi
- Impostare la potenza del laser e il tempo di integrazione per l'acquisizione delle immagini.
- Fare attenzione che i parametri definiti al punto 5.1 non superano i valori di dose di luce circa 50-100 J / cm 2 per le cellule native o 10-20 J / cm 2 per le cellule incubate con un colorante fluorescente o transfettate con un plasmide codifica proteina fluorescente a evitare di fototossicità (per i dettagli vedi Rif. 12).
- Impostare l'incremento per la z-stack per Az = 5-10 micron, che è preferibile per l'analisi dei dati 3-dimensionale, come lo spessore della lamiera della luce è di circa 10 micron.
- Eseguire misurazioni di singole immagini o z-stack dalla variazione del piano focale all'interno della sferoide cellulare.
Risultati
Esperimento 1: Cellulari sferoidi incubate con un farmaco chemioterapico
Una scansione z-stack di una precedentemente incubate MCF-7 sferoidale celle (8 micron doxorubicina, 6 ore) è illustrato in Figura 3. Esso fornisce informazioni dettagliate circa l'assorbimento cellulare e la distribuzione di doxorubicina 17 e del suo prodotto di degradazione 18,19. All'interno della cella strato esterno della doxorubicina fluorescente ros...
Discussione
Il presente manoscritto descrive un foglio leggero o singola microscopia illuminazione piano (SPIM) dispositivo che è ottimizzato per sistemi cellulari 3-dimensionale, ad esempio, sferoidi tumorali multicellulari (MCTS). Tre applicazioni esemplari sono (1) l'assorbimento di un farmaco citostatico e la sua conversione parziale di un prodotto di degradazione (il cui contributo all'efficacia chemioterapici rimane ancora da valutare), (2) le misurazioni dello stato redox mediante l'uso di un sensore di...
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Questo progetto è stato finanziato dal Land Baden-Württemberg, nonché dall'Unione Europea, Europäischer Fonds für die Entwicklung Regionale. Gli autori ringraziano Rainer Wittig (ILM Ulm) per fornire la linea cellulare U251-MG-L106-GRX1-roGFP2 e Claudia Hintze per l'assistenza tecnica abile.
Materiali
| Name | Company | Catalog Number | Comments |
| Microtiter plate | Orange Scientific | 4430100 | For cell spheroid growing |
| Agarose | Carl Roth GmbH | 3810.1 | For cell spheroid growing |
| MCF-7 cell line | CLS Cell Lines Service GmbH | 300273 | Cell line |
| U251-MG-L106 cell line | Cell line | ||
| DMEM | Biochrom AG (Merck Millipore) | FG0435 | Culture medium |
| DMEM/Ham's F-12 | Biochrom AG (Merck Millipore) | FG4815 | Culture medium |
| FCS | Biochrom AG (Merck Millipore) | S0615 | Cell culture supplement |
| Penicillin/streptomycin | Biochrom AG (Merck Millipore) | A 2213 | Antibiotics |
| Hygromycin B | PAA Laboratories | P02-015 | Antibiotic |
| EBSS | Sigma-Aldrich Inc. | E3024 | Cell culture supplement |
| Doxorubicin | Sigma-Aldrich Inc. | D1515 | Fluorescent dye (CAUTION: acute toxicity) |
| Green cytotoxicity dye | Promega GmbH | G8742 | CellTox - fluorescent cytotoxicity dye |
| Rotenone | Sigma-Aldrich Inc. | R8875 | Cellular inhibitor (CAUTION: acute toxicity) |
| Hydrogen peroxide (H2O2) | Sigma-Aldrich Inc. | 95302 | Reagent for oxidation (CAUTION: acute toxicity) |
| Capillary | VitroCom | 8260-050 | Sample preparation |
| Microscope | Carl Zeiss Jena | Axiovert 200M | |
| AxioCam MRc CCD-camera | Carl Zeiss MicroImaging GmbH | 426508-9901-000 | CCD-camera |
| AxioVision data aquisition software | Carl Zeiss MicroImaging GmbH | version 4.8.2. | |
| Laser diode | Pico Quant GmbH | LDH-P-C-470 | Used with driver PDL800-B |
| Peristaltic pump | Ismatec Labortechnik | MS-1 Reglo | Re-calibrated to reduce the minimum pump speed by 1/10 |
| Silicone tubes | IDEX Health & Science GmbH | TYGON R3607 |
Riferimenti
- Pawley, J. . Handbook of biological confocal microscopy. , (1990).
- Webb, R. H. Confocal optical microscopy. Rep. Prog. Phys. 59, 427-471 (1996).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- König, K. Multiphoton microscopy in life sciences. J. Microsc. 200 (2), 83-104 (2000).
- Neil, M. A., Juskaitis, R., Wilson, T. Method of obtaining optical sectioning by using structured light in a conventional microscope. Opt. Lett. 22 (24), 1905-1907 (1997).
- Gustafsson, M. G. L., et al. Three-dimensional resolution doubling in wide-field fluorescence microscopy by structured illumination. Biophys. J. 94 (12), 4957-4970 (2008).
- Huisken, J., Swoger, J., del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical sectioning deep inside live embryos by SPIM. Science. 305 (5686), 1007-1009 (2004).
- Huisken, J., Stainier, D. Y. R. Selective plane illumination microscopy techniques in development biology. Development. 136 (12), 1963-1975 (2009).
- Santi, P. A. Light sheet fluorescence microscopy: a review. J. Histochem. Cytochem. 59 (2), 129-138 (2011).
- Kunz-Schughart, L. A., Freyer, J. P., Hofstaedter, F., Ebner, R. The use of 3-D cultures for high throughput screening: the multi-cellular spheroid model. J. Biomol. Screen. 9 (4), 273-285 (2004).
- Schneckenburger, H., et al. Multi-dimensional fluorescence microscopy of living cells. J. Biophotonics. 4 (3), 143-149 (2011).
- Schneckenburger, H., et al. Light exposure and cell viability in fluorescence microscopy. J. Microsc. 245 (3), 311-318 (2012).
- Ritter, J. G., Veith, R., Veenendaal, A., Siebrasse, J. P., Kubitschek, U. Light sheet microscopy for single molecule tracking in living tissue. PLoS One. 5 (7), e11639:1-e11639:7 (2010).
- Mertz, J., Kim, J. Scanning light-sheet microscopy in the whole mouse brain with HiLo background rejection. J. Biomed. Opt. 15 (1), 016027 (2010).
- Fahrbach, F. O., Rohrbach, A. A line-scanned light-sheet microscope with phase shaped self-reconstructing beams. Opt. Express. 18 (23), 24229-24244 (2010).
- Bruns, T., Schickinger, S., Wittig, R., Schneckenburger, H. Preparation strategy and illumination of 3D cell cultures in light-sheet based fluorescence microscopy. J. Biomed. Opt. 17 (10), 101518 (2012).
- Ma, H. L., et al. Multicellular tumor spheroids as an in vivo-like tumor model for three-dimensional imaging of chemotherapeutic and nano material cellular penetration. Mol. Imaging. 11 (6), 487-498 (2012).
- Weber, P., Wagner, M., Schneckenburger, H. Cholesterol dependent uptake and interaction of doxorubicin in MCF-7 breast cancer cells. Int. J. Mol. Sci. 14 (4), 8358-8366 (2013).
- Hovorka, O., et al. Spectral analysis of doxorubicin accumulation and the indirect quantification of its DNA intercalation. Eur. J. Pharm. Biopharm. 76 (3), 514-524 (2010).
- Schickinger, S., Bruns, T., Wittig, R., Weber, P., Wagner, M., Schneckenburger, H. Nanosecond ratio imaging of redox states in tumor cell spheroids using light sheet-based fluorescence microscopy. J. Biomed. Opt. 18 (12), 126007 (2013).
- Lippert, H., Wald, M., Radt, B. Optical arrangement for the production of a light sheet. U.S. Patent. , (2010).
- Lorenzo, C., et al. Live cell division dynamics monitoring in 3D large spheroid tumor models using light sheet microscopy. Cell Division. 6 (22), 1-8 (2011).
- Bruns, T., Schneckenburger, H., Schickinger, S. Sample holder for rotation of three-dimensional specimens in microscopy. European Patent Application. , (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon