A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מטוס אחד תאורת מודול וגישת מיקרו-נימים למיקרוסקופ שדה רחב
In This Article
Summary
מודול למיקרוסקופיה תאורת מטוס בודד (SPIM) מתואר אשר מותאם בקלות למיקרוסקופ שדה הרחב הפוך ומותאם במיוחד לתרביות תאים 3 ממדים. המדגם ממוקם בתוך נימים מלבניות, ובאמצעות צבעי ניאון מערכת microfluidic, יכולים להיות מיושמים סוכנים או תרופות תרופות בכמויות קטנות.
Abstract
מודול לגיליון אור או מיקרוסקופ תאורת מטוס בודד (SPIM) מתואר אשר מותאם בקלות למיקרוסקופ שדה הרחב הפוך ומותאם במיוחד לתרביות תאים 3 ממדים, למשל, spheroids רב תאי גידול (MCTS). צורות עירור SPIM מודול ומסיט את האור כך שהמדגם הוא מואר על ידי אור גיליון בניצב לדרך זיהוי של המיקרוסקופ. המערכת מאופיינת בשימוש בנימים מלבניות להחזקה (ובגרסה מתקדמת גם על ידי גישת מיקרו נימים לסיבוב) הדגימות, על ידי התאמה סינכרונית של גיליון האור המאיר ועדשה האובייקטיבית המשמשת לגילוי הקרינה, כמו גם על ידי התאמה של מערכת microfluidic ליישום של צבעי ניאון, סוכנים או תרופות תרופות בכמויות קטנות. פרוטוקול לעבודה עם מערכת זו הוא נתון, וכמה פרטים טכניים שדווחו. נציג תוצאות כוללות (1) מדידות של עדלקחת תרופת cytostatic (דוקסורוביצין) והמרתו החלקית למוצר השפלה, (2) מדידות חיזור על ידי שימוש בחיישן גלוטתיון מקודד גנטי על תוספת של סוכן חמצון, ו (3) ייזום ותיוג של נמק תא על עיכוב של שרשרת הנשימה במיטוכונדריה. הבדלים ויתרונות של מודול SPIM הנוכחי בהשוואה למערכות קיימות נדונים.
Introduction
בנוסף לשיטות מבוססות היטב (מיקרוסקופיה confocal או במיקרוסקופ סריקת לייזר רב פוטון 1-4, מובנה התאורה 5,6) גיליון אור או מיקרוסקופ מטוס בודד תאורה (SPIM) הוכיח להיות שיטת ערך של 3D ההדמיה 7,8, 9. מעניין במיוחד הוא היישום שלה לתרבויות 3 ממדי תא, למשל, spheroids גידול רב תאי (MCTS), אשר נמצא בשימוש יותר ויותר למחקר לגילוי תרופות 10,11. יתר על כן, SPIM הוא שיטה מועדפת, כאשר גם בחשיפה ארוכת טווח או מדידות חוזרות ונשנות מינוני אור נמוכים נדרשים לשמור על כדאיות של המדגם, שכן למדידה של כל מטוס המדגם רק המטוס הזה נחשף לאור. זאת בניגוד לשיטות מיקרוסקופיה אחרות, שבו לגילוי של כל מטוס מוקד המדגם כולו מואר, כך שעם הקלטה של מטוסים רבים סכומי מינון אור ועלול לגרום נזק למדגם 12.
מיקרוסקופיה גיליון אור או SPIM מבוססת על תאורה של המדגם בכיוון מאונך לנתיב התצפית או על ידי שימוש בעדשה גלילית או על ידי סריקת קרן הלייזר המרגש (לסקירה ראה נ"צ. 8). זה בדרך כלל דורש תאים מיוחדים מדגם 13,14 או מטריצות, למשל, agarose 7,15, מיושם במיקרוסקופים גבוהה בעלות מיוחדת. כחלופה למערכות אלה מכשיר תאורה פשוט comparably לSPIM פותח והותאם למיקרוסקופ הקונבנציונלי הפוך 16 (ראה איור 1). הוא מורכב מקרן לייזר התרחבה לקוטר של 8 מ"מ וממוקד על ידי עדשה גלילית (אורך מוקד: 50 מ"מ, צמצם מספרי: 0.08) לגיליון אור של 6-10 עובי מיקרומטר על עומק השדה של כ 100 מיקרומטר . דוגמאות נמצאות בנימים מלבניות של 600-900 מיקרומטר קוטר פנימי להציב מול len האובייקטיבי מיקרוסקופים לגילוי הקרינה. התכונות העיקריות אלה הושלמו כיום ומותאמים על ידי השימוש בגישות מיקרו נימים מתקדמות להחזקה ולמסתובב דגימות, ההתאמה סינכרוני של גיליון האור המאיר (בכיוון צירי) ועדשה האובייקטיבית המשמשות לגילוי הקרינה (נתיב אופטי זהה אורכים של עקירה דורשים תיקון של ההזנה המכנית), וההסתגלות של מערכת microfluidic ליישום של צבעי ניאון, סוכנים או תרופות תרופות, וכך לצמצם את הכמויות והוצאות הנדרשות.
Protocol
גידולי אליפטית 1 נייד ודגירה
- ניסוי 1: spheroids הסלולרי הודגרו עם תרופה כימותרפיות
- הכן agarose 1.5% במדיום תרבות על ידי הוספת 0.45 גרם של agarose ל30 בינוניים מ"ל תרבות (מספיק ל6 צלחות).
- מחממים את התערובת מהצעד 1.1.1 לפחות 80 ° C תוך ערבוב אותו מעת לעת.
- מלא 50 μl של התערובת המחוממת מהצעד 1.1.2 לבאר כל צלחת 96 היטב ולתת לו לגבש בתוך 1-2 שעות. אחסן את הצלחות סגורות ומכוסה במקרר ב5 מעלות צלזיוס עד לשימוש.
- זרע על 150 MCF-7 תאי סרטן השד בכל טוב של הצלחת מוכנה 96 היטב בינוניים השתנה Dulbecco של הנשר (DMEM) עם מדיום F-12 התרבות של בשר חזיר בתוספת סרום 10% עוברי עגל (FCS) ו1% פניצילין / סטרפטומיצין .
- לגדול spheroids ל5-7 ימים עד קוטר של כ 200-300 מיקרומטר בחממה ב 5% CO 2 ו3776; C.
- דגירה spheroids התא עם hydrochloride דוקסורוביצין האנטיביוטיקה anthracycline ל6 שעות בריכוז הנע בין 2 מיקרומטר ו8 מיקרומטר (במדיום תרבות) בחממה ב5% CO 2 ו37 מעלות צלזיוס.
- שטוף את spheroids התא עם מדיום תרבות או מאוזן תמיסת מלח של ארל (EBSS) לפני במיקרוסקופ.
- ניסוי 2: תהליך החמצון בspheroids להביע חיישן חיזור
- זרע על 400 תאי U251-MG-L106 גליובלסטומה באופן קבוע transfected עם גלוטתיון חיישן חיזור ניאון ירוק רגיש Grx1-roGFP2 בבארות מצופה agarose ג'ל (ההליך מתואר בצעדים 1.1.1-1.1.3) של צלחת 96 היטב בDMEM מדיום התרבות בתוספת FCS 10%, 1% פניצילין / סטרפטומיצין וhygromycin B (150 מיקרוגרם / מ"ל).
- לגדול spheroids ל5-7 ימים עד קוטר של כ 200-300 מיקרומטר בחממה ב 5% CO 2 ו37 C °.
- הוסף 10 & #181; l של פתרון מי חמצן (pa purum, ≥ 30%) ל990 מים מזוקקים דו μl ליצור פתרון מניות מ"מ 100 לשימוש בתוך שעות 12.
- לדלל את פתרון המניות מהצעד 1.2.3 ל50 מיקרומטר בEBSS ממש לפני הניסוי.
- דגירה spheroids התא באמצעות מערכת microfluidic בזמן מדידה עם מי חמצן 50 מיקרומטר בEBSS לחמצון של חיישן חיזור.
- ניסוי 3: ייזום וסימון של נמק הסלולר בתוך spheroids
- זרע תאים -400 (למשל, תאי גליובלסטומה U251-MG-L106-Grx1-roGFP2) בבארות מצופים agarose ג'ל (הליך מתואר בצעדים 1.1.1-1.1.3) של צלחת 96 היטב במדיום תרבות DMEM בתוספת FCS 10%, 1% פניצילין / סטרפטומיצין וhygromycin B (150 מ"ג / מ"ל).
- לגדול spheroids ל5-7 ימים עד קוטר של כ 200-300 מיקרומטר בחממה ב 5% CO 2 ו37 C °.
- דגירה התאspheroids עם rotenone המיטוכונדריה הובלת אלקטרונים המעכב ל3 שעות בריכוז של 1 מיקרומטר במדיום התרבות כדי לגרום לנימק סלולארי. בנוסף, שיתוף דגירה עם צבע רעיל ירוק ל3 שעות בריכוז של 1 μl במדיום תרבות מ"ל 1 לתייג תאי נימקי.
- שטוף את spheroids התא עם מדיום תרבות או EBSS לפני במיקרוסקופ.
.2 התאמת גיליון אור
הערה: להשגת התוצאות הטובות ביותר שיש לו להבטיח שמותן הקורה של גיליון האור היא במישור המוקד של העדשה האובייקטיבית. העמדה של המותניים הקרן ניתן ליישר רק על ידי התבוננות גיליון האור במצב אנכי ביחס לנימים (ראה צעדים 2.5-2.8).
- שימוש במיקרוסקופ הפוכה והר מודול עירור SPIM, כפי שמתואר במס. 16, לbaseplate של טבלת המיצוב (ראה איור 1 א).
- לצייד את מיקרוסקופ עם 1עדשת 0x / 0.3 או 20X / 0.5 מיקרוסקופ אובייקטיבי ומסנן ארוך לעבור מתאים (ננומטר למשל, λ ≥ 515) בדרך זיהוי של המיקרוסקופ.
- הר מצלמה שילוב לנמל זיהוי של המיקרוסקופ.
- השתמש בקרן collimated מקבילה של לייזר או דיודת לייזר עם אורך גל עירור של מועדף 470 ננומטר ולהחיל אותו על מודול SPIM.
- סובב את העדשה הגלילית על ידי 90 מעלות, המעבירה את גיליון האור למצב אנכי להתאמה צירית של המותניים הקורה של גיליון האור.
- הנח נימים המכילות נוזל עם צבע פלואורסצנטי בבעל המדגם.
- צרף את בעל מדגם עם הנימים לשולחן המיצוב של מיקרוסקופ וליישר את עמדתו של הנימים כך שהוא מרוכז ומותני הקורה של גיליון האור הוא בפוקוס.
- התאם את המותניים קרן על ידי וריאציה של התנוחה הצירית של העדשה הגלילית עצמו. להחזיר את העדשה לאחר מודעהjustment.
יישום אליפטית .3 נייד וסנכרון Feed מיקרוסקופ
- הנח את spheroids התא בנפרד או בקבוצות בתוך נימי זכוכית בורוסיליקט המלבני 16 עם סעיף פנימי צולב של 600 מיקרומטר x 600 מיקרומטר ועובי דופן של 120 מיקרומטר. שתי טכניקות ליישום של אליפטית תא הוכיחו להיות מוצלח.
- קח את הנימים הריקות זקופות עם אגודל ואצבע אמצעית ולאטום את הפתח העליון עם האצבע שלך. להביא את הפתיחה נמוכה יותר קרובה לאליפטית התא בנוזל סביבו (EBSS או מדיום תרבות). שחרר את האצבע מהפתח העליון. נוזל עם אליפטית התא בו יהיה ספוג באופן מיידי על ידי כוחות נימים. להתאים את המיקום של אליפטית בתוך הנימים מולא בגרביטציה בתנוחה זקופה בהתאמה של הנימים.
- לחלופין, להחיל את אליפטית התא לנימים באמצעות פיפטה. קח tha טיפולt הפתיחה של הקצה פיפטה היא, מצד אחד, גדולה מספיק לגודל אליפטית ו, לעומת זאת, פחות או שווה בגודלו לקוטר הפנימי של הנימים.
- מניחים את הנימים עם אליפטית בזה בבעל מדגם מיוחד למיקרוסקופיה.
- צרף את בעל מדגם עם הנימים לשולחן המיצוב של מיקרוסקופ וליישר את העמדה של אליפטית התא כך שהוא מרוכז וממוקד.
- הגדר את ההתאמה בין גיליון האור ומישור המוקד של העדשה האובייקטיבית מיקרוסקופ בנתיב הגילוי על ידי התאמת המיקום של מראה ההשתקפות והעדשה הגלילית (ראה בורג התאמה באיור 1 ב).
- כוונן את בורג מיקרומטר (ראה איור 1) בהתאם למדדי השבירה והצמצם המספרי של העדשה האובייקטיבית כדי לפצות את השפעת fishtank.
הערה: מדדים שונים שבירה של המדגם והתקשורתי סביב tהוא להוביל עדשה אובייקטיבית לפער שבין השינוי של העדשה האובייקטיבית והמשמרת של מישור המוקד. מאחר שמדובר באור מועבר על ידי הצריח האובייקטיבי, חוסר ההתאמה בין המשמרת של גיליון האור (המקביל למשמרת של העדשה האובייקטיבית) והשינוי של מישור המוקד הוא מתוגמל על ידי זרוע מנוף (ראה איור 1). בורג מיקרומטר משמש להתאים את המרחק בין העליון והתחתונה הסיכה כדי להתאים את המשמרת של גיליון האור בהתאם לצמצם המספרי של העדשה האובייקטיבית ומדדי השבירה.
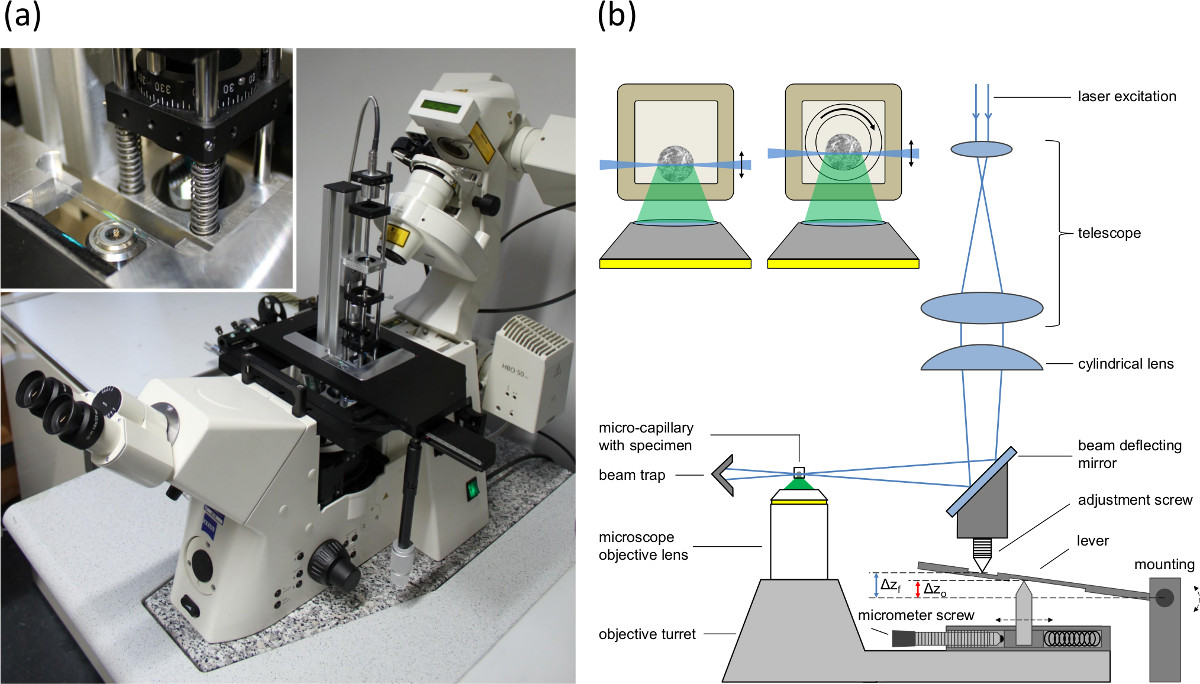
1 (א) תמונה של מודול תאורת מטוס הבודד רכוב על baseplate של טבלת המיצוב של מיקרוסקופ הפוכה, (ב) הגדרת דמותו של תאורת המטוס הבודדמודול וסנכרון הזנת מיקרוסקופ כדי לפצות הרמת חוסר ההתאמה (השפעת fishtank) בין מישור מוקד ומטוס תאורה. o Δz מציינת את המעבר של העדשה האובייקטיבית וΔz f המשמרת של מישור המוקד וגיליון האור. שיבוץ תערוכות חתכים של נימי אליפטית המכילה. משמאל: נימים מלבניות עם קוטר פנימי של 600 מיקרומטר (קיר 120 מיקרומטר). מימין: הגדרה המשמשת לסיבוב. נימים פנימיות עגולות (קוטר פנימי 400 מיקרומטר, בקוטר חיצוני 550 מיקרומטר) הוא הסתובב בתוך הנימים מלבניות החיצוניות. החלל שבין שתי הנימים מלא בנוזל טבילה.
.4 מדידה בדינמית נוזלית סביבה
הערה: הפרוטוקול הקודם משמש לדגירת סטטי לפני מדידה שבו אליפטית התא כבר בעבר מודגרות ולאחר מכן נערכה במקום בנימים על ידי כוח הכביד פשוט. אין צורך בfixati נוסףב. עם זאת, למדידות בזורמות תקשורת שבו דגירה דינמית, ולכן, סביבה דינמית רצוי למדוד קינטיקה ספיגה, אחד יכול להשיג תת פרוטוקול זה. צעדים 4.5-4.9 הם קריטיים כדי למנוע בועות אוויר שהגיעו למדגם.
- מלא את הנימים עם FCS למשך 30 דקות כדי לתמוך בהדבקה מאוחר יותר סלולרית של אליפטית תא למשטח הזכוכית הפנימית.
- בואו ציפוי FCS שנותר בנימים המדולדלים להתייבש במשך שעה לפחות 12.
- להציג אליפטית התא לנימים המצופים FCS כמתואר בשלב 3.2.
- השאר את הנימים בחממה ב5% CO 2 וC ° 37 ל2-4 שעות נוספות כדי לגרום להידבקות סלולרית של אליפטית.
- הגדרת חלק afflux של מערכת microfluidic (ראה איור 2). השתמש במשאבת peristaltic למלא afflux של הצינור (הקוטר הפנימי: 0.89 מ"מ) עם מדיום תרבות המכיל ניאון צבע, סמים או סוכן.
- Connect חלק afflux של מערכת microfluidic למלכודת בועה (ראה איור 2).
- ראשון מהדק את הנימים ללא בועה לצינורות afflux ולאחר מכן מהדק הצד של הנימים האחרות לצינורות הניקוז.
- מנגינת טמפרטורת הנוזל של אמבט המים לערך הרצוי (למשל, 37 מעלות צלזיוס).
- התאם את משאבת peristaltic למהירות המשאבה הרצויה (למשל, קצב זרימה: 9 μl / דקה; מהירות משאבה בנימים: 25 מ"מ / min).
- לאסוף את הנוזל נשאב גם בנמען (התקנת לולאה פתוחה), להאכיל אותו בחזרה למקור שלה (הגדרת לולאה סגורה) או להאכיל אותו ישירות לתוך צינורות של משאבת peristaltic (התקנה הדוקה לולאה סגורה).
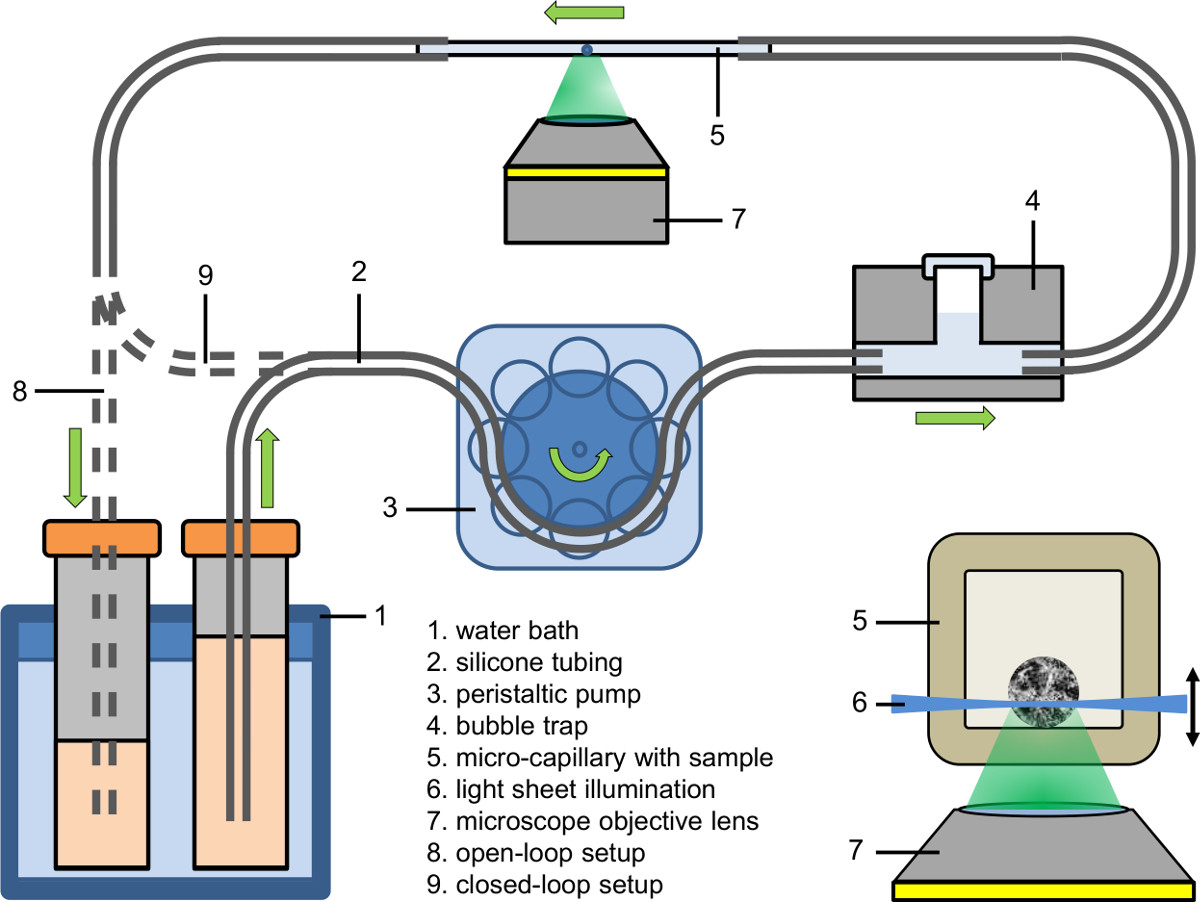
איור 2 התקנת Microfluidic (לולאה פתוחה והדוק לולאה סגורה); שיבוץ: תאורה של SPHeroid בתוך מיקרו נימים באמצעות מיקרוסקופ אור גיליון מבוססת הקרינה מצמידים מיקרוסקופ הפוכה.
.5 רכישת נתונים וניתוח
- הגדר את כוח הלייזר וזמן האינטגרציה לרכישת התמונה.
- תשמור על עצמך כי הפרמטרים שהוגדרו בשלב 5.1 לא יעלו על ערכי מינון אור על 50-100 J / 2 סנטימטר לתאים מקומיים או 10-20 J / 2 סנטימטר לתאים הודגרו עם צבע פלואורסצנטי או transfected עם פלסמיד קידוד חלבון פלואורסצנטי ל להימנע phototoxicity (לפרטים ראו Ref. 12).
- הגדר את התוספת עבור z-המחסנית לΔz = 5-10 מיקרומטר שעדיף לניתוח נתונים 3 ממדים כעובי גיליון האור הוא כ 10 מיקרומטר.
- לבצע מדידות של תמונות בודדות או z-ערימות על ידי וריאציה של מטוס המוקד בתוך אליפטית התא.
תוצאות
ניסוי 1: spheroids הסלולרי הודגרו עם תרופה כימותרפיות
סריקת z-ערימת אליפטית מודגרות בעבר MCF-7 תאים (8 מיקרומטר דוקסורוביצין, 6 שעות) מתוארת באיור 3. זה נותן מידע מפורט על הספיגה הסלולרית והפצה של דוקסורוביצין 17 ומו...
Discussion
כתב היד הנוכחית מתארת גיליון אור או מכשיר מיקרוסקופיה תאורת מטוס בודדת (SPIM) אשר מותאם במיוחד עבור מערכות תא 3 ממדים, למשל, spheroids רב תאי גידול (MCTS). שלושה יישומים למופת כוללים (1) ספיגה של תרופת cytostatic והמרה החלקית שלה למוצר פגום (תרומה ליעילות כימותרפיות שעדיין נשא...
Disclosures
אין ניגודי אינטרסים הכריזו.
Acknowledgements
פרויקט זה מומן על ידי הארץ באדן וירטמברג, כמו גם על ידי האיחוד האירופי, יורופאישר Fonds für die Regionale Entwicklung. המחברים מודים ריינר יטיג (ILM Ulm) לאספקת קו U251-MG-L106-Grx1-roGFP2 התא וקלאודיה Hintze לקבלת סיוע טכני מיומן.
Materials
| Name | Company | Catalog Number | Comments |
| Microtiter plate | Orange Scientific | 4430100 | For cell spheroid growing |
| Agarose | Carl Roth GmbH | 3810.1 | For cell spheroid growing |
| MCF-7 cell line | CLS Cell Lines Service GmbH | 300273 | Cell line |
| U251-MG-L106 cell line | Cell line | ||
| DMEM | Biochrom AG (Merck Millipore) | FG0435 | Culture medium |
| DMEM/Ham's F-12 | Biochrom AG (Merck Millipore) | FG4815 | Culture medium |
| FCS | Biochrom AG (Merck Millipore) | S0615 | Cell culture supplement |
| Penicillin/streptomycin | Biochrom AG (Merck Millipore) | A 2213 | Antibiotics |
| Hygromycin B | PAA Laboratories | P02-015 | Antibiotic |
| EBSS | Sigma-Aldrich Inc. | E3024 | Cell culture supplement |
| Doxorubicin | Sigma-Aldrich Inc. | D1515 | Fluorescent dye (CAUTION: acute toxicity) |
| Green cytotoxicity dye | Promega GmbH | G8742 | CellTox - fluorescent cytotoxicity dye |
| Rotenone | Sigma-Aldrich Inc. | R8875 | Cellular inhibitor (CAUTION: acute toxicity) |
| Hydrogen peroxide (H2O2) | Sigma-Aldrich Inc. | 95302 | Reagent for oxidation (CAUTION: acute toxicity) |
| Capillary | VitroCom | 8260-050 | Sample preparation |
| Microscope | Carl Zeiss Jena | Axiovert 200M | |
| AxioCam MRc CCD-camera | Carl Zeiss MicroImaging GmbH | 426508-9901-000 | CCD-camera |
| AxioVision data aquisition software | Carl Zeiss MicroImaging GmbH | version 4.8.2. | |
| Laser diode | Pico Quant GmbH | LDH-P-C-470 | Used with driver PDL800-B |
| Peristaltic pump | Ismatec Labortechnik | MS-1 Reglo | Re-calibrated to reduce the minimum pump speed by 1/10 |
| Silicone tubes | IDEX Health & Science GmbH | TYGON R3607 |
References
- Pawley, J. . Handbook of biological confocal microscopy. , (1990).
- Webb, R. H. Confocal optical microscopy. Rep. Prog. Phys. 59, 427-471 (1996).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- König, K. Multiphoton microscopy in life sciences. J. Microsc. 200 (2), 83-104 (2000).
- Neil, M. A., Juskaitis, R., Wilson, T. Method of obtaining optical sectioning by using structured light in a conventional microscope. Opt. Lett. 22 (24), 1905-1907 (1997).
- Gustafsson, M. G. L., et al. Three-dimensional resolution doubling in wide-field fluorescence microscopy by structured illumination. Biophys. J. 94 (12), 4957-4970 (2008).
- Huisken, J., Swoger, J., del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical sectioning deep inside live embryos by SPIM. Science. 305 (5686), 1007-1009 (2004).
- Huisken, J., Stainier, D. Y. R. Selective plane illumination microscopy techniques in development biology. Development. 136 (12), 1963-1975 (2009).
- Santi, P. A. Light sheet fluorescence microscopy: a review. J. Histochem. Cytochem. 59 (2), 129-138 (2011).
- Kunz-Schughart, L. A., Freyer, J. P., Hofstaedter, F., Ebner, R. The use of 3-D cultures for high throughput screening: the multi-cellular spheroid model. J. Biomol. Screen. 9 (4), 273-285 (2004).
- Schneckenburger, H., et al. Multi-dimensional fluorescence microscopy of living cells. J. Biophotonics. 4 (3), 143-149 (2011).
- Schneckenburger, H., et al. Light exposure and cell viability in fluorescence microscopy. J. Microsc. 245 (3), 311-318 (2012).
- Ritter, J. G., Veith, R., Veenendaal, A., Siebrasse, J. P., Kubitschek, U. Light sheet microscopy for single molecule tracking in living tissue. PLoS One. 5 (7), e11639:1-e11639:7 (2010).
- Mertz, J., Kim, J. Scanning light-sheet microscopy in the whole mouse brain with HiLo background rejection. J. Biomed. Opt. 15 (1), 016027 (2010).
- Fahrbach, F. O., Rohrbach, A. A line-scanned light-sheet microscope with phase shaped self-reconstructing beams. Opt. Express. 18 (23), 24229-24244 (2010).
- Bruns, T., Schickinger, S., Wittig, R., Schneckenburger, H. Preparation strategy and illumination of 3D cell cultures in light-sheet based fluorescence microscopy. J. Biomed. Opt. 17 (10), 101518 (2012).
- Ma, H. L., et al. Multicellular tumor spheroids as an in vivo-like tumor model for three-dimensional imaging of chemotherapeutic and nano material cellular penetration. Mol. Imaging. 11 (6), 487-498 (2012).
- Weber, P., Wagner, M., Schneckenburger, H. Cholesterol dependent uptake and interaction of doxorubicin in MCF-7 breast cancer cells. Int. J. Mol. Sci. 14 (4), 8358-8366 (2013).
- Hovorka, O., et al. Spectral analysis of doxorubicin accumulation and the indirect quantification of its DNA intercalation. Eur. J. Pharm. Biopharm. 76 (3), 514-524 (2010).
- Schickinger, S., Bruns, T., Wittig, R., Weber, P., Wagner, M., Schneckenburger, H. Nanosecond ratio imaging of redox states in tumor cell spheroids using light sheet-based fluorescence microscopy. J. Biomed. Opt. 18 (12), 126007 (2013).
- Lippert, H., Wald, M., Radt, B. Optical arrangement for the production of a light sheet. U.S. Patent. , (2010).
- Lorenzo, C., et al. Live cell division dynamics monitoring in 3D large spheroid tumor models using light sheet microscopy. Cell Division. 6 (22), 1-8 (2011).
- Bruns, T., Schneckenburger, H., Schickinger, S. Sample holder for rotation of three-dimensional specimens in microscopy. European Patent Application. , (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved