Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Simple Plan Illumination module et l'approche micro-capillaire pour un microscope à grand champ
Dans cet article
Résumé
Un module de plan unique éclairage microscopie (SPIM) est décrit qui est facilement adapté à un microscope à grand champ inversé et optimisée pour des cultures de cellules en 3 dimensions. L'échantillon se trouve à l'intérieur d'un capillaire rectangulaire, et par l'intermédiaire d'un micro-fluidiques colorants fluorescents de système, des agents pharmaceutiques ou des médicaments peut être appliquée dans de petites quantités.
Résumé
Un module de nappe de lumière ou un seul plan illumination microscopie (SPIM) est décrit qui est facilement adapté à un microscope à grand champ inversé et optimisée pour des cultures de cellules en 3 dimensions, par exemple, sphéroïdes tumoraux multicellulaires (SCTM). Les formes de modules SPIM d'excitation et dévie la lumière de telle sorte que l'échantillon est illuminé par une nappe de lumière perpendiculaire à la voie de détection du microscope. Le système est caractérisé par l'utilisation d'un capillaire rectangulaire pour contenir (et dans une version améliorée aussi par une méthode de micro-capillaire pour faire tourner) des échantillons, par le réglage synchrone de la feuille de lumière d'éclairage et la lentille d'objectif utilisé pour la détection de la fluorescence ainsi que par l'adaptation d'un système microfluidique pour l'application de colorants fluorescents, des agents pharmaceutiques ou des médicaments dans de petites quantités. Un protocole pour travailler avec ce système est donnée, et certains détails techniques sont signalés. Les résultats représentatifs comprennent (1) la mesure de la placeprendre un médicament cytostatique (doxorubicine) et sa conversion partielle en un produit de dégradation, (2) des mesures rédox par l'utilisation d'un capteur de glutathion génétiquement codé lors de l'addition d'un agent oxydant, et (3) l'initiation et l'étiquetage de nécrose cellulaire sur l'inhibition de l' la chaîne respiratoire mitochondriale. Les différences et les avantages du module de SPIM présente en comparaison avec les systèmes existants sont discutés.
Introduction
En plus des méthodes bien établies (confocale ou multi-photons microscopie à balayage laser 1-4, structuré éclairage microscopie 5,6) feuilles microscopie optique ou d'éclairage de plan unique (SPIM) s'est avérée être une méthode valable de l'imagerie 3D 7,8, 9. Il est particulièrement intéressant de son application à des cultures de cellules en 3 dimensions, par exemple, sphéroïdes tumoraux multicellulaires (SCTM), qui sont utilisés de plus en plus à la recherche de découverte de médicaments 10,11. En outre, SPIM est une méthode préférentielle quand même lors de l'exposition à long terme ou des mesures répétitives doses de faible éclairage sont nécessaires pour maintenir la viabilité de l'échantillon, car pour la mesure de chaque plan de l'échantillon que ce plan est exposé à la lumière. Ceci est en contraste avec d'autres techniques de microscopie, où pour la détection de chaque plan focal de la totalité de l'échantillon est illuminé, de sorte que lors de l'enregistrement de plusieurs plans les sommes de la dose de lumière et peut endommager l'échantillon 12.
Microscopie à lumière ou SPIM feuille est basée sur un éclairage de l'échantillon en direction perpendiculaire au trajet d'observation, soit par l'utilisation d'une lentille cylindrique ou par balayage du faisceau laser d'excitation (pour une revue, voir Ref. 8). Cela exige souvent des chambres d'échantillons spéciaux 13,14 ou des matrices, par exemple, de l'agarose 7,15, mis en œuvre dans des microscopes spéciaux à coût élevé. Comme alternative à ces systèmes un dispositif d'éclairage simple, comparable à SPIM a été développée et adaptée à un microscope inversé conventionnel 16 (voir figure 1). Il se compose d'un faisceau laser dilaté à un diamètre de 8 mm et focalisé par une lentille cylindrique (distance focale: 50 mm, ouverture numérique: 0,08) à une nappe de lumière de 6 à 10 um d'épaisseur sur une profondeur de champ d'environ 100 um . Les échantillons sont placés dans un tube capillaire rectangulaire de 600 à 900 um de diamètre interne placé à l'avant de l'objectif len microscopes pour la détection de fluorescence. Ces caractéristiques principales sont actuellement remplis et optimisés par l'utilisation de méthodes de micro-capillaires de pointe pour maintenir et pour faire tourner les échantillons, le réglage synchrone de la feuille de lumière d'éclairage (en direction axiale) et la lentille d'objectif utilisé pour la détection de fluorescence (de chemin optique identique des longueurs de déplacement nécessitent une correction de la charge mécanique), et l'adaptation d'un système microfluidique pour l'application de colorants fluorescents, des agents pharmaceutiques ou des médicaments, réduisant ainsi les quantités et les charges requises.
Protocole
1 cellule en croissance sphéroïde et incubation
- Expérience 1: cellules sphéroïdes incubées avec un médicament chimiothérapeutique
- Préparer agarose à 1,5% dans du milieu de culture par addition de 0,45 g d'agarose à 30 milieu de culture ml (suffisamment pour plaques 6).
- Chauffer le mélange de l'étape 1.1.1 à au moins 80 ° C en agitant de temps en temps.
- Remplissez 50 pi du mélange chauffé de l'étape 1.1.2 dans chaque puits d'une plaque de 96 puits et laisser solidifier dans 1-2 heures. Conserver les plaques fermés et couverts dans le réfrigérateur à 5 ° C jusqu'à utilisation.
- Graine environ 150 cellules MCF-7 du cancer du sein dans chaque puits de la plaque préparée de 96 puits en milieu de Eagle modifié par Dulbecco (DMEM) avec du milieu F-12 culture de Ham supplémenté avec 10% de sérum de veau foetal (FCS) et 1% de pénicilline / streptomycine .
- Cultiver sphéroïdes de 5-7 jours jusqu'à un diamètre d'environ 200 à 300 um dans un incubateur à 5% de CO 2 et 3776; C.
- Incuber les sphéroïdes de cellules avec le chlorhydrate de doxorubicine antibiotique anthracycline pendant 6 heures à une concentration comprise entre 2 et 8 uM uM (dans du milieu de culture) dans un incubateur à 5% de CO 2 et 37 ° C.
- Laver les sphéroïdes de cellules avec du milieu de culture ou solution saline équilibrée de Earle (EBSS) avant à la microscopie.
- Expérience 2: Procédé d'oxydation sphéroïdes exprimant un capteur redox
- Graine environ 400 cellules de glioblastome U251 MG-L106-transfectées de manière permanente avec la sonde redox du glutathion fluorescent sensible au vert Grx1-roGFP2 dans des puits revêtues de gel d'agarose (procédé décrit dans les étapes 1.1.1-1.1.3) d'une plaque à 96 puits dans du DMEM milieu de culture supplémenté avec 10% de SVF, 1% de pénicilline / streptomycine et l'hygromycine B (150 ug / ml).
- Cultivez sphéroïdes pour 5-7 jours jusqu'à un diamètre d'environ 200-300 um dans un incubateur à 5% de CO 2 et 37 ° C.
- Ajouter 10 & #181; l de solution de peroxyde d'hydrogène (purum pa, ≥ 30%) à 990 de l'eau bi-distillée ul de créer un mM solution 100 à être utilisé dans les 12 heures.
- Diluer la solution mère de l'étape 1.2.3 à 50 uM dans EBSS juste avant l'expérience.
- Incuber les sphéroïdes de cellules par l'intermédiaire du système microfluidique lors de la mesure avec le peroxyde d'hydrogène à 50 uM EBSS pour l'oxydation de la sonde redox.
- Expérience 3: Initiation et l'étiquetage de la nécrose cellulaire dans sphéroïdes
- Semences environ 400 cellules (par exemple, les cellules de glioblastome U251-MG-L106-Grx1-roGFP2) dans les puits revêtues de gel d'agarose (procédure décrite dans les étapes 1.1.1-1.1.3) d'une plaque de 96 puits dans un milieu de culture DMEM supplémenté avec 10% de SVF, 1% de pénicilline / streptomycine et l'hygromycine B (150 mg / ml).
- Cultivez sphéroïdes pour 5-7 jours jusqu'à un diamètre d'environ 200-300 um dans un incubateur à 5% de CO 2 et 37 ° C.
- Incuber les cellulessphéroïdes avec le transport d'électrons mitochondriale inhibiteur roténone pendant 3 heures à une concentration de 1 uM dans du milieu de culture pour induire une nécrose cellulaire. En outre, la co-incuber avec un colorant vert de cytotoxicité pendant 3 heures à une concentration de 1 ul à 1 ml de milieu de culture pour marquer les cellules nécrotiques.
- Laver les sphéroïdes de cellules avec du milieu de culture ou EBSS avant à la microscopie.
2. nappe de lumière Réglage
NOTE: Pour la réalisation de meilleurs résultats, il faut veiller à ce que la taille du faisceau de la nappe de lumière est dans le plan de mise au point de l'objectif. La position de la taille du faisceau ne peut être alignée par l'observation de la nappe de lumière dans la position verticale par rapport au capillaire (voir les étapes 2.5 à 2.8).
- Utilisation d'un microscope inversé et monter le module d'excitation de SPIM, comme décrit dans la réf. 16, à la plaque de base de la table de positionnement (voir figure 1A).
- Équiper le microscope avec un 10X / ou 20X 0,3 / 0,5 objectif de microscope et un filtre passe-temps approprié (par exemple, λ ≥ 515 nm) dans le trajet de détection du microscope.
- Monter une caméra intégrant à l'orifice de détection du microscope.
- Utiliser un faisceau collimaté d'un laser parallèle ou une diode laser avec une longueur d'onde d'excitation de 470 nm de préférence et de l'appliquer au module de SPIM.
- Faire tourner la lentille cylindrique de 90 degrés, ce qui transfère la nappe de lumière dans une position verticale pour un réglage axial de la partie rétrécie du faisceau de lumière de la feuille.
- Placer un capillaire contenant un liquide avec un colorant fluorescent dans le porte-échantillon.
- Fixer le support d'échantillon avec le capillaire de la table de microscope de positionnement et d'aligner la position du capillaire de telle sorte qu'elle est centrée et la taille du faisceau de lumière de la feuille est mise au point.
- Ajuster la taille du faisceau par variation de la position axiale de la lentille cylindrique elle-même. Retournez la lentille après l'annonceAJUSTEMENT.
3. cellulaire application de sphéroïde et Microscope RSS synchronisation
- Placer les sphéroïdes de cellules séparément ou en groupes à l'intérieur borosilicate rectangulaire capillaires en verre 16 avec une section interne de 600 um x 600 um et une épaisseur de paroi de 120 pm. Deux techniques d'application d'un sphéroïde cellulaire ont donné de bons résultats.
- Prenez le capillaire vide verticale avec le pouce et le majeur et sceller l'ouverture supérieure avec l'index. Apportez l'ouverture inférieure près de la sphéroïde cellulaire dans son liquide environnant (EBSS ou milieu de culture). Relâchez l'index de l'ouverture supérieure. Liquide avec le sphéroïde cellulaire en elle sera immédiatement trempée dans de forces capillaires. Ajuster la position du sphéroïde à l'intérieur du capillaire rempli par gravitation en position verticale respective du capillaire.
- En variante, appliquer le sphéroïde cellulaire à travers le capillaire pipetage. Prenez soin de that l'ouverture de la pointe de la pipette est, d'une part, assez grande pour la taille de l'ellipsoïde et, d'autre part, inférieure ou égale à la taille du diamètre interne du capillaire.
- Placer le capillaire avec le sphéroïde à elle dans un porte-échantillon pour la microscopie spécial.
- Fixer le support d'échantillon avec le capillaire de la table de microscope de positionnement et aligner la position de l'ellipsoïde de la cellule de telle sorte qu'elle est centrée et concentrée.
- Régler la correspondance entre la nappe de lumière et le plan focal de l'objectif de microscope dans la voie de détection en réglant la position du miroir de réflexion et la lentille cylindrique (voir la vis de réglage sur la figure 1B).
- Régler la vis micrométrique (voir figure 1B) selon les indices de réfraction et l'ouverture numérique de l'objectif de compenser l'effet aquarium.
NOTE: Les différents indices de réfraction de l'échantillon et les milieux environnants til lentille objectif principal d'une différence entre le déplacement de la lentille d'objectif et le décalage du plan focal. Etant donné que la nappe de lumière est déplacée par le revolver porte-objectifs, le décalage entre le passage de la nappe de lumière (correspondant au décalage de l'objectif), et le déplacement du plan focal est compensée par un bras de levier (voir la figure 1B). La vis micrométrique permet d'adapter la distance entre la partie supérieure et la broche inférieure pour régler le déplacement de la nappe de lumière selon l'ouverture numérique de la lentille d'objectif et les indices de réfraction.
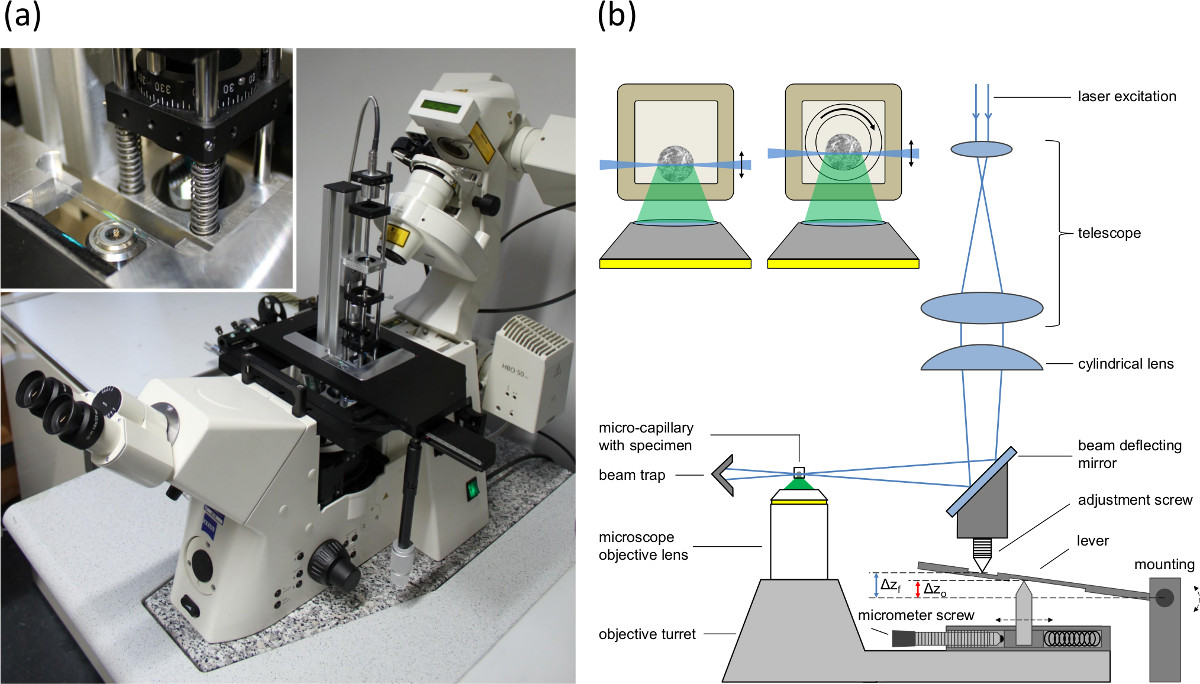
Figure 1: (A) Image de la seule plan du module d'éclairage monté sur la plaque de base de la table d'un microscope inversé de positionnement, (B) l'installation de l'éclairage du plan uniquemodule et la synchronisation de l'alimentation microscope pour compenser la levée ou non-concordance (effet aquarium) entre le plan focal et le plan d'éclairement. Az o indique le décalage de l'objectif et f Az le déplacement du plan focal et la nappe de lumière. L'incrustation montre des sections de sphéroïdes contenant des capillaires. Gauche: capillaire rectangulaire avec un diamètre intérieur de 600 um (paroi 120 um). Droite: Configuration utilisée pour la rotation. Un capillaire intérieure ronde (diamètre intérieur 400 um, diamètre extérieur de 550 um) est tourné dans le capillaire rectangulaire extérieur. L'espace entre les deux capillaires est rempli d'un liquide d'immersion.
4. mesure en dynamique liquide Environnement
REMARQUE: Le protocole précédent est utilisé pour l'incubation statique avant une mesure où le sphéroïde cellule a déjà été incubé puis maintenu en place dans le capillaire par simple gravitation. Il n'y a pas besoin d'autres FIXATIsur. Toutefois, pour les mesures dans les médias où une incubation dynamique et, par conséquent, un environnement dynamique est souhaitable de mesurer la cinétique absorption coule, on peut accomplir ce sous-protocole. Les étapes 4.5 à 4.9 sont essentielles pour éviter les bulles d'air atteignant l'échantillon.
- Remplir le tube capillaire avec FCS pendant 30 min plus tard, à l'appui de l'adhérence cellulaire d'un sphéroïde cellulaire à la surface de verre interne.
- Laissez le revêtement FCS restant dans le capillaire appauvri sécher pendant au moins 12 heures.
- Présentez le sphéroïde cellulaire au capillaire revêtu FCS comme décrit dans l'étape 3.2.
- Laissez le capillaire dans l'incubateur à 5% de CO 2 et 37 ° C pendant 2-4 heures supplémentaires pour provoquer l'adhérence cellulaire de l'ellipsoïde.
- Mettre en place la partie afflux du système microfluidique (voir Figure 2). Utilisation d'une pompe péristaltique à l'afflux de remplir le tube (diamètre interne: 0,89 mm) avec un milieu de culture contenant le colorant fluorescent, un médicament ou un agent.
- Connect la partie afflux du système microfluidique à un piège à bulles (voir Figure 2).
- Tout d'abord serrer le tube capillaire de bulle à la tubulure d'afflux, puis serrer l'autre côté du capillaire à la tubulure de vidange.
- Tune la température du liquide du bain d'eau à la valeur désirée (par exemple, 37 ° C).
- Ajuster la pompe péristaltique à la vitesse désirée de la pompe (par exemple, débit: 9 pl / min; la vitesse de la pompe dans le capillaire: 25 mm / min).
- Recueillir le liquide pompé soit dans un (configuration en boucle ouverte) destinataire, le nourrir à sa source (configuration en boucle fermée) ou alimenter directement dans le tube de la pompe péristaltique (configuration en boucle fermée serré).
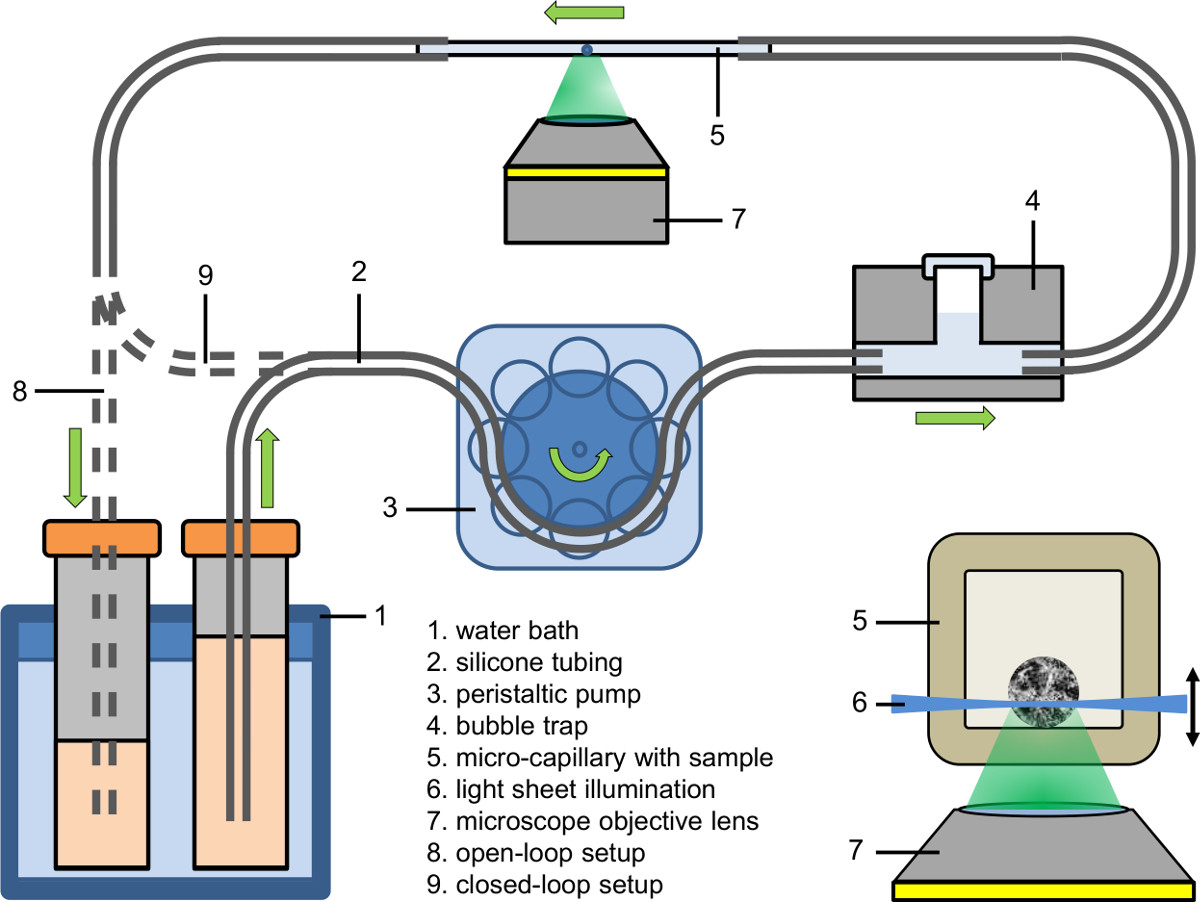
Figure 2: configuration microfluidique (en boucle ouverte et serrée en boucle fermée); incrustation: Illumination d'une spheroid l'intérieur d'un micro-capillaire en utilisant la microscopie optique en feuille à base de fluorescence couplé à un microscope inversé.
Acquisition de données et analyse 5.
- Régler la puissance du laser et le temps d'intégration pour l'acquisition de l'image.
- Prendre garde que les paramètres définis à l'étape 5.1 ne dépassent pas les valeurs de dose de lumière au sujet de 50 à 100 J / cm 2 pour les cellules natives ou de 10 à 20 J / cm 2 pour les cellules incubées avec un colorant fluorescent ou transfectées avec un plasmide fluorescent codant pour la protéine à éviter phototoxicité (pour plus de détails voir. Réf 12).
- Régler l'incrément pour la pile à z Az = 5-10 um ce qui est préférable pour les trois dimensions de l'analyse des données en tant que l'épaisseur de la nappe de lumière est d'environ 10 um.
- Effectuer des mesures d'images simples ou z-piles par une variation du plan focal dans le sphéroïde cellulaire.
Résultats
Expérience 1: cellules sphéroïdes incubées avec un médicament chimiothérapeutique
Un balayage z-stack d'un MCF-7 sphéroïde cellule préalablement incubées (8 uM de doxorubicine, 6 h) est représenté dans la figure 3. Elle donne des informations détaillées sur l'absorption cellulaire et la distribution de la doxorubicine 17 et son produit de dégradation 18,19. Dans la couche externe de la cellule de la doxorubicine f...
Discussion
Le présent manuscrit décrit une nappe de lumière ou simple microscopie plan d'éclairage (SPIM) dispositif qui est optimisé pour les systèmes cellulaires en 3 dimensions, par exemple sphéroïdes multicellulaires tumorales (SCTM). Trois exemples d'applications sont (1) l'absorption d'un médicament cytostatique et sa conversion partielle à un produit de dégradation (dont la contribution à l'efficacité chimiothérapeutique reste encore à évaluer), (2) les mesures de l'...
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Ce projet a été financé par le Land de Bade-Wurtemberg ainsi que par l'Union européenne, Europäischer Fonds für die Entwicklung Regionale. Les auteurs remercient Rainer Wittig (ILM Ulm) pour fournir la lignée cellulaire U251-MG-L106-Grx1-roGFP2 et Claudia Hintze d'assistance technique habile.
matériels
| Name | Company | Catalog Number | Comments |
| Microtiter plate | Orange Scientific | 4430100 | For cell spheroid growing |
| Agarose | Carl Roth GmbH | 3810.1 | For cell spheroid growing |
| MCF-7 cell line | CLS Cell Lines Service GmbH | 300273 | Cell line |
| U251-MG-L106 cell line | Cell line | ||
| DMEM | Biochrom AG (Merck Millipore) | FG0435 | Culture medium |
| DMEM/Ham's F-12 | Biochrom AG (Merck Millipore) | FG4815 | Culture medium |
| FCS | Biochrom AG (Merck Millipore) | S0615 | Cell culture supplement |
| Penicillin/streptomycin | Biochrom AG (Merck Millipore) | A 2213 | Antibiotics |
| Hygromycin B | PAA Laboratories | P02-015 | Antibiotic |
| EBSS | Sigma-Aldrich Inc. | E3024 | Cell culture supplement |
| Doxorubicin | Sigma-Aldrich Inc. | D1515 | Fluorescent dye (CAUTION: acute toxicity) |
| Green cytotoxicity dye | Promega GmbH | G8742 | CellTox - fluorescent cytotoxicity dye |
| Rotenone | Sigma-Aldrich Inc. | R8875 | Cellular inhibitor (CAUTION: acute toxicity) |
| Hydrogen peroxide (H2O2) | Sigma-Aldrich Inc. | 95302 | Reagent for oxidation (CAUTION: acute toxicity) |
| Capillary | VitroCom | 8260-050 | Sample preparation |
| Microscope | Carl Zeiss Jena | Axiovert 200M | |
| AxioCam MRc CCD-camera | Carl Zeiss MicroImaging GmbH | 426508-9901-000 | CCD-camera |
| AxioVision data aquisition software | Carl Zeiss MicroImaging GmbH | version 4.8.2. | |
| Laser diode | Pico Quant GmbH | LDH-P-C-470 | Used with driver PDL800-B |
| Peristaltic pump | Ismatec Labortechnik | MS-1 Reglo | Re-calibrated to reduce the minimum pump speed by 1/10 |
| Silicone tubes | IDEX Health & Science GmbH | TYGON R3607 |
Références
- Pawley, J. . Handbook of biological confocal microscopy. , (1990).
- Webb, R. H. Confocal optical microscopy. Rep. Prog. Phys. 59, 427-471 (1996).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- König, K. Multiphoton microscopy in life sciences. J. Microsc. 200 (2), 83-104 (2000).
- Neil, M. A., Juskaitis, R., Wilson, T. Method of obtaining optical sectioning by using structured light in a conventional microscope. Opt. Lett. 22 (24), 1905-1907 (1997).
- Gustafsson, M. G. L., et al. Three-dimensional resolution doubling in wide-field fluorescence microscopy by structured illumination. Biophys. J. 94 (12), 4957-4970 (2008).
- Huisken, J., Swoger, J., del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical sectioning deep inside live embryos by SPIM. Science. 305 (5686), 1007-1009 (2004).
- Huisken, J., Stainier, D. Y. R. Selective plane illumination microscopy techniques in development biology. Development. 136 (12), 1963-1975 (2009).
- Santi, P. A. Light sheet fluorescence microscopy: a review. J. Histochem. Cytochem. 59 (2), 129-138 (2011).
- Kunz-Schughart, L. A., Freyer, J. P., Hofstaedter, F., Ebner, R. The use of 3-D cultures for high throughput screening: the multi-cellular spheroid model. J. Biomol. Screen. 9 (4), 273-285 (2004).
- Schneckenburger, H., et al. Multi-dimensional fluorescence microscopy of living cells. J. Biophotonics. 4 (3), 143-149 (2011).
- Schneckenburger, H., et al. Light exposure and cell viability in fluorescence microscopy. J. Microsc. 245 (3), 311-318 (2012).
- Ritter, J. G., Veith, R., Veenendaal, A., Siebrasse, J. P., Kubitschek, U. Light sheet microscopy for single molecule tracking in living tissue. PLoS One. 5 (7), e11639:1-e11639:7 (2010).
- Mertz, J., Kim, J. Scanning light-sheet microscopy in the whole mouse brain with HiLo background rejection. J. Biomed. Opt. 15 (1), 016027 (2010).
- Fahrbach, F. O., Rohrbach, A. A line-scanned light-sheet microscope with phase shaped self-reconstructing beams. Opt. Express. 18 (23), 24229-24244 (2010).
- Bruns, T., Schickinger, S., Wittig, R., Schneckenburger, H. Preparation strategy and illumination of 3D cell cultures in light-sheet based fluorescence microscopy. J. Biomed. Opt. 17 (10), 101518 (2012).
- Ma, H. L., et al. Multicellular tumor spheroids as an in vivo-like tumor model for three-dimensional imaging of chemotherapeutic and nano material cellular penetration. Mol. Imaging. 11 (6), 487-498 (2012).
- Weber, P., Wagner, M., Schneckenburger, H. Cholesterol dependent uptake and interaction of doxorubicin in MCF-7 breast cancer cells. Int. J. Mol. Sci. 14 (4), 8358-8366 (2013).
- Hovorka, O., et al. Spectral analysis of doxorubicin accumulation and the indirect quantification of its DNA intercalation. Eur. J. Pharm. Biopharm. 76 (3), 514-524 (2010).
- Schickinger, S., Bruns, T., Wittig, R., Weber, P., Wagner, M., Schneckenburger, H. Nanosecond ratio imaging of redox states in tumor cell spheroids using light sheet-based fluorescence microscopy. J. Biomed. Opt. 18 (12), 126007 (2013).
- Lippert, H., Wald, M., Radt, B. Optical arrangement for the production of a light sheet. U.S. Patent. , (2010).
- Lorenzo, C., et al. Live cell division dynamics monitoring in 3D large spheroid tumor models using light sheet microscopy. Cell Division. 6 (22), 1-8 (2011).
- Bruns, T., Schneckenburger, H., Schickinger, S. Sample holder for rotation of three-dimensional specimens in microscopy. European Patent Application. , (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon