Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Tek Düzlem Aydınlatma Modülü ve geniş alan Mikroskop Mikro-kılcal Yaklaşım
Bu Makalede
Özet
Tek düzlem aydınlatma mikroskopi için bir modül (SPIM) kolay bir şekilde ters geniş alan mikroskobu üzere uyarlanmıştır ve 3-boyutlu hücre kültürleri için optimize edildiği açıklanmaktadır. Numune bir dikdörtgen kılcal içinde yer almaktadır ve mikro-akışkan sistem floresan boyalar ile, farmasötik maddeler ya da ilaç küçük miktarlarda uygulanabilir.
Özet
Kolayca ters geniş alan mikroskobu üzere uyarlanmıştır ve 3-boyutlu hücre kültürleri için optimize edilmiş anlatılan ışık tabaka ya da tek bir düzlem aydınlatma mikroskobu (SPIM) için bir modül, örneğin, çok hücreli tümör sferoidler (MCTS). SPIM uyarma modülü şekiller ve örnek dik mikroskop algılama yoluna açık tabaka ile aydınlatılacak şekilde ışığın yönünü değiştirir. Sistem aydınlatan ışık tabakanın her iki ayar durumunda ve hem de floresan tespiti için kullanılan objektif mercek tarafından, örneklerin (aynı zamanda döndürülmesi için bir mikro-kapiller yaklaşımı ve gelişmiş bir versiyonu) tutmak için dikdörtgen kılcal kullanılması ile karakterize edilir Floresan boyalar, küçük miktarlarda farmasötik maddeler ya da ilaç uygulaması için bir mikro-akışkan sistemi adaptasyonu. Bu sistem ile çalışmak için bir protokol verilir ve bazı teknik detaylar bildirilmektedir. Temsilcisi sonuçları up (1) ölçümlerini içermektedirbir oksitleyici madde ilave edilmesi üzerine bir sitostatik ilaç (doksorubisin) ve bir bozunma ürünü olan kısmi dönüşüm genetik olarak kodlanmış glutation sensörünün kullanılmasıyla, (2) bir redoks ölçüm yapmak, ve (3) başlangıç ve inhibisyon sonucunda nekroz etiketleme mitokondriyal solunum zinciri. Mevcut sistemler ile karşılaştırıldığında, bu SPIM modülünün farklılıklar ve avantajları tartışılacaktır.
Giriş
Iyi kurulmuş yöntemleri (konfokal veya çoklu foton lazer tarama mikroskopisi 1-4, yapılandırılmış aydınlatma mikroskopisi 5,6) hafif levha veya tek düzlem aydınlatma mikroskobu (SPIM) ek olarak 3D görüntüleme 7,8 değerli bir yöntem olduğu kanıtlanmıştır, 9. Özel ilgi ilaç keşfi araştırmaları 10,11 giderek kullanılan 3 boyutlu hücre kültürleri, örneğin, çok hücreli tümör sferoidlerle (MCTS), onun uygulamadır. Ayrıca, SPIM hatta uzun süreli maruz kalma ya da yineleyici ölçümleri üzerine düşük ışık dozunun yalnızca bu düzlem ışığına maruz numunenin her düzlemde ölçümü için yana, numunenin canlılığını korumak için gerekli olan tercih edilen bir yöntemdir. Bu, her bir odaklama düzleminin tespiti için tüm numune aydınlatılır diğer mikroskopi teknikleri, aksine, ışık dozu özetliyor sayıda düzlemin üzerine kaydedilmesi ve böylece örnek 12 zarar verebilir.
Işık mikroskobu ya da tabaka SPIM silindirik lens kullanımı ile ya da (bir yorumda bakınız Ref. 8) verici lazer ışını tarayarak ya da gözlem yoluna dik yönde numunenin aydınlatma dayanmaktadır. Bu genellikle özel örnek odaları 13,14 veya matrisinim gerektirir örneğin, agaroz 7,15, özel yüksek maliyetli mikroskoplar uygulanmaktadır. Bu sistemlere bir alternatif olarak SPIM için nispeten basit bir aydınlatma aygıtı geliştirilmiştir ve bu geleneksel bir ters mikroskop 16 (Şekil 1 'e bakınız) özel olarak uyarlanmıştır. Yaklaşık 100 um arasında bir alan derinliği üzerinde 6-10 um kalınlıkta ince bir tabakaya bir silindirik bir mercek (0.08: 50 mm, sayısal açıklık odak uzunluğu) 8 mm'lik bir çapa genişletilmiş ve odaklanmış bir lazer ışını içerir . Örnekler mikroskop objektif len önüne yerleştirilen 600-900 mikron iç çapa sahip olan bir dikdörtgen kılcal bulunurfloresan tespiti için lar. Bu ana özellikleri şu anda tamamlanan ve tutmak için ve floresans saptama (aynı optik yol boyunca ikinci (eksenel yönde) örnekleri, aydınlatan ışık tabakanın senkron uyum ve objektif lens döndürülmesi için gelişmiş mikro-kapiller yaklaşımların kullanımı optimize edilmiştir deplasman uzunlukları böylece gerekli miktarlarda ve giderleri en aza indirmek, mekanik itmesinin bir düzeltilmesi) ve floresan boyalar, farmasötik maddeler ya da ilaç uygulaması için bir mikroakışkan sisteminin uyum gerektirir.
Protokol
1. Hücre Sferoid Büyüyen ve Kuluçka
- Deney 1: Hücre sferoidler bir kemoterapötik ajan ile inkübe
- (6 plakaları için yeterlidir) 30 ml kültür ortamı Agaroz 0.45 g eklenmesi ile kültür ortamı içinde% 1.5 agaroz hazırlayın.
- Zaman zaman bu karıştırılırken aşama 1.1.1 en az 80 ° C için karışımın ısıtılması.
- 96 oyuklu bir plakanın her bir oyuğuna aşama 1.1.2 ısıtılan karışımın 50 ul doldurun ve 1-2 saat içinde katılaşır sağlar. Kullanılana kadar 5 ° C'de buzdolabında kapatılmış ve kaplı plakalar saklayın.
- Hazırlanan 96 oyuklu% 10 fetal dana serumu (FCS) ile takviye edilmiş Ham F-12 kültür ortamı ihtiva eden Dulbecco'nun modifiye edilmiş Eagle ortamında (DMEM) içinde plaka ve% 1 penisilin / streptomisin her çukuruna 150 MCF-7 göğüs kanseri hücreleri ile ilgili Tohum .
- % 5 CO2 ve 37 ° C'de bir inkübatör içinde yaklaşık 200-300 um bir çapa kadar 5-7 gün boyunca büyütün sferoidler76 C.
- % 5 CO2 ve 37 ° C'de bir kuluçka makinesi içinde 2 uM ve (kültür ortamında) 8 uM arasında değişen bir konsantrasyonda, 6 saat süre antrasiklin antibiyotik doksorubisin hidroklorid ile hücre küremsilerin inkübe edin.
- Kültür ortamının veya Earle Dengeli Tuz Çözeltisi (EBSS) önce mikroskop ile hücre küremsilerin yıkayın.
- Deney 2: Bir redoks sensör ifade küresellerde Oksitleme işlemi
- DMEM içinde 96 çukurlu bir levhanın sürekli agaroz jel ile kaplı çukurlara glutation duyarlı yeşil floresan redoks sensörü GRX1-roGFP2 (yöntem adımlarında tarif 1.1.1-1.1.3) ile transfekte edilmiş 400 U251-MG-L106, glioblastoma hücreleri ile ilgili Tohum Kültür ortamı,% 10 FCS,% 1 penisilin / streptomisin ve higromisin B (ug / ml 150 ug) ile takviye edilmiştir.
- % 5 CO2 ve 37 ° C'de bir inkübatör içinde yaklaşık 200-300 um bir çapa kadar 5-7 gün boyunca büyütün sferoidler.
- 10 & # ekle181, 100 mM'lik bir stok çözeltisi oluşturmak için 990 ul iki kez damıtılmış su, hidrojen peroksit çözeltisi (purum pa, ≥% 30) l 12 saat içinde kullanılmalıdır.
- Hemen deneyden önce adımdan EBSS'ye 1.2.3 50 mcM stok solüsyonu sulandırmak.
- Redoks sensör oksitlenmesi için EBSS'ye hidrojen peroksit 50 uM ile, ölçüm sırasında mikroakışkan sistemi vasıtasıyla hücre küremsilerin inkübe edin.
- Deney 3: Başlatma ve parçacıklarının içindeki hücresel nekroz etiketleme
- Ile desteklenmiş DMEM kültür ortamı içinde bir 96-yuvalı plakanın agaroz jel ile kaplı çukurlara Tohum 400 hücreler (örneğin, U251-MG-L106-GRX1-roGFP2 glioblastoma hücreleri) (yöntem adımlarda açıklandığı 1.1.1-1.1.3) % 10 FCS,% 1 penisilin / streptomisin ve higromisin B (150 mg / ml).
- % 5 CO2 ve 37 ° C'de bir inkübatör içinde yaklaşık 200-300 um bir çapa kadar 5-7 gün boyunca büyütün sferoidler.
- Hücre inkübeKültür ortamı içinde, 1 mM'lik bir konsantrasyonda 3 saat mitokondriyal elektron taşıma inhibitörü rotenone ile sferoidler hücresel nekroz oluşturma. Buna ek olarak, nekrotik hücreleri etiketlemek için 1 ml kültür ortamı içinde 1 ul bir konsantrasyonda 3 saat için bir yeşil boya sitotoksisite ile birlikte inkübe edilir.
- Kültür ortamının veya mikroskop önce EBSS ile hücre küremsilerin yıkayın.
2. Işık Sayfası Ayarı
NOT: En iyi sonuçları elde etmek için, ışık ışını tabakanın bel objektifin odak düzleminde olduğu sağlanmalıdır. Kiriş bel konumu sadece (- 2.8 adım 2.5) kılcal göre dikey konumda ışık tabakası gözlemleyerek hizalanabilir.
- Devrik bir mikroskop kullanarak ve Ref tarif edildiği gibi, SPIM uyarım monte modülü. 16, konumlandırma tablonun tablaya (Şekil 1A bakınız).
- 1 ile mikroskop donatın0X / 0,3 veya 20X / 0.5 mikroskop objektif lens ve mikroskop algılama yolunda bir uygun uzun-pass filtre (örneğin, λ ≥ 515 nm).
- Mikroskop algılama noktasına bir entegre kamera monte edin.
- Tercihen 470 nm bir eksitasyon dalga boyuna sahip bir lazer ya da bir lazer diyot paralel bir birleştirilmiş ışın kullanarak ve SPIM modüle uygulayın.
- Işık ışını tabakanın bel bölgesinin bir eksenel olarak yer değiştirmesi için dikey bir konuma transfer ışık tabakası 90 derece ile silindirik lens döndürün.
- , Numune tutucu içindeki bir floresan boya ile bir sıvı içeren bir kılcal yerleştirin.
- Mikroskop konumlandırma tablosuna kılcal numune tutucu takın ve merkezli ve ışık tabakanın ışın bel odakta ve bu şekilde, kılcal hizalayabilmesi.
- Silindirik bir mercek kendisinin eksenel pozisyonunun değiştirilmesi ile bel kiriş ayarlayın. Reklam sonra lens geri dönünayarlayabilme özelliği.
3. Hücre Sferoid Uygulama ve Mikroskop Yem Senkronizasyon
- 600 um x 600 um iç enine kesitine ve 120 um arasında bir duvar kalınlığına sahip ayrı olarak ya da dikdörtgen bir borosilikat cam kılcal 16 içinde gruplarda hücre küremsilerin yerleştirin. Hücre sferoit olması ile uygulanması için iki teknik başarılı olduğu kanıtlanmıştır.
- Başparmak ve orta parmak ile dik boş kılcal alın ve işaret parmağı ile üst açıklık mühür. Alt çevresi sıvı hücre sfero yakın açıklık (EBSS veya kültür ortamını) getirin. Üst açıklığından işaret parmağı bırakın. O hücre sfero ile sıvı kılcal güçleri tarafından derhal batırılmış olacak. Kılcal ilgili dik konumda yerçekimi tarafından doldurulmuş kılcal içindeki sfero konumunu ayarlayın.
- Seçenek olarak ise, pipetleme yoluyla kılcal hücre sfero uygulanır. Bakım tha alınküremsi boyutu için yeterince büyük bir yandan bir pipet ucunun açılması, ve t, diğer taraftan, daha az ya da kılcal iç çapı boyutuna eşit boyutlara sahiptirler.
- Mikroskopi için özel bir numune tutucu içindeki içindeki sfero ile kılcal yerleştirin.
- Mikroskop konumlandırma tablosuna kılcal numune tutucu ekleme ve merkezli ve odaklanacağı gibi hücre sfero hizalayabilmesi.
- Işık tabaka ve yansıtma aynası konumunu ve silindirik lens ayarlanmasıyla tespit yolu mikroskop objektif merceğin odak düzlemi arasındaki eşleştirmeyi ayarlayın (Şekil 1B ayar vidası bakınız).
- Mikrometre vidasını ayarlayın kırılma endeksleri ve fishtank etkisini telafi etmek için objektif lens sayısal açıklığına göre (Şekil 1B bakınız).
NOT: Farklı kırılma numunenin endeksleri ve t çevreleyen ortamo objektif lens kayması ve odak düzlemi kayma arasındaki fark objektif lens kurşun. Işık tabaka amacı, taret hareket ettirildiği için, ışık tabakanın (objektif lens kaymasına karşılık gelir) ve odak düzlemi kayması geçiş arasında bir uyumsuzluk bir manivela kolu ile dengelenir (Şekil 1B'ye bakınız). Mikrometre vida objektif merceğinin sayısal açıklığı ve kırılma indeksleri göre ışık tabakanın geçişi ayarlamak için, üst ve alt mil arasındaki mesafenin adapte etmek için kullanılır.
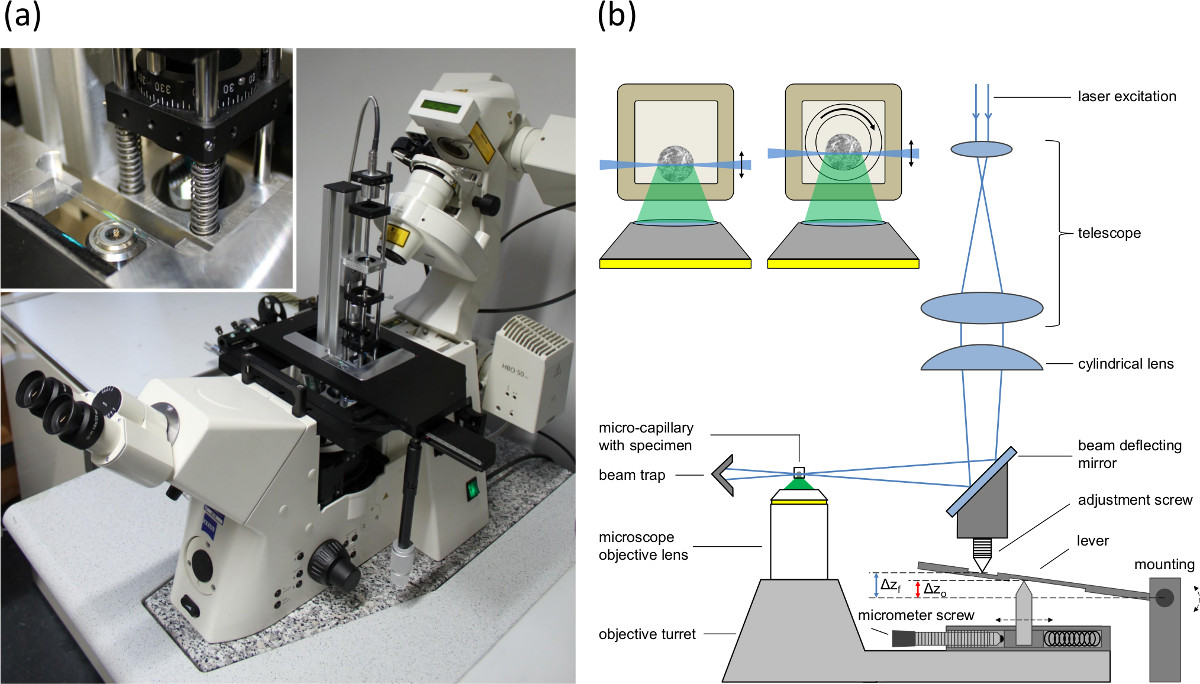
Tek düzlem aydınlatma Şekil 1. (A) ters bir mikroskop konumlandırma tablo taban plakasına monte tek düzlem aydınlatma modülü resmi, (B) kurulummodülü ve mikroskop yem senkronizasyon odak düzlemi ve aydınlatma düzlemi arasındaki kaldırma-uyumsuzluğunu (fishtank etkisi) telafi etmek. Δz o odak düzlemi kayması ve ışık tabakanın ön objektif ile Δz kaymasını gösterir. Kakma sfero içeren kılcal damarların kesitlerini göstermektedir. Sol: Dikdörtgen kılcal 600 mikron (duvar 120 mikron) iç çapı ile. Sağ: dönüş için kullanılır Kur. Bir iç yuvarlak kılcal (iç çapı 400 mm, dış çapı 550 mm) dış dikdörtgen kapiler içinde döndürülür. İki kılcal boşluklar arasındaki boşluk bir daldırma sıvısı ile doldurulur.
Dinamik Sıvı Ortamında 4. Ölçme
NOT: Bir önceki protokol hücre küremsi önce basit yer çekimi ile kılcal yerinde bekletilir ve daha sonra tutulan bir ölçme işleminin statik bir inkübasyon için kullanılır. Daha fazla fixati gerek yokturüzerinde. Ancak, dinamik bir inkübasyon ve bu nedenle, dinamik bir ortam alım kinetiği ölçmek için tercih edilir madde akım ölçümleri için, bir bu alt-protokol başarabilir. 4.5-4.9 örnek ulaşan hava kabarcıklarını önlemek için kritik adımlar.
- 30 dakika iç cam yüzeyine bir hücre sferoit olması daha sonra hücre yapışmasını desteklemek için FCS ile kılcal doldurun.
- Tükenmiş kılcal kalan FCS kaplama en az 12 saat boyunca kurumasına izin verin.
- Adım 3.2 'de tarif edildiği gibi FCS kaplanmış kılcal hücre sfero tanıtılması.
- Sfero hücresel yapışma neden olmak için% 5 CO2 ve ek 2-4 saat boyunca 37 ° C'de kuluçka makinesi içindeki kılcal bırakın.
- Mikroakışkan sisteminin kan toplanması parçası kadar (bakınız Şekil 2). (: 0.89 mm iç çap) flüoresan boya, ilaç ya da maddesini ihtiva eden kültür ortamı ile boru arasında kan toplanması dolduracak bir peristaltik pompa kullanılır.
- ConneBir kabarcık tuzak mikroakışkan sisteminin kan toplanması parçası BT (bakınız Şekil 2).
- Üretim hücumu boru kabarcık içermeyen kapiler sıkıştırma ve daha sonra boşaltma borusuna kılcal diğer tarafını kelepçe.
- Ayarlama değere (örneğin, 37 ° C) su banyosu sıvı sıcaklığı.
- Arzu edilen bir pompa hızı ile peristaltik pompa ayarlayın (örneğin, akış hızı: 9 ml / dakika, pompa hızı kılcal: 25 mm / dak).
- , Bir alıcı (açık-döngü kurulum) olarak pompalanan sıvı ya toplayın kaynağından (kapalı-döngü kurulum) geri beslemek veya peristaltik pompa (sıkı kapalı döngü kurulum) hortumun içine doğrudan doyurmaya.
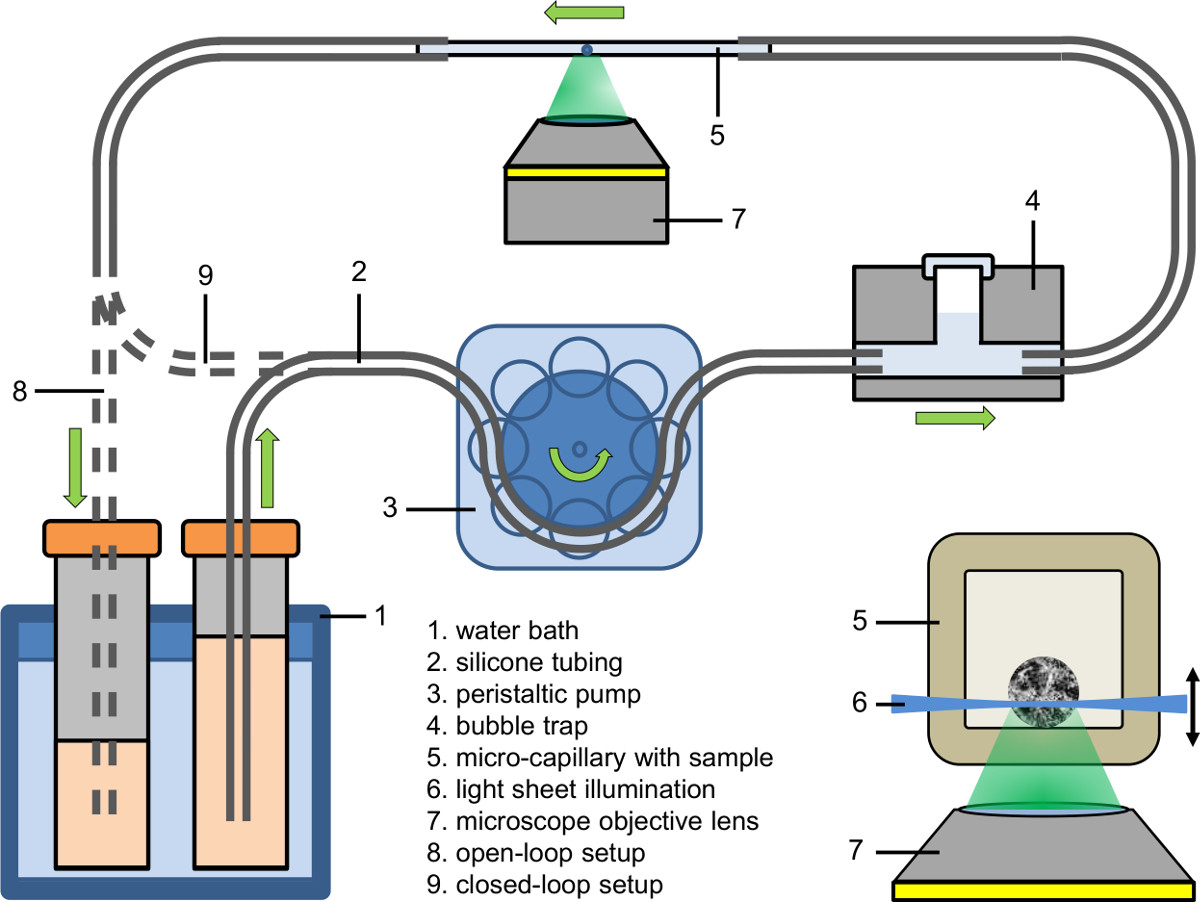
Şekil 2. Mikroakışkan kurulum (açık-döngü ve sıkı kapalı-döngü); kakma: Bir sph Aydınlatma, bir inverted mikroskop birleştirilmiş ışık levha bazında floresan mikroskopi kullanılarak bir mikro kapiler içinde eroid.
5. Veri Toplama ve Analizi
- Lazer gücünü ve görüntü alımı için entegrasyon süresini ayarlayın.
- Adım 5.1 'de tanımlanan parametreler ışık dozu değerlerinin natif hücreleri için yaklaşık 50-100 J / cm2 veya bir fluoresan proteini kodlayan plazmid ile bir floresan boya ile inkübe veya transfekte edilen hücreler için 10-20 l / cm2 aşmayan özen (detaylar Ref. 12 bakınız) fototoksiteyi kaçının.
- Δz etmek için z yığını için artış = ışık tabaka kalınlığı yaklaşık 10 mm olan 3-boyutlu veri analizi için tercih edilen 5-10 um ayarlayın.
- Hücre sfero içindeki odak düzlemi değişimi ile tek görüntü veya Z yığınlarının ölçümleri yapın.
Sonuçlar
Deney 1: Hücre sferoidler bir kemoterapötik ajan ile inkübe
Önceden inkübe MCF-7 hücre sferoit (8 uM, doksorubisin, 6 saat) bir z-yığın tarama, Şekil 3'te gösterilmektedir. Bu hücresel alımı ve doksorubisin 17 arasında dağılım ve bozunma ürünü 18,19 hakkında ayrıntılı bilgi vermektedir. İç küremsi alanlarda bozunma ürünü tarafından yayılan yeşil flüoresans hücre zarının 19 baskın hal...
Tartışmalar
Bu el yazması bir ışık tabakası veya 3-boyutlu hücre sistemleri için optimize edilmiştir tek düzlem aydınlatma mikroskobu (SPIM) aygıtı, örneğin çok hücreli tümör sferoitleri (MCTS) açıklar. Üç örnek uygulamaları (1), bir sitostatik ilacın alınması ve (kemoterapötik etkinliğe katkısı hala değerlendirilmesi gereken kalır), bir bozunma ürününe onun kısmi dönüşüm, genetik olarak kodlanmış glutation sensörünün kullanımı üzerine ile redoks durumunun (2) ölçümlerdir...
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Bu proje Kara, Baden-Württemberg tarafından yanı sıra Avrupa Birliği, Europäischer Fonds tarafından finanse für Regionale ENTWICKLUNG die edildi. Yazarlar usta teknik yardım için U251-MG-L106-GRX1-roGFP2 hücre hattı ve Claudia HINTZE sağlamak için Rainer Wittig (ILM Ulm) teşekkür ederim.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Microtiter plate | Orange Scientific | 4430100 | For cell spheroid growing |
| Agarose | Carl Roth GmbH | 3810.1 | For cell spheroid growing |
| MCF-7 cell line | CLS Cell Lines Service GmbH | 300273 | Cell line |
| U251-MG-L106 cell line | Cell line | ||
| DMEM | Biochrom AG (Merck Millipore) | FG0435 | Culture medium |
| DMEM/Ham's F-12 | Biochrom AG (Merck Millipore) | FG4815 | Culture medium |
| FCS | Biochrom AG (Merck Millipore) | S0615 | Cell culture supplement |
| Penicillin/streptomycin | Biochrom AG (Merck Millipore) | A 2213 | Antibiotics |
| Hygromycin B | PAA Laboratories | P02-015 | Antibiotic |
| EBSS | Sigma-Aldrich Inc. | E3024 | Cell culture supplement |
| Doxorubicin | Sigma-Aldrich Inc. | D1515 | Fluorescent dye (CAUTION: acute toxicity) |
| Green cytotoxicity dye | Promega GmbH | G8742 | CellTox - fluorescent cytotoxicity dye |
| Rotenone | Sigma-Aldrich Inc. | R8875 | Cellular inhibitor (CAUTION: acute toxicity) |
| Hydrogen peroxide (H2O2) | Sigma-Aldrich Inc. | 95302 | Reagent for oxidation (CAUTION: acute toxicity) |
| Capillary | VitroCom | 8260-050 | Sample preparation |
| Microscope | Carl Zeiss Jena | Axiovert 200M | |
| AxioCam MRc CCD-camera | Carl Zeiss MicroImaging GmbH | 426508-9901-000 | CCD-camera |
| AxioVision data aquisition software | Carl Zeiss MicroImaging GmbH | version 4.8.2. | |
| Laser diode | Pico Quant GmbH | LDH-P-C-470 | Used with driver PDL800-B |
| Peristaltic pump | Ismatec Labortechnik | MS-1 Reglo | Re-calibrated to reduce the minimum pump speed by 1/10 |
| Silicone tubes | IDEX Health & Science GmbH | TYGON R3607 |
Referanslar
- Pawley, J. . Handbook of biological confocal microscopy. , (1990).
- Webb, R. H. Confocal optical microscopy. Rep. Prog. Phys. 59, 427-471 (1996).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- König, K. Multiphoton microscopy in life sciences. J. Microsc. 200 (2), 83-104 (2000).
- Neil, M. A., Juskaitis, R., Wilson, T. Method of obtaining optical sectioning by using structured light in a conventional microscope. Opt. Lett. 22 (24), 1905-1907 (1997).
- Gustafsson, M. G. L., et al. Three-dimensional resolution doubling in wide-field fluorescence microscopy by structured illumination. Biophys. J. 94 (12), 4957-4970 (2008).
- Huisken, J., Swoger, J., del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical sectioning deep inside live embryos by SPIM. Science. 305 (5686), 1007-1009 (2004).
- Huisken, J., Stainier, D. Y. R. Selective plane illumination microscopy techniques in development biology. Development. 136 (12), 1963-1975 (2009).
- Santi, P. A. Light sheet fluorescence microscopy: a review. J. Histochem. Cytochem. 59 (2), 129-138 (2011).
- Kunz-Schughart, L. A., Freyer, J. P., Hofstaedter, F., Ebner, R. The use of 3-D cultures for high throughput screening: the multi-cellular spheroid model. J. Biomol. Screen. 9 (4), 273-285 (2004).
- Schneckenburger, H., et al. Multi-dimensional fluorescence microscopy of living cells. J. Biophotonics. 4 (3), 143-149 (2011).
- Schneckenburger, H., et al. Light exposure and cell viability in fluorescence microscopy. J. Microsc. 245 (3), 311-318 (2012).
- Ritter, J. G., Veith, R., Veenendaal, A., Siebrasse, J. P., Kubitschek, U. Light sheet microscopy for single molecule tracking in living tissue. PLoS One. 5 (7), e11639:1-e11639:7 (2010).
- Mertz, J., Kim, J. Scanning light-sheet microscopy in the whole mouse brain with HiLo background rejection. J. Biomed. Opt. 15 (1), 016027 (2010).
- Fahrbach, F. O., Rohrbach, A. A line-scanned light-sheet microscope with phase shaped self-reconstructing beams. Opt. Express. 18 (23), 24229-24244 (2010).
- Bruns, T., Schickinger, S., Wittig, R., Schneckenburger, H. Preparation strategy and illumination of 3D cell cultures in light-sheet based fluorescence microscopy. J. Biomed. Opt. 17 (10), 101518 (2012).
- Ma, H. L., et al. Multicellular tumor spheroids as an in vivo-like tumor model for three-dimensional imaging of chemotherapeutic and nano material cellular penetration. Mol. Imaging. 11 (6), 487-498 (2012).
- Weber, P., Wagner, M., Schneckenburger, H. Cholesterol dependent uptake and interaction of doxorubicin in MCF-7 breast cancer cells. Int. J. Mol. Sci. 14 (4), 8358-8366 (2013).
- Hovorka, O., et al. Spectral analysis of doxorubicin accumulation and the indirect quantification of its DNA intercalation. Eur. J. Pharm. Biopharm. 76 (3), 514-524 (2010).
- Schickinger, S., Bruns, T., Wittig, R., Weber, P., Wagner, M., Schneckenburger, H. Nanosecond ratio imaging of redox states in tumor cell spheroids using light sheet-based fluorescence microscopy. J. Biomed. Opt. 18 (12), 126007 (2013).
- Lippert, H., Wald, M., Radt, B. Optical arrangement for the production of a light sheet. U.S. Patent. , (2010).
- Lorenzo, C., et al. Live cell division dynamics monitoring in 3D large spheroid tumor models using light sheet microscopy. Cell Division. 6 (22), 1-8 (2011).
- Bruns, T., Schneckenburger, H., Schickinger, S. Sample holder for rotation of three-dimensional specimens in microscopy. European Patent Application. , (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır