Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Einzigen Ebene Beleuchtungsmodul und Micro-Kapillar-Ansatz für ein Weitfeld-Mikroskop
In diesem Artikel
Zusammenfassung
Ein Modul für einzelne Ebene Illumination Microscopy (SPIM) beschrieben, die leicht zu einer umgekehrten Weitfeld-Mikroskop angepasst ist und für 3-dimensionale Zellkulturen optimiert. Die Probe wird in einer rechteckigen Kapillare angeordnet ist, und über ein Mikrofluidiksystem Fluoreszenzfarbstoffe können pharmazeutische Mittel oder Arzneimittel in kleinen Mengen angewendet werden.
Zusammenfassung
Ein Modul für Lichtbogen oder einzelne Ebene Illumination Microscopy (SPIM) beschrieben, die leicht zu einem umgekehrten Weitfeld-Mikroskop angepasst ist und für 3-dimensionale Zellkulturen optimiert, zB mehrzelligen Tumorsphäroide (MCTS). SPIM Anregungsmodul Formen und lenkt das Licht, so dass die Probe durch einen Lichtschnitt senkrecht zur Detektion Gang des Mikroskops beleuchtet. Das System wird durch Verwendung einer rechteckigen Kapillare zur Aufnahme (und in einer erweiterten Version auch durch eine Mikrokapillare Ansatz zum Drehen) der Proben, durch synchrone Verstellung der Beleuchtungslichtbogen und der Objektivlinse für die Fluoreszenzdetektion verwendet wird, sowie dadurch gekennzeichnet, durch Anpassung eines mikrofluidischen Systems zur Anwendung von Fluoreszenzfarbstoffen, pharmazeutische Mittel oder Arzneimittel in kleinen Mengen. Ein Protokoll für die Arbeit mit diesem System gegeben wird, und einige technische Details berichtet. Repräsentative Ergebnisse umfassen (1) Messungen der bisnehmen eines Zytostatikums (Doxorubicin) und dessen teilweise Umwandlung in ein Abbauprodukt, (2) Redox-Messungen unter Verwendung einer genetisch codierten Glutathion Sensor bei Zugabe eines Oxidationsmittels, und (3) die Einleitung und Kennzeichnung Zellnekrose auf Hemmung der mitochondrialen Atmungskette. Unterschiede und Vorteile der vorliegenden SPIM Modul im Vergleich mit bestehenden Systemen diskutiert.
Einleitung
Neben den gut etablierten Methoden (oder konfokalen Multi-Photonen-Laser-Scanning-Mikroskopie 1-4, Structured Illumination Microscopy 5,6) Lichtbogen oder einzelne Ebene Illumination Microscopy (SPIM) hat sich als eine wertvolle Methode der 3D-Bildgebung 7,8 sein, 9. Von besonderem Interesse ist die Anwendung eines 3-dimensionalen Zellkulturen, beispielsweise multizellulären Tumor-Sphäroide (MCT), die zunehmend für die Wirkstoffforschung 10,11 verwendet werden. Darüber hinaus ist eine bevorzugte Methode SPIM, wenn auch bei langfristiger Exposition oder sich wiederholende Messungen schlechten Licht Dosen sind erforderlich, um die Lebensfähigkeit der Probe zu erhalten, da für die Messung von jeder Ebene der Probe nur diese Ebene dem Licht ausgesetzt wird. Dies steht im Gegensatz zu anderen Mikroskopietechniken, wobei zur Detektion der jeweiligen Brennebene die gesamte Probe beleuchtet wird, so daß bei der Aufzeichnung einer Vielzahl von Ebenen, die die Lichtdosis summiert und kann die Probe 12 zu beschädigen.
Lichtschnittmikroskopie oder SPIM auf Beleuchtung der Probe in Richtung senkrecht zur Beobachtungspfad entweder durch die Verwendung einer Zylinderlinse oder durch Abtasten des anregenden Laserstrahls (für eine Übersicht siehe Ref. 8) basiert. Dies erfordert oft spezielle Probenkammern 13,14 oder Matrizen, zB Agarose 7,15, in speziellen High-Cost-Mikroskopen implementiert. Als Alternative zu diesen Systemen eine vergleichsweise einfache Beleuchtungseinrichtung für SPIM wurde entwickelt und mit einem herkömmlichen inversen Mikroskop 16 (siehe Figur 1) angepaßt ist. Es besteht aus einem Laserstrahl auf einen Durchmesser von 8 mm durch eine Zylinderlinse (Fokuslänge: 50 mm, numerische Apertur: 0,08) erweitert und fokussiert, um einen Lichtschnitt von 6-10 um Dicke über eine Schärfentiefe von etwa 100 um . Proben werden in einer rechteckigen Kapillare mit 600-900 um Innendurchmesser vor dem Mikroskopobjektiv angeordnet len befindets für die Fluoreszenzdetektion. Diese Hauptmerkmale werden gegenwärtig abgeschlossen und durch die Verwendung von fortschrittlichen Mikrokapillare Ansätze zum Halten und zum Drehen der Proben, die synchrone Verstellung der Beleuchtungslichtblatt (in axialer Richtung) und der Objektivlinse für die Fluoreszenzdetektion (identischen optischen Pfad eingesetzt optimiert Längen Verschiebung erfordern eine Korrektur der mechanischen Vorschub) und die Anpassung eines mikrofluidischen Systems zur Anwendung von fluoreszierenden Farbstoffen, pharmazeutischen Wirkstoffen oder Arzneimitteln, damit die erforderliche Menge und Kosten zu minimieren.
Protokoll
1. Zell Sphäroid wächst und Inkubation
- Versuch 1: Zell Sphäroiden mit einem Chemotherapeutikum inkubiert
- Bereiten Agarose 1,5% im Kulturmedium durch Zugabe von 0,45 g Agarose auf 30 ml Kulturmedium (ausreichend für 6 Platten).
- Das Gemisch aus Schritt 1.1.1 auf mindestens 80 ° C unter Rühren von Zeit zu Zeit.
- Füllen Sie 50 ul der erhitzten Mischung aus Schritt 1.1.2 in jedes Well einer 96-Well-Platte und lassen Sie es in 1-2 Stunden fest werden. Lagern Sie die Platten geschlossen und abgedeckt im Kühlschrank bei 5 ° C bis zur Verwendung.
- Samen etwa 150 MCF-7-Brustkrebszellen in jeder Vertiefung der hergestellten Platte mit 96 Vertiefungen in Dulbecco-modifiziertem Eagle-Medium (DMEM) mit Ham F-12-Kulturmedium mit 10% fötalem Kälberserum (FCS) und 1% Penicillin / Streptomycin .
- Wachsen Sphäroide für 5-7 Tage bis zu einem Durchmesser von etwa 200-300 um in einem Inkubator bei 5% CO 2 und 3776, c.
- Die Zell Sphäroide mit der Anthracyclin-Antibiotikum Doxorubicin-Hydrochlorid für 6 Stunden Inkubation bei einer Konzentration im Bereich zwischen 2 um und 8 um (in Kulturmedium) in einem Inkubator bei 5% CO 2 und 37 ° C liegt.
- Die Zell Sphäroiden mit Kulturmedium oder Earle-Balanced Salt Solution (EBSS) vor der Mikroskopie zu waschen.
- Versuch 2: Oxidationsprozess in Sphäroiden eine Redox-Sensor zum Ausdruck
- Samen etwa 400 U251-MG-L106 Glioblastomzellen permanent mit der Glutathion-empfindliche grün fluoreszierenden Redoxsensor Grx1-roGFP2 in Agarose-Gel-beschichtete Vertiefungen (in Schritten beschriebenen Verfahren 1.1.1-1.1.3) transfiziert einer 96-Well-Platte in DMEM Kulturmedium mit 10% FCS, 1% Penicillin / Streptomycin und Hygromycin B (150 ug / ml) ergänzt.
- Wachsen Sphäroide für 5-7 Tage bis zu einem Durchmesser von etwa 200-300 um in einem Inkubator bei 5% CO 2 und 37 ° C liegt.
- Fügen Sie 10 & #181; l Wasserstoffperoxid-Lösung (purum pa, ≥ 30%) auf 990 ul bi-destilliertem Wasser zu einer 100 mM Stammlösung zu schaffen, um innerhalb von 12 Stunden verwendet werden.
- Von der Stammlösung aus Schritt 1.2.3 bis 50 um in EBSS direkt vor dem Experiment.
- Während der Messung mit Wasserstoffperoxid 50 um EBSS zur Oxidation des Redox-Sensor die Zellkügelchen über das mikrofluidische System zu inkubieren.
- Versuch 3: Initiation und Kennzeichnung von zellulären Nekrose innerhalb Sphäroiden
- Samen etwa 400 Zellen (zB U251-MG-L106-Grx1-roGFP2 Glioblastomzellen) in Agarose-Gel-beschichtete Vertiefungen (in Schritten beschriebenen Verfahren 1.1.1-1.1.3) einer Platte mit 96 Vertiefungen in DMEM-Kulturmedium, ergänzt mit 10% FCS, 1% Penicillin / Streptomycin und Hygromycin B (150 mg / ml).
- Wachsen Sphäroide für 5-7 Tage bis zu einem Durchmesser von etwa 200-300 um in einem Inkubator bei 5% CO 2 und 37 ° C liegt.
- Inkubieren Sie die ZelleSphäroide mit der mitochondrialen Elektronentransportinhibitor Rotenon für 3 Stunden bei einer Konzentration von 1 uM in einem Kulturmedium, um zelluläre Nekrose induzieren. Die gleichzeitige Inkubation mit einem grünen Farbstoff Zytotoxizität für 3 Stunden bei einer Konzentration von 1 ul in 1 ml Kulturmedium zu nekrotischen Zellen zu markieren.
- Mit Kulturmedium oder EBSS vor Mikroskopie Waschen Sie die Zell Sphäroiden.
2. Lichtblatt Anpassung
Hinweis: Zur Erzielung bester Ergebnisse ist darauf zu achten, dass die Strahltaille des Lichtblattes ist in der Fokusebene der Objektivlinse ist. Die Position der Strahltaille kann nur durch Beobachten der Lichtblatt in vertikaler Position in bezug auf die Kapillare ausgerichtet werden (siehe Schritte 2,5-2,8).
- Verwenden Sie ein inverses Mikroskop und montieren Sie die SPIM Anregung Modul, wie in Lit. beschrieben. 16 an der Grundplatte des Positionierungstisches (siehe Abbildung 1a).
- Rüsten Sie das Mikroskop mit einer 10X / 0,3 oder 20x / 0,5 Mikroskopobjektivlinse und ein geeignetes Tiefpassfilter (beispielsweise λ ≥ 515 nm) in dem Detektionspfad des Mikroskops.
- Halterung eine integrierende Kamera auf den Detektionsanschluss des Mikroskops.
- Eine parallele kollimierten Strahl eines Lasers oder einer Laserdiode mit einer Anregungswellenlänge von vorzugsweise 470 nm und es auf dem SPIM Modul.
- Drehen die Zylinderlinse von 90 Grad, die das Licht Blatt in einer vertikalen Position für eine axiale Einstellung der Strahltaille des Lichtbogenüber.
- Platzieren einer Kapillare eine Flüssigkeit mit einem fluoreszierenden Farbstoff, der in den Probenhalter enthält.
- Befestigen des Probenhalters mit der Kapillare auf den Positionierungstisch des Mikroskops und richten die Position der Kapillare, so dass er zentriert ist und die Strahltaille des Lichtblattes im Fokus ist.
- Einstellen der Strahltaille durch Veränderung der axialen Position der Zylinderlinse sich. Drehen Sie die Linse nach Anzeigenstellung.
3. Zell Sphäroid Anwendung und Mikroskop-Feed Synchronisation
- Küvette Sphäroide einzeln oder in Gruppen in dem rechteckigen Borosilikatglas Kapillaren 16 mit einem Innenquerschnitt von 600 um x 600 um und einer Wanddicke von 120 um. Zwei Verfahren für die Anwendung eines Zell-Sphäroiden haben sich als erfolgreich erwiesen.
- Nehmen Sie die leeren Kapillare senkrecht mit Daumen und Mittelfinger und dichten die obere Öffnung mit dem Zeigefinger. Bringen Sie die untere Öffnung in der Nähe der Zell-Sphäroiden in seiner Umgebung Flüssigkeit (EBSS oder Kulturmedium). Lassen Sie den Zeigefinger von der oberen Öffnung. Flüssigkeit mit der Zell-Sphäroiden in sie sofort durch Kapillarkräfte eingeweicht werden. Einstellen der Position des Sphäroids innerhalb der gefüllten Kapillare durch Schwerkraft in den jeweiligen aufrechten Position der Kapillare.
- Alternativ gelten die Zelle Sphäroid auf die Kapillare über Pipettieren. Achten Sie darauf, that die Öffnung der Pipettenspitze ist, die einerseits groß genug für das Sphäroid Größe und andererseits kleiner oder gleich groß wie der Innendurchmesser der Kapillare.
- Platzieren der Kapillare mit dem Sphäroid in ihm in einem speziellen Probenhalter für die Mikroskopie.
- Befestigen des Probenhalters mit der Kapillare auf den Positionierungstisch des Mikroskops und richten die Position der Zell-Sphäroiden, daß sie zentriert und ausgerichtet.
- Stellen Sie die Anpassung zwischen dem Lichtbogen und der Brennebene des Mikroskopobjektivlinse in dem Detektionspfad durch Einstellen der Position des Reflexionsspiegels und der zylindrischen Linse (siehe Einstellschraube in 1B).
- Einstellen der Mikrometerschraube (siehe Figur 1B) entsprechend den Brechungsindices und der numerischen Apertur der Objektivlinse, um das Aquarium Effekt zu kompensieren.
Anmerkung: verschiedene Brechungsindizes der Probe, und die sie umgebenden Medien ter die Objektivlinse zu einer Differenz zwischen der Verschiebung der Objektivlinse und der Verschiebung der Brennebene. Da der Lichtbogen wird durch die Objektivrevolver bewegt wird, wird die Fehlanpassung zwischen der Verschiebung des Lichtbogen (entsprechend der Verschiebung der Objektivlinse) und die Verschiebung der Fokusebene durch einen Hebelarm kompensiert (siehe Abbildung 1b). Die Mikrometerschraube wird verwendet, um den Abstand zwischen den oberen und den unteren Stift anzupassen, um die Verschiebung des Lichtbogens gemäß der numerischen Apertur der Objektivlinse und der Brechungsindizes ändern.
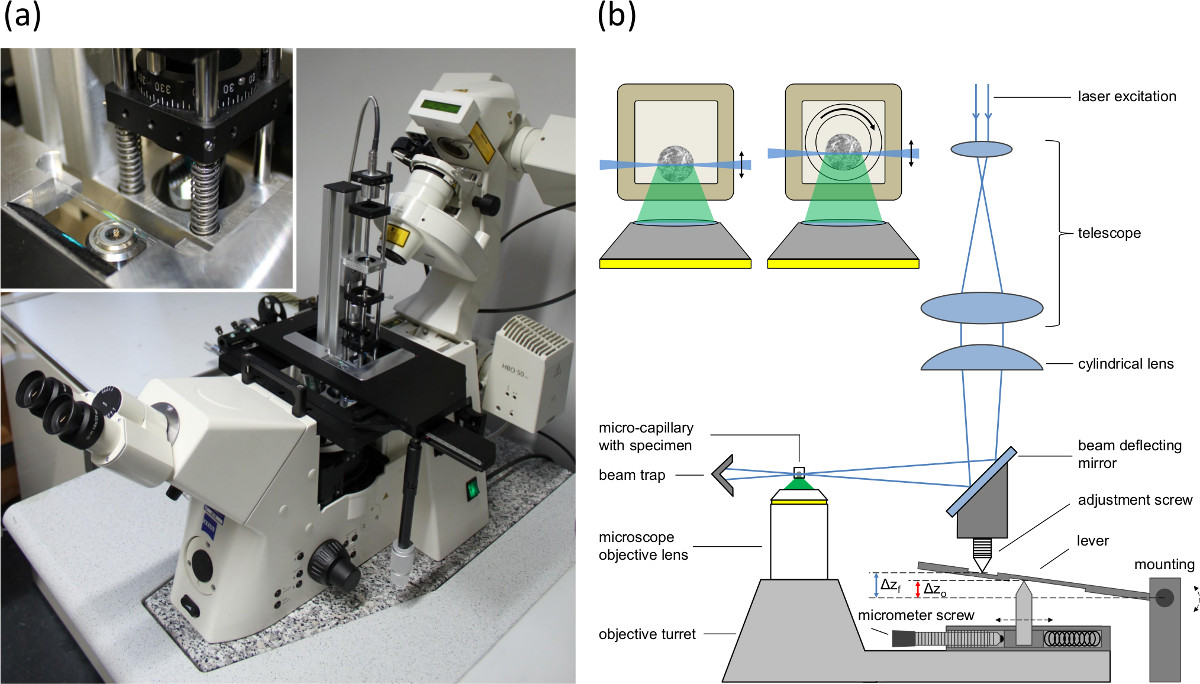
Abbildung 1. (A) Bild von der an der Grundplatte des Stelltisch von einem inversen Mikroskop montiert einzigen Ebene Beleuchtungsmodul, (B) Aufbau der einzelnen Ebene BeleuchtungModul und das Mikroskop Feed Synchronisation auf die Hebe-Mismatch (Aquarium-Effekt) zwischen Brennebene und Beleuchtungsebene auszugleichen. Az o zeigt die Verschiebung der Objektivlinse und Az f die Verschiebung der Brennebene und der Lichtbogen. Die Einlage zeigt Querschnitte von Sphäroiden enthält Kapillaren. Links: rechteckige Kapillare mit Innendurchmesser von 600 um (Wand 120 um). Rechts: Setup für die Rotation eingesetzt. Einen inneren runden Kapillare (Innendurchmesser 400 um, Außendurchmesser 550 um) in dem äußeren rechteckigen Kapillare gedreht. Der Raum zwischen den beiden Kapillaren mit einer Immersionsflüssigkeit gefüllt ist.
4. Messung in dynamischen flüssigen Umgebung
HINWEIS: Die bisherige Protokoll wird für die statische Inkubation vor einer Messung, bei der die Zelle Sphäroid zuvor in der Kapillare durch einfache Gravitation inkubiert und dann an Ort und Stelle gehalten wurde verwendet. Es besteht keine Notwendigkeit für eine weitere Befestigungsauf. Für Messungen in strömenden Medien, in denen eine dynamische Inkubation und daher ist eine dynamische Umgebung wünschenswert Aufnahmekinetik messen, kann diese Unterprotokoll auszuführen. Schritte 4,5-4,9 sind entscheidend, um Luftblasen Erreichen der Probe zu vermeiden.
- Füllen der Kapillare mit FCS für 30 min später zelluläre Adhäsion einer Zelle Sphäroid mit dem inneren Glasoberfläche zu unterstützen.
- Lassen die restlichen FCS Beschichtung im abgereicherten Kapillare austrocknen mindestens 12 Stunden.
- Einführung der Zell-Sphäroiden in die FCS beschichtet Kapillare, wie in Schritt 3.2 beschrieben.
- Verlassen die Kapillare im Inkubator bei 5% CO 2 und 37 ° C für weitere 2-4 h auf zelluläre Adhäsion des Sphäroids verursachen.
- Den Zustrom Teil des mikrofluidischen Systems (siehe Abbildung 2). Verwenden eine peristaltische Pumpe, um die Zuströmung des Schlauchs zu füllen (Innendurchmesser: 0,89 mm) mit Kulturmedium, das den Fluoreszenzfarbstoff, Arzneimittel oder Mittel.
- Connect der Zustrom Teil des mikrofluidischen Systems zu einer Blasenfalle (siehe Abbildung 2).
- Erste Klemme der Kapillare blasenfrei an den Zulauf Rohr und klemmen dann die andere Seite der Kapillare an der Ablaufschlauch.
- Abstimmung der Temperatur der Flüssigkeit von dem Wasserbad zu dem gewünschten Wert (zB 37 ° C).
- Einstellen der Schlauchpumpe auf die gewünschte Pumpengeschwindigkeit (zB Flußrate: 9 ml / min, Pumpengeschwindigkeit in der Kapillare: 25 mm / min).
- Sammeln Sie die gepumpte Flüssigkeit entweder in einem Empfänger (Open-Loop-Setup), führen Sie es zurück zu seiner Quelle (Closed-Loop-Setup) oder führen Sie es direkt in den Schlauch der Schlauchpumpe (tight Closed-Loop-Setup).
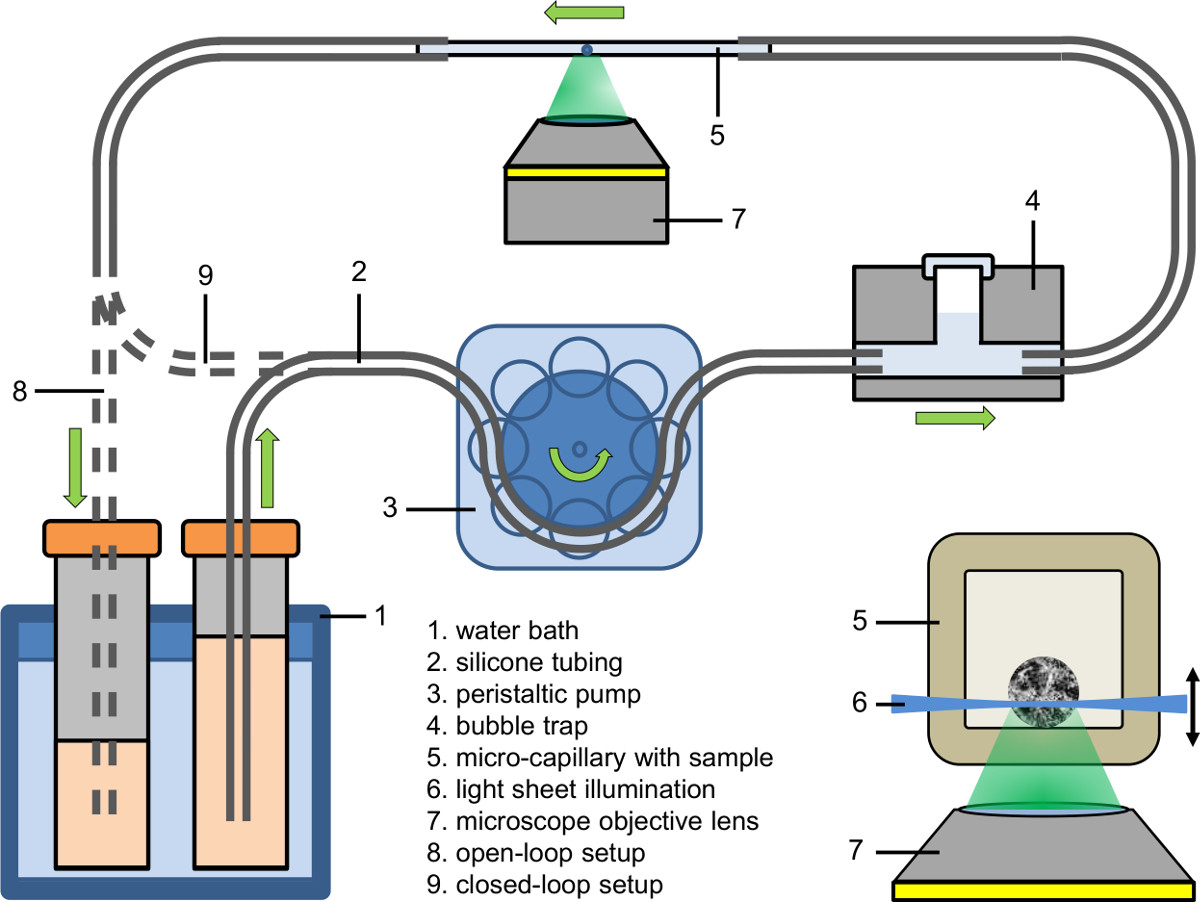
Abbildung 2. Mikrofluidik-Setup (Open-Loop-und Closed-Loop fest); Inlay: Beleuchtung eines spheroid innerhalb einer Mikro-Kapillare mittels Lichtbogen auf der Basis der Fluoreszenzmikroskopie zu einem inversen Mikroskop gekoppelt.
5. Datenerfassung und Auswertung
- Eingestellt, die Laserleistung und die Integrationszeit für die Bildaufnahme.
- Achten Sie darauf, dass die in Schritt 5.1 festgelegten Parameter nicht Licht Dosiswerte etwa 50-100 J / cm 2 für native Zellen oder 10-20 J / cm 2 für Zellen mit einem Fluoreszenzfarbstoff inkubiert oder mit einem fluoreszierenden Protein kodierenden Plasmid transfiziert nicht überschreiten Phototoxizität zu vermeiden (Details siehe Ref. 12).
- Stellen Sie die Schrittweite für die Z-Stapel, um Az = 5-10 um was bevorzugt für 3-dimensionale Datenanalyse ist als das Licht Blechdicke etwa 10 um.
- Führen Messungen von Einzelbildern oder Z-Stapel durch Variation der Brennebene innerhalb des Zell-Sphäroiden.
Ergebnisse
Versuch 1: Zell Sphäroiden mit einem Chemotherapeutikum inkubiert
Ein Z-Stapel-Scan eines zuvor inkubiert MCF-7-Zell-Sphäroiden (8 uM Doxorubicin, 6 h) wird in Abbildung 3 dargestellt. Es gibt ausführliche Informationen über die zelluläre Aufnahme und Verteilung von Doxorubicin 17 und seinem Abbauprodukt 18,19. In der äußeren Zellschicht der Sphäroid roten Fluoreszenz Doxorubicin wird hauptsächlich im Zellkern lokalisiert, wäh...
Diskussion
Die vorliegende Manuskript beschreibt ein Lichtbogen oder einzelne Ebene Illumination Microscopy (SPIM) Gerät, das für 3-dimensionale Zellsysteme optimiert ist, zB, mehrzelligen Tumorsphäroide (MCTS). Drei beispielhafte Anwendungen umfassen (1) die Aufnahme eines Zytostatikums und dessen teilweise Umwandlung in ein Abbauprodukt (deren Beitrag zur chemotherapeutischen Wirksamkeit bleibt ausgewertet werden), (2) Messung des Redox-Zustand durch Verwendung einer genetisch codierten Glutathion Sensor auf Zugabe e...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Dieses Projekt wurde vom Land Baden-Württemberg sowie von der Europäischen Union, Europäischer Fonds finanziert für sterben Regionale entwicklung. Die Autoren danken Rainer Wittig (ILM Ulm) für die Bereitstellung der U251-MG-L106-Grx1-roGFP2 Zelllinie und Claudia Hintze für geschickte technische Hilfe.
Materialien
| Name | Company | Catalog Number | Comments |
| Microtiter plate | Orange Scientific | 4430100 | For cell spheroid growing |
| Agarose | Carl Roth GmbH | 3810.1 | For cell spheroid growing |
| MCF-7 cell line | CLS Cell Lines Service GmbH | 300273 | Cell line |
| U251-MG-L106 cell line | Cell line | ||
| DMEM | Biochrom AG (Merck Millipore) | FG0435 | Culture medium |
| DMEM/Ham's F-12 | Biochrom AG (Merck Millipore) | FG4815 | Culture medium |
| FCS | Biochrom AG (Merck Millipore) | S0615 | Cell culture supplement |
| Penicillin/streptomycin | Biochrom AG (Merck Millipore) | A 2213 | Antibiotics |
| Hygromycin B | PAA Laboratories | P02-015 | Antibiotic |
| EBSS | Sigma-Aldrich Inc. | E3024 | Cell culture supplement |
| Doxorubicin | Sigma-Aldrich Inc. | D1515 | Fluorescent dye (CAUTION: acute toxicity) |
| Green cytotoxicity dye | Promega GmbH | G8742 | CellTox - fluorescent cytotoxicity dye |
| Rotenone | Sigma-Aldrich Inc. | R8875 | Cellular inhibitor (CAUTION: acute toxicity) |
| Hydrogen peroxide (H2O2) | Sigma-Aldrich Inc. | 95302 | Reagent for oxidation (CAUTION: acute toxicity) |
| Capillary | VitroCom | 8260-050 | Sample preparation |
| Microscope | Carl Zeiss Jena | Axiovert 200M | |
| AxioCam MRc CCD-camera | Carl Zeiss MicroImaging GmbH | 426508-9901-000 | CCD-camera |
| AxioVision data aquisition software | Carl Zeiss MicroImaging GmbH | version 4.8.2. | |
| Laser diode | Pico Quant GmbH | LDH-P-C-470 | Used with driver PDL800-B |
| Peristaltic pump | Ismatec Labortechnik | MS-1 Reglo | Re-calibrated to reduce the minimum pump speed by 1/10 |
| Silicone tubes | IDEX Health & Science GmbH | TYGON R3607 |
Referenzen
- Pawley, J. . Handbook of biological confocal microscopy. , (1990).
- Webb, R. H. Confocal optical microscopy. Rep. Prog. Phys. 59, 427-471 (1996).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- König, K. Multiphoton microscopy in life sciences. J. Microsc. 200 (2), 83-104 (2000).
- Neil, M. A., Juskaitis, R., Wilson, T. Method of obtaining optical sectioning by using structured light in a conventional microscope. Opt. Lett. 22 (24), 1905-1907 (1997).
- Gustafsson, M. G. L., et al. Three-dimensional resolution doubling in wide-field fluorescence microscopy by structured illumination. Biophys. J. 94 (12), 4957-4970 (2008).
- Huisken, J., Swoger, J., del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical sectioning deep inside live embryos by SPIM. Science. 305 (5686), 1007-1009 (2004).
- Huisken, J., Stainier, D. Y. R. Selective plane illumination microscopy techniques in development biology. Development. 136 (12), 1963-1975 (2009).
- Santi, P. A. Light sheet fluorescence microscopy: a review. J. Histochem. Cytochem. 59 (2), 129-138 (2011).
- Kunz-Schughart, L. A., Freyer, J. P., Hofstaedter, F., Ebner, R. The use of 3-D cultures for high throughput screening: the multi-cellular spheroid model. J. Biomol. Screen. 9 (4), 273-285 (2004).
- Schneckenburger, H., et al. Multi-dimensional fluorescence microscopy of living cells. J. Biophotonics. 4 (3), 143-149 (2011).
- Schneckenburger, H., et al. Light exposure and cell viability in fluorescence microscopy. J. Microsc. 245 (3), 311-318 (2012).
- Ritter, J. G., Veith, R., Veenendaal, A., Siebrasse, J. P., Kubitschek, U. Light sheet microscopy for single molecule tracking in living tissue. PLoS One. 5 (7), e11639:1-e11639:7 (2010).
- Mertz, J., Kim, J. Scanning light-sheet microscopy in the whole mouse brain with HiLo background rejection. J. Biomed. Opt. 15 (1), 016027 (2010).
- Fahrbach, F. O., Rohrbach, A. A line-scanned light-sheet microscope with phase shaped self-reconstructing beams. Opt. Express. 18 (23), 24229-24244 (2010).
- Bruns, T., Schickinger, S., Wittig, R., Schneckenburger, H. Preparation strategy and illumination of 3D cell cultures in light-sheet based fluorescence microscopy. J. Biomed. Opt. 17 (10), 101518 (2012).
- Ma, H. L., et al. Multicellular tumor spheroids as an in vivo-like tumor model for three-dimensional imaging of chemotherapeutic and nano material cellular penetration. Mol. Imaging. 11 (6), 487-498 (2012).
- Weber, P., Wagner, M., Schneckenburger, H. Cholesterol dependent uptake and interaction of doxorubicin in MCF-7 breast cancer cells. Int. J. Mol. Sci. 14 (4), 8358-8366 (2013).
- Hovorka, O., et al. Spectral analysis of doxorubicin accumulation and the indirect quantification of its DNA intercalation. Eur. J. Pharm. Biopharm. 76 (3), 514-524 (2010).
- Schickinger, S., Bruns, T., Wittig, R., Weber, P., Wagner, M., Schneckenburger, H. Nanosecond ratio imaging of redox states in tumor cell spheroids using light sheet-based fluorescence microscopy. J. Biomed. Opt. 18 (12), 126007 (2013).
- Lippert, H., Wald, M., Radt, B. Optical arrangement for the production of a light sheet. U.S. Patent. , (2010).
- Lorenzo, C., et al. Live cell division dynamics monitoring in 3D large spheroid tumor models using light sheet microscopy. Cell Division. 6 (22), 1-8 (2011).
- Bruns, T., Schneckenburger, H., Schickinger, S. Sample holder for rotation of three-dimensional specimens in microscopy. European Patent Application. , (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten