A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
إنتاج واستخدام الفيروسة البطيئة إلى خلايا انتقائي تنبيغ الابتدائية دبقية قليلة التغصن السلائف ل
In This Article
Summary
Here we present protocols that offer a flexible and strategic foundation for virally manipulating oligodendrocyte precursor cells to overexpress proteins of interest in order to specifically interrogate their role in oligodendrocytes via the in vitro model of central nervous system myelination.
Abstract
تكون الميالين هو عملية معقدة تشمل كل من الخلايا العصبية والمايلين تشكيل الخلايا الدبقية، قليلة التغصن في الجهاز العصبي المركزي (CNS) وخلايا شوان في الجهاز العصبي المحيطي (السندات الإذنية). نستخدم في المختبر تكون الميالين الفحص، وهو نموذج أنشئت لدراسة الجهاز العصبي المركزي تكون الميالين في المختبر. للقيام بذلك، يتم إضافة خلايا دبقية قليلة التغصن السلائف (يجد OPCs) إلى تنقية القوارض الظهرية العقدة الجذر الابتدائية (DRG) الخلايا العصبية لتشكيل myelinating المشترك الثقافات. من أجل استجواب تحديدا الأدوار التي البروتينات المحددة التي أعربت عنها قليلة التغصن تمارس عليه تكون الميالين ضعنا البروتوكولات التي تنبيغ انتقائي يجد OPCs باستخدام الفيروسة البطيئة overexpressing النوع البري والبروتينات السلبية النشطة جوهري أو المهيمنة قبل أن تبذر على الخلايا العصبية DRG. وهذا يسمح لنا لاستجواب تحديدا أدوار هذه البروتينات oligodendroglial في تنظيم تكون الميالين. ويمكن أيضا البروتوكولات تطبيقها في دراسة بعد التمديدأنواع الخلايا لها، وبالتالي توفير نهج الذي يسمح التلاعب الانتقائي للبروتينات التي أعربت عنها نوع من الخلايا المطلوبة، مثل قليلة التغصن لدراسة المستهدفة من الإشارات وآليات التعويض. في الختام، والجمع بين الفحص في المختبر تكون الميالين مع lentiviral المصابين يجد OPCs يوفر أداة استراتيجية لتحليل الآليات الجزيئية المشاركة في تكون الميالين.
Introduction
تكون الميالين من المحاور أمر بالغ الأهمية لنقل سريعة وفعالة من إمكانات العمل في كل من الجهاز العصبي المركزي والمحيطي. الخلايا المتخصصة، خلايا شوان في الجهاز العصبي المحيطي و oligodendrocytes في الجهاز العصبي المركزي، والتفاف حولها ويغمد محاور في المايلين، وعزل فعال العصب وتسهيل التوصيل قفزي 1. ويمكن دراسة عملية تكون الميالين في المختبر باستخدام الخلايا العصبية الشبكية العقدة 2، ألياف النانو المهندسة 3، أو الخلايا العصبية العقدة الجذرية الظهرية شارك في تربيتها مع أي خلايا شوان 4 أو قليلة التغصن 5-7. في المختبر تكون الميالين الفحص هو نموذج أنشئت لدراسة العصبي تكون الميالين نظام ويعيد العديد من العمليات الأساسية التي تحدث أثناء تكون الميالين في الجسم الحي 5-8. الفحص ينطوي على coculture السكان النقي في ظهري الجذر العقدة (DRG) الخلايا العصبية، مع يجد OPCs (لCNS تكون الميالين) أو خلايا شوان (لPNS تكون الميالين). في ظل ظروف معينة هذه الخلايا myelinating يغمد محاور DRG في أمر، فائقة التحقق هيكليا، ورقة متعددة رقائقي العازلة غشاء البلازما التي تعبر عن نفس مكمل للبروتينات محددة المايلين موجودة في الجسم الحي.
نموذج خلية الأكثر استخداما لدراسة الجهاز العصبي المركزي تكون الميالين في المختبر هو المشارك الثقافات من الخلايا العصبية DRG ونسمة، والتي تم استخدامها بنجاح لدراسة تأثير تلك العوامل الخارجية مثل neurotrophins تمارس على الجهاز العصبي المركزي تكون الميالين في المختبر 5،6. العوامل الخارجية مثل عوامل النمو أو مثبطات الدوائية جزيء صغير وقد استخدمت على نطاق واسع لدراسة دور مسارات إشارات في تكون الميالين باستخدام DRG-OPC نموذج coculture 7،9. ومع ذلك، في إعدادات شارك في الثقافة المختلطة التي تحتوي على الخلايا العصبية و oligodendrocytes، فإنه لا يزال من الممكن رسميا إما أن عوامل النمو أو PHARمثبطات macological من الممكن أن يمارس تأثيرات على كل من الخلايا العصبية DRG و oligodendrocytes (OL). هذا لا توفر القدرة على تشريح تحديدا الأدوار التي البروتينات أعربت فقط من قبل DRGs أو دبق قليل التغصن يمارس عليها تكون الميالين باستخدام هذا النظام خلية المزدوج. لتأكيد بشكل قاطع أن مسار الإشارات في oligodendroglial ينظم تكون الميالين، تنبيغ lentiviral من نسمة، وقبل البذر على الخلايا العصبية DRG لفي المختبر تكون الميالين الفحص أثبت، ليكون وسيلة أنيقة لبإفراط على حد سواء البرية من نوع والبروتينات متحولة، فضلا مباشرة كما التعبير ضربة قاضية للبروتينات وأعرب جوهري كتبها قليلة التغصن. وهكذا فإن هذا النهج يوفر وسيلة لاستجواب تحديدا والتلاعب مسارات إشارات ضمن قليلة التغصن لدراسة تكون الميالين 9،10.
في هذه الورقة، ونحن التقرير الأساليب التي قمنا بتطويرها لبإفراط عن بروتين من الفائدة بشكل انتقائي في قليلة التغصن عبر lentiviralنهج لدراسة تكون الميالين في المختبر. تقنية تبدأ مع جيل من ناقلات التعبير التي تحتوي على الجينات في المصالح، سواء كان ذلك في نوع البرية، شكل سلبي نشط جوهري أو المهيمنة التي يتم بعد ذلك المستنسخة في وقت لاحق في pENTR ناقلات (pENTR L1-L2 pENTR4IRES2GFP). هذا ناقلات (التي تحتوي على الجينات في المصالح)، يتم الجمع بين المانحين CMV PROMOTOR (pENTR L4-R1 pENTR-pDNOR-CMV) وlentivector 2K7 في رد فعل الانزيم لإنتاج ناقلات 2K7 تحتوي على CMV المروج، الجينات في المصالح، وهو الداخلية الموقع الريباسي الدخول وGFP (الشكل 1). هذه العبارة المستنسخة بناء 2K7 جنبا إلى جنب مع المغلف فيروس PMD2.G وحزمة فيروس pBR8.91 يمكن أن يشترك transfected-إلى خلايا HEK293T لتوليد الفيروسة البطيئة التي يمكن بعد ذلك أن تستخدم لتنبيغ يجد OPCs. مرة واحدة مصابة الفيروسة البطيئة ويجد OPCs تعبر عن مستوى عال من البروتين من الفائدة. ويمكن بعد ذلك المصنف هذه يجد OPCs على الثقافات DRG الخلايا العصبية وتأثير هذا التعبيرمستويات عالية من البروتين المطلوب تمارس على تكون الميالين يمكن استجوابه. ويتم تقييم والثقافات المشتركة للبروتين النخاعين التعبير من خلال تحليل لطخة الغربي وتصور لتشكيل قطاعات محور عصبي مياليني التي كتبها مناعية.
Protocol
وكانت جميع الحيوانات المستخدمة في هذه الدراسة من الجنس المختلط ولدت في مرافق الحيوانية من قسم التشريح وعلم الأمراض ومعهد فلوري العلوم العصبية والعقلية بحوث الصحية في جامعة ملبورن: ملاحظة. تمت الموافقة على جميع الإجراءات الحيوانية الحيوان جان أخلاقيات التجريب في جامعة ملبورن.
1. الاستنساخ من 2K7 Lentivector
- قبل استنساخ الجينات في المصالح في ناقلات 2K7 lentiviral، subclone الجينات في ناقلات pENTR (3637 سنة مضت، ومقاومة الكاناميسين) باستخدام التقنيات الجزيئية القياسية 11. استخدام مواقع تقييد EcoRI وSacII لاستنساخ فرعي.
- التضخيم من 2K7 Lentivector
- تحويل DNA lentivector 2K7 عن طريق خلط بلطف 100 نانوغرام من DNA البلازميد مع الخلايا المختصة واحتضان على الجليد لمدة 30 دقيقة.
- DNA الصدمة الحرارية / الخلايا المختصة مزيج في 42 درجة مئوية لمدة 90 ثانية وصفيحة منهم على لوحات LB آجار تحتوي على كل ampicillin (100 ميكروغرام / مل)، والكلورامفينيكول (15 ميكروغرام / مل) عند 37 درجة مئوية لمدة 16-18 ساعة.
يستخدم الكلورامفينيكول لمنع إعادة التركيب بين يكرر محطة الطويلة: ملاحظة. - في اليوم التالي، وتنمو اختيار استنساخ البكتيرية في وسائل الإعلام LB تحتوي على كل الأمبيسلين (100 ميكروغرام / مل)، والكلورامفينيكول (15 ميكروغرام / مل) عند 37 درجة مئوية لمدة 16-18 ساعة. استخراج الحمض النووي باستخدام البلازميد التجاري DNA Maxiprep عدة وفقا لتعليمات الشركة الصانعة.
- الاستنساخ الفرعي من pENTR متجه إلى 2K7 Lentivector (الشكل 1)
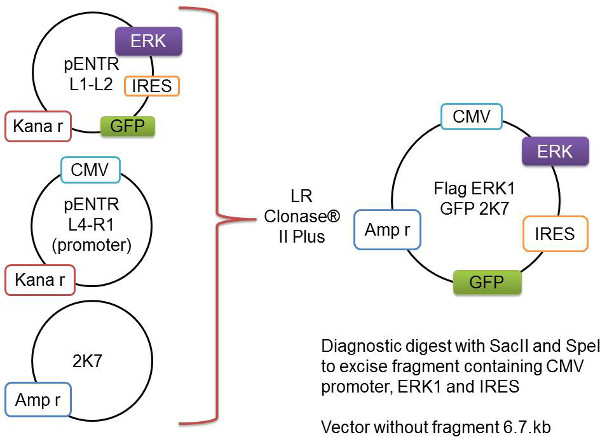
الشكل 1: تمثيل تخطيطي لعملية إعادة التركيب بوابة الجين من الفائدة، وهنا ممثلة على النحو العلم-Erk1، يتم استنساخ في ناقلات pENTR L1-L2. يضاف هذا إلى ناقلات pENTR L4-R1 تحتوي على مروج CMV وناقلات العمود الفقري 2K7. ومعاد هذه النواقل ثلاثة بواسطة انزيم LR Clonase II Plus لإدراج الجينات من الفائدة والمروج في الفيروسات استعداد 2K7 النواقل.- إضافة ما يلي إلى أنبوب 1.5 مل وتخلط بلطف:
L4-R1 pENTR-pDNOR-CMV (المروج) (60 BNG) 1-2.5 ميكرولتر
L1-L2 pENTR4IRES2GFP (مع الجينات في المصالح) (80 BNG) 1-2.5 ميكرولتر
K7 lentivector (80 نانوغرام / ميكرولتر) 1 ميكرولتر
TE العازلة، ودرجة الحموضة 82-5 ميكرولتر
مجموع 8 ميكرولتر - إزالة مزيج انزيم clonase من -80 ° C وذوبان الجليد على الجليد لمدة 2 دقيقة. تأكد من أن هذا الإنزيم هو قسامة جديدة من -80 ° C كما الانزيم خفضت إلى حد كبير استنساخ كفاءة مع تكرار تجميد أذاب دورات
- إضافة 2 ميكرولتر من انزيم في رد الفعل وتخلط جيدا عبر دوامة، واحتضان خليط التفاعل clonase في 23-25 درجة مئوية لمدة 6-24 ساعة.
- إضافة 1 ميكرولتر من بروتين K الحل (مرفق مع عدة انزيم) إلى خليط التفاعل clonase واحتضان لمدة 10 دقيقة عند 37 ° C.
- تحويل clonase خليط التفاعل في الخلايا المختصة وتنمية حددالمستعمرات في وسائل الإعلام LB تحتوي على الأمبيسلين (100 ميكروغرام / مل) عند 37 درجة مئوية لمدة 16-18 ساعة.
- استخراج وتنقية الحمض النووي باستخدام البلازميد التجاري DNA Miniprep عدة وفقا لتعليمات الشركة الصانعة.
- تأكيد DNA عن طريق الهضم باستخدام تقييد الانزيمات جمعية مهندسي البترول الأول والثاني ساك وجود مخزن مؤقت المناسب وفقا لتعليمات الشركة الصانعة لإزالة شظية تحتوي على المروج والجينات في المصالح.
ملاحظة: هذه الخطوة حاسمة لمعرفة ما اذا كان لديه DNA subcloned الجين إدراج الصحيح للاهتمام مع الحق في ناقلات العمود الفقري. حجم ناقلات نفسها دون إدراج جزء هو 6.7 كيلو بايت. حجم جزء إدراج صدر يشمل كلا من المروج والجين إدراج من الفائدة. حساب الأحجام شظية المتوقعة من هضم لجين معين عن طريق برنامج تحرير تسلسل الحمض النووي، وعلى سبيل المثال، القرد - محرر البلازميد. - التحقق من الأحجام من كل من الحمض النووي ناقلات العمود الفقري وجزء صدر عن طريق تشغيل agarose هلام 1٪في المخزن 1X TAE (انظر الجدول الحلول الأسهم) في 100 V.
- تضخيم الحمض النووي أكدت من خلال زراعة البكتيريا في 500 مل من وسائل الاعلام LB تحتوي على الأمبيسلين (100 ميكروغرام / مل) عند 37 درجة مئوية لمدة 16-18 ساعة.
- استخراج وتنقية الحمض النووي باستخدام البلازميد التجاري DNA Maxiprep عدة وفقا لتعليمات الشركة الصانعة.
ملاحظة: Maxiprep عادة يولد كمية كافية من الحمض النووي المطلوبة لإنتاج الفيروسي.
- إضافة ما يلي إلى أنبوب 1.5 مل وتخلط بلطف:
- كرر الخطوات من 1.3.9-1.3.10 لتضخيم السلطات الوطنية المعينة التالية للتحضير lentiviral: ناقلات مغلف (PMD2.G، 6.1 كيلوبايت)، ناقلات حزمة (pBR8.91، 12.5 كيلو بايت)، وناقلات lentiviral فارغة كعنصر تحكم (GFP -CMV-2K7، 8.7 كيلوبايت).
2. 2K7 إنتاج الفيروسات
ملاحظة: يوم 1:
- في يوم ترنسفكأيشن، لوحة 32 مليون خلايا T في HEK293 T175 قارورة تحتوي على 25 مل HEK293 T وسائل الإعلام خلية (انظر الجدول الحلول الأسهم). بدلا من ذلك، لوحة 16 مليون خلايا اليومقبل ترنسفكأيشن إذا ينتهي الوقت ضيق يوم ترنسفكأيشن.
ملاحظة: ترنسفكأيشن يمكن أن تكون ناجحة على قدم المساواة من قبل خلايا الطلاء في يوم ترنسفكأيشن أو قبل اليوم. باستخدام أي من البديلين، النقطة الحرجة هنا هي لجعل يكون عالقا خلايا المؤكد الخناق على الثقافة سطح الطبق قبل ترنسفكأيشن.
ملاحظة: يوم 2: - ترنسفكأيشن
- قبل ترنسفكأيشن، وتمييع DNA إلى 1 ميكروغرام / ميكرولتر في TE العازلة التي تحتوي على 10 ملي تريس درجة الحموضة 8، 1 ملم EDTA الرقم الهيدروجيني 8 في الماء منزوع الأيونات.
- في أنبوب 50 مل، وإعداد مزيج الرئيسي (الجدول 1) لترنسفكأيشن في قارورة T175. إضافة DNA إلى قبل تحسنت Dulbecco لتعديل النسر المتوسطة (DMEM) ومزيج جيد من قبل دوامة، ثم يضاف polyethylenimine معقم (PEI) (انظر الجدول الحلول الأسهم) لتجنب الأمطار سابقا لأوانه. ">
الجدول 1: إعداد مزيج ترنسفكأيشن لل2K7 الفيروسات.ناقلات ترونج> تركيز حجم pMDG.2 1 ميكروغرام / ميكرولتر 5 ميكرولتر pBR8.91 1 ميكروغرام / ميكرولتر 15 ميكرولتر ناقلات 2K7 مع GFP + الجينات في المصالح 1 ميكروغرام / ميكرولتر 22 ميكرولتر Polyethylenimine معقم (PEI) 1 غرام / L 500 ميكرولتر DMEM 2،100 ميكرولتر - مزيج جيد من قبل للقلب 3-4x أنبوب واحتضان لمدة 15 دقيقة في درجة حرارة الغرفة (RT).
- إجراء تغيير وسائل الإعلام الكامل على الخلايا HEK293T. نضح قبالة سائل الإعلام والثقافة من الخلايا تماما وتغذية مع ما قبل تحسنت وسائل الإعلام ثقافة الخلية HEK293T (25 مل لكل T175 قارورة).
- يضاف خليط ترنسفكأيشن (DNA / PEI خليط) قطرة من الحكمة أن الخلايا أحادي الطبقة. تحرك بلطف إلى مزيج جيد واحتضان الخلايا المصابة بالعدوى بالنقل عند 37 درجة مئوية، و 5٪ CO 2، بين عشية وضحاها.
ملاحظة: يوم 3: - لضمان ترنسفكأيشن ناجحا، تحقق GFP التعبير 24 ساعة بعد ترنسفكأيشن عن طريق الفحص المجهري الفلورسنت.
ملاحظة: أكثر من 50٪ من الخلايا معربا عن GFP يشير عادة ترنسفكأيشن جيد.
ملاحظة: يوم 4:
- في 48 ساعة بعد ترنسفكأيشن، وجمع طاف الفيروسية واستبدالها مع وسائل الإعلام HEK293 T الطازجة (25 مل لكل T175 قارورة).
- أجهزة الطرد المركزي طاف الفيروسي في 1،140 x ج لمدة 10 دقيقة في 4 درجات مئوية لازالة الانقاض والحطام خلية من طاف. نقل مسح طاف لأنبوب 50 مل وتخزينها في 4 ° C.
ملاحظة: يوم 5:
- أجهزة الطرد المركزي طاف الفيروسي في 1،140 x ج لمدة 10 دقيقة في 4 درجات مئوية لازالة الانقاض والحطام خلية من طاف. نقل مسح طاف لأنبوب 50 مل وتخزينها في 4 ° C.
- في 72 ساعة بعد ترنسفكأيشن، وجمع الدفعة الثانية من طاف الفيروسي. كرر الخطوة 2.3.1 وتجمع 48 و 72 ساعة برأت supernatants.
- لتركيز الفيروس، طاف الفيروسي الطرد المركزي في 170،000 x ج لمدة 90 دقيقة على 4 درجات مئوية باستخدام 30 مل أنابيب نابذة فائقة السرعة.
- تجاهل طاف وكرر الخطوة 2.6 حتى يتم طرد كل طاف مسح ترك (غير مرئية) بيليه من الفيروسات بالإضافة إلى عجلت PEI في قاعدة الأنبوب.
- ل resuspend الفيروس، إضافة 500 ميكرولتر ساتو وسائل الإعلام (انظر الجدول الحلول الأسهم) إلى أنابيب نابذة فائقة السرعة. دوامة لمدة 30 ثانية لالثانية كشط القاعدة من الأنبوب مع طرف ماصة لتخفيف ميكانيكيا الفيروس. كرر هذه الخطوة 6X من أجل تفقد بيليه الفيروسي.
- تجميع الفيروس معلق في أنابيب microcentrifuge وتدور لفترة وجيزة جدا لإزالة غير قابلة للذوبان PEI. تصفية طاف من خلال مرشح 0.45 ميكرون لإزالة البروتينات.
- قسامة الفيروس إلى 20 ميكرولتر، 50 ميكرولتر، و 100 مكل وتخزينها في -80 ° C.
3. الفيروسية تحديد العيار الحجمي في خلايا HEK293T
- للتحقق من التعبير عن بروتين من الفائدة وتحديد تركيز الفيروسي الأمثل للتجارب، إضافة إلى سلسلة من التخفيفات المسلسل من الأسهم الفيروسي (على سبيل المثال، 0، 5، 10، 20، 40، 80 ميكرولتر) لتنبيغ خلايا T HEK293 مطلي في 6 لوحات جيدا، والثقافة لمدة 24 ساعة على 37 درجة مئوية، 5٪ CO 2. هذا البروتوكول يولد عادة الفيروسات التي يمكن استخدامها بتركيزات تتراوح بين 01:50 إلى 1: 200 تحقق التعبير القوي للجيناتالفائدة.
- 48 ساعة بعد تنبيغ الفيروسية، وخلايا HEK293T ليز في المخزن TNE (انظر الجدول من حل الأسهم) مع مثبطات الأنزيم البروتيني.
- شطف الآبار مرتين مع DPBS المبردة ثم إضافة 150 ميكرولتر عازلة TNE إلى كل بئر.
- خلايا ليز من قبل pipetting صعودا وهبوطا 5-10x. نقل لست] خلية كاملة إلى 1.5 مل أنبوب microcentrifuge واحتضان على الجليد لمدة 15-30 دقيقة.
- الطرد المركزي لست] في 4 درجة مئوية لمدة 30 دقيقة في أقصى سرعة (20،000 x ج) ونقل برأت طاف لأنبوب جديد لتحديد البروتين برادفورد واللاحقة تحليل لطخة الغربي.
- تحديد مستوى التعبير عن بروتين الاهتمام من جانب معيار تحليل لطخة الغربي حين التحقيق عن الأجسام المضادة ضد البروتين نفسه والعلامة تنصهر (أي العلم). استخدام تخفيف الفيروسي يمكن أن ينتج خلايا> 95٪ GFP + والتعبير القوي من البروتين من الفائدة للتجارب.
4. العزلة والثقافة من DRGs (Figure 2 الخطوات من 1 و 2)
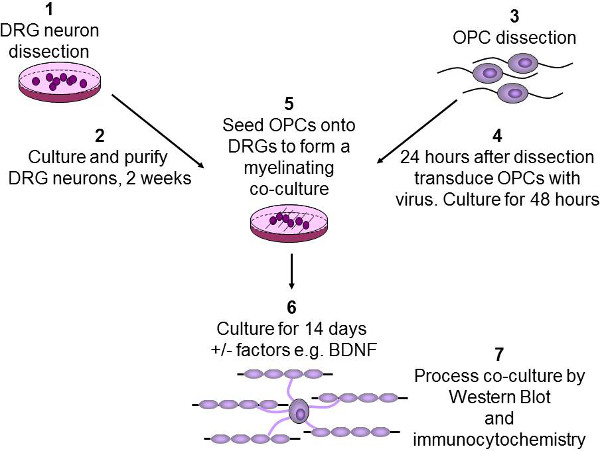
الشكل 2: رسم تخطيطي للفحص في المختبر تكون الميالين الخلايا العصبية DRG يتم تشريح من الفئران الوليدة P2-3، ثم تنقيته ومثقف اكثر من اسبوعين (1-2). وتنقيته من أدمغة الفئران يجد OPCs P7-9 باستخدام immunopanning (3). ثم يصاب يجد OPCs مع الفيروسة البطيئة ومثقف لمدة 48 ساعة (4). ثم يتم المصنف يجد OPCs على DRGs، ويتم إضافة أي عوامل النمو ذات الأهمية مثل عامل التغذية العصبية (5). شارك في الثقافات ثم تربيتها لمدة 2 أسابيع للسماح يجد OPCs للتمييز وmyelinate المحاور (6). وأخيرا، هي lysed إما الثقافات شارك في لالنشاف الغربية أو ثابتة للمناعية (7).
ملاحظة: 1- يوم 2 أيام قبل تشريح:
<رأ>ملاحظة: يوم 2: تشريح وعزل DRGs:
5. العزلة والثقافة من يجد OPCs (الشكل 2 الخطوة 3)
ملاحظة: 1- يوم 2 أيام قبل تشريح:
- معطف 10 سم زراعة الأنسجة لوحات مع بولي-D-ليسين (PDL، 10 ميكروغرام / مل في تعقيم الماء منزوع الأيونات) في 4 درجات مئوية خلال الليل.
ملاحظة: يوم 2: 1 يوم قبل تشريح: - غسل الأطباق PDL مع تعقيم الماء منزوع الأيونات ل3X. السماح ليجف ل~ 6 ساعات في نسيج الثقافة غطاء محرك السيارة. إذا لم يتم استخدامه على الفور، والتفاف وتخزينلمدة تصل إلى 4 أسابيع في 4 درجات مئوية.
- إعداد لوحات الأجسام المضادة الثانوية للimmunopanning. ل1 تشريح الدماغ، وإعداد لوحات مفتش 2X (لRan2 الأجسام المضادة لإزالة الخلايا النجمية وO1 الأجسام المضادة لإزالة premyelinating قليلة التغصن)، مع 45 ميكرولتر مفتش الماعز α الماوس في DPBS (15 مل) لكل 10 سم طبق بتري. 1X الغلوبولين المناعي لوحة ل (O4 الأجسام المضادة لاختيار خلايا دبقية قليلة التغصن السلائف)، 45 ميكرولتر الماعز α الماوس الغلوبولين المناعي في DPBS (15 مل) لكل 10 سم طبق بتري.
ملاحظة: يوم 3: يوم تشريح: - إضافة 200 وحدة من غراء في 10 مل من غراء عازلة (الجدول 2)، والاحماء عند 37 درجة مئوية حتى يتحول المخزن المؤقت واضح.
الجدول 2: إعداد عازلة غراء.تركيز ل 250 مل التركيز النهائي الأسهم EBSS 10X 25 مل 1X MgSO 4 100 ملي 2.5 مل 1 ملم جلوكوز 30٪ 3 مل 0.46٪ EGTA 0.5 M 1 مل 2 مم NaHCO 3 1 M 6.5 مل 26 ملي جعل حجم ما يصل الى 250 مل مع الماء منزوع الأيونات وفلتر تعقيم - غسل جميع لوحات الأجسام المضادة الثانوية مع موانئ دبيBS ل3X.
- صب Ran2 وO1 الأجسام المضادة على لوحات مفتش وهجين O4 إلى لوحة الغلوبولين المناعي. احتضان كل هذه اللوحات الأجسام المضادة الأولية لأكثر من 2 ساعة على RT.
- تشريح الدماغ واحد من الفئران P7. قطع رأس الجرو مع مقص شحذ وإزالة الجلد المغطي الجمجمة مع مقص.
- قطع حول الجمجمة من الفص القذالي، الفص الصدغي، والفص الجبهي. إزالة الدماغ من الجمجمة باستخدام ملقط وبلطف تحويلها إلى 35 ملم طبق بتري مع 1 مل DPBS.
- الزهر الدماغ الى قطع صغيرة تقريبا مع مقص أو شفرة معقمة.
- مرشح ما قبل تحسنت عازلة غراء (10 مل) في أنبوب جديد 15 مل تحتوي على بضع حبات من L-السيستين، ثم يضاف 200 ميكرولتر DNAase (12،500 U / مل) إلى المخزن المؤقت غراء تصفيتها.
- صب المخزن المؤقت غراء على أنسجة المخ مكعبات. احتضان عند 37 درجة مئوية لمدة 90 دقيقة.
- نقل Gentlly فصلها أنسجة المخ في أنبوب 50 مل باستخدام ماصة 25 مل والسماح لتسوية.
- إزالة عازلة غراء، إضافة 2 مل لو البيضة (مخاطاني البيض) لأنسجة المخ وtiturate 5-10x من قبل pipetting لتفريق أجزاء من أنسجة المخ، والسماح لتسوية وإزالة أعلى 2 مل من طاف لأنبوب جديد.
- إضافة آخر 2 مل لو البيضة إلى أنسجة المخ وكرر الخطوة 5.11 حتى لا تظل قطعا من الأنسجة. Tituration يمكن الحصول على عدوانية على نحو متزايد.
- الطرد المركزي فصل تعليق خلية لمدة 15 دقيقة في 200 ز س. نضح قبالة طاف وبيليه الخلية resuspend في 10 مل مرحبا البيضة وأجهزة الطرد المركزي لمدة 15 دقيقة في 200 ز س.
- غسل أول لوحة immunopanning (ران 2 لوحة) مع DPBS ل3X. نضح طاف، وخلايا resuspend في 10 مل بالغسل عازلة (الجدول 2) وتصب على لوحة immunopanning الأولى (ران 2 لوحة). احتضان خلايا لمدة 15 دقيقة في RT.
- غسل لوحة immunopanning الثانية (O1 لوحة) مع DPBS ل3X.
- بعد الحضانة على لوحة immunopanning الأولى، تلميح تعليق الخلية على الثانيةلوحة immunopanning (O1 لوحة)، وشطف أي خلايا فضفاضة قبالة سطح لوحة مع 1-3 مل من بالغسل العازلة ونقل بواسطة ماصة لوحة O1. احتضان خلايا لمدة 15 دقيقة في RT.
- غسل لوحة immunopanning الثالثة (O4 لوحة). هذه اللوحة هي لوحة اختيار إيجابية حيث يجد OPCs ربط سطحه. غسل لوحة O4 مع DPBS ل3X.
- بعد الحضانة على لوحة immunopanning الثانية، ونقل الخلايا إلى لوحة immunopanning النهائية (O4 لوحة)، واحتضان خلايا لمدة 45 دقيقة في RT. وهذه الخطوة اختيار O4 + يجد OPCs.
- نضح طاف من مشاركة لوحة immunopanning (O4 لوحة) وشطف لوحة مع EBSS ل6X.
- لإزالة يجد OPCs قبالة لوحة، واحتضان الخلايا مع 5 مل من الحارة 0.05٪ التربسين-EDTA المخفف 01:10 مع EBSS عند 37 درجة مئوية لمدة 8 دقائق.
- إضافة 5 مل من 30٪ FBS (صنع في EBSS) لتحييد التربسين. إزالة الخلايا من سطح لوحة من قبل pipetting لحوالي 50X.
- نقل كل خليةتعليق لأنبوب جديد وأجهزة الطرد المركزي لمدة 15 دقيقة في 200 ز س.
- تجاهل وطاف بيليه الخلية resuspend في 1 مل قبل تحسنت وسائل الإعلام ساتو، تليها العد الخلية. تشريح الدماغ يمكن للمرء أن تسفر 1،5-2000000 يجد OPCs.
- لوحة الخلايا الجافة على لوحات PDL المغلفة في مناطق ذات كثافة بين 1 × 10 5 و 5 × 10 5 في 10 سم لوحة مع وسائل الإعلام في ساتو (10 مل) التي تحتوي على عامل التغذية العصبية الهدبي (CNTF، 10 نانوغرام / مل)، عامل النمو المشتق من الصفيحات (PDGF، 10 نانوغرام / مل،)، neurotrophin 3 (NT3، 1 نانوغرام / مل)، وforskolin (4.2 ميكروغرام / مل) 2،12. يجد OPCs الثقافة عند 37 درجة مئوية، و 8٪ CO 2.
6. يجد OPCs Transducing
- يجد OPCs الثقافة الابتدائية في وسائل الإعلام ساتو (10ML / 10CM لوحة) مع CNTF (10 نانوغرام / مل)، PDGF (10 نانوغرام / مل)، NT3 (1 نانوغرام / مل)، وforskolin (4.2 ميكروغرام / مل) عند 37 درجة مئوية، 8٪ CO 2 لمدة 24 ساعة بعد تشريح.
- نضح تماما من وسائل الإعلام الثقافة OPC، وخلايا تغذية مع تقدم طازجة وسائل الإعلام ساتو (10 مل) مع عوامل النمو (انظر أعلاه في الخطوة 6.1).
- إضافة الفيروس إلى يجد OPCs إلى تركيز الأمثل تحديد الخطوة 3 (الشكل 2، الخطوة 4)، يجد OPCs الثقافة ل48 ساعة أخرى.
7. OPC البذر لMyelinating المشارك الثقافات (الشكل 2، الخطوتين 5 و 6)
- لإزالة يجد OPCs من السطح، الأولى لوحات شطف OPC مع 8 مل EBSS مرتين، ثم احتضان الخلايا مع 5 مل باب الحارة 0.05٪ التربسين-EDTA المخفف 01:10 مع EBSS عند 37 درجة مئوية لمدة 2 دقيقة.
- تحييد التربسين مع 30٪ FBS في EBSS (5 مل)، وإزالة الخلايا من لوحة من قبل pipetting. نقل تعليق خلية إلى أنبوب 15 مل، أجهزة الطرد المركزي في 180 x ج لمدة 15 دقيقة في RT.
- نضح قبالة طاف و resuspend بيليه خلية في 1 مل قبل تحسنت وسائل الإعلام ساتو تليها عدد خلايا.
- قبل البذر OPC، ووسائل الإعلام نضح تماما عن لوحة الثقافة DRG. البذور بلطف انخفاض 200،000 يجد OPCs الحكيمة إلى الخلايا العصبية DRG كما هو موضح سابقا 4-6.
ملاحظة:يجب أن يكون إجمالي حجم بذر OPC أقل من 200 ميكرولتر في 22 ملم ساترة. - ترك الخلايا ليستقر دون تحريك لوحة لمدة 10 دقيقة في نسيج الثقافة هود، ثم أعلى بلطف مع 1 مل قبل تحسنت وسائل الإعلام ساتو لكل بئر.
- Replate المتبقية يجد OPCs الشقيقة مع وسائل الإعلام ساتو مع عوامل النمو (راجع الخطوة 6.1). استخدام هذه يجد OPCs شقيقة للتحقق من التعبير عن بروتين من الفائدة.
- بعد 24 ساعة، واستبدال وسائل الإعلام ساتو مع وسائل الإعلام المشارك الثقافة (2 مل / جيد) تحتوي على وسائل الإعلام ساتو (أي العوامل) وneurobasal (ت / ت) مع 1٪ B27. الحفاظ على المشترك الثقافات لمدة 14 يوما مع تغيير وسائل الاعلام كل 2-3 أيام.
- تقييم المشترك الثقافات للبروتين النخاعين التعبير من خلال تحليل لطخة الغربي وتصور لتشكيل قطاعات محور عصبي مياليني بالنقر المزدوج المناعية مع الأجسام المضادة ضد المايلين علامات البروتين الأساسية وعلامات العصبية 4-6.
النتائج
والموسومة العلم خارج الخلية كيناز 1 (العلم-Erk1) المتعلقة إشارة بناء المستخدمة لإنتاج الفيروسة البطيئة يتم التحقق من قبل تقييد انزيم الهضم من بنيات المستخدمة، بما في ذلك كل من يبني 2K7 والتعبئة والتغليف والاكسسوار البنى اللازمة لإنتاج فيروس (الشكل 3) .
Discussion
تكون الميالين من المحاور هي عملية حاسمة لوظيفة المثلى من كل من الجهاز العصبي المركزي والمحيطي من الفقاريات. جيل وصيانة myelinated محاور عصبية هي عملية معقدة ومنسقة تشمل التفاعلات الجزيئية بين الخلايا العصبية، الدبقية (من خلايا شوان أو قليلة التغصن) والبروتينات إضافية مص...
Disclosures
The authors declare that there is no conflict of interest regarding this research.
Acknowledgements
This work was supported by the Australian National Health and Medical Research Council (NHMRC fellowship #454330 to JX, project grant #628761 to SM and APP1058647 to JX), Multiple Sclerosis Research Australia (MSRA #12070 to JX), the University of Melbourne Research Grant Support Scheme and Melbourne Research CI Fellowship to JX as well as Australia Postgraduate Scholarships to HP and AF. We would like to acknowledge the Operational Infrastructure Scheme of the Department of Innovation, Industry and Regional Development, Victoria Australia.
Materials
| Name | Company | Catalog Number | Comments |
| 2K7 lentivector | Kind gift from Dr Suter9 | ||
| 5-Fluoro-2′-deoxyuridine | Sigma-Aldrich | F0503-100mg | |
| Alexa Fluor 488 Goat anti-mouse IgG | Jackson Immunoresearch | 115545205 | |
| Alexa Fluor 488 goat anti-rabbit IgG (H+L) | Life Technologies | A11008 | |
| Alexa Fluor 594 goat anti-mouse IgG (H+L) | Life Technologies | A11005 | |
| Alexa Fluor 594 goat anti-rabbit IgG (H+L) | Life Technologies | A11012 | |
| Ampicillin | Sigma-Aldrich | A9518-5G | |
| B27 - NeuroCul SM1 Neuronal Supplement | Stem Cell Technologies | 5711 | |
| BDNF (Human) | Peprotech | PT450021000 | |
| Biotin (d-Biotin) | Sigma Aldrich | B4639 | |
| Bradford Reagent | Sigma Aldrich | B6916-500ML | |
| BSA | Sigma Aldrich | A4161 | |
| Chloramphenicol | Sigma-Aldrich | C0378-100G | |
| CNTF | Peprotech | 450-13020 | |
| DAKO fluoresence mounting media | DAKO | S302380-2 | |
| DMEM, high glucose, pyruvate, no glutamine | Life Technologies | 10313039 | |
| DNase | Sigma-Aldrich | D5025-375KU | |
| DPBS | Life Technologies | 14190250 | |
| DPBS, calcium, magnesium | Life Technologies | 14040182 | |
| EBSS | Life Technologies | 14155063 | |
| EcoRI-HF | NEB | R3101 | |
| Entry vectors for promoter and gene of interest | Generate as per protocols 1-2 | ||
| Fetal Bovine Serum | Sigma-Aldrich | 12003C | |
| Forskolin | Sigma Aldrich | F6886-50MG | |
| Glucose (D-glucose) | Sigma-Aldrich | G7528 | |
| Glycerol | Chem Supply | GL010-500M | See stock solutions |
| Goat Anti-Mouse IgG | Jackson ImmunoResearch | 115005003 | |
| Goat Anti-Mouse IgM | Jackson ImmunoResearch | 115005020 | |
| Goat Anti-Rat IgG | Jackson ImmunoResearch | 112005167 | |
| Hoechst 33342 | Life Technologies | H3570 | |
| Igepal | Sigma Aldrich | I3021-100ML | |
| Insulin | Sigma Aldrich | I6634 | |
| Kanamycin | Sigma-Aldrich | 60615 | |
| Laminin | Life Technologies | 23017015 | |
| LB Medium | See stock solutions | ||
| LB-Agar | See stock solutions | ||
| L-Cysteine | Sigma-Aldrich | C-7477 | |
| Leibovitz's L-15 Medium | Life Technologies | 11415064 | |
| L-Glutamate | Sigma-Aldrich | G1626 | |
| L-Glutamine- 200 mM (100x) liquid | Life Technologies | 25030081 | |
| LR Clonase II Plus enzyme | Life Technologies | 12538-120 | |
| MEM, NEAA, no Glutamine | Life Technologies | 10370088 | |
| Mouse α βIII Tubulin | Promega | G7121 | |
| Mouse αMBP (monoclonal) | Millipore | MAB381 | |
| Na pyruvate | Life Technologies | 11360-070 | |
| NAC | Sigma Aldrich | A8199 | |
| NcoI-HF | NEB | R3193S | |
| NEBuffer 4 | NEB | B7004S | |
| Neurobasal medium | Life Technologies | 21103049 | |
| NGF (mouse) | Alomone Labs | N-100 | |
| NT-3 | Peprotech | 450-03 | |
| O1 antibody - Mouse anti-O1 | Millipore | MAB344 | Alternative if O1 hybridoma cells are unavailable |
| O1 hybridoma cells | Conditioned medium containing anti-O1 antibody to be used for immunopanning | ||
| O4 antibody - Mouse anti-O4 | Millipore | MAB345 | Alternative if O4 hybridoma cells are unavailable |
| O4 hybridoma cells | Conditioned medium containing anti-O4 antibody to be used for immunopanning | ||
| Competent cells | Life Technologies | A10460 | |
| One Shot Stbl competent cells | Life Technologies | C7373-03 | |
| Papain Suspension | Worthington/Cooper | LS003126 | |
| pBR8.91 | Kind gift from Dr Denham10 | ||
| PDGF-AA (Human) | Peprotech | PT10013A500 | |
| Penicillin-streptomycin 100x solution | Life Technologies | 15140122 | |
| pENTRY4IRES2GFP | Invitrogen | 11818-010 | |
| pMD2.G | Addgene | 12259 | |
| Poly-D-lysine | Sigma | P6407-5MG | |
| Polyethylenimine (PEI) | Sigma-Aldrich | 408727-100ML | |
| Poly-L-ornithine | Sigma Aldrich | P3655 | |
| Progesterone | Sigma Aldrich | P8783 | |
| Protease inhibitor tablet (Complete mini) | Roche | 11836153001 | |
| Proteinase K | Supplied with Clonase enzyme | ||
| Putrescine | Sigma Aldrich | P-5780 | |
| Rabbit α neurofilament | Millipore | AB1987 | |
| Rabbit αMBP (polyclonal) | Millipore | AB980 | |
| Ran2 hybridoma cells | ATCC | TIB-119 | Conditioned medium containing anti-Ran2 antibody to be used for immunopanning |
| Rat anti CD140A/PDGFRa antibody | BD Pharmingen | 558774 | |
| SacII | NEB | R0157 | |
| SOC medium | Supplied with competent bacteria | ||
| Sodium selenite | Sigma Aldrich | S5261 | |
| Spe I | NEB | R0133S | |
| T4 DNA Ligase | NEB | M0202S | |
| T4 DNA Ligase Buffer | NEB | B0202S | |
| TE buffer pH8 | See stock solutions | ||
| TNE lysis buffer | |||
| Trace Elements B | Cellgro | 99-175-CI | |
| Transferrin (apo-Transferrin human) | Sigma-Aldrich | T1147 | |
| Triton X-100 | Sigma-Aldrich | T9284 | |
| Trypsin | Sigma-Aldrich | T9201-1G | |
| Trypsin Inhibitor From Chicken Egg White | Roche | 10109878001 | |
| Trypsin-EDTA (1x), phenol red (0.05%) | Life Technologies | 25300-054 | |
| Unconjugated Griffonia Simplicifolia Lectin BSL-1 | Vector laboratories | L-1100 | |
| Uridine | Sigma-Aldrich | U3003-5G |
References
- Baumann, N., Pham-Dinh, D. Biology of oligodendrocyte and myelin in the mammalian central nervous system. Physiol Rev. 81 (2), 871-927 (2001).
- Watkins, T. A., Emery, B., Mulinyawe, S., Barres, B. A. Distinct stages of myelination regulated by gamma-secretase and astrocytes in a rapidly myelinating CNS coculture system. Neuron. 60 (4), 555-569 (2008).
- Lee, K., et al. MDGAs interact selectively with neuroligin-2 but not other neuroligins to regulate inhibitory synapse development. Proc Natl Acad Sci U S A. 110 (1), 336-341 (2013).
- Xiao, J., et al. BDNF exerts contrasting effects on peripheral myelination of NGF-dependent and BDNF-dependent DRG neurons. J Neurosci. 29 (13), 4016-4022 (2009).
- Chan, J. R., et al. NGF controls axonal receptivity to myelination by Schwann cells or oligodendrocytes. Neuron. 43 (2), 183-191 (2004).
- Xiao, J., et al. Brain-Derived Neurotrophic Factor Promotes Central Nervous System Myelination via a Direct Effect upon Oligodendrocytes. Neurosignals. 18 (3), 186-202 (2010).
- Lundgaard, I., et al. Neuregulin and BDNF induce a switch to NMDA receptor-dependent myelination by oligodendrocytes. PLoS Biology. 11 (12), e1001743 (2013).
- Kleitman, N., W, P. M., Bunge, R. P. . Tissue culture methodes for the study of myelination. , (1991).
- Xiao, J., et al. Extracellular signal-regulated kinase 1/2 signaling promotes oligodendrocyte myelination in vitro. J Neurochem. 122 (6), 1167-1180 (2012).
- Wong, A. W., Xiao, J., Kemper, D., Kilpatrick, T. J., Murray, S. S. Oligodendroglial expression of TrkB independently regulates myelination and progenitor cell proliferation. The Journal of Neuroscience. 33 (11), 4947-4957 (2013).
- Li, Z., et al. Molecular cloning, Characterization and Expression of miR-15a-3p and miR-15b-3p in Dairy Cattle. Molecular and Cellular Probes. , (2014).
- Emery, B., et al. Myelin gene regulatory factor is a critical transcriptional regulator required for CNS myelination. Cell. 138 (1), 172-185 (2009).
- Murai, K., et al. Nuclear receptor TLX stimulates hippocampal neurogenesis and enhances learning and memory in a transgenic mouse model. Proc Natl Acad Sci U S A. 111 (25), 9115-9120 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved