Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Üretim ve seçici transduce İlköğretim Oligodendrosit Öncü Hücreler için Lentivirüste kullanımı için
Bu Makalede
Özet
Here we present protocols that offer a flexible and strategic foundation for virally manipulating oligodendrocyte precursor cells to overexpress proteins of interest in order to specifically interrogate their role in oligodendrocytes via the in vitro model of central nervous system myelination.
Özet
Miyelinasyon nöronlar ve glial hücreleri oluşturan miyelin iki içeren karmaşık bir süreçtir, periferal sinir sisteminin (PNS), merkezi sinir sisteminde (CNS) oligodendrositler ve Schwann hücreleri. Biz bir in vitro miyelinasyon deneyi, in vitro MSS miyelinasyonun eğitim için kurulmuş bir modeli kullanın. Bunu yapmak için, ön-madde oligodendrosit hücreleri (OPC) Myelinating ko-kültürler oluşturmak üzere saflaştırılmış primer, kemirgen Dorsal kök ganglion (DRG) nöronlarının ilave edilir. Oligodendrositler tarafından ifade belirli proteinler miyelinasyona üzerine uygulamayın spesifik rolleri sorgulamak için biz seçici DRG nöronlar üzerine numaralı seribaşı önce yabani türü, yapısal olarak aktif veya dominant negatif proteinlerini aşın lentivirüs kullanarak OPC transduce protokolleri geliştirmiştir. Bu bize özellikle miyelinasyonun düzenleyen bu oligodendroglial proteinlerin rollerini sorgulamak için izin verir. protokolleri de ot çalışmaya uygulanabilirher hücre tipi, böylece bu tip bir sinyal ve dengeleme mekanizmaları arasında hedef çalışma için oligodendrositler gibi arzu edilen bir hücre tipi ile ifade edilen proteinlerin, seçici manipülasyonuna olanak veren bir yaklaşım sağlar. Sonuç olarak, lentiviral enfekte OPC ile in vitro miyelinasyon tahlil birleştirerek miyelinasyona yer alan moleküler mekanizmaların analizi için stratejik bir araç sağlar.
Giriş
Aksonların myelinizasyonuna hem merkezi hem periferik sinir sisteminde aksiyon potansiyeli hızlı ve etkin iletimi için çok önemlidir. İhtisas hücreler, Schwann hücreleri, merkezi sinir sisteminde periferik sinir sistemi ve oligodendrositler olarak, etrafında sarın ve miyelin de ensheathe aksonlar, etkin bir sinir yalıtım ve saltatory iletimini 1 kolaylaştırılması. miyelinasyon işlemi, retinal ganglion nöronlarının 2, mühendislik nanolifler 3 ya da Schwann hücrelerinin 4 veya oligodendrosit 5-7 ya da birlikte kültürlenmiş Dorsal kök ganglion nöronlarının kullanılarak in vitro incelenebilir. in vitro miyelinasyon tahlil sinir sistemi miyelinasyonun eğitim için kurulmuş bir modeldir ve in vivo 5-8 miyelinasyona sırasında meydana temel süreçlerin birçok çoğaltır. Tahlil C OPC ile dorsal kök ganglion (DRG) nöronların saflaştırılmış popülasyonlarının kokültürü, (içerirNS myelinasyon) veya Schwann hücreleri (PNS miyelinasyona için). Belirli koşullar altında bu myelinating hücrelerin in vivo mevcut miyelin spesifik proteinlerin aynı tamamlayıcısı ifade plazma zarı yalıtım sipariş ultra yapısal doğrulanmış, çok katmanlı levha DRG aksonlar ensheathe.
in vitro olarak merkezi sinir sistemi miyelin okuyan en yaygın olarak kullanılan hücre modeli başarılı bir şekilde bu nörotrofinlerin gibi dış faktörler, in vitro 5,6 CNS miyelinasyon üzerinde uyguladığı etkilerini incelemek için kullanılmıştır DRG nöronlarının ve OPC, ko-kültürler bir. Bu gibi büyüme faktörlerinin veya küçük molekül farmakolojik inhibitörleri olarak, dış faktörlerin yaygın DRG'ye OPC kokültürünün modeli 7,9 ile miyelinasyon yolaklarını rolünü incelemek için kullanılmıştır. Ancak, nöronlar ve oligodendrositlerin hem de içeren karma ko-kültür ortamlarında, resmen mümkün kaldığını büyüme faktörleri veya phar yamacological inhibitörleri DRG nöronlar ve oligodendrosit (OL) hem üzerine etkileri sarf olabilirdi. Bu, özellikle proteinler DRG'lerin sadece ifade veya oligodendroglia bu ikili hücre sistemini kullanarak miyelinasyona üzerine uyguladığı bu rolleri incelemek için yeteneği sunuyor. Tümden oligodendroglial sinyalizasyon yolunun doğrudan, in vitro miyelinasyon deneyi için DRG nöronlarının üzerine konmadan önce, yanı sıra, yabani tip ve mutant proteinlerin her ikisini fazla sentezleyen bir zarif bir yolu olduğu kanıtlanmıştır miyelinasyon, OPC lentiviral transdüksiyon düzenleyen olduğunu doğrulamak için oligodendrositler tarafından kurucu olarak ifade proteinlerin demonte ifadesi olarak. Böylece bu yaklaşım, özellikle sorguya ve miyelinasyonun 9,10 çalışmak için oligodendrositler içinde sinyal yolları işlemek için bir cadde sunuyor.
Bu yazıda, biz bir lentiviral aracılığıyla seçici oligodendrositlerin ilgi bir protein aşın geliştirdik yöntemleri raporin vitro miyelinasyonun incelemek için yaklaşım. teknikler ilgi alanı dahilindeki geni içeren sentezleme vektörlerinin üretimi ile başlar, daha sonra daha sonra pENTR vektörü (pENTR L1-L2 pENTR4IRES2GFP) klonlanır bir vahşi tipli, yapısal olarak aktif bir veya baskın negatif formunda olsun. (Ilgili geni içeren) Bu vektör, CMV yükselticisi verici (pENTR L4-R1, pENTR-pDNOR CMV) ve 2K7 Lentivector CMV promotörünü içeren bir 2K7 vektör yapılandırmak için söz konusu genin bir üretilmesi için bir enzim reaksiyonu birleştirilir ensefalomiyokarditis ve GFP (Şekil 1). PMD2.G virüs kılıfının ve pBR8.91 virüs paketi ile birlikte, bu ağ klonlanmış 2K7 yapısı daha sonra OPC nakletmek için kullanılabilir lentivirüs oluşturmak için HEK293T hücrelerine ko-transfekte edilirler. Lentivirüs ile enfekte sonra OPC ilgi protein yüksek düzeyde ifade. Bu OPC sonra DRG nöron kültürleri üzerine ekilmiş ve etkisi ifadesi olduğunu edilebiliristenen proteinin yüksek düzeyde sorguya olabilir miyelinasyona üzerinde uygular. ko-kültürler Western blot analizi ile miyelin protein ifadesi için değerlendirilir ve immünositokimya miyelinli aksonal segmentlerin oluşumu için görünür hale getirilir.
Protokol
NOT: Bu çalışma için kullanılan tüm hayvanlar karışık seks ve Anatomi ve Patoloji Anabilim Dalı Hayvan Tesisleri ve Melbourne Üniversitesi Nörobilim ve Ruh Sağlığı Araştırma Enstitüsü'nde yetiştirilen Florey. Tüm hayvan prosedürleri Melbourne Üniversitesi'nde Hayvan Deneyleri Etik Kurullarının tarafından kabul edildi.
2K7 Lentivector 1. Klonlama
- 2K7 lentiviral vektör içine ilgili genin klonlanmasına önce, standart moleküler teknikler kullanılarak 11 pENTR vektörü (3637 bp Kanamisin dirençli) içine gen alt-klonlanmıştır. Alt-klonlama için EcoRI ve Sacll sınırlama sitesi kullanın.
- 2K7 Lentivector amplifikasyonu
- Hafifçe yetkin hücre ile plazmid DNA, 100 ng karıştırılarak 2K7 Lentivector DNA Dönüşümü ve 30 dakika boyunca buz üzerinde inkübe edilir.
- Isı şoku, DNA / kompetan hücreler 90 sn için 42 ° C sıcaklıkta karıştırmak ve ampici her ikisini de içeren LB-Agar plakalar üzerine bunları plakallin (100 ug / ml) ve 16-18 saat süre ile 37 ° C 'de, kloramfenikol (15 ug / ml).
Not: Kloramfenikol uzun terminal tekrarı arasındaki rekombinasyonu önlemek için kullanılır. - Bir sonraki gün, 16-18 saat boyunca 37 ° C'de ampisilin (100 ug / ml) ve kloramfenikol (15 ug / ml) her ikisini de içeren LB ortamında bakteri seçilmiş klondaki büyür. Üreticinin talimatlarına göre bir ticari plazmid DNA Maksiprep kiti kullanılarak DNA ekstrakte edin.
- 2K7 Lentivector için pENTR vektöründen alt-klonlama (Şekil 1)
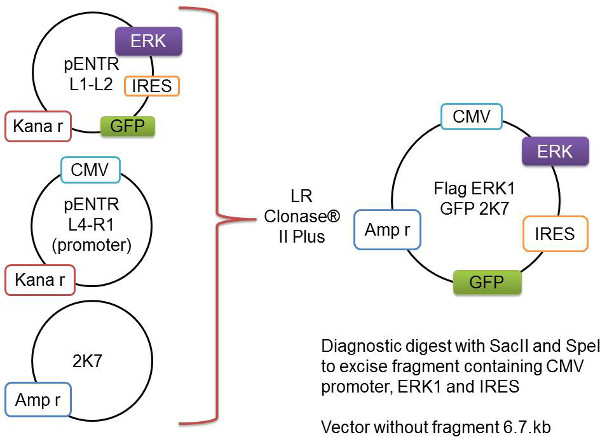
Şekil 1:. Ağ Geçidi yeniden birleştirme işleminin şematik gösterimi, söz konusu genin, burada Flag-ERK1 olarak temsil pENTR L1-L2 vektörü içine klonlanır. Bu, CMV promotörü ve omurga 2K7 vektörü içeren pENTR L4-R1, vektörüne eklenir. Bu üç vektörler LR Clonase II Plus enzim ile yeniden birleştirilirVirüs hazır 2K7 vektörü içine bir çıkar geni-ve promotör yerleştirin.- 1.5 ml tüp Aşağıdaki ekleyin ve hafifçe karıştırın:
L4-R1, pENTR-pDNOR CMV (yükseltici) (60 bng) 1-2.5 ul
(80 bng) 1-2.5 ul (ilgi dahilindeki gen ile birlikte) L1-L2 pENTR4IRES2GFP
K7 Lentivector (80 ng / ul) 1 ul
TE-tamponu, pH 82-5 ul
Toplam 8 ul - -80 ° C ila Clonase enzim karışımı çıkarın ve 2 dakika boyunca buz üzerinde eritin. Enzim hemen hemen tekrarlanan donma-çözme döngüsü verimliliği klonlama azalttı olarak, bu enzim, -80 ° C arasında bir miktar daha taze olduğundan emin olun
- Reaksiyon başına enzimin 2 ul ekleyin ve vorteks yoluyla iyice karıştırılır ve 6-24 saat boyunca 23-25 ° C'de Clonase tepkime karışımı inkübe edilir.
- Clonase Reaksiyon karışımına (enzim kitiyle birlikte verilen), proteinaz K çözeltisi 1 ul ilave edin ve 37 ° C'de 10 dakika inkübe edilir.
- Yetkili hücrelere Clonase reaksiyon karışımı Transform ve seçin büyümek16-18 saat boyunca 37 ° C'de ampisilin (100 ug / ml) içeren LB ortamında kolonileri.
- Özü ve üretici talimatlarına göre bir ticari miniprep kiti kullanılarak DNA'nın arıtılması.
- Spe I ve Sac II ve ilgi promoteri ve gen içeren parçasını çıkarmak için üreticinin talimatlarına göre uygun bir tampon enzimleri kısıtlama ile sindirimi yoluyla DNA teyit edin.
Not: Bu adım alt klonlanmış DNA sağ vektör omurgası ile ilgi doğru eklemek geni olup olmadığını kontrol etmek önemlidir. Bu eklenen parça olmadan vektör kendisinin büyüklüğü 6.7 kb'dir. serbest yerleştirilen fragmanının boyutu, promotörü ve ilgili geni uç içerir. Bir Plazmid Editor - örneğin DNA dizisi düzenleme programı, APE üzerinden belirli gen için sindirilmiş beklenen fragman boyutları hesaplayın. - DNA vektörü omurgası ve bir% 1 agaroz jeli yürütülerek serbest fragmanının her iki boyutta Giriş1x TAE tamponu 100 V'de (stok çözümleri Tablo bakınız)
- 16-18 saat boyunca 37 ° C'de ampisilin (100 ug / ml) ihtiva eden LB ortamı, 500 ml bakteri büyüme ile teyit DNA yükseltin.
- Özü ve üreticinin talimatlarına göre bir ticari plazmid DNA Maksiprep kiti kullanılarak DNA arındırmak.
Not: Maksiprep tipik haliyle, viral üretimi için gerekli olan DNA yeterli miktarda üretir.
- 1.5 ml tüp Aşağıdaki ekleyin ve hafifçe karıştırın:
- Tekrar lentiviral hazırlıkları için aşağıdaki DNA'lar yükseltmek için 1.3.9-1.3.10 adımları: Bir kontrol olarak Zarf vektörü (PMD2.G, 6.1 kb), Paket vektörü (pBR8.91, 12.5 kb), ve boş bir lentiviral vektör (GFP -CMV-2K7, 8.7 kb),.
2. 2K7 Virüs Üretimi
NOT: 1. Gün:
- Transfeksiyondan bir gün, 25 mi HEK293 T hücre ortamı içeren T175 şişesi içinde plaka 32000000 HEK293 T hücreleri (stok çözeltilerinin Tablo). Seçenek olarak ise, günün 16000000 hücreleri plakatransfeksiyondan önceki zaman transfeksiyonunun gününde sıkı çalışır eğer.
NOT: Transfeksiyon transfeksiyon gün önce veya bir gün için hücreleri kaplama ile aynı derecede başarılı olabilir. Iki alternatiften birini kullanarak, burada kritik nokta emin hücreler transfeksiyondan önce kültür çanak yüzeyinden aşağı sıkışmış yapmaktır.
NOT: Gün 2: - Transfeksiyon
- Transfeksiyondan önce, 10 mM Tris pH 8, deiyonize su içinde 1 mM EDTA, pH 8 ihtiva TE Tamponu içinde 1 ug / ul DNA seyreltin.
- 50 ml'lik bir tüp içinde, T175 şişesi içinde transfeksiyon için bir ana karışımı (Tablo 1) hazırlanması. DNA ekleme Dulbecco Modifiye Edilmiş Eagle Ortamı (DMEM) ısıtılmış ön ve vorteks yoluyla iyice karıştırın, daha sonra erken çökelmesini önlemek için steril bir polietilenimin (PEI) (stok çözeltilerinin Tablo) ekleyin. ">
Tablo 1: 2K7 Virüs için hazırlık transfeksiyon karışımı.Vektör trong> Konsantrasyon Hacim pMDG.2 1 ug / ul 5 ul pBR8.91 1 ug / ul 15 ul GFP + söz konusu gen ile 2K7 vektör 1 ug / ul 22 ul Steril Polietileniminin (PEI) 1 g / l 500 ul DMEM 2.100 ul - Tüp 3-4x çevrilmesi ile iyice karıştırıldıktan sonra, oda sıcaklığında 15 dakika boyunca (RT) enkübe edilir.
- HEK293T hücreleri üzerinde tam bir medya değişiklik yapın. Aspire tamamen hücrelerin kültür ortamı dışında ve önceden ısıtılmış HEK293T hücre kültür ortamı (T175 şişesi başına 25 mL) ile beslenir.
- Transfeksiyon karışımı (DNA / PEI karışımı) tek tabakalı hücrelere damla damla ekleyin. Gece boyunca, 37 ° C'de,% 5 CO2 de transfekte edilmiş hücreler, iyice karıştırın ve inkübe yavaşça hareket ettirin.
NOT: Gün 3: - Transfeksiyon başarılı sağlamak için, bir floresan mikroskobu ile GFP 24 saat sonrası transfeksiyon kontrol edin.
NOT: GFP ifade hücrelerin% 50'den fazlası, genellikle iyi bir transfeksiyona gösterir.
NOT: Gün 4:
- 48 saat sonra, transfeksiyondan de viral supernatant toplamak ve taze HEK293 T ortamı (T175 şişesi başına 25 mL) ile değiştirin.
- Yüzer hücre artıkları temizlemek için 4 ° C'de 10 dakika boyunca 1140 x g'de, viral süpernatan santrifüjleyin. Aktarım, 4 ° C'de, 50 ml tüp ve saklamak için süpernatan temizlenir.
NOT: Gün 5:
- Yüzer hücre artıkları temizlemek için 4 ° C'de 10 dakika boyunca 1140 x g'de, viral süpernatan santrifüjleyin. Aktarım, 4 ° C'de, 50 ml tüp ve saklamak için süpernatan temizlenir.
- 72 saat sonrası transfeksiyon anda, viral süpernatant ikinci parti toplamak. Adımı yineleyin 2.3.1 ve havuz 48 ve 72 saat süpernatanlan temizledi.
- 30 ml'lik bir ultra santrifüj tüpleri kullanılarak 4 ° C'de 90 dakika boyunca 170,000 x g'de virüsü, santrifüj, viral süpernatan yoğunlaştırmak.
- Süpernatantı atın ve tüm süpernatant virüsünün (görünmez) pelet bırakarak santrifüj artı tüp tabanında PEI çöktürülmüş kadar adımı 2.6 tekrarlayın.
- , Virüs tekrar süspansiyon ultrasantrifüjdeki tüplerine 500 ul SATO medya (stok çözümleri Tabloya bakınız) ekleyin. 30 sn a için Vortexnd mekanik virüs gevşetmek için bir pipet ile tüpün tabanını kazıyın. Viral pelet gevşek için bu adımı tekrarlayın 6x.
- Mikrosantrifüj tüpler içine yeniden süspanse virüs Havuz ve çözünmeyen PEI kaldırmak için çok kısa bir süre döndürün. Proteinleri uzaklaştırmak için 0.45 um'lik bir filtre ile süpernatant filtre.
- -80 ° C'de 20 ul, 50 ul ve 100 ul hacimde ve deposuna virüs alikosu.
HEK293T Hücreleri 3. viral titre tesbiti
- Eklemek viral stoklar seri seyreltileri, bir dizi ilgili proteinin ekspresyonunu kontrol etmek ve deneyler için uygun virüs konsantrasyonunu belirlemek için (örneğin, 0, 5, 10, 20, 40, 80 ul) kaplanmıştır HEK293, T hücreleri nakletmek için 37 ° C'de 24 saat boyunca 6-yuvalı plakalar ve kültür,% 5 CO2. Geninin güçlü bir ifadesini sağlamak bu 200: Bu protokol, tipik olarak 1:50 ila 1 arasında değişen konsantrasyonlarda kullanılabilir virüsü üretirFaiz.
- 48 saat sonra, viral transdüksiyon, proteaz önleyicileri ihtiva eden tampon maddesi içinde lize TNE HEK293T hücreleri (stok çözeltisi Tablo).
- Soğutulmuş DPBS ile iki kere yıkayın ve daha sonra her bir oyuğa 150 ul PLE tamponunda ekleyin.
- Yukarı pipetleme ve 5-10x aşağı lizleyin hücreleri. 1.5 ml mikrosantrifüj tüpüne bütün hücre lizatları aktarın ve 15-30 dakika boyunca buz üzerinde inkübe edilir.
- Santrifüj maksimum hızda (20,000 xg) ve transfer, 30 dakika boyunca 4 ° C 'de lizatlar Bradford protein belirlenmesi ve daha sonra Western blot analizi için, yeni bir tüpe supernatant temizlenir.
- Proteinin kendi ve kaynaşık etiketi (örneğin, Bayrak) karşı antikorlar için tarama yaparken standart Batı benek analizi ile ilgili proteinin ekspresyon seviyesinin belirlenmesi. >% 95 GFP + hücreleri ve deneyler için ilgili proteinin güçlü bir ifadenin, viral seyreltme kullanın.
4. İzolasyon ve Kültür DRG'lerin (Figure 2 1 & 2) adımları
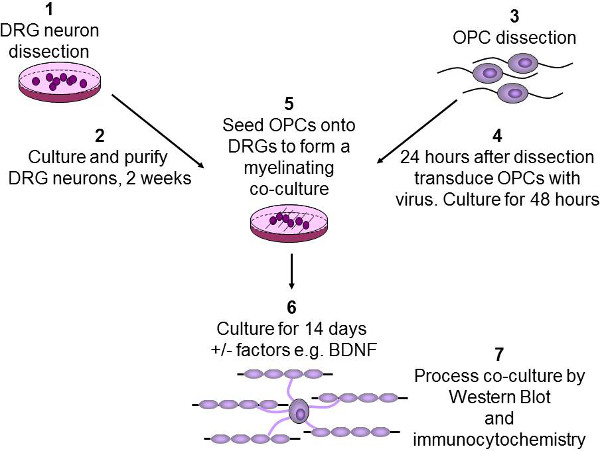
Şekil 2:. In vitro miyelinasyon tahlil DRG nöronların şematik iki hafta (1-2) üzerinden daha sonra saflaştırılmış ve kültüre P2-3 sıçan yavrularının, disseke edilir. OPC immunopanning kullanılarak P7-9 fare beyinlerinden saflaştırılır (3). OPC sonra lentivirüs ve 48 saat (4) kültürlendi ile enfekte edilir. OPC sonra DRG'ler üzerine ekilir ve bu BDNF gibi söz konusu herhangi bir büyüme faktörleri (5) ilave edilir. Eş-kültür 2 hafta OPC aksonlar ayırt etmek ve myelinate izin vermesi kültürlenir (6). Son olarak, ko-kültürler ya da batı lekeleme için lize edildi ve immünolojik hücre kimyası için sabittir (7).
NOT: Gün 1- 2 gün önce diseksiyon için:
- Ceket 22 mm x 22 mm, lamelleri otoklava Poli-L-ornitin (0.5 mg / ml), 6-çukurlu plaka ve bir gece boyunca 37 ° C'de inkübe edin.
- Bir sonraki gün, Laminin yeniden kat lamelleri gece boyunca 37 ° C'de (MEM içinde 20 ug / ml), fazla aspire ve doku kültürü kaputu 20 dakika boyunca kurutulur.
NOT: DRG'lerin Diseksiyon ve izolasyon: 2. Gün: - Kurban P2-P3 sıçan yavrular servikal transection tarafından 12x.
- Hayvanın arkasından kas örten cilt çıkarın. Vertebra foramen açın ve yavaşça omuriliği oymak için forseps kullanmak için Vannas makas kullanın.
- Vertebra sütunlar arasında yalan DRG'lerin dışarı koparmak ve 3 ml L-15 medya içeren bir 33 mm Petri kabındaki bağlı sonra spinal sinir liflerini, yer DRG'lerin kesti. Bu omurilik her taraftan DRG 8 ila 12 bir araya getirmenin mümkün olduğunu
- 5 dakika boyunca 180 x g'de 15 ml tüp, santrifüje L-15 ortamı ile birlikte Aktarım toplanan DRG'ler.
- SolukluSüpernatan, pelet DRG ve 30 dakika boyunca 37 ° C'de inkübasyona 2 mi,% 0.25 tiripsin ilave edin.
- Oda sıcaklığında 3 dakika boyunca 180 x g'de tripsin ve santrifüj durdurmak için DRG peletler M1 ortamında (stok çözeltisi Tabloya bakınız) 5 ml ilave edilir.
- Süpernatant aspire (değil büyüme faktörleri), 2 ml önceden ısıtılmış M1 orta pelet yeniden askıya. 50x pipetleme veya ganglion dağınık kadar ganglion pelet çiğnemek. 3 dakika boyunca 180 xg'de Santrifüj hücre süspansiyonu.
- Süspanse M1 medyada nöronlar ayrışmış ve iyi başına 100 ul başına 5 ganglionlar bir 6-plaka aşağı plaka.
- , Eki kolaylaştırmak M1 ortamı çıkarın ve M2 medya ile nöronların beslemek için 4 saat inkübasyon az sonra, nöronal olmayan hücrelerin çoğalan kaldırmak için (stok solüsyonu Tablo bakınız). NGF (100 ng / ml) varlığında kültür DRG nöronlarında NGF'sine bağlı, TrkA-sentezleyen DRG'ler bir kültür saflaştırmak için. Seçenek olarak ise, BDNF, bağımlı TrkB-Expres saflaştırmak için BDNF (100 ng / ml) kullanımıDRG'lerin şarkı.
- Aşağıdaki gibi 2 hafta içinde antimitotik M2 medya münavebeli (100 ng / ml'de + NGF ya da BDNF) M1 ortam nöronların koruyun.
- Günlerde ortam M1 (+, 100 ng / ml NGF ya da BDNF) muhafaza: 4-6, 8-10, sonra 1 12-14 ve M2'nin FDU ile ortam (100 ng / ml NGF ya da BDNF +) ve üridin için 4, 6-8, 10-12 ve. M2 medya arıtılmadan 3 kez en az gereklidir.
- 2 hafta antimitotik döngüsünü tamamladıktan sonra bir başka hafta M1 DRG yalnız koruyun. Her 2-3 günde M1 medya değiştirin.
5. İzolasyon ve OPC Kültür (Şekil 2 adım 3)
NOT: Gün 1- 2 gün önce diseksiyon için:
- Poli-D-lizin (PDL, steril iyondan arındırılmış su içinde 10 ug / ml), bir gece boyunca 4 ° C'de kaplayın 10 cm doku kültür plakaları.
NOT: Gün 2: diseksiyon önce 1 gün: - 3x için sterilize deiyonize su ile PDL plakaları yıkayın. Doku kültürü kaputu ~ 6 saat kurumasını bekleyin. Hemen kullanılan değilse, şal ve mağaza4 ° C 'de 4 hafta için.
- Immunopanning için ikincil antikor tabak hazırlayın. 1 beyin diseksiyon için, 2x IgG plakaları hazırlamak için (ran2 oligodendrositlerin premyelinating kaldırmak için astrositleri ve A1 antikoru uzaklaştırmak için bir antikor) 10 cm'lik petri tabağı başına DPBS 45 ul Keçi α-fare IgG (15 mi) ile; (Oligodendrosit öncü hücrelerin seçilmesi için O4 antikor) 1x IgM levha, DPBS 45 ul Keçi α fare IgM 10 cm Petri çanağı başına (15 mi).
NOT: Gün 3: diseksiyon gün: - Papain tamponu (Tablo 2), 10 ml papain 200 adet ekleyin ve tampon açık olana kadar 37 ° C'de ısıtın.
Tablo 2: Papain tampon hazırlanması.Konsantrasyon 250 ml Nihai konsantrasyon EBSS stok 10x 25 mi 1x MgSO 4 100 mM 2.5 mi 1 mM Glikoz % 30 3 mi 0.46% EGTA 0.5 M 1 mi 2 mM NaHCO 3 1M 6.5 mi 26 mM Deiyonize su ve filtre sterilize ile 250 ml hacmi kadar getirin - DP ile tüm ikincil antikor plakaları yıkayın3x BS.
- IgG plakaları ve IgM plakasına O4 hibridoması üzerine ran2 ve O1 antikoru dökün. Oda sıcaklığında 2 saat boyunca tüm bu birincil antikor inkübe.
- Bir P7 sıçan gelen bir beyin teşrih. Bilenmiş makas ile yavru başını kesmek ve makas ile kafatası örten deri kaldırmak.
- Oksipital lobda, temporal lob gelen ve frontal lob kafatası etrafında kesin. 1 ml DPBS ile 35 mm Petri kabı transfer hafifçe forseps kullanılarak kafatası beyin çıkarın ve.
- Kabaca makas veya steril bıçak ile küçük parçalar halinde beyin zar.
- L-sistein arasında bir kaç tane ihtiva eden yeni bir 15 ml tüp içine filtre önceden ısıtılmış papain tamponu (10 mi), daha sonra filtre edildi, papain tampon 200 ul, DNAaz (12,500 U / ml) ilave edilmektedir.
- Doğranmış beyin dokularında üzerine papain tampon dökün; 90 dakika boyunca 37 ° C'de inkübe edin.
- Gentlly transferi 25 ml'lik bir pipet kullanılarak 50 ml tüp içine beyin dokuları ayrılmış veyerleşmek için izin verir.
- , Papain tamponu çıkarın beyin dokularının parçalarını kırmak için pipetle beyin dokularında ve titurate 5-10x 2 ml Lo OVO (ovomukoid) ekleyin, yerleşmek ve yeni bir tüp süpernatant üst 2 ml kaldırmak için izin verir.
- Dokusunda hiçbir topakları kalmayacak beyin dokularında ve tekrar adım 5.11 başka 2 ml Lo OVO ekleyin. Toz haline getirme giderek agresif alabilirsiniz.
- Santrifüj 200 x g'de 15 dakika boyunca bir hücre süspansiyonu ayrışmış. Aspire süpernatan ve 10 ml Hi Ovo içinde tekrar süspansiyon hücre topağı, 200 x g'de 15 dakika boyunca santrifüje tabi tutun.
- 3x için DPBS ilk immunopanning plakasını (Ran 2 tabak) yıkayın. Süpernatant aspire, 10 ml tekrar süspansiyon hücreleri tampon (Tablo 2) kaydırma ve ilk immunopanning plaka (Ran 2 plaka) üzerine dökün. Oda sıcaklığında 15 dakika boyunca inkübe hücreleri.
- 3x için DPBS ile ikinci immunopanning plakasını (A1 plaka) yıkayın.
- İlk immunopanning plaka üzerinde inkübe edildikten sonra, ikinci üzerine hücre süspansiyonu ucuimmunopanning plaka (A1 plaka), A1 plaka pipetle tampon ve transferi kaydırma 1-3 ml plaka yüzeyinden herhangi bir gevşek hücreleri durulayın. Oda sıcaklığında 15 dakika boyunca inkübe hücreleri.
- Üçüncü immunopanning plakasını (plaka O4) yıkayın. Bu plaka OPC yüzeyini bağlayan olumlu seçim plaka. 3x için DPBS ile O4 plakasını yıkayın.
- İkinci immunopanning plaka üzerinde inkübe edildikten sonra oda sıcaklığında 45 dakika boyunca hücreler, nihai immunopanning plakasına (O4 plaka) hücreleri transferi inkübe edin. Bu adım O4 + OPC seçecektir.
- Son immunopanning plakası (O4 plaka) süpernatant aspire ve 6x için EBSS'ye ile plaka yıkayın.
- Plakasından OPC kaldırmak için, sıcak,% 0.05 Tripsin-EDTA, 5 ml ile hücrelerin inkübe 8 dakika boyunca 37 ° C'de EBSS'ye ile 1:10 seyreltilmiştir.
- Tripsin nötralize edilmesi için (EBSS'ye yapılan)% 30 FBS 5 ml ilave edilir. Yaklaşık 50x için pipetleme plaka yüzeyinden hücreleri çıkarmak.
- Tüm hücre aktarın200 x g'de 15 dakika boyunca yeni bir tüp ve santrifüj süspansiyon.
- Hücre sayımı ve ardından önceden ısıtılmış Sato ortam 1 ml supernatant ve tekrar süspansiyon hücre pelletini atın. Bir beyin diseksiyonu 1,5-2 milyon OPC elde edebilirsiniz.
- Kirpiksi nörotrofik faktör içeren Sato ortam içinde 1 x 10 5 ve 5 x 10 5 10 başına cm plaka arasında bir yoğunlukta, kuru PDL kaplı plakalar üzerine plakası hücreleri (10 mi) (CNTF, 10 ng / ml), örneğin platelet türevi büyüme faktörü 3 (NT3, 1 ng / ml), nörotrofin (PDGF, 10 ng / ml) ve forskolin (4.2 ug / ml), 2,12. 37 ° C 'de kültür OPC,% 8 CO2.
6. İleten OPC
- CNTF ile Sato ortam (10 ml / 10 cm plaka) Kültür birinci OPC (10 ng / ml), PDGF (10 ng / ml), NT3 (1 ng / ml) ve forskolin (4.2 ug / ml), 37 ° C 'de, diseksiyonu sonrası 24 saat% 8 CO 2.
- Tamamen (10 ml OPC kültür ortamı, taze yapılmış SATO medya ile besleme hücreleri aspire), Büyüme faktörleri ile () aşama 6.1'de yukarıya bakın.
- Bir başka 48 saat için, aşama 3 (Şekil 2, adım 4), kültür OPC ile belirlenen en uygun konsantrasyona kadar OPC virüs ekleyin.
Eş-kültür Myelinating 7. OPC Tohum (Şekil 2, adımlar 5 ve 6)
- Iki kez 8 mi EBSS'ye ile yüzeyden OPC, birinci durulama OPC plakaları çıkarmak için, daha sonra sıcak% 0.05 tripsin-EDTA, 5 ml 2 dakika için 37 ° C 'de EBSS'ye ile 1:10 seyreltilmiş, hücreler inkübe edin.
- EBSS'ye içinde% 30 FBS ile tripsin (5 mi) nötralize ve pipetleme hücreleri plakadan çıkarın. Oda sıcaklığında 15 dakika boyunca 180 x g'de 15 ml tüp, santrifüj hücre süspansiyonu aktarın.
- Aspire hücre sayısı ve ardından önceden ısıtılmış SATO medya 1 ml süpernatant ve tekrar süspansiyon hücre pelet kapalı.
- OPC tohumlama öncesinde, DRG kültür plaka tamamen aspire medya. Yavaşça 200.000 OPC DRG nöronlar üzerine damla damla tohum olarak daha önce 4-6 nitelendirdi.
NOT:Toplam OPC tohumlama hacmi 22 mm lamel başına en az 200 ul olmalıdır. - Sonra yavaşça 1 ml önceden ısıtılmış SATO medya ile kontör başına iyi, doku kültürü kaputu 10 dakika süreyle plaka hareket etmeden yerleşmek için hücreleri bırakın.
- Büyüme faktörleri ile SATO medya ile kalan kardeş OPC Replate (adım 6.1). İlgi konusu proteinin ekspresyonunu doğrulamak için bu kardeş OPC kullanın.
- 24 saat sonra,% 1 B27 ile ko-kültür ortamı (2 ml / oyuk) ihtiva eden Sato ortam (hiç faktörler) ve Neurobasal (h / h) ile Sato ortamı değiştirin. Ortam değişikliği ile 14 gün boyunca her 2-3 gün için ko-kültürler koruyun.
- Western blot analizi ile miyelin protein ekspresyonu için ko-kültürler değerlendirmek ve miyelin bazik protein belirteçleri ve nöronal belirteçler 4-6 karşı antikorlar ile çift immüno-boyama ile miyelinli aksonal segmentlerin oluşumu için görsel.
Sonuçlar
FLAG-etiketli hücre dışı sinyal ile ilişkili kinaz 1 (Flag-ERK1) enzim 2K7 yapıları ve virüs üretimi için gerekli olan ambalaj ve aksesuar yapılar, her iki dahil olmak üzere kullanılan yapıların, bir restriksiyon dijest ile doğrulanır lentivirüs üretimi için kullanılan yapı (Şekil 3) .
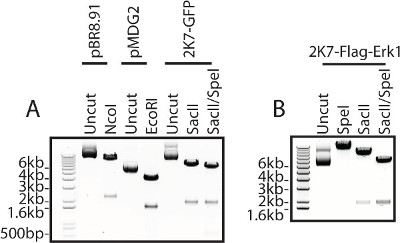
Şekil 3: DNA yapısı doğrulama....
Tartışmalar
Aksonların myelinizasyonuna omurgalıların merkezi ve çevresel sinir sistemlerinde optimal fonksiyonu için önemli bir işlemdir. miyelinli akson nesil ve bakım ve hücre dışı matriks proteinleri (Schwann hücreleri veya oligodendrositler itibaren) moleküler nöronal arasındaki etkileşimleri, glial içeren bir karmaşık ve koordineli bir süreçtir. Bu protokolün önemi ve uygulanabilirliği karışık ko-kültür ayarları içinde belirli bir hücre tipinde proteinlerin manipülasyonu izin vermesidir. Bird...
Açıklamalar
The authors declare that there is no conflict of interest regarding this research.
Teşekkürler
This work was supported by the Australian National Health and Medical Research Council (NHMRC fellowship #454330 to JX, project grant #628761 to SM and APP1058647 to JX), Multiple Sclerosis Research Australia (MSRA #12070 to JX), the University of Melbourne Research Grant Support Scheme and Melbourne Research CI Fellowship to JX as well as Australia Postgraduate Scholarships to HP and AF. We would like to acknowledge the Operational Infrastructure Scheme of the Department of Innovation, Industry and Regional Development, Victoria Australia.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2K7 lentivector | Kind gift from Dr Suter9 | ||
| 5-Fluoro-2′-deoxyuridine | Sigma-Aldrich | F0503-100mg | |
| Alexa Fluor 488 Goat anti-mouse IgG | Jackson Immunoresearch | 115545205 | |
| Alexa Fluor 488 goat anti-rabbit IgG (H+L) | Life Technologies | A11008 | |
| Alexa Fluor 594 goat anti-mouse IgG (H+L) | Life Technologies | A11005 | |
| Alexa Fluor 594 goat anti-rabbit IgG (H+L) | Life Technologies | A11012 | |
| Ampicillin | Sigma-Aldrich | A9518-5G | |
| B27 - NeuroCul SM1 Neuronal Supplement | Stem Cell Technologies | 5711 | |
| BDNF (Human) | Peprotech | PT450021000 | |
| Biotin (d-Biotin) | Sigma Aldrich | B4639 | |
| Bradford Reagent | Sigma Aldrich | B6916-500ML | |
| BSA | Sigma Aldrich | A4161 | |
| Chloramphenicol | Sigma-Aldrich | C0378-100G | |
| CNTF | Peprotech | 450-13020 | |
| DAKO fluoresence mounting media | DAKO | S302380-2 | |
| DMEM, high glucose, pyruvate, no glutamine | Life Technologies | 10313039 | |
| DNase | Sigma-Aldrich | D5025-375KU | |
| DPBS | Life Technologies | 14190250 | |
| DPBS, calcium, magnesium | Life Technologies | 14040182 | |
| EBSS | Life Technologies | 14155063 | |
| EcoRI-HF | NEB | R3101 | |
| Entry vectors for promoter and gene of interest | Generate as per protocols 1-2 | ||
| Fetal Bovine Serum | Sigma-Aldrich | 12003C | |
| Forskolin | Sigma Aldrich | F6886-50MG | |
| Glucose (D-glucose) | Sigma-Aldrich | G7528 | |
| Glycerol | Chem Supply | GL010-500M | See stock solutions |
| Goat Anti-Mouse IgG | Jackson ImmunoResearch | 115005003 | |
| Goat Anti-Mouse IgM | Jackson ImmunoResearch | 115005020 | |
| Goat Anti-Rat IgG | Jackson ImmunoResearch | 112005167 | |
| Hoechst 33342 | Life Technologies | H3570 | |
| Igepal | Sigma Aldrich | I3021-100ML | |
| Insulin | Sigma Aldrich | I6634 | |
| Kanamycin | Sigma-Aldrich | 60615 | |
| Laminin | Life Technologies | 23017015 | |
| LB Medium | See stock solutions | ||
| LB-Agar | See stock solutions | ||
| L-Cysteine | Sigma-Aldrich | C-7477 | |
| Leibovitz's L-15 Medium | Life Technologies | 11415064 | |
| L-Glutamate | Sigma-Aldrich | G1626 | |
| L-Glutamine- 200 mM (100x) liquid | Life Technologies | 25030081 | |
| LR Clonase II Plus enzyme | Life Technologies | 12538-120 | |
| MEM, NEAA, no Glutamine | Life Technologies | 10370088 | |
| Mouse α βIII Tubulin | Promega | G7121 | |
| Mouse αMBP (monoclonal) | Millipore | MAB381 | |
| Na pyruvate | Life Technologies | 11360-070 | |
| NAC | Sigma Aldrich | A8199 | |
| NcoI-HF | NEB | R3193S | |
| NEBuffer 4 | NEB | B7004S | |
| Neurobasal medium | Life Technologies | 21103049 | |
| NGF (mouse) | Alomone Labs | N-100 | |
| NT-3 | Peprotech | 450-03 | |
| O1 antibody - Mouse anti-O1 | Millipore | MAB344 | Alternative if O1 hybridoma cells are unavailable |
| O1 hybridoma cells | Conditioned medium containing anti-O1 antibody to be used for immunopanning | ||
| O4 antibody - Mouse anti-O4 | Millipore | MAB345 | Alternative if O4 hybridoma cells are unavailable |
| O4 hybridoma cells | Conditioned medium containing anti-O4 antibody to be used for immunopanning | ||
| Competent cells | Life Technologies | A10460 | |
| One Shot Stbl competent cells | Life Technologies | C7373-03 | |
| Papain Suspension | Worthington/Cooper | LS003126 | |
| pBR8.91 | Kind gift from Dr Denham10 | ||
| PDGF-AA (Human) | Peprotech | PT10013A500 | |
| Penicillin-streptomycin 100x solution | Life Technologies | 15140122 | |
| pENTRY4IRES2GFP | Invitrogen | 11818-010 | |
| pMD2.G | Addgene | 12259 | |
| Poly-D-lysine | Sigma | P6407-5MG | |
| Polyethylenimine (PEI) | Sigma-Aldrich | 408727-100ML | |
| Poly-L-ornithine | Sigma Aldrich | P3655 | |
| Progesterone | Sigma Aldrich | P8783 | |
| Protease inhibitor tablet (Complete mini) | Roche | 11836153001 | |
| Proteinase K | Supplied with Clonase enzyme | ||
| Putrescine | Sigma Aldrich | P-5780 | |
| Rabbit α neurofilament | Millipore | AB1987 | |
| Rabbit αMBP (polyclonal) | Millipore | AB980 | |
| Ran2 hybridoma cells | ATCC | TIB-119 | Conditioned medium containing anti-Ran2 antibody to be used for immunopanning |
| Rat anti CD140A/PDGFRa antibody | BD Pharmingen | 558774 | |
| SacII | NEB | R0157 | |
| SOC medium | Supplied with competent bacteria | ||
| Sodium selenite | Sigma Aldrich | S5261 | |
| Spe I | NEB | R0133S | |
| T4 DNA Ligase | NEB | M0202S | |
| T4 DNA Ligase Buffer | NEB | B0202S | |
| TE buffer pH8 | See stock solutions | ||
| TNE lysis buffer | |||
| Trace Elements B | Cellgro | 99-175-CI | |
| Transferrin (apo-Transferrin human) | Sigma-Aldrich | T1147 | |
| Triton X-100 | Sigma-Aldrich | T9284 | |
| Trypsin | Sigma-Aldrich | T9201-1G | |
| Trypsin Inhibitor From Chicken Egg White | Roche | 10109878001 | |
| Trypsin-EDTA (1x), phenol red (0.05%) | Life Technologies | 25300-054 | |
| Unconjugated Griffonia Simplicifolia Lectin BSL-1 | Vector laboratories | L-1100 | |
| Uridine | Sigma-Aldrich | U3003-5G |
Referanslar
- Baumann, N., Pham-Dinh, D. Biology of oligodendrocyte and myelin in the mammalian central nervous system. Physiol Rev. 81 (2), 871-927 (2001).
- Watkins, T. A., Emery, B., Mulinyawe, S., Barres, B. A. Distinct stages of myelination regulated by gamma-secretase and astrocytes in a rapidly myelinating CNS coculture system. Neuron. 60 (4), 555-569 (2008).
- Lee, K., et al. MDGAs interact selectively with neuroligin-2 but not other neuroligins to regulate inhibitory synapse development. Proc Natl Acad Sci U S A. 110 (1), 336-341 (2013).
- Xiao, J., et al. BDNF exerts contrasting effects on peripheral myelination of NGF-dependent and BDNF-dependent DRG neurons. J Neurosci. 29 (13), 4016-4022 (2009).
- Chan, J. R., et al. NGF controls axonal receptivity to myelination by Schwann cells or oligodendrocytes. Neuron. 43 (2), 183-191 (2004).
- Xiao, J., et al. Brain-Derived Neurotrophic Factor Promotes Central Nervous System Myelination via a Direct Effect upon Oligodendrocytes. Neurosignals. 18 (3), 186-202 (2010).
- Lundgaard, I., et al. Neuregulin and BDNF induce a switch to NMDA receptor-dependent myelination by oligodendrocytes. PLoS Biology. 11 (12), e1001743 (2013).
- Kleitman, N., W, P. M., Bunge, R. P. . Tissue culture methodes for the study of myelination. , (1991).
- Xiao, J., et al. Extracellular signal-regulated kinase 1/2 signaling promotes oligodendrocyte myelination in vitro. J Neurochem. 122 (6), 1167-1180 (2012).
- Wong, A. W., Xiao, J., Kemper, D., Kilpatrick, T. J., Murray, S. S. Oligodendroglial expression of TrkB independently regulates myelination and progenitor cell proliferation. The Journal of Neuroscience. 33 (11), 4947-4957 (2013).
- Li, Z., et al. Molecular cloning, Characterization and Expression of miR-15a-3p and miR-15b-3p in Dairy Cattle. Molecular and Cellular Probes. , (2014).
- Emery, B., et al. Myelin gene regulatory factor is a critical transcriptional regulator required for CNS myelination. Cell. 138 (1), 172-185 (2009).
- Murai, K., et al. Nuclear receptor TLX stimulates hippocampal neurogenesis and enhances learning and memory in a transgenic mouse model. Proc Natl Acad Sci U S A. 111 (25), 9115-9120 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır