このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
生産と選択的に伝達する一次オリゴデンドロサイト前駆細胞へのレンチを使用するための
要約
Here we present protocols that offer a flexible and strategic foundation for virally manipulating oligodendrocyte precursor cells to overexpress proteins of interest in order to specifically interrogate their role in oligodendrocytes via the in vitro model of central nervous system myelination.
要約
髄鞘形成は、末梢神経系(PNS)のニューロンおよびグリア細胞を形成するミエリン、中枢神経系(CNS)におけるオリゴデンドロサイトおよびシュワン細胞の両方を含む複雑なプロセスである。我々 は、in vitro髄鞘形成アッセイ、in vitroでのCNS ミエリン形成を研究するための確立されたモデルを使用しています。これを行うには、オリゴデンドロサイト前駆細胞(OPCの)髄鞘共培養を形成するために、精製された主要なげっ歯類後根神経節(DRG)ニューロンに添加される。オリゴデンドロサイトによって発現される特定のタンパク質は、ミエリン形成の際に発揮することを、具体的な役割を調べるために、我々は選択的にDRGニューロン上に播種される前に、野生型、構成的に活性またはドミナントネガティブタンパク質を過剰発現するレンチウイルスを使用したOPCを伝達するプロトコルを開発した。これは、私たちは特に髄鞘形成の調節にこれらのオリゴデンドログリアのタンパク質の役割を調べることができます。プロトコルがotの研究にも適用することができる彼女の細胞型は、このようにしてそのようなシグナリング及び補償メカニズムの研究のための標的オリゴデンドロサイトのような所望の細胞型によって発現されるタンパク質の選択的操作を可能にするアプローチを提供する。結論として、レンチウイルスに感染したOPC を用いたin vitro髄鞘形成アッセイを組み合わせること髄鞘形成に関与する分子メカニズムの解析のための戦略的なツールを提供しています。
概要
軸索の髄鞘形成は、両方の中枢神経系および末梢神経系における活動電位の迅速かつ効率的な伝送のために重要である。特殊化した細胞は、シュワン細胞が中枢神経系における末梢神経系およびオリゴデンドロサイトでは、ラップアラウンドおよびミエリンでensheathe軸索、効果的に神経を絶縁し、跳躍伝導1を容易にする。髄鞘形成の過程は、網膜神経節ニューロン2、人工ナノファイバー3、またはシュワン細胞4またはオリゴデンドロサイト5-7のいずれかとの共培養後根神経節ニューロンを用いてインビトロで研究することができる。 インビトロ髄鞘形成アッセイは、神経系のミエリン形成を研究するための確立されたモデルであり、それは、生体内 5-8 のミエリン形成時に発生する基本的なプロセスの多くを複製します。アッセイは、CのためのOPCと後根神経節(DRG)ニューロンの精製集団の共培養を、(関与NSの髄鞘形成)またはシュワン細胞(PNSの髄鞘形成のため)。特定の条件下で、これらの髄鞘形成細胞は、生体内に存在するミエリン特異的タンパク質の同一の相補体を発現する形質膜の絶縁命じ、超構造的に検証され、多層のシートのDRG軸索をensheathe。
インビトロでの CNS の髄鞘形成を研究する最も一般的に使用される細胞モデルに成功などのニューロトロフィンのような外因性因子は、インビトロ 5,6 における CNS髄鞘形成に発揮することの効果を研究するために使用されたDRGニューロンおよびOPCの共培養である。そのような増殖因子または小分子薬理学的阻害剤のような外因性因子は広くDRG-OPC共培養モデル7,9を用いて、髄鞘形成におけるシグナル伝達経路の役割を研究するために使用されている。しかし、ニューロンおよびオリゴデンドロサイトの両方を含む混合共培養の設定で、それは正式に可能残って、成長因子またはPharのいずれかmacological阻害剤は、DRGニューロンおよびオリゴデンドロサイト(OL)の両方に効果を発揮している可能性があります。これは、具体的のみのDRGによって発現されるタンパク質またはオリゴデンドログリアは、このデュアルセルシステムを使用して、髄鞘形成の際に発揮することの役割を分析する機能を提供していますか。明確に乏突起膠細胞におけるシグナル伝達経路を直接インビトロ髄鞘形成アッセイのためのDRGニューロン上に播種する前に、同様に、野生型および変異型タンパク質の両方を過剰発現するためのエレガントな方法であることが証明された髄鞘形成、OPCのレンチウイルス形質導入、調節していることを確認するためにオリゴデンドロサイトによる構成的に発現するタンパク質のノックダウン式として。このように、このアプローチは、具体的に質問すると髄鞘9,10を研究するためのオリゴデンドロサイト内のシグナル伝達経路を操作するための手段を提供しています。
本稿では、我々は、レンチウイルスを経由してオリゴデンドロサイトに選択的に目的のタンパク質を過剰発現するように開発したメソッドを報告in vitroでの髄鞘形成を研究するためのアプローチ。技術は、目的の遺伝子を含む発現ベクターの生成で始まり、続いて、pENTRベクター(をpENTR L1-L2 pENTR4IRES2GFP)にクローニングされた野生型、構成的に活性またはドミナントネガティブ型であること。 (目的の遺伝子を含む)このベクターは、CMVプロモーター供与体(をpENTR L4-R1のpENTR-pDNOR-CMV)および2K7レンチベクターは、CMVプロモーターを含む2K7ベクターは、目的の遺伝子を生成するための酵素反応で合成される内部リボソーム侵入部位およびGFP( 図1)。 PMD2.GウイルスエンベロープとpBR8.91ウイルスパッケージと組み合わせて、このゲートウェイクローニングさ2K7構築物は、その後のOPCを形質導入するために使用することができるレンチウイルスを生成するために、HEK293T細胞に同時トランスフェクトすることができる。一旦OPCは、目的のタンパク質を高レベルで発現するレンチウイルスに感染した。これらのOPCは、その後のDRGニューロン培養と効果発現が上に播種することができる所望のタンパク質の高レベルを調べることができる髄鞘形成に及ぼす。共培養は、ウェスタンブロット分析によってミエリンタンパク質の発現について評価し、免疫細胞化学によって有髄軸索のセグメントを形成するために可視化される。
プロトコル
注:この研究のために使用された全ての動物は雌雄混合のものであり、解剖学&病理学部とメルボルン大学の神経科学と精神衛生研究所のフローリー研究所の動物施設で飼育。すべての動物の手順は、メルボルン大学で動物実験倫理委員会によって承認された。
2K7レンチベクターのクローニング
- 2K7のレンチウイルスベクターに目的の遺伝子をクローニングする前に、標準的な分子技術11を使用して、pENTRベクター(3637塩基対、耐カナマイシン)に遺伝子をサブクローニング。サブクローニングのためにEcoRIおよびSacIIでの制限部位を使用してください。
- 2K7レンチベクターの増幅
- 穏やかにコンピテント細胞にプラスミドDNA 100ngのを混合することにより2K7のレンチベクターDNAを形質転換し、30分間氷上でインキュベートする。
- 熱ショックDNA /コンピテント細胞を90秒間、42℃で混合しampiciの両方を含有するLB寒天プレート上にプレート電話(100μg/ ml)を16〜18時間37℃でクロラムフェニコール(15μg/ ml)を。
NOTE:クロラムフェニコールは、長い末端反復配列間の組換えを防止するために使用される。 - 次の日は、16〜18時間37℃でアンピシリン(100μg/ ml)およびクロラムフェニコール(15μg/ ml)を両方を含むLB培地中で細菌クローンを選択して増殖する。製造元の指示に従って市販のプラスミドDNAマキシプレップキットを用いてDNAを抽出します。
- 2K7レンチベクターへのpENTRベクターからサ ブクローニング( 図1)
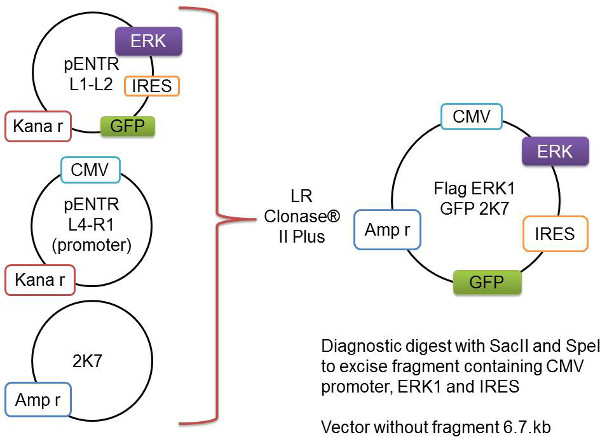
図1:Gateway組換えプロセスの略図目的の遺伝子は、ここでフラッグ酸化Erk1として表される、をpENTR L1-L2ベクターにクローニングする。これは、CMVプロモーターおよびバックボーン2K7ベクターを含むのpENTR L4-R1ベクトルに加算される。これら三つのベクトルはにLRクロナーゼII Plusの酵素によって再結合されるウイルス対応2K7ベクターに関心遺伝子およびプロモーターを挿入します。- 1.5mlチューブに以下を加え、穏やかに混合:
L4-R1のpENTR-pDNOR-CMV(プロモーター)(60 BNG)1〜2.5μL
(80 BNG)1〜2.5μL(目的の遺伝子を持つ)L1-L2 pENTR4IRES2GFP
K7のレンチベクター(80 ng /μLで)1μL
TE緩衝液、pHが82から5μL
トータル8μL - -80℃からクロナーゼ酵素ミックスを削除し、2分間氷上で解凍。この酵素は酵素が実質的に凍結融解の繰り返しでクローニング効率が低下しているとして、-80℃から新鮮な分量であることを確認してください
- 反応あたりの酵素2μl加え、ボルテックスを経由してよく混ぜ、及び6-24時間、23-25℃でクロナーゼ反応混合物をインキュベートする。
- クロナーゼ反応混合物に(酵素キットに付属)プロテイナーゼK溶液1μlを加え、37℃で10分間インキュベートする。
- コンピテント細胞にクロナーゼ反応混合物を変換し、[選択]を育てる16〜18時間、37℃でアンピシリン(100μg/ ml)を含有するLB培地でコロニー。
- 抽出し、製造業者の指示に従って市販のプラスミドDNAミニプレップキットを用いてDNAを精製する。
- のSpe IとのSac II、目的のプロモーターと遺伝子を含む断片を除去するために、メーカーの指示に従って、適切な緩衝液を制限酵素を使用して消化を介してDNAを確認してください。
注:このステップはサブクローン化DNAは右のベクター骨格と関心の正しい挿入遺伝子を持っているかどうかを確認することが重要です。挿入断片を含まないベクター自体のサイズは6.7 KBです。リリースされ挿入された断片の大きさは、プロモーターと目的の挿入遺伝子の両方が含まれています。プラスミドエディタ- たとえば DNA配列編集プログラム、APEを経由して特定の遺伝子のためのダイジェストから予想されるフラグメントサイズを計算。 - DNAベクターバックボーンと1%アガロースゲルを実行して、遊離された断片の両方のサイズを確認する1×TAEバッファー中で100Vで(ストック溶液の表を参照してください)
- 16-18時間、37℃で、アンピシリン(100μg/ ml)を含むLB培地500ml中に細菌を増殖させることによって確認されたDNAを増幅する。
- 抽出し、製造業者の指示に従って市販のプラスミドDNAマキシプレップキットを用いてDNAを精製する。
NOTE:マキシプレップは、典型的には、ウイルス産生のために必要十分な量のDNAを生成する。
- 1.5mlチューブに以下を加え、穏やかに混合:
- 繰り返しは、レンチウイルスの調製のために以下のDNAを増幅するために1.3.9-1.3.10ステップ:エンベロープベクター(PMD2.G、6.1キロバイト)、パッケージのベクトル(pBR8.91、12.5キロバイト)、およびコントロールとして空のレンチウイルスベクター(GFP -CMV-2K7、8.7キロバイト)。
2. 2K7ウイルス産生
注:1日目:
- トランスフェクションの日に、25ミリリットルHEK293 T細胞の培地を含むT175フラスコ中板3200万HEK293 T細胞(原液の表を参照)。また、16日目万個の細胞をプレーティングトランスフェクションの前に時間はトランスフェクション当日にタイトな実行されている場合。
注:トランスフェクションは、トランスフェクションまたは前日までの日に細胞をプレーティングすることによって同じように成功することができます。二つの選択肢のいずれかを使用して、ここで重要な点は、細胞がトランスフェクションの前に培養皿の表面を下に貼り付けることを確認することです。
注意: 2日目: - トランスフェクション
- トランスフェクションの前に、脱イオン水中で10mMトリスpH8の、1mMのEDTA pHが8を含むTE緩衝液中の200μlの1μgの/へDNAを希釈する。
- 50mlのチューブでは、T175フラスコ内でトランスフェクションのためのマスターミックス( 表1)を調製。予め温めためにDNAを追加したダルベッコ改変イーグル培地(DMEM)とボルテックスでよく混ぜ、その後早期の沈殿を避けるために(ストック溶液の表を参照)、滅菌ポリエチレンイミン(PEI)を追加します。 ">
表1:2K7ウイルスの準備トランスフェクションミックス。ベクトル ·チョン> 濃度 ボリューム pMDG.2 を1μg/μL 5μL pBR8.91 を1μg/μL 15μL GFP +目的の遺伝子を持つ2K7ベクトル を1μg/μL 22μL 無菌のポリエチレンイミン(PEI) 1g / Lの 500μL DMEM 2,100μL - チューブ3~4を反転させて十分に混合し、室温(RT)で15分間インキュベートする。
- HEK293T細胞上の完全な培地交換を行います。吸引した細胞からの培地から完全に予め温めたHEK293T細胞培養培地(T175フラスコあたり25ml)でフィードバックする。
- トランスフェクション混合物(DNA / PEI混合物)単層細胞に滴下して追加します。よく混ぜ、一晩37℃、5%CO 2、でトランスフェクトした細胞をインキュベートすることを穏やかに移動する。
注:3日目: - トランスフェクションが成功するようにするには、蛍光顕微鏡でGFP発現24時間後、トランスフェクションをご確認ください。
注記:GFPを発現する細胞の50%以上が一般的に良いトランスフェクションを示している。
注:4日目:
- 48時間後、トランスフェクションでは、ウイルス上清を収集し、新鮮HEK293 Tメディア(T175フラスコあたり25ml)で交換してください。
- 遠心上清から細胞残屑をクリアするために4℃で10分間、1140×gでのウイルス上清。転送は4℃で50ミリリットルチューブとストアに上清をクリア。
注:5日目:
- 遠心上清から細胞残屑をクリアするために4℃で10分間、1140×gでのウイルス上清。転送は4℃で50ミリリットルチューブとストアに上清をクリア。
- 72時間後、トランスフェクションでは、ウイルス上清の第二のバッチを収集します。手順を繰り返し2.3.1とプール48及び72時間に上清をクリア。
- 30ミリリットル超遠心管を用いて、4℃で90分間17万×gでウイルス、遠心分離ウイルス上清を濃縮する。
- 上清を捨て、すべてクリアし、上清をウイルスの(見えない)ペレットを残して、遠心分離プラスチューブの基部にPEI沈殿されるまで、ステップ2.6を繰り返します。
- ウイルスを再懸濁し、超遠心チューブに500μlの佐藤メディア(ストック溶液の表を参照)を追加します。 30秒aの渦ND機械的にウイルスを緩めるためにピペットの先端でチューブの底をこすり。ウイルスペレットを失うためには、このステップ6倍速を繰り返します。
- プールは、マイクロ遠心チューブにウイルスを再懸濁し、不溶性のPEIを除去することは非常に簡単にスピン。タンパク質を除去するために0.45μmのフィルターを通して上清をフィルタリングします。
- -80℃で20μL、50μL、および100μlのアリコートとストアにウイルスをアリコート。
HEK293T細胞3.ウイルス力価の決定
- 目的のタンパク質の発現を確認するために、実験のための最適なウイルス濃度を決定するために、ウイルスストックの連続希釈の一連の追加( 例えば 、0、5、10、20、40、80μlの)に播種したHEK293 T細胞を形質導入する6ウェルプレート、培養を37℃、5%CO 2で24時間インキュベート。このプロトコルは、典型的には1:50〜1の範囲の濃度で使用することができるウイルスを生成し遺伝子の強い発現を達成する200関心。
- プロテアーゼ阻害剤を用いた48時間後にウイルス形質導入、TNE緩衝液で溶解するHEK293T細胞(原液の表を参照)。
- チルドDPBSでウェルを2回すすぎ、その後、各ウェルに150μlのTNE緩衝液を追加します。
- 上下5〜10倍ペッティング行ない、細胞を溶解する。 1.5ミリリットルのマイクロチューブに全細胞溶解物を移し、15〜30分間氷上でインキュベートする。
- 遠心分離機は、最大速度(20,000×gで)転送で30分間4℃で溶解物を、Bradfordによってタンパク質測定およびその後のウェスタンブロット分析のために上清を新しいチューブにクリアする。
- タンパク質自体と融合したタグ( すなわち 、旗)に対する抗体のためにプロービングしながら、標準のウェスタンブロット分析により、目的のタンパク質の発現レベルを決定します。 > 95%のGFP +細胞および実験のための目的のタンパク質の強い発現をもたらすウイルスの希釈を使用してください。
4.単離および培養のDRGの(Figure 2ステップ1&2)
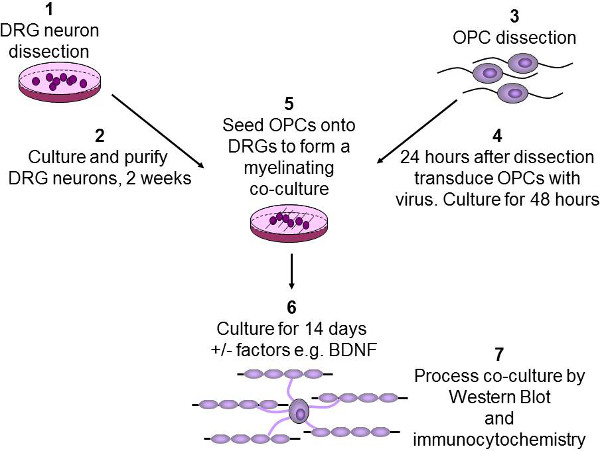
図2: インビトロ髄鞘形成アッセイの模式図 DRGニューロンは二週間(1-2)で精製し、培養した後、P2-3仔ラットから解剖されている。 OPCは(3)を用いたイムノP7-9ラットの脳から精製される。 OPCは、次いで48時間(4)レンチウイルス培養に感染している。 OPCは次いで、DRGを上に播種され、BDNFなどの任意の目的の成長因子は、(5)を添加する。共培養は、その後OPCは軸索(6)を区別し、ミエリン化することを可能にする2週間培養する。最後に、共培養物はどちらウェスタンブロッティングのために溶解または免疫細胞化学のために固定されている(7)。
注:1〜2日前に解剖の日:
- コートは、6ウェルプレート中のポリ-L-オルニチン(0.5mg / ml)を22ミリメートル×22ミリメートルのカバーガラスをオートクレーブ処理し、そして37℃で一晩インキュベートする。
- ラミニン(MEM中に20μg/ ml)を37℃で一晩、組織培養フード中で20分間過剰とドライオフ吸引と再び次の日に、コートカバースリップ。
注:のDRGの解剖および単離:2日目: - 犠牲P2-P3の仔ラット子宮頸離断によって12倍。
- 動物の背中から筋肉を覆う皮膚を削除します。椎孔を開き、そっと脊髄をかき出すために鉗子を使用するようにvannasハサミを使用してください。
- 脊椎の列の間にあるのDRGを摘み取ると3ミリリットルL-15培地を含む33ミリメートルペトリ皿に付着した後、脊髄の神経線維、場所のDRGを遮断。これは、脊髄の各側からDRG 8〜12を集めるために通常可能である
- 転送は、15ミリリットルチューブにL-15メディアと一緒にのDRGを集め、5分間180×gで遠心。
- 吸引物上清をDRGペレットに2ミリリットル0.25%トリプシンを追加し、30分間37℃でインキュベートする。
- トリプシンを停止するにはDRGペレットに(原液の表を参照)、M1培地5mlを追加し、室温で3分間180×gで遠心。
- 上清を吸引し(ない成長因子)2mlに予め温めM1媒体ペレットを再懸濁する。 50倍をピペッティングして、または神経節が分散されるまで、神経節ペレットを粉砕する。 3分間180×gで遠心細胞懸濁液。
- 再懸濁はM1培地中でニューロンを解離させ、ウェル当たり100μl当たり5節で6ウェルプレートにダウンプレート。
- 増殖して非神経細胞を削除するには、添付ファイルを容易にするために4時間のインキュベーションの最小の後、M2メディア(原液の表を参照)、M1メディアと送りニューロンを削除する。 NGF(100ng / mlの)の存在下での培養DRGニューロンは、NGF依存のTrkA発現のDRGの文化を精製する。代替的に、BDNF依存のTrkB EXPRESを精製するBDNF(100ng / mlの)を使用するのDRGを歌う。
- 以下のように2週間抗有糸分裂のM2メディアと交互に(100ng / mlの時+ NGFまたはBDNF)のM1メディアのニューロンを維持します。
- 日にメディアM1(+ 100ng / mlの時のNGFまたはBDNF)を維持:4-6、8-10、1日に12〜14とM2のFDUとメディア(100ng / mlの時のNGFまたはBDNF +)およびウリジンに4、6-8、および10〜12。 M2メディア精製の3サイクル以上が必要です。
- 2週間の抗有糸分裂サイクルを完了した後、さらに一週間だけではM1でのDRGを維持します。 2〜3日ごとM1メディアを変更します。
OPCの5。単離および培養(図2ステップ3)
注:1〜2日前に解剖の日:
- ポリ-D-リジン(PDL、滅菌脱イオン水中10μg/ ml)を4℃で一晩で被覆10cmの組織培養プレート。
注:以前の解剖の1日:2日目: - 3Xのために滅菌脱イオン水でPDLプレートを洗ってください。組織培養フード中〜6時間乾燥することができます。すぐに使用されていない場合は、ラップと店舗4℃で4週間まで。
- イムノ用二次抗体プレートを準備します。 1脳の解剖については、10センチメートルペトリ皿当たりDPBSで45μlのヤギαマウスIgG(15ミリリットル)で2回のIgGプレート(RAN2抗体についてpremyelinatingオリゴデンドロサイトを削除するには星状細胞およびO1抗体を除去するため)、準備。 10センチメートルペトリ皿当たりDPBS中(オリゴデンドロサイト前駆細胞を選択するためのO4抗体)、45μlのヤギαマウスIgM(15ml)中のIgMのための1×プレート。
注:3日目:解剖の日: - パパインバッファー( 表2)の10ミリリットルでパパインの200台を追加し、バッファが明確になるまで37℃でウォームアップ。
表2:パパイン緩衝液の調製。濃度 250ミリリットルのために 最終濃度 EBSS在庫 10倍 25ミリリットル 1X MgSO 4を 100 mMの 2.5ミリリットル 1 mMの グルコース 30パーセント 3ミリリットル 0.46パーセント EGTA 0.5 M 1ミリリットル 2 mMの のNaHCO 3 1 M 6.5ミリリットル 26 mMの 脱イオン水とフィルター滅菌して250ミリリットルにボリュームを起動し - DPを持つすべての二次抗体プレートを洗う3XのためのBS。
- IgGのプレートおよびIgMプレートにO4ハイブリドーマ上にRAN2とO1抗体を注ぐ。 RTで2時間以上のために、これらすべての一次抗体プレートをインキュベートする。
- P7のラットから1脳を解剖。シャープにハサミで子犬を斬首し、ハサミで頭蓋骨を覆う皮膚を削除します。
- 後頭葉、側頭葉からと前頭葉に頭蓋骨の周りにカット。ピンセットを用いて頭蓋骨から脳を取り出し、静かに1ミリリットルのDPBSで35 mmのペトリ皿に移す。
- おおよそハサミまたは滅菌刃で細かく脳をサイコロ。
- L-システインのいくつかの粒子を含有する新たな15mlチューブに予め温めパパイン緩衝液(10ml)でフィルタリングし、次いで濾過パパイン緩衝液に200μlのDNAアーゼ(12500 U / ml)を加える。
- さいの目に切った脳組織にパパインバッファを注ぐ。 90分間37℃でインキュベートする。
- Gentlly転送を25mlピペットを用いて50mlチューブに脳組織を解離沈降させる。
- 、パパインバッファを削除する脳組織の塊を破壊するためにピペッティングにより脳組織とtiturate 5〜10倍に2ミリリットルLoのOVO(オボムコイド)を追加し、新しいチューブに上清のトップ2ミリリットルを解決して削除することができます。
- 脳組織に別の2ミリリットルLoのOVOを追加し、組織のない塊がなくなるまでステップ5.11を繰り返します。トリチュレートはますます積極的に得ることができます。
- 遠心分離機は、200×gで15分間、細胞懸濁液を解離。吸引しオフ上清と10ミリリットルのHi OVOでの再懸濁細胞ペレットと200×gで15分間遠心する。
- 3XのためにDPBSで最初のイムノプレート(RAN 2板)を洗浄します。上清を吸引し、バッファ( 表2)、パン10ミリリットル中に細胞を再懸濁し、最初のイムノプレート(RAN 2板)へ注ぐ。 RTで15分間細胞をインキュベート。
- 3XのためにDPBSで第二イムノプレート(O1プレート)を洗浄します。
- 最初のイムノプレート上でのインキュベーション後に、第二の上に細胞懸濁液を傾けるイムノプレート(O1板)、O1プレートにピペットでバッファし、転送をパンニング1-3 mlのプレートの表面から緩んで細胞をすすぐ。 RTで15分間細胞をインキュベート。
- 第三のイムノプレート(O4プレート)を洗浄します。このプレートは、OPCは、その表面に結合するポジティブ選択プレートである。 3XのためにDPBSでO4プレートを洗浄してください。
- 第イムノプレート上でのインキュベーション後、最終イムノプレート(O4プレート)に細胞を移す、RTで45分間細胞をインキュベートする。このステップは、O4 + OPCが選択されます。
- 最後のイムノプレート(O4プレート)からの上清を吸引および6xためのEBSSでプレートをすすぐ。
- プレートからのOPCを削除するには、暖かい0.05%トリプシン-EDTAの5ミリリットルを用いて細胞を培養するには、8分間37℃でEBSSで1:10に希釈した。
- トリプシンを中和するために30%のFBS(EBSS製)の5ミリリットルを追加します。約50倍のためにピペッティングにより板の表面から細胞を除去する。
- すべてのセルを転送200×gで15分間、新しいチューブと遠心分離機にサスペンション。
- 細胞計数に続いて1ミリリットルで上清と再懸濁細胞ペレット予め温め佐藤メディアを、捨てる。 1脳の解剖は、1.5から2000000のOPCを得ることができる。
- ドライPDL上板細胞は、毛様体神経栄養因子(CNTF、10ng / mlの)を含有するSATO培地(10ml)に、血小板由来増殖因子で10cmプレートあたり1×10 5〜5×10 5の密度でプレートをコーティングした(PDGF、10ng / mlの、)、3(NT3、を1ng / ml)を、ニューロトロフィン、およびフォルスコリン(4.2μg/ ml)を2,12。 37℃、8%CO 2で培養するOPC。
6.変換のOPC
- 37℃でのCNTF(10 ng / ml)を、PDGF(10 ng / ml)を、NT3(1 ng / ml)を、およびフォルスコリン(4.2μg/ ml)を有するSATO培地(10ミリリットル/ 10センチメートルプレート)で培養主要OPCは、切開後24時間、8%CO 2。
- 完全に吸引OPC培養培地から、作りたて佐藤メディアとの飼料細胞(10ミリリットル)増殖因子と(ステップ6.1において上記参照)。
- さらに48時間、ステップ3で決定された最適濃度( 図2、ステップ4)、文化のOPCへのOPCにウイルスを追加します。
共培養をミエリン形成7. OPC播種(図2は、5と6ステップ)
- 二回8ミリリットルEBSSで表面からOPCは、第一のリンスOPCプレートを削除するには、その後暖かい0.05%トリプシン-EDTAの5ミリリットルを2分間37℃でEBSSで1:10に希釈で細胞を培養する。
- EBSSでは30%FBS(5ml)でトリプシンを中和し、ピペッティングによりプレートから細胞を除去する。 、15mlチューブにRTで15分間180×gで遠心分離し、細胞懸濁液を移す。
- 細胞数に続いて吸引し上清オフと1ミリリットル中に細胞ペレットを再懸濁予め温め佐藤メディア。
- OPCの播種に先立ち、DRG培養プレートから完全に培地を吸引。静かに20万OPCはDRGニューロン上に滴下シードとして以前に4-6について説明した。
注意:総OPC播種ボリュームは22ミリメートルのカバースリップあたり200μl未満でなければなりません。 - その後静かに1ミリリットル予め温め佐藤メディアに補充するウェル当たり、組織培養フード中で10分間プレートを移動せずに決済する細胞のままにしておきます。
- 増殖因子と佐藤メディアとの残りの姉妹のOPCをReplate(ステップ6.1を参照)。目的のタンパク質の発現を確認するために、これらの姉妹のOPCを使用してください。
- 24時間後、1%のB27との共培養培地(2ミリリットル/ウェル)を含有するSATO培地(なし因子)および神経基礎(v / v)を用いてSATO培地を交換する。 2〜3日ごとに培地を交換し、14日間共培養を維持します。
- ウェスタンブロット分析によりミエリンタンパク質の発現のための共培養物を評価し、ミエリン塩基性タンパク質マーカー及びニューロンマーカー4-6に対する抗体で二重免疫染色によりミエリン化軸索のセグメントを形成するために可視化する。
結果
レンチウイルス産生のために使用されるフラッグタグ化細胞外シグナル関連キナーゼ1(フラッグのErk1)構築物を酵素2K7構築物およびウイルス産生に必要なパッケージングおよびアクセサリーのコンストラクト( 図3)の両方を含む、使用した構築物の制限消化によって確認される。
ディスカッション
軸索の髄鞘形成は、脊椎動物の中枢神経系および末梢神経系の両方の最適な機能のために重要なプロセスである。髄軸索の生成と維持管理は、神経、(シュワン細胞またはオリゴデンドロサイトから)グリアと細胞外マトリックスタンパク質との間の分子間相互作用を含む複雑かつ協調的なプロセスである。このプロトコルの重要性と適用性は、混合、共培養の設定内の1つの特定の細胞型に...
開示事項
The authors declare that there is no conflict of interest regarding this research.
謝辞
This work was supported by the Australian National Health and Medical Research Council (NHMRC fellowship #454330 to JX, project grant #628761 to SM and APP1058647 to JX), Multiple Sclerosis Research Australia (MSRA #12070 to JX), the University of Melbourne Research Grant Support Scheme and Melbourne Research CI Fellowship to JX as well as Australia Postgraduate Scholarships to HP and AF. We would like to acknowledge the Operational Infrastructure Scheme of the Department of Innovation, Industry and Regional Development, Victoria Australia.
資料
| Name | Company | Catalog Number | Comments |
| 2K7 lentivector | Kind gift from Dr Suter9 | ||
| 5-Fluoro-2′-deoxyuridine | Sigma-Aldrich | F0503-100mg | |
| Alexa Fluor 488 Goat anti-mouse IgG | Jackson Immunoresearch | 115545205 | |
| Alexa Fluor 488 goat anti-rabbit IgG (H+L) | Life Technologies | A11008 | |
| Alexa Fluor 594 goat anti-mouse IgG (H+L) | Life Technologies | A11005 | |
| Alexa Fluor 594 goat anti-rabbit IgG (H+L) | Life Technologies | A11012 | |
| Ampicillin | Sigma-Aldrich | A9518-5G | |
| B27 - NeuroCul SM1 Neuronal Supplement | Stem Cell Technologies | 5711 | |
| BDNF (Human) | Peprotech | PT450021000 | |
| Biotin (d-Biotin) | Sigma Aldrich | B4639 | |
| Bradford Reagent | Sigma Aldrich | B6916-500ML | |
| BSA | Sigma Aldrich | A4161 | |
| Chloramphenicol | Sigma-Aldrich | C0378-100G | |
| CNTF | Peprotech | 450-13020 | |
| DAKO fluoresence mounting media | DAKO | S302380-2 | |
| DMEM, high glucose, pyruvate, no glutamine | Life Technologies | 10313039 | |
| DNase | Sigma-Aldrich | D5025-375KU | |
| DPBS | Life Technologies | 14190250 | |
| DPBS, calcium, magnesium | Life Technologies | 14040182 | |
| EBSS | Life Technologies | 14155063 | |
| EcoRI-HF | NEB | R3101 | |
| Entry vectors for promoter and gene of interest | Generate as per protocols 1-2 | ||
| Fetal Bovine Serum | Sigma-Aldrich | 12003C | |
| Forskolin | Sigma Aldrich | F6886-50MG | |
| Glucose (D-glucose) | Sigma-Aldrich | G7528 | |
| Glycerol | Chem Supply | GL010-500M | See stock solutions |
| Goat Anti-Mouse IgG | Jackson ImmunoResearch | 115005003 | |
| Goat Anti-Mouse IgM | Jackson ImmunoResearch | 115005020 | |
| Goat Anti-Rat IgG | Jackson ImmunoResearch | 112005167 | |
| Hoechst 33342 | Life Technologies | H3570 | |
| Igepal | Sigma Aldrich | I3021-100ML | |
| Insulin | Sigma Aldrich | I6634 | |
| Kanamycin | Sigma-Aldrich | 60615 | |
| Laminin | Life Technologies | 23017015 | |
| LB Medium | See stock solutions | ||
| LB-Agar | See stock solutions | ||
| L-Cysteine | Sigma-Aldrich | C-7477 | |
| Leibovitz's L-15 Medium | Life Technologies | 11415064 | |
| L-Glutamate | Sigma-Aldrich | G1626 | |
| L-Glutamine- 200 mM (100x) liquid | Life Technologies | 25030081 | |
| LR Clonase II Plus enzyme | Life Technologies | 12538-120 | |
| MEM, NEAA, no Glutamine | Life Technologies | 10370088 | |
| Mouse α βIII Tubulin | Promega | G7121 | |
| Mouse αMBP (monoclonal) | Millipore | MAB381 | |
| Na pyruvate | Life Technologies | 11360-070 | |
| NAC | Sigma Aldrich | A8199 | |
| NcoI-HF | NEB | R3193S | |
| NEBuffer 4 | NEB | B7004S | |
| Neurobasal medium | Life Technologies | 21103049 | |
| NGF (mouse) | Alomone Labs | N-100 | |
| NT-3 | Peprotech | 450-03 | |
| O1 antibody - Mouse anti-O1 | Millipore | MAB344 | Alternative if O1 hybridoma cells are unavailable |
| O1 hybridoma cells | Conditioned medium containing anti-O1 antibody to be used for immunopanning | ||
| O4 antibody - Mouse anti-O4 | Millipore | MAB345 | Alternative if O4 hybridoma cells are unavailable |
| O4 hybridoma cells | Conditioned medium containing anti-O4 antibody to be used for immunopanning | ||
| Competent cells | Life Technologies | A10460 | |
| One Shot Stbl competent cells | Life Technologies | C7373-03 | |
| Papain Suspension | Worthington/Cooper | LS003126 | |
| pBR8.91 | Kind gift from Dr Denham10 | ||
| PDGF-AA (Human) | Peprotech | PT10013A500 | |
| Penicillin-streptomycin 100x solution | Life Technologies | 15140122 | |
| pENTRY4IRES2GFP | Invitrogen | 11818-010 | |
| pMD2.G | Addgene | 12259 | |
| Poly-D-lysine | Sigma | P6407-5MG | |
| Polyethylenimine (PEI) | Sigma-Aldrich | 408727-100ML | |
| Poly-L-ornithine | Sigma Aldrich | P3655 | |
| Progesterone | Sigma Aldrich | P8783 | |
| Protease inhibitor tablet (Complete mini) | Roche | 11836153001 | |
| Proteinase K | Supplied with Clonase enzyme | ||
| Putrescine | Sigma Aldrich | P-5780 | |
| Rabbit α neurofilament | Millipore | AB1987 | |
| Rabbit αMBP (polyclonal) | Millipore | AB980 | |
| Ran2 hybridoma cells | ATCC | TIB-119 | Conditioned medium containing anti-Ran2 antibody to be used for immunopanning |
| Rat anti CD140A/PDGFRa antibody | BD Pharmingen | 558774 | |
| SacII | NEB | R0157 | |
| SOC medium | Supplied with competent bacteria | ||
| Sodium selenite | Sigma Aldrich | S5261 | |
| Spe I | NEB | R0133S | |
| T4 DNA Ligase | NEB | M0202S | |
| T4 DNA Ligase Buffer | NEB | B0202S | |
| TE buffer pH8 | See stock solutions | ||
| TNE lysis buffer | |||
| Trace Elements B | Cellgro | 99-175-CI | |
| Transferrin (apo-Transferrin human) | Sigma-Aldrich | T1147 | |
| Triton X-100 | Sigma-Aldrich | T9284 | |
| Trypsin | Sigma-Aldrich | T9201-1G | |
| Trypsin Inhibitor From Chicken Egg White | Roche | 10109878001 | |
| Trypsin-EDTA (1x), phenol red (0.05%) | Life Technologies | 25300-054 | |
| Unconjugated Griffonia Simplicifolia Lectin BSL-1 | Vector laboratories | L-1100 | |
| Uridine | Sigma-Aldrich | U3003-5G |
参考文献
- Baumann, N., Pham-Dinh, D. Biology of oligodendrocyte and myelin in the mammalian central nervous system. Physiol Rev. 81 (2), 871-927 (2001).
- Watkins, T. A., Emery, B., Mulinyawe, S., Barres, B. A. Distinct stages of myelination regulated by gamma-secretase and astrocytes in a rapidly myelinating CNS coculture system. Neuron. 60 (4), 555-569 (2008).
- Lee, K., et al. MDGAs interact selectively with neuroligin-2 but not other neuroligins to regulate inhibitory synapse development. Proc Natl Acad Sci U S A. 110 (1), 336-341 (2013).
- Xiao, J., et al. BDNF exerts contrasting effects on peripheral myelination of NGF-dependent and BDNF-dependent DRG neurons. J Neurosci. 29 (13), 4016-4022 (2009).
- Chan, J. R., et al. NGF controls axonal receptivity to myelination by Schwann cells or oligodendrocytes. Neuron. 43 (2), 183-191 (2004).
- Xiao, J., et al. Brain-Derived Neurotrophic Factor Promotes Central Nervous System Myelination via a Direct Effect upon Oligodendrocytes. Neurosignals. 18 (3), 186-202 (2010).
- Lundgaard, I., et al. Neuregulin and BDNF induce a switch to NMDA receptor-dependent myelination by oligodendrocytes. PLoS Biology. 11 (12), e1001743 (2013).
- Kleitman, N., W, P. M., Bunge, R. P. . Tissue culture methodes for the study of myelination. , (1991).
- Xiao, J., et al. Extracellular signal-regulated kinase 1/2 signaling promotes oligodendrocyte myelination in vitro. J Neurochem. 122 (6), 1167-1180 (2012).
- Wong, A. W., Xiao, J., Kemper, D., Kilpatrick, T. J., Murray, S. S. Oligodendroglial expression of TrkB independently regulates myelination and progenitor cell proliferation. The Journal of Neuroscience. 33 (11), 4947-4957 (2013).
- Li, Z., et al. Molecular cloning, Characterization and Expression of miR-15a-3p and miR-15b-3p in Dairy Cattle. Molecular and Cellular Probes. , (2014).
- Emery, B., et al. Myelin gene regulatory factor is a critical transcriptional regulator required for CNS myelination. Cell. 138 (1), 172-185 (2009).
- Murai, K., et al. Nuclear receptor TLX stimulates hippocampal neurogenesis and enhances learning and memory in a transgenic mouse model. Proc Natl Acad Sci U S A. 111 (25), 9115-9120 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved