A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ייצור ושימוש בLentivirus לתאי סלקטיבי transduce הראשי oligodendrocyte מבשר ל
In This Article
Summary
Here we present protocols that offer a flexible and strategic foundation for virally manipulating oligodendrocyte precursor cells to overexpress proteins of interest in order to specifically interrogate their role in oligodendrocytes via the in vitro model of central nervous system myelination.
Abstract
Myelination הוא תהליך מורכב שכרוכים בשני תאי עצב ותאי גליה המיאלין יוצרים, oligodendrocytes במערכת העצבים המרכזית (CNS) ותאי שוואן במערכת העצבים ההיקפית (PNS). אנו משתמשים במבחנה assay myelination, מודל שנקבע ללימוד myelination CNS במבחנה. כדי לעשות זאת, תאי מבשר oligodendrocyte (OPCs) מתווספים לנוירונים המטוהרים גנגליון שורש הגבי מכרסם העיקרי (DRG) כדי ליצור שיתוף תרבויות myelinating. על מנת לחקור את אופן ספציפי התפקידים שחלבונים מסוימים שהביעו oligodendrocytes מפעילים על myelination פיתחנו פרוטוקולים שסלקטיבי transduce OPCs באמצעות lentivirus ביתר סוג בר, חלבונים שליליים פעילים constitutively או דומיננטיים לפני שזורע על נוירונים DRG. זה מאפשר לנו לחקור את אופן ספציפי את התפקידים של חלבוני oligodendroglial אלה בויסות myelination. יכולים להיות מיושמים גם בפרוטוקולים במחקר של otסוגי תאיה, ובכך לספק גישה המאפשרת מניפולציה סלקטיבית של חלבונים לידי ביטוי בסוג תא רצוי, כגון oligodendrocytes למחקר הממוקד של איתות ומנגנוני פיצוי. לסיכום, שילוב של assay myelination במבחנה עם OPCs lentiviral נגוע מספק כלי אסטרטגי לניתוח של מנגנונים מולקולריים המעורבים בmyelination.
Introduction
Myelination של אקסונים הוא חיוני להעברה מהירה ויעילה של פוטנציאל פעולה בשתי מערכות העצבים המרכזיות והיקפיות. תאים מיוחדים, תאי שוואן במערכת העצבים ההיקפית וoligodendrocytes במערכת העצבים המרכזית, לעטוף וensheathe האקסונים במיאלין, ביעילות בידוד העצב והקלת הולכה קופצנית 1. תהליך היווצרות של מעטפת המיאלין ניתן ללמוד במבחנה באמצעות נוירונים ברשתית גנגליון 2, nanofibers המהונדס 3, או נוירונים גנגליון שורש הגבי שיתוף תרבותי עם שני תאי שוואן 4 או oligodendrocytes 5-7. Assay myelination במבחנה הוא מודל הוקם לחקר myelination מערכת עצבים וזה משכפל רב של התהליכים הבסיסיים המתרחשים במהלך myelination in vivo 5-8. Assay כרוך coculture של אוכלוסיות מטוהרים של הגבי שורש גנגליון (DRG) נוירונים, עם OPCs (לגmyelination NS) או בתאי שוואן (לmyelination PNS). בתנאים מסוימים תאי myelinating אלה ensheathe אקסונים DRG במאומת מבני גיליון הורה, אולטרה, רב-שבשבת של בידוד קרום פלזמה המבטא את אותו משלים של חלבונים ספציפיים המיאלין הנוכחיים in vivo.
מודל התא הנפוץ ביותר של לימוד myelination CNS במבחנה הוא שיתוף התרבויות של נוירונים DRG וOPCs, אשר שימשו בהצלחה כדי לחקור את ההשפעה שגורמים אקסוגניים כגון neurotrophins להפעיל על myelination CNS במבחנה 5,6. גורמים אקסוגניים כגון גורמי גדילה או מעכבים תרופתיים מולקולה קטן היו בשימוש נרחב כדי ללמוד את התפקיד של מסלולי איתות בmyelination באמצעות 7,9 מודל coculture DRG-OPC. עם זאת, בהגדרות שיתוף התרבות המעורבות המכילות שני תאי העצב וoligodendrocytes, הוא נשאר באופן רשמי ייתכן שגם גורמי גדילה או pharמעכבי macological יכלו הפעילו השפעות על שני נוירונים DRG וoligodendrocytes (OL). זה עושה מציע את היכולת לנתח באופן ספציפי התפקידים שהחלבונים לידי ביטוי רק על ידי DRGs או oligodendroglia מפעיל על myelination באמצעות מערכת תא הכפולה הזה. כדי לאשר באופן חד משמעי כי מסלול האיתות בoligodendroglial ישירות מסדיר myelination, התמרה lentiviral של OPCs, לפני זריעה על נוירונים DRG לassay myelination במבחנה, הוכיח להיות דרך אלגנטית לביטוי יתר שני wild-type וחלבוני מוטציה, כמו גם כביטוי מציאה של חלבונים הביעו constitutively ידי oligodendrocytes. כך גישה זו מציעה שדרת לחקור באופן ספציפי ולטפל מסלולי איתות תוך oligodendrocytes ללימוד myelination 9,10.
במאמר זה, אנו מדווחים שיטות שפיתחנו לביטוי יתר של חלבון של עניין באופן סלקטיבי בoligodendrocytes באמצעות lentiviralגישה ללימוד myelination במבחנה. הטכניקה מתחילה עם הדור של וקטורי ביטוי המכילים את הגן של עניין, יהיה זה בסוג בר, צורה שלילית פעילה constitutively או דומיננטית אשר לאחר מכן משובטות לאחר מכן לתוך וקטור pENTR (pENTR L1-L2 pENTR4IRES2GFP). וקטור זה (המכיל את הגן של עניין), תורם promotor CMV (pENTR L4-R1 pENTR-pDNOR-CMV) וlentivector 2K7 משולבים בתגובת אנזים לייצר וקטור 2K7 מכיל אמרגן CMV, הגן של עניין, אתר פנימי ריבוזומלי כניסה וGFP (איור 1). מבנה זה Gateway המשובט 2K7 בשילוב עם מעטפת וירוס PMD2.G וחבילת וירוס pBR8.91 יכול להיות שותף transfected לתאי HEK293T ליצור lentivirus שלאחר מכן ניתן להשתמש כדי transduce OPCs. ברגע שנדבק בlentivirus OPCs להביע רמה גבוהה של החלבון של עניין. אז יכול להיות שנזרע OPCs אלה על תרבויות נוירון DRG ועל ההשפעה שביטוירמות גבוהות של החלבון הרצוי מפעילה על myelination יכול להיחקר. שיתוף התרבויות מוערכות לביטוי חלבון המיאלין על ידי ניתוח כתם מערבי ומדמיינות ליצירת מגזרי axonal myelinated ידי immunocytochemistry.
Protocol
הערה: כל בעלי החיים המשמשים למחקר זה היו מעורב מין וגדלה במתחם בעלי החיים מהמחלקה לאנטומיה ופתולוגיה ומכון Florey of Neuroscience והמחקר לבריאות נפש באוניברסיטת מלבורן. נהלי כל החיה אושרו על ידי בעלי החיים ועדות אתיקה לניסויים באוניברסיטת מלבורן.
1. שיבוט של 2K7 Lentivector
- לפני שיבוט הגן של עניין לתוך וקטור lentiviral 2K7, subclone הגן לתוך וקטור pENTR (3637 נ"ב, Kanamycin עמיד) תוך שימוש בטכניקות מולקולריות סטנדרטיים 11. השתמש באתרי הגבלת EcoRI וSacII לsubcloning.
- הגברה של Lentivector 2K7
- להפוך DNA lentivector 2K7 בעדינות על ידי הערבוב של ה- DNA פלסמיד עם תאים מוסמכים 100 ng ולדגור על קרח למשך 30 דקות.
- DNA הלם חום / תאים מוסמכים לערבב על 42 מעלות צלזיוס למשך 90 שניות וצלחת אותם על צלחות LB-אגר המכילות את שני ampicillin (100 מיקרוגרם / מיליליטר) וכלורמפניקול (15 מיקרוגרם / מיליליטר) ב 37 מעלות צלזיוס במשך 16-18 שעות.
הערה: כלורמפניקול משמש למניעת רקומבינציה בין חזרות מסוף הארוכות. - למחרת, לגדול נבחרו שיבוטים חיידקים בתקשורת LB המכילה את שני אמפיצילין (100 מיקרוגרם / מיליליטר) וכלורמפניקול (15 מיקרוגרם / מיליליטר) ב 37 מעלות צלזיוס במשך 16-18 שעות. חלץ את ה- DNA באמצעות פלסמיד המסחרי ערכת DNA Maxiprep לפי הוראות יצרן.
- תת-שיבוט מוקטור pENTR ל2K7 Lentivector (איור 1)
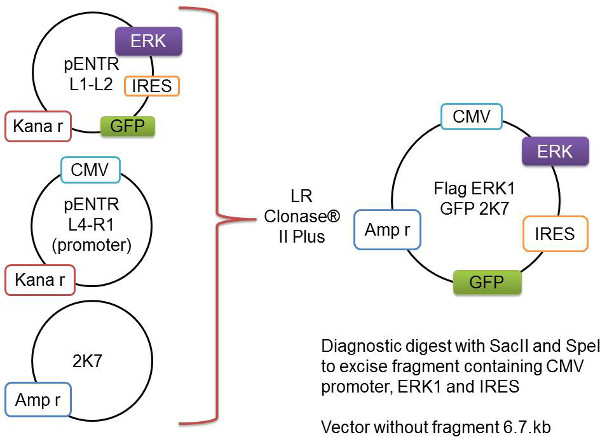
איור 1:. ייצוג סכמטי של תהליך רקומבינציה Gateway הגן של עניין, כאן מיוצג כדגל-Erk1, הוא משובט לתוך וקטור pENTR L1-L2. זה מתווסף לוקטור pENTR L4-R1 המכיל את אמרגן CMV ווקטור 2K7 עמוד השדרה. שלושת וקטורים אלה recombined על ידי אנזים LR Clonase II Plus להכנס את הגן-של-עניין והאמרגן לתוך וקטור 2K7 וירוס-מוכן.- להוסיף את הדברים הבאים לצינור 1.5 מ"ל ומערבבים בעדינות:
L4-R1 pENTR-pDNOR-CMV (אמרגן) (60 BNG) 1-2.5 μl
L1-L2 pENTR4IRES2GFP (עם גן של עניין) (80 BNG) 1-2.5 μl
lentivector K7 (80 ng / μl) 1 μl
TE-חיץ, μl 82-5 pH
8 μl סה"כ - הסר תערובת אנזים clonase מ-80 ° C ולהפשיר על קרח למשך 2 דקות. ודא שאנזים זה הוא aliquot טרי מ-80 מעלות צלזיוס כאנזים צמצם באופן משמעותי את יעילות שיבוט עם להקפיא להפשיר מחזורים חוזרים ונשנים
- הוסף 2 μl של אנזים לכל תגובה ומערבבים היטב באמצעות מערבולת, ודגירת תערובת תגובת clonase ב23-25 מעלות צלזיוס למשך 6-24 שעות.
- הוסף 1 μl של פתרון proteinase K (מסופק עם ערכת אנזים) לתערובת תגובת clonase ודגירה של 10 דקות על 37 מעלות צלזיוס.
- להפוך תערובת תגובת clonase לתוך תאים מוסמכים ולגדול בחרמושבות בתקשורת LB המכילה אמפיצילין (100 מיקרוגרם / מיליליטר) ב 37 מעלות צלזיוס במשך 16-18 שעות.
- לחלץ ולטהר DNA באמצעות פלסמיד המסחרי ערכת DNA Miniprep לפי הוראות יצרן.
- אשר את ה- DNA באמצעות אנזימי עיכול באמצעות הגבלת Spe אני וSac השני ומאגר מתאים בהתאם להוראה של היצרן כדי להסיר את הקטע המכיל את האמרגן וגן של עניין.
הערה: שלב זה הוא קריטי כדי לבדוק אם DNA subcloned יש גן להכניס הנכון של עניין עם עמוד השדרה הווקטור תקין. גודלו של הווקטור עצמו ללא בר הוכנס הוא 6.7 kb. גודל שוחרר הבר הוכנס כולל גם את האמרגן וגן להוסיף עניין. לחשב את גודל השבר הצפוי מהתקציר עבור גן המסוים באמצעות תכנית רצף ה- DNA עריכה, למשל, APE - פלסמיד עורך. - בדקו את הגדלים של שני עמוד השדרה וקטור DNA והבר שפורסם על ידי פועל ג'ל agarose 1%במאגר 1x טה (ראה טבלה של פתרונות מניות) ב 100 V.
- להגביר את ה- DNA אישר על ידי גידול חיידקים ב500 מיליליטר של תקשורת LB המכילה אמפיצילין (100 מיקרוגרם / מיליליטר) ב 37 מעלות צלזיוס במשך 16-18 שעות.
- לחלץ ולטהר DNA באמצעות פלסמיד המסחרי ערכת DNA Maxiprep לפי הוראות יצרן.
הערה: Maxiprep בדרך כלל מייצר כמות מספקת של DNA הנדרשת לייצור נגיפי.
- להוסיף את הדברים הבאים לצינור 1.5 מ"ל ומערבבים בעדינות:
- חזור על שלבים 1.3.9-1.3.10 כדי להגביר את DNAs הבא להכנות lentiviral: וקטור מעטפה (PMD2.G, 6.1 kb), וקטור חבילה (pBR8.91, 12.5 kb), ווקטור lentiviral ריק כביקורת (GFP -CMV-2K7, 8.7 kb).
ייצור וירוס 2. 2K7
הערה: יום 1:
- ביום transfection, צלחת 32 מיליון תאי T HEK293 בבקבוק T175 המכיל 25 מיליליטר תקשורת סלולארי HEK293 T (ראו טבלה של פתרונות מניות). לחלופין, צלחת 16 מיליון תאים ביוםלפני transfection אם נגמר זמן הדוק ביום transfection.
הערה: Transfection יכול להיות מוצלח באותה מידה על ידי תאי ציפוי ביום transfection או לפני היום. באמצעות אחת משתי החלופות, הנקודה הקריטית כאן היא להפוך את התאים בטוחים להיות תקועים על פני השטח צלחת תרבות לפני transfection.
הערה: יום 2: - Transfection
- לפני transfection, לדלל DNA 1 מיקרוגרם / μl בTE מאגר המכיל 10 מ"מ טריס pH 8, 1 mM EDTA pH 8 במים ללא יונים.
- בשפופרת 50 מיליליטר, להכין תערובת הורים (טבלת 1) לtransfection בבקבוק T175. להוסיף DNA למחומם מראש הנשר בינוני השתנה Dulbecco (DMEM) ומערבבים היטב על ידי מערבולת, ולאחר מכן להוסיף polyethylenimine סטרילי (PEI) (ראה הטבלה של פתרונות מניות), כדי למנוע משקעים מוקדמים. ">
טבלת 1: תערובת transfection הכנה לוירוס 2K7.וקטור trong> ריכוז נפח pMDG.2 1 מיקרוגרם / μl 5 μl pBR8.91 1 מיקרוגרם / μl 15 μl וקטור 2K7 עם GFP + גן של עניין 1 מיקרוגרם / μl 22 μl Polyethylenimine סטרילי (PEI) g 1 / L 500 μl DMEM 2,100 μl - מערבבים היטב על ידי היפוך 3-4x צינור דגירה במשך 15 דקות בטמפרטורת חדר (RT).
- לבצע שינוי תקשורת מלא בתאי HEK293T. לשאוב את התקשורת והתרבות מהתאים לחלוטין ולהאכיל עם תקשורת מחוממת מראש תרבית תאי HEK293T (25 מיליליטר לכל בקבוק T175).
- מוסיף את תערובת transfection (DNA תערובת / PEI) שחרר חכם תאי monolayer. העבר בעדינות לתערובת היטב דגירה תאי transfected על 37 מעלות צלזיוס, 5% CO 2, לילה.
הערה: יום 3: - כדי להבטיח את transfection הוא מוצלח, לבדוק הביטוי של GFP לאחר transfection 24 שעות באמצעות מיקרוסקופ פלואורסצנטי.
הערה: מעל 50% מתאים המבטאים GFP בדרך כלל מציין transfection טוב.
הערה: יום 4:
- שבלאחר transfection 48 שעות, לאסוף את supernatant ויראלי ולהחליף עם תקשורת טרי HEK293 T (25 מיליליטר לכל בקבוק T175).
- צנטריפוגה supernatant ויראלי ב1,140 XG במשך 10 דקות ב 4 ° C כדי לנקות את פסולת תא מsupernatant. העברה פינתה supernatant לצינור 50 מ"ל ולאחסן ב 4 מעלות צלזיוס.
הערה: יום 5:
- צנטריפוגה supernatant ויראלי ב1,140 XG במשך 10 דקות ב 4 ° C כדי לנקות את פסולת תא מsupernatant. העברה פינתה supernatant לצינור 50 מ"ל ולאחסן ב 4 מעלות צלזיוס.
- ב 72 שעות שלאחר transfection, לאסוף את המנה השנייה של supernatant ויראלי. חזור על שלב 2.3.1 ובריכה 48 ו -72 שעות פינו supernatants.
- לרכז את הנגיף, supernatant ויראלי צנטריפוגות ב 170,000 XG למשך 90 דקות ב 4 ° C באמצעות 30 מיליליטר צינורות ultracentrifuge.
- בטל supernatant וחזור על שלב 2.6 עד שכל supernatant פינה כבר centrifuged עוזב גלולה (בלתי נראית) של וירוס בתוספת זירז PEI בבסיס של הצינור.
- לresuspend וירוס, להוסיף מדיה SATO 500 μl (ראה טבלה של פתרונות מניות) לצינורות ultracentrifuge. מערבולת 30 שניותnd לגרד הבסיס של הצינור עם קצה פיפטה כדי לשחרר את הווירוס באופן מכאני. חזור 6x שלב זה כדי לאבד גלולה ויראלי.
- בריכת וירוס resuspended לתוך צינורות microcentrifuge ספין לזמן קצר מאוד כדי להסיר PEI מסיס. סנן את supernatant דרך פילטר 0.45 מיקרומטר להסיר חלבונים.
- Aliquot הווירוס לתוך 20 μl, 50 μl, ו- 100 aliquots μl ולאחסן ב -80 ° C.
3. קביעת כייל נגיף בתאי HEK293T
- כדי לבדוק את הביטוי של חלבון של עניין וכדי לקבוע את הריכוז הנגיפי האופטימלי לניסויים, להוסיף שורה של דילולים סדרתי של מניית ויראלי (למשל, 0, 5, 10, 20, 40, 80 μl) לtransduce תאי T HEK293 מצופים ב 6-גם צלחות, ותרבות למשך 24 שעות על 37 מעלות צלזיוס, 5% CO 2. פרוטוקול זה בדרך כלל יוצר וירוס שיכול לשמש בריכוזים הנעים בין 01:50 עד 1: 200 שהשיג ביטוי חזק של הגן שלריבית.
- התמרה 48 שעות שלאחר נגיפית, תאי lyse HEK293T במאגר TNE (ראה טבלה של פתרון מניות) עם מעכבי פרוטאז.
- יש לשטוף את בארות פעמיים עם DPBS המקורר ולאחר מכן להוסיף למאגר TNE 150 μl היטב כל אחד.
- תאי Lyse ידי pipetting מעלה ומטה 5-10x. העבר את lysates תא השלם לצינור microcentrifuge 1.5 מ"ל ולדגור על קרח במשך 15-30 דקות.
- צנטריפוגה lysates על 4 מעלות צלזיוס למשך 30 דקות במהירות המרבית (20,000 XG) והעברה פינתה supernatant לצינור טרי לקביעת חלבון על ידי ברדפורד וניתוח כתם מערבי שלאחר מכן.
- לקבוע את רמת הביטוי של החלבון של עניין על ידי ניתוח כתם מערבי סטנדרטי תוך חיטוט לנוגדנים נגד החלבון עצמו ואת התג התמזגו (כלומר, הדגל). השתמש בדילול הנגיפי שמניב תאי GFP> 95% + וביטוי חזק של חלבון של עניין לניסויים.
4. בידוד והתרבות של DRGs (Figure 2 שלבים 1 ו -2)
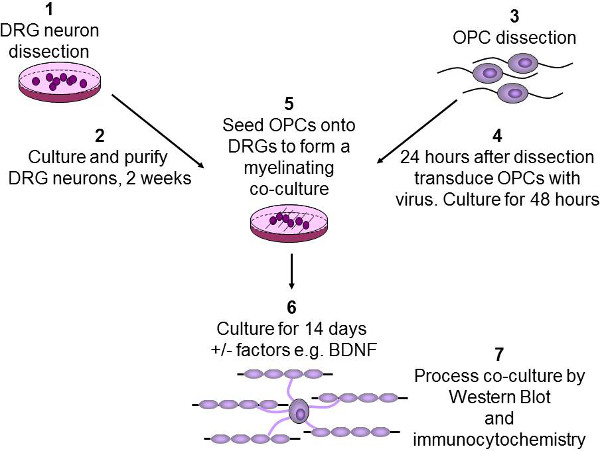
איור 2:. תרשים סכמטי של במבחנה myelination assay נוירונים DRG הם גזורים מגורי החולדה P2-3, אז מטוהרים ומתורבתים יותר משבועות (1-2). OPCs מטוהר ממוח החולדה P7-9 באמצעות immunopanning (3). אז OPCs נגוע בlentivirus ותרבותי במשך 48 שעות (4). אז OPCs הם זורעים על DRGs, וכל גורמי גדילה של עניין, כגון BDNF מתווספים (5). שיתוף תרבויות הן בתרבית, 2 שבועות כדי לאפשר OPCs להבדיל וmyelinate אקסונים (6). לבסוף, שיתוף תרבויות הן lysed או למערבי סופג או קבוע לimmunocytochemistry (7).
הערה: יום 1- 2 ימים לפני לנתיחה:
- מעיל autoclaved coverslips x 22 מ"מ 22 מ"מ עם פולי-L-ornithine (0.5 מ"ג / מיליליטר) בצלחת 6-היטב, ולדגור על 37 מעלות צלזיוס למשך לילה.
- ביום המחרת, coverslips מעיל שוב עם Laminin (20 מיקרוגרם / מיליליטר בממ) על 37 מעלות צלזיוס למשך הלילה, לשאוב את העודף ויבש במשך 20 דקות במכסת מנוע בתרבית רקמה.
הערה: יום 2: Dissection ובידוד של DRGs: - גורי החולדה P2-P3 הקרבת 12x על ידי חיתוך רוחב צוואר רחם.
- הסר את העור שמעל השריר בחלק האחורי של בעלי החיים. השתמש במספרי Vannas לפתוח foramen השדרה ולהשתמש במלקחיים כדי לגרוף החוצה בעדינות את חוט השדרה.
- למרוט את DRGs שמצויים בין עמודות בעמוד השדרה ומנותקות סיבי עצב בעמוד השדרה מצורפים, אז DRGs המקום בצלחת פטרי המכילה 33 מ"מ תקשורת L-15 3 מיליליטר. זה בדרך כלל ניתן לאסוף בין 8 ל 12 DRG מכל צד של חוט השדרה
- DRGs העברה נאספה יחד עם L-15 מדיה לתוך צינור 15 מיליליטר, צנטריפוגות ב 180 XG במשך 5 דקות.
- לשאובsupernatant, להוסיף 2 מיליליטר טריפסין 0.25% לDRG כדורים ולדגור על 37 מעלות צלזיוס למשך 30 דקות.
- הוסף 5 מיליליטר של מדיום M1 (ראה טבלה של פתרון מניות) לכדורי DRG להפסיק טריפסין, ו צנטריפוגות ב 180 XG במשך 3 דקות ב RT.
- לשאוב supernatant, מחדש להשעות גלולה ב 2 מיליליטר בינוני M1 מראש חימם (לא עם גורמי גדילה). Triturate גלולה הגרעינים על ידי pipetting 50x או עד הגרעינים פזורים. השעיה תא צנטריפוגות ב 180 XG במשך 3 דקות.
- Resuspend ניתק נוירונים בתקשורת M1 וצלחת על שולחן צלחת 6-גם בשעה 5 הגרעינים לכל גם 100 μl.
- כדי להסיר תאים מתרבים ללא עצביים, לאחר מינימום של דגירה 4 שעות כדי להקל על קובץ מצורף, להסיר תקשורת M1 ולהאכיל את תאי עצב עם תקשורת M2 (ראה טבלה של פתרון המלאי). הנוירונים DRG תרבות בנוכחות NGF (100 ng / ml) כדי לטהר את תרבות של DRGs להביע TrkA NGF תלוי. לחלופין, להשתמש BDNF (100 ng / ml) כדי לטהר TrkB-Expres BDNF תלוילשיר DRGs.
- לשמור על תאי עצב בתקשורת M1 (+ NGF או BDNF ב 100 ng / ml) לסירוגין עם תקשורת M2 antimitotic 2 שבועות כלהלן.
- לשמור M1 הבינוני (+ NGF או BDNF ב 100 ng / ml) בימים: 4-6, 8-10, 12-14 ותקשורת M2 (+ NGF או BDNF ב 100 ng / ml) עם FDU וuridine בימים 1 ל 4, 6-8, ו10-12. מינימום של 3 מחזורים של טיהור תקשורת M2 נדרש.
- לשמור DRGs בM1 לבד במשך שבוע נוסף לאחר שסיים את מחזור antimitotic 2 שבוע. שינוי בתקשורת M1 כל 2-3 ימים.
5. בידוד והתרבות של OPCs (איור 2 שלב 3)
הערה: יום 1- 2 ימים לפני לנתיחה:
- צלחות מעיל 10 סנטימטרים תרבית רקמה עם פולי-D ליזין (PDL, 10 מיקרוגרם / מיליליטר במים ללא יונים מעוקרים) בשעה 4 ° C למשך הלילה.
הערה: יום 2: יום 1 לפני לנתיחה: - לשטוף צלחות PDL עם מים ללא יונים מעוקרים ל3x. לייבוש ~ 6 שעות במכסת מנוע בתרבית רקמה. אם אינו בשימוש מייד, לעטוף ולאחסןלתקופה של עד 4 שבועות ב 4 מעלות צלזיוס.
- הכן צלחות נוגדנים משני לimmunopanning. לנתיחה מוח 1, להכין צלחות IgG 2x (לRan2 נוגדן כדי להסיר האסטרוציטים ונוגדן O1 להסיר premyelinating oligodendrocytes), עם IgG 45 μl עכבר α עיזים בDPBS (15 מיליליטר) לכל 10 סנטימטרים צלחת פטרי; צלחת 1x IgM ל( נוגדן O4 לבחירת תאי מבשר oligodendrocyte), 45 μl עיזים α IgM העכבר בDPBS (15 מיליליטר) לכל 10 סנטימטרים צלחת פטרי.
הערה: יום 3: יום של נתיחה: - הוספת 200 יחידות של פפאין ב 10 מיליליטר של חיץ פפאין (טבלה 2), ולהתחמם על 37 מעלות צלזיוס עד החיץ הופך ברור.
טבלה 2: הכנת חיץ פפאין.ריכוז עבור 250 מיליליטר ריכוז סופי מניית EBSS 10x 25 מיליליטר 1x 4 MgSO 100 מ"מ 2.5 מיליליטר 1 מ"מ גלוקוז 30% 3 מיליליטר 0.46% EGTA 0.5 M 1 מיליליטר 2 מ"מ NaHCO 3 1 M 6.5 מיליליטר 26 מ"מ תביא נפח של עד 250 מיליליטר עם מים ללא יונים ולעקר מסנן - לשטוף את כל צלחות נוגדנים משני עם DPBS ל3x.
- יוצקים את נוגדן Ran2 וO1 לצלחות IgG וhybridoma O4 לצלחת IgM. דגירה כל צלחות נוגדן הראשוניות הללו במשך שעה 2 ב RT.
- לנתח מוח אחד מעכברוש P7. לערוף גור עם מספריים מושחזים ולהסיר את העור שמעל הגולגולת במספריים.
- חותך סביב הגולגולת מהאונה העורפית, האונה הטמפורלית ולאונה הקדמית. הסר מוח מגולגולת באמצעות מלקחיים ובעדינות להעביר אותו לצלחת פטרי 35 מ"מ עם 1 DPBS מיליליטר.
- קוביות המוח לחתיכות קטנות בערך במספריים או סכין סטרילי.
- מסנן מראש חימם חיץ פפאין (10 מיליליטר) לתוך צינור 15 מיליליטר חדש המכיל כמה גרגרים של L-ציסטאין, ולאחר מכן להוסיף DNAase 200 μl (12,500 U / ml) למאגר פפאין המסונן.
- יוצקים את חיץ פפאין על רקמות המוח חתוכות לקוביות; לדגור על 37 מעלות צלזיוס במשך 90 דקות.
- העברת Gentlly ניתקה רקמות מוח לתוך צינור 50 מיליליטר בעזרת פיפטה 25 מיליליטר ולאפשר ליישוב.
- הסר חוצץ פפאין, להוסיף 2 מיליליטר Lo אוב (Ovomucoid) לרקמות המוח וtiturate 5-10x ידי pipetting כדי לשבור את הגושים של רקמות מוח, מאפשר להתיישב ולהסיר את 2 מיליליטר העליון של supernatant לצינור חדש.
- להוסיף עוד 2 מיליליטר Lo אוב לרקמות מוח וחזור על שלב 5.11 עד אין גושים של רקמה להישאר. Tituration יכול לקבל יותר ויותר אגרסיווי.
- צנטריפוגה ניתקה השעיה תא במשך 15 דקות ב 200 x גרם. לשאוב את supernatant ו resuspend תא גלולה ב 10 מיליליטר היי אוב וצנטריפוגות במשך 15 דקות ב 200 x גרם.
- לשטוף צלחת immunopanning הראשונה (רן 2 צלחת) עם DPBS ל3x. לשאוב supernatant, תאי resuspend ב 10 מיליליטר פנורמי חיץ (טבלה 2) ויוצקים על הצלחת הראשונה immunopanning (רן 2 צלחת). דגירה תאים במשך 15 דקות ב RT.
- לשטוף את הצלחת השנייה immunopanning (צלחת O1) עם DPBS ל3x.
- לאחר הדגירה על צלחת immunopanning הראשונה, להטות את ההשעיה התא על שניצלחת immunopanning (צלחת O1), יש לשטוף את כל תאים שנשרו על פני השטח של הצלחת עם 1-3 מיליליטר של צילום פנורמי חיץ והעברה על ידי פיפטה לצלחת O1. דגירה תאים במשך 15 דקות ב RT.
- לשטוף את הצלחת השלישית immunopanning (צלחת O4). צלחת זו היא צלחת הסלקציה החיובית שבו OPCs לאגד פני השטח שלו. לשטוף את צלחת O4 עם DPBS ל3x.
- לאחר הדגירה על צלחת immunopanning השנייה, להעביר את תאי הצלחת הסופית immunopanning (צלחת O4), דגירה תאים במשך 45 דקות ב RT. צעד זה יבחר O4 + OPCs.
- לשאוב supernatant מצלחת immunopanning האחרונה (צלחת O4) ולשטוף את הצלחת עם EBSS ל6x.
- כדי להסיר OPCs מהצלחת, דגירה תאים עם 5 מיליליטר של 0.05% טריפסין החמים-EDTA מדולל 1:10 עם EBSS על 37 מעלות צלזיוס למשך 8 דקות.
- הוסף 5 מיליליטר של FBS 30% (שנעשה בEBSS) על מנת לנטרל את טריפסין. הסרת תאים מפני השטח של הצלחת ידי pipetting כ 50x.
- להעביר את כל התאהשעיה לצינור וצנטריפוגות חדשים במשך 15 דקות ב 200 x גרם.
- בטל supernatant ו resuspend תא גלולה ב 1 מיליליטר תקשורת SATO מחומם מראש, ואחריו ספירת תאים. Dissection של מוח אחד יכול להניב 1.5-2,000,000 OPCs.
- פלייט תאים על גבי צלחות PDL מצופות יבשות בצפיפות בין 1 x 10 5 ו -5 x 10 5 לכל 10 סנטימטרים צלחת עם בתקשורת SATO (10 מיליליטר) המכילים גורם neurotrophic הריסים (CNTF, 10 ng / ml), גורם גדילה של טסיות דם נגזר (PDGF, 10 ng / ml,), neurotrophin 3 (NT3, ng 1 / מיליליטר), וforskolin (4.2 מיקרוגרם / מיליליטר) 2,12. OPCs תרבות על 37 מעלות צלזיוס, 8% CO 2.
6. OPCs transducing
- OPCs העיקרי תרבות בתקשורת SATO (10 מ"ל / 10 ס"מ צלחת) עם CNTF (/ מיליליטר 10 ng), PDGF (10 ng / ml), NT3 (1 ננוגרם / מיליליטר), וforskolin (4.2 מיקרוגרם / מיליליטר) בשעה 37 ° C, 8% CO 2 למשך 24 שעות לאחר ניתוח.
- לחלוטין לשאוב את התקשורת ותרבות OPC, תאי הזנה עם תקשורת SATO טרי (10 מיליליטר) עם גורמי גדילה (ראה לעיל בשלב 6.1).
- להוסיף וירוס לOPCs לריכוז האופטימלי נקבע על ידי שלב 3 (איור 2, שלב 4), OPCs התרבות לשעה 48 נוספת.
זריעת OPC 7. לmyelinating שיתוף תרבויות (איור 2, שלבים 5 ו -6)
- כדי להסיר OPCs את פני השטח, צלחות OPC השטיפה הראשונות עם 8 מיליליטר EBSS פעמיים, ואז דגירה תאים עם 5 מיליליטר של 0.05% טריפסין-EDTA החם מדולל 1:10 עם EBSS על 37 מעלות צלזיוס למשך 2 דקות.
- לנטרל את טריפסין עם 30% FBS בEBSS (5 מיליליטר) ולהסיר תאים מצלחת ידי pipetting. העבר את ההשעיה תא צינור 15 מיליליטר, צנטריפוגות ב 180 XG במשך 15 דקות ב RT.
- לשאוב את התא גלולה supernatant ו resuspend ב 1 מיליליטר תקשורת SATO מראש התחמם ואחרי ספירת תאים.
- לפני זריעת OPC, תקשורת לשאוב לחלוטין מצלחת תרבות DRG. בעדינות זרע 200,000 OPCs טיפה חכם לנוירונים DRG תאר 4-6 כמו בעבר.
הערה:סך הכל OPC זריעת הנפח חייב להיות פחות מ -200 μl לcoverslip 22 מ"מ. - השאר תאים להתיישב מבלי להזיז את הצלחת למשך 10 דקות במכסת המנוע בתרבית רקמה, ואז בעדינות ראש עם תקשורת SATO 1 מיליליטר מחומם מראש לכל טוב.
- Replate OPCs האחות שנותר עם תקשורת SATO עם גורמי גדילה (ראה שלב 6.1). השתמש OPCs האחות אלה כדי לוודא ביטוי של החלבון של עניין.
- לאחר 24 שעות, להחליף את תקשורת SATO עם תקשורת התרבות המשותפת (2 מיליליטר / טוב) תקשורת SATO מכיל (ללא גורמים) וneurobasal (V / V) עם B27 1%. לשמור על שיתוף התרבויות במשך 14 ימים עם תקשורת לשנות כל 2-3 ימים.
- להעריך את שיתוף התרבויות לביטוי חלבון המיאלין על ידי ניתוח כתם מערבי ולדמיין ליצירת מגזרי axonal myelinated על ידי לחיצה כפולה immunostaining עם נוגדנים כנגד סמני המיאלין בסיסיים חלבון וסמנים עצביים 4-6.
תוצאות
מתויג הדגל תאי kinase 1 (Flag-Erk1) הקשורים לאות בונה הלמשמש לייצור lentivirus מאומת על ידי הגבלת אנזים עיכול של המבנים המשמשים, ביניהם שני מבני 2K7 ובונת האריזה ואבזר הנדרשת לייצור וירוס (איור 3) .
Discussion
Myelination של אקסונים הוא תהליך חיוני לתפקוד האופטימלי של שני מערכות עצבים המרכזיות והיקפיות של בעלי חוליות. הייצור והתחזוקה של אקסונים myelinated הוא תהליך מורכב ומתואם מעורבים אינטראקציות מולקולריות בין תאי עצב, גליה (מתאי שוואן או oligodendrocytes) וחלבוני מטריצה סלולריים נוס...
Disclosures
The authors declare that there is no conflict of interest regarding this research.
Acknowledgements
This work was supported by the Australian National Health and Medical Research Council (NHMRC fellowship #454330 to JX, project grant #628761 to SM and APP1058647 to JX), Multiple Sclerosis Research Australia (MSRA #12070 to JX), the University of Melbourne Research Grant Support Scheme and Melbourne Research CI Fellowship to JX as well as Australia Postgraduate Scholarships to HP and AF. We would like to acknowledge the Operational Infrastructure Scheme of the Department of Innovation, Industry and Regional Development, Victoria Australia.
Materials
| Name | Company | Catalog Number | Comments |
| 2K7 lentivector | Kind gift from Dr Suter9 | ||
| 5-Fluoro-2′-deoxyuridine | Sigma-Aldrich | F0503-100mg | |
| Alexa Fluor 488 Goat anti-mouse IgG | Jackson Immunoresearch | 115545205 | |
| Alexa Fluor 488 goat anti-rabbit IgG (H+L) | Life Technologies | A11008 | |
| Alexa Fluor 594 goat anti-mouse IgG (H+L) | Life Technologies | A11005 | |
| Alexa Fluor 594 goat anti-rabbit IgG (H+L) | Life Technologies | A11012 | |
| Ampicillin | Sigma-Aldrich | A9518-5G | |
| B27 - NeuroCul SM1 Neuronal Supplement | Stem Cell Technologies | 5711 | |
| BDNF (Human) | Peprotech | PT450021000 | |
| Biotin (d-Biotin) | Sigma Aldrich | B4639 | |
| Bradford Reagent | Sigma Aldrich | B6916-500ML | |
| BSA | Sigma Aldrich | A4161 | |
| Chloramphenicol | Sigma-Aldrich | C0378-100G | |
| CNTF | Peprotech | 450-13020 | |
| DAKO fluoresence mounting media | DAKO | S302380-2 | |
| DMEM, high glucose, pyruvate, no glutamine | Life Technologies | 10313039 | |
| DNase | Sigma-Aldrich | D5025-375KU | |
| DPBS | Life Technologies | 14190250 | |
| DPBS, calcium, magnesium | Life Technologies | 14040182 | |
| EBSS | Life Technologies | 14155063 | |
| EcoRI-HF | NEB | R3101 | |
| Entry vectors for promoter and gene of interest | Generate as per protocols 1-2 | ||
| Fetal Bovine Serum | Sigma-Aldrich | 12003C | |
| Forskolin | Sigma Aldrich | F6886-50MG | |
| Glucose (D-glucose) | Sigma-Aldrich | G7528 | |
| Glycerol | Chem Supply | GL010-500M | See stock solutions |
| Goat Anti-Mouse IgG | Jackson ImmunoResearch | 115005003 | |
| Goat Anti-Mouse IgM | Jackson ImmunoResearch | 115005020 | |
| Goat Anti-Rat IgG | Jackson ImmunoResearch | 112005167 | |
| Hoechst 33342 | Life Technologies | H3570 | |
| Igepal | Sigma Aldrich | I3021-100ML | |
| Insulin | Sigma Aldrich | I6634 | |
| Kanamycin | Sigma-Aldrich | 60615 | |
| Laminin | Life Technologies | 23017015 | |
| LB Medium | See stock solutions | ||
| LB-Agar | See stock solutions | ||
| L-Cysteine | Sigma-Aldrich | C-7477 | |
| Leibovitz's L-15 Medium | Life Technologies | 11415064 | |
| L-Glutamate | Sigma-Aldrich | G1626 | |
| L-Glutamine- 200 mM (100x) liquid | Life Technologies | 25030081 | |
| LR Clonase II Plus enzyme | Life Technologies | 12538-120 | |
| MEM, NEAA, no Glutamine | Life Technologies | 10370088 | |
| Mouse α βIII Tubulin | Promega | G7121 | |
| Mouse αMBP (monoclonal) | Millipore | MAB381 | |
| Na pyruvate | Life Technologies | 11360-070 | |
| NAC | Sigma Aldrich | A8199 | |
| NcoI-HF | NEB | R3193S | |
| NEBuffer 4 | NEB | B7004S | |
| Neurobasal medium | Life Technologies | 21103049 | |
| NGF (mouse) | Alomone Labs | N-100 | |
| NT-3 | Peprotech | 450-03 | |
| O1 antibody - Mouse anti-O1 | Millipore | MAB344 | Alternative if O1 hybridoma cells are unavailable |
| O1 hybridoma cells | Conditioned medium containing anti-O1 antibody to be used for immunopanning | ||
| O4 antibody - Mouse anti-O4 | Millipore | MAB345 | Alternative if O4 hybridoma cells are unavailable |
| O4 hybridoma cells | Conditioned medium containing anti-O4 antibody to be used for immunopanning | ||
| Competent cells | Life Technologies | A10460 | |
| One Shot Stbl competent cells | Life Technologies | C7373-03 | |
| Papain Suspension | Worthington/Cooper | LS003126 | |
| pBR8.91 | Kind gift from Dr Denham10 | ||
| PDGF-AA (Human) | Peprotech | PT10013A500 | |
| Penicillin-streptomycin 100x solution | Life Technologies | 15140122 | |
| pENTRY4IRES2GFP | Invitrogen | 11818-010 | |
| pMD2.G | Addgene | 12259 | |
| Poly-D-lysine | Sigma | P6407-5MG | |
| Polyethylenimine (PEI) | Sigma-Aldrich | 408727-100ML | |
| Poly-L-ornithine | Sigma Aldrich | P3655 | |
| Progesterone | Sigma Aldrich | P8783 | |
| Protease inhibitor tablet (Complete mini) | Roche | 11836153001 | |
| Proteinase K | Supplied with Clonase enzyme | ||
| Putrescine | Sigma Aldrich | P-5780 | |
| Rabbit α neurofilament | Millipore | AB1987 | |
| Rabbit αMBP (polyclonal) | Millipore | AB980 | |
| Ran2 hybridoma cells | ATCC | TIB-119 | Conditioned medium containing anti-Ran2 antibody to be used for immunopanning |
| Rat anti CD140A/PDGFRa antibody | BD Pharmingen | 558774 | |
| SacII | NEB | R0157 | |
| SOC medium | Supplied with competent bacteria | ||
| Sodium selenite | Sigma Aldrich | S5261 | |
| Spe I | NEB | R0133S | |
| T4 DNA Ligase | NEB | M0202S | |
| T4 DNA Ligase Buffer | NEB | B0202S | |
| TE buffer pH8 | See stock solutions | ||
| TNE lysis buffer | |||
| Trace Elements B | Cellgro | 99-175-CI | |
| Transferrin (apo-Transferrin human) | Sigma-Aldrich | T1147 | |
| Triton X-100 | Sigma-Aldrich | T9284 | |
| Trypsin | Sigma-Aldrich | T9201-1G | |
| Trypsin Inhibitor From Chicken Egg White | Roche | 10109878001 | |
| Trypsin-EDTA (1x), phenol red (0.05%) | Life Technologies | 25300-054 | |
| Unconjugated Griffonia Simplicifolia Lectin BSL-1 | Vector laboratories | L-1100 | |
| Uridine | Sigma-Aldrich | U3003-5G |
References
- Baumann, N., Pham-Dinh, D. Biology of oligodendrocyte and myelin in the mammalian central nervous system. Physiol Rev. 81 (2), 871-927 (2001).
- Watkins, T. A., Emery, B., Mulinyawe, S., Barres, B. A. Distinct stages of myelination regulated by gamma-secretase and astrocytes in a rapidly myelinating CNS coculture system. Neuron. 60 (4), 555-569 (2008).
- Lee, K., et al. MDGAs interact selectively with neuroligin-2 but not other neuroligins to regulate inhibitory synapse development. Proc Natl Acad Sci U S A. 110 (1), 336-341 (2013).
- Xiao, J., et al. BDNF exerts contrasting effects on peripheral myelination of NGF-dependent and BDNF-dependent DRG neurons. J Neurosci. 29 (13), 4016-4022 (2009).
- Chan, J. R., et al. NGF controls axonal receptivity to myelination by Schwann cells or oligodendrocytes. Neuron. 43 (2), 183-191 (2004).
- Xiao, J., et al. Brain-Derived Neurotrophic Factor Promotes Central Nervous System Myelination via a Direct Effect upon Oligodendrocytes. Neurosignals. 18 (3), 186-202 (2010).
- Lundgaard, I., et al. Neuregulin and BDNF induce a switch to NMDA receptor-dependent myelination by oligodendrocytes. PLoS Biology. 11 (12), e1001743 (2013).
- Kleitman, N., W, P. M., Bunge, R. P. . Tissue culture methodes for the study of myelination. , (1991).
- Xiao, J., et al. Extracellular signal-regulated kinase 1/2 signaling promotes oligodendrocyte myelination in vitro. J Neurochem. 122 (6), 1167-1180 (2012).
- Wong, A. W., Xiao, J., Kemper, D., Kilpatrick, T. J., Murray, S. S. Oligodendroglial expression of TrkB independently regulates myelination and progenitor cell proliferation. The Journal of Neuroscience. 33 (11), 4947-4957 (2013).
- Li, Z., et al. Molecular cloning, Characterization and Expression of miR-15a-3p and miR-15b-3p in Dairy Cattle. Molecular and Cellular Probes. , (2014).
- Emery, B., et al. Myelin gene regulatory factor is a critical transcriptional regulator required for CNS myelination. Cell. 138 (1), 172-185 (2009).
- Murai, K., et al. Nuclear receptor TLX stimulates hippocampal neurogenesis and enhances learning and memory in a transgenic mouse model. Proc Natl Acad Sci U S A. 111 (25), 9115-9120 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved