Method Article
المحسن انخفاض التمثيل بيسلفيت تسلسل لتقييم الحامض النووي في قرار قاعدة زوج
* These authors contributed equally
In This Article
Summary
Enhanced Reduced Representation Bisulfite Sequencing is a method for the preparation of sequencing libraries for DNA methylation analysis based on restriction enzyme digestion combined with cytosine bisulfite conversion. This protocol requires 50 ng of starting material and yields base pair resolution data at GC-rich genomic regions.
Abstract
تدرس DNA رسم الخرائط نمط مثيلة بكثافة في الأنسجة الطبيعية والمريضة. وقد وضعت مجموعة متنوعة من الأساليب لاستجواب أنماط السيتوزين مثيلة في الخلايا. وقد وضعت التمثيل انخفاض كله تسلسل الجينوم بيسلفيت للكشف عن الكمية زوج قاعدة أنماط قرار السيتوزين مثيلة في-GC الغنية مواضع الجيني. يتم ذلك عن طريق الجمع بين استخدام انزيم تقييد تليها تحويل بيسلفيت. تعزيز انخفاض التمثيل بيسلفيت تسلسل (ERRBS) يزيد من مواضع الجيني بيولوجيا تغطيتها واستخدمت لمحة السيتوزين مثيلة في DNA من البشر، والماوس وغيرها من الكائنات. ERRBS يبدأ مع تقييد انزيم هضم الحمض النووي لتوليد منخفضة شظايا الوزن الجزيئي لاستخدامها في إعداد مكتبة. وتتعرض هذه الشظايا إلى بناء مكتبة القياسية للجيل القادم التسلسل. تحويل بيسلفيت من cytosines unmethylated مسبق للamplificati نهائيعلى خطوة تسمح للقرار قاعدة الكمي لمستويات الحامض السيتوزين في مواضع الجيني مغطى. بروتوكول يمكن أن تكتمل في غضون أربعة أيام. على الرغم من التعقيد منخفض في القواعد الثلاثة الأولى التسلسل والمكتبات ERRBS تسفر عن بيانات عالية الجودة عند استخدام ممر السيطرة التسلسل المعين. ثم يتم تنفيذ ورسم الخرائط والمعلوماتية الحيوية تحليل البيانات والعوائد التي يمكن دمجها بسهولة مع مجموعة متنوعة من المنصات على نطاق الجينوم. ERRBS يمكن الاستفادة كميات المواد المدخلات صغيرة مما يجعل من الممكن لمعالجة العينات السريرية البشرية وقابلة للتطبيق في مجموعة من التطبيقات البحثية. الفيديو المنتجة يوضح الخطوات الحاسمة للبروتوكول ERRBS.
Introduction
الحامض النووي في السيتوزين (5-ميثيل سيتوزين) هو علامة جينية حاسمة في خلايا الثدييات لمجموعة متنوعة من العمليات البيولوجية، بما في ذلك سبيل المثال لا الحصر يطبع، X كروموسوم تعطيل، والتنمية، وتنظيم التعبير الجيني 1-8. حددت دراسة أنماط الحامض النووي في اضطرابات الخبيثة وغيرها من أنماط محددة من الأمراض وساهمت في فهم المرض والتسبب في والاكتشافات العلامات البيولوجية المحتملة 9-17. هناك العديد من البروتوكولات التي استجواب epigenome للحصول على مركز الحامض النووي. ويمكن تقسيم هذه إلى أساس تقارب، المستندة إلى إنزيم التقييد، والمقايسات القائم على تحويل بيسلفيت التي تستخدم ميكروأري أو التسلسل منصات المصب. وعلاوة على ذلك، هناك عدد قليل من البروتوكولات التي سد هذه الفئات العامة بما في ذلك، ولكن ليس على سبيل الحصر، جنبا إلى جنب تحليل تقييد بيسلفيت 18 وخفض التمثيل بيسلفيت تسلسل (RRBS 19).
وقد وصفت RRBS في الأصل من قبل ميسنر وآخرون 19،20. عرض البروتوكول خطوة لإثراء المناطق الجينومية-GC الغنية تليها التسلسل بيسلفيت، مما أدى إلى قرار الكمي بيانات قاعدة الزوج التي هي فعالة 21،22 التكلفة. وتستهدف المناطق GC الغنية التي MspI (C ^ CGG) انزيم التقييد، ويتم حل السيتوزين مثيلة عن طريق تحويل بيسلفيت من cytosines (نزع الأمين من cytosines معدلة لاليوراسيل)، تليها تفاعل البلمرة المتسلسل (PCR) والتضخيم. غطت RRBS غالبية المروجين الجين والجزر الدليل السياسي الشامل في جزء من تسلسل المطلوبة لالجينوم كله؛ وكان مع ذلك RRBS التغطية المحدودة للشواطئ الدليل السياسي الشامل والمناطق بين الأخرى ذات الصلة البيولوجية. وقد نشرت العديد من المجموعات تحديث بروتوكولات RRBS منذ التقرير الأصلي الذي تحسين بناء على منهجية والتغطية الناتجة من هذه المناطق الجينومية 23-25. تعزيز انخفاض التمثيل بيسلفيت Sequencing (ERRBS) يتضمن تعديلات إعداد مكتبة ومحاذاة البيانات البديلة نهج 26 بالمقارنة مع RRBS. أدى ERRBS في عدد أكبر من CpGs ممثلة في البيانات التي تم إنشاؤها وزيادة تغطية جميع المناطق الجينومية استجوبت 26. وقد استخدمت هذه الطريقة لحل أنماط الحامض النووي في المريض البشري والعينات الحيوانية الأخرى 26-30.
وصف بروتوكول ERRBS تفاصيل العروض على جميع الخطوات اللازمة لاستكمال والبيانات تم إنشاؤها باستخدام الحمض النووي البشري ممثل (تم الحصول على عينات من ذكرت سابقا، والعينات التي تم تحديدها دي المرضى 31، وCD34 + العظام عينة نخاع من متبرع الإنسان العادي). ويتضمن البروتوكول عملية اختيار حجم الآلي، مما يقلل من الوقت اللازم لتجهيز لكل عينة ويسمح لزيادة الدقة في اختيار حجم المكتبات. بروتوكول يجمع سلسلة من تقنيات البيولوجيا الجزيئية المعمول بها. يتم هضم عالية DNA الوزن الجزيئي ثإيث ل-مثيلة حساسة تقييد انزيم (MspI)، يليه نهاية إصلاح، A-المخلفات، وربط محولات مميثل. ويتبع اختيار حجم الشظايا-GC غنية عن طريق تحويل بيسلفيت PCR والتضخيم قبل التسلسل. وقد تم تحويل بيسلفيت سابقا ووصف 32 و استعراض مفصل لتحليل البيانات والتطبيقات خارج نطاق هذه الورقة، ومع ذلك يتم تضمينها التوصيات والمراجع للاستخدام القراء. لا يمكن أن يؤديها البروتوكول على مدى أربعة أيام وغير قابلة للمدخلات صغير (50 نانوغرام أو أقل) كميات المواد. بروتوكول كما غلة وصف البيانات مع تغطية عالية لكل موقع الدليل السياسي الشامل كافية ليس فقط لموقع مثيلة والمنطقة التفاضلية قرارات ولكن أيضا للكشف عن تعدد الأشكال جينية كما وصفها Landan، وآخرون. 33.
Protocol
تمت الموافقة على جميع الإجراءات التي تنفذها مدرسة جامعة إنديانا للطب المؤسسي رعاية الحيوان واستخدام اللجنة ومتابعة المعهد الوطني للصحة المبادئ التوجيهية.
1. تقنية جراحية
- الحفاظ على تقنية العقيم أثناء هذا الإجراء باستخدام القفازات المعقمة، والصكوك، وحقل جراحي معقم وفقا للمبادئ التوجيهية NIH 25. تعقيم الأدوات قبل البدء في عملية جراحية قبل التعقيم لهم (انظر الجدول من الكواشف محددة / معدات لائحة كاملة). استخدام التعقيم الزجاج حبة لتعقيم الأدوات خلال العملية.
2. التخدير والتحضير
- تخدير الماوس في مربع التخدير مع خليط من 0.9 لتر / دقيقة الأكسجين و 2.5٪ الأيزوفلورين باستخدام نظام المرذاذ isoflurane البيطرية. تأكد من أن الماوس لا يستجيب للتغيرات في وضع الجسم قبل إزالته من مربع.
- تطبيق مرهم للعين لمذكرة التفاهمعيون حد ذاتها لحمايتها من الجفاف.
- التبديل تدفق الغاز من مربع إلى مخروط الأنف. ضع الماوس بشكل مباشر على جانبها الأيسر على وسادة ساخنة مغطاة سادة الجراحية ورقة ماصة مقاعد البدلاء مع أنفها والفم داخل مخروط. باستمرار مراقبة التنفس إيقاع الماوس، ومعدل وضبط مستويات الأيزوفلورين حسب الحاجة (مابين 2.5 - 3٪ الأيزوفلورين) للحفاظ على مستوى كاف من التخدير، واستخدام إصبع القدم قرصة رد الفعل لتأكيد الكلي التخدير.
3. المنهج الجراحي
- محاذاة والتركيز على المجسام مع الجراحي الميداني. ضبط مخروط الأنف والشريط عليه بحيث يتم وضعه على طول حافة المجال البصري.
- مع الماوس ملقاة على جانبها الأيسر، والشريط حافة الأذن اليمنى إلى مخروط الأنف، وتعريض منطقة خلف الأذن حيث سيتم إجراء شق. ضمان الوريد الأذني الخلفي يسافر أفقيا عبر الأذن. لاحظ أن الموضع الصحيح للرانه حيوان وتسجيل اللقطات من الأذن حاسمة من أجل العثور بسرعة على العصب الوجهي.
- الرطب الفراء على وخلف الأذن مع 70٪ من الإيثانول ويحلق موقع الجراحية باستخدام شفرة حلاقة أو مشرط شفرة. قبل ترطيب الفراء يجعل حلق أسهل في هذا الموقع التشريحي.
- تنظيف البشرة مع محلول اليود، مثل بتدين فرك الجراحية (7.5٪ بوفيدون اليود)، تليها 70٪ من الإيثانول. كرر هذه التنظيف مرتين أخريين لتطهير شاملة للمنطقة.
- لتحديد مكان لجعل شق، وتتبع الوريد الأذني الخلفي من الأذن نحو caudally إلى المنطقة الخلفية للالناشزة الأذن. باستخدام مقص الربيع، وجعل شق 4 مم 2-3 ملم الخلفي إلى الناشزة.
- تشريح من خلال الدهون تحت الجلد واللفافة باستخدام تشريح حادة. تجنب القطع المباشر مع مقص لأن الأوعية الدموية أو الأنسجة العضلية يمكن أن تتلف بسهولة.
- إذا كان النزيف يحدث، والضغط لموقع الجراحية مع مسحة القطن المعقمةلا يقل عن 30 ثانية. إذا كان يحدث فقدان السوائل كبيرة، وضخ الماوس البريتونى مع ما يصل إلى 0.5 مل من معقم 0.9٪ محلول ملحي باستخدام 25 أو 27 G الإبرة.
- استخدام العديد من المعالم الرئيسية، العصب الشوكي التبعي، قناة الأذن، والأمامي عضلة ذات البطنين (موضح أدناه)، لتحديد موقع العصب الوجهي. تشريح حول هذه المعالم حتى يتم تصور فروع العصب الوجهي. ستظهر العصب كهيكل الأبيض الصلبة كبير عندما تبين وطبقة من اللفافة تلتزم إلى الهياكل الأساسية.
- البحث عن العصب الشوكي التبعي، الذي يسافر من الجزء الذيلية من الجمجمة إلى يعصب العضلة شبه المنحرفة، مرة واحدة وقد تم تشريح الدهون تحت الجلد واللفافة. العصب الوجهي هو عميق في العصب الشوكي الإكسسوارات.
- البحث عن قناة الأذن الغضروفية التي تبدو بيضاء لؤلؤية ويمكن أن ينظر إليه منقاري إلى العصب الوجهي.
- العثور على بطن عضلة عضلة ذات البطنين الأمامية التي تقع على رأس وجaudal إلى العصب الوجهي.
- عندما يتم تصور الفروع الرئيسية من العصب الوجهي، وتتبع لهم ظهريا للعثور على أصلهم من الثقبة الإبرية الخشائية. باستخدام يميل غرامة دومون ملقط # 5/45 لعقد موقع الجراحية المفتوحة، تقدم النصائح الربيع مقص التالية مسار العصب، ثم نقل ملقط ظهريا للحفاظ على المنطقة المتقدمة حديثا مفتوحة.
- تصور جذع العصب الوجهي مع الوجني، الشدق، وفروع الفك السفلي هامشية في هذه المرحلة.
ملاحظة: سيتم العثور فرع الزمني أقرب إلى الثقبة. فروع العصب الفك السفلي الهامشية إلى أجزائه العلوية والسفلية أقرب إلى الفك، وبالتالي هذه الفروع العصبية لن تكون مرئية على هذا المستوى.- إذا يؤدون transection العصب، وتثبيت العصب بلطف مع ملقط غيض غرامة وقطع العصب مع مقص الربيع. تجنب تطبيق الكثير من الجر في العصب مع ملقط لمنع avulsing العصب من الدماغ. إدفعجذوعها بعيدا عن بعضها البعض، أو قطع وإزالة جزء من العصب البعيدة للتأكد من أن يمكن أن يحدث أي إعادة الاتصال.
- إذا كان أداء اصابة في سحق، استخدم دومون # 5/45 ملقط لضغط العصب لمدة 30 ثانية باستخدام الضغط المستمر لقطع جميع المحاور، ثم كرر هذا الزحام على زاوية الثانية عمودي على الموقع سحق الأول. تجنب استخدام كميات متفاوتة من الضغوط خلال سحق 30 ثانية، وإلا فإن الإصابة سوف تكون غير متناسقة بين الحيوانات.
4. الإنتهاء والإنعاش
- إعادة الدهون والعضلات على الهياكل الأساسية.
- تقريب حواف الجرح وإغلاق الجرح باستخدام 7.5 ملم الجرح كليب. الغرز أو الغراء هي أيضا مقبولة لإغلاق الجرح. ويمكن تقديم المسكنات بعد الجراحة في هذا الوقت.
- إزالة الشريط من الأذن الفأر. إيقاف تدفق الأيزوفلورين والسماح الماوس لتنفس الأكسجين النقي لمدة 30 ثانية إلى 1 دقيقة. ررالآس الماوس في قفص فارغ مع أي الفراش للتعافي من التخدير.
- عندما يتم استرداد الماوس، ودراسة سلوكها عن علامات مؤكدة من شلل في الوجه. ستصاب بالشلل شعيرات والزاوية مرة أخرى نحو الخد، سيتم انحرف الأنف، وسوف العين لا وميض ردا على نفخة من الهواء.
- حيوانات المنزل معا بعد الجراحة إذا كانت الإناث. تجنب تأوي الفئران الذكور معا لأنها أكثر عدوانية وتميل إلى إزالة قسرا مقاطع الجرح cagemate الخاصة بهم، الأمر الذي يؤدي إلى العدوى. تقديم المسكنات بعد الجراحة في هذا الوقت، إذا لزم الأمر.
- مراقبة الفئران مرة واحدة يوميا لعدة أيام بعد العملية لضمان عدم وجود عدوى أو مضاعفات أخرى يحدث بعد العمل الجراحي. إزالة مقاطع الجرح 7 - 10 أيام بعد الجراحة إن لم تكن قد سقطت من تلقاء نفسها.
- تطبيق التشحيم مرهم العين إلى العين المصابة يوميا لمنع مضاعفات القرنية، سواء حتى لا ارادي طرفة العين هو إعادةمغطاة أو حتى القتل الرحيم.
النتائج
ويقدم الشكل 1 لمحة عامة عن ERRBS، وتسليط الضوء الخطوات الرئيسية التي سيتم شرحها في جميع أنحاء بروتوكول صفها. تم إعداد مكتبات ERRBS باستخدام DNA المدخلات 50 نانوغرام.
تقييم جودة المكتبات مستعدا. إنتاج مكتبة غلة بشكل روتيني أحجام جزء من 150-250 نقطة أساس و250-400 سنة مضت (الشكل 3A-C). ومن المتوقع اختلافات طفيفة في حجم التوزيعات المكتبة بين العينات. لاحظ أنه في كل من الكسور المكتبة الدنيا والعليا هناك أحجام DNA قوية جدا، وتدل على إثراء تسلسل معين. MspI النتائج الهضم في إثراء عائلة من DNA المتكرر تتابعات الموجودة في الجينوم البشري عند 190 نقطة أساس و 250 نقطة أساس و 310 نقطة أساس في المكتبات ERRBS. هذه يكرر الثلاثة تمثل توقيع مميزة من مكتبة ERRBS 20 (انظر الأرقام 3A-C و 3G). والتسلسل المكتبات تمثيلية على تسلسل الجيل المقبلص يقرأ باستخدام نهاية واحدة. عند تحميل في تركيز مكتبة أوصى على البورشيد HiSeq 2500 المنظم، ومن المتوقع الكثافة مجموعة من 500،000-700،000 لكل مم 2. في هذه الكثافة المجموعات، 81.6٪ ± 3.14٪ (ن = 81) من مجموعات تمرير مرشح (الشكل 4A). نظرا لتعقيد نهاية منخفضة من إدراج مكتبة (الموقع الاعتراف MspI: C ^ CGG)، قيم الكثافة وعشرات جودة سجلت خلال التسلسل ولكن تختلف اختلافا كبيرا في القواعد الثلاثة الأولى (الشكل 4B-C)، إذا كان الممر تحكم مستقل يتم تضمين (انظر المناقشة)، و85٪ من قواعد لها عشرات جودة 30 أو أكبر (قيم Q30، الشكل 4D).
محاذاة البيانات وتحديد السيتوزين مثيلة كما هو موضح في البيانات قرار عوائد بروتوكول قاعدة الزوج (الجدول 7). لالجينوم البشري، و51 دورة واحدة للقراءة المدى تسلسل مكتبة ERRBS في حارة واحدة من HiSeq 2500 وضع عالية الانتاج العاديةلاي يولد 153194882 ± 12918302 مجموعه يقرأ أنه بعد تصفية الجودة ومحول التشذيب عوائد 152231183 ± 13189678 يقرأ للمساهمة في خط أنابيب التحليل. متوسط كفاءة رسم الخرائط لمكتبة ERRBS هو عادة 62.95٪ ± 5.92٪ مع تمثيل 3183594 ± 713547 CpGs مع الحد الأدنى من التغطية في الدليل السياسي الشامل من 10x و بمتوسط تغطية في الدليل السياسي الشامل من 84.94 ± 16.29 (ن = 100).
بروتوكول ERRBS غير قابلة للمضاعفة (انظر ملف إضافي 1: التكيف بروتوكول لتسلسل المضاعفة). البيانات من تسلسل تمثيلية تدير تتلخص في الشكل 5 بيانات من يدير التسلسل المضاعفة (51 دورة واحدة للقراءة المدى التسلسل؛ ن = 128 للمكتبتين في حارة، ن = 11 لمدة ثلاث مكتبات في حارة، ن = 11 لمدة أربعة المكتبات في حارة) كانت مقارنة تسلسل حارة كاملة من مكتبة ERRBS (51-دورة واحدة للقراءة ويدير التسلسل، ن = 100)، وكذلك الاختزال ممر واحد لsimulatه 50٪، 33٪ و 25٪ من يقرأ في حارة (2، 3، و 4 عينة مضاعفة في حارة التوالي؛ ن = 3). ولما كان عدد من يقرأ لكل عينة يتناقص مع عامل مضاعفة، وعدد من CpGs تغطيتها على تغطية الحد الأدنى من 10X والتغطية في الدليل السياسي الشامل يقلل كذلك (الشكل 5 والجدول 8). يعني أسعار التحويل من المواقع غير الدليل السياسي الشامل المتوقع هي 99.85٪ ± 0.04٪ (ن = 400). أسعار التحويل أقل من 99٪ قد تشير إلى أقل من تحويل بيسلفيت الأمثل الذي يمكن أن يؤدي إلى ارتفاع معدلات مستويات الحامض كاذبة.
تم تحليل البيانات من مكتبة ERRBS أعدت من الحمض النووي الجيني البشري تمثيلي في R 2.15.2 45 باستخدام حزمة methylKit 26 (انظر ملف التعليمات البرمجية التكميلي 1 للحصول على تفاصيل الأوامر). يمكن تصور البيانات في متصفحات الجينوم التي يشيع استخدامها (الشكل 6A). ويستمد البيانات السيتوزين مثيلة على قدم المساواة من كل من خيوط (الشكل 6B) ويتراوح كاملالطيف من مستويات السيتوزين مثيلة المحتملة (الشكل 6C). تحليل مكررات التقنية من ممثل عوائد عينة DNA الإنسان التوافق الكبير بين نتائج البيانات (الشكل 6D) ويغطي CpGs في طائفة واسعة من مواضع الجيني (الشكل 6E وF وكما هو موضح سابقا 26). بينما النسخ المتماثلة الفنية سوف تسفر عالية R 2 القيم (أكبر من 97٪)، والنسخ المتماثلة البيولوجية تسفر R 2 القيم تتراوح 0،92-0،96 26، ومقارنة أنواع مختلفة من الخلايا البشرية سوف تسفر R 2 القيم أقل من 0.86 (لا تظهر البيانات).
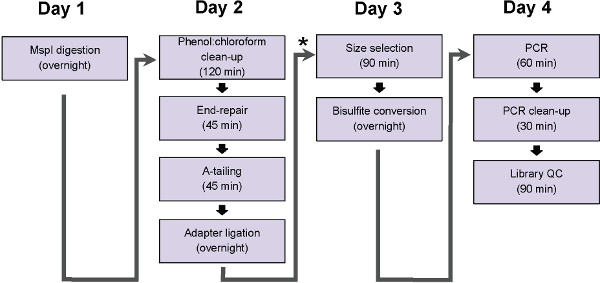
الشكل 1: تدفق الرسم البياني من الخطوات بروتوكول ERRBS. الرسم البياني يمثل الخطوات، التي يمكن أن تكتمل في يوم العمل التقليدي. * يشير إلى نقطة وقفة المحتملة (اتبع فورا جي ربط تنظيف وقبل اختيار الحجم، خطوة بروتوكول 5) في عينات التي يمكن تجميد في -20 ° C قبل الشروع في مدة البروتوكول.
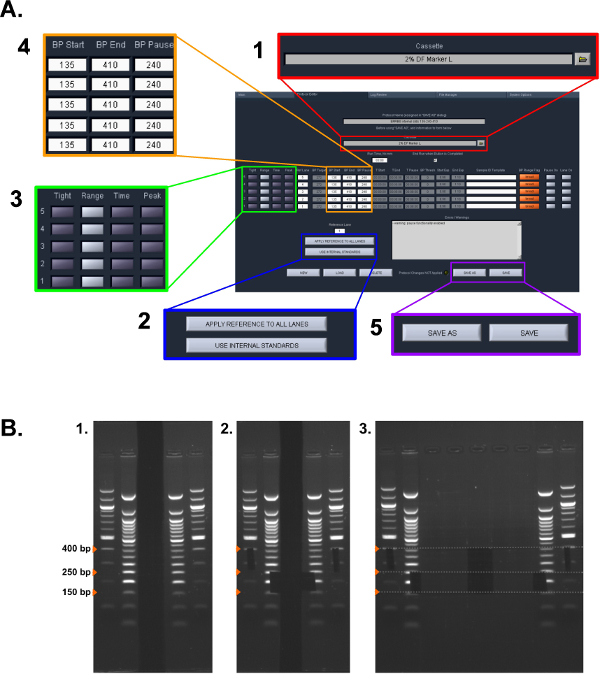
الشكل 2: بروتوكول اختيار الحجم. (A) قطة الشاشة من الإعدادات المستخدمة في بروتوكول ERRBS التفاح الإعدادية (انظر القسم بروتوكول 5.1.2 - 5.1.6): (1) تحديد نوع كاسيت. (2) تحديد المعايير التي سيتم استخدامها. (3) حدد وسيلة جمع البيانات عن كل حارة. (4) أدخل نطاقات جمع مضت. (5) حفظ البروتوكول (B) مراحل اليدوي في استخراج الهلام المستخدمة في القسم بروتوكول 5.2:. (1) سلالم هلام تصور. (2) تميز مقاسات لاختيار حجم باستخدام شفرة حلاقة. (3) صورة من عينات رفعه (أقل جزء: 150-250 نقطة أساس وأعلى نسبة: 250-400 بي بي)."> الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
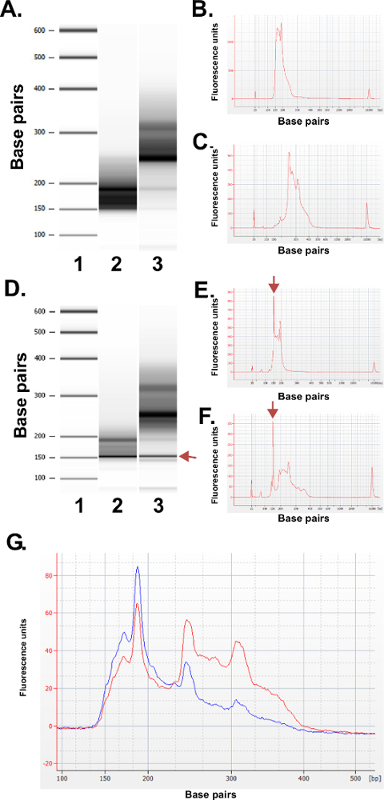
الشكل (3): نتائج مراقبة الجودة للمكتبات ERRBS تمثيلية أعدت من عينات DNA الإنسان باستخدام آلة bioanalyzer. (A) جل تشبه الصورة التي تظهر على سلم القياسي (1)، وانخفاض نسبة مكتبة (135-240 نقطة أساس جزء من التفاح الإعدادية)؛ 2) وجزء مكتبة العالي (240-410 نقطة أساس جزء من التفاح الإعدادية)؛ 3) (B) Bioanalyzer رحلاني من أدنى جزء مكتبة المتوقع (C) Bioanalyzer رحلاني من المتوقع ارتفاع نسبة مكتبة D -.. F) بيانات تمثيلية من الفقراء الإعدادية مكتبة الجودة. مثل هلام صورة (D) من سلم القياسي (1)، وانخفاض نسبة المكتبة (2) وجزء مكتبة العالي (3). الفرقة في 150 نقطة أساس تحمل علامة arroث يشير كميات مفرطة من المحول. رحلاني من أسفل (E) والكسور المكتبة أعلى (F) مع قمم محول الزائدة عند 150 نقطة أساس (ملحوظ مع السهام). (G) Bioanalyzer رحلاني مكتبة ERRBS المجمعة عن التسلسل. يمثل أثر الاحمر المجمعة مكتبة جودة عالية مع التمثيل المتساوي للكسور العليا والدنيا. يمثل الأزرق أثر مكتبة المجمعة غير كافية لتسلسل نظرا لعدم وجود تمثيل متساو من الكسور العليا والدنيا. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
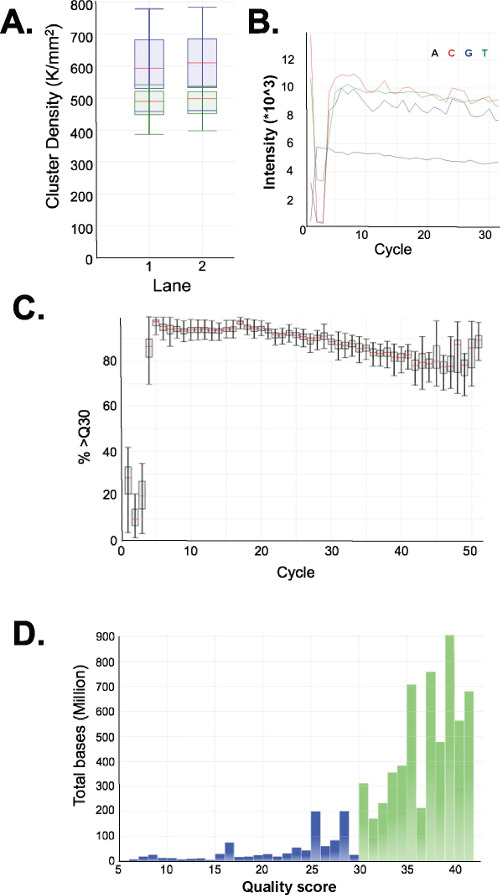
الشكل 4: التسلسل الرسوم البيانية لممثل ERRBS 51 دورة تسلسل واحد قراءة المدى على المنظم HiSeq 2500 عالية الانتاجواسطة. (A) كثافة الكتلة (ك / مم 2 = 1،000 مجموعات في كل مليمتر التربيعية، الأزرق). وكثافة الكتلة تمرير مرشح (الأخضر) في مسربين مع المكتبات ERRBS (B) شدة النموذجية ينظر في الدورات ال 30 الأولى في حارة مع مكتبة ERRBS. ملاحظة توقيع CGG من MspI الهضم في شدة الدورات الثلاث الأولى. (C) النسبة المئوية للقواعد بنتيجة جودة 30 أو أعلى (٪> Q30) لكل دورة واحدة في حارة ERRBS. (D) توزيع نقاط الجودة ل جميع دورات في إحدى حارات ERRBS. أزرق = أقل من Q30، أخضر = أكبر من أو يساوي Q30. في هذا الممر، كان 84.7٪ من قواعد عشرات جودة 30 أو أعلى.
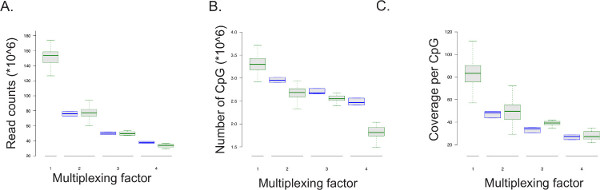
الشكل 5: التسلسل نتائج الإخراج. قطع مربع من البيانات التجريبية من عينة المضاعفة واحدة في حارة التسلسل رو نانوثانية (يظهر على شكل صناديق خضراء) والبيانات المستمدة من الاختزال محاكاة من يدير تسلسل ثلاثة ERRBS المكتبات (يظهر على شكل مربعات زرقاء، عينات خمس مرات لكل شوط التسلسل) من 51 دورة يدير تسلسل واحد للقراءة يتوافق عامل مضاعفة ل. عدد المكتبات ERRBS التسلسل في حارة. 1 = حارة كله أو 100٪ من يقرأ وتمثل البيانات من مكتبة ERRBS واحدة لكل حارة. 2 = 50٪ من حارة وتمثل البيانات من اثنين ERRBS المكتبات في حارة. 3 = 33٪ من ممر وتمثل البيانات من ثلاثة ERRBS المكتبات في حارة. و، 4 = 25٪ من ممر وتمثل البيانات من أربعة ERRBS المكتبات في حارة. (A) والتهم قراءة، أو عدد من متواليات تحليلها، في عامل مضاعفة. (ب) عدد من الدليل السياسي الشامل من قبل تسلسل البيانات في مضاعفة تغطيها عامل. (C) تغطية متوسط في الدليل السياسي الشامل لكل عامل الإرسال المتعدد._blank "> اضغط هنا لمشاهدة نسخة أكبر من هذا الرقم.
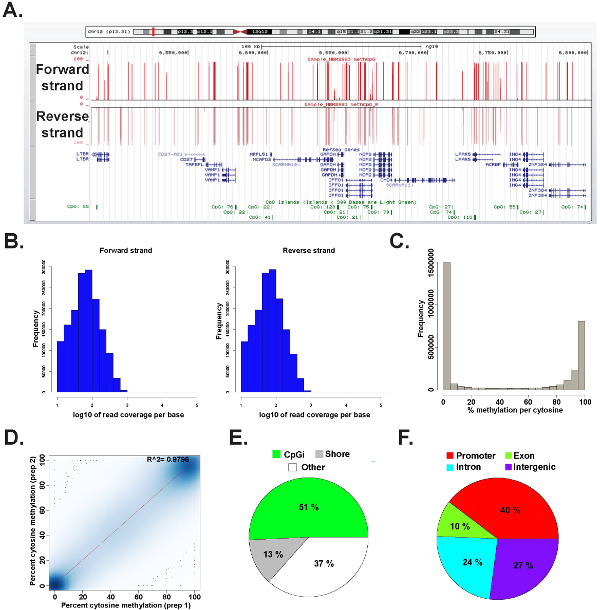
الشكل 6: بيانات تمثيلية من مكتبة ERRBS المعدة من الحمض النووي الجيني البشري (A) من جامعة كاليفورنيا في سانتا كروز (UCSC) متصفح الجينوم 43 صورة من بيانات تمثيلية من حارة ERRBS التسلسل. يمثل شريط نطاق المحور ص 0-100٪ مثيلة في كل السيتوزين مغطاة مع حد أدنى من 10X. يمثل المسار المخصص كبار حبلا إلى الأمام ويمثل مسار مخصص انخفاض حبلا عكسي. أظهرت هو chr12:.. 6،489،523-6،802،422 (hg19) بما في ذلك الجينات refseq والجزر الدليل السياسي الشامل في هذه المنطقة الجينومية رسوم بيانية (B) توزيع التغطية الدليل السياسي الشامل على طول إلى الأمام وعكس فروع في CD34 + البشري نخاع العظم عينة تمثيلية (C) توزيع الرسم البيانيمستويات الحامض الدليل السياسي الشامل على طول كلا فروع في CD34 البشري + نخاع العظم عينة تمثيلية. (D) مؤامرة الارتباط من مستويات الحامض الدليل السياسي الشامل من نسخة متماثلة الفني التمثيلي لعينة DNA الإنسان. (E) فطيرة رسم بياني يوضح نسب CpGs المشمولة في ERRBS التي المشروح إلى الجزر الدليل السياسي الشامل (الضوء الأخضر)، الدليل السياسي الشامل شواطئ (الرمادي) وغيرها من المناطق (أبيض) في عينة تمثيلية أعدت من الحمض النووي الجيني البشري. (F) فطيرة رسم بياني يوضح نسب CpGs المشمولة في ERRBS التي المشروح لمروجي الجين (أحمر )، الإكسونات (الأخضر)، الإنترونات (الأزرق) والمناطق بين (البنفسجية). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
| كاشف | حجم | تعليق |
| 10X T4 DNA يغاز رد فعل العازلة | 10 ميكرولتر | |
| ثلاثي الفوسفات Deoxynucleotide (dNTP) الحل ميكس | 4 ميكرولتر | مزيج من 10 ملم من كل النوكليوتيدات |
| T4 البلمرة DNA | 5 ميكرولتر | 3،000 وحدة / مل |
| البلمرة DNA أنا كبير (Klenow) قطعة | 1 ميكرولتر | 5،000 وحدة / مل |
| T4 كيناز عديد النوكليوتيد | 5 ميكرولتر | 10،000 وحدة / مل |
| المياه خالية من الدناز | 45 ميكرولتر |
الجدول 1: نهاية الكواشف رد فعل إصلاح أسماء الكاشف والكميات المستخدمة في رد فعل إصلاح نهاية (بروتوكول خطوة 2.1).
| كاشف | حجم | تعليق |
| 10X رد فعل العازلة | 5 ميكرولتر | على سبيل المثال، NEBuffer 2 |
| 1 ملم 2'-deoxyadenosine 5'-ثلاثي الفوسفات (dATP) | 10 ميكرولتر | |
| Klenow جزء (3 '→ 5' exo-) | 3 ميكرولتر | 5،000 وحدة / مل |
الجدول 2: A المخلفات الكواشف رد فعل أسماء الكاشف والكميات المستخدمة في رد فعل المخلفات ألف (بروتوكول خطوة 3.1).
| كاشف | حجم | تعليق |
| 15 ميكرومتر محولات صلب في المياه خالية من الدناز | 3 ميكرولتر | محول 1.0 و PE PE محول 2.0؛ انظر الجدول 4 للمتواليات والمراجع |
| 10X T4 DNA يغاز رد فعل العازلة | 581؛ ل | |
| T4 DNA يغاز | 1 ميكرولتر | 2،000،000 وحدة / مل |
| المياه خالية من الدناز | 31 ميكرولتر |
الجدول 3: محول ربط الكواشف رد فعل أسماء الكاشف والكميات المستخدمة في رد فعل محول ربط (بروتوكول خطوة 4.2).

الجدول 4: Oligos المستخدمة في بروتوكول ERRBS قائمة oligos المستخدمة في بروتوكول ERRBS في رد فعل ربط (بروتوكول الخطوة 4) وPCR الخطوات التضخيم (الخطوة بروتوكول 7).
| كاشف | حجم | تعليق |
| 10X FastStart الدقة العالية رد فعل العازلة وايعشر 18 ملي كلوريد المغنيسيوم | 20 ميكرولتر | |
| 10 ملي dNTP الحل ميكس | 5 ميكرولتر | |
| 25 ميكرومتر PE PCR التمهيدي 1.0 | 4 ميكرولتر | انظر الجدول 4 |
| 25 ميكرومتر PE PCR التمهيدي 2.0 | 4 ميكرولتر | انظر الجدول 4 |
| FastStart الدقة العالية أنزيم | 2 ميكرولتر | 5 وحدات / ميكرولتر FastStart طق البلمرة DNA |
| المياه خالية من الدناز | 125 ميكرولتر |
الجدول 5: PCR الكواشف رد فعل أسماء الكاشف والكميات المستخدمة في تضخيم رد فعل PCR (بروتوكول خطوة 7.1).
| خطوة بروتوكول | كاشف / بروتوكول التفاصيل | إدخال كمية DNA | ||
| 5-10 نانوغرام | 25 نانوغرام | 50 نانوغرام | ||
| 1 | MspI انزيم | 1 ميكرولتر | 2 ميكرولتر | 2 ميكرولتر |
| MspI هضم حجم رد الفعل | 50 | 100 | 100 | |
| 4 | محولات في رد فعل ربط | 1 ميكرولتر | 2 ميكرولتر | 3 ميكرولتر |
| ربط حجم رد الفعل | 20 ميكرولتر | 25 ميكرولتر | 50 ميكرولتر | |
| 5 | بروتوكول اختيار الحجم | دليل هلام فقط | التفاح الإعدادية أو هلام اليدوي | التفاح الإعدادية أو هلام اليدوي |
| 7 | PCR تركيز التمهيدي | 25 ميكرومتر | 25 ميكرومتر | 10 ميكرومتر لمدة 14 دورات، 25 ميكرومتر لمدة 18 دورات |
| عدد دورات PCR | 18 | 18 | 14-18 | |
الجدول 6: بروتوكول التعديلات خطوة لإدخال كميات مادية تتراوح 5-50 نانوغرام عدة خطوات في جميع أنحاء بروتوكول تتطلب تعديل كميات كاشف استخدامها لتوليد المكتبات جودة عالية من كميات مختلفة من المواد ابتداء. وشملت التغييرات على كميات كاشف الأساسية هنا. ضبط العازلة وكميات المياه في ردود الفعل وفقا لذلك.
| مركز حقوق الانسان | قاعدة | ساحل | تغطية | freqC | freqT |
| chr1 | 10564 | R | 366 | 85.52 | 14.48 |
| chr1 | 10571 | F | 423 | 91.25 | 8.75 |
| chr1 | 10542 | F | 432 | 91.2 | 8.8 |
| chr1 | 10563 | F | 429 | 94.64 | 5.36 |
| chr1 | 10572 | R | 366 | 96.99 | 3.01 |
| chr1 | 10590 | R | 370 | 88.11 | 11.89 |
| chr1 | 10526 | R | 350 | 92 | 8 |
| chr1 | 10543 | R | 368 | 92.93 | 7.07 |
| chr1 | 10525 | F | 433 | 91.92 | 8.08 |
| chr1 | 10497 | F | 435 | 88.74 | 11.26 |
| عدد من المكتبات ERRBS في حارة | متوسط عدد الانحياز فريد يقرأ | متوسط عدد CpGs غطى | يعني تغطية في الدليل السياسي الشامل |
| 1 | 152231184 ± 13189678 | 3183594 ± 713547 | 85 ± 16 |
| 2 | 77680837 ± 7657058 | 2674823± 153494 | 49 ± 9 |
| 3 | 49938156 ± 2436865 | 2552186 ± - 76624 | 39 ± 2 |
| 4 | 34457208 ± 4441686 | 1814461 ± 144339 | 28 ± 4 |
هو الممثل المعلمات من تسلسل المكتبات ERRBS واحدة والمضاعفة يظهر البيانات في حارة من 51 دورة واحدة للقراءة يدير التسلسل: الجدول 8. المتوسط والانحرافات المعيارية من الانحياز فريد يقرأ، وعدد من CpGs تغطية والتغطية لكل موقع الدليل السياسي الشامل تم الحصول عليها من تسلسل واحد المكتبات ERRBS في حارة (ن = 100)، وهما ERRBS المكتبات في حارة (ن = 128)، وثلاثة ERRBS المكتبات في حارة (ن = 11)، وأربعة ERRBS المكتبات في حارة (ن = 11).
Discussion
بروتوكول عرض البيانات قرار عائدات قاعدة زوج من السيتوزين مثيلة في المناطق الجينومية بيولوجيا ذات الصلة. بروتوكول كما هو مكتوب هو الأمثل لمدة 50 نانوغرام من المواد ابتداء، ومع ذلك، فإنه يمكن تكييفها للتعامل مع مجموعة واسعة من المواد المدخلات (5 نانوغرام أو أكثر) 26. وهذا سيتطلب تعديلات لبعض الخطوات البروتوكول كما رأينا في الجدول 6. والمكتبات ERRBS قابلة لليقترن التسلسل نهاية ومزيد من تغطية الجينومية ويمكن أيضا أن يتحقق عن طريق التسلسل يقرأ أطول من 51 دورات. تسلسل المضاعفة سوف نقدم بروتوكول تكلفة أقل لكل عينة، ولكن هذا سوف يؤدي إلى انخفاض تغطية لكل موقع الدليل السياسي الشامل ممثلة في البيانات (الشكل 5 والجدول 8)، وسوف لن تحقق عمق كاف من التغطية لإجراء تحليلات التي تحتاج إلى تغطية عالية في الموقع الدليل السياسي الشامل (على سبيل المثال كما وصفها Landan وآخرون. 33). وأخيرا، هذا البروتوكول (أو أي protoco القائم على بيسلفيتل) لا يمكن التمييز بين ميثيل السيتوزين وhydroxymethyl السيتوزين 46،47. ومع ذلك، فإن البيانات التي يمكن أن تكون متكاملة مع بروتوكول اخرى النتائج 48،49 لتحديد التعديلات مختلفة، والتعديلات السيتوزين أخرى ذكرت مؤخرا 50، ينبغي أن تكون ذات فائدة.
ستظهر المكتبات ذات جودة عالية كما هو مبين في الشكل 3A-C، ومرة واحدة مجمعة للتسلسل ينتج أي أثر كما هو مبين في الشكل الجيل الثالث 3G (تتبع الأحمر) تمثل مساهمات المولي متساوية من كل من الكسور المكتبة. فشل إعداد مكتبة يمكن أن تنجم عن أي خطوة أثناء العملية. إذا تم معالجة DNA المتدهورة انه سيؤدي الى المكتبات التي لم يتم التخصيب في شظايا MspI وبالتالي في تغطية الدليل السياسي الشامل منخفضة باستخدام المعلمات التسلسل الوارد وصفها في هذا البروتوكول. إذا انزيم هو غير وظيفية أو استبعادها عن غير قصد من واحدة من ردود الفعل، فإن البروتوكول لن تسفر المكتبة المتوقع. إذا كان الجرمية ربطction غير فعالة، ومحولات هي بتركيز أعلى من المتوقع، و / أو تركيز الاشعال المستخدم هو كاشف الحد للخطوات التضخيم النهائية، يمكن أن يحدث فشل المكتبة. محولات الزائدة (ينظر إليها على أنها قمم في ~ 150 شركة بريتيش بتروليوم في نتائج bioanalyzer، الشكل 3D-F) في المكتبة سوف تتداخل أيضا مع التسلسل بسبب تجميع العشوائي للكل من المكتبة ومحولات الزائدة. وفي حين أن هذا قد مكتبة تسلسل يبدو عادة، وجزء كبير من يقرأ سيكون تسلسل محول مجرد. إذا لوحظ محولات الزائدة في مكتبة، فمن الأفضل أن يكرر إعداد مكتبة اذا المواد متاحة باستخدام مواد المدخلات المثلى لمحول نسب الكمية. وأخيرا، لضمان كفاءة التضخيم PCR من المكتبات، ويتم الاحتفاظ الكسور المكتبة الدنيا والعليا كعينات منفصلة في جميع أنحاء تحويل بيسلفيت والخطوات تخصيب PCR. عدم القيام بذلك ينتج كفاءة التفاضلية من التضخيم خلال Pرد فعل CR الكسور العليا والدنيا (كما رأينا في الشكل الجيل الثالث 3G أثر الأزرق) وإمكانية التمثيل غير العادل للمواضع الجيني المعنية المشمولة في كل جزء المكتبة خلال التسلسل. يمكن للمستخدم اختيار لتشمل خطوة PCR الكمي مباشرة بعد تحويل بيسلفيت لمزيد من المعايرة دورات PCR المثلى اللازمة لتضخيم المكتبات التي يتم توليدها.
ERRBS بروتوكول إعداد مكتبة لديها العديد من الخطوات الرئيسية التي ينصح الكواشف محددة. في خطوة نهاية إصلاح، واستخدام مزيج dNTP أربعة النوكليوتيدات-يسمح للنهاية إصلاح أي منتجات لا تحتوي على عبء CG، مثل تلك الناجمة عن النشاط MspI نجوم الأنزيمية وشظايا الحمض النووي المنفصمة الموجودة في عينة DNA الأصلية. وهذا يؤدي إلى تحسين التمثيل الدليل السياسي الشامل في النتائج. في خطوة ربط فمن الأهمية بمكان أن استخدام يغاز تركيز عال (2،000،000 وحدة / مل)، ومحولات مميثل للتأكد من أن reacti ربطعلى غير كفاءة وأن تحويل بيسلفيت لا يؤثر على تسلسل محول الأساسية للدقيقة محاذاة البيانات. في خطوة PCR، وذلك باستخدام البلمرة قادرة على تضخيم-GC الغنية شظايا الحمض النووي المعالجة بيسلفيت هو ضروري لخصوصية عالية. وأخيرا، لضمان القضاء على محولات الزائدة والاشعال، سبري حبة تنقية (على سبيل المثال: Agencourt AMPure XP) يوصى بدلا من المقايسات مقرها عمود لربط والعزلة المنتج PCR.
من أجل توليد بيانات عالية الجودة، من المهم لضمان كفاءة تحويل بيسلفيت. سيطرة قدمت وتقدم للمستخدم القدرة على تحديد كفاءة التحويل قبل التسلسل. وكبديل لذلك، وهو DNA غير البشرية مثل امدا DNA يمكن أن تستخدم بمثابة الرقابة الداخلية (ارتفاع في). بسبب الاختلافات في الأنواع، وهذا النوع من عنصر تحكم يمكن إدراجها مباشرة في التسلسل المصب (على سبيل المثال كما يستخدمه يو، وآخرون. 34). ومع ذلك، إذا أنا وارتفاع فيق المستخدمة، فإنه لا يمكن أن تستخدم لتحديد كفاءة التحويل السابقة لتسلسل مكتبة إلا إذا تضخمت بشكل فريد والتسلسل قبل التسلسل مكتبة مستقل. وتستند أسعار التحويل تحديدها عن حالة مثيلة في مواقع غير الدليل السياسي الشامل. هذا قد لا يكون مناسبا للاستخدام في سياق ارتفاع السيتوزين مثيلة في عدم الدليل السياسي الشامل للسياق (على سبيل المثال الخلايا الجذعية الجنينية) وعينات موازية أو غيرها من وسائل تقييم لكفاءة التحويل يمكن استخدامها لهذا الغرض.
هناك بعض المحاذير إلى عنوان التي هي فريدة من نوعها لتسلسل المكتبات ERRBS. الأسس الثلاثة الأولى من الكسور مكتبة التسلسل هي تقريبا بشكل موحد غير عشوائية بسبب MspI الاعتراف الموقع قطع (C ^ CGG؛ انظر الشكل 4B، C). هذه النتائج في إمكانية فقدان البيانات الهامة نظرا لجودة منخفضة يقرأ الناجمة عن سوء توطين العنقودية على الرغم من كثافة واضحة العنقودية عالية خلال التسلسل. للتغلب على هذا الحاجز،تشمل مكتبة تعقيد عالية في حارة المستقلة (السيطرة PhiX أو غيرها من نوع المكتبة) كما حارة مخصصة للتحكم. المكتبات تعقيد عالية لها نهايات تحتوي على التمثيل المتوازن للA، C، T وG في أول أربع قواعد التسلسل. وتشمل الممرات السيطرة مناسبة المكتبات مثل RNA وما يليها، ورقاقة وما يليها، كله تسلسل الجينوم، أو عنصر تحكم المقدمة من قبل الشركة المصنعة آلة التسلسل (على سبيل المثال مراقبة PhiX V3). عندما توصف بأنها ممر السيطرة على المدى تسلسل منها، يمكن أن تكون بمثابة أساس للجيل المصفوفة التي استخدمت أثناء القواعد الأربعة الأولى من تسلسل للكشف عن مواقف المجموعة. جودة أعلى يقرأ اعتقلت سيرفع التغطية المتوسط لكل موقع الدليل السياسي الشامل بنسبة 5.2 (ن = 4). بدلا من ذلك، يمكن أيضا أن هذه الصعوبة الفنية يمكن التغلب عليها باستخدام نهج التسلسل الظلام كما هو موضح سابقا 23. معايير أخرى تتبع تسلسل إجراءات التشغيل القياسية في البروتوكولات المصنعة. وأخيرا، فإن التغطية في الدليل السياسي الشامل جستوجه هوزن لتحليل البيانات من قبل المستخدم وجزئيا على الأسئلة البيولوجية من الفائدة. 10X عتبة تغطية تتيح نهج تحليل التغطية العالية، ولكن هذه العتبة يمكن خفض يجب أن تكون ذات فائدة.
مناقشة الكاملة لتحليل البيانات ERRBS هي خارج نطاق هذا المقال، ومع ذلك، تفاضلي cytosines والمناطق ميثليته يمكن تحديد باستخدام أدوات مفتوحة المصدر 31،51-53. تم اعتبارات التحليل إضافية والنهج وصفها جيدا 54،55، ويشجع القارئ للبحث في الأدب لأكثر الأدوات المناسبة لتحليل المخطط لها.
بالمقارنة مع الطرق الأخرى المنشورة، ERRBS يقدم البروتوكول لمدة أربعة أيام والتي عندما يؤديها كما غلة وصف ارتفاع معدلات التكاثر. تم التحقق من صحة ذلك مقارنة مع معيار الذهب MassARRAY EpiTYPER 26، هو للبيانات تغطية عالية فعالة من حيث التكلفة، وغير قابلة للتكيف لمختلف المواد المدخلاتكميات (مواتية لأنواع تجهيز العينات السريرية وخلية أخرى من التردد المنخفض) ونهج التسلسل. ويقدم قرار قاعدة الزوج عند مواضع ذات الصلة بيولوجيا، ويمكن استخدامها في تحليل تكاملية مع تقنيات أخرى التنميط الجينوم على نطاق عامل النسخ ملزمة، لونين إعادة عرض، وعلامات جينية والتعديلات السيتوزين الأخرى ذات الاهتمام. استخدام البيانات ERRBS في مثل هذه الدراسات يمكن أن تسهم في نهج شامل والجزيئية تسمح عالية الأبعاد يحلل في دراسة النماذج البيولوجية والأمراض التي تصيب البشر.
Disclosures
الكتاب ليس لديهم تضارب المصالح في الكشف عنها.
Acknowledgements
We thank all the authors of the original ERRBS report. We thank Mame Fall for technical assistance. We acknowledge the Weill Cornell Medical College Epigenomics Core for technical services and assistance. The work was supported by a Sass Foundation Judah Folkman Fellowship, an NCI K08CA169055 and ASH-AMFDP12005 to FGB, NIH R01HG006798 and R01NS076465, funding from the Irma T. Hirschl and Monique Weill-Caulier Charitable Trusts and STARR Consortium (I7-A765) to CEM, and an LLS SCORE grant (7006-13) to AMM.
Materials
| Name | Company | Catalog Number | Comments |
| MspI | New England Biolabs | R0106M | 100,000 units/ml |
| NEBuffer 2 | New England Biolabs | B7002S | Reaction buffer for MspI enzyme; protocol step 1.2 |
| Phenol solution | Sigma-Aldrich | P4557 | Equilibrated with 10 mM Tris HCl, pH 8.0; see safety and handling instructions at http://www.sigmaaldrich.com/catalog/product/sigma/p4557 |
| Chloroform | Sigma-Aldrich | C2432 | See safety and handling instructions at http://www.sigmaaldrich.com/catalog/product/sial/c2432 |
| Glycogen | Sigma-Aldrich | G1767 | 19-22 mg/ml |
| NaOAc | Sigma-Aldrich | S7899 | 3 M, pH 5.2 |
| Ethanol | Sigma-Aldrich | E7023 | 200 proof, for molecular biology |
| Buffer EB | Qiagen | 19086 | 10 mM Tris-Cl, pH 8.5 |
| tris(hydroxymethyl)aminomethane (Tris) | Sigma-Aldrich | T1503 | prepare a 1 M, pH 8.5 solution |
| Tris- Ethylenediaminetetraacetic acid (TE) | Sigma-Aldrich | T9285 | Dilute to 1x buffer solution per manufacturer's recommendations |
| T4 DNA Ligase Reaction Buffer | New England Biolabs | B0202S | 10x concentration |
| Deoxynucleotide triphosphate (dNTP) Solution Mix | New England Biolabs | N0447L | 10 mM each nucleotide |
| T4 DNA Polymerase | New England Biolabs | M0203L | 3,000 units/ml |
| DNA Polymerase I, Large (Klenow) Fragment | New England Biolabs | M0210L | 5,000 units/ml |
| T4 Polynucleotide Kinase | New England Biolabs | M0201L | 10,000 units/ml |
| QIAquick PCR Purification Kit | Qiagen | 28104 | Used for DNA product purification in protocol step 2.3 |
| 2'-deoxyadenosine 5'-triphosphate (dATP) | Promega | U1201 | 100 mM |
| Klenow Fragment (3'→5' exo-) | New England Biolabs | M0212L | 5,000 units/ml |
| MinElute PCR Purification Kit | Qiagen | 28004 | Used for DNA product purification in protocol step 3.3 |
| T4 DNA Ligase | New England Biolabs | M0202M | 2,000,000 units/ml |
| Methylation Adapter Oligo Kit | Illumina | ME-100-0010 | |
| Agencourt AMPure XP | Beckman Coulter | A63881 | Used in protocol sections that implement magnetic bead purification steps (steps 4.3 and 8.2). Equilibrate to room temperature before use. |
| Pippin Prep Gel Cassettes, 2% Agarose, dye-free | Sage Science | CDF2010 | with internal standards |
| Certified Low Range Ultra Agarose | Bio-Rad | 161-3106 | |
| Tris-Borate-EDTA (TBE) buffer | Sigma-Aldrich | T4415 | |
| Ethidium bromide solution | Sigma-Aldrich | E1510 | 10 mg/ml |
| 50 bp DNA Ladder | NEB | N3236S | |
| 100 bp DNA Ladder | NEB | N3231S | |
| Gel Loading Dye, Orange (6x) | NEB | B7022S | |
| Scalpel Blade No. 11 | Fisher Scientific | 3120030 | |
| QIAquick Gel Extraction Kit | Qiagen | 28704 | |
| EZ DNA Methylation Kit | Zymo Research | D5001 | Used in protocol step 6.2 |
| EZ DNA Methylation-Lightning Kit | Zymo Research | D5030 | Alternative for step 6.2 |
| Universal Methylated Human DNA Standard | Zymo Research | D5011 | Used as bisulfite conversion control |
| FastStart High Fidelity PCR System | Roche | 03553426001 | |
| Qubit dsDNA High Sensitivity Assay Kit | Life Technologies | Q32854 | A fluorescence-based DNA quantitation assay; used in protocol steps 1.1, 9.1 and 10.1 |
| DynaMag-2 Magnet | Life Technologies | 12321D | |
| High Sensitivity DNA Kit | Agilent Technologies | 5067-4626 | |
| 2100 Bioanalyzer | Agilent Technologies | ||
| PhiX Control v3 | Illumina | FC-110-3001 | |
| HiSeq 2500 | Illumina | ||
| Pippin Prep | Sage Science | ||
| Qubit 2.0 Fluorometer | Life Technologies | Q32872 | |
| TruSeq SR Cluster Kit v3-cBot-HS | Illumina | GD-401-3001 | |
| TruSeq SBS Kit v3-HS | Illumina | FC-401-3002 | |
| TruSeq RNA Sample prep | Illumina | RS-122-2001 | Barcoded adapters used for multiplexing libraries; See Supplemental file for multiplexing protocol. |
| Microcentrifuge | |||
| Vortex Mixer | |||
| Dry Block Heater | |||
| Thermal Cycler | |||
| Water Bath | |||
| Gel electrophoresis system | |||
| Electrophoresis power supply | |||
| Gel doc | |||
| UV or blue light transilluminator |
References
- Jones, P. A. Functions of DNA methylation: islands, start sites, gene bodies and beyond. Nat Rev Genet. 13 (7), 484-492 (2012).
- Barlow, D. P. Genomic imprinting: a mammalian epigenetic discovery model. Annual Review Of Genetics. 45, 379-403 (2011).
- Thiagarajan, R. D., Morey, R., Laurent, L. C. The epigenome in pluripotency and differentiation. Epigenomics. 6 (1), 121-137 (2014).
- Reik, W. Stability and flexibility of epigenetic gene regulation in mammalian development. Nature. 447 (7143), 425-432 (2007).
- Hartnett, L., Egan, L. J. Inflammation, DNA methylation and colitis-associated cancer. Carcinogenesis. 33 (4), 723-731 (2012).
- Smith, Z. D., Meissner, A. DNA methylation: roles in mammalian development. Nat Rev Genet. 14 (3), 204-220 (2013).
- Li, E., Bestor, T. H., Jaenisch, R. Targeted mutation of the DNA methyltransferase gene results in embryonic lethality. Cell. 69 (6), 915-926 (1992).
- Okano, M., Bell, D. W., Haber, D. A., Li, E. DNA methyltransferases Dnmt3a and Dnmt3b are essential for de novo methylation and mammalian development. Cell. 99 (3), 247-257 (1999).
- Feinberg, A. P. Phenotypic plasticity and the epigenetics of human disease. Nature. 447 (7143), 433-440 (2007).
- Bock, C. Epigenetic biomarker development. Epigenomics. 1 (1), 99-110 (2009).
- Laird, P. W. The power and the promise of DNA methylation markers. Nat Rev Cancer. 3 (4), 253-266 (2003).
- How Kit, A., Nielsen, H. M., Tost, J. DNA methylation based biomarkers: practical considerations and applications. Biochimie. 94 (11), 2314-2337 (2012).
- Mikeska, T., Bock, C., Do, H., Dobrovic, A. DNA methylation biomarkers in cancer: progress towards clinical implementation. Expert Review Of Molecular Diagnostics. 12 (5), 473-487 (2012).
- Gyparaki, M. T., Basdra, E. K., Papavassiliou, A. G. DNA methylation biomarkers as diagnostic and prognostic tools in colorectal cancer. Journal of Molecular Medicine. 91 (11), 1249-1256 (2013).
- Figueroa, M. E., et al. DNA methylation signatures identify biologically distinct subtypes in acute myeloid leukemia. Cancer Cell. 17 (1), 13-27 (2010).
- Heyn, H., Mendez-Gonzalez, J., Esteller, M. Epigenetic profiling joins personalized cancer medicine. Expert review of Molecular Diagnostics. 13 (5), 473-479 (2013).
- Kulis, M., Esteller, M. DNA methylation and cancer. Advances in Genetics. 70, 27-56 (2010).
- Xiong, Z., Laird, P. W. COBRA: a sensitive and quantitative DNA methylation assay. Nucleic Acids Res. 25 (12), 2532-2534 (1997).
- Meissner, A., et al. Reduced representation bisulfite sequencing for comparative high-resolution DNA methylation analysis. Nucleic Acids Res. 33 (18), 5868-5877 (2005).
- Gu, H., et al. Preparation of reduced representation bisulfite sequencing libraries for genome-scale DNA methylation profiling. Nat Protoc. 6 (4), 468-481 (2011).
- Bock, C., et al. Quantitative comparison of genome-wide DNA methylation mapping technologies. Nat Biotechnol. 28 (10), 1106-1114 (2010).
- Harris, R. A., et al. Comparison of sequencing-based methods to profile DNA methylation and identification of monoallelic epigenetic modifications. Nat Biotechnol. 28 (10), 1097-1105 (2010).
- Boyle, P., et al. Gel-free multiplexed reduced representation bisulfite sequencing for large-scale DNA methylation profiling. Genome Biol. 13 (10), R92 (2012).
- Chatterjee, A., Rodger, E. J., Stockwell, P. A., Weeks, R. J., Morison, I. M. Technical considerations for reduced representation bisulfite sequencing with multiplexed libraries. Journal of Biomedicine & Biotechnology. 2012, 741542 (2012).
- Lee, Y. K., et al. Improved reduced representation bisulfite sequencing for epigenomic profiling of clinical samples. Biological Procedures Online. 16 (1), 1 (2014).
- Akalin, A., et al. Base-pair resolution DNA methylation sequencing reveals profoundly divergent epigenetic landscapes in acute myeloid leukemia. PLoS Genet. 8 (6), e1002781 (2012).
- Hatzi, K., et al. A Hybrid Mechanism of Action for BCL6 in B Cells Defined by Formation of Functionally Distinct Complexes at Enhancers and Promoters. Cell Reports. 4 (3), 578-588 (2013).
- Will, B., et al. Satb1 regulates the self-renewal of hematopoietic stem cells by promoting quiescence and repressing differentiation commitment. Nature Immunology. 14 (5), 437-445 (2013).
- Lu, C., et al. Induction of sarcomas by mutant IDH2. Genes Dev. 27 (18), 1986-1998 (2013).
- Kumar, R., et al. AID stabilizes stem-cell phenotype by removing epigenetic memory of pluripotency genes. Nature. 500 (7460), 89-92 (2013).
- Li, S., et al. An optimized algorithm for detecting and annotating regional differential methylation. BMC Bioinformatics. 14, S10 (2013).
- Patterson, K., Molloy, L., Qu, W., Clark, S. DNA methylation: bisulphite modification and analysis. Journal of Visualized Experiments. (56), 3170 (2011).
- Landan, G., et al. Epigenetic polymorphism and the stochastic formation of differentially methylated regions in normal and cancerous tissues. Nat Genet. 44 (11), 1207-1214 (2012).
- Yu, M., et al. Tet-assisted bisulfite sequencing of 5-hydroxymethylcytosine. Nat Protoc. 7 (12), 2159-2170 (2012).
- Goecks, J., Nekrutenko, A., Taylor, J., Galaxy, T. Galaxy: a comprehensive approach for supporting accessible, reproducible, and transparent computational research in the life sciences. Genome Biol. 11 (8), R86 (2010).
- Dorff, K. C., et al. GobyWeb: simplified management and analysis of gene expression and DNA methylation sequencing data. PLoS One. 8 (7), e69666 (2013).
- Roehr, J. T., Dodt, M., Ahmed, R., Dieterich, C. Flexbar − flexible barcode and adapter processing for next-generation sequencing platforms. MDPI Biology. 1 (3), 895-905 (2012).
- Martin, M. Cutadapt removes adapter sequences from high-throughput sequencing reads. EMBnet.journal, North America. 17 (1), 10-12 (2011).
- Bolger, A. M., Lohse, M., Usadel, B. Trimmomatic: a flexible trimmer for Illumina sequence data. Bioinformatics. 30 (15), 2114-2120 (2014).
- Needleman, S. B., Wunsch, C. D. A general method applicable to the search for similarities in the amino acid sequence of two proteins. J Mol Biol. 48 (3), 443-453 (1970).
- Krueger, F., Andrews, S. R. Bismark: a flexible aligner and methylation caller for Bisulfite-Seq applications. Bioinformatics. 27 (11), 1571-1572 (2011).
- Li, H., et al. The Sequence Alignment/Map format and SAMtools. Bioinformatics. 25 (16), 2078-2079 (2009).
- Kent, W. J., et al. The human genome browser at UCSC. Genome Res. 12 (6), 996-1006 (2002).
- Thorvaldsdottir, H., Robinson, J. T., Mesirov, J. P. Integrative Genomics Viewer (IGV): high-performance genomics data visualization and exploration. Briefings in Bioinformatics. 14 (2), 178-192 (2013).
- Team, R. C. R. A language and environment for statistical computing. R Foundation for Statistical Computing. Vienna, Austria. ISBN 3-900051-07-0, (2012).
- Nestor, C., Ruzov, A., Meehan, R., Dunican, D. Enzymatic approaches and bisulfite sequencing cannot distinguish between 5-methylcytosine and 5-hydroxymethylcytosine in DNA. BioTechniques. 48 (4), 317-319 (2010).
- Huang, Y., et al. The behaviour of 5-hydroxymethylcytosine in bisulfite sequencing. PLoS One. 5 (1), e8888 (2010).
- Yu, M., et al. Base-resolution analysis of 5-hydroxymethylcytosine in the mammalian genome. Cell. 149 (6), 1368-1380 (2012).
- Song, C. X., et al. Genome-wide profiling of 5-formylcytosine reveals its roles in epigenetic priming. Cell. 153 (3), 678-691 (2013).
- Ito, S., et al. Tet proteins can convert 5-methylcytosine to 5-formylcytosine and 5-carboxylcytosine. Science. 333 (6047), 1300-1303 (2011).
- Akalin, A., et al. methylKit: a comprehensive R package for the analysis of genome-wide DNA methylation profiles. Genome Biol. 13 (10), R87-1186 (2012).
- Stockwell, P. A., Chatterjee, A., Rodger, E. J., Morison, I. M. DMAP: Differential Methylation Analysis Package for RRBS and WGBS data. Bioinformatics. 30 (13), 1814-1822 (2014).
- Sun, D., et al. MOABS: model based analysis of bisulfite sequencing data. Genome Biol. 15 (2), R38 (2014).
- Bock, C. Analysing and interpreting DNA methylation data. Nat Rev Genet. 13 (10), 705-719 (2012).
- Rivera, C. M., Ren, B. Mapping human epigenomes. Cell. 155 (1), 39-55 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved