Method Article
Baz Çifti Çözünürlük DNA metilasyon Değerlendirme Temsil bisülfit sıralamayı İndirimli pekiştirilmiş
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Enhanced Reduced Representation Bisulfite Sequencing is a method for the preparation of sequencing libraries for DNA methylation analysis based on restriction enzyme digestion combined with cytosine bisulfite conversion. This protocol requires 50 ng of starting material and yields base pair resolution data at GC-rich genomic regions.
Özet
DNA metilasyon motifi eşleme ağır normal ve hastalıklı dokularda incelenmiştir. Çeşitli yöntemler hücrelerinde sitozin metilasyonu desenleri sorgulamak için kurulmuştur. Tüm genom dizileme bisülfit İndirimli temsil GC-zengin genomik loci nicel baz çifti çözünürlüğü sitozin metilasyonu kalıplarını tespit için geliştirilmiştir. Bu bisülfit dönüşümü, ardından, bir kısıtlama enzimi kullanımını birleştirilmesiyle gerçekleştirilir. Geliştirilmiş Düşük Temsil bisülfit dizileme (ERRBS) kapalı biyolojik ilgili genomik lokusları arttırır ve insan, fare ve diğer organizmalardan DNA sitozin metilasyonu profil kullanılmıştır. ERRBS kütüphanesi hazırlanmasında kullanım için, düşük molekül ağırlıklı parçaları üretmek için DNA, sınırlama enzimi özümlemesi ile başlatılır. Bu parçalar, yeni nesil dizileme için standart kütüphane yapımı tabi tutulur. Nihai amplificati önce metillenmemiş sitozinlerin bisülfit dönüşümüadım kapalı genomik loci sitozin metilasyon seviyelerinin nicel taban çözünürlüğü sağlar. protokol dört gün içinde tamamlanabilir. Belirlenmiş bir dizilim kontrol şeridini kullanarak sıralandı ilk üç üsleri düşük karmaşıklık rağmen, ERRBS kütüphaneleri yüksek kaliteli veri elde. Haritalama ve biyoinformatik analizi, daha sonra yapılır ve verim verileri kolayca genom platformlarda çeşitli entegre edilebilir. ERRBS bu mümkün araştırma uygulamaları bir dizi insan klinik örnekleri ve uygulanabilir işlemek için yapım küçük giriş malzeme miktarlarını kullanabilir. üretilen bir video ERRBS protokol kritik adımları gösterir.
Giriş
Sitosin (5-metilsitosin) DNA metilasyonu, biyolojik süreçlerin çeşitli memeli hücrelerinde önemli dahil, ancak baskılı X kromozomu inaktivasyonu, geliştirme ve gen ifadesinin 1-8 düzenlenmesi ile sınırlı değildir epigenetik işaretidir. Malign ve diğer bozukluklar DNA metilasyon desen çalışması hastalığa özgü desenleri tespit ve hastalık patogenezinde ve potansiyel biyomarker keşifler 9-17 anlayışına katkıda bulunmuştur. DNA metilasyonu durumu epigenom sorguya birçok protokol vardır. Bu afinite göre ayrılabilir, kısıtlayıcı enzim bazlı ve aşağı mikrodizi veya sıralama platformları kullanan Bisülfit dönüşümü-ölçülür. Ayrıca, bu genel kategoriler de dahil olmak üzere, ancak, Kombine bisülfit Kısıtlama Analizi 18 ile sınırlı ve Temsil bisülfit sıralamayı (RRBS 19) İndirimli olmayan köprü, birkaç protokoller vardır.
RRBS başlangıçta Meissner et al. 19,20 tarafından tarif edilmiştir. protokol maliyeti 21,22 etkilidir nicel baz çifti çözünürlük verileri sonuçlandı bisülfit sıralama, ardından GC-zengin genomik bölgeleri zenginleştirmek için bir adım tanıttı. GC-zengin bölgeler MspI (C ^ CGG) kısıtlama enzimi tarafından hedeflenen, ve sitozin metilasyonu polimeraz zincir reaksiyonu (PCR) amplifikasyonu ardından sitosinlerin bisülfit dönüşüm (urasile değiştirilmemiş sitosinlerin Deaminasyon), tarafından çözümlenir. RRBS gen promoterleri ve tüm genom sekanslama için gerekli bir kısmını CpG adalarının kısmını içermektedir; Ancak RRBS CpG kıyıları ve biyolojik alaka diğer arası bölgelerde sınırlı kapsama vardı. Çeşitli gruplar bu genomik bölgelerin 23-25 metodoloji ve sonuç kapsama üzerine geliştirmek orijinal rapordan bu yana RRBS protokolleri güncellendi yayınladı var. Geliştirilmiş İndirimli Temsil bisülfit aşağıya bakınızencing (ERRBS) RRBS göre kütüphane hazırlık değişiklikler ve alternatif veri uyum yaklaşımı 26 içermektedir. ERRBS üretilen veriler temsil CpG'lerin daha yüksek bir sayısı ile sonuçlandı ve genomik bölgelerinin kapsamı 26 sorguya artmıştır. Bu yöntem, insan hastaya ve diğer hayvan örneklerinde 26-30 DNA metilasyon modelleri gidermek için kullanılmıştır.
ERRBS protokolü tamamlanması ve temsili insan DNA'sı kullanılarak oluşturulan veriler için gerekli adımlar teklifleri ayrıntıları tarif edildiği gibi (örnekler, daha önce rapor de tanımlanan hasta numunelerinin 31 elde edilir ve normal bir insan vericiden bir CD34 + kemik iliği numunesi edildi). Protokol numune başına işleme süresini azaltır ve kütüphane büyüklüğü seçiminde fazla ayrıntı için sağlayan otomatik bir boyut seçim süreci içerir. Protokol, bilinen moleküler biyoloji teknikleri, bir dizi bir araya getirir. Yüksek molekül ağırlıklı DNA ağırlık sindirilirson-tamir A-atık ve metillenmiş bağlanmasının ardından metilasyona duyarlı restriksiyon enzimi (MspI) i. GC açısından zengin parçalarının boyutları seçimi bisülfit dönüşümü ve dizileme için önceki PCR tarafından takip edilir. Bisülfit dönüşüm önce yapılmış 32 tarif ve veri analizi ve uygulamaları detaylı yorum öneriler ve referanslar okuyucuların kullanımı için dahil edilir, ancak bu yazının kapsamı, ötesinde olmuştur. protokol, dört gün boyunca yapılan ve küçük girişi (50 ng veya daha az) malzeme miktarlarına müsait olabilir. diferansiyel metilasyon Alanı ve bölgesi belirlemeleri için değil, aynı zamanda epigenetik polimorfizm tespiti için sadece yeterli CpG site başına yüksek içerisinde tarif edilen verimler veri olarak protokol ve ark. 33 Landan tarafından tarif edildiği gibi.
Protokol
Idam tüm işlemler Tıp Kurumsal Hayvan Bakımı ve Kullanımı Komitesi Indiana Üniversitesi tarafından onaylanmış ve Sağlık kılavuzların Ulusal Enstitüsü takip edilmektedir.
1. Cerrahi Tekniği
- Steril eldiven, aletler ve NIH kurallarına 25 göre steril cerrahi alanını kullanarak bu işlem sırasında aseptik teknik koruyun. Onları otoklav ile ameliyat başlamadan önce araçları sterilize (tam liste için özel Reaktifler / Ekipman Tablo). Operasyon sırasında araçları sterilize etmek için bir cam boncuk sterilizatör kullanın.
2. Anestezi ve Hazırlık
- Bir veteriner izofluran buharlaştırıcı sistemi kullanılarak 0.9 L / dk oksijen ve% 2.5 izofluran karışımı ile anestezi kutusuna fare anestezisi. Fare kutusundan çıkarmadan önce vücut pozisyonunda değişikliklere yanıt vermez emin olun.
- Mou oftalmik merhem sürünSE gözleri kurumasını onları korumak için.
- Burun konisi kutuya gaz akışını geçin. Koni içinde kendi burun ve ağız ile cerrahi ped ve emici tezgah kağıdı ile kaplı bir ısıtılmış pad üzerinde sol tarafta kare fare yerleştirin. Sürekli farenin solunum ritmi ve hızı izlemek ve gerektiğinde izofluran seviyelerini ayarlamak - anestezi yeterli düzeyde tutmak için (2,5 ila% 3 izofluran), toplam sedasyon onaylamak için ayak tutam refleksini kullanın.
3. Cerrahi Yaklaşım
- Hizalayın ve cerrahi alan ile stereoskopla odak. Burun konisi ayarlayın ve görme alanının kenarında konumlandırılmış böylece aşağı bantlayın.
- Fare sol tarafta yalan, kesi yapılacaktır kulağın arkasındaki alanı açığa burun konisi sağ kulak kenarına bantlayın. Posterior aurikular ven kulağa boyunca yatay hareket emin olun. Not t doğru yerleştirmeO hayvan ve kulak bantlama hızlı yüz siniri bulmak için çok önemlidir.
- Ve% 70 etanol ile kulak arkasında kürk ıslatın ve bir jilet veya neşter bıçak kullanarak cerrahi siteyi tıraş. Ön ıslatma kürk, bu anatomik konumda kolay tıraş sağlar.
- % 70 etanol ile ve ardından bu Betadinede cerrahi fırçalama (% 7.5 povidon-iyot) gibi bir iyot çözeltisi ile deri temizleyin. Iyice bölgeyi dezenfekte bu temizlik iki kez daha tekrarlayın.
- , Kesi yapmak kulak çıkıntı için alan posterior kaudal kulak arka aurikular ven iz yeri belirlemek için. Çıkıntı 3 mm posterior - yaylı makas kullanarak, 4 mm'lik kesi 2 yapmak.
- Künt diseksiyon kullanarak deri altı yağ ve fasya ile ayır. Kan damarları veya kas dokusu kolayca zarar görebilir, çünkü makas ile doğrudan kesme kaçının.
- Kanama oluşursa, steril bir pamuklu çubukla cerrahi bölgeye baskı uygulamaken az 30 saniye boyunca karıştırılmıştır. Belirgin sıvı kaybı meydana gelmesi durumunda, fazla 25 ya da 27 G iğne kullanılarak steril% 0.9 tuzlu su çözeltisi 0.5 ml ile periton içine fare enjekte edilir.
- Yüz siniri bulmak için, birkaç anahtar yerler, spinal aksesuar sinir, kulak kanalına kullanın ve (aşağıda açıklanmıştır) digastrik kas anterior. Fasiyal sinirin dalları görüntülenmiştir kadar bu yerler etrafında ayır. o zaman ortaya sinir önemli bir beyaz katı bir yapı olarak görünür ve fasya tabakası altında yatan yapılara bunu yapışır.
- Deri altı yağ ve fasya disseke edilmiş bir kez, trapez kasını innerve kafatası kaudal kısmından geçecek spinal aksesuar sinir, bulun. fasial sinir, spinal aksesuar sinir derin.
- Inci beyazı görünüyor ve fasiyal sinirin rostralinde görülebilir kıkırdak kulak kanalı bulun.
- Üst ve c yatıyor ön digastrik kas kas karın bulfasiyal sinirin için audal.
- Fasial sinirin ana dalları görüntülenmiştir zaman, Stylomastoid foramende kendi kökenini bulmak için dorsal onları iz. , Açık cerrahi siteyi tutun sinirin yolu takip bahar makas ipuçlarını ilerlemek, daha sonra açık yeni gelişmiş alan tutmak için dorsal forseps taşımak için ince uçlu Dumont forseps # 5/45 kullanma.
- Bu noktada elmacık, yanak ile fasiyal sinirin gövdesini ve marjinal mandibular dalı gözünüzde canlandırın.
NOT: Temporal dal foramen yakın bulunacaktır. üst ve alt bölüme marjinal mandibular sinir dalları yakın çene, böylece bu sinir dalları bu düzeyde görünür olmayacaktır.- Bir sinir transeksiyonu performans ise, ince uçlu forseps ile yavaşça sinir stabilize ve yaylı makas ile sinir kesti. Beyin sapından sinir avulsing önlemek için forseps ile sinire çok çekiş uygulamaktan kaçının. İtBirbirlerinden uzakta, ya da kesilmiş ve distal sinir bir kısmını çıkarmadan kütükleri hiçbir yeniden bağlanma oluşabilir sağlamak için.
- Bir ezilme yaralanması gerçekleştirmek, sonra, tüm aksonlar sever ilk ezilme sitesine dik ikinci bir açıyla bu ezmek tekrarlamak için sabit basınç kullanarak 30 saniye boyunca sinir sıkıştırmak için Dumont # 5/45 forseps kullanabilir. Aksi takdirde yaralanma hayvanlar arasında tutarsız olacaktır, 30 sn ezmek sırasında basınç değişken miktarlarda uygulamaktan kaçının.
4. Kapanış ve Kurtarma
- Altta yatan yapıları üzerinde yağ ve kas yerleştirin.
- Kesi kenarlarını yaklaştığı ve 7,5 mm yara klibi kullanarak yara kapatın. Dikişler ya da yapıştırıcı aynı zamanda yara kapatma için kabul edilebilir. Ameliyat sonrası analjezikler, şu anda temin edilebilir.
- Farenin kulağına bandı çıkarın. Izofluran akışını kapatın ve fare 1 dakika 30 saniye için saf oksijen solumak için izin verir. Planestezi kurtarmak için hiçbir yatak ile boş bir kafes içinde fare ace.
- Fare kurtarıldı zaman, yüz felci doğrulayıcı belirtileri için davranışlarını incelemek. bıyıkları felç ve sırt yanak doğru açılı olacak, burun sapma olacak, ve göz hava puf yanıt yanıp olmaz.
- Ev hayvanlar ortaklaşa ameliyattan sonra onlar kadın iseniz. Daha agresif ve zorla enfeksiyona yol açar onların cagemate yara klipleri, kaldırmak eğilimindedir çünkü ortaklaşa erkek fareler konut kaçının. Gerekirse, şu anda cerrahi sonrası analjezik sağlayın.
- Hiçbir enfeksiyon ya da diğer bir komplikasyon postoperatif meydana sağlamak için ameliyattan sonra birkaç gün günde bir defa fareler izleyin. Kendi üzerinde düşmüş değil varsa ameliyattan sonra 10 gün - yara klipleri 7 çıkarın.
- Göz kırpma refleksi yeniden ya kadar günlük kornea komplikasyonları önlemek için etkilenen göze göz merhemi yağlama Uygulaörtülü veya ötenazi kadar.
Sonuçlar
Şekil 1 açıklanan protokol boyunca açıklanmıştır önemli adımlar, vurgulayarak, ERRBS bir bakış sağlar. ERRBS kütüphaneler 50 ng giriş DNA kullanılarak hazırlandı.
Hazırlanan kütüphaneler kalitesini değerlendirmek. Kütüphane üretim rutin 150-250 bp ve 250-400 bp (Şekil 3A-C) fraksiyonu boyutlarını verir. Örnekler arasında kütüphane boyutu dağılımları hafif farklılıklar bekleniyor. Belirli bir dizinin zenginleşme göstergesi çok yoğun DNA boyutları, orada hem alt hem de üst kütüphane fraksiyonları unutmayın. Tekrar eden bir DNA aile zenginleştirilmesinde MspI parçalama 190 bp, 250 bp ve ERRBS kütüphanelerinde 310 bp insan genomunda bulunan sıralar. Bu üç tekrarlar (Şekil 3A-C ve 3G bakınız) ERRBS kitaplığı 20 bir karakteristik imza temsil eder. Temsilci kütüphaneler bir nesil dizisine dizildir kullanarak tek uç okur. Bir Illumina HiSeq 2500 dizileyiciye tavsiye kütüphane konsantrasyonunda yüklerken, mm 2 başına 500,000-700,000 küme yoğunlukları bekleniyor. Kümelerin bu kümelenme yoğunluğu,% 81.6 ± 3.14% (n = 81) filtre (Şekil 4A) geçmektedir. Nedeniyle kütüphane ekler düşük karmaşıklık ucuna (MspI tanıma sitesi: C ^ CGG) bağımsız denetim şeritli ise, sıralama sırasında kaydedilen yoğunluk değerleri ve kalite puanları, ancak, ilk üç bazlar (Şekil 4B-C) derece değişken olduğu (tartışma) dahil, üslerinden 85% 30 veya daha fazla kalite puanları olacak (S30 değerleri Şekil 4D).
Veri hizalama ve protokol verimleri baz-çifti çözünürlük verilerinin de tarif edildiği gibi sitosin metilasyon tayini (Tablo 7). İnsan genomu için, yüksek çıkış modunda bir HiSeq 2500 bir şeritte bir ERRBS kütüphanesinin bir 51-döngüsü tek okunan sıralama çalışma düzenlily 153.194.882 12.918.302 ± toplam kalite filtreleme ve adaptör verimleri kırparak sonra 152.231.183 13.189.678 ± analiz boru hattı içine girişi için okur okur üretir. Bir ERRBS kütüphanesi için ortalama haritalama verimliliği 10x CpG başına minimum kapsama ve 84,94 ± 16,29 (n = 100) CpG'nin başına ortalama kapsama tipik 62.95% 3.183.594 ± 713.547 CpG'lerin gösterimi ile% 5.92 ± olduğunu.
ERRBS protokolü (: çoğaltılmış sıralama için Protokol adaptasyon Ek dosya 1'e bakınız) çoklama elverişlidir. 11 dört kütüphaneler n =;. Temsili dizileme Veri çoğaltılmış sıralama çalışır (51-döngüsü tek okunan dizileme çalıştırmak gelen Şekil 5 Veri özetlenmiştir çalışır; n = kulvar başına iki kütüphaneler için 128; n = kulvar başına 11 üç için kütüphaneler n = 100) aynı zamanda Simulat tek bir şerit alt örnekleme (51 döngü, tek oku dizileme çalışır bir ERRBS kütüphanesi, tam şerit dizisi ile karşılaştırıldığında idi) şerit başınae,% 50,% 33 ve% 25, sıra başına, okur (2, 3, ve hat başına 4 Örnek çoklayıcı sırasıyla n = 3). Örnek başına okur sayısı çoğullama faktörü azalır gibi, 10x minimum kapsama ve CpG başına dolulukla kaplı CpG'lerin sayısı da (Şekil 5 ve Tablo 8) azalır. Beklenen CpG olmayan sitelerin ortalama dönüşüm oranları% 0.04 (n = 400) ± 99,85% vardır. 99% daha düşük dönüşüm oranları yanlış metilasyon seviyeleri yüksek oranlarda neden olabilir optimum bisülfit dönüşüm daha az gösterebilir.
Temsili bir insan genomik DNA'dan hazırlanmış bir ERRBS kütüphanesinden elde edilen veriler, bir paket methylKit 26 (komut detayları için ek kod dosyası 1 e bakınız) kullanılarak R 2.15.2 45 analiz edilmiştir. Veri yaygın olarak kullanılan genom tarayıcılar (Şekil 6A) görülebilir. sitosin metilasyon veriler eşit bir şekilde, her iki şerit (Şekil 6B) elde edilen ve bütün arasında değişirPotansiyel sitozin metilasyonu düzeyleri (Şekil 6C) spektrumu. Veri sonuçlarının (Şekil 6D) ve genomik lokusların geniş bir yelpazede CPG'lerin kapsar arasında bir temsili insan DNA örneği verimleri yüksek uyum teknik çoğaltır analizi (Şekil 6E ve F ve daha önce 26 tarif). Teknik kopyaları yüksek R 2 değeri (daha fazla% 97) verecek olsa da, biyolojik kopyaları R 0.92 0.96 26 arasında değişen ve 0.86 (veriler gösterilmemiştir) daha 2 değerleri daha düşük R verecek farklı insan hücre tipleri arasında karşılaştırma 2 değerler verecektir.
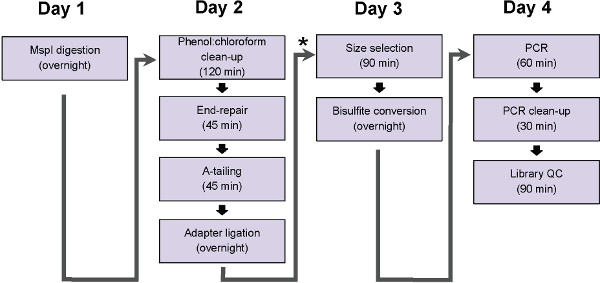
Şekil 1: ERRBS protokol adımları akım şemaları. Grafik geleneksel iş günü içinde tamamlanabilir adımlar, temsil eder. * Potansiyel duraklama noktası gösterir (hemen takip ing ligasyon temizlemek ve boyut seçimi, protokol adım 5) önce hangi örnekler protokol süresi geçmeden önce -20 ° C'de dondurulmuş olabilir.
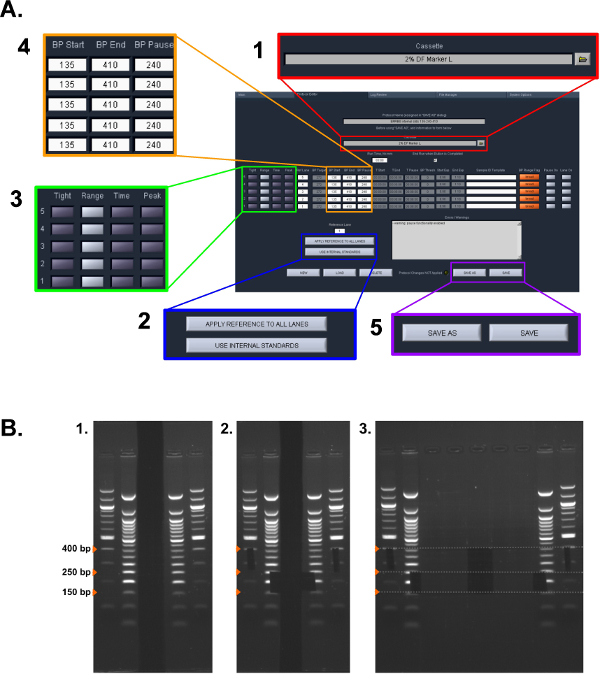
Şekil 2: Boyutu seçimi protokolü. (A) ERRBS Pippin Hazırlık protokolünde kullanılan ayarların ekran görüntüsü (protokol bölümüne bakınız 5.1.2 - 5.1.6): (1) seçin Kaset tipi. (2) Belirli standart kullanılır. (3) Her bir kulvar için toplama modunu seçin. (4) toplama bp aralıklarını girin. (5) protokolü kaydet protokol bölümünde 5.2 kullanılan manuel jel ekstraksiyon (B) Aşamaları:. (1) görüntülenmiştir jel merdivenleri. (2) Bir jilet kullanarak boyut seçimi için Boyutları işaretlendi. Eksize numuneler (: 150-250 bp ve yüksek fraksiyon: 250-400 bp alt fraksiyonu) (3) Görüntü."> Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
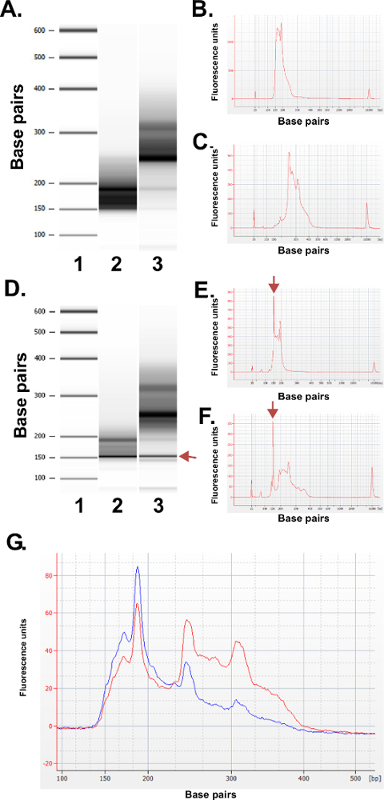
Şekil 3: Bir Bioanalyzer makinesi kullanılarak, insan DNA örneklerinden hazırlanan temsili ERRBS kütüphaneleri için kalite kontrol sonuçları. (A), standart bir merdiven (1) yok Jel benzeri görüntü, düşük kütüphane fraksiyon (Pippin'e Prep gelen 135-240 bp bölümü); 2) ve daha yüksek bir kütüphane fraksiyon (Pippin'e Prep gelen 240-410 bp bölümü); . Beklenen alt kütüphane fraksiyonun 3) (B) Bioanalyzer Elektroferogram (C) beklenen yüksek kütüphane fraksiyon Bioanalyzer Elektroferogram D -.. F) bir kalitesiz kütüphane hazırlık Temsilcisi verileri. Standart bir merdiven (1) olarak jel benzeri görüntü (D), alt kütüphane kısım (2) ve daha yüksek bir kütüphane fraksiyon (3). 150 bp bandı, Arro işaretliw adaptörü aşırı miktarda gösterir. Daha düşük elektroferogramları (E) ve (oklar ile belirtilen) 150 bp fazla adaptör tepe daha yüksek kütüphane fraksiyonlar (F). Dizileme için bir araya getirilmiş ERRBS kütüphanesinin (G) Bioanalyzer elektroferogramıdır. Kırmızı iz yüksek ve düşük kesirler eşit temsil ile yüksek kalitede toplanmış kütüphane temsil eder. Mavi iz nedeniyle yüksek ve düşük kesirler eşit temsil eksikliğine sıralama için yeterli değil havuza kütüphane temsil eder. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
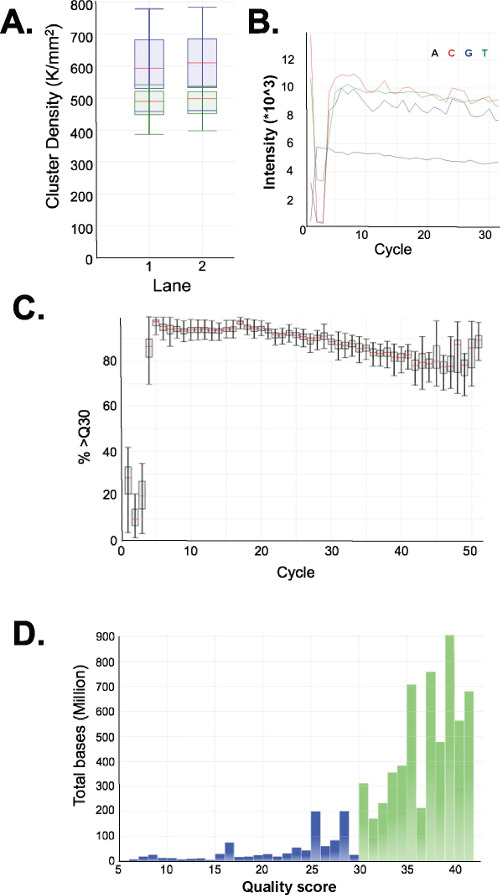
Şekil 4: Bir temsilci için grafikler sequencing yüksek çıktı bir HiSeq 2500 sequencer 51-döngüsü tek okunan sıralama run ERRBSmodu. (A) Küme yoğunlukları (milimetre başına 2 = 1,000 kümeleri kare K / aa; mavi). Ve ERRBS kütüphaneleri ile iki şerit Filtreyi (yeşil) geçen küme yoğunlukları (B) ile bir şeritte ilk 30 döngü görülen tipik yoğunlukları ERRBS kitaplığı. Ilk üç döngü yoğunluklarda MspI sindirimi gelen CGG imza unutmayın. Bir ERRBS şeritte her döngü için 30 veya daha yüksek bir kalite puanı (%> S30) ile bazlar (C) yüzdesi. (D) Kalite puanı dağılımı bir ERRBS şeritte tüm döngüleri. Mavi = Q30, Green az = daha ya Q30 eşit büyüktür. Bu şeritte, üslerinden% 84.7, 30 veya daha yüksek kalite puanları vardı.
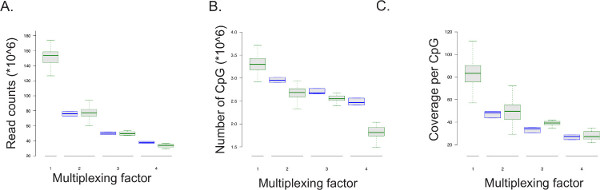
Şekil 5: çıktı sonuçları sequencing. Şerit dizilim ru başına çoğaltılmış ve tek örnek deneysel verilerin Kutu araziler ns (yeşil kutu olarak görüntülenir) ve üç ERRBS kütüphanelerin sıralama çalışır simüle altörnekleme tarafından elde edilen verilerin (mavi kutular olarak görüntülenir; her sıralama çalıştırmak için beş kez örneklenmiş). Tek okunan sıralama çalışan 51-döngüsü çoğullama faktörü karşılık gelen ERRBS kütüphanesi sayısı, her şeride dizilenmiştir. 1 = bütün şerit veya 100 okur ve hat başına tek bir ERRBS kütüphanesinden verileri temsil eden% 'si; Şerit 2 =% 50 ve hat başına iki ERRBS kütüphanelerden verileri temsil eder; Bir sokağın 3 =% 33 ve sokağın başına üç ERRBS kütüphanelerden verileri temsil eder; ve, bir sokağın 4 = 25% ve sokağın başına dört ERRBS kütüphanelerden verileri temsil eder. (A) çoğullama faktörü başına okuma sayıları, ya da analiz dizilerin sayısını,. (B) çoğullama başına sıralama verinin kapsadığı CpG en sayısı faktör. (C) çoğullama faktör başına CpG'nin başına ortalama kapsama."_blank> bu rakamın daha büyük bir versiyonunu görmek için burayı tıklayınız.
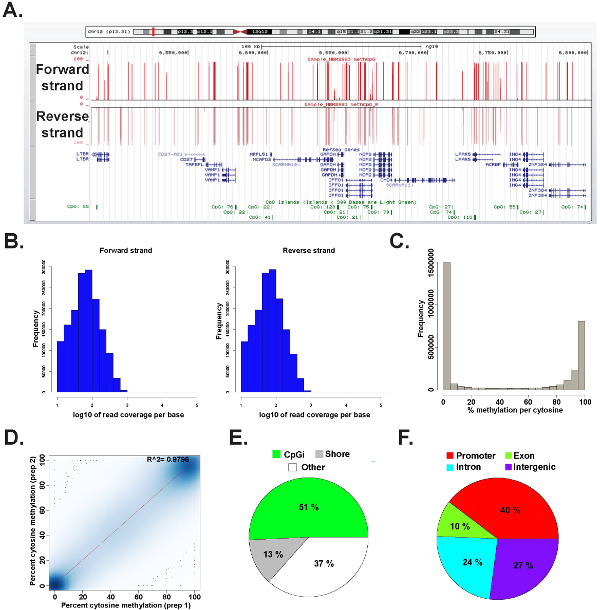
Şekil 6: İnsan genomik DNA'dan hazırlanmış bir ERRBS kütüphanesinden Örnek veri California (A) Üniversitesi, Santa Cruz (ucsc) genomunun tarayıcısı bir ERRBS dizileme kuşaktan gelen temsili verilerin 43 görüntüsü.. y ekseni ölçek çubuğu 10x minimum kaplı her sitozin 0-100% metilasyon temsil eder. Üst özel parça ileri sarmalını temsil ve alt özel parça ters strand temsil eder. . Gösterildi chr12 olduğunu:. Öne birlikte CpG kapsama (B) Dağıtım histogramlar 6,489,523-6,802,422 (hg19) bu genomik bölgede RefSeq genlerin ve CpG adalar dahil ve temsili bir insan CD34 + kemik iliği örneğindeki ipliklerini ters (C) Dağıtım histogramtemsili bir insan CD34 + kemik iliği örneğinde her iki suş boyunca CpG metilasyon seviyesi., bir insan DNA örneği bir temsili teknik kopyadan CpG metilasyon seviyesi (D) korelasyon arsa. (E) Pasta grafik ERRBS kaplı CpG'lerin oranlarını gösteren hangi insan genomik DNA'sından hazırlanan temsili bir örnek CpG adaları (açık yeşil), CpG kıyıları (gri) ve diğer bölgelerde (beyaz) açıklamalı. (F) Pasta grafik gen promoterlere açıklamalı ERRBS kaplı CpG'lerin oranlarını (kırmızı gösteren ), ekzon (yeşil), intronları (mavi) ve intergenik bölgeler (mor). Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
| Reaktif | Hacim | Yorum |
| 10x T4 DNA Ligaz reaksiyon tamponu | 10 ul | |
| Deoksinükleotid trifosfat (dNTP) çözelti karma | 4 ul | Her bir nükleotitden 10 mM karıştırın |
| T4 DNA Polimeraz | 5 ul | 3.000 ünite / ml |
| DNA Polimeraz I Büyük (Klenow) Fragmanı | 1 ul | 5.000 ünite / ml |
| T4 Polinükleotid Kinazı | 5 ul | 10.000 adet / ml |
| DNaz içermeyen su | 45 ul |
Tablo 1:. Sonu onarım reaksiyon reaktifleri Reaktif isimleri ve miktarları uç onarım reaksiyonu (protokol adım 2.1) kullanılır.
| Reaktif | Hacim | Yorum |
| 10x reaksiyon tamponu | 5 ul | örneğin, NEBuffer 2 |
| 1 mM 2'-deoksiadenosin 5'-trifosfat (dATP) | 10 ul | |
| Klenow Fragment (3 '→ 5' ekso-) | 3 ul | 5.000 ünite / ml |
Tablo 2:. A-atık reaksiyon reaktifleri Reaktif isimleri ve miktarları A-atık reaksiyonu (protokol adım 3.1) kullanılır.
| Reaktif | Hacim | Yorum |
| DNase içermeyen su içinde 15 uM tavlanmış adaptörler | 3 ul | PE adaptörü 1.0 ve PE adaptörü 2.0; dizileri ve başvuru için bakınız Tablo 4 |
| 10x T4 DNA Ligaz reaksiyon tamponu | 581 l | |
| T4 DNA Ligaz | 1 ul | 2,000,000 ünite / ml |
| DNaz içermeyen su | 31 ul |
Tablo 3: Adaptör ligasyonu reaksiyon reaktifleri Reaktif adları ve adaptör ligasyon reaksiyonu (protokol adım 4.2) kullanılan miktarları..

Tablo 4:. Ligasyon reaksiyonu (protokol aşama 4) hem de PCR büyütmesinin adım (protokol basamak 7) 'de ERRBS protokolü boyunca kullanılan oligo ERRBS protokolünde kullanılan Oligo listesi.
| Reaktif | Hacim | Yorum |
| 10x FastStart High Fidelity Reaksiyon Tampon wi18 mM magnezyum klorid inci | 20 ul | |
| 10 mM dNTP solüsyon karışımı | 5 ul | |
| 25 mM PCR PE astar 1.0 | 4 ul | Tablo 4 görün |
| 25 mM PCR PE astar 2.0 | 4 ul | Tablo 4 görün |
| FastStart High Fidelity Enzim | 2 ul | 5 birim / ul FastStart Taq DNA Polimeraz |
| DNaz içermeyen su | 125 ul |
Tablo 5: PCR reaksiyon reaktifleri Reaktif adları ve PCR amplifikasyon reaksiyonu (protokol adım 7.1) kullanılan miktarları..
| Protokol adım | Reaktif / protokol detay | Giriş DNA miktarı | ||
| 5-10 ng | 25 ng | 50 ng | ||
| 1 | MspI enzimi | 1 ul | 2 ul | 2 ul |
| MspI özet reaksiyon hacmi | 50 | 100 | 100 | |
| 4 | Ligasyon reaksiyonunda Adaptör | 1 ul | 2 ul | 3 ul |
| Ligasyon reaksiyonu hacmi | 20 ul | 25 ul | 50 ul | |
| 5 | Boyut seçimi protokolü | Manuel jel sadece | Pippin Hazırlık veya manuel jel | Pippin Hazırlık veya manuel jel |
| 7 | PCR primer konsantrasyonu | 25 uM | 25 uM | 14 döngü için 10 uM; 18 döngü için 25 uM |
| PCR döngüsü sayısı | 18 | 18 | 14-18 | |
Tablo 6:. 5-50 ng arasında değişen giriş malzemesi miktarlarda Protokol adımı değişiklikler protokol boyunca çeşitli adımlar başlangıç materyalleri çeşitli miktarlarda yüksek kaliteli kütüphaneleri oluşturmak için kullanılan reaktif miktarları değişiklik gerektirir. Anahtar reaktif miktarları değişiklikler buraya dahil edilmiştir. Buna göre reaksiyonlarda tampon ve su hacimleri ayarlayın.
| Chr | Baz | Iplik | Kapsama | freqC | freqT |
| CHR1 | 10564 | R | 366 | 85.52 | 14.48 |
| CHR1 | 10.571 | F | 423 | 91,25 | 8.75 |
| CHR1 | 10542 | F | 432 | 91.2 | 8.8 |
| CHR1 | 10563 | F | 429 | 94,64 | 5.36 |
| CHR1 | 10.572 | R | 366 | 96,99 | 3.01 |
| CHR1 | 10.590 | R | 370 | 88.11 | 11.89 |
| CHR1 | 10.526 | R | 350 | 92 | 8 |
| CHR1 | 10543 | R | 368 | 92,93 | 7.07 |
| CHR1 | 10525 | F | 433 | 91,92 | 8.08 |
| CHR1 | 10.497 | F | 435 | 88,74 | 11.26 |
Tablo 7: Temsilci ERRBS verileri. Veri uyum ve sitozin metilasyonu belirlenmesi, sonra baz çifti veri elde her CpG kaplı için, tarif edildiği gibi hizalama protokolü genomik koordinat (sütunlar: chr = kromozom, Taban ve Strand) belirleyecektir., Belirli lokusun kapsama oranı (Kapsama ), ve yüzde (freqC ve freqT gibi algılama sitozin karşı timidin oranı sırasıyla).
| Hat başına ERRBS kütüphaneleri sayısı | Benzersiz hizalanmış okur sayısını ortalama | CpG'lerin sayısı kapalı ortalama | CpG başına kapsama ortalama |
| 1 | 152231184 ± 13189678 | 3.183.594 ± 713.547 | 85 ± 16 |
| 2 | 77680837 ± 7.657.058 | 2.674.823153.494 ± | 49 ± 9 |
| 3 | 49938156 ± 2.436.865 | 2.552.186 ± - 76.624 | 39 ± 2 |
| 4 | 34457208 ± 4.441.686 | 1.814.461 ± 144.339 | 28 ± 4 |
Tablo 8:. Tek sıralanması elde edilen CpG site başına ortalama ve benzersiz hizalanmış standart sapmalar, CpG'lerin sayısı kaplı okur ve kapsam: Tek ve çoğaltılmış ERRBS kütüphaneleri sıralanması Temsilcisi parametreler Gösterildi 51-döngüsü tek okunan dizileme çalışır sokağın başına veri Hat başına ERRBS kitaplıkları (n = 100), sıra başına, iki ERRBS kitaplıkları (n = 128), şerit (n = 11) başına üç ERRBS kütüphane ve hat (n = 11) başına dört ERRBS kütüphaneleri.
Tartışmalar
biyolojik-ilgili genomik bölgelerde sitozin metilasyonu protokolü sunulan verimleri baz çifti çözünürlüğü verileri. başlangıç malzemesinin 50 ng için optimize edilmiş yazıldığı gibi protokol, ancak, bu, giriş malzemesi, bir dizi (5 ng ya da daha fazla) 26 işlemek için uyarlanabilir. Tablo 6'da görüldüğü gibi, Bu protokol adımlar bazı ayarlamalar gerektirecektir. ERRBS kütüphaneleri de sekanslama ile gerçekleştirilebilir eşleştirilmiş uç dizisi ve daha da genomik içerisinde için uygun olan daha 51 döngü daha okur. Numune başına daha düşük maliyet protokolü sunacak Multiplexed sıralama, ancak bu verilerin (Şekil 5 ve Tablo 8) temsil CpG site başına azaltılmış kapsama neden olur, ve başına yüksek kapsama gerektiren analizler gerçekleştirmek için kapsama yeterli derinliği vermez (Landan ve ark. 33 tarafından tarif edildiği gibi) örneğin CpG Alanı. Son olarak, bu protokol (veya herhangi bir bisülfit bazlı Protocol) metil-sitozin ve hidroksimetili-sitozin 46,47 arasında ayrım yapamaz. Ancak, diğer protokol ile entegre edilebilir oluşturulan veriler, farklı değişiklikleri tanımlamak için 48,49 sonuçları ve diğer sitozin modifikasyonları son zamanlarda ilgi olmalıdır, 50 bildirdiler.
Şekil 3G (kırmızı iz) her iki kütüphane fraksiyonlardan eşit mol katılım temsil gösterildiği gibi Şekil 3A-C'de gösterildiği gibi, ve bir kez de sekanslama için bir araya getirilmiş bir izleme elde edilmesini sağlar, yüksek kaliteli kütüphaneleri görünür. Kütüphane hazırlık hatası prosedürü sırasında herhangi bir aşamada neden olabilir. Bozulmuş DNA işlenir Eğer bu protokolü açıklanan sıralama parametreleri kullanılarak düşük CpG kapsama dolayısıyla MspI fragmanları zenginleştirilmiş ve kütüphaneler neden olur. Bir enzim işlevsel olmayan veya yanlışlıkla reaksiyonlardan biri dışında ise, protokol beklenen kütüphane vermez. Ligasyon rea Eğerölü m, verimsizdir, adaptörler beklenenden daha yüksek bir konsantrasyonda, ve / veya kullanılan primerler konsantrasyon, son amplifıkasyonda için sınırlayıcı bir madde, kütüphane hata oluşabilir. Nedeniyle kütüphane ve aşırı adaptörler hem gelişigüzel kümelenme da sıralama ile engel olacak kütüphanede, (Şekil 3D-F Bioanalyzer sonuçlarında ~ 150 bp bir zirveleri olarak görülen) Aşırı adaptörler. Böyle bir kütüphane, görünüşe göre, normal olarak sırası da, önemli bir kısmının, sadece adaptör dizileri olacaktır okur. Aşırı adaptörler bir kütüphane gözlenir ise, bu malzeme miktarı oranları adaptör optimal girdi malzeme kullanılarak varsa kütüphane hazırlık tekrarlamak için en iyisidir. Son olarak, kütüphanelerin etkin PCR sağlamak için, alt ve üst kütüphane fraksiyonlar bisülfit dönüşüm ve PCR zenginleştirme aşamaları boyunca ayrı numune olarak muhafaza edilir. Aksi takdirde P sırasında amplifikasyon ayırıcı verimliliğini verirCR (Şekil 3G mavi iz görüldüğü gibi) daha yüksek ve daha düşük fraksiyonların reaksiyon ve sıralama sırasında her kütüphane fraksiyonu kaplı ilgili genomik loci eşitsiz temsil potansiyeli. Kullanıcı kütüphaneleri üretilen yükseltmek için gerekli optimum PCR döngüleri daha titrasyon için bisülfit dönüşüm hemen sonra kantitatif PCR adım dahil etmek tercih edebilir.
ERRBS kütüphane hazırlık protokolü belirli reaktifler tavsiye edildiği birçok önemli adım vardır. Son-tamir aşamada, dört nükleotid dNTP karışımı kullanılması, MspI enzimatik yıldız aktivitesi ve orijinal DNA örneğinde bulunan kesilmiş DNA fragmanları kaynaklananlar CG çıkıntı ihtiva eden herhangi bir ürünlerin son-tamir sağlar. Bu sonuçlar gelişmiş CpG temsil sonuçlanır. Bağlama adımı azından sağlamak için, yüksek konsantrasyon ligazı (2,000,000 birim / ml) ve metilli adaptörler kullanmak kritik olduğunu ligasyon, Reactiüzerinde etkilidir ve Bisülfit dönüşümü doğru veri uyum için gerekli adaptör dizileri etki etmez. PCR adımında, bisülfit ile muamele edilen GC açısından zengin DNA fragmanlarının büyütme yeteneğine sahip bir polimeraz kullanılarak yüksek özgüllük için gereklidir. Son olarak, fazla adaptörleri ve primer eleme sağlamak için, (örneğin: Agencourt AMPure XP) SPRI boncuk arındırma ligasyonu ve PCR ürünü, izolasyonların sütun dayalı tahliller yerine tavsiye edilir.
Yüksek kaliteli veri oluşturmak için, verimli bisülfit dönüşümü sağlamak için önemlidir. sunulan denetim kullanıcıya dizileme önce dönüşüm etkinliğini belirlemek için yeteneği sunar. Bir alternatif olarak, lamda DNA gibi insan dışı bir DNA, bir iç kontrol (spike Giriş) olarak kullanılabilir. Nedeniyle türlerin farklılıkları için, bir kontrol, bu tür doğrudan alt baş dizisi dahil edilebilir (örneğin Yu kullanıldığı haliyle, ve ark. 34). Ancak, başak-in i isekullanılan s, bu benzersiz büyütülmüş ve bağımsız olarak kütüphane dizileme önce dizilenmiştir sürece kütüphane sekanslama önce dönüşüm etkinliğini belirlemek için kullanılamaz. tespit dönüşüm oranları CpG olmayan bölgelerinde metilasyon durumunun dayanmaktadır. Bu (örneğin embriyonik kök hücreleri), CpG olmayan bağlam ve paralel numuneler veya bu amaç için kullanılabilir dönüşüm verimliliği için değerlendirmek başka bir şekilde yüksek sitosin metilasyon bağlamında kullanılmak üzere uygun olmayabilir.
ERRBS kütüphaneleri sekanslanması için benzersiz olan adrese birkaç uyarılar bulunmamaktadır. sıralandı kütüphane fraksiyonların ilk üç üsleri nedeniyle MspI tanıma kesim sitesine neredeyse eşit olmayan rastgele (C ^ CGG Şekil 4B, C bakınız). Düşük kalite önemli veri kaybı potansiyeli Bu sonuçlar sıralama sırasında belirgin yüksek küme yoğunluğu rağmen yoksul küme lokalizasyonu kaynaklanan okur. Bu engeli aşmak için,özel kontrol şeritli olarak bağımsız bir kulvarda (phix kontrolü veya diğer kütüphane türü) yüksek karmaşıklık kütüphane bulunmaktadır. Yüksek karmaşıklık kütüphaneleri sıralandı ilk dört üsleri A, C, T ve G dengeli bir temsilini içeren uçları var. Uygun kontrol hatları, RNA-seq, ChIP-seq, tüm genom dizileme, ya da sıralama makine üreticisi (örn phix Kontrol v3) tarafından sunulan bir kontrol olarak kütüphaneler bulunmaktadır. İlgili sıralama çalıştırmak için bir kontrol şeritte olarak belirlenmiş, bu küme pozisyonları tespit etmek sıralamanın ilk dört üsleri sırasında kullanılmaktadır matris üretimi için temel olarak hizmet verebilir. yüksek kalitede tarafından CpG site başına ortalama kapsama çıkaracağız yakalanan okur 5.2 (n = 4). Seçenek olarak ise, bu teknik bir sorun, aynı zamanda, daha önce tarif edildiği gibi 23 koyu dizilim yaklaşımı kullanılarak aşılabilir. Diğer sıralama kriterleri üreticinin protokolleri başına standart operasyon prosedürlerini izleyin. CpG c başına Nihayet, kapsamaVeri analizi için hosen ilgi biyolojik soruların kullanıcı tarafından ve kısmen yönlendirileceksiniz. 10x kapsama eşiği yüksek kapsama analizi yaklaşımı, ancak bu eşik bu ilgi olmalıdır düşürülebilir tanıyor.
ERRBS veri analizi tam bir tartışma, ancak farklı şekilde metilatlı sitozinler ve bölgeler açık kaynak araçları 31,51-53 kullanılarak tespit edilebilir, bu makalenin kapsamı dışındadır. Ek analiz düşünceler ve yaklaşımlar 54,55 iyi tarif edilmiştir, ve okuyucu planlanan analize en uygun araçlar için literatür taraması teşvik edilmektedir.
Diğer yayınlanmış yöntemlere kıyasla, ERRBS tekrarlanabilirliği açıklanan verim yüksek oranlı olarak gerçekleştirilen dört günlük protokolünü sunmaktadır. Bu MassARRAY EpiTYPER 26 standart altın oranla onaylanmıştır, maliyet-etkin, yüksek kapsama veri ve çeşitli giriş malzeme için uyarlanabilirve sıralama yaklaşımlar (düşük frekanslı klinik örnek işleme ve diğer hücre tipleri için uygun) tutarlar. Bu genom bağlayıcı transkripsiyon faktörü, kromatin remodeling, epigenetik işaretleri ve diğer ilgi sitozin değişiklikler profilleme diğer tekniklerle analiz biyolojik ilgili loci taban çifti çözünürlük sunuyor ve bütünleştirici kullanılabilir. Bu çalışmalarda ERRBS veri kullanımı geniş kapsamlı bir moleküler yaklaşım katkı ve boyutsal biyolojik modellerinde ve insan hastalığının çalışmada analizi yüksek olanak sağlayabilmektedir.
Açıklamalar
Yazarlar ifşa etmek Çıkar çatışması var.
Teşekkürler
We thank all the authors of the original ERRBS report. We thank Mame Fall for technical assistance. We acknowledge the Weill Cornell Medical College Epigenomics Core for technical services and assistance. The work was supported by a Sass Foundation Judah Folkman Fellowship, an NCI K08CA169055 and ASH-AMFDP12005 to FGB, NIH R01HG006798 and R01NS076465, funding from the Irma T. Hirschl and Monique Weill-Caulier Charitable Trusts and STARR Consortium (I7-A765) to CEM, and an LLS SCORE grant (7006-13) to AMM.
Malzemeler
| Name | Company | Catalog Number | Comments |
| MspI | New England Biolabs | R0106M | 100,000 units/ml |
| NEBuffer 2 | New England Biolabs | B7002S | Reaction buffer for MspI enzyme; protocol step 1.2 |
| Phenol solution | Sigma-Aldrich | P4557 | Equilibrated with 10 mM Tris HCl, pH 8.0; see safety and handling instructions at http://www.sigmaaldrich.com/catalog/product/sigma/p4557 |
| Chloroform | Sigma-Aldrich | C2432 | See safety and handling instructions at http://www.sigmaaldrich.com/catalog/product/sial/c2432 |
| Glycogen | Sigma-Aldrich | G1767 | 19-22 mg/ml |
| NaOAc | Sigma-Aldrich | S7899 | 3 M, pH 5.2 |
| Ethanol | Sigma-Aldrich | E7023 | 200 proof, for molecular biology |
| Buffer EB | Qiagen | 19086 | 10 mM Tris-Cl, pH 8.5 |
| tris(hydroxymethyl)aminomethane (Tris) | Sigma-Aldrich | T1503 | prepare a 1 M, pH 8.5 solution |
| Tris- Ethylenediaminetetraacetic acid (TE) | Sigma-Aldrich | T9285 | Dilute to 1x buffer solution per manufacturer's recommendations |
| T4 DNA Ligase Reaction Buffer | New England Biolabs | B0202S | 10x concentration |
| Deoxynucleotide triphosphate (dNTP) Solution Mix | New England Biolabs | N0447L | 10 mM each nucleotide |
| T4 DNA Polymerase | New England Biolabs | M0203L | 3,000 units/ml |
| DNA Polymerase I, Large (Klenow) Fragment | New England Biolabs | M0210L | 5,000 units/ml |
| T4 Polynucleotide Kinase | New England Biolabs | M0201L | 10,000 units/ml |
| QIAquick PCR Purification Kit | Qiagen | 28104 | Used for DNA product purification in protocol step 2.3 |
| 2'-deoxyadenosine 5'-triphosphate (dATP) | Promega | U1201 | 100 mM |
| Klenow Fragment (3'→5' exo-) | New England Biolabs | M0212L | 5,000 units/ml |
| MinElute PCR Purification Kit | Qiagen | 28004 | Used for DNA product purification in protocol step 3.3 |
| T4 DNA Ligase | New England Biolabs | M0202M | 2,000,000 units/ml |
| Methylation Adapter Oligo Kit | Illumina | ME-100-0010 | |
| Agencourt AMPure XP | Beckman Coulter | A63881 | Used in protocol sections that implement magnetic bead purification steps (steps 4.3 and 8.2). Equilibrate to room temperature before use. |
| Pippin Prep Gel Cassettes, 2% Agarose, dye-free | Sage Science | CDF2010 | with internal standards |
| Certified Low Range Ultra Agarose | Bio-Rad | 161-3106 | |
| Tris-Borate-EDTA (TBE) buffer | Sigma-Aldrich | T4415 | |
| Ethidium bromide solution | Sigma-Aldrich | E1510 | 10 mg/ml |
| 50 bp DNA Ladder | NEB | N3236S | |
| 100 bp DNA Ladder | NEB | N3231S | |
| Gel Loading Dye, Orange (6x) | NEB | B7022S | |
| Scalpel Blade No. 11 | Fisher Scientific | 3120030 | |
| QIAquick Gel Extraction Kit | Qiagen | 28704 | |
| EZ DNA Methylation Kit | Zymo Research | D5001 | Used in protocol step 6.2 |
| EZ DNA Methylation-Lightning Kit | Zymo Research | D5030 | Alternative for step 6.2 |
| Universal Methylated Human DNA Standard | Zymo Research | D5011 | Used as bisulfite conversion control |
| FastStart High Fidelity PCR System | Roche | 03553426001 | |
| Qubit dsDNA High Sensitivity Assay Kit | Life Technologies | Q32854 | A fluorescence-based DNA quantitation assay; used in protocol steps 1.1, 9.1 and 10.1 |
| DynaMag-2 Magnet | Life Technologies | 12321D | |
| High Sensitivity DNA Kit | Agilent Technologies | 5067-4626 | |
| 2100 Bioanalyzer | Agilent Technologies | ||
| PhiX Control v3 | Illumina | FC-110-3001 | |
| HiSeq 2500 | Illumina | ||
| Pippin Prep | Sage Science | ||
| Qubit 2.0 Fluorometer | Life Technologies | Q32872 | |
| TruSeq SR Cluster Kit v3-cBot-HS | Illumina | GD-401-3001 | |
| TruSeq SBS Kit v3-HS | Illumina | FC-401-3002 | |
| TruSeq RNA Sample prep | Illumina | RS-122-2001 | Barcoded adapters used for multiplexing libraries; See Supplemental file for multiplexing protocol. |
| Microcentrifuge | |||
| Vortex Mixer | |||
| Dry Block Heater | |||
| Thermal Cycler | |||
| Water Bath | |||
| Gel electrophoresis system | |||
| Electrophoresis power supply | |||
| Gel doc | |||
| UV or blue light transilluminator |
Referanslar
- Jones, P. A. Functions of DNA methylation: islands, start sites, gene bodies and beyond. Nat Rev Genet. 13 (7), 484-492 (2012).
- Barlow, D. P. Genomic imprinting: a mammalian epigenetic discovery model. Annual Review Of Genetics. 45, 379-403 (2011).
- Thiagarajan, R. D., Morey, R., Laurent, L. C. The epigenome in pluripotency and differentiation. Epigenomics. 6 (1), 121-137 (2014).
- Reik, W. Stability and flexibility of epigenetic gene regulation in mammalian development. Nature. 447 (7143), 425-432 (2007).
- Hartnett, L., Egan, L. J. Inflammation, DNA methylation and colitis-associated cancer. Carcinogenesis. 33 (4), 723-731 (2012).
- Smith, Z. D., Meissner, A. DNA methylation: roles in mammalian development. Nat Rev Genet. 14 (3), 204-220 (2013).
- Li, E., Bestor, T. H., Jaenisch, R. Targeted mutation of the DNA methyltransferase gene results in embryonic lethality. Cell. 69 (6), 915-926 (1992).
- Okano, M., Bell, D. W., Haber, D. A., Li, E. DNA methyltransferases Dnmt3a and Dnmt3b are essential for de novo methylation and mammalian development. Cell. 99 (3), 247-257 (1999).
- Feinberg, A. P. Phenotypic plasticity and the epigenetics of human disease. Nature. 447 (7143), 433-440 (2007).
- Bock, C. Epigenetic biomarker development. Epigenomics. 1 (1), 99-110 (2009).
- Laird, P. W. The power and the promise of DNA methylation markers. Nat Rev Cancer. 3 (4), 253-266 (2003).
- How Kit, A., Nielsen, H. M., Tost, J. DNA methylation based biomarkers: practical considerations and applications. Biochimie. 94 (11), 2314-2337 (2012).
- Mikeska, T., Bock, C., Do, H., Dobrovic, A. DNA methylation biomarkers in cancer: progress towards clinical implementation. Expert Review Of Molecular Diagnostics. 12 (5), 473-487 (2012).
- Gyparaki, M. T., Basdra, E. K., Papavassiliou, A. G. DNA methylation biomarkers as diagnostic and prognostic tools in colorectal cancer. Journal of Molecular Medicine. 91 (11), 1249-1256 (2013).
- Figueroa, M. E., et al. DNA methylation signatures identify biologically distinct subtypes in acute myeloid leukemia. Cancer Cell. 17 (1), 13-27 (2010).
- Heyn, H., Mendez-Gonzalez, J., Esteller, M. Epigenetic profiling joins personalized cancer medicine. Expert review of Molecular Diagnostics. 13 (5), 473-479 (2013).
- Kulis, M., Esteller, M. DNA methylation and cancer. Advances in Genetics. 70, 27-56 (2010).
- Xiong, Z., Laird, P. W. COBRA: a sensitive and quantitative DNA methylation assay. Nucleic Acids Res. 25 (12), 2532-2534 (1997).
- Meissner, A., et al. Reduced representation bisulfite sequencing for comparative high-resolution DNA methylation analysis. Nucleic Acids Res. 33 (18), 5868-5877 (2005).
- Gu, H., et al. Preparation of reduced representation bisulfite sequencing libraries for genome-scale DNA methylation profiling. Nat Protoc. 6 (4), 468-481 (2011).
- Bock, C., et al. Quantitative comparison of genome-wide DNA methylation mapping technologies. Nat Biotechnol. 28 (10), 1106-1114 (2010).
- Harris, R. A., et al. Comparison of sequencing-based methods to profile DNA methylation and identification of monoallelic epigenetic modifications. Nat Biotechnol. 28 (10), 1097-1105 (2010).
- Boyle, P., et al. Gel-free multiplexed reduced representation bisulfite sequencing for large-scale DNA methylation profiling. Genome Biol. 13 (10), R92(2012).
- Chatterjee, A., Rodger, E. J., Stockwell, P. A., Weeks, R. J., Morison, I. M. Technical considerations for reduced representation bisulfite sequencing with multiplexed libraries. Journal of Biomedicine & Biotechnology. 2012, 741542(2012).
- Lee, Y. K., et al. Improved reduced representation bisulfite sequencing for epigenomic profiling of clinical samples. Biological Procedures Online. 16 (1), 1(2014).
- Akalin, A., et al. Base-pair resolution DNA methylation sequencing reveals profoundly divergent epigenetic landscapes in acute myeloid leukemia. PLoS Genet. 8 (6), e1002781(2012).
- Hatzi, K., et al. A Hybrid Mechanism of Action for BCL6 in B Cells Defined by Formation of Functionally Distinct Complexes at Enhancers and Promoters. Cell Reports. 4 (3), 578-588 (2013).
- Will, B., et al. Satb1 regulates the self-renewal of hematopoietic stem cells by promoting quiescence and repressing differentiation commitment. Nature Immunology. 14 (5), 437-445 (2013).
- Lu, C., et al. Induction of sarcomas by mutant IDH2. Genes Dev. 27 (18), 1986-1998 (2013).
- Kumar, R., et al. AID stabilizes stem-cell phenotype by removing epigenetic memory of pluripotency genes. Nature. 500 (7460), 89-92 (2013).
- Li, S., et al. An optimized algorithm for detecting and annotating regional differential methylation. BMC Bioinformatics. 14, Suppl 5. S10(2013).
- Patterson, K., Molloy, L., Qu, W., Clark, S. DNA methylation: bisulphite modification and analysis. Journal of Visualized Experiments. (56), 3170(2011).
- Landan, G., et al. Epigenetic polymorphism and the stochastic formation of differentially methylated regions in normal and cancerous tissues. Nat Genet. 44 (11), 1207-1214 (2012).
- Yu, M., et al. Tet-assisted bisulfite sequencing of 5-hydroxymethylcytosine. Nat Protoc. 7 (12), 2159-2170 (2012).
- Goecks, J., Nekrutenko, A., Taylor, J., Galaxy, T. Galaxy: a comprehensive approach for supporting accessible, reproducible, and transparent computational research in the life sciences. Genome Biol. 11 (8), R86(2010).
- Dorff, K. C., et al. GobyWeb: simplified management and analysis of gene expression and DNA methylation sequencing data. PLoS One. 8 (7), e69666(2013).
- Roehr, J. T., Dodt, M., Ahmed, R., Dieterich, C. Flexbar − flexible barcode and adapter processing for next-generation sequencing platforms. MDPI Biology. 1 (3), 895-905 (2012).
- Martin, M. Cutadapt removes adapter sequences from high-throughput sequencing reads. EMBnet.journal, North America. 17 (1), 10-12 (2011).
- Bolger, A. M., Lohse, M., Usadel, B. Trimmomatic: a flexible trimmer for Illumina sequence data. Bioinformatics. 30 (15), 2114-2120 (2014).
- Needleman, S. B., Wunsch, C. D. A general method applicable to the search for similarities in the amino acid sequence of two proteins. J Mol Biol. 48 (3), 443-453 (1970).
- Krueger, F., Andrews, S. R. Bismark: a flexible aligner and methylation caller for Bisulfite-Seq applications. Bioinformatics. 27 (11), 1571-1572 (2011).
- Li, H., et al. The Sequence Alignment/Map format and SAMtools. Bioinformatics. 25 (16), 2078-2079 (2009).
- Kent, W. J., et al. The human genome browser at UCSC. Genome Res. 12 (6), 996-1006 (2002).
- Thorvaldsdottir, H., Robinson, J. T., Mesirov, J. P. Integrative Genomics Viewer (IGV): high-performance genomics data visualization and exploration. Briefings in Bioinformatics. 14 (2), 178-192 (2013).
- Team, R. C. R. A language and environment for statistical computing. R Foundation for Statistical Computing. Vienna, Austria. ISBN 3-900051-07-0, http://www.R-project.org (2012).
- Nestor, C., Ruzov, A., Meehan, R., Dunican, D. Enzymatic approaches and bisulfite sequencing cannot distinguish between 5-methylcytosine and 5-hydroxymethylcytosine in DNA. BioTechniques. 48 (4), 317-319 (2010).
- Huang, Y., et al. The behaviour of 5-hydroxymethylcytosine in bisulfite sequencing. PLoS One. 5 (1), e8888(2010).
- Yu, M., et al. Base-resolution analysis of 5-hydroxymethylcytosine in the mammalian genome. Cell. 149 (6), 1368-1380 (2012).
- Song, C. X., et al. Genome-wide profiling of 5-formylcytosine reveals its roles in epigenetic priming. Cell. 153 (3), 678-691 (2013).
- Ito, S., et al. Tet proteins can convert 5-methylcytosine to 5-formylcytosine and 5-carboxylcytosine. Science. 333 (6047), 1300-1303 (2011).
- Akalin, A., et al. methylKit: a comprehensive R package for the analysis of genome-wide DNA methylation profiles. Genome Biol. 13 (10), R87-1186 (2012).
- Stockwell, P. A., Chatterjee, A., Rodger, E. J., Morison, I. M. DMAP: Differential Methylation Analysis Package for RRBS and WGBS data. Bioinformatics. 30 (13), 1814-1822 (2014).
- Sun, D., et al. MOABS: model based analysis of bisulfite sequencing data. Genome Biol. 15 (2), R38(2014).
- Bock, C. Analysing and interpreting DNA methylation data. Nat Rev Genet. 13 (10), 705-719 (2012).
- Rivera, C. M., Ren, B. Mapping human epigenomes. Cell. 155 (1), 39-55 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır