A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
على قناة واحدة وتحليل الكالسيوم التصوير في Podocytes من الكبيبات المعزولة حديثا
In This Article
Summary
Changes in the intracellular calcium levels in the podocytes are one of the most important means to control the filtration function of glomeruli. Here we explain a high-throughput approach that allows detection of real-time calcium handling and single ion channels activity in the podocytes of the freshly isolated glomeruli.
Abstract
Podocytes (renal glomerular epithelial cells) are known to regulate glomerular permeability and maintain glomerular structure; a key role for these cells in the pathogenesis of various renal diseases has been established since podocyte injury leads to proteinuria and foot process effacement. It was previously reported that various endogenous agents may cause a dramatic overload in intracellular Ca2+ concentration in podocytes, presumably leading to albuminuria, and this likely occurs via calcium-conducting ion channels. Therefore, it appeared important to study calcium handling in the podocytes both under normal conditions and in various pathological states. However, available experimental approaches have remained somewhat limited to cultured and transfected cells. Although they represent a good basic model for such studies, they are essentially extracted from the native environment of the glomerulus. Here we describe the methodology of studying podocytes as a part of the freshly isolated whole glomerulus. This preparation retains the functional potential of the podocytes, which are still attached to the capillaries; therefore, podocytes remain in the environment that conserves the major parts of the glomeruli filtration apparatus. The present manuscript elaborates on two experimental approaches that allow 1) real-time detection of calcium concentration changes with the help of ratiometric confocal fluorescence microscopy, and 2) the recording of the single ion channels activity in the podocytes of the freshly isolated glomeruli. These methodologies utilize the advantages of the native environment of the glomerulus that enable researchers to resolve acute changes in the intracellular calcium handling in response to applications of various agents, measure basal concentration of calcium within the cells (for instance, to evaluate disease progression), and assess and manipulate calcium conductance at the level of single ion channels.
Introduction
الكلى الحفاظ على التوازن استتبابي للمواد المختلفة وتنظيم حجم الدم في الطريقة التي يحدد مجموع ضغط الدم. الاضطرابات في الترشيح الكلوي، استيعاب أو إفراز الرصاص أو مرافقة الحالات المرضية، التي تتراوح بين المفرط أو انخفاض ضغط الدم لإنهاء مرحلة المرض الكلوي الذي يتطلب في نهاية المطاف زرع الكلى. وحدة تصفية الكلى (الكبيبة) ويتكون من ثلاث طبقات - البطانة الشعرية، الغشاء القاعدي وطبقة خلية واحدة من الخلايا الطلائية - podocytes، والتي تلعب دورا رئيسيا في الحفاظ على سلامة شق الحجاب الحاجز وظيفة 1. الخلل في تصفية الكبيبي permselective يسبب فقدان البولية من الجزيئات، مثل بروتينية. عوامل مختلفة قد تؤثر على هيكل podocytes والعمليات أقدامهم، والتي تحدد على سلامة حاجز الترشيح الكبيبات.
وتشارك podocytes في الحفاظ على يسرقeruli ظيفة الترشيح. وقد ثبت أن تناول الكالسيوم غير لائق من قبل خلية رجلاء يؤدي إلى إصابة الخلايا ويلعب دورا هاما في تطور مختلف أشكال nephropathies 2،3. لذلك، ووضع نموذج الذي يسمح للقياس المباشر للتغيرات تركيز الكالسيوم داخل الخلايا سوف يكون مفيدا للدراسات وظيفة خلية رجلاء. تم الكبيبات معزولة تستخدم سابقا في العديد من الدراسات بما في ذلك قياس معامل الانعكاس الألبومين يغير 4 و تقييم التيارات الخلوية المتكاملة في خلية كاملة الكهربية القياسات التصحيح، المشبك 5،6. في هذه الورقة وصفنا البروتوكول الذي يسمح الباحث لقياس التغيرات تركيز الكالسيوم داخل الخلايا استجابة لطلبات من وكلاء الدوائية، وتقدير مستويات القاعدية من الكالسيوم داخل الخلايا، وتقييم النشاط الفردي قنوات الكالسيوم. قياسات تركيز الكالسيوم Ratometric والتصحيح، المشبك electropاستخدمت hysiology لتحديد التغيرات في تركيز الكالسيوم داخل الخلايا ضمن النشاط خلية رجلاء وقناة، على التوالي.
Protocol
استخدام الحيوان ورعايته ينبغي أن تلتزم دليل المعاهد الوطنية للصحة للرعاية واستخدام الحيوانات المختبرية التالية بروتوكولات مراجعتها والموافقة عليها من قبل لجنة رعاية واستخدام الحيوان المؤسسي (IACUC).
1. الكلى فلوش
- استخدام 8-12 اسبوع الفئران الذكور القديم (المقترح هو سلالة سبراغ داولي، ومع ذلك سلالات أخرى من مختلف الأعمار والجنسين يمكن استخدامها مع التغييرات المناسبة).
- تخدير الحيوان وفقا للإجراءات التي يسمح بها بروتوكول IACUC. رصد عمق التخدير وفحص الحيوانات. وصف مفصل للجراحة التي يتعين القيام بها في 1،3-1،8 يمكن العثور عليها في Ilatovskaya وآخرون 7.
- بعد التخدير المناسب، ووضع الحيوان على طاولة الجراحة التحكم في درجة حرارته، وجعل شق خط الوسط من البطن (ما يصل الى 3 بوصات في الطول)، وكشف الوريد الأجوف والشريان الأورطي.
- إدراج رباط حول الاضطرابات الهضمية والمساريقي العلوي الشرايين والبطنالشريان الأبهر فوق تلك. لا ligate.
- بلانت تشريح الشريان الأورطي البطني تحت الشرايين الكلوية، ووضع اثنين من الأربطة المحيطة به، ولكن لا ligate، ثم تضييق الشريان الأبهر فوق الحروف المركبة وربط موضوع أقل.
- يقثطر الشريان الأورطي مع أنابيب البولي ايثيلين PE50 (تعلق على ضخ حقنة مليئة PBS) تحت المشبك وإصلاح القسطرة مع ربطة الثاني. إزالة المشبك، بدوره على مضخة، وligate الشريان الأورطي والشرايين المساريقي مع الاضطرابات الهضمية. جعل بسرعة شق في الوريد الكلوي لتخفيف الضغط.
- يبث في الشريان الأورطي مع PBS المبردة قبل لمدة 2 أو 3 دقائق بمعدل 6 مل / دقيقة.
- وقف نضح والرسوم وdecapsulate 7 الكلى، ووضعها على الجليد في حل PBS. الموت ببطء الحيوانية وفقا لبروتوكول التي وافق عليها IACUC.
2. عزل الجرذ الكبيبات
- إعداد 30 مل من محلول جديدة من 5٪ BSA في RPMI 1640.
- باستخدام شفرة حلاقة ومقص،عزل القشرة من كل من الكليتين، ومن ثم اللحم المفروم حتى متجانسة. وقد وصفت هذا الإجراء في وقت سابق 7.
- دفع الأنسجة المفروم خلال الخطوة السابقة من خلال 100 شبكة المقاوم للصدأ غربال الصلب (غارقة مسبقا في 5٪ BSA / RPMI الحل) باستخدام ملعقة. جمع التدفق من خلال وبالقوة خطورة السماح للتدفق من خلال لتمرير من خلال غربال 140 شبكة.
- تصفية التدفق من خلال جمعها من شبكة 140 غربال باستخدام غارقة قبل 200 عيون غربال، تجاهل الترشيح، وغسل الجزء العلوي من غربال مع 10-15 مل من محلول استعداد BSA / RPMI لجمع الكبيبات أن الرواسب على غربال.
- وضع حل BSA / RPMI تحتوي على الكبيبات على الجليد في أنبوب 15 مل وترك الرواسب الكبيبات في الجزء السفلي من الأنبوب لمدة تصل إلى 20 دقيقة. وسوف ينظر في التركيز الكبيبات على الجزء السفلي من الأنبوب بشكل واضح. إزالة الحل الزائدة، وترك ما يقرب من 2 مل في الأنبوب.
3. على قناة واحدة التصحيح، المشبك شركةectrophysiology
- إعداد 5 × 5 مم رقائق الزجاج غطاء من قبل طلائها مع MW 70،000 - 150،000 بولي ʟ، ليسين، واسمحوا الجافة. استخدام حوالي 30 ميكرولتر من 0.01٪ محلول معقم التي تمت تصفيتها في الماء في غطاء زجاجي.
- الاحماء الحلول التجريبية لRT وملء غرفة التصحيح المشبك وماصة. لقنوات TRPC الرصد واستخدام حل حمام، في ملي: 126 كلوريد الصوديوم، 1 CaCl 2، 10 HEPES، 2 MgCl 2، 10 الجلوكوز، ودرجة الحموضة 7.4؛ ماصة: 126 كلوريد الصوديوم، 1.5 CaCl 2، 10 HEPES، 10 الجلوكوز. 7.4 درجة الحموضة.
- إضافة مثبطات إلى حل ماصة لمنع النشاط من القنوات المحلية، والتي هي ليست ذات صلة للدراسات (الموصى بها: 100 ميكرومتر حمض niflumic أو DIDS (لمنع الكالسيوم 2+ -activated الكلور - قنوات)، 10 ملي TEA (لكبح واسع تصرف الكالسيوم 2 + - K يعتمد + قناة)، 10 نانومتر iberiotoxin (لمنع الكالسيوم 2+ -activated K + قنوات)، 10 ميكرومتر نيكارديبين (لمنع N-نوع كا2+ قنوات)) مباشرة قبل التجربة التصحيح، المشبك.
- المزيج بلطف حل تحتوي على الكبيبات، ومن ثم تطبيق ما يقرب من 50 ميكرولتر من أن الغطاء المطلي رقائق الزجاج بولي ʟ-يسين. السماح للكبيبات نعلق لمدة 5 دقائق تقريبا.
- نقل رقائق الزجاج مع الكبيبات إلى غرفة التصحيح المشبك شغل قبل مع الحل حمام. يروي غرفة بمعدل 3 مل / دقيقة لمدة 1 دقيقة لضمان إزالة الكبيبات غير مرتبط.
- إجراء تجربة التصحيح، المشبك التقليدية في وضع الخلية المرفقة 7. مع ماصة الزجاج (7-10 MΩ المقاومة ماصة) شكل خاتم عالية المقاومة بين ماصة وغشاء خلية رجلاء من خلال تطبيق طيف الامتصاص (ماصة تعلق على خلية رجلاء على سطح الكبيبة معزولة في الشكل 2، على اليسار).
- للقياسات الخلية المرفقة، المنخفضة تمرير التيارات في 300 هرتز على فلتر من ثماني قطب بسل.
- Uحد ذاتها معزولة الكبيبات في تجارب التصحيح، المشبك لمدة تصل إلى 4-6 ساعة. الحفاظ على جزء الأسهم الكبيبات على الجليد.
4. القياسات Ratiometric متحد البؤر مضان من تركيز الكالسيوم داخل الخلايا في Podocytes
- وضع 500 ميكرولتر من الكسر الكبيبات (وصفها في 2.5) في 0.5 مل أنبوب مخروطي الشكل وإضافة الأصباغ الكالسيوم FURA الأحمر، وAM فلوو-4، AM. استخدام 2 مم و 1 تركيزات الأسهم ملي من FURA الأحمر، وAM فلوو-4، AM، على التوالي (مخزن في -20 ° C، الذائبة في DMSO) واستخدام 2.5 ميكرولتر من كل صبغة ل500 ميكرولتر من الكبيبات الكسر. مباشرة بعد إضافة الأصباغ تغطية الأنبوب بورق الألمنيوم.
- مكان الأنابيب على شاكر الدورية لمدة 20 دقيقة على الأقل ما يصل إلى 1 ساعة على RT.
ملاحظة: وكلاء الدوائية ويمكن أن يضاف خلال هذه الخطوة. - إعداد coverslips الزجاج، غطاء لهم مع بولي ʟ يسين والسماح التجفيف باستخدام ساخنة لوحة مجموعة إلى 70 درجة مئوية.
- بمجرد تحميل الأصباغ الكالسيوم الإنشائيةه، وتطبيق 100 ميكرولتر من الكبيبات التي تحتوي على حل للل coverslips المغلفة بولي ʟ-يسين والسماح لهم التمسك السطح لمدة 5 دقائق. جبل لل coverslips المرفقة الكبيبات إلى غرفة التصوير، ويروي مع الحل حمام (التي تحتوي على (مم): 145 كلوريد الصوديوم، 4.5 بوكل، 2 MgCl 2، 10 HEPES، ودرجة الحموضة 7.35) بمعدل 3 مل / دقيقة لإزالة الكبيبات غير مرتبط والأصباغ المتبقية.
- تعيين متحد البؤر المسح بالليزر المجهر إلى 488 نانومتر الطول الموجي الإثارة والمرشحات الانبعاثات (525/25 650/25 ونانومتر لفلوو-4 و FURA الأحمر، على التوالي). تعيين برامج التصوير على التردد المطلوب والقرار.
- العثور على الكبيبات في brightfield ثم تتحول على الكشف عن إشارة مضان. ضبط كثافة الليزر لكل صبغ لتجنب تشبع الإشارة. اختر المستوى البؤري مع podocytes التي يعلق مباشرة على الزجاج. هذا يقلل من تأثير الناجم عن تقلص من الكبيبة ردا على المخدراتالتطبيق. المزدوج الاختيار التي الكبيبة من اختيار ويرد أيضا على الزجاج.
- بدء تصوير البؤري من خيار (لقطة 512 X 512 صورة مع تردد وضعت في 4 ثانية لتصور كا سريع 2+ تغيرات عابرة. استخدام 60X / NA 1.4 أو عدسة موضوعية مماثلة لصورة عالية الدقة)، وتطبيق المخدرات من الفائدة، وتسجيل استجابة.
- اختر المستوى البؤري المطلوب (أقرب إلى سطح الزجاج ممكن، لضمان تصوير podocytes على سطح الكبيبة). تحقق من شدة مضان على Fluo4 وقنوات FuraRed، وتأكد من أن الكبيبة وينظر بشكل واضح في brightfield.
- بدء التصوير. قبل تطبيق أي أدوية، سجل 1 دقيقة على الأقل من مضان خط الأساس للتأكد من أن إشارة مستقرة (لا توجد طفرات مفاجئة أو يتلاشى من إشارة).
- تطبيق الأدوية المطلوبة مع مساعدة من micropipette. توخي الحذر والتأكد من ان المخدرات قادرة على الانتشار بشكل جيد والوصول إلى glomerأولوس. مزيج الحل حمام بلطف إذا لزم الأمر، ومراقبة البؤري المحدد وتأكد من أنه لم يتحرك من التركيز بسبب تطبيق المخدرات.
- تسجيل التغيرات في كثافة مضان للإشارات Fluo4 وFuraRed. تأكد من تسجيل طويل بما فيه الكفاية، عن طريق الانتظار حتى تصل إشارة مستوى الهضبة أو تصل إلى الذروة ثم يعود الى الاساس. أداء التغيير حل أو إضافة أي أدوية أخرى إذا لزم الأمر.
- إيقاف التسجيل، وحفظ الملف في تنسيق أصلي من البرنامج.
5. تحليل الصور لقياس الكالسيوم
- لتحليل الصورة مع يماغيج البرمجيات مفتوحة مجهزة المساعد المساعدة ND التي تسمح باستيراد الصور في شكل ND2 الأصلي.
- استيراد تسلسل الصور. تأكد لتقسيم القنوات واستخدام وضع hyperstack الرمادي.
- اتبع → أدوات → مسار مدير تحليل العائد على الاستثمار في البرمجيات يماغيج لسالقلم نافذة مدير ROI. اختر العديد من المناطق ذات الاهتمام (podocytes) باستخدام أداة التحديد البيضاوي و "إضافة (ر)" وظيفة في إدارة العائد على الاستثمار. كما ROI الماضي، تحديد منطقة في الخلفية. حفظ رويس المحدد (المزيد → حفظ).
- تسليط الضوء على الإطار الذي يحتوي على القناة المحددة للتحليلات. استخدام المزيد → متعددة الوظائف قياس في إدارة ROI، بمناسبة "صف واحد لكل شريحة" مربع في الحوار أن الملوثات العضوية الثابتة، ومن ثم انقر فوق موافق. وسيتم عرض النتائج في شكل يمكن أن تقام في إطار النتائج: الدخول في نتائج خيار القائمة → مجموعة القياسات، حدد "يعني قيمة الرمادية" وحساب قيم الكثافة بكسل لكل ROI، والتي سوف يتم عرضها في نتائج نافذة في أعمدة منفصلة لكل ROI.
- نسخ قيم الكثافة قياس العائد على الاستثمار لكل قناة (فلوو-4 و FURA الأحمر) في فضل برمجيات تحليل البيانات؛ طرح قيم الكثافة الخلفية من كل داتنقطة.
- لكل نقطة زمنية حساب نسبة كثافة من فلوو-4 إلى قنوات FURA الأحمر. مؤامرة مبعثر / خط التغييرات في الوقت نقطة من الكالسيوم 2+ عابرة لكل ROI. حساب القيم متوسط / SE للكبيبات المحدد.
ملاحظة: يجب تعيين عمود وقت وفقا لتردد التصوير المحدد عند 4.5.
6. داخل الخلوية الحسابات تركيز الكالسيوم عن طريق فلوو-4 الإسفار الإشارة
- أخذ عينة من الكبيبات وتنفيذ بروتوكول تجريبي تصل إلى الخطوة 4.7. بعد تسجيل مضان الخلفية إضافة Ionomycin (تركيز النهائي في غرفة الحمام يجب أن تكون 10 ميكرومتر) إلى حل حمام، وسجل مضان زيادة كثافة. عند بلوغ كثافة الأقصى ويبدأ تسوس، إضافة MnCl 2 (يجب أن يكون التركيز النهائي 5 ملم) لإرواء مضان 8.
- تحليل البيانات التي تم الحصول عليها في 6.1. نسخ القيم كثافة ROI فلوو-4 إشارة التي تم الحصول عليها وفقالبروتوكول صفها في 5،1-5،5 بواسطة برنامج التحليل المفضل.
- حساب تركيز الكالسيوم داخل الخلايا (في نانومتر) في خلية رجلاء المقابلة لROI باستخدام الصيغة:
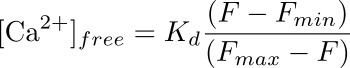
حيث K د هو التفكك محدد مسبقا المستمر لفلوو-4 (345 نيوتن متر)، F هو كثافة في timepoint التي تقوم بحساب تركيز الكالسيوم ل(خط الأساس)، وF دقيقة وF ماكس هي القيم كثافة في نقطة الحمل الأقصى الكالسيوم (بعد تطبيق ionomycin) وبعد التبريد من مضان (مع MnCl 2)، على التوالي (انظر الشكل 3).
النتائج
نحن هنا تعالج مشكلة قياس التغيرات الحادة في مستويات الكالسيوم في podocytes الشكل 1 يدل على تمثيل تخطيطي للبروتوكول تجريبي تصميمها من أجل أداء عالية الدقة التصوير متحد البؤر مضان الحية وحيدة القناة الايونية التسجيلات النشاط في podocytes من الطازجة الكبيبات القوارض ?...
Discussion
النهج وصفها هنا يسمح لتحليل التعامل مع الكالسيوم من قبل podocytes من الكبيبات القوارض. هذا الأسلوب يسمح تطبيق التصحيح، المشبك الكهربية واحد قناة ومضان التصوير متحد البؤر ratiometric. ومع ذلك، كلا النهجين يمكن استخدامها بشكل منفصل، من تلقاء نفسها. البروتوكول المقترح عدة خطوات...
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
فإن الكتاب أود أن أشكر غلين سلوكم (كلية الطب في ويسكونسن) وكولين A. لافين (نيكون الآلات، وشركة) للحصول على المساعدة الفنية ممتازة مع التجارب المجهري. ومن المسلم به غريغوري بلاس لتصحيح التجارب المطبعية نقدية للمخطوطة. وأيد هذا البحث من قبل المعاهد الوطنية للHL108880 منحة الصحة وجمعية السكري الأميركية منح 1-15-BS-172 (إلى AS)، وJ. زمالة بن Lipps البحوث من الجمعية الأمريكية لأمراض الكلى (لDVI).
Materials
| Name | Company | Catalog Number | Comments |
| Fluo4 AM | Life Technologies | F14217 | 500 µl in DMSO |
| FuraRed AM | Life Technologies | F-3020 | |
| Poly-ʟ-lysine | Sigma-Aldrich | P4707 | |
| Pluronic acid | Sigma-Aldrich | F-68 | solution |
| Ionomycin | Sigma-Aldrich | I3909-1ML | |
| Tube rotator | Miltenyi Biotec GmbH | 130-090-753 | Germany |
| Nikon confocal microscope (inverted) | Nikon | Nikon A1R | Laser exitation 488 nm. Emission filters 500-550 nm and 570-620 nm |
| Objective | Nikon | Plan Apo 60x/NA 1.4 Oil | |
| Cover Glass | Thermo Scientific | 6661B52 | |
| High vacuum grease | Dow Corning | Silicone Compound | |
| Software | Nikon | Nikon NIS-Elements | |
| Recording/perfusion chamber | Warner Instruments | RC-26 | |
| Patch clamp amplifier | Molecular Devices | MultiClamp 700B | |
| Data acquisition system | Molecular Devices | Digidata 1440A | Axon Digidata® System |
| Low pass filter | Warner Instruments | LPF-8 | 8 pole Bessel |
| Borosilicate glass capillaries | World Precision Instruments | 1B150F-4 | |
| Micropipette puller | Sutter Instrument Co | P-97 | Flaming/Brown type micropipette puller |
| Microforge | Narishige | MF-830 | Japan |
| Motorized micromanipulator | Sutter Instrument Co | MP-225 | |
| Inverted microscope | Nikon | Eclipse Ti | |
| Microvibration isolation table | TMC | equipped with Faraday cage | |
| Multichannel valve perfusion system | AutoMake Scientific | Valve Bank II | |
| Recording/perfusion chamber | Warner Instruments | RC-26 | |
| Software | Molecular Devices | pClamp 10.2 | |
| Nicardipine | Sigma-Aldrich | N7510 | |
| Iberiotoxin | Sigma | I5904-5UG | |
| Niflumic acid | Sigma-Aldrich | N0630 | |
| DIDS | Sigma-Aldrich | D3514-25MG | |
| TEA chloride | Tocris | T2265 | |
| RPMI 1640 | Life Technologies | 11835030 | without antibiotics |
| BSA | Sigma-Aldrich | A8327 | 30% albumin solution |
| Temperature controlled surgical table | MCW core | for rodents | |
| Steel sieves: | #100 (150 μm), 140 (106 μm) | ||
| Gilson, Inc SIEVE 3 SS FH NO200 | Fisher Sci | 50-871-316 | |
| Gilson, Inc SIEVE 3 SS FH NO270 | Fisher Sci | 50-871-318 | |
| Gilson, Inc SIEVE 3 SS FH NO400 | Fisher Sci | 50-871-320 | |
| mesh 200 | Sigma-Aldrich | s4145 | screen for CD-1 |
| Binocular microscope | Nikon | Eclipse TS100 | |
| Binocular microscope | Nikon | SMZ745 | |
| Syringe pump-based perfusion system | Harvard Apparatus | ||
| Polyethylene tubing | Sigma-Aldrich | PE50 | |
| Isofluorane anesthesia |  VetEquip, Inc. VetEquip, Inc. | 911103 | |
| Other basic reagents | Sigma-Aldrich |
References
- Machuca, E., Benoit, G., Antignac, C. Genetics of nephrotic syndrome: connecting molecular genetics to podocyte physiology. Hum. Mol. Genet. 18, R185-R194 (2009).
- Haraldsson, B., Nystrom, J., Deen, W. M. Properties of the glomerular barrier and mechanisms of proteinuria. Physiol. Rev. 88, 451-487 (2008).
- Patrakka, J., Tryggvason, K. New insights into the role of podocytes in proteinuria. Nat. Rev. Nephrol. 5, 463-468 (2009).
- Savin, V. J., Sharma, R., Lovell, H. B., Welling, D. J. Measurement of albumin reflection coefficient with isolated rat glomeruli. J. Am. Soc. Nephrol. 3, 1260-1269 (1992).
- Gloy, J., et al. Angiotensin II depolarizes podocytes in the intact glomerulus of the Rat. J. Clin. Invest. 99, 2772-2781 (1997).
- Nitschke, R., et al. Angiotensin II increases the intracellular calcium activity in podocytes of the intact glomerulus. Kidney Int. 57, 41-49 (2000).
- Ilatovskaya, D., Staruschenko, A. Single-channel analysis of TRPC channels in the podocytes of freshly isolated glomeruli. Methods Mol Biol. 998, 355-369 (2013).
- Snitsarev, V. A., McNulty, T. J., Taylor, C. W. Endogenous heavy metal ions perturb fura-2 measurements of basal and hormone-evoked Ca2+ signals. Biophys. J. 71, 1048-1056 (1996).
- Fukuda, A., Fujimoto, S., Iwatsubo, S., Kawachi, H., Kitamura, K. Effects of mineralocorticoid and angiotensin II receptor blockers on proteinuria and glomerular podocyte protein expression in a model of minimal change nephrotic syndrome. Nephrology (Carlton). 15, 321-326 (2010).
- Abramowitz, J., Birnbaumer, L. Physiology and pathophysiology of canonical transient receptor potential channels). FASEB J. 23, 297-328 (2009).
- Heeringa, S. F., et al. A novel TRPC6 mutation that causes childhood FSGS. PLoS ONE. 4, e7771 (2009).
- Zhang, X., Song, Z., Guo, Y., Zhou, M. The novel role of TRPC6 in vitamin D ameliorating podocyte injury in STZ-induced diabetic rats. Mol. Cell. Biochem. 399, 155-165 (2015).
- Bohrer, M. P., et al. Mechanisms of the puromycin-induced defects in the transglomerular passage of water and macromolecules. J. Clin. Invest. 60, 152-161 (1977).
- Olson, J. L., Rennke, H. G., Venkatachalam, M. A. Alterations in the charge and size selectivity barrier of the glomerular filter in aminonucleoside nephrosis in rats. Lab. Invest. 44, 271-279 (1981).
- Schiessl, I. M., Castrop, H. Angiotensin II AT2 receptor activation attenuates AT1 receptor-induced increases in the glomerular filtration of albumin: a multiphoton microscopy study. Am J Physiol Renal Physiol. 305, F1189-F1200 (2013).
- Ilatovskaya, D. V., Levchenko, V., Ryan, R. P., Cowley, A. W., Staruschenko, A. NSAIDs acutely inhibit TRPC channels in freshly isolated rat glomeruli. Biochem. Biophys. Res. Commun. 408, 242-247 (2011).
- Peti-Peterdi, J. Calcium wave of tubuloglomerular feedback. Am. J. Physiol. Renal Physiol. 291, F473-F480 (2006).
- Peti-Peterdi, J., Warnock, D. G., Bell, P. D. Angiotensin II directly stimulates ENaC activity in the cortical collecting duct via AT(1) receptors. J. Am. Soc. Nephrol. 13, 1131-1135 (2002).
- Ilatovskaya, D. V., Palygin, O., Levchenko, V., Staruschenko, A. Pharmacological characterization of the P2 receptors profile in the podocytes of the freshly isolated rat glomeruli. Am. J. Physiol. Cell Physiol. 305, C1050-C1059 (2013).
- Ilatovskaya, D. V., et al. Angiotensin II has acute effects on TRPC6 channels in podocytes of freshly isolated glomeruli. Kidney Int. 305, C1050-C1059 (2014).
- Schaldecker, T., et al. Inhibition of the TRPC5 ion channel protects the kidney filter. J. Clin. Invest. 123, 5298-5309 (2013).
- Roshanravan, H., Dryer, S. E. ATP acting through P2Y receptors causes activation of podocyte TRPC6 channels: role of podocin and reactive oxygen species. Am. J. Physiol. Renal Physiol. 306, F1088-F1097 (2014).
- Anderson, M., Roshanravan, H., Khine, J., Dryer, S. E. Angiotensin II activation of TRPC6 channels in rat podocytes requires generation of reactive oxygen species. J. Cell. Physiol. 229, 434-442 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved