Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Análisis y calcio monocanal Imaging en los podocitos de los glomérulos recién aisladas
En este artículo
Resumen
Changes in the intracellular calcium levels in the podocytes are one of the most important means to control the filtration function of glomeruli. Here we explain a high-throughput approach that allows detection of real-time calcium handling and single ion channels activity in the podocytes of the freshly isolated glomeruli.
Resumen
Podocytes (renal glomerular epithelial cells) are known to regulate glomerular permeability and maintain glomerular structure; a key role for these cells in the pathogenesis of various renal diseases has been established since podocyte injury leads to proteinuria and foot process effacement. It was previously reported that various endogenous agents may cause a dramatic overload in intracellular Ca2+ concentration in podocytes, presumably leading to albuminuria, and this likely occurs via calcium-conducting ion channels. Therefore, it appeared important to study calcium handling in the podocytes both under normal conditions and in various pathological states. However, available experimental approaches have remained somewhat limited to cultured and transfected cells. Although they represent a good basic model for such studies, they are essentially extracted from the native environment of the glomerulus. Here we describe the methodology of studying podocytes as a part of the freshly isolated whole glomerulus. This preparation retains the functional potential of the podocytes, which are still attached to the capillaries; therefore, podocytes remain in the environment that conserves the major parts of the glomeruli filtration apparatus. The present manuscript elaborates on two experimental approaches that allow 1) real-time detection of calcium concentration changes with the help of ratiometric confocal fluorescence microscopy, and 2) the recording of the single ion channels activity in the podocytes of the freshly isolated glomeruli. These methodologies utilize the advantages of the native environment of the glomerulus that enable researchers to resolve acute changes in the intracellular calcium handling in response to applications of various agents, measure basal concentration of calcium within the cells (for instance, to evaluate disease progression), and assess and manipulate calcium conductance at the level of single ion channels.
Introducción
Los riñones mantienen el equilibrio homeostático para diversas sustancias y regulan el volumen de sangre en una forma que determina la presión de la sangre total. Las perturbaciones en la filtración renal, reabsorción o plomo secreción o acompañar a los estados patológicos, que van desde la hiper o hipotensión que terminan enfermedad renal que eventualmente requiere un trasplante de riñón. La unidad de filtración renal (glomérulo) consiste en tres capas - el endotelio capilar, la membrana basal y una capa de una sola célula de las células epiteliales - podocitos, que desempeñan un papel importante en el mantenimiento de la integridad y la función 1-rendija de diafragma. Disfunción en el filtro glomerular de permeabilidad selectiva provoca la pérdida urinaria de macromoléculas, tales como proteinuria. Varios agentes pueden afectar a la estructura de los podocitos y sus procesos de pie, que determinan la integridad de la barrera de filtración glomérulos.
Los podocitos están involucrados en el mantenimiento de la Glomfunción de filtración eruli. Se ha establecido que el manejo inadecuado de calcio por el podocitos conduce a la lesión de las células y juega un papel importante en la progresión de diversas formas de nefropatías 2,3. Por lo tanto, el desarrollo de un modelo que permite la medición directa de los cambios de concentración de calcio intracelular será fundamental para el estudio de la función de podocitos. Glomérulos aislados se utilizaron previamente en un numerosos estudios incluyendo la medición del coeficiente de reflexión albúmina cambia 4 y la evaluación de las corrientes celulares integrales en las mediciones electrofisiológicas de patch-clamp de células enteras 5,6. En el presente trabajo se describe el protocolo que permite al investigador para medir cambios en la concentración de calcio intracelular en respuesta a las solicitudes de los agentes farmacológicos, estimar los niveles basales de calcio dentro de las células, y evaluar la actividad de los canales de calcio individual. Mediciones de la concentración de calcio y Ratometric electrop patch-clamphysiology se utilizaron para determinar los cambios en la concentración de calcio intracelular dentro de la actividad de podocitos y el canal, respectivamente.
Protocolo
El uso de animales y el bienestar deben adherirse a la Guía del NIH para el Cuidado y Uso de Animales de Laboratorio siguiendo los protocolos revisados y aprobados por el Cuidado y Uso de Animales Comité Institucional (IACUC).
Flush 1. Riñón
- Emplear de 8 a 12 semanas de edad rata macho (sugerida es una cepa Sprague Dawley, sin embargo otras cepas de diferente edad y el género se pueden utilizar con los cambios apropiados).
- Anestesiar al animal de acuerdo con el procedimiento permitido por protocolo de IACUC; controlar la profundidad de la anestesia e inspeccionar el animal. La descripción detallada de la cirugía que se realiza en 01.03 a 01.08 se pueden encontrar en Ilatovskaya et al 7.
- Después de la anestesia adecuada, coloque el animal en una mesa quirúrgica con control de temperatura, hacer una incisión en la línea media del abdomen (hasta 3 pulgadas de largo), y descubrir la vena cava y la aorta.
- Inserte ligadura alrededor de los celíacos y mesentéricos superiores arterias y el abdomenaorta por encima de aquellos; no ligar.
- Blunt disección de la aorta abdominal por debajo de las arterias renales, y coloque dos ligaduras alrededor de ella, pero no ligar, a continuación, sujetar la aorta por encima de las ligaduras y atar el hilo inferior.
- Cateterizar la aorta con un tubo de PE50 de polietileno (que se adjunta a una bomba de jeringa llena con PBS) por debajo de la abrazadera y fijar el catéter con la segunda ligadura; quitar la pinza, encienda la bomba, y ligar la aorta y arterias mesentérica con celíacos. Hacer rápidamente incisión en la vena renal para aliviar la presión.
- Infundir la aorta con el PBS pre-enfriado para 2 o 3 min a una velocidad de 6 ml / min.
- Deje de perfusión, los impuestos especiales y decapsulate 7 los riñones, y los puso en el hielo en la solución de PBS. La eutanasia del animal según el protocolo aprobado por el IACUC.
2. Aislamiento de la rata Los glomérulos
- Preparar 30 ml de solución fresca de 5% de BSA en medio RPMI 1640.
- Utilizando una hoja de afeitar y tijeras,aislar la corteza de ambos riñones, y luego picar hasta homogeneidad. Este procedimiento ha sido descrito anteriormente 7.
- Empujar el tejido picada durante el paso anterior a través de un tamiz de acero inoxidable de malla 100 (pre-empapado en 5% de solución de BSA / RPMI) usando una espátula. Recoger el flujo a través y por la fuerza de gravedad permiten que el flujo a través pase a través de un tamiz de 140 mesh.
- Filtrar el flujo a través recogido de la malla 140 usando un tamiz de 200 tamiz de malla pre-empapado, desechar el filtrado, y lavar la parte superior del tamiz con 10 - 15 ml de la solución de BSA / RPMI preparado para recoger los glomérulos que el sedimento en el tamiz.
- Ponga la solución de BSA / RPMI que contiene glomérulos en el hielo en un tubo de 15 ml y dejar que el sedimento glomérulos en la parte inferior del tubo para un máximo de 20 min. El concentrado glomérulos en la parte inferior del tubo se puede ver claramente. Eliminar el exceso de solución, dejando aproximadamente 2 ml en el tubo.
3. monocanal Patch-clamp Electrophysiology
- Preparar 5 x 5 mm chips de vidrio cubierta por revestimiento con 70.000 MW - 150000 poli-ʟ-lisina, y dejar secar. Utilice aproximadamente 30 l de solución filtrada estéril 0,01% en agua por cubierta de vidrio.
- Calentar las soluciones experimentales a temperatura ambiente y llenar la cámara de patch-clamp y la pipeta. Para el monitoreo canales TRPC, utilice una solución de baño, en mM: 126 NaCl, CaCl2 1, 10 HEPES, 2 MgCl2, 10 glucosa, pH 7,4; pipeta: 126 NaCl, 1,5 CaCl 2, 10 HEPES, 10 glucosa; pH 7,4.
- Añadir inhibidores a la solución de la pipeta para bloquear la actividad de los canales endógenos, que no son relevantes para los estudios (recomendados son: 100 mM de ácido niflúmico, o DIDS (para bloquear Ca 2 + activados por Cl - canales), TEA 10 mM (para inhibir la de gran conductancia Ca 2 + - K + dependientes de canal), 10 nM iberiotoxina (para bloquear los Ca2 + activados por canales de K +), 10 mM nicardipina (para bloquear de tipo N Ca2 + canales)) directamente antes del experimento de patch-clamp.
- Mezclar suavemente la solución que contiene los glomérulos, y luego aplicar aproximadamente 50 l de a la cubierta revestida virutas de cristal poli-ʟ-lisina. Deje que los glomérulos conceden durante aproximadamente 5 minutos.
- Mover los chips de vidrio con glomérulos a la cámara de patch-clamp pre-llenado con la solución del baño; perfundir la cámara a una velocidad de 3 ml / min durante 1 min para asegurar la eliminación de los glomérulos no fijadas.
- Llevar a cabo un experimento de patch-clamp convencional en un modo celular conectado a 7. Con una pipeta de vidrio (7 - 10 de mO resistencia pipeta) formar un sello de alta resistencia entre una pipeta y una membrana de podocitos mediante la aplicación de una succión suave (una pipeta unida a una podocitos en la superficie del glomérulo aislado se muestra en la Figura 2, en la izquierda).
- Para las mediciones de células inscritos, de paso bajo las corrientes de 300 Hz por un filtro de ocho polos de Bessel.
- Use aisló glomérulos en experimentos de patch-clamp para un máximo de 4-6 horas. Mantenga la fracción de stock glomérulos en hielo.
4. Ratiometric confocal de fluorescencia mediciones de la concentración de calcio intracelular en los podocitos
- Coloque 500 l de la fracción de glomérulos (descrito en 2.5) en 0,5 ml tubo cónico y añadir colorantes calcio Fura Red, AM y Fluo-4, de AM. Utilice 2 mM y 1 mM concentraciones stock de Fura Red, AM y Fluo-4 AM, respectivamente (almacenar a -20 ° C, se disolvió en DMSO) y el uso de 2,5 l de cada colorante por unos 500 l de fracción glomérulos. Inmediatamente después de la adición de los colorantes cubrir el tubo con papel de aluminio.
- Colocar los tubos en un agitador giratorio durante al menos 20 min hasta 1 h a RT.
Nota: Los agentes farmacológicos pueden ser añadidos durante este paso. - Preparar cubreobjetos de vidrio, cubrirlos con poli-ʟ-lisina y permitir el secado utilizando conjunto placa calentada a 70 ° C.
- Una vez que la carga de colorantes de calcio es complete, aplicar 100 l de los glomérulos que contienen solución a los cubreobjetos recubiertos de poli-ʟ-lisina y dejar que ellos se adhieren a la superficie durante aproximadamente 5 min. Montar los cubreobjetos glomérulos conectado a una cámara de formación de imágenes, y perfundir con la solución del baño (que contiene (en mM): 145 NaCl, 4,5 KCl, 2 MgCl 2, 10 HEPES, pH 7,35) a una velocidad de 3 ml / min para eliminar los glomérulos no unidas y los tintes restantes.
- Ajuste el microscopio de barrido confocal láser a una longitud de onda de excitación de 488 nm y filtros de emisión (525/25 y 650/25 nm para Fluo-4 y Fura Red, respectivamente). Ajuste el software de imágenes a una frecuencia y resolución deseada.
- Encuentra los glomérulos en campo claro y luego girar en la detección de la señal de fluorescencia. Ajuste de la intensidad del láser para cada tinte para evitar la saturación de la señal. Elija el plano focal con los podocitos que están directamente conectados a la copa. Esto minimiza el efecto causado por la contracción de un glomérulo en respuesta a drogassolicitud. Haga doble verificación que el glomérulo de elección es bien unido al cristal;
- Comience imágenes del plano focal de elección (tomar 512 x 512 imágenes con la frecuencia establecida en 4 segundos para visualizar Ca 2+ rápida cambios transitorios. Use un NA 1.4 o / lente de objetivo similar 60X imagen de alta resolución para), aplicar fármacos de interés, y registrar la respuesta.
- Seleccionar un plano focal deseada (tan cerca de la superficie del vidrio como sea posible, para asegurar la obtención de imágenes de los podocitos en la superficie del glomérulo). Compruebe la intensidad de la fluorescencia en el Fluo4 y canales FuraRed, y asegúrese de que el glomérulo se ve claramente en campo claro.
- Iniciar la formación de imágenes. Antes de la aplicación de cualquier droga, ficha al menos 1 min de la fluorescencia de referencia para asegurarse de que la señal es estable (no hay picos repentinos o desvanecimiento de la señal).
- Aplicar medicamentos deseados con la ayuda de una micropipeta; tener cuidado y asegurarse de la droga era capaz de difundir bien y llegar a la glomerulus. Mezcle la solución del baño suavemente, si es necesario, controlar el plano focal seleccionada y comprobar que no se movió fuera de foco debido a la aplicación del fármaco.
- Registre los cambios en la intensidad de fluorescencia de las señales Fluo4 y FuraRed. Asegúrese de que la grabación es lo suficientemente largo, por la espera hasta que la señal alcanza el nivel de meseta o alcanza un pico y luego vuelve a la línea de base. Realizar el cambio o adición de solución de otros medicamentos si es necesario.
- Detener la grabación y guardar el archivo en el formato nativo del software.
5. Análisis de imagen para las mediciones de calcio
- Realizar análisis de imágenes con el software ImageJ abierta equipada con el plugin Utilidad ND que permite la importación de imágenes en el formato nativo ND2.
- Importe la secuencia de imágenes; asegúrese de dividir los canales y utilizar un modo de escala de grises HyperStack.
- Siga el camino → Herramientas → Analizar gerente ROI en el software ImageJ para opluma una ventana del gestor ROI. Seleccione varias regiones de interés (podocitos) utilizando una herramienta de selección ovalada y el "Añadir (t)" función en el Administrador de retorno de la inversión. Como el último ROI, seleccione el área en el fondo; guardar la ROI seleccionados (Más → Guardar).
- Resalte la ventana que contiene el canal seleccionado para los análisis. Utilice la función de Más → Medida múltiples en el Administrador de retorno de la inversión, marque la casilla de "una fila por rebanada" en el diálogo que aparece, y luego haga clic en Aceptar. Los resultados se muestran en el formato que se puede configurar en la ventana de resultados: entrar en la opción de menú Resultados → Set mediciones, seleccione "valor de gris medio" y calcular los valores de intensidad de píxel para cada ROI, que se muestra en el ventana Resultados en columnas separadas para cada ROI.
- Copiar los valores de intensidad medidos de ROI para cada canal (Fluo-4 y Fura Red) en el software de análisis de datos preferido; valores de intensidad fondo restar de cada datun punto.
- Para cada punto de tiempo de calcular la relación de intensidades de la Fluo-4 a los canales de Fura rojas. Gráfico de dispersión / línea cambios en tiempo punto de Ca 2+ transitorio para cada ROI. Calcular los valores medios / SE para glomérulos seleccionados.
Nota: la columna Tiempo debe ajustarse de acuerdo a la frecuencia de imagen seleccionado en el 4,5.
6. intracelulares cálculos de concentración de calcio Fluo-4 Uso de la señal de fluorescencia
- Tomar una muestra de los glomérulos y realizar el protocolo experimental hasta el paso 4.7. Después de la grabación de la fluorescencia de fondo añadir ionomicina (concentración final en la cámara de baño debe ser de 10 M) a la solución del baño, y el aumento de la intensidad de fluorescencia registro. Una vez que la intensidad alcanza su máximo y la decadencia se inicia, agregue MnCl2 (concentración final debe ser de 5 mM) para apagar la fluorescencia 8.
- Analizar los datos obtenidos en 6.1. Copie los Fluo-4 valores de intensidad de señal de retorno de la inversión obtenidos de acuerdocon el protocolo descrito en 5.1 a 5.5 por software de análisis preferido.
- Calcular la concentración de calcio intracelular (en nM) en el podocito correspondiente a la ROI mediante una fórmula:
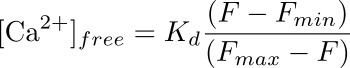
donde K d es una disociación predeterminado constante de Fluo-4 (345 nm), F es la intensidad en el punto de tiempo que se está calculando la concentración de calcio para la (línea de base), y F min y F max son los valores de intensidad de la punto de carga máxima de calcio (después de la aplicación ionomicina) y después de la extinción de la fluorescencia (con MnCl 2), respectivamente (véase la Figura 3).
Resultados
Aquí abordamos el problema de la medición de los cambios agudos en los niveles de calcio en los podocitos. La figura 1 muestra una representación esquemática del protocolo experimental diseñado para realizar alta resolución de imagen confocal de fluorescencia en vivo y grabaciones de actividades individuales de los canales iónicos en los podocitos del recién glomérulos roedores aislados. En pocas palabras, después de que se anestesió la rata, los riñones deben lavarse con PBS para borrarlos ...
Discusión
El enfoque descrito aquí permite el análisis de manejo del calcio por los podocitos de los glomérulos de roedores. Esta técnica permite la aplicación de patch-clamp electrofisiología solo canal y de fluorescencia de imagen confocal radiométrica. Sin embargo, ambos enfoques pueden ser utilizados por separado, por su propia cuenta. El protocolo propuesto tiene varios pasos relativamente simples, incluyendo ras 1) del riñón; 2) el aislamiento de los glomérulos por tamizado diferencial; 3) la realización de patch...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores desean agradecer a Glen Slocum (Colegio Médico de Wisconsin) y Colleen A. Lavin (Nikon Instruments, Inc.) para una excelente asistencia técnica con los experimentos de microscopía. Gregory Blass es reconocido por corrección crítica del manuscrito. Esta investigación fue financiada por los Institutos Nacionales de Salud de subvención HL108880 y la Asociación Americana de Diabetes conceder 1-15-BS-172 (AS), y el Ben J. Lipps de Becas de Investigación de la Sociedad Americana de Nefrología (DVI).
Materiales
| Name | Company | Catalog Number | Comments |
| Fluo4 AM | Life Technologies | F14217 | 500 µl in DMSO |
| FuraRed AM | Life Technologies | F-3020 | |
| Poly-ʟ-lysine | Sigma-Aldrich | P4707 | |
| Pluronic acid | Sigma-Aldrich | F-68 | solution |
| Ionomycin | Sigma-Aldrich | I3909-1ML | |
| Tube rotator | Miltenyi Biotec GmbH | 130-090-753 | Germany |
| Nikon confocal microscope (inverted) | Nikon | Nikon A1R | Laser exitation 488 nm. Emission filters 500-550 nm and 570-620 nm |
| Objective | Nikon | Plan Apo 60x/NA 1.4 Oil | |
| Cover Glass | Thermo Scientific | 6661B52 | |
| High vacuum grease | Dow Corning | Silicone Compound | |
| Software | Nikon | Nikon NIS-Elements | |
| Recording/perfusion chamber | Warner Instruments | RC-26 | |
| Patch clamp amplifier | Molecular Devices | MultiClamp 700B | |
| Data acquisition system | Molecular Devices | Digidata 1440A | Axon Digidata® System |
| Low pass filter | Warner Instruments | LPF-8 | 8 pole Bessel |
| Borosilicate glass capillaries | World Precision Instruments | 1B150F-4 | |
| Micropipette puller | Sutter Instrument Co | P-97 | Flaming/Brown type micropipette puller |
| Microforge | Narishige | MF-830 | Japan |
| Motorized micromanipulator | Sutter Instrument Co | MP-225 | |
| Inverted microscope | Nikon | Eclipse Ti | |
| Microvibration isolation table | TMC | equipped with Faraday cage | |
| Multichannel valve perfusion system | AutoMake Scientific | Valve Bank II | |
| Recording/perfusion chamber | Warner Instruments | RC-26 | |
| Software | Molecular Devices | pClamp 10.2 | |
| Nicardipine | Sigma-Aldrich | N7510 | |
| Iberiotoxin | Sigma | I5904-5UG | |
| Niflumic acid | Sigma-Aldrich | N0630 | |
| DIDS | Sigma-Aldrich | D3514-25MG | |
| TEA chloride | Tocris | T2265 | |
| RPMI 1640 | Life Technologies | 11835030 | without antibiotics |
| BSA | Sigma-Aldrich | A8327 | 30% albumin solution |
| Temperature controlled surgical table | MCW core | for rodents | |
| Steel sieves: | #100 (150 μm), 140 (106 μm) | ||
| Gilson, Inc SIEVE 3 SS FH NO200 | Fisher Sci | 50-871-316 | |
| Gilson, Inc SIEVE 3 SS FH NO270 | Fisher Sci | 50-871-318 | |
| Gilson, Inc SIEVE 3 SS FH NO400 | Fisher Sci | 50-871-320 | |
| mesh 200 | Sigma-Aldrich | s4145 | screen for CD-1 |
| Binocular microscope | Nikon | Eclipse TS100 | |
| Binocular microscope | Nikon | SMZ745 | |
| Syringe pump-based perfusion system | Harvard Apparatus | ||
| Polyethylene tubing | Sigma-Aldrich | PE50 | |
| Isofluorane anesthesia |  VetEquip, Inc. VetEquip, Inc. | 911103 | |
| Other basic reagents | Sigma-Aldrich |
Referencias
- Machuca, E., Benoit, G., Antignac, C. Genetics of nephrotic syndrome: connecting molecular genetics to podocyte physiology. Hum. Mol. Genet. 18, R185-R194 (2009).
- Haraldsson, B., Nystrom, J., Deen, W. M. Properties of the glomerular barrier and mechanisms of proteinuria. Physiol. Rev. 88, 451-487 (2008).
- Patrakka, J., Tryggvason, K. New insights into the role of podocytes in proteinuria. Nat. Rev. Nephrol. 5, 463-468 (2009).
- Savin, V. J., Sharma, R., Lovell, H. B., Welling, D. J. Measurement of albumin reflection coefficient with isolated rat glomeruli. J. Am. Soc. Nephrol. 3, 1260-1269 (1992).
- Gloy, J., et al. Angiotensin II depolarizes podocytes in the intact glomerulus of the Rat. J. Clin. Invest. 99, 2772-2781 (1997).
- Nitschke, R., et al. Angiotensin II increases the intracellular calcium activity in podocytes of the intact glomerulus. Kidney Int. 57, 41-49 (2000).
- Ilatovskaya, D., Staruschenko, A. Single-channel analysis of TRPC channels in the podocytes of freshly isolated glomeruli. Methods Mol Biol. 998, 355-369 (2013).
- Snitsarev, V. A., McNulty, T. J., Taylor, C. W. Endogenous heavy metal ions perturb fura-2 measurements of basal and hormone-evoked Ca2+ signals. Biophys. J. 71, 1048-1056 (1996).
- Fukuda, A., Fujimoto, S., Iwatsubo, S., Kawachi, H., Kitamura, K. Effects of mineralocorticoid and angiotensin II receptor blockers on proteinuria and glomerular podocyte protein expression in a model of minimal change nephrotic syndrome. Nephrology (Carlton). 15, 321-326 (2010).
- Abramowitz, J., Birnbaumer, L. Physiology and pathophysiology of canonical transient receptor potential channels). FASEB J. 23, 297-328 (2009).
- Heeringa, S. F., et al. A novel TRPC6 mutation that causes childhood FSGS. PLoS ONE. 4, e7771 (2009).
- Zhang, X., Song, Z., Guo, Y., Zhou, M. The novel role of TRPC6 in vitamin D ameliorating podocyte injury in STZ-induced diabetic rats. Mol. Cell. Biochem. 399, 155-165 (2015).
- Bohrer, M. P., et al. Mechanisms of the puromycin-induced defects in the transglomerular passage of water and macromolecules. J. Clin. Invest. 60, 152-161 (1977).
- Olson, J. L., Rennke, H. G., Venkatachalam, M. A. Alterations in the charge and size selectivity barrier of the glomerular filter in aminonucleoside nephrosis in rats. Lab. Invest. 44, 271-279 (1981).
- Schiessl, I. M., Castrop, H. Angiotensin II AT2 receptor activation attenuates AT1 receptor-induced increases in the glomerular filtration of albumin: a multiphoton microscopy study. Am J Physiol Renal Physiol. 305, F1189-F1200 (2013).
- Ilatovskaya, D. V., Levchenko, V., Ryan, R. P., Cowley, A. W., Staruschenko, A. NSAIDs acutely inhibit TRPC channels in freshly isolated rat glomeruli. Biochem. Biophys. Res. Commun. 408, 242-247 (2011).
- Peti-Peterdi, J. Calcium wave of tubuloglomerular feedback. Am. J. Physiol. Renal Physiol. 291, F473-F480 (2006).
- Peti-Peterdi, J., Warnock, D. G., Bell, P. D. Angiotensin II directly stimulates ENaC activity in the cortical collecting duct via AT(1) receptors. J. Am. Soc. Nephrol. 13, 1131-1135 (2002).
- Ilatovskaya, D. V., Palygin, O., Levchenko, V., Staruschenko, A. Pharmacological characterization of the P2 receptors profile in the podocytes of the freshly isolated rat glomeruli. Am. J. Physiol. Cell Physiol. 305, C1050-C1059 (2013).
- Ilatovskaya, D. V., et al. Angiotensin II has acute effects on TRPC6 channels in podocytes of freshly isolated glomeruli. Kidney Int. 305, C1050-C1059 (2014).
- Schaldecker, T., et al. Inhibition of the TRPC5 ion channel protects the kidney filter. J. Clin. Invest. 123, 5298-5309 (2013).
- Roshanravan, H., Dryer, S. E. ATP acting through P2Y receptors causes activation of podocyte TRPC6 channels: role of podocin and reactive oxygen species. Am. J. Physiol. Renal Physiol. 306, F1088-F1097 (2014).
- Anderson, M., Roshanravan, H., Khine, J., Dryer, S. E. Angiotensin II activation of TRPC6 channels in rat podocytes requires generation of reactive oxygen species. J. Cell. Physiol. 229, 434-442 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados