Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Single-channel Analyse et Imagerie de calcium dans les podocytes des glomérules fraîchement isolés
Dans cet article
Résumé
Changes in the intracellular calcium levels in the podocytes are one of the most important means to control the filtration function of glomeruli. Here we explain a high-throughput approach that allows detection of real-time calcium handling and single ion channels activity in the podocytes of the freshly isolated glomeruli.
Résumé
Podocytes (renal glomerular epithelial cells) are known to regulate glomerular permeability and maintain glomerular structure; a key role for these cells in the pathogenesis of various renal diseases has been established since podocyte injury leads to proteinuria and foot process effacement. It was previously reported that various endogenous agents may cause a dramatic overload in intracellular Ca2+ concentration in podocytes, presumably leading to albuminuria, and this likely occurs via calcium-conducting ion channels. Therefore, it appeared important to study calcium handling in the podocytes both under normal conditions and in various pathological states. However, available experimental approaches have remained somewhat limited to cultured and transfected cells. Although they represent a good basic model for such studies, they are essentially extracted from the native environment of the glomerulus. Here we describe the methodology of studying podocytes as a part of the freshly isolated whole glomerulus. This preparation retains the functional potential of the podocytes, which are still attached to the capillaries; therefore, podocytes remain in the environment that conserves the major parts of the glomeruli filtration apparatus. The present manuscript elaborates on two experimental approaches that allow 1) real-time detection of calcium concentration changes with the help of ratiometric confocal fluorescence microscopy, and 2) the recording of the single ion channels activity in the podocytes of the freshly isolated glomeruli. These methodologies utilize the advantages of the native environment of the glomerulus that enable researchers to resolve acute changes in the intracellular calcium handling in response to applications of various agents, measure basal concentration of calcium within the cells (for instance, to evaluate disease progression), and assess and manipulate calcium conductance at the level of single ion channels.
Introduction
Les reins maintiennent l'équilibre homéostatique pour diverses substances et de réguler le volume sanguin d'une manière qui détermine la pression sanguine totale. Des perturbations dans la filtration rénale, la réabsorption ou la sécrétion d'entraîner ou d'accompagner des états pathologiques, allant de l'hyper ou hypotension pour mettre fin à l'insuffisance rénale qui nécessite éventuellement une transplantation rénale. L'unité de filtration rénale (glomérule) se compose de trois couches - l'endothélium capillaire, la membrane basale et une couche mono-cellulaire des cellules épithéliales - podocytes, qui jouent un rôle majeur dans le maintien de l'intégrité et de la fonction 1 fente diaphragme. Dysfonction dans le filtre glomérulaire provoque une perte urinaire à perméabilité sélective de macromolécules, telles que la protéinurie. Différents agents peuvent affecter la structure des podocytes et leurs procédés de pied, qui déterminent l'intégrité de la barrière de filtration de glomérules.
Les podocytes sont impliqués dans le maintien de la glomfonction de filtration Eruli. Il a été établi que la manipulation de calcium impropre à l'podocytes conduit à une lésion de la cellule et joue un rôle important dans la progression de diverses formes de néphropathies 2,3. Par conséquent, le développement d'un modèle qui permet de mesure directe des changements de concentration de calcium intracellulaire sera déterminante pour les études de la fonction des podocytes. Glomérules isolés ont été précédemment utilisés dans de nombreuses études, y compris une mesure du coefficient de réflexion albumine change 4 et l'évaluation des courants cellulaires intégraux dans les cellules entières électrophysiologiques mesures de patch-clamp 5,6. Dans le présent article, nous décrivons le protocole qui permet au chercheur de mesurer intracellulaires changements de concentration de calcium en réponse aux demandes d'agents pharmacologiques, estimer les niveaux de calcium dans les cellules basales, et d'évaluer l'activité des particuliers canaux calciques. Mesures de la concentration de calcium Ratometric et patch-clamp electrophysiology ont été utilisés pour déterminer respectivement des changements dans la concentration de calcium intracellulaire au sein de l'activité de canal et podocytes.
Protocole
L'utilisation et le bien-être des animaux devraient adhérer à la NIH Guide pour le soin et l'utilisation des animaux de laboratoire suivant les protocoles examinés et approuvés par le Comité de protection des animaux et l'utilisation institutionnelle (IACUC).
1. Kidney Flush
- Utiliser 8 à 12 semaines vieux rat mâle (suggéré est une souche Sprague Dawley, mais d'autres souches d'âge et sexe différent peuvent être utilisés avec les modifications appropriées).
- Anesthésier les animaux selon le mode opératoire autorisé par le protocole IACUC; surveiller la profondeur de l'anesthésie et d'inspecter l'animal. La description détaillée de l'opération à effectuer dans 1.3 à 1.8 peuvent être trouvés dans Ilatovskaya 7 et al.
- Après une anesthésie adéquate, placer l'animal sur une table chirurgicale à température contrôlée, faire une incision médiane de l'abdomen (jusqu'à 3 pouces de longueur), et de découvrir la veine cave et l'aorte.
- Insérez ligature autour les cœliaques et mésentériques supérieure artères et les abdominauxceux au-dessus de l'aorte; ne pas ligaturer.
- Blunt disséquer l'aorte abdominale dessous des artères rénales, et placez deux ligatures autour de lui, mais ne ligaturer, puis serrer l'aorte au-dessus des ligatures et attacher le fil inférieur.
- Cathétériser l'aorte avec une tubulure PE50 polyéthylène (attaché à une pompe à seringue remplie de PBS) au-dessous de la pince et fixer le cathéter à la seconde ligature; retirer la pince, tourner sur la pompe, et ligaturer l'aorte et des artères mésentériques avec coeliaques. Vite incision dans la veine rénale pour soulager la pression.
- Infuser l'aorte avec le PBS pré-refroidi pendant 2 ou 3 minutes à une vitesse de 6 ml / min.
- Arrêtez la perfusion, accises et décapsuler 7 les reins, et les mettre sur la glace dans la solution PBS. Euthanasier l'animal selon un protocole approuvé par le IACUC.
2. Isolement des glomérules Rat
- Préparer 30 ml de solution fraîche de 5% de BSA dans du milieu RPMI 1640.
- En utilisant une lame de rasoir et des ciseaux,isoler le cortex des deux reins, puis émincer jusqu'à homogénéité. Cette procédure a été décrite précédemment 7.
- Appuyez sur le tissu haché lors de l'étape précédente à travers un tamis en acier inoxydable de 100 mesh (pré-trempés dans 5% de BSA en solution / RPMI) à l'aide d'une spatule. Recueillir l'écoulement et par la force de gravité permettent l'écoulement de passer à travers un tamis 140 mesh.
- Filtrer la accréditives recueillies auprès des 140 tamis en utilisant un tamis à mailles de 200 pré-imprégné, jeter le filtrat, et laver le haut du tamis avec 10 - 15 ml de la solution préparée BSA / RPMI pour recueillir les glomérules que les sédiments sur le tamis.
- Mettre la solution de BSA / RPMI contenant glomérules sur de la glace dans un tube de 15 ml et laisser le sédiment de glomérules au fond du tube pour un maximum de 20 min. Le concentré de glomérules sur le fond du tube sera clairement visible. Retirer la solution en excès, en laissant environ 2 ml dans le tube.
3. Single-channel patch-clamp Electrophysiology
- Préparer 5 x 5 mm éclats de verre de couverture en les enduisant d'MW 70.000 - 150.000 poly-ʟ-lysine, et laisser sécher. Utilisez environ 30 pi de 0,01% solution filtrée stérile dans l'eau par verre de couverture.
- Réchauffez les solutions expérimentales à RT et remplir la chambre de patch-clamp et la pipette. Pour les canaux de TRPC surveillance, utiliser une solution de bain, en mm: 126 NaCl, CaCl2 1, 10 HEPES, 2 MgCl 2, 10 glucose, pH 7,4; pipette: 126 NaCl, CaCl2 1,5, HEPES 10, 10 glucose; pH 7,4.
- Ajouter inhibiteurs à la solution de la pipette pour bloquer l'activité de canaux endogènes, qui ne sont pas pertinentes pour les études (recommandées sont les suivantes: 100 uM acide niflumique ou DIDS (pour bloquer Ca 2+ activés par canaux Cl -), 10 mM TEA (pour inhiber la grande conductance Ca 2 + - K + dépendante canal), 10 nM ibériotoxine (pour bloquer les Ca2 + canaux K + activés par), 10 uM nicardipine (pour bloquer Ca de type N2+ canaux)) directement avant l'expérience de patch-clamp.
- Mélanger doucement la solution contenant glomérules, et ensuite appliquer environ 50 pi de celui-ci à la couverture enduite éclats de verre poly-ʟ-lysine. Laissez les glomérules attachent pendant environ 5 min.
- Déplacer les éclats de verre avec glomérules à la chambre de patch-clamp pré-remplies avec la solution de bain; perfuser la chambre à un débit de 3 ml / min pendant 1 min à assurer l'élimination des glomérules seules.
- Mener une expérience de patch-clamp conventionnel dans un mode cellule attachée 7. Avec une pipette en verre (7 à 10 MQ de résistance à la pipette) forment un joint d'étanchéité à haute résistance entre une pipette et une membrane de podocytes par application d'une aspiration douce (une pipette fixée à un podocytes sur la surface du glomérule isolé est représenté sur la figure 2, sur la gauche).
- Pour les mesures ci-joint cellules passe-bas, les courants à 300 Hz par un filtre à huit pôles Bessel.
- Usoi isolé glomérules dans les expériences de patch-clamp pour un maximum de 4 - 6 h. Gardez la fraction stock glomérules sur la glace.
4. Ratiométrique confocale de fluorescence mesures de la concentration intracellulaire de calcium dans les podocytes
- Placez 500 pi de la fraction de glomérules (décrit à 2,5) dans 0,5 ml tube conique et ajouter des colorants de calcium Fura rouges, AM et Fluo-4, AM. Utilisez 2 mm et 1 mm actions concentrations de Fura-Rouge, AM et Fluo-4, AM, respectivement (conserver à -20 ° C, dissous dans du DMSO) et utiliser 2,5 pi de chaque colorant pendant 500 pi de fraction de glomérules. Immédiatement après l'ajout des colorants couvrir le tube de papier d'aluminium.
- Placer les tubes sur un agitateur rotatif pendant au moins 20 minutes jusqu'à une heure à température ambiante.
Remarque: Les agents pharmacologiques peuvent être ajoutés au cours de cette étape. - Préparer des lamelles de verre, les couvrir avec de la poly-ʟ-lysine et de permettre un séchage en utilisant ensemble de plaque chauffée à 70 ° C.
- Une fois le chargement des colorants de calcium est complete, applique 100 pl de solution contenant les glomérules des lamelles couvre-objet enduites de poly-lysine-ʟ et qu'ils adhèrent à la surface pendant environ 5 min. Monter les lamelles de glomérules inscrits dans une chambre de formation d'image, et perfuser avec la solution de bain (contenant (en mM): 145 NaCl, 4,5 KCl, 2 MgCl2, 10 HEPES, pH 7,35) à un débit de 3 ml / min pour supprimer les glomérules seules et les colorants restants.
- Régler la confocal à balayage laser à une longueur d'onde d'excitation de 488 nm et de filtres d'émission (525/25 et 650/25 nm pour Fluo-4 et Fura-Rouge, respectivement). Réglez le logiciel d'imagerie à une fréquence et la résolution souhaitée.
- Trouver les glomérules en clair et puis tourner sur la détection du signal de fluorescence. Ajuster l'intensité du laser pour chaque colorant pour éviter la saturation du signal. Choisir le plan focal avec les podocytes qui sont directement attachés à la vitre. Ceci minimise l'effet provoqué par la contraction d'un glomérule en réponse à médicamentapplication. Double-vérifier que le glomérule de choix est bien fixé à la vitre;
- Lancer l'imagerie du plan focal de choix (prendre 512 x 512 images avec la fréquence fixée à 4 secondes de visualiser Ca 2+ rapide des changements transitoires. Utilisez un / NA 1.4 ou objectif 60X similaire image haute résolution pour), appliquer médicaments d'intérêt, et enregistrer la réponse.
- Sélectionner un plan focal souhaité (le plus près de la surface du verre, donc, pour assurer l'imagerie de podocytes sur la surface du glomérule). Vérifiez l'intensité de fluorescence sur le Fluo4 et canaux FuraRed, et assurez-vous que le glomérule est clairement visible dans fond clair.
- Lancer imagerie. Avant l'application de toutes les drogues, fiche d'au moins 1 min de fluorescence de base pour vous assurer que le signal est stable (il n'y a pas de pointes soudaines ou évanouissement du signal).
- Appliquer médicaments souhaités à l'aide d'une micro-pipette; soyez prudent et veiller à la drogue était capable de bien diffuser et atteindre le glomerUlus. Mélanger la solution de bain en douceur si nécessaire, suivre le plan focal choisi et vérifier qu'il ne bougeait pas de mise au point en raison de la demande de drogue.
- Enregistrer les variations de l'intensité de fluorescence pour les signaux Fluo4 et FuraRed. Assurez-vous que l'enregistrement est assez long, en attendant que le signal atteint le niveau du plateau ou atteint un pic, puis retourne à la ligne de base. Effectuer le changement de la solution ou l'addition de tous les autres médicaments si nécessaire.
- Arrêtez l'enregistrement, et enregistrer le fichier dans le format natif du logiciel.
5. Analyse d'image pour les mesures de calcium
- Effectuer l'analyse d'image avec le logiciel ImageJ ouverte équipée avec le plugin utilitaire ND qui permet d'importer des images dans le format natif ND2.
- Importez la séquence d'images; assurez-vous de séparer les canaux et utiliser un mode HyperStack en niveaux de gris.
- Suivez l'→ Outils → ROI chemin Analyser de gestionnaire dans le logiciel ImageJ à oStylo une fenêtre du gestionnaire de ROI. Sélectionnez plusieurs régions d'intérêt (podocytes) en utilisant un outil de sélection ovale et le "(t) Ajouter" fonction dans le Gestionnaire de ROI. Comme la dernière ROI, sélectionnez la zone à l'arrière-plan; enregistrer les ROI sélectionnés (Plus → Enregistrer).
- Mettez en surbrillance la fenêtre contenant le canal sélectionné pour analyses. Utilisez la fonction multi More → Mesurer dans le Gestionnaire de ROI, cochez la case "une ligne par tranche» dans le dialogue qui sort, puis cliquez sur OK. Les résultats seront affichés dans le format qui peut être mis en place dans la fenêtre des résultats: entrer dans les options de menu Résultats → Set Mesures, sélectionnez "Valeur moyenne grise» et de calculer les valeurs d'intensité de pixel pour chaque ROI, qui sera affiché dans la fenêtre Résultats dans des colonnes distinctes pour chaque ROI.
- Copiez les valeurs d'intensité de ROI mesurées pour chaque canal (Fluo-4 et Fura-Rouge) dans le logiciel d'analyse de données pratique; valeurs d'intensité de fond Soustraire de chaque datun point.
- Pour chaque point de temps de calculer le rapport des intensités du Fluo-4 à canaux Fura rouges. Terrain scatter / ligne change de point de temps de la Ca transitoire pour chaque ROI. Calculer les valeurs moyennes / SE pour glomérules sélectionnés.
Remarque: la colonne de temps devrait être fixé en fonction de la fréquence d'imagerie sélectionné à 4,5.
6. Calculs intracellulaires de calcium de concentration en utilisant Fluo-4 Fluorescence Signal
- Prélever un échantillon des glomérules et exécuter le protocole expérimental jusqu'à l'étape 4.7. Après l'enregistrement de la fluorescence de fond ajouter ionomycine (concentration finale dans la chambre de bain doit être de 10 uM) à la solution de bain, et de l'augmentation de l'intensité de fluorescence fiche. Une fois l'intensité atteint son maximum et la décroissance commence, ajouter MnCl2 (concentration finale doit être de 5 mm) pour étancher la fluorescence 8.
- Analyser les données obtenues en 6.1. Copier les valeurs d'intensité de ROI Fluo-4 signal obtenues selonle protocole décrit à 5/1 à 5/5 par un logiciel d'analyse préféré.
- Calculer la concentration en calcium intracellulaire (en nM) dans le podocyte correspondant à la ROI en utilisant une formule:
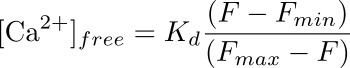
où K d est une dissociation prédéterminée constante de Fluo-4 (345 nM), F est l'intensité au point de temps que vous êtes le calcul de la concentration en calcium de (niveau de référence), et F min et F max sont les valeurs d'intensité au point de charge maximale de calcium (après application ionomycine) et après extinction de la fluorescence (avec MnCl 2), respectivement (voir Figure 3).
Résultats
Ici, nous avons abordé le problème de la mesure des changements de courte durée dans les niveaux de calcium dans les podocytes. La figure 1 montre une représentation schématique du protocole expérimental conçu pour effectuer l'imagerie haute résolution fluorescence confocale en temps réel et des enregistrements individuels de l'activité des canaux ioniques dans les podocytes de la fraîchement glomérules isolés de rongeurs. Brièvement, après le rat est anesthésié, les reins doive...
Discussion
L'approche décrite ici permet l'analyse de manipulation de calcium par les podocytes des glomérules chez les rongeurs. Cette technique permet l'application de patch-clamp électrophysiologie à canal unique et imagerie confocale à fluorescence ratiométrique. Cependant, les deux approches peuvent être utilisés séparément, sur leur propre. Le protocole proposé comporte plusieurs étapes relativement simples, y compris 1) Kidney Flush; 2) l'isolement des glomérules par tamisage différentiel; 3) e...
Déclarations de divulgation
Les auteurs ont rien à révéler.
Remerciements
Les auteurs tiennent à remercier Glen Slocum (Medical College of Wisconsin) et Colleen A. Lavin (Nikon Instruments, Inc.) pour une excellente assistance technique avec des expériences de microscopie. Gregory Blass est reconnu pour la relecture critique du manuscrit. Cette recherche a été financée par les Instituts nationaux de la santé HL108880 de subvention et American Diabetes Association accorder 1-15-BS-172 (AS), et Ben J. Lipps bourse de recherche de l'American Society of Nephrology (DVI).
matériels
| Name | Company | Catalog Number | Comments |
| Fluo4 AM | Life Technologies | F14217 | 500 µl in DMSO |
| FuraRed AM | Life Technologies | F-3020 | |
| Poly-ʟ-lysine | Sigma-Aldrich | P4707 | |
| Pluronic acid | Sigma-Aldrich | F-68 | solution |
| Ionomycin | Sigma-Aldrich | I3909-1ML | |
| Tube rotator | Miltenyi Biotec GmbH | 130-090-753 | Germany |
| Nikon confocal microscope (inverted) | Nikon | Nikon A1R | Laser exitation 488 nm. Emission filters 500-550 nm and 570-620 nm |
| Objective | Nikon | Plan Apo 60x/NA 1.4 Oil | |
| Cover Glass | Thermo Scientific | 6661B52 | |
| High vacuum grease | Dow Corning | Silicone Compound | |
| Software | Nikon | Nikon NIS-Elements | |
| Recording/perfusion chamber | Warner Instruments | RC-26 | |
| Patch clamp amplifier | Molecular Devices | MultiClamp 700B | |
| Data acquisition system | Molecular Devices | Digidata 1440A | Axon Digidata® System |
| Low pass filter | Warner Instruments | LPF-8 | 8 pole Bessel |
| Borosilicate glass capillaries | World Precision Instruments | 1B150F-4 | |
| Micropipette puller | Sutter Instrument Co | P-97 | Flaming/Brown type micropipette puller |
| Microforge | Narishige | MF-830 | Japan |
| Motorized micromanipulator | Sutter Instrument Co | MP-225 | |
| Inverted microscope | Nikon | Eclipse Ti | |
| Microvibration isolation table | TMC | equipped with Faraday cage | |
| Multichannel valve perfusion system | AutoMake Scientific | Valve Bank II | |
| Recording/perfusion chamber | Warner Instruments | RC-26 | |
| Software | Molecular Devices | pClamp 10.2 | |
| Nicardipine | Sigma-Aldrich | N7510 | |
| Iberiotoxin | Sigma | I5904-5UG | |
| Niflumic acid | Sigma-Aldrich | N0630 | |
| DIDS | Sigma-Aldrich | D3514-25MG | |
| TEA chloride | Tocris | T2265 | |
| RPMI 1640 | Life Technologies | 11835030 | without antibiotics |
| BSA | Sigma-Aldrich | A8327 | 30% albumin solution |
| Temperature controlled surgical table | MCW core | for rodents | |
| Steel sieves: | #100 (150 μm), 140 (106 μm) | ||
| Gilson, Inc SIEVE 3 SS FH NO200 | Fisher Sci | 50-871-316 | |
| Gilson, Inc SIEVE 3 SS FH NO270 | Fisher Sci | 50-871-318 | |
| Gilson, Inc SIEVE 3 SS FH NO400 | Fisher Sci | 50-871-320 | |
| mesh 200 | Sigma-Aldrich | s4145 | screen for CD-1 |
| Binocular microscope | Nikon | Eclipse TS100 | |
| Binocular microscope | Nikon | SMZ745 | |
| Syringe pump-based perfusion system | Harvard Apparatus | ||
| Polyethylene tubing | Sigma-Aldrich | PE50 | |
| Isofluorane anesthesia |  VetEquip, Inc. VetEquip, Inc. | 911103 | |
| Other basic reagents | Sigma-Aldrich |
Références
- Machuca, E., Benoit, G., Antignac, C. Genetics of nephrotic syndrome: connecting molecular genetics to podocyte physiology. Hum. Mol. Genet. 18, R185-R194 (2009).
- Haraldsson, B., Nystrom, J., Deen, W. M. Properties of the glomerular barrier and mechanisms of proteinuria. Physiol. Rev. 88, 451-487 (2008).
- Patrakka, J., Tryggvason, K. New insights into the role of podocytes in proteinuria. Nat. Rev. Nephrol. 5, 463-468 (2009).
- Savin, V. J., Sharma, R., Lovell, H. B., Welling, D. J. Measurement of albumin reflection coefficient with isolated rat glomeruli. J. Am. Soc. Nephrol. 3, 1260-1269 (1992).
- Gloy, J., et al. Angiotensin II depolarizes podocytes in the intact glomerulus of the Rat. J. Clin. Invest. 99, 2772-2781 (1997).
- Nitschke, R., et al. Angiotensin II increases the intracellular calcium activity in podocytes of the intact glomerulus. Kidney Int. 57, 41-49 (2000).
- Ilatovskaya, D., Staruschenko, A. Single-channel analysis of TRPC channels in the podocytes of freshly isolated glomeruli. Methods Mol Biol. 998, 355-369 (2013).
- Snitsarev, V. A., McNulty, T. J., Taylor, C. W. Endogenous heavy metal ions perturb fura-2 measurements of basal and hormone-evoked Ca2+ signals. Biophys. J. 71, 1048-1056 (1996).
- Fukuda, A., Fujimoto, S., Iwatsubo, S., Kawachi, H., Kitamura, K. Effects of mineralocorticoid and angiotensin II receptor blockers on proteinuria and glomerular podocyte protein expression in a model of minimal change nephrotic syndrome. Nephrology (Carlton). 15, 321-326 (2010).
- Abramowitz, J., Birnbaumer, L. Physiology and pathophysiology of canonical transient receptor potential channels). FASEB J. 23, 297-328 (2009).
- Heeringa, S. F., et al. A novel TRPC6 mutation that causes childhood FSGS. PLoS ONE. 4, e7771 (2009).
- Zhang, X., Song, Z., Guo, Y., Zhou, M. The novel role of TRPC6 in vitamin D ameliorating podocyte injury in STZ-induced diabetic rats. Mol. Cell. Biochem. 399, 155-165 (2015).
- Bohrer, M. P., et al. Mechanisms of the puromycin-induced defects in the transglomerular passage of water and macromolecules. J. Clin. Invest. 60, 152-161 (1977).
- Olson, J. L., Rennke, H. G., Venkatachalam, M. A. Alterations in the charge and size selectivity barrier of the glomerular filter in aminonucleoside nephrosis in rats. Lab. Invest. 44, 271-279 (1981).
- Schiessl, I. M., Castrop, H. Angiotensin II AT2 receptor activation attenuates AT1 receptor-induced increases in the glomerular filtration of albumin: a multiphoton microscopy study. Am J Physiol Renal Physiol. 305, F1189-F1200 (2013).
- Ilatovskaya, D. V., Levchenko, V., Ryan, R. P., Cowley, A. W., Staruschenko, A. NSAIDs acutely inhibit TRPC channels in freshly isolated rat glomeruli. Biochem. Biophys. Res. Commun. 408, 242-247 (2011).
- Peti-Peterdi, J. Calcium wave of tubuloglomerular feedback. Am. J. Physiol. Renal Physiol. 291, F473-F480 (2006).
- Peti-Peterdi, J., Warnock, D. G., Bell, P. D. Angiotensin II directly stimulates ENaC activity in the cortical collecting duct via AT(1) receptors. J. Am. Soc. Nephrol. 13, 1131-1135 (2002).
- Ilatovskaya, D. V., Palygin, O., Levchenko, V., Staruschenko, A. Pharmacological characterization of the P2 receptors profile in the podocytes of the freshly isolated rat glomeruli. Am. J. Physiol. Cell Physiol. 305, C1050-C1059 (2013).
- Ilatovskaya, D. V., et al. Angiotensin II has acute effects on TRPC6 channels in podocytes of freshly isolated glomeruli. Kidney Int. 305, C1050-C1059 (2014).
- Schaldecker, T., et al. Inhibition of the TRPC5 ion channel protects the kidney filter. J. Clin. Invest. 123, 5298-5309 (2013).
- Roshanravan, H., Dryer, S. E. ATP acting through P2Y receptors causes activation of podocyte TRPC6 channels: role of podocin and reactive oxygen species. Am. J. Physiol. Renal Physiol. 306, F1088-F1097 (2014).
- Anderson, M., Roshanravan, H., Khine, J., Dryer, S. E. Angiotensin II activation of TRPC6 channels in rat podocytes requires generation of reactive oxygen species. J. Cell. Physiol. 229, 434-442 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon