このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
新たに単離した糸球体の足細胞における単一チャネル分析とカルシウムイメージング
要約
Changes in the intracellular calcium levels in the podocytes are one of the most important means to control the filtration function of glomeruli. Here we explain a high-throughput approach that allows detection of real-time calcium handling and single ion channels activity in the podocytes of the freshly isolated glomeruli.
要約
Podocytes (renal glomerular epithelial cells) are known to regulate glomerular permeability and maintain glomerular structure; a key role for these cells in the pathogenesis of various renal diseases has been established since podocyte injury leads to proteinuria and foot process effacement. It was previously reported that various endogenous agents may cause a dramatic overload in intracellular Ca2+ concentration in podocytes, presumably leading to albuminuria, and this likely occurs via calcium-conducting ion channels. Therefore, it appeared important to study calcium handling in the podocytes both under normal conditions and in various pathological states. However, available experimental approaches have remained somewhat limited to cultured and transfected cells. Although they represent a good basic model for such studies, they are essentially extracted from the native environment of the glomerulus. Here we describe the methodology of studying podocytes as a part of the freshly isolated whole glomerulus. This preparation retains the functional potential of the podocytes, which are still attached to the capillaries; therefore, podocytes remain in the environment that conserves the major parts of the glomeruli filtration apparatus. The present manuscript elaborates on two experimental approaches that allow 1) real-time detection of calcium concentration changes with the help of ratiometric confocal fluorescence microscopy, and 2) the recording of the single ion channels activity in the podocytes of the freshly isolated glomeruli. These methodologies utilize the advantages of the native environment of the glomerulus that enable researchers to resolve acute changes in the intracellular calcium handling in response to applications of various agents, measure basal concentration of calcium within the cells (for instance, to evaluate disease progression), and assess and manipulate calcium conductance at the level of single ion channels.
概要
腎臓は、様々な物質のための恒常性バランスを維持し、総血圧を決定するようにして血液量を調節します。ハイパーまたは低血圧に至るまでに腎臓濾過、再吸収や分泌リードの障害または付随する病理学的状態は、最終的に腎臓移植を必要とする末期腎疾患を終了します。毛細血管内皮、基底膜および上皮細胞の単電池層- -スリットダイアフラムの完全性と機能1の維持に重要な役割を果たし足細胞、腎フィルタリング部(糸球体)は、3つの層からなります。選択透過性糸球体フィルタにおける機能不全は、蛋白尿などの巨大分子の尿損失の原因となります。種々の薬剤は、糸球体濾過障壁の完全性を決定し、それらの足細胞足突起の構造に影響を及ぼし得ます。
足細胞は、逮捕されるの維持に関与していますeruli濾過機能。これは、足細胞による不適切なカルシウム処理は、細胞損傷につながり、腎2,3の様々な形の進行に重要な役割を果たしていることが確立されています。したがって、細胞内カルシウム濃度の変化の直接測定を可能にするモデルの開発は、足細胞の機能の研究のための手段になります。単離された糸球体は、以前アルブミン反射係数の測定4および全細胞電気生理学的パッチクランプ測定5,6の積分携帯電流の評価を変更するなど、多くの研究で使用しました。本論文では、研究者は、薬剤の用途に応じて、細胞内カルシウム濃度の変化を測定し、細胞内カルシウムの基礎レベルを推定し、個々のカルシウムチャネルの活性を評価することを可能にするプロトコルを記述します。 Ratometricカルシウム濃度の測定値とパッチクランプelectrophysiologyはそれぞれ、足細胞及びチャネル内の活性細胞内カルシウム濃度の変化を決定するために使用しました。
プロトコル
動物の使用と福祉制度動物実験委員会(IACUC)によってレビューされ、承認されたプロトコル以下の実験動物の管理と使用に関するNIHガイドに付着する必要があります。
1.腎臓フラッシュ
- (ただし、異なる年齢や性別の他の株を適切に変更して使用することができ、スプラーグドーリー株である示唆)8から12週齢の雄ラットを使用してください。
- IACUCプロトコルによって許可された手順に従って、動物を麻酔。麻酔深度を監視し、動物を検査します。手術の詳細な説明は、1.3で実行される- 1.8 Ilatovskaya らに記載されています7。
- 適切な麻酔の後、(長さ3インチまで)、腹部の正中切開を行い、温度制御手術台の上に動物を置き、大静脈と大動脈を発見。
- 腹腔と腸間膜動脈と腹部周りに結紮糸を挿入これらの上記の大動脈。連結しないでください。
- 腎動脈下の腹部大動脈を分析し、その周りに2合字を配置したが、合字の上に大動脈をクランプし、下糸を結ぶその後、連結していない鈍いです。
- クランプ以下(PBSを充填したシリンジポンプに取り付けられた)ポリエチレンPE50チューブを大動脈カテーテルを挿入し、第二の結紮糸でカテーテルを固定します。 、クランプを取り外し、ポンプをオンにし、腹腔動脈と大動脈および腸間膜を連結。すぐに圧力を緩和するために、腎静脈に切開します。
- /分6ミリリットルの速度で、2または3分間予備冷却PBSで大動脈を注入。
- 灌流、消費税を停止し、7腎臓をデカプセル化し、PBS溶液中に氷の上に置きます。 IACUCによって承認されたプロトコルに従って、動物を安楽死させます。
ラット糸球体の2の単離
- RPMI 1640中の5%BSAの新鮮な溶液30mlを準備します。
- カミソリの刃やはさみを使用して、両方の腎臓の皮質を単離し、その後、均一になるまでミンチ。この手順は、以前に記載されている7。
- スパチュラを用いて(5%BSA / RPMI溶液に予備浸漬)100メッシュのステンレス鋼篩を通して、前のステップの間に細分化した組織を押してください。フロースルー及び重力によって収集し、フロースルーを140メッシュのふるいを通過することを可能にします。
- 、フロースルー予め浸漬200メッシュの篩を用いて、140メッシュのふるいから収集をフィルタろ液を捨て、そして10でふるいの上部を洗っ - で沈降糸球体を収集するために準備されたBSA / RPMI溶液15mlふるいです。
- 最大20分間、チューブの底に糸球体の堆積物を15mlチューブに氷の上で糸球体を含むBSA / RPMI液を入れてみましょう。チューブの底に糸球体の濃縮が明らかに見られます。チューブ内の約2ミリリットルを残し、余分な溶液を除去します。
3.シングルチャネルパッチクランプエルectrophysiology
- MW7万でそれらをコーティングすることにより、5×5ミリメートルのカバーガラスチップを準備 - 15万ポリʟリジン、および乾燥させてください。カバーガラスあたりの水に0.01%の滅菌濾過した溶液を約30μLを使用してください。
- RTへの実験的なソリューションをウォームアップし、パッチクランプ室とピペットを埋めます。 TRPCチャネルの監視の場合、mMの中で、浴溶液を使用します。126のNaCl、1のCaCl 2、10 HEPES、2のMgCl 2、10グルコース、pHが7.4;ピペット:126のNaCl、1.5のCaCl 2、10 HEPES、10グルコース; pHは7.4。
- 阻害すること(10mMのTEA、チャンネル) - 100μMのCaを遮断するニフルム酸またはDIDS(2+活性化Clで:推奨される(内因性チャネルの活性をブロックするためにピペット溶液に阻害剤を追加し、研究に関連されていません大コンダクタンスの Ca 2+ -依存性K +チャネル )、10 nmのイベリオトキシン(のCa 2+活性化K +チャネルを遮断するために)、10μMのニカルジピン(N型Caをブロックします直接パッチクランプ実験前2+チャネル))。
- 静かに糸球体を含む溶液を混合し、次いでポリʟリジンコートカバーガラスチップに約50μLを適用します。糸球体は、約5分間添付してみましょう。
- 浴溶液で予め充填されたパッチクランプ室に糸球体のガラスチップを移動します。付着していない糸球体の除去を確実にするために1分間、3ml /分の速度で室を灌流。
- セル接続モード7で、従来のパッチクランプ実験を行います。ガラスピペットを用いて(7から10MΩピペット抵抗)に、単離された糸球体の足細胞表面上に取り付けられたピペットは、 図2に示されている(穏やかな吸引を適用することにより、ピペットと足細胞膜との間に高抵抗シールを形成左)。
- セル付測定のために、8極ベッセルフィルタにより300 Hzの電流を低域通過。
- U6時間 - SEは最大4のパッチクランプ実験で糸球体を単離しました。氷の上で在庫糸球体の割合を保ちます。
足細胞の細胞内カルシウム濃度の4レシオメトリック共焦点蛍光測定
- コニカルチューブ0.5mlの(2.5で説明した)糸球体画分の500μLを置き、カルシウム色素のFuraレッド、AMとのFluo-4、AMを追加します。 2 mMのと(DMSOに溶解し、-20℃で保存)のFuraレッド、AMとのFluo-4、AM、それぞれの1 mMストック濃度を使用し、糸球体画分の500μlの各色素の2.5μLを使用します。直ちに染料の添加後、アルミニウムホイルでチューブを覆います。
- RTで1時間に少なくとも20分までのための回転シェーカー上に置いチューブ。
注:薬理学的薬剤は、この工程の間に加えることができます。 - 、カバーガラスを準備するポリʟリジンでそれらをカバーし、70℃に加熱されたプレートのセットを使用して乾燥を可能にします。
- カルシウム色素のロードはのcompletたらeは、ポリʟリジンコートカバースリップの解決策を含む糸球体の100μLを適用し、それらを約5分間、表面に固執しましょう。撮影室に糸球体付きカバースリップをマウントし、((さ)mmで含む:145のNaCl、4.5のKCl、2のMgCl 2、10 HEPES、pHは7.35)浴溶液で灌流除去するために3ミリリットル/分の速度で付着していない糸球体、残りの染料。
- 488 nmの励起波長および発光フィルタ(それぞれのFluo-4及びフラ赤25分の525と25分の650ナノメートル)の共焦点レーザー走査顕微鏡を設定します。所望の周波数と解像度にイメージングソフトウェアを設定します。
- 明視野で糸球体を検索し、その後、蛍光シグナルの検出をオンにします。信号の飽和を回避するために、各色素のためのレーザーの強さを調整します。直接ガラスに取り付けられている足細胞で焦点面を選択します。これは、薬物に応じて糸球体の収縮による影響を最小限に抑えますアプリケーション。希望の糸球体はよくガラスに接続されていることをダブルチェックしてください。
- 、選択の焦点面を撮像開始(高速のCa 2+過渡変化を可視化するために4秒に設定された周波数で512×512の画像を取る。高解像度画像のための60X / NA 1.4または類似の対物レンズを使用して)、関心のある薬物を適用および応答を記録します。
- (糸球体の表面に足細胞のイメージングを確保するため、可能な限りガラスの表面に近い)は、所望の焦点面を選択します。 FLUO4とFuraRedチャネル上の蛍光の強度を確認し、糸球体は明らかに明視野で見ていることを確認してください。
- 撮影を開始します。いずれかの薬剤の適用前に、レコードベースライン蛍光の少なくとも1分信号が安定していることを確認するために、(そこには突然のスパイクがされていないか、信号のフェージング)。
- マイクロピペットの助けを借りて、所望の薬を適用します。注意して、薬剤がよく拡散し、glomerに到達することができました確認してくださいウルス。必要に応じて静かに浴溶液を混合し、選択された焦点面を監視し、それがために薬物適用の焦点の外に移動しなかったことを確認してください。
- FLUO4とFuraRed信号用の蛍光強度の変化を記録します。記録信号がプラトーレベルに達するか、ピークに達し、その後ベースラインに戻るまで待機することにより、十分な長さであることを確認してください。必要に応じて任意の他の薬剤の溶液の変更や追加を行います。
- 記録を停止し、ソフトウェアのネイティブ形式でファイルを保存します。
カルシウム測定5.画像解析
- ネイティブND2形式で画像をインポートすることができNDユーティリティのプラグインを搭載したImageJのオープンソフトウェアで画像解析を実行します。
- イメージシーケンスをインポートします。チャンネルを分割し、hyperstackのグレースケールモードを使用するようにしてください。
- OへのImageJソフトウェアで分析→ツール→ROIマネージャパスに従ってくださいペンROIマネージャウィンドウ。 ROI Managerの楕円形選択ツール、「追加(T)」関数を使用して、興味のあるいくつかの領域(足細胞)を選択します。最後のROIとしては、バックグラウンドでエリアを選択します。 (保存→詳細)選択したROIを保存します。
- 分析のために選択されたチャンネルを含むウィンドウを強調表示します。 、ROI Managerでマルチ測定機能→詳細を使用して飛び出すの対話で「1行あたりのスライス」のボックスに印を付け、[OK]をクリックします。結果は結果ウィンドウで設定可能な形式で表示されます。→設定測定メニューオプションの結果に入り、「グレー値の平均」と各ROIのための画素強度値を計算選択し、で表示されます各ROIのための別々の列に結果ウィンドウ。
- 好適なデータ解析ソフトウェアに各チャネルの測定されたROIの輝度値(のFluo-4とのFuraレッド)をコピーします。各DATからのバックグラウンド強度値を減算しますポイント。
- 各時点でのFuraレッドチャネルへのFluo-4の強度の比を計算します。各ROIのためのCa 2+トランジェントのプロット散布/ラインポイント時間の変更。選択された糸球体の平均/ SE値を計算します。
注:時間列は4.5で選択した撮影頻度に応じて設定する必要があります。
フルオ4蛍光シグナルを使用した6細胞内カルシウム濃度の計算
- 糸球体のサンプルを取り、4.7のステップに実験プロトコルを実行します。バックグラウンド蛍光を記録した後に浴溶液に、レコード蛍光強度の増加(10μMであるべき浴室中の最終濃度)イオノマイシンを加えます。強度が最大に達し、崩壊が始まると、蛍光8をクエンチする(最終濃度が5 mMのでなければならない)のMnCl 2を追加します。
- 6.1で得られたデータを分析します。従っのFluo-4 ROI信号強度値が得られるコピー好適な解析ソフトウェアによって5.1から5.5に記載されているプロトコルに。
- 式を使用して、ROIに対応する足細胞で(NMで)細胞内カルシウム濃度を計算します。
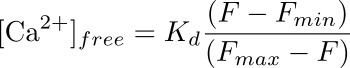
K dはフルオ4(345 nM)をするための一定の予め決め解離であり、Fは、あなたが(ベースライン)のためのカルシウム濃度を計算している時点での強度であり、F min及びF maxはでの強度値であり、 (イオノマイシン適用後)と(のMnCl 2を有する)蛍光の消光後の最大カルシウム負荷の点、それぞれ( 図3参照 )。
結果
ここでは、足細胞内カルシウム濃度の急激な変化を測定するという問題に取り組んだ。 図1は、新しくの足細胞での高解像度ライブ蛍光共焦点イメージングおよび単一のイオンチャネル活性の記録を行うために設計された実験プロトコルの概略図を示します分離されたげっ歯類糸球体。ラットを麻酔した後に簡単に説明すると、腎臓は血液のそれらをクリアするためにPBSでフラッ...
ディスカッション
ここで説明する手法は、げっ歯類の糸球体の足細胞によるカルシウム処理の分析を可能にします。この技術は、パッチクランプ単一チャンネル電気生理学、蛍光レシオメトリック共焦点イメージングの適用を可能にします。しかしながら、両方のアプローチは、それ自体で、別々に使用することができます。提案されたプロトコルは、1)腎フラッシュなど、いくつかの比較的単純なステップ...
開示事項
著者らは、開示することは何もありません。
謝辞
著者らは、顕微鏡実験で優れた技術支援のためにグレン·スローカム(ウィスコンシン医科大学)とコリーンA.ラビン(ニコンインスツルメンツ社)を感謝したいと思います。グレゴリー·ブラスは、原稿の重要な校正のために認められています。この研究は、(DVIに)米国腎臓学会から(ASに)1-15-BS-172を付与し、ベン·J·リップス研究員国立衛生研究所の助成金HL108880と米国糖尿病協会によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| Fluo4 AM | Life Technologies | F14217 | 500 µl in DMSO |
| FuraRed AM | Life Technologies | F-3020 | |
| Poly-ʟ-lysine | Sigma-Aldrich | P4707 | |
| Pluronic acid | Sigma-Aldrich | F-68 | solution |
| Ionomycin | Sigma-Aldrich | I3909-1ML | |
| Tube rotator | Miltenyi Biotec GmbH | 130-090-753 | Germany |
| Nikon confocal microscope (inverted) | Nikon | Nikon A1R | Laser exitation 488 nm. Emission filters 500-550 nm and 570-620 nm |
| Objective | Nikon | Plan Apo 60x/NA 1.4 Oil | |
| Cover Glass | Thermo Scientific | 6661B52 | |
| High vacuum grease | Dow Corning | Silicone Compound | |
| Software | Nikon | Nikon NIS-Elements | |
| Recording/perfusion chamber | Warner Instruments | RC-26 | |
| Patch clamp amplifier | Molecular Devices | MultiClamp 700B | |
| Data acquisition system | Molecular Devices | Digidata 1440A | Axon Digidata® System |
| Low pass filter | Warner Instruments | LPF-8 | 8 pole Bessel |
| Borosilicate glass capillaries | World Precision Instruments | 1B150F-4 | |
| Micropipette puller | Sutter Instrument Co | P-97 | Flaming/Brown type micropipette puller |
| Microforge | Narishige | MF-830 | Japan |
| Motorized micromanipulator | Sutter Instrument Co | MP-225 | |
| Inverted microscope | Nikon | Eclipse Ti | |
| Microvibration isolation table | TMC | equipped with Faraday cage | |
| Multichannel valve perfusion system | AutoMake Scientific | Valve Bank II | |
| Recording/perfusion chamber | Warner Instruments | RC-26 | |
| Software | Molecular Devices | pClamp 10.2 | |
| Nicardipine | Sigma-Aldrich | N7510 | |
| Iberiotoxin | Sigma | I5904-5UG | |
| Niflumic acid | Sigma-Aldrich | N0630 | |
| DIDS | Sigma-Aldrich | D3514-25MG | |
| TEA chloride | Tocris | T2265 | |
| RPMI 1640 | Life Technologies | 11835030 | without antibiotics |
| BSA | Sigma-Aldrich | A8327 | 30% albumin solution |
| Temperature controlled surgical table | MCW core | for rodents | |
| Steel sieves: | #100 (150 μm), 140 (106 μm) | ||
| Gilson, Inc SIEVE 3 SS FH NO200 | Fisher Sci | 50-871-316 | |
| Gilson, Inc SIEVE 3 SS FH NO270 | Fisher Sci | 50-871-318 | |
| Gilson, Inc SIEVE 3 SS FH NO400 | Fisher Sci | 50-871-320 | |
| mesh 200 | Sigma-Aldrich | s4145 | screen for CD-1 |
| Binocular microscope | Nikon | Eclipse TS100 | |
| Binocular microscope | Nikon | SMZ745 | |
| Syringe pump-based perfusion system | Harvard Apparatus | ||
| Polyethylene tubing | Sigma-Aldrich | PE50 | |
| Isofluorane anesthesia |  VetEquip, Inc. VetEquip, Inc. | 911103 | |
| Other basic reagents | Sigma-Aldrich |
参考文献
- Machuca, E., Benoit, G., Antignac, C. Genetics of nephrotic syndrome: connecting molecular genetics to podocyte physiology. Hum. Mol. Genet. 18, R185-R194 (2009).
- Haraldsson, B., Nystrom, J., Deen, W. M. Properties of the glomerular barrier and mechanisms of proteinuria. Physiol. Rev. 88, 451-487 (2008).
- Patrakka, J., Tryggvason, K. New insights into the role of podocytes in proteinuria. Nat. Rev. Nephrol. 5, 463-468 (2009).
- Savin, V. J., Sharma, R., Lovell, H. B., Welling, D. J. Measurement of albumin reflection coefficient with isolated rat glomeruli. J. Am. Soc. Nephrol. 3, 1260-1269 (1992).
- Gloy, J., et al. Angiotensin II depolarizes podocytes in the intact glomerulus of the Rat. J. Clin. Invest. 99, 2772-2781 (1997).
- Nitschke, R., et al. Angiotensin II increases the intracellular calcium activity in podocytes of the intact glomerulus. Kidney Int. 57, 41-49 (2000).
- Ilatovskaya, D., Staruschenko, A. Single-channel analysis of TRPC channels in the podocytes of freshly isolated glomeruli. Methods Mol Biol. 998, 355-369 (2013).
- Snitsarev, V. A., McNulty, T. J., Taylor, C. W. Endogenous heavy metal ions perturb fura-2 measurements of basal and hormone-evoked Ca2+ signals. Biophys. J. 71, 1048-1056 (1996).
- Fukuda, A., Fujimoto, S., Iwatsubo, S., Kawachi, H., Kitamura, K. Effects of mineralocorticoid and angiotensin II receptor blockers on proteinuria and glomerular podocyte protein expression in a model of minimal change nephrotic syndrome. Nephrology (Carlton). 15, 321-326 (2010).
- Abramowitz, J., Birnbaumer, L. Physiology and pathophysiology of canonical transient receptor potential channels). FASEB J. 23, 297-328 (2009).
- Heeringa, S. F., et al. A novel TRPC6 mutation that causes childhood FSGS. PLoS ONE. 4, e7771 (2009).
- Zhang, X., Song, Z., Guo, Y., Zhou, M. The novel role of TRPC6 in vitamin D ameliorating podocyte injury in STZ-induced diabetic rats. Mol. Cell. Biochem. 399, 155-165 (2015).
- Bohrer, M. P., et al. Mechanisms of the puromycin-induced defects in the transglomerular passage of water and macromolecules. J. Clin. Invest. 60, 152-161 (1977).
- Olson, J. L., Rennke, H. G., Venkatachalam, M. A. Alterations in the charge and size selectivity barrier of the glomerular filter in aminonucleoside nephrosis in rats. Lab. Invest. 44, 271-279 (1981).
- Schiessl, I. M., Castrop, H. Angiotensin II AT2 receptor activation attenuates AT1 receptor-induced increases in the glomerular filtration of albumin: a multiphoton microscopy study. Am J Physiol Renal Physiol. 305, F1189-F1200 (2013).
- Ilatovskaya, D. V., Levchenko, V., Ryan, R. P., Cowley, A. W., Staruschenko, A. NSAIDs acutely inhibit TRPC channels in freshly isolated rat glomeruli. Biochem. Biophys. Res. Commun. 408, 242-247 (2011).
- Peti-Peterdi, J. Calcium wave of tubuloglomerular feedback. Am. J. Physiol. Renal Physiol. 291, F473-F480 (2006).
- Peti-Peterdi, J., Warnock, D. G., Bell, P. D. Angiotensin II directly stimulates ENaC activity in the cortical collecting duct via AT(1) receptors. J. Am. Soc. Nephrol. 13, 1131-1135 (2002).
- Ilatovskaya, D. V., Palygin, O., Levchenko, V., Staruschenko, A. Pharmacological characterization of the P2 receptors profile in the podocytes of the freshly isolated rat glomeruli. Am. J. Physiol. Cell Physiol. 305, C1050-C1059 (2013).
- Ilatovskaya, D. V., et al. Angiotensin II has acute effects on TRPC6 channels in podocytes of freshly isolated glomeruli. Kidney Int. 305, C1050-C1059 (2014).
- Schaldecker, T., et al. Inhibition of the TRPC5 ion channel protects the kidney filter. J. Clin. Invest. 123, 5298-5309 (2013).
- Roshanravan, H., Dryer, S. E. ATP acting through P2Y receptors causes activation of podocyte TRPC6 channels: role of podocin and reactive oxygen species. Am. J. Physiol. Renal Physiol. 306, F1088-F1097 (2014).
- Anderson, M., Roshanravan, H., Khine, J., Dryer, S. E. Angiotensin II activation of TRPC6 channels in rat podocytes requires generation of reactive oxygen species. J. Cell. Physiol. 229, 434-442 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved