JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
갓 격리 된 사구체 족 세포의 단일 채널 분석 및 칼슘 이미징
요약
Changes in the intracellular calcium levels in the podocytes are one of the most important means to control the filtration function of glomeruli. Here we explain a high-throughput approach that allows detection of real-time calcium handling and single ion channels activity in the podocytes of the freshly isolated glomeruli.
초록
Podocytes (renal glomerular epithelial cells) are known to regulate glomerular permeability and maintain glomerular structure; a key role for these cells in the pathogenesis of various renal diseases has been established since podocyte injury leads to proteinuria and foot process effacement. It was previously reported that various endogenous agents may cause a dramatic overload in intracellular Ca2+ concentration in podocytes, presumably leading to albuminuria, and this likely occurs via calcium-conducting ion channels. Therefore, it appeared important to study calcium handling in the podocytes both under normal conditions and in various pathological states. However, available experimental approaches have remained somewhat limited to cultured and transfected cells. Although they represent a good basic model for such studies, they are essentially extracted from the native environment of the glomerulus. Here we describe the methodology of studying podocytes as a part of the freshly isolated whole glomerulus. This preparation retains the functional potential of the podocytes, which are still attached to the capillaries; therefore, podocytes remain in the environment that conserves the major parts of the glomeruli filtration apparatus. The present manuscript elaborates on two experimental approaches that allow 1) real-time detection of calcium concentration changes with the help of ratiometric confocal fluorescence microscopy, and 2) the recording of the single ion channels activity in the podocytes of the freshly isolated glomeruli. These methodologies utilize the advantages of the native environment of the glomerulus that enable researchers to resolve acute changes in the intracellular calcium handling in response to applications of various agents, measure basal concentration of calcium within the cells (for instance, to evaluate disease progression), and assess and manipulate calcium conductance at the level of single ion channels.
서문
신장은 다양한 물질에 대한 항상성 균형을 유지하고 전체의 혈압을 결정하는 방식으로 혈액량을 조절한다. 하이퍼 또는 저혈압에 이르기까지의 신장의 여과, 재 흡수 또는 분비 리드의 장애 또는 동반 병적 인 상태는, 결국 신장 이식을 필요로 무대 신장 질환을 종료합니다. 모세 혈관 내피, 기저막 및 상피 세포의 단세포 층 - - 슬릿 다이어프램 무결성 및 기능 (1)의 유지에 중요한 역할을 족 세포, 신장 필터링 부 (사구체)은 3 개의 층으로 이루어져있다. 투과성 사구체 필터 부전은 단백뇨와 같은 거대 분자의 소변 손실이 발생합니다. 각종 제제는 사구체 여과 장벽의 완전성을 결정 족 세포 및 그들의 발 프로세스의 구조에 영향을 미칠 수있다.
족 세포는 glom의 유지에 관여eruli 여과 기능. 이는 발 세포 부적절한 칼슘 처리가 세포 손상에 이르게하고 병증 2,3- 다양한 형태의 진행에 중요한 역할을하는 것으로 확립되어있다. 따라서, 발 세포의 기능 연구를위한 수단이 될 것입니다 세포 내 칼슘 농도의 변화를 직접 측정 가능하게하는 모델의 개발. 격리 사구체 이전 알부민 반사 계수의 측정 (4) 및 전체 셀 전기 생리 패치 - 클램프 측정 5,6-에서 적분 셀룰러 전류의 평가를 변경 포함한 수많은 연구에 사용 하였다. 본 논문에서는, 약학 제제의 적용에 응답하여 세포 내 칼슘 농도의 변화를 측정하는 세포 내 칼슘의 기저 레벨을 추정하고, 개별 칼슘 채널의 활성을 평가하기 위해 연구를 허용하는 프로토콜을 기술한다. Ratometric 칼슘 농도 측정 및 패치 클램프 electrophysiology 각각 발 세포 및 채널 활동 내에서 세포 내 칼슘 농도의 변화를 결정하는데 사용 하였다.
프로토콜
동물 사용 및 복지 기관 동물 관리 및 사용위원회 (IACUC)에 의해 검토 및 승인 프로토콜 다음과 같은 실험 동물의 관리 및 사용에 대한 NIH 가이드를 준수해야합니다.
1. 신장 세척
- (그러나 다른 연령과 성별의 다른 균주에 따라 변경 사용할 수 있습니다, 스프 라그 돌리 변형이 제안) 8-12주 세 남성 쥐를 사용합니다.
- IACUC 프로토콜에 의해 허용 된 절차에 따라 동물을 마취; 마취 깊이를 모니터링하고 동물을 검사한다. 수술의 상세한 설명은 1.3에서 수행되는 - 1.8 Ilatovskaya 외에서 찾을 수있다 (7).
- 적절한 마취 후, 온도 조절 수술 테이블에 동물을 배치 (최대 길이 3 인치) 복부의 정중선 절개를하고, 대정맥과 대동맥을 발견.
- 복강 및 상 장간막 동맥과 복부 주위에 합자를 삽입그 위의 대동맥; 결찰하지 않습니다.
- 신장 동맥 아래 복부 대동맥을 해부하고, 주위에 두 개의 합자를 배치하지만, 결찰하지 않는 무딘, 다음 합자 위의 대동맥을 고정하고 밑실 넥타이.
- 클램프 아래 (PBS로 가득 주사기 펌프에 부착) 폴리에틸렌 PE50 튜브와 대동맥을 카테 테르를 꽂다 두 번째 합자와 카테터를 해결; 클램프를 제거 펌프를 켜고 대동맥을 결찰 및 복강 동맥과 장간막. 빠르게 압력을 완화하기 위해 신장 정맥 절개를합니다.
- / 분의 6 ml의 속도로 2 ~ 3 분 동안 프리 - 냉각 PBS로 대동맥 달이다.
- 관류, 소비세를 중지하고 7 신장을 디 캡슐하고, PBS 용액에 얼음에 넣어. IACUC에 의해 승인 된 프로토콜에 따라 동물을 안락사.
쥐 사구체 2. 분리
- RPMI 1640에서 5 % BSA의 신선한 용액 30 ㎖를 준비합니다.
- 면도날과 가위를 사용하여,모두 신장의 피질을 분리 한 다음 균일까지 말하다. 이 절차는 앞에서 설명 하였다 7.
- 100 메쉬 스테인레스 강 체를 통해 이전 단계 동안 다진 조직을 밀어 주걱을 사용하여 (BSA / RPMI 5 % 용액에 미리 침지). 관류 및 중력에 의해이 플로우 스루는 140 메쉬 체를 통과 할 수 있도록 수집.
- , 미리 적신 200 메쉬 체를 사용하여 체 140 메쉬로부터 수집 관류 필터 여과 액을 폐기하고 (10) 자체의 상단 세척 -에 침강 사구체를 수집하기 위해 제조 된 BSA / RPMI 용액 15 ml에 체.
- 최대 20 분 동안 튜브의 하단 사구체 침전물을 15ml의 튜브에 얼음 사구체 함유 BSA / RPMI 용액을 넣고하자. 튜브의 하단에있는 사구체 농축 명확하게 볼 수 있습니다. 튜브에 약 2 mL를 떠나, 초과 솔루션을 제거합니다.
3. 단일 채널 패치 클램프 엘ectrophysiology
- MW 70,000로 코팅하여 5 × 5mm 커버 유리 칩을 준비 - 150,000 폴리 ʟ 라이신, 건조 할 수 있습니다. 커버 유리 당 물에 0.01 % 멸균 여과 된 용액의 약 30 μl를 사용합니다.
- RT에 대한 실험 솔루션을 따뜻하게하고, 패치 클램프 챔버와 피펫을 입력합니다. TRPC 채널 모니터링의 경우, mM의에서 목욕 솔루션, 사용 : (126)의 NaCl, CaCl2를 1, 10 HEPES, 2의 MgCl 2, 10 포도당, 산도 7.4; 피펫 : (126)의 NaCl, CaCl2를 1.5, 10 HEPES, 10 포도당; pH가 7.4.
- 추천 연구 (관련이 없습니다 내생 채널의 활동을 차단하는 피펫 솔루션에 억제제를 추가 있습니다 : 100 μm의 니플 룸산 또는 DIDS이 (칼슘 부활 CL 차단 - 채널), 10 mM의 차 (을 억제하는 큰 컨덕턴스 칼슘 + - 의존적 K + 채널), 10 나노 iberiotoxin (,)를 10 μM 니 카르 디핀 칼슘 부활 K + 채널을 차단하는 (N 형 칼슘을 차단2+ 직접 패치 클램프 실험 전 채널)).
- 조심스럽게 사구체 함유 용액을 혼합 한 후 폴리 ʟ 라이신 코팅 커버 유리 칩에 약 50 μl를 적용합니다. 사구체는 약 5 분 동안 연결하자.
- 패치 - 클램프 챔버 욕 용액으로 미리 충전하는 사구체으로 유리 절삭 가루를 이동; 부착 사구체의 제거를 보장하기 위해 1 분 / mL의 3 분의 속도로 관류 챔버.
- 세포 부착 모드 7에서 기존의 패치 클램프 실험을 실시한다. 유리 피펫 (7 - 10 MΩ 피펫 저항) 피펫 부드러운 흡입 (고립 사구체의 표면에 발 세포 부착 피펫을 적용하여 발 세포 막 사이에 고 저항 시일을 형성하기에,도 2에 도시 왼쪽).
- 세포 부착 된 측정을 위해 팔 극 베셀 필터에 의해 300 Hz에서 전류를 낮은 패스.
- 유6 시간 - SE는 최대 4에 대한 패치 클램프 실험에서 사구체를 격리합니다. 얼음에 주식 사구체의 비율을 유지합니다.
족 세포에서 세포 내 칼슘 농도의 4 비례 공 초점 형광 측정
- 원뿔 튜브 0.5 ml의 (2.5에서 설명) 사구체 분획 500 μl를 넣고 칼슘 염료의 Fura 레드, AM 및 FLUO-4, 오전를 추가합니다. 2 mM의과 (DMSO에 용해 -20 ° C에서 저장,)은 Fura 레드, AM 및 FLUO-4, 오전, 각각의 1 mM의 재고 농도를 사용하여 사구체 분획 500 ㎕를 각 염료의 2.5 μl를 사용합니다. 즉시 염료 첨가 후 알루미늄 호일로 커버 튜브.
- 실온에서 1 시간에 적어도 20 분까지를위한 회전하는 통에 장소 튜브.
주 : 약리 제제는이 단계에서 첨가 될 수있다. - , 커버 글라스를 준비 폴리 ʟ 라이신로를 커버하고 70 ℃로 가열 플레이트 세트를 사용하여 건조 할 수 있습니다.
- 칼슘 염료 로딩 COMPLET되면E는, 폴리 리신 코팅 ʟ 커버 슬립을 함유 용액 사구체 100 μL를 적용하고 약 5 분 동안 표면에 충실하자. 촬상 챔버 내로 사구체 부착 된 커버를 장착하고 욕 용액 (() mm 단위 함유 :의 MgCl 2 (145)의 NaCl, 4.5 KCl을, 2, 10 HEPES, pH가 7.35)으로 관류 3 ㎖의 속도 / 분 제거 사구체 부착하고 나머지 염료.
- 488 nm의 여기 파장과 방출 필터 (각각 FLUO-4의 Fura 레드에 대한 25분의 525과 25분의 650 nm의)에 공 초점 레이저 주사 현미경을 설정합니다. 원하는 주파수와 해상도 이미징 소프트웨어를 설정합니다.
- 시야에서 사구체를 찾아 다음 형광 신호의 검출을 켭니다. 신호의 포화를 피하기 위해 각각의 염료에 대해 레이저의 강도를 조정한다. 직접 유리에 부착 된 족 세포에 초점면을 선택합니다. 이는 약물에 반응 사구체의 수축에 의한 영향을 최소화신청. 선택의 사구체가 아니라 유리에 연결되어 있는지 다시 확인;
- 선택의 초점면을 이미징 시작, (높은 해상도 이미지에 대한 60X / NA 1.4 또는 유사한 대물 렌즈를 사용합니다. 빠른 칼슘 과도 변화를 시각화하기 위해 4 초에서 설정 한 주파수로 512 X 512 이미지를 가지고) 관심의 약물을 적용 하고 응답을 기록합니다.
- (사구체 족 세포의 표면 상에 이미징을 보장하기 위해 가능한 한 유리 표면에 가까운) 원하는 초점면을 선택한다. Fluo4 및 FuraRed 채널에 형광의 강도를 확인하고, 사구체 분명히 시야에서 볼 수 있는지 확인하십시오.
- 영상을 시작합니다. 어떤 약물의 응용 프로그램을하기 전에, 기본 형광 기록 적어도 1 분은 신호가 (이 갑작스런 스파이크가 없거나 신호의 페이딩) 안정적인지 확인합니다.
- 마이크로 피펫의 도움으로 원하는 약물을 적용; 주의 및 약물이 잘 확산 할 수 있었다 확인하고 glomer에 도달ulus. 필요한 경우, 상기 선택된 초점면을 감시하고 있기 때문에 약물 애플리케이션의 초점이 이동되지 않았다는 것을 확인 부드럽게 욕 용액을 섞는다.
- Fluo4 및 FuraRed 신호에 대한 형광 강도의 변화를 기록한다. 녹음이 신호가 고원 수준에 도달 또는 피크에 도달 한 후베이스 라인으로 복귀 할 때까지 대기하여 충분히 긴 있는지 확인합니다. 필요한 경우 솔루션의 변경 또는 다른 약물의 추가를 수행합니다.
- 녹음을 중지하고 소프트웨어의 기본 형식으로 파일을 저장합니다.
칼슘 측정 5. 이미지 분석
- 기본 ND2 형식으로 이미지를 가져 오기 할 수 있습니다 ND 유틸리티 플러그인을 갖춘 ImageJ에 열려있는 소프트웨어와 이미지 분석을 수행합니다.
- 이미지 시퀀스를 가져옵니다; 채널을 분할하고 hyperstack 그레이 스케일 모드를 사용하십시오.
- O에 ImageJ에 소프트웨어의 분석 → 도구 → 투자 수익 (ROI) 관리자 경로를 따라펜 투자 수익 (ROI) 관리자 창. 타원형 선택 도구 및 투자 수익 (ROI) 관리자의 "추가 (T)"기능을 사용하여 관심 (족 세포)의 여러 지역을 선택합니다. ROI 마지막으로, 배경 영역을 선택; (저장 → 기타) 선택된 ROI를 저장합니다.
- 분석을 위해 선택된 채널을 포함하는 윈도우를 강조. , 투자 수익 (ROI) 관리자에서 멀티 측정 기능 → 이상을 사용 튀어 나올 대화에서 "하나의 행 조각 당"상자를 표시 한 다음 확인을 클릭합니다. 선택 집합 측정 → 메뉴 옵션의 결과에 입력 "회색 평균치"와 표시되는 각 ROI에 대한 화소 강도 값을 계산 : 결과는 결과 창에서 설정 될 수 형식으로 표시 될 각각의 투자 수익 (ROI)에 대한 별도의 컬럼에서 결과 창.
- 바람직한 데이터 분석 소프트웨어로 각 채널 (FLUO-4의 Fura 레드)에 대한 ROI 측정 강도 값을 복사; 각 DAT에서 빼기 배경 강도 값점.
- 각 시점의 Fura 들어 레드 채널 FLUO-4의 세기의 비율을 계산한다. 플롯 분산 / 각각의 투자 수익 (ROI)에 대한 칼슘 과도의 라인 포인트 - 시간 변경. 선택 사구체에 대한 평균 / SE 값을 계산합니다.
참고 : 시간 열은 4.5에서 선택한 영상 주파수에 따라 설정해야합니다.
FLUO-4 형광 신호를 이용하여 제 세포 내 칼슘 농도 계산
- 사구체의 샘플을 가지고 4.7 단계로 실험 프로토콜을 수행합니다. 배경 형광의 기록 후에 조 용액 및 기록 형광 강도 증가 (10 μM이어야 화장실 실내에 최종 농도) 이오 노마 이신을 추가한다. 강도가 최대에 도달하고 붕괴가 시작되면, MnCl 2 추가 8 형광을 켄칭 (최종 농도 5 mM의이어야).
- 6.1에서 얻어진 데이터를 분석한다. 수득 FLUO-4 ROI 신호 세기 값이있어서 복사선호하는 분석 소프트웨어에 의해 5.1-5.5에 설명 된 프로토콜.
- 수식을 이용하여 ROI에 대응 발 세포에서 (㎚)에서 세포 내 칼슘 농도를 계산한다 :
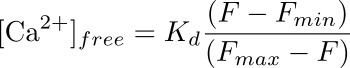
K d를 FLUO-4 (345 ㎚)에 대한 일정한 소정 해리이고, F는 (기준)에 대한 칼슘 농도를 산출하는 평가시기에서의 세기는이고, F 최소 및 F 최대의 강도 값이며 (이오 노마 이신 신청 후) 및 (MnCl 2) 형광의 담금질 후의 칼슘 최대 하중 점의 각각 (도 3 참조).
결과
여기에서는 족 세포에서 칼슘 농도 급성 변화를 측정하는 문제를 해결. 1 갓의 족 세포에서 고해상도 실시간 형광 공 초점 이미지 및 단일 이온 채널 활성 레코딩을 수행하기 위해 설계된 실험 프로토콜의 개략도를 나타낸다 고립 된 쥐 사구체. 쥐를 마취 한 후 간단히, 신장은 피를 취소 PBS로 플러시해야합니다. 그런 다음, 신장 절제와 디 캡슐화하고, 사구체는 차동 체질...
토론
여기에 설명 된 방법은 설치류 사구체의 족 세포에 의한 칼슘 처리의 분석을 위해 수 있습니다. 이 기술은 패치 클램프 단일 채널 전기 생리학 및 형광 비율 계량 공 초점 영상의 응용 프로그램을 할 수 있습니다. 그러나, 두 방식은 자신에, 별도로 사용할 수있다. 제안 된 프로토콜은 1) 신장 플러시 등 여러 상대적으로 간단한 단계를 가지고있다; 2) 차동 체질에 의한 사구체의 분리; 3) 패치 클램프...
공개
저자가 공개하는 게 없다.
감사의 말
저자는 현미경 실험과 우수한 기술 지원을 글렌 슬로 컴 (위스콘신 의과 대학)과 콜린 A. Lavin (니콘 인스트루먼트, Inc.에) 감사의 말씀을 전합니다. 그레고리 블라스는 원고의 중요한 교정을 인정한다. 이 연구는 (AS에) 1-15-BS-172 및 DVI (에) 신장의 미국 사회에서 벤 제이 Lipps 연구 활동을 부여 건강 보조금 HL108880 및 미국 당뇨병 협회 (American Diabetes Association)의 국립 연구소에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| Fluo4 AM | Life Technologies | F14217 | 500 µl in DMSO |
| FuraRed AM | Life Technologies | F-3020 | |
| Poly-ʟ-lysine | Sigma-Aldrich | P4707 | |
| Pluronic acid | Sigma-Aldrich | F-68 | solution |
| Ionomycin | Sigma-Aldrich | I3909-1ML | |
| Tube rotator | Miltenyi Biotec GmbH | 130-090-753 | Germany |
| Nikon confocal microscope (inverted) | Nikon | Nikon A1R | Laser exitation 488 nm. Emission filters 500-550 nm and 570-620 nm |
| Objective | Nikon | Plan Apo 60x/NA 1.4 Oil | |
| Cover Glass | Thermo Scientific | 6661B52 | |
| High vacuum grease | Dow Corning | Silicone Compound | |
| Software | Nikon | Nikon NIS-Elements | |
| Recording/perfusion chamber | Warner Instruments | RC-26 | |
| Patch clamp amplifier | Molecular Devices | MultiClamp 700B | |
| Data acquisition system | Molecular Devices | Digidata 1440A | Axon Digidata® System |
| Low pass filter | Warner Instruments | LPF-8 | 8 pole Bessel |
| Borosilicate glass capillaries | World Precision Instruments | 1B150F-4 | |
| Micropipette puller | Sutter Instrument Co | P-97 | Flaming/Brown type micropipette puller |
| Microforge | Narishige | MF-830 | Japan |
| Motorized micromanipulator | Sutter Instrument Co | MP-225 | |
| Inverted microscope | Nikon | Eclipse Ti | |
| Microvibration isolation table | TMC | equipped with Faraday cage | |
| Multichannel valve perfusion system | AutoMake Scientific | Valve Bank II | |
| Recording/perfusion chamber | Warner Instruments | RC-26 | |
| Software | Molecular Devices | pClamp 10.2 | |
| Nicardipine | Sigma-Aldrich | N7510 | |
| Iberiotoxin | Sigma | I5904-5UG | |
| Niflumic acid | Sigma-Aldrich | N0630 | |
| DIDS | Sigma-Aldrich | D3514-25MG | |
| TEA chloride | Tocris | T2265 | |
| RPMI 1640 | Life Technologies | 11835030 | without antibiotics |
| BSA | Sigma-Aldrich | A8327 | 30% albumin solution |
| Temperature controlled surgical table | MCW core | for rodents | |
| Steel sieves: | #100 (150 μm), 140 (106 μm) | ||
| Gilson, Inc SIEVE 3 SS FH NO200 | Fisher Sci | 50-871-316 | |
| Gilson, Inc SIEVE 3 SS FH NO270 | Fisher Sci | 50-871-318 | |
| Gilson, Inc SIEVE 3 SS FH NO400 | Fisher Sci | 50-871-320 | |
| mesh 200 | Sigma-Aldrich | s4145 | screen for CD-1 |
| Binocular microscope | Nikon | Eclipse TS100 | |
| Binocular microscope | Nikon | SMZ745 | |
| Syringe pump-based perfusion system | Harvard Apparatus | ||
| Polyethylene tubing | Sigma-Aldrich | PE50 | |
| Isofluorane anesthesia |  VetEquip, Inc. VetEquip, Inc. | 911103 | |
| Other basic reagents | Sigma-Aldrich |
참고문헌
- Machuca, E., Benoit, G., Antignac, C. Genetics of nephrotic syndrome: connecting molecular genetics to podocyte physiology. Hum. Mol. Genet. 18, R185-R194 (2009).
- Haraldsson, B., Nystrom, J., Deen, W. M. Properties of the glomerular barrier and mechanisms of proteinuria. Physiol. Rev. 88, 451-487 (2008).
- Patrakka, J., Tryggvason, K. New insights into the role of podocytes in proteinuria. Nat. Rev. Nephrol. 5, 463-468 (2009).
- Savin, V. J., Sharma, R., Lovell, H. B., Welling, D. J. Measurement of albumin reflection coefficient with isolated rat glomeruli. J. Am. Soc. Nephrol. 3, 1260-1269 (1992).
- Gloy, J., et al. Angiotensin II depolarizes podocytes in the intact glomerulus of the Rat. J. Clin. Invest. 99, 2772-2781 (1997).
- Nitschke, R., et al. Angiotensin II increases the intracellular calcium activity in podocytes of the intact glomerulus. Kidney Int. 57, 41-49 (2000).
- Ilatovskaya, D., Staruschenko, A. Single-channel analysis of TRPC channels in the podocytes of freshly isolated glomeruli. Methods Mol Biol. 998, 355-369 (2013).
- Snitsarev, V. A., McNulty, T. J., Taylor, C. W. Endogenous heavy metal ions perturb fura-2 measurements of basal and hormone-evoked Ca2+ signals. Biophys. J. 71, 1048-1056 (1996).
- Fukuda, A., Fujimoto, S., Iwatsubo, S., Kawachi, H., Kitamura, K. Effects of mineralocorticoid and angiotensin II receptor blockers on proteinuria and glomerular podocyte protein expression in a model of minimal change nephrotic syndrome. Nephrology (Carlton). 15, 321-326 (2010).
- Abramowitz, J., Birnbaumer, L. Physiology and pathophysiology of canonical transient receptor potential channels). FASEB J. 23, 297-328 (2009).
- Heeringa, S. F., et al. A novel TRPC6 mutation that causes childhood FSGS. PLoS ONE. 4, e7771 (2009).
- Zhang, X., Song, Z., Guo, Y., Zhou, M. The novel role of TRPC6 in vitamin D ameliorating podocyte injury in STZ-induced diabetic rats. Mol. Cell. Biochem. 399, 155-165 (2015).
- Bohrer, M. P., et al. Mechanisms of the puromycin-induced defects in the transglomerular passage of water and macromolecules. J. Clin. Invest. 60, 152-161 (1977).
- Olson, J. L., Rennke, H. G., Venkatachalam, M. A. Alterations in the charge and size selectivity barrier of the glomerular filter in aminonucleoside nephrosis in rats. Lab. Invest. 44, 271-279 (1981).
- Schiessl, I. M., Castrop, H. Angiotensin II AT2 receptor activation attenuates AT1 receptor-induced increases in the glomerular filtration of albumin: a multiphoton microscopy study. Am J Physiol Renal Physiol. 305, F1189-F1200 (2013).
- Ilatovskaya, D. V., Levchenko, V., Ryan, R. P., Cowley, A. W., Staruschenko, A. NSAIDs acutely inhibit TRPC channels in freshly isolated rat glomeruli. Biochem. Biophys. Res. Commun. 408, 242-247 (2011).
- Peti-Peterdi, J. Calcium wave of tubuloglomerular feedback. Am. J. Physiol. Renal Physiol. 291, F473-F480 (2006).
- Peti-Peterdi, J., Warnock, D. G., Bell, P. D. Angiotensin II directly stimulates ENaC activity in the cortical collecting duct via AT(1) receptors. J. Am. Soc. Nephrol. 13, 1131-1135 (2002).
- Ilatovskaya, D. V., Palygin, O., Levchenko, V., Staruschenko, A. Pharmacological characterization of the P2 receptors profile in the podocytes of the freshly isolated rat glomeruli. Am. J. Physiol. Cell Physiol. 305, C1050-C1059 (2013).
- Ilatovskaya, D. V., et al. Angiotensin II has acute effects on TRPC6 channels in podocytes of freshly isolated glomeruli. Kidney Int. 305, C1050-C1059 (2014).
- Schaldecker, T., et al. Inhibition of the TRPC5 ion channel protects the kidney filter. J. Clin. Invest. 123, 5298-5309 (2013).
- Roshanravan, H., Dryer, S. E. ATP acting through P2Y receptors causes activation of podocyte TRPC6 channels: role of podocin and reactive oxygen species. Am. J. Physiol. Renal Physiol. 306, F1088-F1097 (2014).
- Anderson, M., Roshanravan, H., Khine, J., Dryer, S. E. Angiotensin II activation of TRPC6 channels in rat podocytes requires generation of reactive oxygen species. J. Cell. Physiol. 229, 434-442 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유