Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Einkanal-Analyse und Calcium Imaging in den Podozyten der frisch isolierten Glomeruli
In diesem Artikel
Zusammenfassung
Changes in the intracellular calcium levels in the podocytes are one of the most important means to control the filtration function of glomeruli. Here we explain a high-throughput approach that allows detection of real-time calcium handling and single ion channels activity in the podocytes of the freshly isolated glomeruli.
Zusammenfassung
Podocytes (renal glomerular epithelial cells) are known to regulate glomerular permeability and maintain glomerular structure; a key role for these cells in the pathogenesis of various renal diseases has been established since podocyte injury leads to proteinuria and foot process effacement. It was previously reported that various endogenous agents may cause a dramatic overload in intracellular Ca2+ concentration in podocytes, presumably leading to albuminuria, and this likely occurs via calcium-conducting ion channels. Therefore, it appeared important to study calcium handling in the podocytes both under normal conditions and in various pathological states. However, available experimental approaches have remained somewhat limited to cultured and transfected cells. Although they represent a good basic model for such studies, they are essentially extracted from the native environment of the glomerulus. Here we describe the methodology of studying podocytes as a part of the freshly isolated whole glomerulus. This preparation retains the functional potential of the podocytes, which are still attached to the capillaries; therefore, podocytes remain in the environment that conserves the major parts of the glomeruli filtration apparatus. The present manuscript elaborates on two experimental approaches that allow 1) real-time detection of calcium concentration changes with the help of ratiometric confocal fluorescence microscopy, and 2) the recording of the single ion channels activity in the podocytes of the freshly isolated glomeruli. These methodologies utilize the advantages of the native environment of the glomerulus that enable researchers to resolve acute changes in the intracellular calcium handling in response to applications of various agents, measure basal concentration of calcium within the cells (for instance, to evaluate disease progression), and assess and manipulate calcium conductance at the level of single ion channels.
Einleitung
Nieren halten homöostatischen Gleichgewicht für verschiedene Stoffe und Regulierung des Blutvolumens in einer Weise, die Gesamtblutdruck bestimmt. Störungen der Nierenfiltration, Resorption oder Sekretion führen zu begleiten oder pathologische Zustände, die von Hyper- oder Hypotonie, um Nierenerkrankungen im Endstadium, die schließlich erfordert Nierentransplantation beenden. Die Nieren-Filtereinheit (Glomerulus) besteht aus drei Schichten - die Kapillarendothel, Basalmembran und eine Einzelzellschicht von Epithelzellen - Podozyten, die eine wichtige Rolle bei der Aufrechterhaltung der Spaltmembran Integrität und Funktion 1 zu spielen. Dysfunktion bei permselektiven glomerulären Filter verursacht Urinverlust von Makromolekülen, wie Proteinurie. Verschiedene Mittel können die Struktur der podocytes und deren Fuß Verfahren, die die Integrität der Glomeruli Filtrationsbarriere bestimmen beeinflussen.
Die podocytes in der Aufrechterhaltung der glom beteiligtenEruli Filterfunktion. Es wurde festgestellt, dass Fehlcalcium Handhabung durch den podocyte führt zu Zellschäden und spielt eine wichtige Rolle beim Fortschreiten der verschiedenen Formen von Nephropathien 2,3. Daher ist die Entwicklung eines Modells, das für die direkte Messung der intrazellulären Calciumkonzentration Veränderungen ermöglicht wird entscheidend für die Untersuchung der Podozyten Funktion sein. Isolated Glomeruli waren zuvor in einer Vielzahl von Studien, einschließlich Messung der Albuminreflexionskoeffizient ändert 4 und Beurteilung des integralen Zellströme in den Ganzzellelektrophysiologische Patch-Clamp-Messungen 5,6 verwendet. In der vorliegenden Arbeit beschreiben wir das Protokoll, das die Forscher ermöglicht, intrazelluläre Calcium-Konzentration sich in Abhängigkeit von Anwendungen von pharmakologischen Mitteln zu messen, abzuschätzen Basalniveaus von Calcium in den Zellen und zu beurteilen einzelnen Calciumkanäle Aktivität. Ratometric Calciumkonzentration Messungen und Patch-Clamp-electrophysiology wurden verwendet, um Veränderungen der intrazellulären Calciumkonzentration innerhalb des podocyte und Kanalaktivität zu bestimmen sind.
Protokoll
Tierversuche und Tierschutz sollte auf die NIH Leitfaden für die Pflege und Verwendung von Labortieren folgende Protokolle überprüft und von der Institutional Animal Care und Verwenden Committee (IACUC) genehmigt einzuhalten.
1. Kidney Flush
- Verwenden Sie 8 bis 12 Wochen alte männliche Ratten (empfohlen ist ein Stamm Sprague Dawley, aber andere Stämme von unterschiedlichen Alters und Geschlechts mit entsprechenden Änderungen verwendet werden).
- Betäuben das Tier nach dem Verfahren von IACUC Protokoll erlaubt; Narkosetiefe zu überwachen und zu kontrollieren das Tier. Die detaillierte Beschreibung der Operation in 1.3 durchgeführt werden - 1.8 kann in Ilatovskaya et al 7.
- Nach entsprechender Anästhesie, legen Sie das Tier auf einem temperaturgesteuerten Operationstisch, einen Mittellinienschnitt des Bauches (bis zu 3 cm in der Länge), und entdecken Sie die Hohlvene und die Aorta.
- Legen Ligatur um die Zöliakie und mesenterica superior Arterien und der BauchAorta über denen; nicht zu ligieren.
- Stumpf sezieren der abdominalen Aorta unterhalb der Nierenarterien, und legen Sie zwei Ligaturen um ihn herum, aber nicht unterbinden, dann klemmen die Aorta oberhalb der Ligaturen und binden Sie den Unterfaden.
- Katheterisierung der Aorta mit einer Polyethylen PE50-Schlauch (mit einer Spritzenpumpe mit PBS gefüllt befestigt) unterhalb der Klemme und Fixierung des Katheters mit dem zweiten Ligatur; entfernen Sie die Klammer, schalten Sie die Pumpe und ligieren der Aorta und der Mesenteriallymphknoten mit abdominaler Arterien. Schnell zu machen Einschnitt in Nierenvene, um den Druck zu entlasten.
- Infundieren die Aorta mit vorgekühltem PBS für 2 oder 3 Minuten lang bei einer Geschwindigkeit von 6 ml / min.
- Stoppen Perfusion, Verbrauchsteuern und decapsulate 7 die Nieren, und legte sie auf Eis in der PBS-Lösung. Euthanize das Tier nach Protokoll IACUC genehmigt.
2. Isolierung des Ratten-Glomeruli
- Vorbereitung 30 ml frische Lösung von 5% BSA in RPMI 1640.
- Mit einer Rasierklinge und Scheren,isolieren die Rinde beider Nieren, und dann, bis sie homogen Blatt vor den Mund. Dieses Verfahren wurde zuvor 7 beschrieben.
- Schieben Sie das Gewebe während der vorherigen Schritt Hackfleisch durch ein 100-Mesh-Sieb aus rostfreiem Stahl (in 5% BSA / RPMI-Lösung vorgeweicht) mit einem Spatel. Sammeln Sie die Durchfluss und durch Schwerkraft ermöglicht die Durchfluss um durch ein 140-Mesh-Sieb passieren.
- Filtern Sie die Durchfluss von den 140 mesh Sieb gesammelt unter Verwendung eines vorher eingeweicht 200-Mesh-Sieb, Filtrat verwerfen und waschen Sie die Spitze des Sieb mit 10 bis 15 ml der vorbereiteten BSA / RPMI-Lösung, um den Glomeruli, die auf sedimentieren sammeln das Sieb.
- Legen Sie die BSA / RPMI-Lösung, die Glomeruli auf Eis in einem 15-ml-Tube und lassen Sie die Glomeruli Sediment am Boden des Rohres für bis zu 20 min. Glomeruli Konzentrat auf der Unterseite des Rohres deutlich sichtbar. Entfernen Sie die überschüssige Lösung, so dass etwa 2 ml in die Röhre.
3. Single-Channel-Patch-Clamp Electrophysiology
- Bereiten Sie 5 x 5 mm Deckglas-Chips durch Beschichtung mit MW 70.000 - 150.000 poly-ʟ-Lysin, und trocknen lassen. Verwenden Sie ca. 30 & mgr; l 0,01% steril filtriert Lösung in Wasser pro Deckglas.
- Warm up die experimentellen Lösungen für RT und füllen Sie die Patch-Clamp-Kammer und Pipette. Für TRPC Kanäle Überwachung, verwenden Sie ein Bad-Lösung in mM: 126 NaCl, 1 CaCl 2, 10 HEPES, 2 MgCl 2, 10 Glucose, pH 7,4; Pipette: 126 NaCl, 1,5 CaCl 2, 10 HEPES, 10 Glucose; pH 7,4.
- In Inhibitoren auf die Pipettenlösung, um die Aktivität von endogenen Kanäle, die nicht für die Studien (empfohlen relevanten blockieren: 100 uM Nifluminsäure oder DIDS (auf Ca 2+ -aktivierte Cl blockieren - Kanäle), 10 mM TEA (um das zu verhindern mit großer Leitfähigkeit Ca 2 + - abhängigen K + Kanal), 10 nM Iberiotoxin (um die Ca 2+ -aktivierten K + Kanäle zu blockieren), 10 & mgr; M Nicardipin (N-Typ-Ca blockieren2+ Kanäle)) unmittelbar vor der Patch-Clamp-Experiment.
- Vorsichtig mischen die Glomeruli haltigen Lösung, und dann etwa 50 & mgr; l davon gelten für die poly-ʟ-Lysin beschichteten Deckglas-Chips. Lassen Sie die Glomeruli legen für ca. 5 min.
- Verschieben Sie die Glas-Chips mit Glomeruli auf die Patch-Clamp-Kammer mit der Badlösung vorgefüllt; versorgen die Kammer bei einer Rate von 3 ml / min für 1 min, um die Entfernung der ungebundenen Glomeruli gewährleisten.
- Durchführung einer konventionellen Patch-Clamp-Experiment in einem Cell-Attached-Modus 7. Mit einer Glaspipette (7-10 MOhm Pipette Widerstand) einen hochohmigen Dichtung zwischen einer Pipette und Podozyten Membran durch leichten Sog (einer Pipette, eine Podozyten auf der Oberfläche des isolierten Glomeruli angebracht zu bilden, wird in Abbildung 2 dargestellt, auf die linke).
- Für die Cell-Attached-Messungen, Tiefpass die Ströme bei 300 Hz durch einen achtpoligen Bessel-Filter.
- Use isoliert Glomeruli in Patch-Clamp-Experimente für bis zu 4 - 6 Std. Bewahren Sie die Lager Glomeruli Fraktion auf Eis.
4. Ratiometrisch konfokalen Fluoreszenzmessungen von intrazellulären Calciumkonzentration in den Podozyten
- Platzieren Sie 500 ul der Glomeruli Fraktion (bei 2.5 beschrieben) in 0,5 ml konischen Röhrchen und fügen Kalzium Farbstoffe Fura Red, AM und Fluo-4, AM. Verwenden Sie 2 mm und 1 mm Lager Konzentrationen von Fura Red, AM und Fluo-4, AM, bzw. (bei -20 ° C, gelöst in DMSO) und verwenden Sie 2,5 ul jeder Farbstoff für ein 500 ul Glomeruli Fraktion. Unmittelbar nach der Zugabe der Farbstoffe decken das Röhrchen mit Aluminiumfolie.
- Die Röhrchen auf einem rotierenden Schüttler für mindestens 20 min bis zu 1 h bei RT.
Anmerkung: Die pharmakologische Mittel können während dieses Schritts zugegeben werden. - Bereiten Sie Deckgläser, decken Sie sie mit poly-ʟ-Lysin und trocknen mit beheizten Plattensatz auf 70 ° C.
- Sobald die Beladung des Calcium Farbstoffe completE gelten 100 ul der Glomeruli enthaltenden Lösung auf das Poly-ʟ-Lysin beschichtete Deckgläser und ließ sie an der Oberfläche für etwa 5 min zu haften. Halterung Glomeruli losen Deck in eine Abbildungskammer und Perfusion mit dem Bad-Lösung (enthaltend (in mM): 145 NaCl, 4,5 KCl, 2 MgCl 2, 10 HEPES, pH 7,35) mit einer Geschwindigkeit von 3 ml / min zu entfernen die ungebunden Glomeruli und die verbleibenden Farbstoffe.
- Stellen Sie die konfokale Laser-Scanning-Mikroskop mit einer 488 nm Anregungswellenlänge und Emissionsfiltern (525/25 und 650/25 nm für Fluo-4 und Fura Red, respectively). Legen Sie die Imaging-Software auf eine gewünschte Frequenz und Auflösung.
- Finden Sie die Glomeruli in Hellfeld und dann auf der Detektion des Fluoreszenzsignals zu drehen. Einstellen der Intensität des Laserstrahls für jeden Farbstoff, um die Sättigung des Signals zu vermeiden. Wählen der Brennebene mit den podocytes die direkt auf das Glas angebracht sind. Dies minimiert den Effekt, der durch Kontraktion eines Glomerulus verursacht in Reaktion auf ArzneimittelAnwendung. Überprüfen Sie, dass die Glomeruli der Wahl ist gut an das Glas gebunden ist;
- Starten Sie die Abbildung der Brennebene der Wahl (nehmen 512 x 512 Bilder mit der Frequenz bei 4 s eingestellt, um schnelle Ca 2+ vorübergehende Veränderungen sichtbar zu machen. Verwenden Sie einen 60X / NA 1.4 oder ähnliche Objektiv für hochauflösendes Bild) gelten Drogen von Interesse, und notieren Sie die Antwort.
- Wählen einer gewünschten Fokusebene (möglichst nahe an der Oberfläche des Glases als möglich zu Bildgebung podocytes auf der Oberfläche des Glomerulus zu gewährleisten). Überprüfen Sie die Intensität der Fluoreszenz auf der Fluo4 und FuraRed Kanäle und stellen Sie sicher, dass die Glomerulus ist eindeutig in Hellfeld gesehen.
- Starten Bildgebung. Vor der Anwendung von Drogen, Rekord mindestens 1 min von Fluoreszenzbasis, um sicherzustellen, dass das Signal stabil ist (es gibt keine plötzlichen Spitzen oder Verblassen des Signals).
- Gelten gewünschten Medikamente mit Hilfe einer Mikropipette; vorsichtig sein und sicherstellen, das Medikament in der Lage, gut diffundieren und erreichen die glomerUlus. Mischen Sie die Badlösung vorsichtig, wenn nötig, die Überwachung der ausgewählten Brennebene und überprüfen Sie, dass es nicht aus dem Fokus wegen der Medikamentenapplikation zu bewegen.
- Aufzeichnung der Änderungen der Fluoreszenzintensität für die Fluo4 und FuraRed Signalen. Achten Sie darauf, die Aufnahme ist lang genug, um zu warten, bis das Signal den Plateauniveau erreicht oder einen Spitzenwert erreicht und kehrt zum Ausgangswert dann. Führen Lösung Änderung oder Ergänzung von irgendwelchen anderen Drogen, wenn nötig.
- Beenden Sie die Aufnahme, und speichern Sie die Datei im nativen Format der Software.
5. Bildanalyse für die Calcium-Messungen
- Führen Sie die Bildanalyse mit dem ImageJ offene Software mit dem ND-Dienstprogramm-Plugin, das Importieren von Bildern in der nativen ND2-Format ermöglicht.
- Importieren Sie die Bildsequenz; stellen Sie sicher, um die Kanäle aufgeteilt und mit einem Hyperstack-Graustufen-Modus.
- Folgen Sie dem Analysieren → Werkzeuge → ROI Manager Pfad im ImageJ Software oStift ein ROI-Manager-Fenster. Wählen Sie mehrere Bereiche von Interesse (Podozyten) mit einem ovalen Auswahlwerkzeug und die "hinzufügen (t)" Funktion in der ROI-Manager. Als das letzte ROI, wählen Sie den Bereich, in den Hintergrund; speichern Sie die ausgewählten ROIs (Mehr → Speichern).
- Markieren Sie das Fenster mit der für die Analyse ausgewählten Kanal. Verwenden Sie die Optionen → Multi Funktion Messen in der ROI-Manager, markieren Sie die "eine Zeile pro Scheibe"-Box in der Dialog, der herausspringt, und klicken Sie dann auf OK. Die Ergebnisse werden in dem Format, das sich im Ergebnisfenster eingestellt werden kann gezeigt werden: in die Menüoption Ergebnisse → Set Maße geben, wählen Sie "Mittlerer Grauwert" und berechnen die Pixelintensitätswerte für jede ROI, die in der angezeigt wird, Ergebnisfenster in separaten Spalten für jede ROI.
- Kopieren Sie die gemessenen ROI Intensitätswerte für jeden Kanal (Fluo-4 und Fura Red) in bevorzugten Datenanalyse-Software; subtract Hintergrund Intensitätswerte von jedem datein Punkt.
- Für jeden Zeitpunkt wird das Verhältnis der Intensitäten des Fluo-4 zu Fura Red-Kanälen. Plot Scatter / Linienpunkt-Zeitänderungen von Ca 2+ Transienten für jede ROI. Berechnen Sie Mittelwert / SE Werte für ausgewählte Glomeruli.
Hinweis: Zeitspalte sollte nach Bildgebungsfrequenz bei 4,5 ausgewählt eingestellt werden.
6. intrazellulären Calciumkonzentration Berechnungen mit Fluo-4 Fluoreszenz-Signal
- Nehmen Sie eine Probe der Glomeruli und führen Sie die experimentelle Protokoll bis zu Schritt 4.7. Nach der Aufnahme der Hintergrundfluoreszenz hinzufügen Ionomycin (Endkonzentration in der Badewanne Kammer sollte 10 & mgr; M) zu der Badlösung und Rekordfluoreszenzintensität zu erhöhen. Sobald die Intensität erreicht sein Maximum und der Zerfall beginnt, fügen MnCl 2 (Endkonzentration sollte 5 mM), die Fluoreszenz 8 quenchen.
- Analysieren Sie die in 6.1 erhaltenen Daten. Kopieren Sie die Fluo-4-Signal ROI Intensitätswerte erhalten nachzu der am 5.1 Protokoll - 5,5 von bevorzugten Analysesoftware.
- Berechnen intrazellulären Calciumkonzentration (in nM) in der podocyte entsprechend dem ROI durch eine Formel:
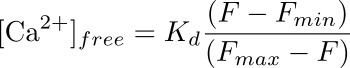
wobei K d ein vorbestimmter Dissoziationskonstante für Fluo-4 (345 nM) konstant ist F die Intensität an dem Zeitpunkt, dass man die Berechnung werden die Calciumkonzentration (Grundlinie) und F min und F max die Intensitätswerte bei der Punkt maximaler Calciumlast (nach Ionomycin Anwendung) und nach Löschung der Fluoreszenz (mit MnCl 2), bzw. (siehe Abbildung 3).
Ergebnisse
Hier haben wir uns mit dem Problem der Messung der akuten Veränderungen der Calciumspiegel in den podocytes. 1 zeigt eine schematische Darstellung des experimentellen Protokolls, um eine hohe Auflösung Live Fluoreszenz konfokale Bildgebung und Einzelionenkanalaktivität in den Aufnahmen podocytes des frisch zuführen entworfen isoliert Nagetier Glomeruli. Kurz nachdem die Ratte betäubt, die Nieren sollten mit PBS gespült werden, um sie von Blut zu löschen. Dann werden die Nieren herausgeschnitten u...
Diskussion
Der hier beschriebene Ansatz ermöglicht die Analyse von Calcium Handhabung durch den Podozyten der Glomeruli Nagetier. Diese Technik ermöglicht die Anwendung der Patch-Clamp-Elektrophysiologie und Einzelkanal-Fluoreszenz ratiometrische konfokale Bildgebung. Jedoch beide Ansätze können einzeln, für sich allein verwendet werden. Das vorgeschlagene Protokoll hat mehrere relativ einfache Schritte, einschließlich 1) Nieren flush; 2) Isolierung der Glomeruli durch Differential Sieben; 3) Durchführen von Patch-Clamp-ele...
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Die Autoren bedanken sich bei Glen Slocum (Medical College of Wisconsin) und Colleen A. Lavin (Nikon Instruments, Inc.) für hervorragende technische Unterstützung bei der Mikroskopie Experimente danken. Gregory Blass ist für kritische Korrekturlesen des Manuskripts anerkannt. Diese Arbeit wurde von den National Institutes of Health Zuschuss HL108880 und American Diabetes Association unterstützt gewähren 1-15-BS-172 (als), und der Ben J. Lipps-Forschungsstipendium von der American Society of Nephrology (auf DVI).
Materialien
| Name | Company | Catalog Number | Comments |
| Fluo4 AM | Life Technologies | F14217 | 500 µl in DMSO |
| FuraRed AM | Life Technologies | F-3020 | |
| Poly-ʟ-lysine | Sigma-Aldrich | P4707 | |
| Pluronic acid | Sigma-Aldrich | F-68 | solution |
| Ionomycin | Sigma-Aldrich | I3909-1ML | |
| Tube rotator | Miltenyi Biotec GmbH | 130-090-753 | Germany |
| Nikon confocal microscope (inverted) | Nikon | Nikon A1R | Laser exitation 488 nm. Emission filters 500-550 nm and 570-620 nm |
| Objective | Nikon | Plan Apo 60x/NA 1.4 Oil | |
| Cover Glass | Thermo Scientific | 6661B52 | |
| High vacuum grease | Dow Corning | Silicone Compound | |
| Software | Nikon | Nikon NIS-Elements | |
| Recording/perfusion chamber | Warner Instruments | RC-26 | |
| Patch clamp amplifier | Molecular Devices | MultiClamp 700B | |
| Data acquisition system | Molecular Devices | Digidata 1440A | Axon Digidata® System |
| Low pass filter | Warner Instruments | LPF-8 | 8 pole Bessel |
| Borosilicate glass capillaries | World Precision Instruments | 1B150F-4 | |
| Micropipette puller | Sutter Instrument Co | P-97 | Flaming/Brown type micropipette puller |
| Microforge | Narishige | MF-830 | Japan |
| Motorized micromanipulator | Sutter Instrument Co | MP-225 | |
| Inverted microscope | Nikon | Eclipse Ti | |
| Microvibration isolation table | TMC | equipped with Faraday cage | |
| Multichannel valve perfusion system | AutoMake Scientific | Valve Bank II | |
| Recording/perfusion chamber | Warner Instruments | RC-26 | |
| Software | Molecular Devices | pClamp 10.2 | |
| Nicardipine | Sigma-Aldrich | N7510 | |
| Iberiotoxin | Sigma | I5904-5UG | |
| Niflumic acid | Sigma-Aldrich | N0630 | |
| DIDS | Sigma-Aldrich | D3514-25MG | |
| TEA chloride | Tocris | T2265 | |
| RPMI 1640 | Life Technologies | 11835030 | without antibiotics |
| BSA | Sigma-Aldrich | A8327 | 30% albumin solution |
| Temperature controlled surgical table | MCW core | for rodents | |
| Steel sieves: | #100 (150 μm), 140 (106 μm) | ||
| Gilson, Inc SIEVE 3 SS FH NO200 | Fisher Sci | 50-871-316 | |
| Gilson, Inc SIEVE 3 SS FH NO270 | Fisher Sci | 50-871-318 | |
| Gilson, Inc SIEVE 3 SS FH NO400 | Fisher Sci | 50-871-320 | |
| mesh 200 | Sigma-Aldrich | s4145 | screen for CD-1 |
| Binocular microscope | Nikon | Eclipse TS100 | |
| Binocular microscope | Nikon | SMZ745 | |
| Syringe pump-based perfusion system | Harvard Apparatus | ||
| Polyethylene tubing | Sigma-Aldrich | PE50 | |
| Isofluorane anesthesia |  VetEquip, Inc. VetEquip, Inc. | 911103 | |
| Other basic reagents | Sigma-Aldrich |
Referenzen
- Machuca, E., Benoit, G., Antignac, C. Genetics of nephrotic syndrome: connecting molecular genetics to podocyte physiology. Hum. Mol. Genet. 18, R185-R194 (2009).
- Haraldsson, B., Nystrom, J., Deen, W. M. Properties of the glomerular barrier and mechanisms of proteinuria. Physiol. Rev. 88, 451-487 (2008).
- Patrakka, J., Tryggvason, K. New insights into the role of podocytes in proteinuria. Nat. Rev. Nephrol. 5, 463-468 (2009).
- Savin, V. J., Sharma, R., Lovell, H. B., Welling, D. J. Measurement of albumin reflection coefficient with isolated rat glomeruli. J. Am. Soc. Nephrol. 3, 1260-1269 (1992).
- Gloy, J., et al. Angiotensin II depolarizes podocytes in the intact glomerulus of the Rat. J. Clin. Invest. 99, 2772-2781 (1997).
- Nitschke, R., et al. Angiotensin II increases the intracellular calcium activity in podocytes of the intact glomerulus. Kidney Int. 57, 41-49 (2000).
- Ilatovskaya, D., Staruschenko, A. Single-channel analysis of TRPC channels in the podocytes of freshly isolated glomeruli. Methods Mol Biol. 998, 355-369 (2013).
- Snitsarev, V. A., McNulty, T. J., Taylor, C. W. Endogenous heavy metal ions perturb fura-2 measurements of basal and hormone-evoked Ca2+ signals. Biophys. J. 71, 1048-1056 (1996).
- Fukuda, A., Fujimoto, S., Iwatsubo, S., Kawachi, H., Kitamura, K. Effects of mineralocorticoid and angiotensin II receptor blockers on proteinuria and glomerular podocyte protein expression in a model of minimal change nephrotic syndrome. Nephrology (Carlton). 15, 321-326 (2010).
- Abramowitz, J., Birnbaumer, L. Physiology and pathophysiology of canonical transient receptor potential channels). FASEB J. 23, 297-328 (2009).
- Heeringa, S. F., et al. A novel TRPC6 mutation that causes childhood FSGS. PLoS ONE. 4, e7771 (2009).
- Zhang, X., Song, Z., Guo, Y., Zhou, M. The novel role of TRPC6 in vitamin D ameliorating podocyte injury in STZ-induced diabetic rats. Mol. Cell. Biochem. 399, 155-165 (2015).
- Bohrer, M. P., et al. Mechanisms of the puromycin-induced defects in the transglomerular passage of water and macromolecules. J. Clin. Invest. 60, 152-161 (1977).
- Olson, J. L., Rennke, H. G., Venkatachalam, M. A. Alterations in the charge and size selectivity barrier of the glomerular filter in aminonucleoside nephrosis in rats. Lab. Invest. 44, 271-279 (1981).
- Schiessl, I. M., Castrop, H. Angiotensin II AT2 receptor activation attenuates AT1 receptor-induced increases in the glomerular filtration of albumin: a multiphoton microscopy study. Am J Physiol Renal Physiol. 305, F1189-F1200 (2013).
- Ilatovskaya, D. V., Levchenko, V., Ryan, R. P., Cowley, A. W., Staruschenko, A. NSAIDs acutely inhibit TRPC channels in freshly isolated rat glomeruli. Biochem. Biophys. Res. Commun. 408, 242-247 (2011).
- Peti-Peterdi, J. Calcium wave of tubuloglomerular feedback. Am. J. Physiol. Renal Physiol. 291, F473-F480 (2006).
- Peti-Peterdi, J., Warnock, D. G., Bell, P. D. Angiotensin II directly stimulates ENaC activity in the cortical collecting duct via AT(1) receptors. J. Am. Soc. Nephrol. 13, 1131-1135 (2002).
- Ilatovskaya, D. V., Palygin, O., Levchenko, V., Staruschenko, A. Pharmacological characterization of the P2 receptors profile in the podocytes of the freshly isolated rat glomeruli. Am. J. Physiol. Cell Physiol. 305, C1050-C1059 (2013).
- Ilatovskaya, D. V., et al. Angiotensin II has acute effects on TRPC6 channels in podocytes of freshly isolated glomeruli. Kidney Int. 305, C1050-C1059 (2014).
- Schaldecker, T., et al. Inhibition of the TRPC5 ion channel protects the kidney filter. J. Clin. Invest. 123, 5298-5309 (2013).
- Roshanravan, H., Dryer, S. E. ATP acting through P2Y receptors causes activation of podocyte TRPC6 channels: role of podocin and reactive oxygen species. Am. J. Physiol. Renal Physiol. 306, F1088-F1097 (2014).
- Anderson, M., Roshanravan, H., Khine, J., Dryer, S. E. Angiotensin II activation of TRPC6 channels in rat podocytes requires generation of reactive oxygen species. J. Cell. Physiol. 229, 434-442 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten