Method Article
تقنية تسمية خالية لتصوير المكانية والزمانية لإفرازات خلية واحدة
In This Article
Summary
الاتصالات بين الخلايا أمر بالغ الأهمية للسيطرة على مختلف الأنشطة الفسيولوجية داخل وخارج الخلية. وتصف هذه الورقة بروتوكول لقياس طبيعة المكانية والزمانية لإفرازات خلية واحدة. ولتحقيق ذلك، يستخدم نهج متعدد التخصصات الذي يجمع بين nanoplasmonic التسمية خالية الاستشعار مع تصوير الخلايا الحية.
Abstract
Inter-cellular communication is an integral part of a complex system that helps in maintaining basic cellular activities. As a result, the malfunctioning of such signaling can lead to many disorders. To understand cell-to-cell signaling, it is essential to study the spatial and temporal nature of the secreted molecules from the cell without disturbing the local environment. Various assays have been developed to study protein secretion, however, these methods are typically based on fluorescent probes which disrupt the relevant signaling pathways. To overcome this limitation, a label-free technique is required.
In this paper, we describe the fabrication and application of a label-free localized surface plasmon resonance imaging (LSPRi) technology capable of detecting protein secretions from a single cell. The plasmonic nanostructures are lithographically patterned onto a standard glass coverslip and can be excited using visible light on commercially available light microscopes. Only a small fraction of the coverslip is covered by the nanostructures and hence this technique is well suited for combining common techniques such as fluorescence and bright-field imaging.
A multidisciplinary approach is used in this protocol which incorporates sensor nanofabrication and subsequent biofunctionalization, binding kinetics characterization of ligand and analyte, the integration of the chip and live cells, and the analysis of the measured signal. As a whole, this technology enables a general label-free approach towards mapping cellular secretions and correlating them with the responses of nearby cells.
Introduction
الاتصالات بين الخلايا هو أمر حاسم لتنظيم العديد من الأنشطة الفسيولوجية داخل وخارج الخلية. مجموعة متنوعة من البروتينات والحويصلات يمكن يفرز التي تؤدي فيما بعد العمليات الخلوية المعقدة مثل التمايز، والتئام الجروح، الاستجابة المناعية، والهجرة، والانتشار. قد تورطت 1-5 الأعطال من مسارات الإشارات بين الخلايا في أمراض عديدة منها السرطان وتصلب الشرايين ، ومرض السكري، على سبيل المثال لا الحصر.
يجب أن تكون الخلية الأمثل إفراز فحص قادرة على مكانيا وزمانيا رسم خرائط بروتين يفرز من الفائدة دون تعطيل مسارات الإشارات ذات الصلة. وبهذه الطريقة يمكن الاستدلال على العلاقات السببية بين ملامح التركيز واستجابة الخلايا المستقبلة. لسوء الحظ، فإن العديد من التقنيات التي تعتمد الفلورسنت الأكثر استخداما لا تلبي هذه المعايير. البروتينات الفلورية الانصهار يمكن استخدامها لعلامة الحليلة ثithin الخلية ولكن يمكن أن يعطل مسار إفرازية، أو إذا يفرز نتائج في توهج منتشر خارج الخلية التي يصعب قياسها كميا. المقايسات القائم على immunosandwich الفلورسنت هي الأكثر استخداما التقنيات للكشف عن الإفرازات الخلوية ولكنها تتطلب عادة عزل الخلايا الفردية. 6-11 وبالإضافة إلى ذلك، وإدخال من الأجسام المضادة الاستشعار عادة ما يوقف أو ينهي التجربة وحجم التسميات الأجسام المضادة، 150 كيلو دالتون للمفتش، وعائقا أمام إشارات المصب.
بسبب هذه الحواجز فمن الأفضل أن تقنية خالية من التسمية أن تستخدم لإفرازات البروتين الصورة وبين تقنيات خالية من التسمية الحالية، سطح صدى مأكل (SPR) والمترجمة صدى مأكل السطح (LSPR) أجهزة الاستشعار مرشحين ممتازة. 12-17 هذه وقد استخدمت أجهزة الاستشعار على نطاق واسع للدراسات ملزمة تحليلها من البروتينات، exosomes والمؤشرات الحيوية الأخرى. 18-24 وفي حالة LSPR، وnanostr plasmonicuctures يمكن منقوشة lithographically على coverslips الزجاج ومتحمس باستخدام الضوء المرئي عبر تكوينات المجهر واسعة المجال القياسية. ونظرا لحضورها النانوية، والغالبية العظمى من الركيزة الزجاج متاحة لتقنيات التصوير الشائعة مثل مشرق الميدان والفحص المجهري مضان جعل هذه التحقيقات أيضا مناسبة للتكامل مع المجهر الخلية الحية. 25-28 لقد أثبتنا قياس الوقت الحقيقي من إفرازات الجسم المضاد من خلايا هجين استخدام الذهب functionalized النانو plasmonic مع القرارات المكانية والزمانية من 225 ميللي ثانية و 10 ميكرون، على التوالي. ويتضح تكوين رقاقة الأساسي في الشكل 1. 28 ينقسم مسار الضوء الناتج من المجهر بين كاميرا CCD المستخدمة في التصوير ومطياف جانب الألياف بصريا لتحديد الكمي للشغل كسور من مجموعة معينة من النانو (الشكل 2 ).
وprotocرأ الواردة في هذه الورقة يصف التصميم التجريبي لقياس الوقت الحقيقي من إفرازات خلية واحدة في حين رصد في الوقت نفسه استجابة الخلايا باستخدام معيار المجهر مشرق الميدان. يتضمن نهج متعدد التخصصات لتصنيع النانو، functionalization من النانو لتقارب عالية ملزم من التحاليل، والتحسين السطح لكل من التقليل غير محددة وملزمة وتميز الثوابت معدل الحركية باستخدام سطح التجاري بلازمون الرنين (SPR) الصك، دمج خطوط الخلايا على الركيزة، وتحليل الصور والبيانات الطيفية. نتوقع هذه التقنية أن تكون التكنولوجيا ملائمة لرسم الخرائط المكانية والزمانية من إفرازات الخلية وعلاقاتها السببية مع الخلايا المستقبلة.
Protocol
1. البنية النانوية تلفيق
- اختيار 25 مم coverslips الزجاج قطر مع سمك تقريبي من 170 ميكرون (رقم 1،5) بمثابة ركائز للnanofabrication.
- تزج لل coverslips في حل سمكة البيرانا (3: 1 نسبة من حامض الكبريتيك وبيروكسيد الهيدروجين) لمدة 6 على الأقل ساعة. غسل سمكة البيرانا غارقة ساترة مع كمية وفيرة من عالى النقاء 18.2 MΩ منزوع الأيونات الماء المقطر (DDW).
تنبيه: حمض سمكة البيرانا يتفاعل بعنف مع المواد العضوية ويجب التعامل معها بعناية فائقة. - إيداع 10 نانومتر الكروم طبقة رقيقة على لل coverslips بواسطة البريد شعاع تبخر لتجنب الآثار تهمة خلال الزخرفة والتصوير النانو.
- تدور الطبقة الأولى من طبقة ثنائية تقاوم تتكون من ميتاكريليت الميثيل إيثيل اللاكتات (MMA_EL6) من البوليمرات في 2000 دورة في الدقيقة لمدة 45 ثانية ثم تخبز في 150 ° C. تدور الطبقة الثانية من بولي ميثيل ميتاكريليت (950PMMA_A2) في 3000 دورة في الدقيقة لمدة 45 ثانية ثم يخبز على حرارة 180 درجة مئوية.
- طقطقن طبقة ثنائية تقاوم باستخدام الطباعة الحجرية شعاع الالكترون (EBL) في 25 كيلو فولت مع جرعة مساحة 300 μC / سم 2. تطوير في ايزوبروبيل (IPA) / الميثيل كيتون إيسوبوتيل (MIBK): 2/1 وشطف في IPA.
- ودائع تي (5 نانومتر) / الاتحاد الافريقي (80 نانومتر) الفيلم على الركيزة باستخدام المبخر شعاع ه.
- بعد ترسب الذهب، ورفع قبالة طبقة ثنائية البوليمرات تقاوم عن طريق نقع الركيزة في الأسيتون لمدة 4 ساعة.
- تفقد الركيزة باستخدام المجهر الإلكتروني الماسح (SEM) لتأكيد شكل البنية النانوية والحجم، وإزالة الكروم المتبقية من الركيزة عن طريق حفر الرطب باستخدام CR-7 منمش لمدة 60 ثانية في RT ثم يشطف في أحواض دبي الجافة العالمية.
- تصميم تباعد مجموعة مركز إلى مركز من 33 ميكرون أن تترك مجالا للتصوير خلية بين المصفوفات. نمط من النانو في 20 × 20 نمط لكل مجموعة مع الملعب من 300 نانومتر باستخدام الكاتب شعاع ه. كل رقاقة تحتوي على 300 صفائف مع البعد البنية النانوية نموذجية من ارتفاع 80 ± 2.5 نانومتر و 70 نانومتر ± 2.5 دياميثالثا.
- تفقد مجموعة فرعية من المصفوفات باستخدام مجهر القوة الذرية (AFM) للتحقق من حجم والتوحيد.
- إرفاق حلقة الدعم، وعادة السيليكون، إلى الجزء الخلفي من ساترة باستخدام الايبوكسي العلاج بالأشعة فوق البنفسجية.
2. رقاقة تنظيف وتطبيق واحد رقائق تجميعها الذاتي
- لتنظيف وتجديد رقائق، ورماد البلازما في قوة 40 واط في خليط 300 mTorr من 5٪ هيدروجين و 95٪ الأرجون لمدة 45 ثانية بعد تنظيف الغرفة لمدة 5 دقائق في ظل نفس الظروف.
- Functionalize والنانو ذهب مباشرة بعد ashing البلازما عن طريق غمر الشريحة في حل ثيول الكحولي اثنين من المكونات التي تتألف من 3: 1 نسبة من SH- (CH 2) 8 -EG 3 -OH (SPO) وعنصر إما مع أمين أو الكربوكسيل مجموعة وظيفية، وهي SH- (CH 2) 11 -EG 3 -NH 2 (SPN) أو SH- (CH 2) 11 -EG 3 -COOH (SPC).
- مغادرة ط رقاقةن الحل ثيول O / N لتشكيل أحادي الطبقة الذاتي تجميعها (SAM).
- شطف رقاقة مع الإيثانول والجافة مع غاز النيتروجين.
- إذا لزم الأمر، وتخزين رقاقة functionalized لتصل إلى 2 أسابيع في 4 درجات مئوية.
- عندما تصبح جاهزة للاستخدام الرد على SPN أو مكون SPC مع يجند باستخدام الكيمياء تبعا ليجند من خيار (انظر أدناه).
ملاحظة: رقائق يمكن تجديدها وإعادة functionalized عشرات المرات. شريحة معينة يمكن استخدامها لفترات تتراوح من 6 أشهر إلى أكثر من عام. أطياف يقاس على مجموعة معينة ترد موثوق بعد regenerations المتكررة التي ashing البلازما، تليها biofunctionalization 29
3. Functionalization السطحية والحركية توصيف
ملاحظة: استخدام رقاقة functionalized في الصك من موارد البرنامج الخاصة التجاري لتوصيف الثوابت معدل الحركية بين يجند وتحليلها، وكذلك لدراسة مقاومة SAM لب غير محددةinding. هناك مجموعة واسعة من معدلات التدفق والتصاميم الموائع الدقيقة التي تسمح للكفاءة functionalization السطح. لأن لدينا SPR المتاحة تجاريا نحن موحدة حول أوصى معدلات تدفقها. ونلاحظ أن هذه المعدلات تدفق هي نموذجية من جميع الصكوك SPR وليست تقييدا لذلك. الصك من موارد البرنامج الخاصة ليست ضرورة لأن جميع functionalization يمكن القيام به مباشرة على رقاقة LSPR، لكنها لم تقلل عبء العمل لدينا لأنها أداة المضاعفة في حين لدينا LSPR الإعداد ميكروفلويديك ليست كذلك.
- Functionalize تجاري رقاقة الذهب عارية مع SAM كما هو موضح في القسم 2.
- إذا باستخدام SAM SPC القائمة على تفعيل مجموعة الكربوكسيل مع 1: 1 خليط من 133 ملي من 1 إيثيل-3- (3-dimethylaminopropyl) carbodiimide (EDC) و 33 ملم من N -hydroxysuccinimide (NHS) في أحواض دبي الجافة العالمية ل10 دقيقة.
- تصريف مجموعة الكربوكسيل تفعيلها مع الأجسام المضادة / يجند من الفائدة لمدة 300 ثانية باستخدام معدل تدفق 30 ميكرولتر / دقيقة. إعداد بروابط فيدرجة الحموضة 6 عازلة الفوسفات، عادة، ولكن هذا يمكن أن تختلف تبعا للجزيء.
- بعد الاقتران يجند، وتدفق 0.1 M ايثانول في الفوسفات مخزنة المالحة (PBS) كخطوة deactivator لمدة 300 ثانية بمعدل 30 ميكرولتر / دقيقة. ايثانول يساعد في تقليل غير محددة وملزمة.
- يعرض تحليلها من الفائدة بمعدل تدفق 100 ميكرولتر / دقيقة باستخدام مجموعة من تركيزات وحساب الثوابت معدل الحركية باستخدام برامج التحليل الحركي.
- إذا غير محددة وملزمة إشكالية، وزيادة نسبة SPO إلى SPC أو SPN.
4. إعدادات LSPR عامة
- ضبط المجهر:
- استخدام 100 W الهالوجين مصباح لكوهلر إلقاء الضوء على عينة. استخدام تمرير مرشح طويلة (عادة 593 نانومتر قطع) في مسار الضوء للقضاء على الأطوال الموجية التي لا تساهم في تحول الرنين (الشكل 2).
- لجمع البيانات LSPRi، استخدام مجهر مقلوب مع immersio النفط 40Xالهدف ن (1.4 NA) والحرارية لتبريد 16 بت كاميرا CCD.
- وضع الحزمة الخائن في منفذ إخراج المجهر للحصول على صور والأطياف في وقت واحد.
- ضبط درجة الحرارة التي تسيطر عليها المرحلة المجهر إلى 37 ° C وتتوازن لمدة 4 ساعات.
- دمج جمعية حضانة إضافي على المجهر لتنظيم تركيز CO 2 والرطوبة بنسبة 5٪ و 95٪ على التوالي.
- إعداد شريحة وتركيب:
- Functionalize رقاقة LSPR كما هو موضح في القسم 2 مع مركبين المثلى نسب SAM تحديد من التجارب SPR.
- تحميل الشريحة في غضون حامل ميكروفلويديك العرف على النحو التالي. وضع رقاقة على قطعة أسفل الألمنيوم. ساندويتش رقاقة بين هذه القطعة السفلي وحشية السيليكون والبلاستيك كبار قطعة واضح. استخدام 4 مسامير لكبح التجمع.
- لتطبيق ثيول نموذجي على أساس SPC، إسقاط معطف 300 ميكرولتر 1: مزيج 1البنية من 133 ملي من EDC و 33 ملم من NHS في أحواض دبي الجافة العالمية لتنشيط مجموعات الكربوكسيل العنصر SPC ثيول.
- الانتظار لمدة 10 دقيقة ويشطف سطح يدويا مع 10 ملي برنامج تلفزيوني.
- تصريف مجموعة الكربوكسيل تفعيلها مع يجند (عادة الأجسام المضادة أو الأجسام المضادة جزء) من الفوائد بنسبة انخفاض طلاء 300 ميكرولتر من الحل يجند.
- الانتظار لمدة 30 دقيقة ويشطف يدويا مع 10 ملي برنامج تلفزيوني.
- إسقاط معطف 300 ميكرولتر من 0.1 M ايثانول في برنامج تلفزيوني على شريحة لتقليل ملزمة انوعي. الانتظار لمدة 10 دقيقة.
- غسل ايثانول مع PBS تحتوي على 0.005٪ توين 20 (PBS-T20).
- ضع قطعة الكوارتز فوق رقاقة للحد من التقلبات في البيانات المتعلقة هلالة تغيير.
- الحفاظ على رقاقة الرطب مع العازلة PBS-T20 بينما المتزايدة على المجهر.
- وضع التجمع رقاقة LSPR بقوة داخل ساخنة صاحب العينة مرحلة وإرفاق أنابيب ميكروفلويديك.
- إرفاق أنابيب على microfluidics إلى التجمع وتدفق بويتم التوصل إلى ffer (أو وسائل الإعلام الحرة المصل للدراسات خلية) حتى حالة مستقرة.
- السماح للتجميع ومجهر لكي تتوازن لا يقل عن 2 ساعة.
- محاذاة رقاقة باستخدام عصا التحكم بحيث يتم محاذاة مجموعة المركزية، مع الألياف البصرية للتحليل الطيفي. يتم أخذ البيانات الطيفي باستخدام مطياف وبرامج التحليل الطيفي.
- الحفاظ صفائف في التركيز في كافة مراحل التجربة باستخدام برنامج ضبط تلقائي للصورة، زايس التركيز مؤكد أو جهاز ضبط تلقائي للصورة ما يعادلها.
5. التصوير LSPR من إفرازات مكافحة ج-MYC من 9E10 خلايا ورم هجين
ملاحظة: الخط خلية هجين المستخدمة في هذه الدراسة تعبير عن معاداة ج-MYC الأجسام المضادة بشكل جوهري، وبالتالي لا تتطلب مشغل الكيميائية
- Functionalize والنانو مع ج-MYC الببتيد. وهذا له قيمة K D من 1.77 نانومتر للأجسام المضادة للج-MYC التي يفرزها استنساخ خلايا 9E10 هجين.
- ثقافة الخلايا هجين في الإنشائيةالبريد متوسطة النمو مع 10٪ مصل بقري جنيني (FBS) و 1٪ للمضادات الحيوية في قارورة T75 عند 37 درجة مئوية تحت 5٪ CO 2. الحفاظ على كثافة الخلية من 4 × 10 5 خلية / مل.
- للدراسات إفراز الخلايا، والخلايا بيليه من القارورة T75 بواسطة الطرد المركزي، ويغسل مرتين مع RPMI-1640 مصل وسائل الاعلام الحرة (SFM) لإزالة الأجسام المضادة يفرز وضبط كثافة الخلية إلى 4 × 10 6 خلية / مل.
- حصاد الخلايا واختبار الجدوى قبل تعريفهم إلى رقائق LSPR.
- إدخال 50 ميكرولتر من الحل خلية يدويا على رقائق LSPR مع micropipette. بعد بضع دقائق 25-50 الخلايا تلتصق على سطح رقائق LSPR.
- يغسل الخلايا المتبقية في حل مع SFM جديدة باستخدام نظام نضح ميكروفلويديك.
- حدد صفائف LSPR للتصوير والتي هي قريبة، في غضون 10 ميكرون، ولكن ليس التداخل مع الخلايا.
- للتأكد من أن إشارة محددة إلى يفرز معاداة ج-MYC antibodies إدخال وسائل الإعلام ثقافة الخلية مع وبدون الأجسام المضادة الحالية وكذلك مع الأجسام المضادة ولكن مع مواقع الربط على حظره من قبل وجود تركيز تشبع من ج myc الببتيد في الحل.
- معايرة أجهزة الاستشعار في نهاية كل شوط مع حل تشبع معاداة ج-MYC الأجسام المضادة (250 نيوتن متر). وهذا يساعد في تطبيع استجابة من أجهزة الاستشعار وتحديد الإشغال كسور استنادا إلى بيان biofunctionalization من كل شوط.
- تصحيح الانحراف في اتجاه X و Y باستخدام برنامج محاذاة الصورة.
النتائج
في دراسة إفراز الخلايا الحية نموذجية هناك طرق متعددة لجمع البيانات التي تجري الشكل 3 يظهر تراكب صورة LSPRi، الذي يسلط الضوء على صفائف مربع، والضوء النافذ صورة مضيئة الذي يسلط الضوء على الخلايا في أسفل اليسار. يتم جمع البيانات عادة على مدى 3-ساعة تليها مقدمة من حل تشبع من الحليلة لحساب التطبيع هو موضح أدناه. ويمكن أيضا أن تكون متكاملة الصور مضان في روتين جمع البيانات من قبل التحويل الآلي مكعب التصفية. في الشكل (4) خلية ملطخة صبغة الفلورسنت غشاء رودامين DHPE يسلك ملحقات مثل أقدام صفاحية (السهام). إذا كانت هذه الملحقات لتتداخل مع صفائف أنها تعطي إيجابية كاذبة لإفراز البروتين. يمكن وجود وسائط متعددة من الصور مساعدة في تحديد مثل هذه الحوادث.
ويبين الشكل 5 البيانات الطيف قبل والخلفإيه إدخال حل تشبع (400 نيوتن متر) من شراؤها تجاريا المضادة للج-MYC الأجسام المضادة لصفائف بين functionalized ج MYC. لم تكن هناك خلايا موجودة في هذه التجربة. يعرض الطيف كلا تحولا الحمراء وزيادة في كثافة. الفرق بين المناطق الخاضعة لالمنحنيين يؤدي إلى زيادة في كثافة صورة مجموعة في وضع LSPRi على كاميرا CCD. وقد تم تطوير منهج تحليل البيانات أقل المربعات غير الخطية للاستدلال الإشغال كسور من سطح ملزمة بروابط من الأطياف. 30،31
في نهاية التجربة، قيم الكثافة المشبعة (أي كسور الإشغال ≈ 1) وتستخدم لحساب استجابة طبيعية لكل مجموعة باستخدام الصيغة التالية:
أين هي كثافة طبيعية في وقت نقطة تي، وكثافة الأولية في بداية التجربة، وكثافة النهائية المشبعة، وكثافة يقاس من مجموعة في وقت نقطة ر ، على التوالي.
يتم عرض القيم تطبيع اثنين من صفائف في الشكل (6). وكان من بين مجموعة ضمن 10 ميكرون من الخلية قيد التحقيق في حين أن الآخر، وتستخدم كعنصر تحكم، وكانت على مسافة 130 ميكرون من الخلية. الزيادة المفاجئة في استجابة طبيعية من مجموعة الأقرب إلى خلية المتعلقة استجابة شقة من مجموعة السيطرة هي التي تشير إلى انفجار المترجمة من الأجسام المضادة يفرز.
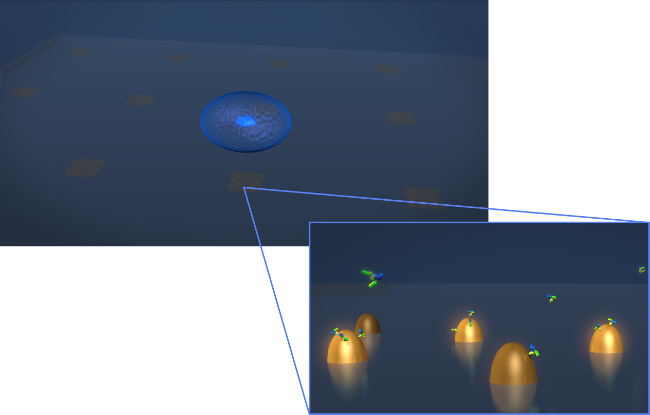
الشكل 1. الاستشعار تصميم. إيداع رسم تصور الهندسي لحية التجربة إفراز الخلايا العادية. الخلية (كروي الأزرق) إلى رقاقة LSPR الذي يحتوي على صفائف النانو الذهب biofunctionalized. في رأي التكبير في وإفراز الخلايا في المصالح، في هذه الحالة الأجسام المضادة كما هو موضح جزيئات على شكل Y، يتم قياس لأنها تربط إلى السطحمن النانو functionalized. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
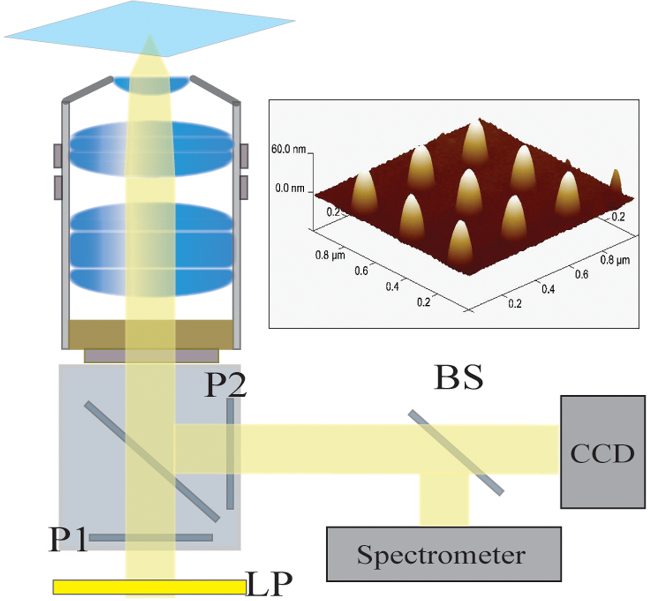
يتم تصفية الشكل 2. إعداد البصري. ضوء مضيئة من مصابيح الهالوجين أول مرة من قبل مرشح تمريرة طويلة (LP). ضوء غير مستقطب خطيا (P1) وينير العينة عن طريق الهدف NA 40X / 1.4. يتم جمع ضوء متناثرة من هدف وتمريرها من خلال المستقطب عبرت (P2). يتم إدخال الخائن 50/50 شعاع (BS) في مسار الضوء جمعها لالطيفية في وقت واحد وتحليل الصور. أعلى اليمين: صورة مجهرية قوة ذرية من 9 النانو الفردية مفصولة الملعب من 300 نانومتر الرجاء انقر هنالعرض نسخة أكبر من هذا الرقم.
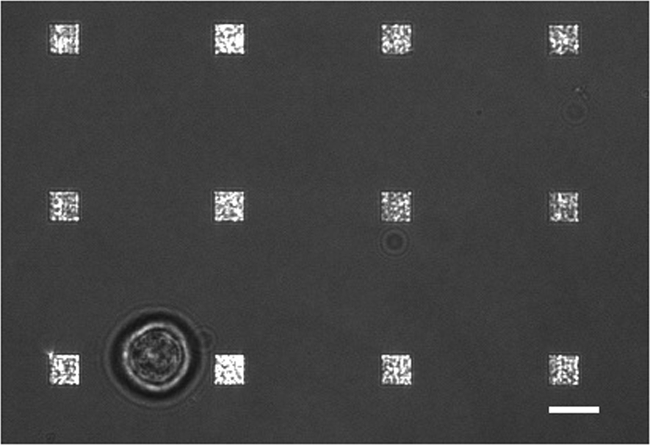
LSPRi الشكل 3. الخلية الحية دراسة. A اندمجت الضوء المرسل وLSPRi صورة تظهر خلية هجين واحدة (أسفل اليسار) محاطا 12 المصفوفات. هذا هو على النقيض من الصورة المحسنة. شريط النطاق هو 10 ميكرون. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
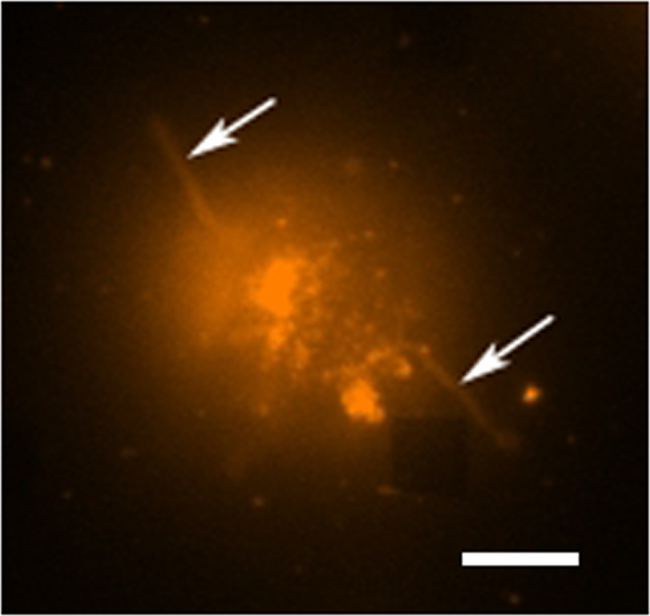
الرقم 4. الخلية الحية الإسفار دراسة. A الفلورسنت صورة ملونة كاذبة عن خلية هجين واحدة ملطخة DHPE رودامين، وهو صبغ الغشاء. في وضع التصوير الفلورسنت صفائف غير مرئية بشكل عام، ومع ذلك، مجموعة القريبة هي ملاحظتها هنا كما ABتفتقر مربع في الزاوية اليمنى السفلى. ويمكن النظر إلى الخلية المراد فصله من مجموعة على الرغم من ملحقات مثل اللامسة (ربما أرجل كاذبة خيطية أو أقدام صفاحية) وتمتد إلى الخارج من الخلايا (السهام). شريط النطاق هو 10 ميكرون. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
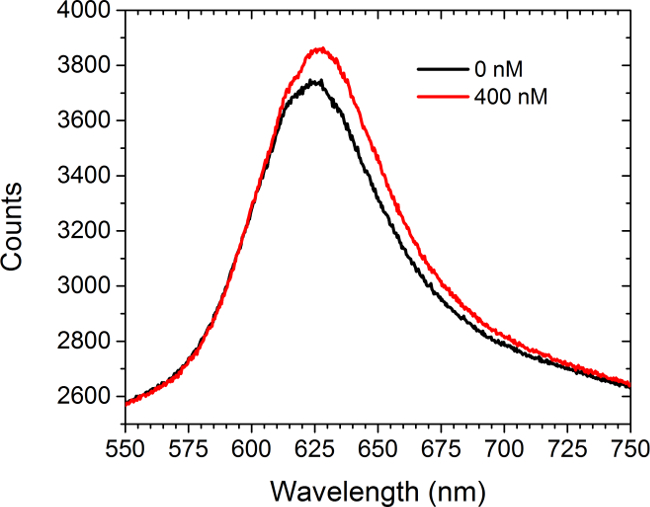
الرقم 5. الطيفي الطريقة. أطياف تم الحصول عليها من مجموعة functionalized ج-MYC قبل وبعد إدخال 400 نانومتر حل أضداد ج-MYC. لم تكن هناك خلايا موجودة في هذه الدراسة. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الرقم 6. واحد إفراز الخلية. واستجابة لمجموعة تقع ضمن 15 ميكرون من خلية واحدة واحدة تقع 130 ميكرون بعيدا (التحكم). شريط النطاق هو 10 ميكرون. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
The LSPR imaging technique described in this work has numerous advantages over more traditional methodologies for detecting cell secretions. First, the time resolution of our technique is on the order of seconds whereas the commercial alternative, an immunosandwhich assay known as EliSpot, has a typical time resolution of 2 to 3 days.7,32 As a result we were able to resolve sudden changes in the rate of protein secretion, such as that shown in Figure 6. Second, having arrays distributed over the chip allows for the secreted signal to be tracked in space and time which enables more rigorous comparisons to diffusion-based models of cell secretion. In addition, arrays like the control array shown in Figure 6 can be used to subtract out global changes in the image that typically arise from instrumental factors such as focus drift. Third, our technique requires no modification of the cells. If desired, the experiment can incorporate commonly used tags such as fluorescent proteins, but if there is concern that such tags may negatively affect cell viability or homeostasis the label-free nature of our approach does not require them. Fourth, using the spectroscopic data we have demonstrated that quantitative information regarding the fractional occupancy of surface bound ligands can be calculated.
There are numerous alternative methods to EBL for fabricating metallic nanoparticles. However, we have found that the EBL provides considerable flexibility for optimizing nanostructure and array dimensions to best suit the optics and the cells under investigation. Also critical is the fact that the chips can be readily regenerated by plasma ashing. In this way, a typical chip can be used dozens of times. Biofunctionalization details must be modified for the specific application. The protocol presented here conjugated the surface with relatively small c-myc peptide ligands. Larger ligands such as whole antibodies typically require more spacing and thus a higher SPO to SPN/SPC ratio. Regardless, a well formed SAM layer is essential for preventing non-specific binding in live-cell experiments. In general, larger molecular weight analytes are more readily detected by LSPR. Thus, in its single-cell manifestation, this technique may not be appropriate for detecting the secretion of small proteins, such as cytokines.
The current setup has been used for studying individual non-adherent cells. There are significant number of secreted signaling proteins and vesicles to which the results reported in this work are directly applicable. For example carcinoembryonic antigen (CEA) which for decades now has been a diagnostic marker for cancer. Colon cancer cells are known to secrete CEA at the rates of thousands of molecules/cell/hr and the molecular weight is 180 kDa which exceeds that of IgG antibodies. CEA is believed to be involved in autocrine and paracrine signaling pathways but the spatio-temporal nature of these secretions have never been measured. Our technique can directly address these signaling questions. An extension of this work will be to measure the spatio-temporal nature of CEA secretion from single cells.33 Future work will also focus on integrating LSPRi with two and three dimensional cell cultures of adherent cells. By incorporating multiplexed arrays capable of detecting a number of secreted proteins in parallel, this technique has the potential to open a new window into cell secretions and how they influence neighboring cells.
Disclosures
We thank George Anderson for helpful comments and discussions. This work was supported by the Naval Research Laboratory’s Institute for Nanoscience and the National Research Council Research Associateship Award.
Acknowledgements
The authors have nothing to disclose.
Materials
| Name | Company | Catalog Number | Comments |
| 25 mm diameter glass coverslips | Bioscience Tools | CSHP-No1.5-25 | 170±5 µm is optimal |
| Poly-methyl methacrylate | Microchem | PMMA 950 A4 | |
| Ethyl lactate methyl metacrylate | Microchem | MMA EL6 | |
| Electron beam evaporator | Temescal | FC-2000 | |
| Electron beam lithography | Raith | Series 150 | |
| Ethanol | Sigma-Aldrich | 459836 | |
| Acetone | Sigma-Aldrich | 320110 | |
| CR-7 chromium etchant | Cyantek | CR-7 | |
| Scanning electron microscope | Zeiss | Ultra 55 | |
| Atomic force microscope | Veeco | Nanoscope III | |
| Plasma ashing system | Technics | Series 85 RIE | |
| SH-(CH2)8-EG3-OH (SPO) | Prochimia | TH 001-m8.n3-0.2 | |
| SH-(CH2)11-EG3-COOH (SPC) | Prochimia | TH 003m11n3-0.1 | |
| SH-(CH2)11-EG3-NH2 (SPN) | Prochimia | TH 002-m11.n3-0.2 | |
| Surface plasmon resonance system | Biorad | XPR36 | |
| Bare gold chip | Biorad | GLC chip | Plasma ashed to remove the monolayer |
| 1-Ethyl-3-(3-dimethylaminopropyl) carbodiimide | Thermo | 22980 | |
| N-hydroxysuccinimide (NHS) | Thermo | 24510 | |
| Pentylamine-Biotin | Thermo | 21345 | |
| Ethanolamine | Sigma-Aldrich | E9508 | |
| Neutraavidin | Thermo | 31000 | |
| Phosphate buffered saline | Thermo | 28374 | |
| Tween 20 | Sigma-Aldrich | P2287 | |
| Inverted microscope | Zeiss | Axio Observer | Microscope is equipped with 40X oil immersion objective; CO2 and humidity incubation from Pecon GmbH |
| CCD camera | Hamamatsu | Orca R2 | Thermoelectrically cooled (16 bit) |
| Spectrometer | Ocean Optics | QE65Pro | |
| Spectrasuite | Ocean Optics | version1.4 | |
| c-myc peptide HyNic Tag | Solulink | SP-E003 | |
| monoclonal anti-c-myc antibody | Sigma-Aldrich | M4439 | |
| Hybridoma cell line | ATCC | CRL-1729 | |
| Antibiotic Antimycotic Solution (100×) | Sigma-Aldrich | A5955 | |
| Serum free media RPMI 1640 | Invitrogen | 11835-030 | |
| Fetal bovine serum | ATCC | 30-2020 | |
| Rhodamine DHPE | Life Technologies | L-1392 |
References
- Ludwig, A. -. K., Giebel, B. Exosomes: Small vesicles participating in intercellular communication. The International Journal of Biochemistry & Cell Biology. 44, 11-15 (2012).
- Friedl, P., Gilmour, D. Collective cell migration in morphogenesis, regeneration and cancer. Nature Reviews Molecular Cell Biology. 10, 445-457 (2009).
- Letterio, J. J., Roberts, A. B. Regulation of immune responses by TGF-beta. Annual Review of Immunology. 16, 137-161 (1998).
- Werner, S., Grose, R. Regulation of wound healing by growth factors and cytokines. Physiological Reviews. 83, 835-870 (2003).
- Werner, S., Krieg, T., Smola, H. Keratinocyte-fibroblast interactions in wound healing. Journal of Investigative Dermatology. 127, 998-1008 (2007).
- Bailey, R. C., Kwong, G. A., Radu, C. G., Witte, O. N., Heath, J. R. DNA-encoded antibody libraries: A unified platform for multiplexed cell sorting and detection of genes and proteins. Journal of the American Chemical Society. 129, 1959-1967 (2007).
- Gazagne, A., et al. A Fluorospot assay to detect single T lymphocytes simultaneously producing multiple cytokines. Journal of Immunological Methods. 283, 91-98 (2003).
- Han, Q., et al. Polyfunctional responses by human T cells result from sequential release of cytokines. Proceedings of the National Academy of Sciences of the United States of America. 109, 1607-1612 (2012).
- Han, Q., Bradshaw, E. M., Nilsson, B., Hafler, D. A., Love, J. C. Multidimensional analysis of the frequencies and rates of cytokine secretion from single cells by quantitative microengraving. Lab on a Chip. 10, 1391-1400 (2010).
- Ma, C., et al. A clinical microchip for evaluation of single immune cells reveals high functional heterogeneity in phenotypically similar T cells. Nature Medicine. 17, 738-743 (2011).
- Shirasaki, Y., et al. Real-time single-cell imaging of protein secretion. Scientific Reports. 4, (2014).
- Milgram, S., et al. On chip real time monitoring of B-cells hybridoma secretion of immunoglobulin. Biosensors and Bioelectronics. 26, 2728-2732 (2011).
- Abbas, A., Linman, M. J., Cheng, Q. A. New trends in instrumental design for surface plasmon resonance-based biosensors. Biosensors & Bioelectronics. 26, 1815-1824 (2011).
- Ermakova, A., et al. Detection of a Few Metallo-Protein Molecules Using Color Centers in Nanodiamonds. Nano Letters. 13, 3305-3309 (2013).
- Haes, A. J., Van Duyne, R. P. A nanoscale optical blosensor: Sensitivity and selectivity of an approach based on the localized surface plasmon resonance spectroscopy of triangular silver nanoparticles. Journal of the American Chemical Society. 124, 10596-10604 (2002).
- Horowitz, V. R., Aleman, B. J., Christle, D. J., Cleland, A. N., Awschalom, D. D. Electron spin resonance of nitrogen-vacancy centers in optically trapped nanodiamonds. Proceedings of the National Academy of Sciences of the United States of America. 109, 13493-13497 (2012).
- Sepulveda, B., Angelome, P. C., Lechuga, L. M., Liz-Marzan, L. M. LSPR-based nanobiosensors. Nano Today. 4, 244-251 (2009).
- Barbillon, G., et al. Biological and chemical gold nanosensors based on localized surface plasmon resonance. Gold Bulletin. 40, 240-244 (2007).
- Endo, T., et al. Multiple label-free detection of antigen-antibody reaction using localized surface plasmon resonance-based core-shell structured nanoparticle layer nanochip. Analytical Chemistry. 78, 6465-6475 (2006).
- Endo, T., Kerman, K., Nagatani, N., Takamura, Y., Tamiya, E. Label-free detection of peptide nucleic acid-DNA hybridization using localized surface plasmon resonance based optical biosensor. Analytical Chemistry. 77, 6976-6984 (2005).
- Haes, A. J., Hall, W. P., Chang, L., Klein, W. L., Van Duyne, R. P. A localized surface plasmon resonance biosensor: First steps toward an assay for Alzheimer's disease. Nano Letters. 4, 1029-1034 (2004).
- Jonsson, M. P., Jonsson, P., Dahlin, A. B., Hook, F. Supported lipid bilayer formation and lipid-membrane-mediated biorecognition reactions studied with a new nanoplasmonic sensor template. Nano Letters. 7, 3462-3468 (2007).
- Park, J. H., et al. A regeneratable, label-free, localized surface plasmon resonance (LSPR) aptasensor for the detection of ochratoxin A.. Biosensors & Bioelectronics. 59, 321-327 (2014).
- Mayer, K. M., Hao, F., Lee, S., Nordlander, P., Hafner, J. H. A single molecule immunoassay by localized surface plasmon resonance. Nanotechnology. 21, (2010).
- Endo, T., Yamamura, S., Kerman, K., Tamiya, E. Label-free cell-based assay using localized surface plasmon resonance biosensor. Analytica Chimica Acta. 614, 182-189 (2008).
- Huang, Y. X., Cai, D., Chen, P. Micro- and Nanotechnologies for Study of Cell Secretion. Analytical Chemistry. 83, 4393-4406 (2011).
- Oh, B. R., et al. Integrated Nanoplasmonic Sensing for Cellular Functional Immunoanalysis Using Human Blood. ACS Nano. 8, 2667-2676 (2014).
- Raphael, M. P., Christodoulides, J. A., Delehanty, J. B., Long, J. P., Byers, J. M. Quantitative Imaging of Protein Secretions from Single Cells in Real Time. Biophysical Journal. 105, 602-608 (2013).
- Raphael, M. P., et al. A New Methodology for Quantitative LSPR Biosensing and Imaging. Analytical Chemistry. 84, 1367-1373 (2011).
- Raphael, M. P., et al. Quantitative LSPR imaging for biosensing with single nanostructure resolution. Biophysical Journal. 104, 30-36 (2013).
- Raphael, M. P., et al. A new methodology for quantitative LSPR biosensing and imaging. Analytical Chemistry. 84, 1367-1373 (2012).
- Henn, A. D., et al. Modulation of single-cell IgG secretion frequency and rates in human memory B cells by CpG DNA, CD40L, IL-21, and cell division. Journal of Immunology. 183, 3177-3187 (2009).
- Bramswig, K. H., et al. Soluble Carcinoembryonic Antigen Activates Endothelial Cells and Tumor Angiogenesis. Cancer Research. 73, 6584-6596 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved