Method Article
Tek Hücre Salgıları uzay-zamansal Görüntüleme için bir etiket içermeyen Tekniği
Bu Makalede
Özet
Arası hücresel iletişim içinde ve hücre dışında çeşitli fizyolojik aktiviteleri kontrol edilmesi için çok önemlidir. Bu kağıt tek hücre salgılarının uzay-zamansal yapısını ölçmek için bir protokol tanımlamaktadır. Bunu başarmak için, bir multidisipliner bir yaklaşım canlı hücre görüntüleme ile algılama etiket içermeyen nanoplasmonic entegre olan kullanılır.
Özet
Inter-cellular communication is an integral part of a complex system that helps in maintaining basic cellular activities. As a result, the malfunctioning of such signaling can lead to many disorders. To understand cell-to-cell signaling, it is essential to study the spatial and temporal nature of the secreted molecules from the cell without disturbing the local environment. Various assays have been developed to study protein secretion, however, these methods are typically based on fluorescent probes which disrupt the relevant signaling pathways. To overcome this limitation, a label-free technique is required.
In this paper, we describe the fabrication and application of a label-free localized surface plasmon resonance imaging (LSPRi) technology capable of detecting protein secretions from a single cell. The plasmonic nanostructures are lithographically patterned onto a standard glass coverslip and can be excited using visible light on commercially available light microscopes. Only a small fraction of the coverslip is covered by the nanostructures and hence this technique is well suited for combining common techniques such as fluorescence and bright-field imaging.
A multidisciplinary approach is used in this protocol which incorporates sensor nanofabrication and subsequent biofunctionalization, binding kinetics characterization of ligand and analyte, the integration of the chip and live cells, and the analysis of the measured signal. As a whole, this technology enables a general label-free approach towards mapping cellular secretions and correlating them with the responses of nearby cells.
Giriş
Inter-hücresel iletişim içinde ve hücre dışında hem birçok fizyolojik faaliyetlerin düzenlenmesi için çok önemlidir. Proteinlerin ve veziküller çeşitli daha sonra, farklılaşma, yara iyileşmesi, bağışıklık tepkisi, göç ve proliferasyon gibi kompleks hücresel süreçleri tetikler salgılanabilir. Hücre içi sinyal yollarının 1-5 arızaları kanseri, ateroskleroz da dahil olmak üzere pek çok bozukluklarda implike edilmiştir ve diyabet, birkaç isim.
Optimum hücre salgılama tahlili mekansal ve zamansal olarak ilgili sinyalizasyon yolları bozmadan ilgi salgılanan proteini eşleme kapasitesine sahip olmalıdır. Bu şekilde, konsantrasyon profilinin ve alıcı hücrelerin tepki arasındaki nedensel ilişki anlaşılabilir. Ne yazık ki, en yaygın olarak kullanılan floresan bazlı tekniklerin birçoğu bu kriterlere uymayan. Floresan füzyon proteinleri w analiti etiketlemek için kullanılabilirhücreyi ithin ancak salgı yolu bozabilir veya salgılanan eğer, ölçmek zordur hücrenin dışında yaygın kızdırma sonuçları. Floresan immunosandwich bazlı deneyler, hücresel salgıları tespit etmek için en sık kullanılan teknikler, ancak, tipik olarak, tek tek hücrelerin izolasyonunu gerektirir. Buna ek olarak, algılama antikoru verme tipik olarak durur veya deney ve antikor etiket büyüklüğü sona 6-11, 150 kDa IgG, aşağı sinyalizasyon bir engeldir.
Bu bariyerlerin bir etiket içermeyen bir teknik, görüntü proteini salgıları ve mevcut etiket içermeyen teknolojiler arasından kullanılan plazmon rezonans (SPR) yüzey lokalize yüzey plasmon rezonans (LSPR) sensörler iyi adaylardır tercih edilir çünkü. 12-17 Bu sensörleri yaygın proteinler, eksozom ve diğer biyo-analit bağlama çalışmaları için kullanılmıştır. 18-24 LSPR, plasmonik nanostr halindeuctures cam kapak slipleri lithographically desenli ve standart geniş alan mikroskopisi konfigürasyonlar yoluyla da görülebilir ışık kullanılarak heyecan edilebilir. Nedeniyle nano ayak izi, cam taban çoğunluğu 25-28. Böyle canlı hücre mikroskopi ile entegrasyon için uygun parlak alan ve iyi bu sondalar yapma floresan mikroskobu gibi yaygın görüntüleme teknikleri kullanılabilir Biz gerçek zamanlı ölçüm göstermiştir sırasıyla 225 msn ve 10 um, mekansal ve zamansal çözünürlükte Fonksiyonlu altın plasmonik nano kullanarak hibridoma hücrelerinden antikor sekresyonların. Temel çip konfigürasyonu Şekil 1 'de gösterilmiştir. 28 mikroskop çıkışı, ışık yolu görüntü için kullanılan bir CCD kamera ve nano belirli bir dizinin fraksiyonel doluluk (Şekil 2 nicel olarak belirlenmesi için bir fiber-optik açıdan bağlanmış spektrometre arasında bölünür ).
ProtocAynı anda standart aydınlık alan mikroskobu kullanarak hücrelerin tepkisini izlerken bu yazıda sunulan ol tek hücre salgılarının gerçek zamanlı ölçümü için deneysel tasarım açıklanır. Multidisipliner yaklaşım hücre çizgilerinin nano üretim, analitlerin yüksek afıniteli bağlanma için nano-fonksiyonalizasyonu, hem de non-spesifik bağlanma en aza indirilmesi ve ticari bir Yüzey Plazmon Rezonansı kullanarak hız sabitleri karakterize (SPR) enstrüman için bir yüzey optimizasyonu, entegrasyonu içerir substrat ve görüntü ve spektral verilerin analizi üzerine. Biz cep salgıları ve alıcı hücrelerle onların nedensel ilişkilerin uzay-zamansal haritalama için elverişli teknoloji olmak için bu tekniği tahmin ediyoruz.
Protokol
1. Nanoyapı Fabrikasyon
- Nano fabrikasyon için alt-tabakalar olarak 170 um (No. 1.5) yaklaşık bir kalınlığa sahip 25 mm çapında bir cam lamelleri seçin.
- En az 6 saat boyunca (bir sülfürik asit ve hidrojen peroksit 1 oranında 3) pirana çözeltisi içinde lamelleri bırakın. Ultra saf M 18.2 deiyonize saf su (DDW) bol miktarda piranha batırılmış lamel yıkayın.
DİKKAT: Piranha asit, organik maddelerle reaksiyona girerek şiddetle ve son derece dikkatli ele alınmalıdır. - E-ışın buharlaştırma yoluyla lamelleri Mevduat 10 nm krom ince film nanoyapıların örneklenmesinden ve görüntüleme sırasında şarj etkilerini önlemek için.
- Çift-katlı bir birinci tabaka 45 saniye boyunca 2000 rpm'de etil laktat, metil metakrilat (MMA_EL6) kopolimerden oluşan karşı Spin ve daha sonra 150 ° C'de pişirilir. Daha sonra 180 ° C'de fırında 45 saniye boyunca 3000 rpm'de poli-metil metakrilat (950PMMA_A2) ikinci katı dönerler.
- Pıtırtın iki tabakalı 300 uc / cm 2 'lik bir alan dozu ile 25 kV elektron demeti litografi (EBL) kullanarak direnmek. Izopropil alkol içinde geliştirir (IPA) / metil izobütil keton (MIBK): 01/02 ve IPA içinde durulayın.
- Mevduat Ti (5 nm) bir e-ışın buharlaştırıcı kullanılarak madde üzerinde / Au (80 nm) film.
- Altın birikimi ardından, kopolimer iki katmanlı 4 saat aseton substrat ıslatarak karşı kaldırın.
- Nanoyapı şekil ve boyutunu onaylamak için taramalı elektron mikroskobu (SEM) ile substrat inceleyin, oda sıcaklığında 60 saniye için CR-7 pürüzlendirici kullanarak ıslak etch yoluyla yüzeye kalan krom kaldırın ve sonra DDW içinde durulayın.
- Dizileri arasında hücre görüntüleme için odayı terk 33 mikron merkezden merkeze dizi aralığı tasarlayın. Desen bir e-ışın yazıcı kullanarak 300 nm sahada her dizi için 20 x 20 desen nanoyapılar. Her çip 80 ± 2.5 nm yüksekliğinde tipik bir nanoyapı boyutunda 300 diziler ve 70 ± 2.5 nm Diame içeriyorter.
- Boyut ve bütünlükte doğrulanması için atomik kuvvet mikroskobu (AFM) kullanarak dizilerin bir alt kümesini kontrol edin.
- UV kürleme epoksi kullanılarak lamel arkasına bir destek halkası, tipik olarak silikon takın.
2. Chip Temizlik ve Öz-montajlı Monolayer Uygulaması
- % 5 hidrojen, aynı koşullar altında 5 dakika boyunca temizleme odası sonra 45 saniye için% 95 bir argon 300 mTorr karışımı içinde 40 W bir güçte, temizlik ve fiş rejenere plazma kül için.
- 3 aşağıdakilerden oluşan iki bileşenli bir etanolik çözelti içinde tiol çip daldırarak hemen plazma külleme sonra, altın nano işlerlik: (CH2) SH- 1 oranında 8 -örn 3-OH (DPT) ve ya bir amin ile, bir bileşen, veya karboksil fonksiyonel grup, yani, SH- (CH2) 11 -örn 3-NH2 (spn) ya da SH- (CH2) 11 -örn 3-COOH (SPC).
- Chip i bırakınn tiol Çözelti O / N kendinden monte tek tabaka (SAM) oluşturulması için.
- Azot gazı ile etanol ve kuru ile çip durulayın.
- Gerekirse, 4 ° C 'de en fazla 2 hafta içinde işlevselleştirilmiş çip saklayın.
- Kullanıma hazır tercih ligand bağlı olarak kimyası kullanılarak bir ligant ile SPN'sini ya SPC bileşenini reaksiyona girerek (bakınız aşağıda).
Not: cips yeniden ve zaman yeniden Fonksiyonlu onlarca olabilir. Belirli bir çip 6 ay bir yıl boyunca değişir dönemler için de kullanılabilir. Belirli bir dizide ölçülen spektrumları güvenilir biofunctionalization ardından plazma külleme tarafından tekrarlanan Rejenerasyonlarda, sonra yeniden üretilir. 29
3. Yüzey Fonksiyonlandırma ve Kinetik Karakterizasyonu
Not: ligand ve analit arasındaki kinetik hız sabitlerini karakterize ticari SPR enstrüman fonksiyonlandırılmış çip kullanın, hem de non-spesifik b SAM direncini incelemek içinINDING. Verimli yüzey işlevsellik izin akış oranları ve mikroakışkan tasarımları geniş bir yelpazesi var. Biz piyasada mevcut SPR beri biz onun tavsiye debileri etrafında standardize. Biz, bu akış hızı, tüm SPR araçlarının tipiktir ve bu nedenle sınırlayıcı değildir olduğuna dikkat edilmelidir. Tüm fonksiyonlandırmalar LSPR yonga üzerinde doğrudan yapılabilir, ancak bir mültipleksli araçtır çünkü bizim LSPR mikroakışkan kurulum değil oysa bizim iş yükünü azaltmak yoktu çünkü SPR enstrüman bir zorunluluk değildir.
- Bölüm 2'de tarif edildiği gibi SAM ticari bir çıplak altın çip işlevselleştirilmesi.
- 133 1-etil-3- (3-dimetilaminopropil) karbodiimid mM (EDC) ve 33 DDW içinde N-hidroksisukinimid mM (NHS) için 10: 1 karışımı SPC göre SAM kullanılıyorsa, bir 1 karboksil grubunu aktive Min.
- 30 ul / dk'lık bir akış oranı kullanılarak 300 sn için ilgili antikor / ligand ile aktive edilmiş karboksil grubunu eşleniği. Ligantlar hazırlayınpH 6 fosfat tamponu, tipik olarak, ancak bu molekülün bağlı olarak değişebilir.
- Ligand konjüge edilmesinden sonra, 30 ul / dk'lık bir hızda 300 saniye süreyle bir deaktivatör adım olarak, fosfat-tamponlu salin (PBS) içinde 0.1 M etanolamin akar. Etanolamin spesifik olmayan bağlanma minimize yardımcı olur.
- Konsantrasyon aralığı kullanılarak 100 ul / dakikalık bir akış hızında ilgi analiti tanıtılması ve kinetik analiz yazılımı kullanılarak kinetik hız sabitleri hesaplar.
- Spesifik olmayan bağlanma, sorunlu ise, SPC veya SPN'sine DPT oranını arttırır.
4. LSPR Genel Ayarlar
- Mikroskop ayarları:
- Numuneyi aydınlatmak Koehler bir 100 W Halojen lamba kullanın. Rezonans kayması (Şekil 2) katkıda yok dalga boylarını ortadan kaldırmak için ışık yolu uzun bir pas filtresi (genellikle 593 nm kesme) kullanın.
- LSPRi veri toplama için, 40X yağ immersio bir ters mikroskop kullanmakn hedefi (1.4 NA) ve bir thermoelectrically 16 bit CCD kamera soğutmalı.
- Aynı anda Görüntülerini ve spektrumları elde etmek için mikroskop çıkış portuna bir ışın ayırıcı yerleştirin.
- 37 sıcaklık kontrollü mikroskop sahne C ° ve 4 saat için dengelenmeye.
- Sırasıyla% 5 ve% 95 CO 2 konsantrasyonu ve nem düzenleyen mikroskop ek kuluçka düzeneğini birleştirin.
- Chip hazırlanması ve montajı:
- SPR deneylerden belirlenen en uygun iki bileşenli SAM oranları, Bölüm 2 de tarif edildiği gibi LSPR çip işlevselleştirilmesi.
- Aşağıdaki gibi bir ısmarlama mikroakışkan tutucu içinde çip yükleyin. Bir alüminyum alt parçası üzerinde çipi yerleştirin. Bu alt parçası ve silikon conta ve şeffaf plastik üst parça arasındaki çip Sandwich. Derleme kelepçe 4 vidayı kullanın.
- 1 karışımı: Tipik bir SPC-tabanlı tiyol uygulaması için, bir 1 ul kat 300 damlaEDC 133 mM ve DDW NHS 33 mM Ture SPC tiyol bileşeninin karboksil grupları etkinleştirmek için.
- 10 dakika bekleyin ve elle 10 mM PBS ile yüzey durulama.
- Ligand çözeltisi 300 ul kaplama damla ilgi ligandı (tipik haliyle bir antikor ya da antikor fragmanı) ile aktive karboksil grubuna bağı içerir.
- 30 dakika bekleyin ve elle 10 mM PBS ile durulayın.
- Spesifik olmayan bağlanma en aza indirmek için bir çip üzerinde kat PBS içinde 0.1 M etanolamin 300 ul bırakın. 10 dakika boyunca bekleyin.
- PBS% 0.005 Tween 20 (PBS-T20) içeren etanolamin yıkayın.
- Değişen menisküs ilgili verilerin dalgalanmaları azaltmak için çip üzerinde bir kuvars parçası yerleştirin.
- Mikroskop monte ederken PBS-T20 tamponu ile ıslak çip tutun.
- Isıtmalı sahne numune tutucu içine sıkıca LSPR yonga takımını yerleştirin ve mikroakışkan tüp takın.
- Montaj ve akış met Mikroakiskan boru takınffer (veya hücre çalışmaları için serum özgür medya) kararlı bir duruma gelene kadar ulaşılır.
- Montaj ve mikroskop, en az 2 saat boyunca dengelenmeye bırakın.
- Merkez dizi spektroskopisi için fiber optik ile aynı hizada olacak şekilde joystick'i kullanarak çip hizalayın. Spektroskopik veri bir spektrometre ve spektral analiz yazılımı kullanılarak alınır.
- Yazılım otofokus, Zeiss Kesin Odaklama veya eşdeğer otofokus aygıtı kullanarak deney boyunca odak dizileri tutun.
9E10 hibridoma hücrelerinden anti-c-myc Salgıları 5. LSPR Görüntüleme
Not: Bu çalışma için kullanılan hibridoma hücre çizgisi, bir kimyasal tetikleyici gerektirmeyen yapısal olarak ve bu nedenle anti-c-myc antikoru eksprese
- C-myc peptidi ile nano işlerlik. Bu klon 9E10 hibridoma hücreleri tarafından salgılanan bir anti-c-myc antikorları için 1.77 nM'lik bir KD değerine sahiptir.
- Kültür tamamlandıktan hibridoma hücreleri% 5 CO2 altında 37 ° C 'de T75 şişesi içinde% 10 fetal sığır serumu (FBS) ve% 1 antibiyotik e büyüme ortamı. / Ml 4 x 10 5 hücre bir hücre yoğunluğuna koruyun.
- Hücre salgılama çalışmaları için, santrifüj ile T75 şişesi pelet hücreleri, salgılanan antikorların çıkarın ve 4 x 10 6 hücre / ml hücre yoğunluğunu ayarlamak için RPMI-1640 serumsuz vasat (SFM) ile iki kez yıkanır.
- LSPR cips onları tanıtan önce canlılığı hücreleri ve testi Hasat.
- Elle mikropipet ile LSPR cips üzerine hücre solüsyonu 50 ul tanıtın. Birkaç dakika sonra 25 ila 50 hücre LSPR fiş yüzeyine yapışır.
- Mikroakışkan perfüzyon sistemi kullanılarak taze SFM ile çözelti içinde kalan hücrelerin silsin.
- 10 mikron içinde yakın görüntüleme için LSPR diziler, seçin, ancak hücreleri ile örtüşmeyen.
- Sinyal salgılanan bir anti-c-myc antib özgü sağlamakOdies ve mevcut antikorlar olmayan ve antikorlar ile, ancak çözelti içinde, c-myc peptid ile doyurucu bir konsantrasyonu varlığı ile bloke bağlanma siteleri ile hücre kültür ortamı getirmektedir.
- Anti-c-myc antikorları (250 nM) ile doyurucu bir çözeltisi, her çalışma sonunda sensörler kalibre edin. Bu her çalışma biofunctionalization profiline göre fraksiyonel doluluk sensörleri yanıtını normale yardımcı olur ve belirler.
- Görüntü hizalama yazılımı kullanarak X ve Y yönünde sürüklenme düzeltin.
Sonuçlar
Tipik bir canlı hücre salgı çalışmasında yer alan veri toplama birden modları vardır. 3 kare diziler vurgular bir LSPRi görüntü bir bindirme göstermektedir, ve alt sol tarafındaki hücreyi vurgular iletilen ışık aydınlatılmış görüntü. Veriler, tipik olarak aşağıda tarif edilen normalleştirme hesaplanması için analit ile doyurucu bir çözüm getirilmesi ve ardından 3 saatlik bir süre boyunca toplanır. Floresan görüntüleri de bir filtre küp otomatik geçiş yoluyla veri toplama rutin entegre edilebilir. Şekil 4 floresan membran boya rodamin DHPE ile boyanmış bir hücre içinde lamellipodia benzeri uzantıları (oklar) sergiler. Böyle uzantıları dizileri ile üst üste olsaydı onlar protein salgılaması için yanlış pozitif verecekti. Görüntülerinin birden fazla modları olması gibi olaylar belirlemenize yardımcı olabilir.
Şekil 5 spektrometresi önce verileri ve kıç gösterirer satüre solüsyonunun koyulmasını ticari olarak c-myc fonksiyonalize diziler anti-c-myc antikorları satın alınan (400 nM). Resim hücreleri bu deneyde yer aldı. Spektrum kırmızı shift ve yoğunluğunda bir artış, hem görüntüler. İki eğri altındaki alanlar arasındaki fark CCD kamerada LSPRi modunda dizi görüntü yoğunluğunda bir artışa neden olur. Bir doğrusal olmayan en küçük kareler analizi yaklaşımı spektrumdan yüzeye bağlı ligandların fraksiyonel doluluk sonucuna geliştirilmiştir. 30,31
Deneyin sonunda, doymuş yoğunluk değerlerinin (fraksiyonel doluluk ≈ 1 örneğin) aşağıdaki formülü kullanarak her bir dizi için normalleştirilmiş bir yanıt hesaplamak için kullanılmıştır:
Zaman noktası t zaman noktasında t normalize şiddeti, deney, nihai doymuş yoğunluğu başında ilk şiddeti ve dizinin ölçülen yoğunluğu nerede , sırasıyla.
Iki dizi ile ilgili normalize değerleri Şekil 6'da gösterilmiştir. Bir dizi, bir kontrol olarak kullanılmıştır, diğer ise araştırılmaktadır hücrenin 10 um içinde olduğu hücreden 130 um'lik bir mesafe vardı. Kontrol dizisi düz yanıt hücre nisbetle en yakın dizinin normalize cevap ani artış, salgılanan antikorların lokalize bir patlamasının bir göstergesidir.
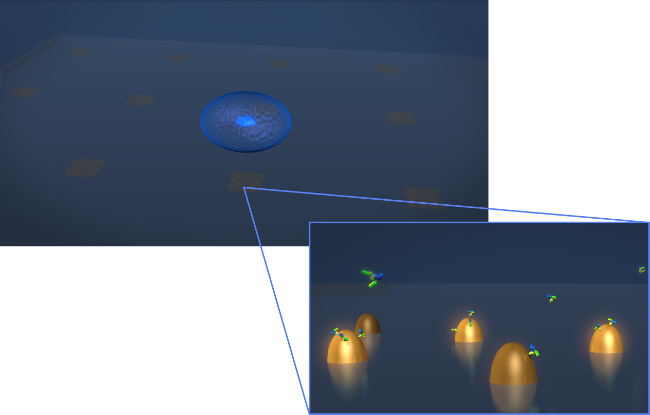
1. Sensör Tasarımı Şekil. Tipik bir canlı hücre salgılanması deneyi geometrisini tasvir. Hücre (mavi sfero) bir çizim biofunctionalized altın nano dizileri içerir LSPR çip üzerine yatırılır. Yüzeye bağlanan Y-şekilli moleküller olarak gösterilen bu durumda antikorlar yakınlaştırılmış görünümü, ilgi hücre salgılanması olarak ölçülürfonksiyonlandırılmış nanoyapıların. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
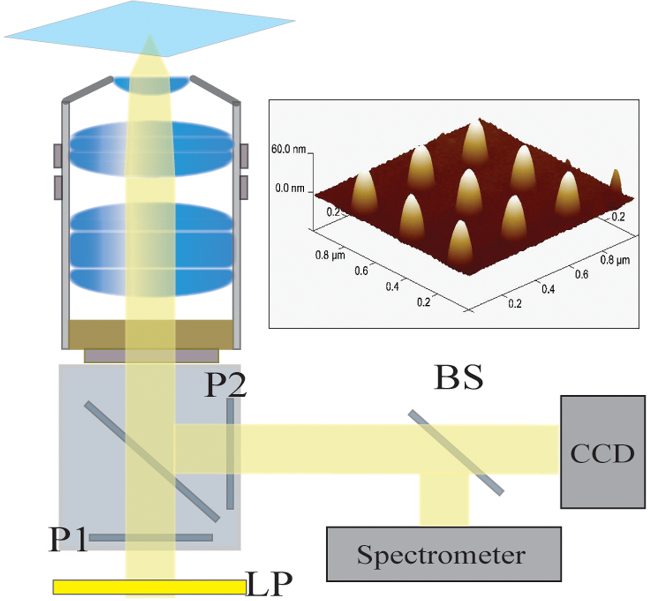
Şekil 2. Optik Kur. Bir halojen lambadan gelen ışık aydınlatılmış ilk uzun geçiş filtresi (LP) tarafından filtre edilir. Işık doğrusal (P1) polarize ve 40X / 1.4 NA objektif yoluyla numune aydınlatır edilir. Dağınık ışık bir çapraz polarize (P2) yoluyla objektif ile toplanır ve geçirilir. A 50/50 ışın ayırıcı (BS) eşzamanlı spektroskopik ve görüntülerinin analizi için toplanan ışık yoluna sokulur. Sağ Üst:. 300 nm sahada ayrılmış 9 ayrı nanoyapıların bir atomik kuvvet mikroskopisi görüntü tıklayınızBu rakamın büyük bir versiyonunu görmek için.
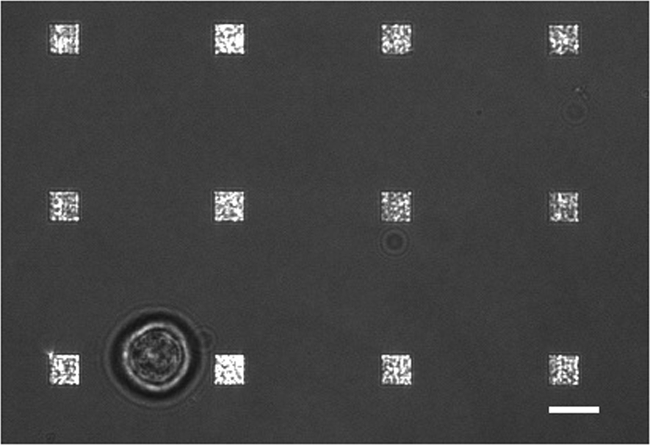
Şekil 3. Canlı Hücre LSPRi Çalışması. A 12 diziler çevrili tek bir hibridoma hücre (sol alt) gösteren iletilen ışık ve LSPRi görüntü birleşti. Bu kontrastlı görüntü. Ölçek çubuğu 10 mm. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
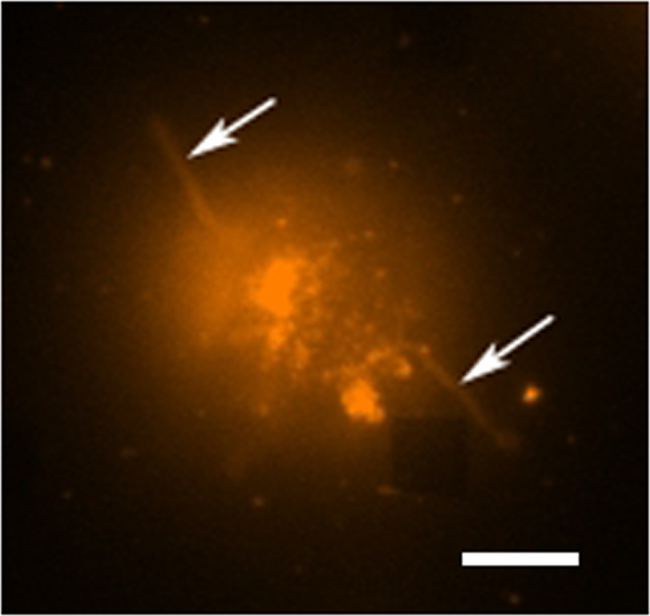
Şekil 4. Canlı Hücre Floresan Çalışması. Bir zar boya olan rhodamine DHPE, lekeli bir tek hibridoma hücresinin bir floresan sahte renkli görüntü. Diziler genellikle görünmeyen floresan görüntüleme modunda ise, yakındaki bir dizi ab burada gözlemlenebilirsağ alt köşedeki kare yoksundur. Hücre hücreleri (oklar) dışarı doğru uzanan dokunacı benzeri uzantıları (muhtemelen filopodia ya lamellipodia), ancak bir dizi ayrılmış olması görülebilir. Ölçek çubuğu 10 mm. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
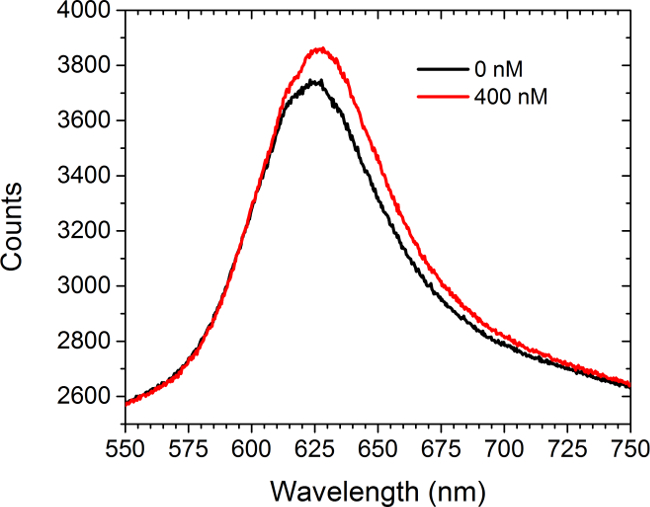
Şekil 5. Spektral Şekli. Öncesinde ve anti-c-myc antikor 400 nM çözeltisinin giriş sonra c-myc işlevselleştirilmiş diziden elde edilen spektrumlar. Hiçbir hücreleri bu çalışmada hazır bulundu. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Şekil 6. Tek Hücre salgılanması. 15, tek bir hücrenin um ve 130 mikron uzaklıkta bulunan bir (Kontrol) içinde bulunan bir dizi tepki. Ölçek çubuğu 10 mm. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Tartışmalar
The LSPR imaging technique described in this work has numerous advantages over more traditional methodologies for detecting cell secretions. First, the time resolution of our technique is on the order of seconds whereas the commercial alternative, an immunosandwhich assay known as EliSpot, has a typical time resolution of 2 to 3 days.7,32 As a result we were able to resolve sudden changes in the rate of protein secretion, such as that shown in Figure 6. Second, having arrays distributed over the chip allows for the secreted signal to be tracked in space and time which enables more rigorous comparisons to diffusion-based models of cell secretion. In addition, arrays like the control array shown in Figure 6 can be used to subtract out global changes in the image that typically arise from instrumental factors such as focus drift. Third, our technique requires no modification of the cells. If desired, the experiment can incorporate commonly used tags such as fluorescent proteins, but if there is concern that such tags may negatively affect cell viability or homeostasis the label-free nature of our approach does not require them. Fourth, using the spectroscopic data we have demonstrated that quantitative information regarding the fractional occupancy of surface bound ligands can be calculated.
There are numerous alternative methods to EBL for fabricating metallic nanoparticles. However, we have found that the EBL provides considerable flexibility for optimizing nanostructure and array dimensions to best suit the optics and the cells under investigation. Also critical is the fact that the chips can be readily regenerated by plasma ashing. In this way, a typical chip can be used dozens of times. Biofunctionalization details must be modified for the specific application. The protocol presented here conjugated the surface with relatively small c-myc peptide ligands. Larger ligands such as whole antibodies typically require more spacing and thus a higher SPO to SPN/SPC ratio. Regardless, a well formed SAM layer is essential for preventing non-specific binding in live-cell experiments. In general, larger molecular weight analytes are more readily detected by LSPR. Thus, in its single-cell manifestation, this technique may not be appropriate for detecting the secretion of small proteins, such as cytokines.
The current setup has been used for studying individual non-adherent cells. There are significant number of secreted signaling proteins and vesicles to which the results reported in this work are directly applicable. For example carcinoembryonic antigen (CEA) which for decades now has been a diagnostic marker for cancer. Colon cancer cells are known to secrete CEA at the rates of thousands of molecules/cell/hr and the molecular weight is 180 kDa which exceeds that of IgG antibodies. CEA is believed to be involved in autocrine and paracrine signaling pathways but the spatio-temporal nature of these secretions have never been measured. Our technique can directly address these signaling questions. An extension of this work will be to measure the spatio-temporal nature of CEA secretion from single cells.33 Future work will also focus on integrating LSPRi with two and three dimensional cell cultures of adherent cells. By incorporating multiplexed arrays capable of detecting a number of secreted proteins in parallel, this technique has the potential to open a new window into cell secretions and how they influence neighboring cells.
Açıklamalar
We thank George Anderson for helpful comments and discussions. This work was supported by the Naval Research Laboratory’s Institute for Nanoscience and the National Research Council Research Associateship Award.
Teşekkürler
The authors have nothing to disclose.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 25 mm diameter glass coverslips | Bioscience Tools | CSHP-No1.5-25 | 170±5 µm is optimal |
| Poly-methyl methacrylate | Microchem | PMMA 950 A4 | |
| Ethyl lactate methyl metacrylate | Microchem | MMA EL6 | |
| Electron beam evaporator | Temescal | FC-2000 | |
| Electron beam lithography | Raith | Series 150 | |
| Ethanol | Sigma-Aldrich | 459836 | |
| Acetone | Sigma-Aldrich | 320110 | |
| CR-7 chromium etchant | Cyantek | CR-7 | |
| Scanning electron microscope | Zeiss | Ultra 55 | |
| Atomic force microscope | Veeco | Nanoscope III | |
| Plasma ashing system | Technics | Series 85 RIE | |
| SH-(CH2)8-EG3-OH (SPO) | Prochimia | TH 001-m8.n3-0.2 | |
| SH-(CH2)11-EG3-COOH (SPC) | Prochimia | TH 003m11n3-0.1 | |
| SH-(CH2)11-EG3-NH2 (SPN) | Prochimia | TH 002-m11.n3-0.2 | |
| Surface plasmon resonance system | Biorad | XPR36 | |
| Bare gold chip | Biorad | GLC chip | Plasma ashed to remove the monolayer |
| 1-Ethyl-3-(3-dimethylaminopropyl) carbodiimide | Thermo | 22980 | |
| N-hydroxysuccinimide (NHS) | Thermo | 24510 | |
| Pentylamine-Biotin | Thermo | 21345 | |
| Ethanolamine | Sigma-Aldrich | E9508 | |
| Neutraavidin | Thermo | 31000 | |
| Phosphate buffered saline | Thermo | 28374 | |
| Tween 20 | Sigma-Aldrich | P2287 | |
| Inverted microscope | Zeiss | Axio Observer | Microscope is equipped with 40X oil immersion objective; CO2 and humidity incubation from Pecon GmbH |
| CCD camera | Hamamatsu | Orca R2 | Thermoelectrically cooled (16 bit) |
| Spectrometer | Ocean Optics | QE65Pro | |
| Spectrasuite | Ocean Optics | version1.4 | |
| c-myc peptide HyNic Tag | Solulink | SP-E003 | |
| monoclonal anti-c-myc antibody | Sigma-Aldrich | M4439 | |
| Hybridoma cell line | ATCC | CRL-1729 | |
| Antibiotic Antimycotic Solution (100×) | Sigma-Aldrich | A5955 | |
| Serum free media RPMI 1640 | Invitrogen | 11835-030 | |
| Fetal bovine serum | ATCC | 30-2020 | |
| Rhodamine DHPE | Life Technologies | L-1392 |
Referanslar
- Ludwig, A. -. K., Giebel, B. Exosomes: Small vesicles participating in intercellular communication. The International Journal of Biochemistry & Cell Biology. 44, 11-15 (2012).
- Friedl, P., Gilmour, D. Collective cell migration in morphogenesis, regeneration and cancer. Nature Reviews Molecular Cell Biology. 10, 445-457 (2009).
- Letterio, J. J., Roberts, A. B. Regulation of immune responses by TGF-beta. Annual Review of Immunology. 16, 137-161 (1998).
- Werner, S., Grose, R. Regulation of wound healing by growth factors and cytokines. Physiological Reviews. 83, 835-870 (2003).
- Werner, S., Krieg, T., Smola, H. Keratinocyte-fibroblast interactions in wound healing. Journal of Investigative Dermatology. 127, 998-1008 (2007).
- Bailey, R. C., Kwong, G. A., Radu, C. G., Witte, O. N., Heath, J. R. DNA-encoded antibody libraries: A unified platform for multiplexed cell sorting and detection of genes and proteins. Journal of the American Chemical Society. 129, 1959-1967 (2007).
- Gazagne, A., et al. A Fluorospot assay to detect single T lymphocytes simultaneously producing multiple cytokines. Journal of Immunological Methods. 283, 91-98 (2003).
- Han, Q., et al. Polyfunctional responses by human T cells result from sequential release of cytokines. Proceedings of the National Academy of Sciences of the United States of America. 109, 1607-1612 (2012).
- Han, Q., Bradshaw, E. M., Nilsson, B., Hafler, D. A., Love, J. C. Multidimensional analysis of the frequencies and rates of cytokine secretion from single cells by quantitative microengraving. Lab on a Chip. 10, 1391-1400 (2010).
- Ma, C., et al. A clinical microchip for evaluation of single immune cells reveals high functional heterogeneity in phenotypically similar T cells. Nature Medicine. 17, 738-743 (2011).
- Shirasaki, Y., et al. Real-time single-cell imaging of protein secretion. Scientific Reports. 4, (2014).
- Milgram, S., et al. On chip real time monitoring of B-cells hybridoma secretion of immunoglobulin. Biosensors and Bioelectronics. 26, 2728-2732 (2011).
- Abbas, A., Linman, M. J., Cheng, Q. A. New trends in instrumental design for surface plasmon resonance-based biosensors. Biosensors & Bioelectronics. 26, 1815-1824 (2011).
- Ermakova, A., et al. Detection of a Few Metallo-Protein Molecules Using Color Centers in Nanodiamonds. Nano Letters. 13, 3305-3309 (2013).
- Haes, A. J., Van Duyne, R. P. A nanoscale optical blosensor: Sensitivity and selectivity of an approach based on the localized surface plasmon resonance spectroscopy of triangular silver nanoparticles. Journal of the American Chemical Society. 124, 10596-10604 (2002).
- Horowitz, V. R., Aleman, B. J., Christle, D. J., Cleland, A. N., Awschalom, D. D. Electron spin resonance of nitrogen-vacancy centers in optically trapped nanodiamonds. Proceedings of the National Academy of Sciences of the United States of America. 109, 13493-13497 (2012).
- Sepulveda, B., Angelome, P. C., Lechuga, L. M., Liz-Marzan, L. M. LSPR-based nanobiosensors. Nano Today. 4, 244-251 (2009).
- Barbillon, G., et al. Biological and chemical gold nanosensors based on localized surface plasmon resonance. Gold Bulletin. 40, 240-244 (2007).
- Endo, T., et al. Multiple label-free detection of antigen-antibody reaction using localized surface plasmon resonance-based core-shell structured nanoparticle layer nanochip. Analytical Chemistry. 78, 6465-6475 (2006).
- Endo, T., Kerman, K., Nagatani, N., Takamura, Y., Tamiya, E. Label-free detection of peptide nucleic acid-DNA hybridization using localized surface plasmon resonance based optical biosensor. Analytical Chemistry. 77, 6976-6984 (2005).
- Haes, A. J., Hall, W. P., Chang, L., Klein, W. L., Van Duyne, R. P. A localized surface plasmon resonance biosensor: First steps toward an assay for Alzheimer's disease. Nano Letters. 4, 1029-1034 (2004).
- Jonsson, M. P., Jonsson, P., Dahlin, A. B., Hook, F. Supported lipid bilayer formation and lipid-membrane-mediated biorecognition reactions studied with a new nanoplasmonic sensor template. Nano Letters. 7, 3462-3468 (2007).
- Park, J. H., et al. A regeneratable, label-free, localized surface plasmon resonance (LSPR) aptasensor for the detection of ochratoxin A.. Biosensors & Bioelectronics. 59, 321-327 (2014).
- Mayer, K. M., Hao, F., Lee, S., Nordlander, P., Hafner, J. H. A single molecule immunoassay by localized surface plasmon resonance. Nanotechnology. 21, (2010).
- Endo, T., Yamamura, S., Kerman, K., Tamiya, E. Label-free cell-based assay using localized surface plasmon resonance biosensor. Analytica Chimica Acta. 614, 182-189 (2008).
- Huang, Y. X., Cai, D., Chen, P. Micro- and Nanotechnologies for Study of Cell Secretion. Analytical Chemistry. 83, 4393-4406 (2011).
- Oh, B. R., et al. Integrated Nanoplasmonic Sensing for Cellular Functional Immunoanalysis Using Human Blood. ACS Nano. 8, 2667-2676 (2014).
- Raphael, M. P., Christodoulides, J. A., Delehanty, J. B., Long, J. P., Byers, J. M. Quantitative Imaging of Protein Secretions from Single Cells in Real Time. Biophysical Journal. 105, 602-608 (2013).
- Raphael, M. P., et al. A New Methodology for Quantitative LSPR Biosensing and Imaging. Analytical Chemistry. 84, 1367-1373 (2011).
- Raphael, M. P., et al. Quantitative LSPR imaging for biosensing with single nanostructure resolution. Biophysical Journal. 104, 30-36 (2013).
- Raphael, M. P., et al. A new methodology for quantitative LSPR biosensing and imaging. Analytical Chemistry. 84, 1367-1373 (2012).
- Henn, A. D., et al. Modulation of single-cell IgG secretion frequency and rates in human memory B cells by CpG DNA, CD40L, IL-21, and cell division. Journal of Immunology. 183, 3177-3187 (2009).
- Bramswig, K. H., et al. Soluble Carcinoembryonic Antigen Activates Endothelial Cells and Tumor Angiogenesis. Cancer Research. 73, 6584-6596 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır