Method Article
טכניקה ללא תווית להדמית החלל-הזמן של פרשות תא בודדת
In This Article
Summary
תקשורת בין-תאית היא קריטית לשליטה בפעילות פיזיולוגית שונות בתוך ומחוץ לתא. מאמר זה מתאר פרוטוקול למדידת טבע מרחב ובזמן של הפרשות תא בודדות. כדי להשיג זאת, גישה רב תחומית המשלבת משמשת nanoplasmonic ללא תווית חישה עם הדמיה תא חי.
Abstract
Inter-cellular communication is an integral part of a complex system that helps in maintaining basic cellular activities. As a result, the malfunctioning of such signaling can lead to many disorders. To understand cell-to-cell signaling, it is essential to study the spatial and temporal nature of the secreted molecules from the cell without disturbing the local environment. Various assays have been developed to study protein secretion, however, these methods are typically based on fluorescent probes which disrupt the relevant signaling pathways. To overcome this limitation, a label-free technique is required.
In this paper, we describe the fabrication and application of a label-free localized surface plasmon resonance imaging (LSPRi) technology capable of detecting protein secretions from a single cell. The plasmonic nanostructures are lithographically patterned onto a standard glass coverslip and can be excited using visible light on commercially available light microscopes. Only a small fraction of the coverslip is covered by the nanostructures and hence this technique is well suited for combining common techniques such as fluorescence and bright-field imaging.
A multidisciplinary approach is used in this protocol which incorporates sensor nanofabrication and subsequent biofunctionalization, binding kinetics characterization of ligand and analyte, the integration of the chip and live cells, and the analysis of the measured signal. As a whole, this technology enables a general label-free approach towards mapping cellular secretions and correlating them with the responses of nearby cells.
Introduction
תקשורת בין-תאית חיונית להסדרת פעילויות רבות פיסיולוגיות הן בתוך ומחוץ לתא. מגוון של חלבונים ושלפוחית יכול להיות מופרש שלאחר מכן יפעיל תהליכים תאיים מורכבים כגון בידול, ריפוי פצעים, תגובה חיסונית, הגירה, והתפשטות. 1-5 תקלות של מסלולי איתות בין-תאיים היו מעורבות במספר רבה של הפרעות, כולל סרטן, טרשת עורקים , וסוכרת, עד כמה שם.
Assay הפרשת התא האופטימלי צריך להיות מסוגל מרחב ובזמן מיפוי החלבון המופרש של עניין מבלי לשבש את מסלולי איתות הרלוונטיים. בדרך זו קשרים סיבתיים בין פרופילי הריכוז והתגובה של התאים שקיבלו ניתן להסיק. למרבה הצער, רב של טכניקות המבוסס על ניאון הנפוץ ביותר אינו עומד בקריטריונים אלה. חלבוני היתוך פלורסנט יכולים לשמש כדי לתייג אנליטי within התא אבל יכול לשבש את מסלול ההפרשה, או אם מופרש, תוצאות בזוהר מפוזר מחוץ לתא שקשה לכמת. מבחני מבוססי immunosandwich ניאון הם הטכניקות הנפוצות ביותר לאיתור הפרשות סלולריות אך בדרך כלל דורשים הבידוד של תאים בודדים. 6-11 בנוסף, כניסתה של נוגדן החישה בדרך כלל עוצרת או מסיימת את הניסוי ואת הגודל של תוויות הנוגדן, 150 kDa עבור IgG, הוא מכשול לאיתות במורד הזרם.
בגלל המחסומים אלה עדיף שטכניקה ללא תווית להיות מנוצלת להפרשות חלבון תמונה ובין טכנולוגיות ללא תווית קיימות, משטח תהודת plasmon (SPR) והתהודה plasmon פני השטח מקומית חיישנים (LSPR) הם מועמדים מצוינים. 12-17 אלה חיישנים היו בשימוש נרחב ללימודים מחייבים אנליטי של חלבונים, exosomes וסמנים ביולוגיים אחרים. 18-24 במקרה של LSPR, nanostr plasmonicuctures ניתן בדוגמת lithographically על coverslips זכוכית ונרגש באמצעות אור נראה דרך תצורות מיקרוסקופ שדה רחב סטנדרטיים. בשל טביעת רגל ננו, רוב מצע הזכוכית זמין עבור טכניקות הדמיה נפוצות כגון שדה בהיר ומיקרוסקופ פלואורסצנטי ביצוע בדיקות אלה גם מתאים לשילוב עם מיקרוסקופ לחיות תאים. 25-28 אנחנו הוכחנו מדידה בזמן אמת הפרשות נוגדנים מתאי hybridoma באמצעות ננו plasmonic זהב פונקציונליות עם החלטות מרחב ובזמן של 225 אלפיות שני ו -10 מיקרומטר, בהתאמה. תצורת השבב הבסיסית מתוארת באיור 1. 28 נתיב פלט האור של המיקרוסקופ הוא פיצול בין מצלמת CCD המשמשת להדמיה וספקטרומטר בשילוב סיבים אופטי-לקביעה כמותית של התפוסה החלקית של מערך נתון של ננו (איור 2 ).
Protocol מוצג במאמר זה מתאר את תכנון הניסוי למדידת הפרשות תא בודדים בזמן אמת תוך מעקב התגובה של התאים באמצעות מיקרוסקופ השדה בהיר הסטנדרטי בו-זמנית. גישה רב תחומית כוללת ייצור של ננו, functionalization של ננו לזיקה הגבוהה המחייבת של analytes, אופטימיזציה משטח לשני מכשיר מזעור מחייב שאינו ספציפי ואפיון קבועי קצב קינטית באמצעות משטח מסחרי Plasmon תהודה (SPR), שילוב של שורות תאים על גבי המצע, והניתוח של דימויים ונתוני רפאים. אנו צופים בטכניקה זו כדי להיות טכנולוגיה המאפשרת למיפוי המרחב ובזמן של הפרשות תא והקשרים סיבתיים שלהם עם תאים מקבלים.
Protocol
ייצור ננו-מבנה 1.
- בחר 25 מ"מ coverslips זכוכית קוטר עם עובי משוער של 170 מיקרומטר (מס '1.5) כמצעים לnanofabrication.
- לטבול את coverslips בפתרון פיראניה (3: 1 יחס של חומצה גופרתית ומי חמצן) במשך לפחות 6 שעות. לשטוף את coverslip הספוג פיראניה עם כמות עצומה של ultrapure 18.2 MΩ deionized מים מזוקקים (DDW).
זהירות: חומצת Piranha מגיבה באלימות עם חומרים אורגניים ויש לטפל בם בזהירות רבה. - סרט דק הפקדת 10 ננומטר כרום על coverslips על ידי אידוי קורה אלקטרוני כדי למנוע תופעות תשלום בדפוסים וההדמיה של ננו.
- ספין את השכבה הראשונה של bilayer להתנגד בהיקף של methacrylate מתיל אתיל חומצת החלב קופולימר (MMA_EL6) ב 2000 סל"ד במשך 45 שניות ולאחר מכן לאפות ב 150 מעלות צלזיוס. ספין השכבה השנייה של methacrylate פולי-מתיל (950PMMA_A2) בסל"ד 3000 במשך 45 שניות ולאחר מכן לאפות ב 180 מעלות צלזיוס.
- לַהַגn להתנגד bilayer באמצעות קרן אלקטרונים ליתוגרפיה (EBL) ב 25 ק עם מינון שטח של 300 μC / 2 סנטימטר. לפתח באלכוהול איזופרופיל / קטון (IPA) מתיל isobutyl (MIBK): 2/1 ולשטוף בIPA.
- ההפקדה Ti (5 ננומטר) / סרט Au (80 ננומטר) על המצע באמצעות מאייד קורה אלקטרוני.
- בעקבות תצהיר הזהב, להרים את bilayer קופולימר להתנגד ידי השרייה המצע באצטון במשך 4 שעות.
- בדוק את המצע באמצעות מיקרוסקופ האלקטרונים הסורק (SEM) כדי לאשר צורת ננו-מבנה וגודל, להסיר את הכרום שנותר מהמצע באמצעות לחרוט רטוב באמצעות CR-7 etchant עבור 60 שניות ב RT ולאחר מכן לשטוף בDDW.
- עיצוב מרווח מערך מרכז למרכז 33 מיקרומטר להשאיר מקום להדמית תא בין מערכים. תבנית ננו 20 x 20 תבנית לכל מערך עם המגרש של 300 ננומטר באמצעות סופר קורה אלקטרוני. כל שבב מכיל 300 מערכים עם ממד ננו-מבנה אופייני לגובה 80 ± 2.5 ננומטר ו -70 ננומטר ± diame 2.5ter.
- בדוק משנה של מערכים באמצעות מיקרוסקופ הכוח האטומי (AFM) עבור האימות של גודל ואחידות.
- צרף טבעת תמיכה, בדרך כלל סיליקון, לחלק האחורי של coverslip באמצעות אפוקסי ריפוי UV.
2. שבב ניקוי ויישום של חד שכבתי התאסף עצמית
- לניקוי והתחדשות השבבים, אפר פלזמה בכוח של 40 וואט בתערובת 300 mTorr של מימן 5%, ארגון 95% במשך 45 שניות לאחר ניקוי התא למשך 5 דקות באותם תנאים.
- Functionalize ננו הזהב מייד לאחר ashing הפלזמה ידי טבילת השבב בפתרון תיאול האתנולית שני מרכיבים המורכב של יחס 3: 1 של SH- (CH 2) 8 -EG 3 אה (SPO) ורכיב עם או אמין או קבוצה פונקציונלית carboxyl, כלומר, SH- (CH 2) 11 -EG 3 -NH 2 (SPN) או SH- (CH 2) 11 -EG 3 -COOH (SPC).
- השאר אותי השבבn O פתרון תיאול / N כדי ליצור monolayer עצמית התאספו (SAM).
- יש לשטוף את השבב עם אתנול ויבש עם גז חנקן.
- במידת הצורך, לאחסן השבב פונקציונליות של עד 2 שבועות על 4 מעלות צלזיוס.
- כשמוכן לשימוש להגיב SPN או רכיב SPC עם יגנד באמצעות כימיה בהתאם ליגנד של בחירה (ראה להלן).
הערה: יכולים להיות מחדש השבבים ועשרות-פונקציונליות מחדש של פעמים. שבב נתון יכול לשמש לתקופות שנעות בין 6 חודשים ליותר משנה. הספקטרום נמדד על מערך נתונה לשכפל באופן מהימן לאחר regenerations חוזר ונשנה של ashing פלזמה, ואחריו biofunctionalization. 29
3. Functionalization השטח וקינטי אפיון
הערה: השתמש בשבב פונקציונליות במכשיר SPR המסחרי לאפיין את קבועי קצב הקינטית בין יגנד ואנליטי, כמו גם ללמוד את ההתנגדות של סם ב הלא ספציפיinding. יש מגוון רחב של ספיקות ועיצובי microfluidic המאפשרים functionalization משטח יעיל. מאז יש לנו SPR זמין מסחרי שטופלנו סביב ספיקות המומלצות. נציין כי ספיקות אלה הן אופייניות לכל מכשירי SPR ולכן הם לא מגבילים. מכשיר SPR הוא לא הכרח שכן כל functionalization יכול להתבצע ישירות על שבב LSPR, אבל זה לא להפחית עומס העבודה שלנו כי זה מכשיר מרובב ואילו הגדרת microfluidic LSPR שלנו היא לא.
- Functionalize שבב זהב חשוף מסחרי עם SAM כפי שתואר בסעיף 2.
- אם באמצעות SAM מבוסס SPC, להפעיל את קבוצת carboxyl עם 1: 1 תערובת של 133 מ"מ של 1-אתיל-3 (3-dimethylaminopropyl) carbodiimide (EDC) ו -33 מ"מ של -hydroxysuccinimide N (NHS) בDDW 10 דקות.
- להטות קבוצת carboxyl מופעלת עם הנוגדן / יגנד של עניין עבור 300 שניות באמצעות קצב זרימה של 30 μl / דקה. הכן את הליגנדים בpH 6 חיץ פוספט, בדרך כלל, אבל זה יכול להשתנות בהתאם למולקולה.
- לאחר נטיה ליגנד, לזרום 0.1 M ethanolamine בנאגר מלוח פוספט (PBS) כצעד deactivator עבור 300 שניות בשיעור של 30 μl / דקה. Ethanolamine מסייע במזעור המחייב שאינו ספציפית.
- להציג אנליטי של ריבית בקצב זרימה של 100 μl / דקה באמצעות מגוון של ריכוזים ולחשב את קבועי קצב קינטית באמצעות תוכנת ניתוח קינטית.
- אם אינו ספציפי מחייב הוא בעייתי, להגדיל את היחס של SPO לSPC או SPN.
4. LSPR הגדרות כלליות
- הגדרות מיקרוסקופ:
- השתמש במנורת הלוגן W 100 לקוהלר להאיר את המדגם. השתמש במסנן מסירה ארוך (בדרך כלל 593 הפסקת ננומטר) בנתיב האור לחסל אורכי גל שאינו תורם לשינוי התהודה (איור 2).
- לאיסוף נתונים LSPRi, להשתמש במיקרוסקופ הפוכה עם immersio שמן 40Xמטרת n (1.4 NA) וthermoelectrically מקורר מצלמת CCD 16 ביט.
- הנח מפצל קרן ביציאת הפלט של מיקרוסקופ כדי להשיג תמונות וספקטרום בו-זמנית.
- הגדר את הבמה מיקרוסקופ טמפרטורה מבוקרת עד 37 ° C ולאזן במשך 4 שעות.
- לשלב הרכבה דגירה נוספת על מיקרוסקופ כדי להסדיר את ריכוז CO 2 ולחות של 5% ו -95%, בהתאמה.
- הכנת שבב והרכבה:
- Functionalize שבב LSPR כפי שתואר בסעיף 2 ביחסי SAM אופטימלי שני המרכיבים נקבעו מהניסויים SPR.
- טען את השבב בתוך מחזיק microfluidic מותאם אישית כדלקמן. מניחים את השבב על חתיכה תחתונה אלומיניום. כריך השבב בין זה חתיכה תחתונה ואטם סיליקון וחתיכה עליונה פלסטיק שקופה. השתמש 4 ברגים כדי להדק את ההרכבה.
- ליישום תיאול מבוסס SPC טיפוסי, שחרר מעיל 300 μl 1: לערבב 1ture של 133 מ"מ של EDC ו -33 מ"מ של NHS בDDW להפעיל קבוצות carboxyl של רכיב תיאול SPC.
- חכה 10 דקות ולשטוף באופן ידני את פני השטח עם 10 מ"מ PBS.
- להטות קבוצת carboxyl מופעלת עם יגנד (בדרך כלל שבר נוגדנים או נוגדן) של ריבית על ידי ירידת ציפוי 300 μl של פתרון ליגנד.
- חכה 30 דקות ולשטוף באופן ידני עם 10 מ"מ PBS.
- זרוק מעיל 300 μl של 0.1 מ 'ethanolamine בPBS על השבב כדי למזער מחייב ספציפי. חכה 10 דקות.
- שטוף את ethanolamine עם PBS המכיל 0.005% Tween 20 (PBS-T20).
- מניחים פיסה מעל השבב קוורץ להפחית תנודות בנתונים הקשורים להמניסקוס שינוי.
- שמור את השבב רטוב עם חיץ PBS-T20 תוך גובר על מיקרוסקופ.
- הנח את מכלול שבב LSPR בחוזקה לבעל מדגם במה המחומם ולצרף צינורות microfluidic.
- לצרף את צינורות מיקרופלואידיקה לbu ההרכבה והזרימהffer (או מדיה סרום חופשית ללימודי תא) עד למצב יציב הוא הגיע.
- לאפשר ההרכבה ומיקרוסקופ כדי לאזן לפחות 2 שעות.
- יישר את השבב באמצעות ג'ויסטיק, כך שהמערך המרכזי מיושר עם הסיבים האופטיים לספקטרוסקופיה. נתונים ספקטרוסקופיות נלקחים באמצעות ספקטרומטר ותוכנת ניתוח ספקטרלי.
- שמור מערכים בפוקוס לאורך הניסוי באמצעות תוכנת פוקוס אוטומטי, פוקוס Definite Zeiss או מכשיר אוטומטי שווה ערך.
5. הדמיה LSPR של פרשות אנטי-c-myc מ9E10 תאי Hybridoma
הערה: קו תא hybridoma משמש למחקר זה להביע נוגדן אנטי c-myc constitutively ולכן אינו דורש הדק כימי
- Functionalize ננו עם פפטיד c-myc. יש לכך ערך K D של 1.77 ננומטר לנוגדנים אנטי-c-myc מופרשים על ידי שיבוט 9E10 תאי hybridoma.
- תרבות תאי hybridoma בcompletמדיום גידול דואר עם 10% בסרום שור עוברי (FBS) ואנטיביוטיקת 1% בבקבוק T75 ב 37 מעלות צלזיוס מתחת 5% CO 2. לשמור על צפיפות תאים של 4 × 10 5 תאים / מיליליטר.
- למחקרי הפרשת תא, תאים גלולה מהבקבוק T75 ידי צנטריפוגה, לשטוף פעמיים עם RPMI-1640 מדיה סרום חופשית (SFM) כדי להסיר את הנוגדנים המופרשים ולהתאים את צפיפות תאי 4 × 10 6 תאים / מיליליטר.
- קציר התאים ובדיקת כדאיויות לפני מציג אותם לשבבי LSPR.
- להציג את 50 μl של פתרון התא באופן ידני על גבי שבבי LSPR עם micropipette. אחרי כמה דקות 25 עד 50 תאים לדבוק פני השטח של שבבי LSPR.
- לשטוף את התאים שנותרו בפתרון עם SFM הטרי באמצעות מערכת זלוף microfluidic.
- בחר את מערכי LSPR הדמיה שהם קרובים, בתוך 10 מיקרומטר, אך לא חופף עם התאים.
- כדי להבטיח שהאות היא ספציפית לantib אנטי c-myc מופרשodies להציג תקשורת תרבות תא עם ובלי הנוגדנים הנוכחיים, כמו גם עם הנוגדנים אבל עם אתרי הקישור שלהם נחסמו על ידי הנוכחות של ריכוז להרוות של פפטיד c-myc בפתרון.
- לכייל את החיישנים בסוף כל סיבוב עם פתרון להרוות של נוגדנים אנטי-c-myc (250 ננומטר). זה עוזר בנרמול התגובה של החיישנים ולקבוע התפוסה חלקית המבוססת על פרופיל biofunctionalization של כל ריצה.
- תקן את הסחף בכיוון X ו- Y באמצעות תוכנת יישור תמונה.
תוצאות
במחקר שנערך הפרשת תא חי טיפוסי יש מצבים רבים של איסוף נתונים מתרחש. איור 3 מראה כיסוי של תמונת LSPRi, אשר מדגישה את המערכים רבועים, ותמונה מוארת אור מועבר אשר מדגישה את התא בפינה השמאלית תחתונה. הנתונים נאספים בדרך כלל על פני תקופה של 3 שעות ואחרי ההקדמה של פתרון להרוות של אנליטי לחישוב הנורמליזציה המתואר להלן. דימויי הקרינה יכולים גם להיות משולבים בשגרת איסוף נתונים על ידי המיתוג האוטומטי של קוביית מסנן. באיור 4 תא מוכתם בDHPE rhodamine צבע קרום הניאון מציג סיומות כמו lamellipodia (חיצים). אם הרחבות כאלה היו חפיפה עם המערכים הם היו נותנים חיוביים שגויים להפרשת חלבון. יש מצבים רבים של דימויים יכול לעזור לזהות מקרים כאלה.
איור 5 מראה נתונים ספקטרומטריית לפני ומאחוראה ההקדמה של פתרון להרוות (400 ננומטר) של לרכוש מסחרי נוגדנים נגד c-myc למערכים פונקציונליות c-myc. לא תאים נכחו בניסוי זה. הספקטרום מציג שני משמרות אדומות ועלייה בעוצמת. ההבדל בין האזורים בשתי עקומות תוצאות בעלייה בעוצמת תמונת המערך במצב LSPRi על מצלמת CCD. גישת ניתוח נתונים ריבועים פחותים שאינו ליניארי פותחה כדי להסיק התפוסה חלקית של ligands משטח מחויב מהספקטרום. 30,31
בסוף הניסוי, את ערכי העצמה רוויה (כלומר, ≈ תפוסת השבר 1) משמשים לחישוב תגובה מנורמלת עבור כל מערך באמצעות הנוסחה הבאה:
איפה עוצמה המנורמלת בt נקודת הזמן, עוצמת ראשונית בתחילת הניסוי, עוצמת רוויה סופית, ועוצמת נמדדת של המערך בt נקודת הזמן , בהתאמה.
ערכים מנורמלים משני מערכים מוצגים באיור 6. מערך אחד היה בתוך 10 מיקרומטר של התא תחת חקירה ואילו השני, המשמש כביקורת, היה במרחק של 130 מיקרומטר מהתא. העלייה הפתאומית בתגובה המנורמלת של המערך הקרוב ביותר לתא ביחס לתגובה השטוחה של מערך הבקרה מעידה על התפרצות מקומית של נוגדנים מופרשים.
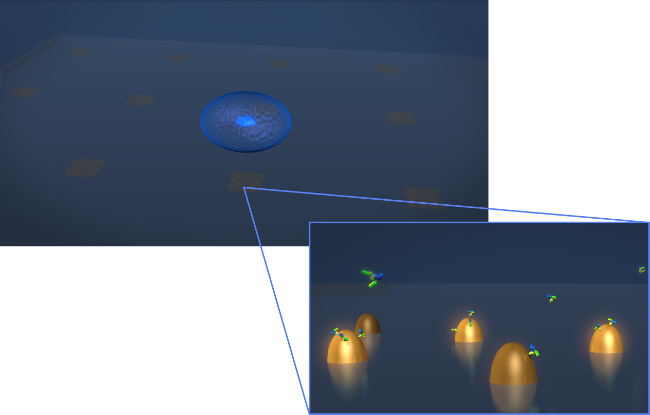
איור 1. חיישן עיצוב. ציור המתאר את הגיאומטריה של ניסוי הפרשת תא חי טיפוסי. התא (אליפטית הכחולה) מופקד על שבב LSPR המכיל מערכים של ננו זהב biofunctionalized. בתצוגה המוגדלת-ב, הפרשת התא של עניין, במקרה נוגדנים זה מוצגים כמולקולות בצורת אות V, נמדד כהם נקשרים אל פני השטחשל ננו פונקציונליות. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
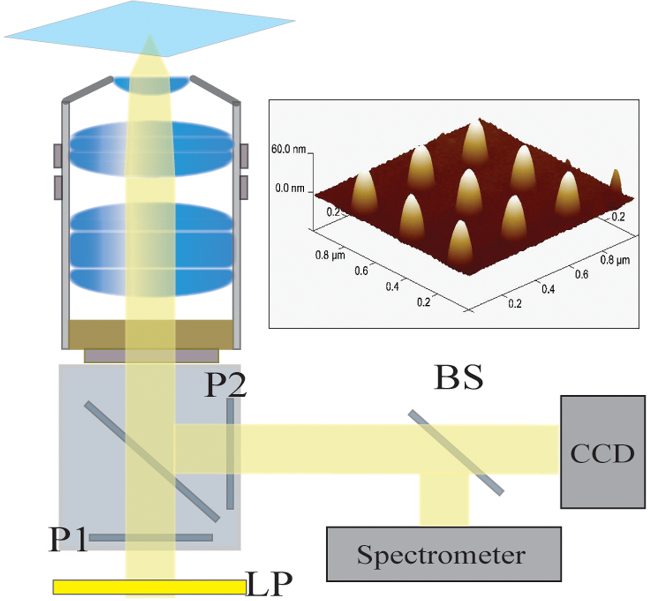
איור 2. התקנה אופטית. האור האיר ממנורת הלוגן מסונן ראשון על ידי מסנן מסירה ארוכה (LP). האור מקוטב ליניארית (P1) ומאיר את המדגם באמצעות אובייקטיבי NA 40X / 1.4. האור המפוזר נאסף על ידי המטרה ועבר דרך מקטב חצה (P2). מפצל 50/50 קרן (BS) מוכנס לתוך נתיב האור שנאסף לספקטרוסקופיות בו זמנית וניתוח הדמיה. למעלה מימין:. תמונה מיקרוסקופית כוח אטומית של 9 ננו הבודד מופרד על ידי המגרש של 300 ננומטר אנא לחץ כאןכדי לצפות בגרסה גדולה יותר של דמות זו.
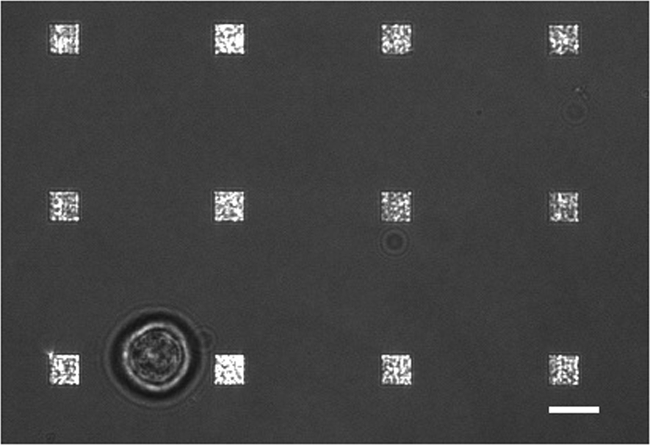
איור 3. תא חי LSPRi לימוד. התמזג אור מועבר ותמונת LSPRi מראה תא בודד hybridoma (שמאלי תחתון) מוקף 12 מערכים. זוהי תמונת ניגודיות משופרת. סרגל קנה מידה הוא 10 מיקרומטר. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
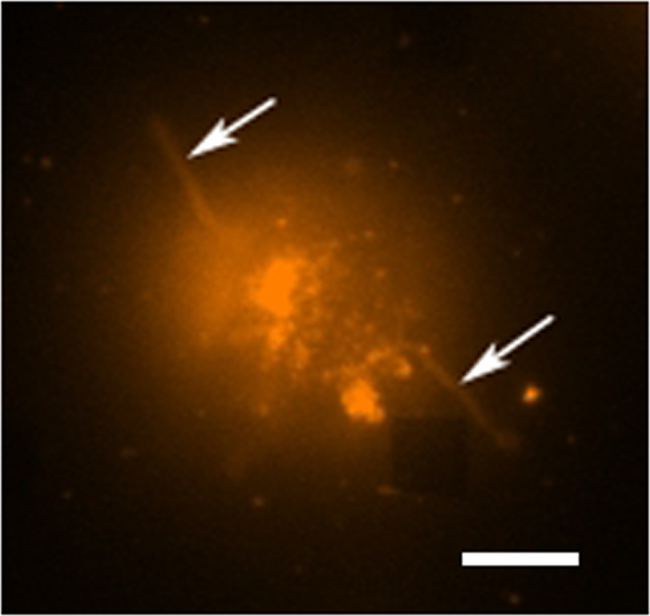
איור 4. תא חי פלואורסצנטי הלימוד. תמונה צבעונית שווא ניאון של תא hybridoma אחת מוכתם בDHPE rhodamine, שהוא צבע קרום. במצב הדמיה ניאון המערכים הם בדרך כלל לא נראים לעין, עם זאת, מערך סמוך הוא לצפייה כאן כabחסרים כיכר בפינה הימנית התחתונה. התא ניתן לראות להיות מופרד מהמערך למרות סיומות כמו זרוע (אולי filopodia או lamellipodia) מאריכים החוצה מהתאים (חיצים). סרגל קנה מידה הוא 10 מיקרומטר. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
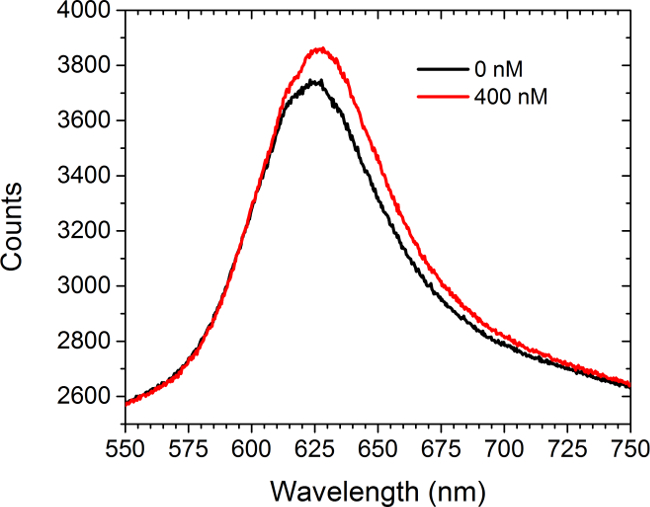
איור 5. Spectral לערוץ. הספקטרום המתקבל ממערך פונקציונליות c-myc לפני ואחרי כניסתה של 400 ננומטר פתרון של נוגדנים אנטי-c-myc. לא תאים נכחו במחקר זה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 6. הפרשת תא בודדת. התגובה של מערך ממוקם בתוך 15 מיקרומטר של תא בודד ואחד הממוקם במרחק 130 מיקרומטר (בקרה). סרגל קנה מידה הוא 10 מיקרומטר. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Discussion
The LSPR imaging technique described in this work has numerous advantages over more traditional methodologies for detecting cell secretions. First, the time resolution of our technique is on the order of seconds whereas the commercial alternative, an immunosandwhich assay known as EliSpot, has a typical time resolution of 2 to 3 days.7,32 As a result we were able to resolve sudden changes in the rate of protein secretion, such as that shown in Figure 6. Second, having arrays distributed over the chip allows for the secreted signal to be tracked in space and time which enables more rigorous comparisons to diffusion-based models of cell secretion. In addition, arrays like the control array shown in Figure 6 can be used to subtract out global changes in the image that typically arise from instrumental factors such as focus drift. Third, our technique requires no modification of the cells. If desired, the experiment can incorporate commonly used tags such as fluorescent proteins, but if there is concern that such tags may negatively affect cell viability or homeostasis the label-free nature of our approach does not require them. Fourth, using the spectroscopic data we have demonstrated that quantitative information regarding the fractional occupancy of surface bound ligands can be calculated.
There are numerous alternative methods to EBL for fabricating metallic nanoparticles. However, we have found that the EBL provides considerable flexibility for optimizing nanostructure and array dimensions to best suit the optics and the cells under investigation. Also critical is the fact that the chips can be readily regenerated by plasma ashing. In this way, a typical chip can be used dozens of times. Biofunctionalization details must be modified for the specific application. The protocol presented here conjugated the surface with relatively small c-myc peptide ligands. Larger ligands such as whole antibodies typically require more spacing and thus a higher SPO to SPN/SPC ratio. Regardless, a well formed SAM layer is essential for preventing non-specific binding in live-cell experiments. In general, larger molecular weight analytes are more readily detected by LSPR. Thus, in its single-cell manifestation, this technique may not be appropriate for detecting the secretion of small proteins, such as cytokines.
The current setup has been used for studying individual non-adherent cells. There are significant number of secreted signaling proteins and vesicles to which the results reported in this work are directly applicable. For example carcinoembryonic antigen (CEA) which for decades now has been a diagnostic marker for cancer. Colon cancer cells are known to secrete CEA at the rates of thousands of molecules/cell/hr and the molecular weight is 180 kDa which exceeds that of IgG antibodies. CEA is believed to be involved in autocrine and paracrine signaling pathways but the spatio-temporal nature of these secretions have never been measured. Our technique can directly address these signaling questions. An extension of this work will be to measure the spatio-temporal nature of CEA secretion from single cells.33 Future work will also focus on integrating LSPRi with two and three dimensional cell cultures of adherent cells. By incorporating multiplexed arrays capable of detecting a number of secreted proteins in parallel, this technique has the potential to open a new window into cell secretions and how they influence neighboring cells.
Disclosures
We thank George Anderson for helpful comments and discussions. This work was supported by the Naval Research Laboratory’s Institute for Nanoscience and the National Research Council Research Associateship Award.
Acknowledgements
The authors have nothing to disclose.
Materials
| Name | Company | Catalog Number | Comments |
| 25 mm diameter glass coverslips | Bioscience Tools | CSHP-No1.5-25 | 170±5 µm is optimal |
| Poly-methyl methacrylate | Microchem | PMMA 950 A4 | |
| Ethyl lactate methyl metacrylate | Microchem | MMA EL6 | |
| Electron beam evaporator | Temescal | FC-2000 | |
| Electron beam lithography | Raith | Series 150 | |
| Ethanol | Sigma-Aldrich | 459836 | |
| Acetone | Sigma-Aldrich | 320110 | |
| CR-7 chromium etchant | Cyantek | CR-7 | |
| Scanning electron microscope | Zeiss | Ultra 55 | |
| Atomic force microscope | Veeco | Nanoscope III | |
| Plasma ashing system | Technics | Series 85 RIE | |
| SH-(CH2)8-EG3-OH (SPO) | Prochimia | TH 001-m8.n3-0.2 | |
| SH-(CH2)11-EG3-COOH (SPC) | Prochimia | TH 003m11n3-0.1 | |
| SH-(CH2)11-EG3-NH2 (SPN) | Prochimia | TH 002-m11.n3-0.2 | |
| Surface plasmon resonance system | Biorad | XPR36 | |
| Bare gold chip | Biorad | GLC chip | Plasma ashed to remove the monolayer |
| 1-Ethyl-3-(3-dimethylaminopropyl) carbodiimide | Thermo | 22980 | |
| N-hydroxysuccinimide (NHS) | Thermo | 24510 | |
| Pentylamine-Biotin | Thermo | 21345 | |
| Ethanolamine | Sigma-Aldrich | E9508 | |
| Neutraavidin | Thermo | 31000 | |
| Phosphate buffered saline | Thermo | 28374 | |
| Tween 20 | Sigma-Aldrich | P2287 | |
| Inverted microscope | Zeiss | Axio Observer | Microscope is equipped with 40X oil immersion objective; CO2 and humidity incubation from Pecon GmbH |
| CCD camera | Hamamatsu | Orca R2 | Thermoelectrically cooled (16 bit) |
| Spectrometer | Ocean Optics | QE65Pro | |
| Spectrasuite | Ocean Optics | version1.4 | |
| c-myc peptide HyNic Tag | Solulink | SP-E003 | |
| monoclonal anti-c-myc antibody | Sigma-Aldrich | M4439 | |
| Hybridoma cell line | ATCC | CRL-1729 | |
| Antibiotic Antimycotic Solution (100×) | Sigma-Aldrich | A5955 | |
| Serum free media RPMI 1640 | Invitrogen | 11835-030 | |
| Fetal bovine serum | ATCC | 30-2020 | |
| Rhodamine DHPE | Life Technologies | L-1392 |
References
- Ludwig, A. -. K., Giebel, B. Exosomes: Small vesicles participating in intercellular communication. The International Journal of Biochemistry & Cell Biology. 44, 11-15 (2012).
- Friedl, P., Gilmour, D. Collective cell migration in morphogenesis, regeneration and cancer. Nature Reviews Molecular Cell Biology. 10, 445-457 (2009).
- Letterio, J. J., Roberts, A. B. Regulation of immune responses by TGF-beta. Annual Review of Immunology. 16, 137-161 (1998).
- Werner, S., Grose, R. Regulation of wound healing by growth factors and cytokines. Physiological Reviews. 83, 835-870 (2003).
- Werner, S., Krieg, T., Smola, H. Keratinocyte-fibroblast interactions in wound healing. Journal of Investigative Dermatology. 127, 998-1008 (2007).
- Bailey, R. C., Kwong, G. A., Radu, C. G., Witte, O. N., Heath, J. R. DNA-encoded antibody libraries: A unified platform for multiplexed cell sorting and detection of genes and proteins. Journal of the American Chemical Society. 129, 1959-1967 (2007).
- Gazagne, A., et al. A Fluorospot assay to detect single T lymphocytes simultaneously producing multiple cytokines. Journal of Immunological Methods. 283, 91-98 (2003).
- Han, Q., et al. Polyfunctional responses by human T cells result from sequential release of cytokines. Proceedings of the National Academy of Sciences of the United States of America. 109, 1607-1612 (2012).
- Han, Q., Bradshaw, E. M., Nilsson, B., Hafler, D. A., Love, J. C. Multidimensional analysis of the frequencies and rates of cytokine secretion from single cells by quantitative microengraving. Lab on a Chip. 10, 1391-1400 (2010).
- Ma, C., et al. A clinical microchip for evaluation of single immune cells reveals high functional heterogeneity in phenotypically similar T cells. Nature Medicine. 17, 738-743 (2011).
- Shirasaki, Y., et al. Real-time single-cell imaging of protein secretion. Scientific Reports. 4, (2014).
- Milgram, S., et al. On chip real time monitoring of B-cells hybridoma secretion of immunoglobulin. Biosensors and Bioelectronics. 26, 2728-2732 (2011).
- Abbas, A., Linman, M. J., Cheng, Q. A. New trends in instrumental design for surface plasmon resonance-based biosensors. Biosensors & Bioelectronics. 26, 1815-1824 (2011).
- Ermakova, A., et al. Detection of a Few Metallo-Protein Molecules Using Color Centers in Nanodiamonds. Nano Letters. 13, 3305-3309 (2013).
- Haes, A. J., Van Duyne, R. P. A nanoscale optical blosensor: Sensitivity and selectivity of an approach based on the localized surface plasmon resonance spectroscopy of triangular silver nanoparticles. Journal of the American Chemical Society. 124, 10596-10604 (2002).
- Horowitz, V. R., Aleman, B. J., Christle, D. J., Cleland, A. N., Awschalom, D. D. Electron spin resonance of nitrogen-vacancy centers in optically trapped nanodiamonds. Proceedings of the National Academy of Sciences of the United States of America. 109, 13493-13497 (2012).
- Sepulveda, B., Angelome, P. C., Lechuga, L. M., Liz-Marzan, L. M. LSPR-based nanobiosensors. Nano Today. 4, 244-251 (2009).
- Barbillon, G., et al. Biological and chemical gold nanosensors based on localized surface plasmon resonance. Gold Bulletin. 40, 240-244 (2007).
- Endo, T., et al. Multiple label-free detection of antigen-antibody reaction using localized surface plasmon resonance-based core-shell structured nanoparticle layer nanochip. Analytical Chemistry. 78, 6465-6475 (2006).
- Endo, T., Kerman, K., Nagatani, N., Takamura, Y., Tamiya, E. Label-free detection of peptide nucleic acid-DNA hybridization using localized surface plasmon resonance based optical biosensor. Analytical Chemistry. 77, 6976-6984 (2005).
- Haes, A. J., Hall, W. P., Chang, L., Klein, W. L., Van Duyne, R. P. A localized surface plasmon resonance biosensor: First steps toward an assay for Alzheimer's disease. Nano Letters. 4, 1029-1034 (2004).
- Jonsson, M. P., Jonsson, P., Dahlin, A. B., Hook, F. Supported lipid bilayer formation and lipid-membrane-mediated biorecognition reactions studied with a new nanoplasmonic sensor template. Nano Letters. 7, 3462-3468 (2007).
- Park, J. H., et al. A regeneratable, label-free, localized surface plasmon resonance (LSPR) aptasensor for the detection of ochratoxin A.. Biosensors & Bioelectronics. 59, 321-327 (2014).
- Mayer, K. M., Hao, F., Lee, S., Nordlander, P., Hafner, J. H. A single molecule immunoassay by localized surface plasmon resonance. Nanotechnology. 21, (2010).
- Endo, T., Yamamura, S., Kerman, K., Tamiya, E. Label-free cell-based assay using localized surface plasmon resonance biosensor. Analytica Chimica Acta. 614, 182-189 (2008).
- Huang, Y. X., Cai, D., Chen, P. Micro- and Nanotechnologies for Study of Cell Secretion. Analytical Chemistry. 83, 4393-4406 (2011).
- Oh, B. R., et al. Integrated Nanoplasmonic Sensing for Cellular Functional Immunoanalysis Using Human Blood. ACS Nano. 8, 2667-2676 (2014).
- Raphael, M. P., Christodoulides, J. A., Delehanty, J. B., Long, J. P., Byers, J. M. Quantitative Imaging of Protein Secretions from Single Cells in Real Time. Biophysical Journal. 105, 602-608 (2013).
- Raphael, M. P., et al. A New Methodology for Quantitative LSPR Biosensing and Imaging. Analytical Chemistry. 84, 1367-1373 (2011).
- Raphael, M. P., et al. Quantitative LSPR imaging for biosensing with single nanostructure resolution. Biophysical Journal. 104, 30-36 (2013).
- Raphael, M. P., et al. A new methodology for quantitative LSPR biosensing and imaging. Analytical Chemistry. 84, 1367-1373 (2012).
- Henn, A. D., et al. Modulation of single-cell IgG secretion frequency and rates in human memory B cells by CpG DNA, CD40L, IL-21, and cell division. Journal of Immunology. 183, 3177-3187 (2009).
- Bramswig, K. H., et al. Soluble Carcinoembryonic Antigen Activates Endothelial Cells and Tumor Angiogenesis. Cancer Research. 73, 6584-6596 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved