Method Article
단일 세포 분비물의 공간 - 시간 영상의 레이블이없는 기술
요약
간 셀룰러 통신은 내부와 세포 외부의 각종 생리 활성 조절에 중요하다. 이 논문은 단일 세포 분비물의 시공간적 특성을 측정하기위한 프로토콜을 설명합니다. 이를 달성하기 위해, 종합 접근법 생균 이미징 감지 라벨없는 nanoplasmonic을 통합하는 데 사용된다.
초록
Inter-cellular communication is an integral part of a complex system that helps in maintaining basic cellular activities. As a result, the malfunctioning of such signaling can lead to many disorders. To understand cell-to-cell signaling, it is essential to study the spatial and temporal nature of the secreted molecules from the cell without disturbing the local environment. Various assays have been developed to study protein secretion, however, these methods are typically based on fluorescent probes which disrupt the relevant signaling pathways. To overcome this limitation, a label-free technique is required.
In this paper, we describe the fabrication and application of a label-free localized surface plasmon resonance imaging (LSPRi) technology capable of detecting protein secretions from a single cell. The plasmonic nanostructures are lithographically patterned onto a standard glass coverslip and can be excited using visible light on commercially available light microscopes. Only a small fraction of the coverslip is covered by the nanostructures and hence this technique is well suited for combining common techniques such as fluorescence and bright-field imaging.
A multidisciplinary approach is used in this protocol which incorporates sensor nanofabrication and subsequent biofunctionalization, binding kinetics characterization of ligand and analyte, the integration of the chip and live cells, and the analysis of the measured signal. As a whole, this technology enables a general label-free approach towards mapping cellular secretions and correlating them with the responses of nearby cells.
서문
간 셀룰러 통신은 내부와 세포 내외 많은 생리 활성의 조절을 위해 매우 중요합니다. 단백질과 소포의 다양한 이후 이러한 분화, 상처 치유, 면역 반응, 마이그레이션 및 확산 등의 복잡한 세포 과정을 트리거 것을 분비 될 수있다. 간 세포 신호 전달 경로의 1-5 오작동 암, 동맥 경화 등 다양한 질환에 연루되어 , 당뇨병, 몇 가지 이름을 지정합니다.
최적의 세포 분비 분석은 공간적으로 시간적 관련 신호 전달 경로를 방해하지 않고 관심의 분비 단백질을 매핑 할 수 있어야한다. 이러한 방식으로 농도 분포 및 수용 세포의 응답 사이에 인과 관계를 추론 할 수있다. 불행히도, 가장 일반적으로 사용되는 형광 기반 기술들의 대부분은이 기준을 충족하지 않는다. 형광 융합 단백질 승 분석에 태그를 사용할 수 있습니다셀 ithin하지만 분비 경로를 방해하거나 분비 된 경우, 정량하기 어려운 세포 외부 광선 확산을 초래한다. 형광 immunosandwich 기반 분석법은 세포 분비를 검출하기위한 가장 널리 사용되는 기술이지만 일반적으로 개별 세포의 분리를 필요로한다. 또한, 감지 항체의 도입은 일반적으로 정지 또는 실험 및 항체 레이블 크기 단부 6-11, 150 kDa의 IgG에 대한이, 다운 스트림 신호에 장애입니다.
이러한 장애물들 그 라벨없는 기술은, 화상 단백질 분비하고 기존 라벨없는 기술 사이 이용 플라즈몬 공명 (SPR)을 표면 및 국소 표면 플라즈몬 공명 (LSPR) 센서는 우수한 후보 것이 바람직하기 때문이다. 12-17 이들 센서는 널리 단백질, 엑소 좀 다른 바이오 마커 분석 결합 연구를 위해 사용되어왔다. 18 ~ 24를 저 채도, 플라즈몬 nanostr의 경우uctures 유리 커버 슬립 상에 리소그래피 패터닝 및 표준 와이드 필드 현미경 구성을 통해 가시광을 사용하여 여기 될 수있다. 인해 나노 공간에, 유리 기판의 대부분은 25-28. 이러한 살아있는 세포 현미경과의 통합에 적합 시야 잘 이러한 프로브를 만드는 형광 현미경과 같은 일반적인 영상 기술로 사용할 우리는 실시간 측정을 입증 각각 225 밀리 초와 10 μm의,의 공간과 시간 해상도 기능화 된 금 플라즈 모닉 나노 구조를 사용하여 하이 브리 도마 세포에서 항체 분비물. 기본 칩 구성은도 1에 도시되어있다. 28 현미경의 출사 광로가 이미지에 사용 CCD 카메라와 나노 구조물의 소정의 배열 분별 점유 (도 2의 정량 용 섬유 광학적 결합 분광계가 나눠 ).
protoc동시에 표준 명 시야 현미경을 사용하여 세포의 반응을 모니터링하면서 본 논문에서 제시 올 단세포 분비물의 실시간 측정을위한 실험 설계를 설명한다. 종합 접근법은 세포주의 나노 구조물의 제조, 분석 물질의 결합 친화력을위한 나노 구조물의 기능화, 모두 비 - 특이 적 결합을 최소화 및 상업적 표면 플라즈몬 공명을 이용하여 운동 속도 상수의 특성 (SPR) 악기 표면 최적화, 통합이 포함 기판과 영상 및 스펙트럼 데이터를 분석 상. 우리는 세포 분비물 및 수신 세포와의 인과 관계의 시공간 매핑 가능 기술로이 기술을 기대하고 있습니다.
프로토콜
1. 나노 구조 제작
- 나노 제조를위한 기판으로 170 μm의 (제 1.5)의 대략 두께 25mm 직경 커버 글라스를 선택합니다.
- 적어도 6 시간 동안 : (황산과 과산화수소의 비율 1 3) 피라니아 용액에 담가 커버 슬립. 초순수 18.2 MΩ 탈 증류수 (DDW)의 풍부한 양의 피라 흠뻑 커버 슬립을 씻으십시오.
주의 : 피라냐 산은 유기 물질과 격렬하게 반응하여 극단적 인주의하여 취급해야합니다. - 전자 빔 증착법에 의해 커버 슬립에 기탁 10 nm의 크롬 박막의 나노 패터닝 및 이미징 동안 전하 효과를 회피한다.
- 이중층의 제 1 층은 45 초 동안 2,000 rpm에서 에틸 락 테이트, 메틸 메타 크릴 레이트 (MMA_EL6) 공중 합체로 이루어지는 레지스트 스핀 한 다음 150 ℃에서 굽는다. 다음, 180 ℃에서 45 초간 베이크 3,000 rpm에서 폴리 메틸 메타 크릴 레이트 (950PMMA_A2)의 2 층을 스핀.
- 은어N 이중층 300 μC / ㎠의 도즈 영역에서 25 kV의 전자빔 리소그래피 (EBL)을 사용하여 레지스트. 이소 프로필 알콜에서 프로그래밍 (IPA) / 메틸 이소 부틸 케톤 (MIBK) : 2/1 IPA 린스.
- 금고의 Ti (5 ㎚)의 전자 빔 증발기를 이용하여 기판 상 / 금 (80 ㎚) 필름.
- 금 증착에 이어 합체 이중층 4 시간 동안 아세톤에 기판을 침지하여 레지스트 리프트 오프.
- 나노 구조물의 모양과 크기를 확인하기 위해 주사 전자 현미경 (SEM)을 이용하여 기판 검사, RT에서 60 초간 CR-7 에칭액 습식 식각을 통해 기판으로부터 잔류 크롬을 제거하고 DDW로 헹군다.
- 어레이 사이 세포 이미징을위한 공간을 확보하기 위해 33 ㎛의 중심 간 간격 배열을 설계한다. 패턴 전자빔 라이터를 이용하여 300 nm의 피치 각 배열은 20 × 20 나노 패턴. 각각의 칩은 80 ± 2.5 nm의 높이의 전형적인 치수를 갖는 나노 구조 (300) 배열 및 70 ± 2.5 나노 diame를 포함터.
- 크기와 균일 성의 확인을위한 원 자간 력 현미경 (AFM)을 사용하여 어레이의 서브 세트를 검사한다.
- UV 경화 에폭시를 이용하여 커버 슬립의이면에,지지 링, 일반적으로 실리콘을 부착.
2. 칩 청소 및 자기 조립 단분자막의 응용 프로그램
- 5 % 수소, 동일한 조건에서 5 분 동안 실을 세정 후 45 초 동안 95 % 아르곤의 혼합물을 300 mTorr 내지 40 W의 전력에서 세정 및 재생 칩, 플라스마 애시.
- (3)로 구성된 이성 에탄올 티올 용액 칩 침지 즉시 플라즈마 애싱 후 금 나노 구조물을 기능화 (CH 2) SH- 1 비율을 8 -EG 3 -OH (SPO)과 어느 아민 성분 또는 카복실 작용기, 즉, SH- (CH2) 11 -EG 3 -NH 2 (SPN) 또는 SH- (CH 2) 11 (3) -COOH -EG (SPC).
- 칩의 I를 남겨N 티올 용액 O / N은 자기 조립 단분자막 (SAM)을 형성한다.
- 질소 가스로 에탄올 건조와 칩을 씻어.
- 필요한 경우, 4 ° C에서 최대 2 주 동안 작용 칩을 저장합니다.
- 사용할 준비가 선택의 리간드에 따라 화학 제를 사용하여 리간드와 SPN 또는 SPC 구성 요소를 반응 할 때 (아래 참조).
참고 :이 칩은 재생 및 시간의 재 기능화 수십 될 수있다. 주어진 칩 6 개월 년 이상 범위 기간 동안 사용할 수 있습니다. 지정된 배열에 측정 된 스펙트럼은 안정적으로 biofunctionalization 다음 플라즈마 에싱에 의해 반복 재생성, 후 재생된다. (29)
3. 표면 기능화 및 운동 특성
주 : 리간드 분석 물 사이의 운동 속도 상수의 특성을 상업용 SPR 악기 기능화 칩을 사용뿐만 아니라 비 특이성 B에 SAM의 저항 공부inding. 효율적인 표면 기능화 허용 유량과 미세 유체 광범위한 설계가있다. 우리가 시판 SPR하고 있으므로 우리는 추천 유량을 약 표준화. 우리는 이러한 유속이 모든 SPR 악기의 전형적인 때문에 제한되지 않습니다 있습니다. 모든 작용은 LSPR 칩 상에 직접 수행 될 수 있지만, 다중화 기기이기 때문에 우리 LSPR 미세 설치가 아닌 반면, 우리의 작업 부하를 경감 않았기 때문에 SPR 장비는 필요하지 않다.
- 제 2 항에 기재된 바와 같이 상업적으로 SAM 골드 베어 칩을 기능화.
- 133 1- 에틸 -3- (3- 디메틸 아미노 프로필) 카르 보디이 미드의 밀리미터 (EDC) 및 33 DDW에서 N의 -hydroxysuccinimide mM의 (NHS)를위한 (10)의 1 : 1 혼합물 SPC 계 SAM을 사용하는 경우, 1 카르복실기를 활성화 분.
- 30 μL / 분의 유속을 사용하여 300 초 동안 관심의 항체 / 리간드 활성화 된 카르복실기 접합체. 에 리간드를 준비pH가 6 인산염 완충액은 일반적으로, 그러나 이것은 분자에 따라 변할 수있다.
- 리간드 결합 후, 30 μL / 분의 속도로 300 초 동안 탈 활성화 단계로서 인산염 완충 식염수 (PBS) 중 0.1 M 에탄올 아민을 흐른다. 에탄올은 비 - 특이 적 결합을 최소화하는 데 도움이.
- 농도 범위를 사용하여 100 μL / 분의 유속으로 관심있는 분석 물을 도입하고 운동 분석 소프트웨어를 이용하여 운동 속도 상수를 계산한다.
- 비특이적 결합이 문제가되는 경우, SPC 또는 SPN에 SPO의 비율을 증가시킨다.
4. 저 채도 일반 설정
- 현미경 설정 :
- 샘플을 조명 쾰러에 100 W 할로겐 램프를 사용합니다. 공진 변화 (그림 2)에 기여하지 않는 파장을 제거하는 빛의 경로에 긴 패스 필터 (일반적으로 593 nm의 컷오프)를 사용합니다.
- LSPRi 데이터 수집을 위해, 40X 오일 immersio와 거꾸로 현미경을 사용하여N 목표 (1.4 NA)와 열전 16 비트 CCD 카메라를 냉각.
- 동시에 이미지와 스펙트럼을 얻었다 현미경의 출력 포트에서 빔 스플리터를 배치했다.
- 37 온도 조절 현미경 단계를 설정 C를 ° 4 시간 동안 평형.
- 각각 5 % 및 95 %에서 2 CO 농도와 습도를 조절하기 위해 현미경에 추가 인큐베이션 조립체를 통합.
- 칩 준비와 장착 :
- SPR 실험에서 결정된 최적 이성 SAM 비율로 제 2 항에 기재된 LSPR 칩 기능화.
- 다음과 같이 사용자 정의 만든 미세 유체 홀더 내에서 칩을 넣습니다. 알루미늄 바닥 부분에 칩을 놓습니다. 이 바닥 조각과 실리콘 가스켓 및 투명한 플라스틱 상단 부분의 칩을 샌드위치. 어셈블리를 고정하는 나사 4 개를 사용합니다.
- 1 혼합 : 일반적인 SPC 기반 티올 응용 프로그램의 경우, 1 μL 코트 (300)를 드롭133 mM의 EDC 및 NHS DDW에서 33 mM로 스트럭처는 SPC 티올 성분의 카르복실기를 활성화한다.
- 10 분 동안 기다린 후 수동으로 된 10 mM PBS로 표면을 씻어.
- 리간드 용액을 300 μL 도포함으로써 드롭 관심 리간드 (전형적으로 항체 또는 항체 단편)와 카르복실기로 활성화 접합체.
- 30 분 동안 기다린 후 수동으로 된 10 mM PBS로 씻어.
- 비특이적 결합을 최소화하기 위해 칩에 코트를 PBS 0.1 M 에탄올 300 μl를 삭제합니다. 10 분 동안 기다립니다.
- PBS는 0.005 % 트윈 20 (PBS-T20)를 포함하여 에탄올을 씻으십시오.
- 변화의 메 니스 커스 (meniscus)와 관련된 데이터의 변동을 줄이기 위해 칩 위의 석영 조각을 놓습니다.
- 현미경에 장착하는 동안 PBS-T20 버퍼 젖은 칩을 유지합니다.
- 가열 단계의 샘플 홀더에 단단히 저 채도 칩 어셈블리를 놓고 마이크로 유체 튜브를 연결합니다.
- 조립 및 흐름 BU에 미세 유체 튜브를 연결합니다ffer (또는 세포 연구에 대한 혈청 무료 미디어) 정상 상태까지 도달한다.
- 조립 및 현미경 적어도 2 시간 동안 평형을 허용합니다.
- 중앙 배열이 분광법의 광섬유로 정렬되도록 조이스틱을 사용하여 칩을 맞 춥니 다. 분광 데이터를 분광 스펙트럼 분석 소프트웨어를 사용하여 수행된다.
- 소프트웨어 자동 초점, 자이스 확실한 초점 또는 이에 상응하는 자동 초점 장치를 사용하여 실험을하는 동안 초점 배열을 유지합니다.
9E10 하이 브리 도마 세포에서 안티-C-myc의 분비물 5. 저 채도 이미징
참고 : 본 연구에 사용 된 하이 브리 도마 세포주가 화학 트리거가 필요하지 않은 구조적 따라서 안티 C-myc의 항체를 발현
- C-myc의 펩티드의 나노 구조물을 기능화. 이는 클론 9E10 하이 브리 도마 세포에 의해 분비 된 항 - C-myc의 항체는 1.77 nM의 K D의 값을 갖는다.
- COMPLET 문화 하이 브리 도마 세포5 % CO 2, 37 ℃ 이하에서 T75 플라스크에 10 % 소 태아 혈청 (FBS) 및 1 % 항생제 E 성장 배지. / ㎖ 4 × 105 세포의 세포 밀도를 유지한다.
- 세포 분비 연구를 들어 원심 분리에 의해 T75 플라스크에서 펠렛 세포는 분비 된 항체를 제거하고, 4 × 106 세포 / ml의 세포 밀도를 조정하는 RPMI-1640 혈청이없는 배지 (SFM)로 두 번 세척 하였다.
- 저 채도의 칩을에 도입하기 전에 실행 가능성에 대한 세포 및 테스트를 수확.
- 수동으로 마이크로 피펫으로 저 채도 칩에 세포 용액 50 μl를 소개합니다. 몇 분 후 25~50 세포 LSPR 칩의 표면에 부착.
- 미세 관류 시스템을 사용하여 신선한 SFM 용액에 남아있는 세포를 씻어.
- 10 μm의 내 가까운 영상의 저 채도의 배열을 선택하지만, 세포와 중복되지 않습니다.
- 신호는 분비 된 항 - C-myc의 antib 특정되도록odies과 함께 본없이 항체뿐만 아니라 항체하지만 용액 중 c-myc의 펩티드의 포화 농도의 존재에 의해 차단 그들의 결합 부위로 세포 배양 배지를 소개한다.
- 항 - C-myc의 항체 (250 ㎚)의 포화 용액으로 각 런의 끝에서 센서 교정. 이것은 각 런의 biofunctionalization 프로파일에 기초 부분을 점유 센서의 응답을 정규화 돕고 결정.
- 이미지 정렬 소프트웨어를 이용하여 X 및 Y 방향에서의 드리프트를 정정.
결과
전형적인 라이브 세포 분비 연구에서 발생하는 데이터 수집의 여러 모드가 있습니다. (3) 사각형 배열을 강조 LSPRi 이미지의 오버레이를 보여줍니다, 그리고 왼쪽 아래에있는 셀을 강조 투과광 조사 이미지. 데이터는 일반적으로 후술 정규화 계산 분석 물의 포화 용액을 도입 한 다음 3 시간에 걸쳐 수집된다. 형광 이미지는 필터 큐브의 자동 전환하여 데이터 수집 루틴으로 통합 될 수있다. 그림 4 형광 막 염료 로다 민 DHPE 물들 세포에서 lamellipodia 같은 확장 (화살표)를 나타낸다. 이러한 확장 배열과 겹쳐한다면 그들은 단백질 분비에 대한 위양성을 줄 것입니다. 이미지의 여러 모드를 갖는 등의 발생을 식별 할 수 있습니다.
그림 5는 분석의 이전 데이터와 후미를 보여줍니다ER 포화 용액의 도입 상업적 C-myc의 작용 어레이 안티 C-myc의 항체의 살 (400 ㎚). 어떤 세포는이 실험에 존재하지 않았다. 스펙트럼은 적색 이동과 강도의 증가를 모두 표시합니다. 두 곡선 아래 면적의 차이는 CCD 카메라에 LSPRi 모드 어레이 이미지 세기의 증가를 초래한다. 비선형 최소 자승 데이터 분석 방법은 스펙트럼에서 표면 결합 된 리간드의 점유 부분을 추정하기 위해 개발되었다. (30, 31)
실험의 끝에, 포화 강도 값 (분수 점유 ≈ 1 IE)는 다음 식을 이용하여 각각의 어레이에 대한 정규화 된 응답을 계산하기 위해 사용된다 :
시각 t에서의 시각 t에서의 정규화 강도 실험 최종 포화 강도의 개시시의 초기 강도, 및 어레이의 강도 측정 어디 , 각각.
두 어레이로부터의 정규화 값은도 6에 도시되어있다. 하나의 어레이는, 대조군으로 사용, 조사중인 동안 다른 셀의 10 μm의 이내 셀로부터 130 ㎛의 거리이다. 상기 제어 배열의 평면에 응답하여 상기 셀에 대하여 가장 근접한 어레이의 정규화 답변 급격한 증가는 분비 된 항체의 국부 버스트를 나타낸다.
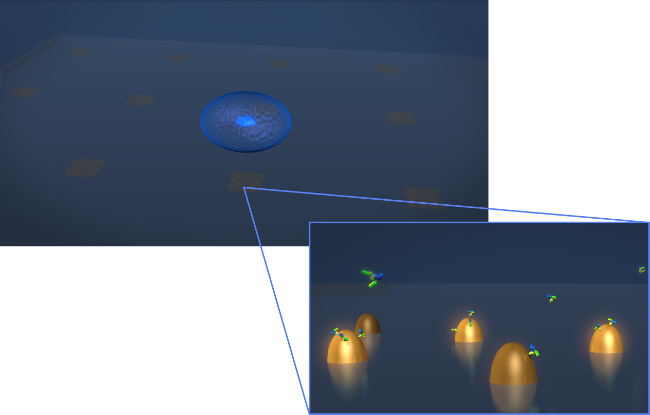
1. 센서 디자인 그림. 전형적인 생균 분비 실험의 형상을 묘사. 세포 (파란색 타원체)를 연신 biofunctionalized 금 나노 구조물의 어레이를 포함 LSPR 칩에 증착된다. 이들이 표면에 결합 같이 Y 자 형상 분자로 도시 이때 항체의 줌인 뷰 관심 세포 분비에서 측정된다기능화 된 나노 구조. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
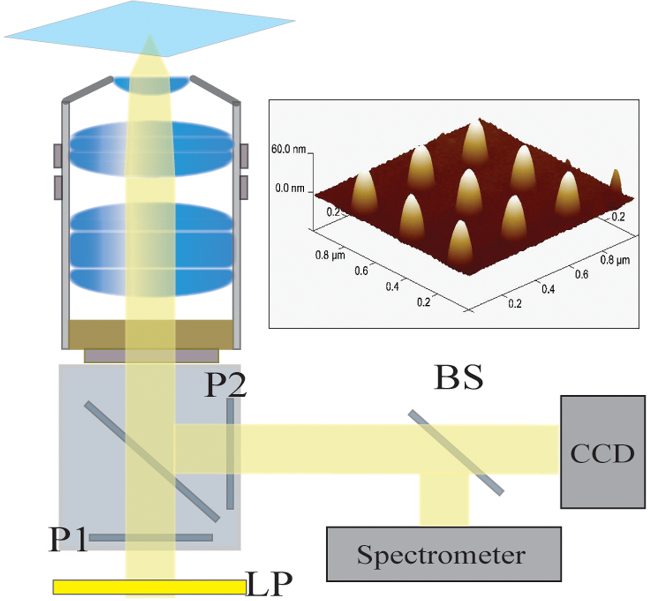
그림 2. 광 설치. 할로겐 램프의 조명 빛이 먼저 긴 패스 필터 (LP)에 의해 필터링된다. 빛은 선형 (P1) 편광 및 40X / 1.4 NA 목표를 통해 샘플을 조명한다. 산란 된 빛이 교차 편광판 (P2)를 통해 목적에 의해 수집하고 전달됩니다. 50/50 빔 스플리터 (BS)를 동시 분광 및 영상 분석을 위해 수집 된 광로에 삽입된다. 오른쪽 상단 :. 300 nm의 피치로 구분하여 9 개별 나노 구조의 원자 힘 현미경 이미지 여기를 클릭하십시오이 그림의 더 큰 버전을 볼 수 있습니다.
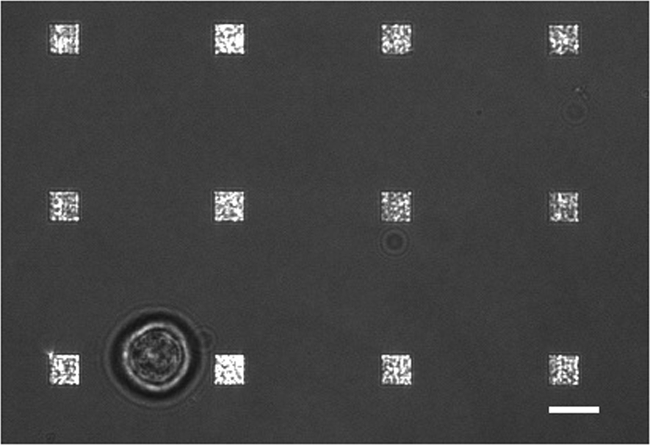
그림 3. 라이브 셀 LSPRi 연구. 12 배열에 둘러싸여 하나의 하이 브리 도마 세포 (왼쪽 아래)을 보여주는 투과광과 LSPRi 이미지를 합병했다. 이 대비 강화 된 이미지입니다. 스케일 바는 10 μm의입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
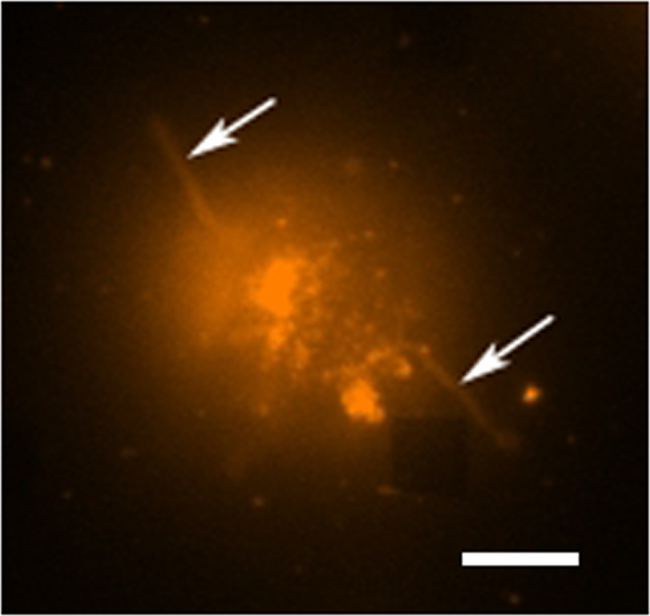
그림 4. 라이브 셀 형광 연구. 막 염료 인 로다 민 DHPE, 염색 한 하이 브리 도마 세포의 형광 거짓 컬러 이미지. 어레이는 일반적으로 보이지 않는 형광 촬상 모드에서는, 그러나, 주변 배열 AB 여기 관측오른쪽 하단 모서리에 사각형이 부족하다. 세포는 세포 (화살표)으로부터 외측으로 연장되어 촉수 형 익스텐션 (또는 아마도 filopodia lamellipodia) 비록 어레이로부터 분리되는 것을 알 수있다. 스케일 바는 10 μm의입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
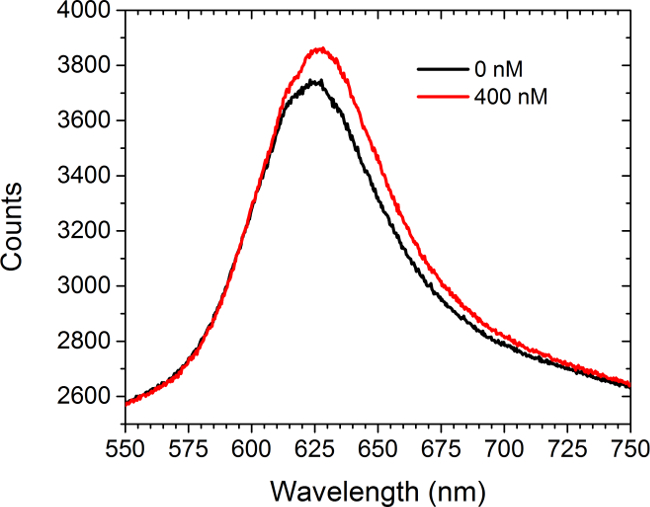
도 5 스펙트럼 모덜. 전에 안티 C-myc의 항체가 400 nM의 용액을 도입 한 후 C-myc의 작용 어레이로부터 얻어진 스펙트럼. 어떤 세포는이 연구에 존재하지 않았다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6. 단일 세포 분비. 15 단일 셀의 μm의 130 μm의 거리에 하나 (제어)에 위치한 배열의 응답. 스케일 바는 10 μm의입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
The LSPR imaging technique described in this work has numerous advantages over more traditional methodologies for detecting cell secretions. First, the time resolution of our technique is on the order of seconds whereas the commercial alternative, an immunosandwhich assay known as EliSpot, has a typical time resolution of 2 to 3 days.7,32 As a result we were able to resolve sudden changes in the rate of protein secretion, such as that shown in Figure 6. Second, having arrays distributed over the chip allows for the secreted signal to be tracked in space and time which enables more rigorous comparisons to diffusion-based models of cell secretion. In addition, arrays like the control array shown in Figure 6 can be used to subtract out global changes in the image that typically arise from instrumental factors such as focus drift. Third, our technique requires no modification of the cells. If desired, the experiment can incorporate commonly used tags such as fluorescent proteins, but if there is concern that such tags may negatively affect cell viability or homeostasis the label-free nature of our approach does not require them. Fourth, using the spectroscopic data we have demonstrated that quantitative information regarding the fractional occupancy of surface bound ligands can be calculated.
There are numerous alternative methods to EBL for fabricating metallic nanoparticles. However, we have found that the EBL provides considerable flexibility for optimizing nanostructure and array dimensions to best suit the optics and the cells under investigation. Also critical is the fact that the chips can be readily regenerated by plasma ashing. In this way, a typical chip can be used dozens of times. Biofunctionalization details must be modified for the specific application. The protocol presented here conjugated the surface with relatively small c-myc peptide ligands. Larger ligands such as whole antibodies typically require more spacing and thus a higher SPO to SPN/SPC ratio. Regardless, a well formed SAM layer is essential for preventing non-specific binding in live-cell experiments. In general, larger molecular weight analytes are more readily detected by LSPR. Thus, in its single-cell manifestation, this technique may not be appropriate for detecting the secretion of small proteins, such as cytokines.
The current setup has been used for studying individual non-adherent cells. There are significant number of secreted signaling proteins and vesicles to which the results reported in this work are directly applicable. For example carcinoembryonic antigen (CEA) which for decades now has been a diagnostic marker for cancer. Colon cancer cells are known to secrete CEA at the rates of thousands of molecules/cell/hr and the molecular weight is 180 kDa which exceeds that of IgG antibodies. CEA is believed to be involved in autocrine and paracrine signaling pathways but the spatio-temporal nature of these secretions have never been measured. Our technique can directly address these signaling questions. An extension of this work will be to measure the spatio-temporal nature of CEA secretion from single cells.33 Future work will also focus on integrating LSPRi with two and three dimensional cell cultures of adherent cells. By incorporating multiplexed arrays capable of detecting a number of secreted proteins in parallel, this technique has the potential to open a new window into cell secretions and how they influence neighboring cells.
공개
We thank George Anderson for helpful comments and discussions. This work was supported by the Naval Research Laboratory’s Institute for Nanoscience and the National Research Council Research Associateship Award.
감사의 말
The authors have nothing to disclose.
자료
| Name | Company | Catalog Number | Comments |
| 25 mm diameter glass coverslips | Bioscience Tools | CSHP-No1.5-25 | 170±5 µm is optimal |
| Poly-methyl methacrylate | Microchem | PMMA 950 A4 | |
| Ethyl lactate methyl metacrylate | Microchem | MMA EL6 | |
| Electron beam evaporator | Temescal | FC-2000 | |
| Electron beam lithography | Raith | Series 150 | |
| Ethanol | Sigma-Aldrich | 459836 | |
| Acetone | Sigma-Aldrich | 320110 | |
| CR-7 chromium etchant | Cyantek | CR-7 | |
| Scanning electron microscope | Zeiss | Ultra 55 | |
| Atomic force microscope | Veeco | Nanoscope III | |
| Plasma ashing system | Technics | Series 85 RIE | |
| SH-(CH2)8-EG3-OH (SPO) | Prochimia | TH 001-m8.n3-0.2 | |
| SH-(CH2)11-EG3-COOH (SPC) | Prochimia | TH 003m11n3-0.1 | |
| SH-(CH2)11-EG3-NH2 (SPN) | Prochimia | TH 002-m11.n3-0.2 | |
| Surface plasmon resonance system | Biorad | XPR36 | |
| Bare gold chip | Biorad | GLC chip | Plasma ashed to remove the monolayer |
| 1-Ethyl-3-(3-dimethylaminopropyl) carbodiimide | Thermo | 22980 | |
| N-hydroxysuccinimide (NHS) | Thermo | 24510 | |
| Pentylamine-Biotin | Thermo | 21345 | |
| Ethanolamine | Sigma-Aldrich | E9508 | |
| Neutraavidin | Thermo | 31000 | |
| Phosphate buffered saline | Thermo | 28374 | |
| Tween 20 | Sigma-Aldrich | P2287 | |
| Inverted microscope | Zeiss | Axio Observer | Microscope is equipped with 40X oil immersion objective; CO2 and humidity incubation from Pecon GmbH |
| CCD camera | Hamamatsu | Orca R2 | Thermoelectrically cooled (16 bit) |
| Spectrometer | Ocean Optics | QE65Pro | |
| Spectrasuite | Ocean Optics | version1.4 | |
| c-myc peptide HyNic Tag | Solulink | SP-E003 | |
| monoclonal anti-c-myc antibody | Sigma-Aldrich | M4439 | |
| Hybridoma cell line | ATCC | CRL-1729 | |
| Antibiotic Antimycotic Solution (100×) | Sigma-Aldrich | A5955 | |
| Serum free media RPMI 1640 | Invitrogen | 11835-030 | |
| Fetal bovine serum | ATCC | 30-2020 | |
| Rhodamine DHPE | Life Technologies | L-1392 |
참고문헌
- Ludwig, A. -. K., Giebel, B. Exosomes: Small vesicles participating in intercellular communication. The International Journal of Biochemistry & Cell Biology. 44, 11-15 (2012).
- Friedl, P., Gilmour, D. Collective cell migration in morphogenesis, regeneration and cancer. Nature Reviews Molecular Cell Biology. 10, 445-457 (2009).
- Letterio, J. J., Roberts, A. B. Regulation of immune responses by TGF-beta. Annual Review of Immunology. 16, 137-161 (1998).
- Werner, S., Grose, R. Regulation of wound healing by growth factors and cytokines. Physiological Reviews. 83, 835-870 (2003).
- Werner, S., Krieg, T., Smola, H. Keratinocyte-fibroblast interactions in wound healing. Journal of Investigative Dermatology. 127, 998-1008 (2007).
- Bailey, R. C., Kwong, G. A., Radu, C. G., Witte, O. N., Heath, J. R. DNA-encoded antibody libraries: A unified platform for multiplexed cell sorting and detection of genes and proteins. Journal of the American Chemical Society. 129, 1959-1967 (2007).
- Gazagne, A., et al. A Fluorospot assay to detect single T lymphocytes simultaneously producing multiple cytokines. Journal of Immunological Methods. 283, 91-98 (2003).
- Han, Q., et al. Polyfunctional responses by human T cells result from sequential release of cytokines. Proceedings of the National Academy of Sciences of the United States of America. 109, 1607-1612 (2012).
- Han, Q., Bradshaw, E. M., Nilsson, B., Hafler, D. A., Love, J. C. Multidimensional analysis of the frequencies and rates of cytokine secretion from single cells by quantitative microengraving. Lab on a Chip. 10, 1391-1400 (2010).
- Ma, C., et al. A clinical microchip for evaluation of single immune cells reveals high functional heterogeneity in phenotypically similar T cells. Nature Medicine. 17, 738-743 (2011).
- Shirasaki, Y., et al. Real-time single-cell imaging of protein secretion. Scientific Reports. 4, (2014).
- Milgram, S., et al. On chip real time monitoring of B-cells hybridoma secretion of immunoglobulin. Biosensors and Bioelectronics. 26, 2728-2732 (2011).
- Abbas, A., Linman, M. J., Cheng, Q. A. New trends in instrumental design for surface plasmon resonance-based biosensors. Biosensors & Bioelectronics. 26, 1815-1824 (2011).
- Ermakova, A., et al. Detection of a Few Metallo-Protein Molecules Using Color Centers in Nanodiamonds. Nano Letters. 13, 3305-3309 (2013).
- Haes, A. J., Van Duyne, R. P. A nanoscale optical blosensor: Sensitivity and selectivity of an approach based on the localized surface plasmon resonance spectroscopy of triangular silver nanoparticles. Journal of the American Chemical Society. 124, 10596-10604 (2002).
- Horowitz, V. R., Aleman, B. J., Christle, D. J., Cleland, A. N., Awschalom, D. D. Electron spin resonance of nitrogen-vacancy centers in optically trapped nanodiamonds. Proceedings of the National Academy of Sciences of the United States of America. 109, 13493-13497 (2012).
- Sepulveda, B., Angelome, P. C., Lechuga, L. M., Liz-Marzan, L. M. LSPR-based nanobiosensors. Nano Today. 4, 244-251 (2009).
- Barbillon, G., et al. Biological and chemical gold nanosensors based on localized surface plasmon resonance. Gold Bulletin. 40, 240-244 (2007).
- Endo, T., et al. Multiple label-free detection of antigen-antibody reaction using localized surface plasmon resonance-based core-shell structured nanoparticle layer nanochip. Analytical Chemistry. 78, 6465-6475 (2006).
- Endo, T., Kerman, K., Nagatani, N., Takamura, Y., Tamiya, E. Label-free detection of peptide nucleic acid-DNA hybridization using localized surface plasmon resonance based optical biosensor. Analytical Chemistry. 77, 6976-6984 (2005).
- Haes, A. J., Hall, W. P., Chang, L., Klein, W. L., Van Duyne, R. P. A localized surface plasmon resonance biosensor: First steps toward an assay for Alzheimer's disease. Nano Letters. 4, 1029-1034 (2004).
- Jonsson, M. P., Jonsson, P., Dahlin, A. B., Hook, F. Supported lipid bilayer formation and lipid-membrane-mediated biorecognition reactions studied with a new nanoplasmonic sensor template. Nano Letters. 7, 3462-3468 (2007).
- Park, J. H., et al. A regeneratable, label-free, localized surface plasmon resonance (LSPR) aptasensor for the detection of ochratoxin A.. Biosensors & Bioelectronics. 59, 321-327 (2014).
- Mayer, K. M., Hao, F., Lee, S., Nordlander, P., Hafner, J. H. A single molecule immunoassay by localized surface plasmon resonance. Nanotechnology. 21, (2010).
- Endo, T., Yamamura, S., Kerman, K., Tamiya, E. Label-free cell-based assay using localized surface plasmon resonance biosensor. Analytica Chimica Acta. 614, 182-189 (2008).
- Huang, Y. X., Cai, D., Chen, P. Micro- and Nanotechnologies for Study of Cell Secretion. Analytical Chemistry. 83, 4393-4406 (2011).
- Oh, B. R., et al. Integrated Nanoplasmonic Sensing for Cellular Functional Immunoanalysis Using Human Blood. ACS Nano. 8, 2667-2676 (2014).
- Raphael, M. P., Christodoulides, J. A., Delehanty, J. B., Long, J. P., Byers, J. M. Quantitative Imaging of Protein Secretions from Single Cells in Real Time. Biophysical Journal. 105, 602-608 (2013).
- Raphael, M. P., et al. A New Methodology for Quantitative LSPR Biosensing and Imaging. Analytical Chemistry. 84, 1367-1373 (2011).
- Raphael, M. P., et al. Quantitative LSPR imaging for biosensing with single nanostructure resolution. Biophysical Journal. 104, 30-36 (2013).
- Raphael, M. P., et al. A new methodology for quantitative LSPR biosensing and imaging. Analytical Chemistry. 84, 1367-1373 (2012).
- Henn, A. D., et al. Modulation of single-cell IgG secretion frequency and rates in human memory B cells by CpG DNA, CD40L, IL-21, and cell division. Journal of Immunology. 183, 3177-3187 (2009).
- Bramswig, K. H., et al. Soluble Carcinoembryonic Antigen Activates Endothelial Cells and Tumor Angiogenesis. Cancer Research. 73, 6584-6596 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유