Method Article
Une technique Label-free pour l'imagerie spatio-temporelle de cellule unique sécrétions
Dans cet article
Résumé
La communication inter-cellulaire est essentielle pour contrôler diverses activités physiologiques à l'intérieur et l'extérieur de la cellule. Ce document décrit un protocole pour la mesure de la nature spatio-temporelle des sécrétions cellulaires uniques. Pour atteindre cet objectif, une approche multidisciplinaire est utilisé qui intègre nanoplasmonic sans étiquette de détection avec l'imagerie des cellules vivantes.
Résumé
Inter-cellular communication is an integral part of a complex system that helps in maintaining basic cellular activities. As a result, the malfunctioning of such signaling can lead to many disorders. To understand cell-to-cell signaling, it is essential to study the spatial and temporal nature of the secreted molecules from the cell without disturbing the local environment. Various assays have been developed to study protein secretion, however, these methods are typically based on fluorescent probes which disrupt the relevant signaling pathways. To overcome this limitation, a label-free technique is required.
In this paper, we describe the fabrication and application of a label-free localized surface plasmon resonance imaging (LSPRi) technology capable of detecting protein secretions from a single cell. The plasmonic nanostructures are lithographically patterned onto a standard glass coverslip and can be excited using visible light on commercially available light microscopes. Only a small fraction of the coverslip is covered by the nanostructures and hence this technique is well suited for combining common techniques such as fluorescence and bright-field imaging.
A multidisciplinary approach is used in this protocol which incorporates sensor nanofabrication and subsequent biofunctionalization, binding kinetics characterization of ligand and analyte, the integration of the chip and live cells, and the analysis of the measured signal. As a whole, this technology enables a general label-free approach towards mapping cellular secretions and correlating them with the responses of nearby cells.
Introduction
La communication inter-cellulaire est crucial pour la régulation de nombreuses activités physiologiques tant à l'intérieur qu'à l'extérieur de la cellule. Une variété de protéines et des vésicules peut être sécrété par la suite qui déclenchent des processus cellulaires complexes tels que la différenciation, la cicatrisation, la réponse immunitaire, la migration et la prolifération. 1-5 défaillances de voies de signalisation inter-cellulaires ont été impliqués dans de nombreuses maladies y compris le cancer, l'athérosclérose et le diabète, pour ne nommer que quelques-uns.
Le dosage de sécrétion cellulaire optimale doit être capable d'spatialement et temporellement la cartographie de la protéine sécrétée d'intérêt sans perturber les voies de signalisation pertinentes. De cette façon, les relations causales entre les profils de concentration et la réponse des cellules de réception peuvent être déduites. Malheureusement, la plupart des techniques fluorescents basée sur les plus couramment utilisés ne répondent pas à ces critères. Des protéines de fusion fluorescentes peuvent être utilisées pour marquer l'analyte wurant la cellule mais peuvent perturber la voie de sécrétion, ou si sécrétée, les résultats dans une lueur diffuse en dehors de la cellule qui est difficile à quantifier. Des essais à base de immunosandwich-fluorescents sont les techniques les plus couramment utilisés pour détecter des sécrétions cellulaires, mais exigent généralement l'isolement des cellules individuelles. 11.6 De plus, l'introduction de l'anticorps de détection arrête ou se termine l'expérience et la taille des étiquettes d'anticorps en général, 150 kDa pour les IgG, est un obstacle à la signalisation en aval.
En raison de ces barrages routiers, il est préférable que la technique sans marqueur être utilisé pour des sécrétions protéiques de l'image et entre des technologies sans étiquette-existants, surface résonance de plasmon (SPR) et de résonance de plasmon de surface localisée (LSPR) capteurs sont d'excellents candidats. 12-17 Ces capteurs ont été largement utilisés pour les études de liaison de l'analyte de protéines, les exosomes et d'autres biomarqueurs. 18-24 Dans le cas de LSPR, la plasmonique nanostructures peut être modelée par lithographie sur des lamelles de verre et excité en utilisant la lumière visible par l'intermédiaire de configurations standard de microscopie à champ large. En raison de leur encombrement à l'échelle nanométrique, la majorité du substrat de verre est disponible pour des techniques d'imagerie courantes comme champ lumineux et microscopie par fluorescence faisant bien ces sondes adapté pour l'intégration avec la microscopie de cellules vivantes. 25-28 Nous avons démontré la mesure en temps réel des sécrétions d'anticorps à partir de cellules d'hybridome utilisant or fonctionnalisés nanostructures plasmoniques avec des résolutions spatiales et temporelles de 225 msec et 10 um, respectivement. La configuration de base de la puce est illustré sur la figure 1. 28 Le trajet de la lumière de sortie du microscope est divisé entre une caméra CCD utilisée pour l'imagerie et un spectromètre à fibre optique couplée à la détermination quantitative d'occupation partielle d'un tableau donné de nanostructures (Figure 2 ).
Le protocol présentées dans ce document décrit la conception expérimentale pour la mesure en temps réel des sécrétions cellulaires simples tout en contrôlant simultanément la réponse des cellules à l'aide de la microscopie à champ clair standard. L'approche multidisciplinaire comprend la fabrication de nanostructures, fonctionnalisation des nanostructures pour la grande liaison d'analytes affinité, l'optimisation de la surface à la fois pour minimiser la liaison non-spécifique et la caractérisation des constantes cinétiques utilisant une surface commerciale Plasmon Resonance (SPR) instrument, l'intégration de lignées cellulaires sur le substrat, et l'analyse de l'imagerie et des données spectrales. Nous prévoyons que cette technique est une technologie habilitante pour la cartographie spatio-temporelle des sécrétions cellulaires et leurs relations causales avec des cellules réceptrices.
Protocole
1. Fabrication Nanostructures
- Choisir 25 mm lamelles de verre de diamètre avec une épaisseur approximative de 170 (n ° 1,5) um comme substrats pour la nano-fabrication.
- Plonger les lamelles couvre-objet en solution piranha (rapport 3: 1 d'acide sulfurique et de peroxyde d'hydrogène) pendant au moins 6 heures. Laver le piranha lamelle imbibé abondamment avec de l'ultra-pure 18,2 MQ déminéralisée de l'eau distillée (DDW).
ATTENTION: l'acide Piranha réagit violemment avec les matières organiques et doit être manipulé avec un soin extrême. - Dépôt de 10 nm de chrome film mince sur les lamelles par évaporation par faisceau d'électrons pour éviter les effets de charge au cours de la structuration et de l'imagerie de nanostructures.
- Spin la première couche de résister bicouche constitué de méthacrylate d'éthyle lactate de méthyle (MMA_EL6) copolymère à 2000 tpm pendant 45 secondes, puis cuire au four à 150 ° C. Faites tourner la deuxième couche de poly-méthacrylate de méthyle (950PMMA_A2) à 3000 tpm pendant 45 secondes, puis cuire au four à 180 ° C.
- Crépitern la bicouche résist en utilisant la lithographie par faisceau d'électrons (EBL) à 25 kV avec une dose de surface de 300 uC / cm2. Développer dans l'alcool isopropylique (IPA) / méthylisobutylcétone (MIBK): 2/1 et rincer à l'IPA.
- Ti-fort (5 nm) / Au (80 nm) film sur le substrat en utilisant un évaporateur à faisceau électronique.
- Après le dépôt de l'or, décoller la bicouche copolymère résister par trempage du substrat dans de l'acétone pendant 4 heures.
- Inspectez le substrat en utilisant la microscopie électronique à balayage (MEB) pour confirmer forme et la taille nanostructure, enlever le chrome restant dans le substrat par gravure humide utilisant CR-7 décapant pendant 60 secondes à la température ambiante, puis rincer à DDW.
- Concevoir un espacement de 33 um centre-à-centre tableau pour laisser de la place pour l'imagerie cellulaire entre les tableaux. Motif les nanostructures à 20 x 20 modèle pour chaque tableau avec un terrain de 300 nm en utilisant un écrivain e-beam. Chaque puce contient 300 tableaux avec une dimension de nanostructure typique de la hauteur de 80 ± 2,5 nm et 70 nm ± 2,5 Diameter.
- Inspecter un sous-ensemble de tableaux en utilisant le microscope à force atomique (AFM) pour la vérification de la taille et de l'uniformité.
- Attacher une bague de support, typiquement du silicium, à l'arrière de la lamelle couvre-objet en utilisant un époxy durcissant aux UV.
2. Chip nettoyage et l'application de monocouche autoassemblée
- Pour le nettoyage et la régénération des frites, des cendres de plasma à une puissance de 40 W dans un mélange de 300 mTorr de 5% d'hydrogène, 95% d'argon pendant 45 sec après le nettoyage de la chambre pendant 5 min dans les mêmes conditions.
- Fonctionnaliser les nanostructures d'or immédiatement après incinération de plasma par immersion de la puce dans une solution éthanolique thiol à deux composants constitué d'un ratio de 3: 1 de SH (CH 2) 8 -EG 3 OH (SPO) et un composant avec soit une amine ou un groupe fonctionnel carboxyle, à savoir, SH (CH 2) 3 -NH 11 -EG 2 (SPN) ou SH (CH 2) 3 -COOH 11 -EG (SPC).
- Laissez la puce in la solution de thiol O / N afin de former une monocouche auto-assemblée (SAM).
- Rincer la puce à l'éthanol et sec avec de l'azote gazeux.
- Si nécessaire, stocker la puce fonctionnalisés pour un maximum de 2 semaines à 4 ° C.
- Lorsque vous êtes prêt pour une utilisation réagissent le SPN ou d'un composant de la CPS avec le ligand en utilisant une chimie en fonction du ligand de choix (voir ci-dessous).
Remarque: Les puces peuvent être régénérées et des dizaines de re-fonctionnalisés de fois. Une puce donnée peut être utilisée pour des périodes allant de 6 mois à plus d'un an. Les spectres mesurés sur un tableau donné sont reproduits de manière fiable après régénérations répétées par incinération au plasma, suivis par biofonctionnalisation 29.
3. fonctionnalisation de surface et Kinetic Caractérisation
Remarque: Utilisez la puce fonctionnalisés dans l'instrument SPR commerciale pour caractériser les constantes cinétiques entre le ligand et l'analyte, ainsi que d'étudier la résistance du SAM b non spécifiquerouver. Il ya une large gamme de débits et de dessins microfluidiques qui permettent efficace fonctionnalisation de surface. Puisque nous avons un disponible dans le commerce SPR nous normalisé autour de ses débits recommandés. Nous notons que ces débits sont typiques de tous les instruments de SPR et ainsi ne sont pas limitatives. L'instrument SPR est pas une nécessité puisque tous fonctionnalisation peut être effectuée directement sur la puce LSPR, mais il n'a réduire notre charge de travail, car il est un instrument multiplexé alors que notre configuration microfluidique LSPR est pas.
- Fonctionnaliser une puce d'or nue commerciale avec le SAM comme décrit dans la section 2.
- Si l'on utilise un SAM à base de CCP, activer le groupe carboxyle avec un mélange 1: 1 de 133 mM de 1-éthyl-3- (3-diméthylaminopropyl) carbodiimide (EDC) et de 33 mM de N-hydroxysuccinimide de (NHS) dans DDW à 10 min.
- Conjuguer le groupe carboxyle activé avec l'anticorps / ligand d'intérêt à 300 secondes en utilisant un débit de 30 ul / min. Préparer les ligands danstampon phosphate pH 6, typiquement, mais cela peut varier en fonction de la molécule.
- Après la conjugaison du ligand, le débit d'éthanolamine 0,1 M dans une solution saline tamponnée au phosphate (PBS) en tant qu'étape de désactivateur de 300 secondes à un débit de 30 ul / min. L'éthanolamine aide à minimiser la liaison non spécifique.
- Présentez l'analyte d'intérêt à un débit de 100 pi / min en utilisant une gamme de concentrations et de calculer les constantes cinétiques en utilisant un logiciel d'analyse cinétique.
- Si la liaison non spécifique est problématique, augmenter le ratio de SPO à la CPS ou SPN.
4. Paramètres LSPR générales
- Réglages du microscope:
- Utilisez une lampe halogène 100 W à Koehler éclairer l'échantillon. Utilisez un filtre passe longue (typiquement 593 nm de coupure) dans le trajet de la lumière pour éliminer les longueurs d'onde qui ne contribuent pas au changement de résonance (Figure 2).
- Pour la collecte de données LSPRi, utiliser un microscope inversé avec un IMMERSIO d'huile 40Xn objectif (1,4 NA) et un thermoélectriquement refroidi 16 bits caméra CCD.
- Placer un séparateur de faisceau à l'orifice de sortie du microscope pour l'imagerie et obtenir des spectres simultanément.
- Réglez la phase à température contrôlée de 37 à microscope ° C et équilibrer pendant 4 h.
- Incorporer un ensemble d'incubation supplémentaire sur le microscope pour réguler la concentration en CO 2 et de l'humidité à 5% et 95%, respectivement.
- Préparation de la puce et montage:
- Fonctionnaliser la puce LSPR comme décrit dans la section 2 avec les ratios SAM à deux composants optimales déterminées à partir des expériences de SPR.
- Charger la puce dans un support microfluidique sur mesure comme suit. Placez le jeton sur une pièce de fond en aluminium. Sandwich la puce entre cette pièce de fond et un joint de silicone et une pièce supérieure en plastique transparent. Utilisez 4 vis pour serrer l'ensemble.
- Pour une application à base de thiol-CPS typique, déposer manteau 300 pi d'un mélange 1: 1ture de 133 mM d'EDC et de NHS 33 mM dans du DDW à activer les groupes carboxyle du composant SPC thiol.
- Attendre 10 min et rincer manuellement la surface avec du PBS 10 mM.
- Conjuguer le groupe carboxyle activé avec le ligand (typiquement un anticorps ou fragment d'anticorps) de revêtement d'intérêt à goutte 300 ul de solution de ligand.
- Attendez 30 minutes et rincer manuellement avec PBS 10 mM.
- Déposez manteau 300 ul de 0,1 M éthanolamine dans du PBS sur la puce afin de minimiser la liaison non spécifique. Attendez 10 min.
- Laver l'éthanolamine avec du PBS contenant 0,005% de Tween 20 (PBS-T20).
- Placez un morceau de quartz au-dessus de la puce pour réduire les fluctuations dans les données liées à un changement ménisque.
- Gardez la puce humide avec du tampon PBS-T20 pendant le montage sur microscope.
- Placez l'ensemble de la puce LSPR fermement dans le porte-échantillon de scène chauffée et attachez un tube microfluidique.
- Fixez le tube de la microfluidique à l'Assemblée et de débit buffer (ou milieu sans sérum pour les études cellulaires) jusqu'à ce qu'un état d'équilibre est atteint.
- Permettre à l'Assemblée et microscope pour équilibrer pendant au moins 2 h.
- Aligner la puce en utilisant manette de commande de sorte que le réseau central est alignée avec la fibre optique pour la spectroscopie. Les données spectroscopiques est prise à l'aide d'un spectromètre et un logiciel d'analyse spectrale.
- Gardez tableaux en bref toute l'expérience en utilisant le logiciel de mise au point automatique, mise au point définitive Zeiss ou le dispositif de mise au point automatique équivalent.
5. LSPR imagerie des sécrétions anti-c-myc 9E10 de cellules hybridomes
Remarque: La lignée cellulaire d'hybridome utilisé pour cette étude exprime un anticorps anti-c-myc de manière constitutive et donc ne nécessitent pas un déclencheur chimique
- Fonctionnaliser les nanostructures avec c-myc peptide. Ceci a une valeur K D de 1,77 nM pour les anticorps anti-c-myc 9E10 sécrétés par le clone les cellules d'hybridome.
- Culture des cellules d'hybridome dans completmilieu de croissance avec 10 e% de sérum bovin fœtal (FBS) et 1% d'antibiotiques dans un flacon T75 à 37 ° C sous 5% de CO 2. Maintenir une densité cellulaire de 4 x 10 5 cellules / ml.
- Pour les études de sécrétion de la cellule, des cellules de pastilles à partir de la fiole T75 par centrifugation, laver deux fois avec du RPMI-1640 du milieu sans sérum (SFM) pour éliminer les anticorps sécrétés et ajuster la densité cellulaire à 4 × 10 6 cellules / ml.
- Récolter les cellules et les tests de viabilité avant leur introduction sur les puces de LSPR.
- Introduire 50 ul de la solution de cellules manuellement sur les puces LSPR avec une micropipette. Après quelques minutes de 25 à 50 cellules adhèrent à la surface des puces LSPR.
- Laver les cellules restantes en solution avec des produits frais GDF en utilisant le système de perfusion microfluidique.
- Sélectionnez les tableaux LSPR pour l'imagerie qui sont proches, à moins de 10 um, mais ne se chevauchent pas avec les cellules.
- Afin d'assurer que le signal est spécifique à l'anti-c-myc ANTIB sécrétéeOdies introduire les milieux de culture de cellules avec et sans les anticorps présents ainsi que avec les anticorps mais avec leurs sites de liaison sont bloquées par la présence d'une concentration saturante de peptide c-myc dans la solution.
- Étalonner les capteurs à la fin de chaque course avec une solution de saturation d'anticorps anti-c-myc (250 Nm). Cela contribue à la normalisation de la réponse des capteurs et de déterminer occupation partielle sur la base du profil de biofonctionnalisation de chaque terme.
- Corriger la dérive dans la direction X et Y en utilisant le logiciel d'alignement de l'image.
Résultats
Dans une étude typique de la sécrétion de cellules vivantes il ya plusieurs modes de collecte de données en cours. La figure 3 montre une superposition d'une image LSPRi, qui met en valeur les tableaux carrés, et une image éclairée de lumière transmise qui met en évidence la cellule en bas à gauche. Les données sont généralement collectées sur une période de 3 heures, suivi par l'introduction d'une solution saturante de l'analyte pour le calcul d'étalonnage, décrite ci-dessous. L'imagerie par fluorescence peut également être intégré dans le programme de collecte de données par la commutation automatique d'un cube de filtre. Sur la figure 4 une cellule colorée avec le colorant fluorescent de rhodamine DHPE membrane présente des extensions de lamellipodes-like (flèches). Si ces extensions étaient à se chevaucher avec les tableaux ils donnent un faux-positif pour la sécrétion de protéines. Ayant de multiples modes d'imagerie peut aider à identifier de tels événements.
La figure 5 montre des données de spectrométrie avant et à l'arrièreer l'introduction d'une solution de saturation (400 nM) de acheté dans le commerce anti-c-myc anticorps dirigés contre les groupements fonctionnalisés c-myc. Aucune cellule étaient présents dans cette expérience. Le spectre affiche à la fois un décalage vers le rouge et une augmentation de l'intensité. La différence entre les aires sous les deux courbes se traduit par une augmentation de la gamme d'intensité d'image en mode LSPRi sur la caméra CCD. Un non-linéaire approche moins d'analyse de données carrés a été développée pour déduire occupation partielle de surface lié ligands de spectres. 30,31
À la fin de l'expérience, les valeurs d'intensité saturé (c.-à-fractionnée occupation ≈ 1) sont utilisées pour calculer une réponse normalisée pour chaque tableau en utilisant la formule suivante:
Où sont l'intensité normalisée au moment t, l'intensité initiale au début de l'expérience, de l'intensité finale saturé, et l'intensité mesurée de la matrice au moment t , respectivement.
Les valeurs normalisées des deux réseaux sont montrés sur la figure 6. Une matrice est à l'intérieur de 10 um de la cellule à l'étude tandis que l'autre, utilisé comme témoin, a une distance de 130 um de la cellule. L'augmentation soudaine de la réponse normalisée de la matrice les plus proches de la cellule par rapport à la réponse linéaire de la matrice de contrôle est indicative d'une rafale localisée d'anticorps sécrétés.
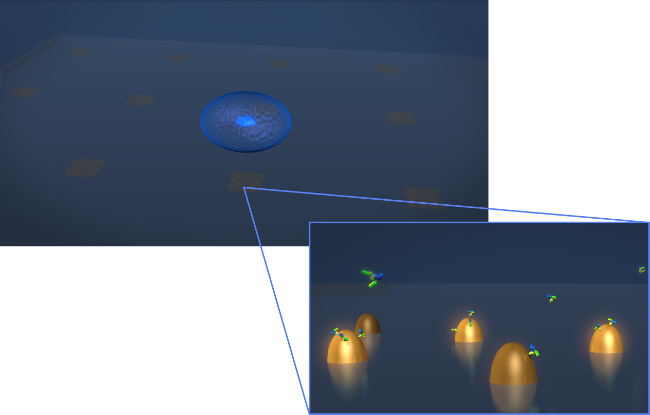
Figure 1. Capteur de conception. Un dessin représentant la géométrie d'une expérience de sécrétion de cellules vivantes typique. La cellule (sphéroïde bleu) est déposée sur la puce LSPR qui contient des tableaux de nanostructures d'or biofunctionalized. Dans la vue zoomée, la sécrétion de cellules d'intérêt, dans ce cas, les anticorps présentés comme des molécules en forme de Y, est mesuré comme ils se lient à la surfacedes nanostructures fonctionnalisés. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
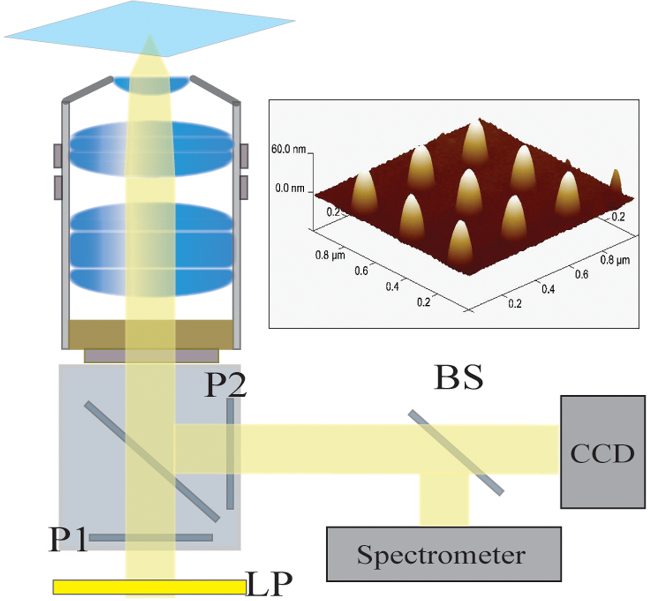
Figure 2. Configuration optique. La lumière éclairé par une lampe halogène est d'abord filtré par un filtre passe-long (PL). La lumière est polarisée linéairement (P1) et illumine l'échantillon par l'intermédiaire d'un objectif 40X / NA 1.4. La lumière diffusée est collectée par l'objectif et passé à travers un polariseur croisé (P2). Un diviseur de faisceau 50/50 (BS) est inséré dans le trajet lumineux collecté pour analyse spectroscopique simultanée et d'imagerie. En haut à droite:. Une image de microscopie à force atomique de 9 nanostructures individuelles séparées par un terrain de 300 nm S'il vous plaît cliquez icipour voir une version plus grande de cette figure.
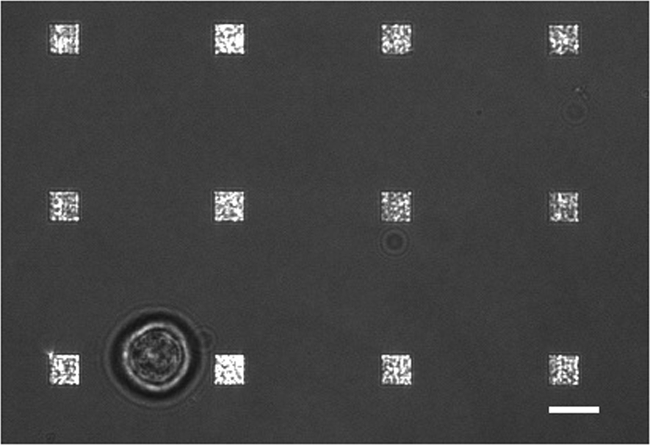
Figure 3. Live Cell LSPRi étude. Un fusionné lumière transmise et l'image LSPRi montrant une cellule d'hybridome unique (en bas à gauche) entouré par 12 tableaux. Ceci est une image de contraste amélioré. La barre d'échelle est de 10 um. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
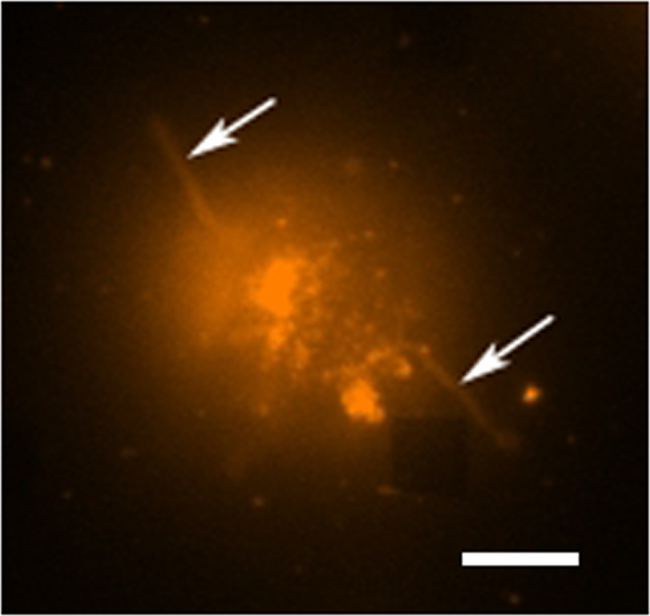
Figure 4. Live Cell étude fluorescence. Une image en fausse couleur fluorescente d'une seule cellule d'hybridome souillé avec de la rhodamine DHPE, qui est un colorant de membrane. Dans le mode de formation d'image fluorescent les tableaux ne sont généralement pas visible, cependant, est un réseau à proximité observable ici comme abmanque carré dans le coin inférieur droit. La cellule peut être vu pour être séparé de la matrice dont les extensions tentaculaires (éventuellement filopodia ou lamellipodes) sont étendant vers l'extérieur à partir des cellules (flèches). La barre d'échelle est de 10 um. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
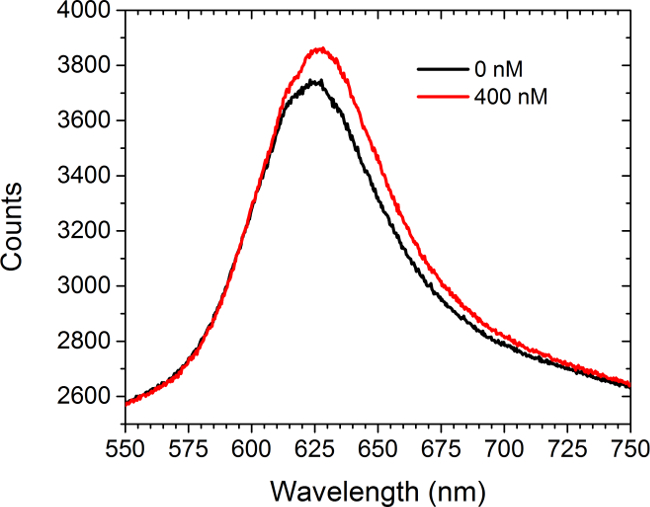
Figure 5. Modalité spectrale. Les spectres obtenus à partir d'une matrice fonctionnalisé c-myc, avant et après l'introduction de la solution 400 nM d'anticorps anti-c-myc. Aucune cellule étaient présents dans cette étude. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.

Figure 6. cellule unique sécrétion. La réponse d'un tableau situé à l'intérieur de 15 um d'une seule cellule et un situé 130 um distance (contrôle). La barre d'échelle est de 10 um. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
Discussion
The LSPR imaging technique described in this work has numerous advantages over more traditional methodologies for detecting cell secretions. First, the time resolution of our technique is on the order of seconds whereas the commercial alternative, an immunosandwhich assay known as EliSpot, has a typical time resolution of 2 to 3 days.7,32 As a result we were able to resolve sudden changes in the rate of protein secretion, such as that shown in Figure 6. Second, having arrays distributed over the chip allows for the secreted signal to be tracked in space and time which enables more rigorous comparisons to diffusion-based models of cell secretion. In addition, arrays like the control array shown in Figure 6 can be used to subtract out global changes in the image that typically arise from instrumental factors such as focus drift. Third, our technique requires no modification of the cells. If desired, the experiment can incorporate commonly used tags such as fluorescent proteins, but if there is concern that such tags may negatively affect cell viability or homeostasis the label-free nature of our approach does not require them. Fourth, using the spectroscopic data we have demonstrated that quantitative information regarding the fractional occupancy of surface bound ligands can be calculated.
There are numerous alternative methods to EBL for fabricating metallic nanoparticles. However, we have found that the EBL provides considerable flexibility for optimizing nanostructure and array dimensions to best suit the optics and the cells under investigation. Also critical is the fact that the chips can be readily regenerated by plasma ashing. In this way, a typical chip can be used dozens of times. Biofunctionalization details must be modified for the specific application. The protocol presented here conjugated the surface with relatively small c-myc peptide ligands. Larger ligands such as whole antibodies typically require more spacing and thus a higher SPO to SPN/SPC ratio. Regardless, a well formed SAM layer is essential for preventing non-specific binding in live-cell experiments. In general, larger molecular weight analytes are more readily detected by LSPR. Thus, in its single-cell manifestation, this technique may not be appropriate for detecting the secretion of small proteins, such as cytokines.
The current setup has been used for studying individual non-adherent cells. There are significant number of secreted signaling proteins and vesicles to which the results reported in this work are directly applicable. For example carcinoembryonic antigen (CEA) which for decades now has been a diagnostic marker for cancer. Colon cancer cells are known to secrete CEA at the rates of thousands of molecules/cell/hr and the molecular weight is 180 kDa which exceeds that of IgG antibodies. CEA is believed to be involved in autocrine and paracrine signaling pathways but the spatio-temporal nature of these secretions have never been measured. Our technique can directly address these signaling questions. An extension of this work will be to measure the spatio-temporal nature of CEA secretion from single cells.33 Future work will also focus on integrating LSPRi with two and three dimensional cell cultures of adherent cells. By incorporating multiplexed arrays capable of detecting a number of secreted proteins in parallel, this technique has the potential to open a new window into cell secretions and how they influence neighboring cells.
Déclarations de divulgation
We thank George Anderson for helpful comments and discussions. This work was supported by the Naval Research Laboratory’s Institute for Nanoscience and the National Research Council Research Associateship Award.
Remerciements
The authors have nothing to disclose.
matériels
| Name | Company | Catalog Number | Comments |
| 25mm diameter glass coverslips | Bioscience Tools | CSHP-No1.5-25 | 170±5 µm is optimal |
| Poly-methyl methacrylate | Microchem | PMMA 950 A4 | |
| Ethyl lactate methyl metacrylate | Microchem | MMA EL6 | |
| Electron beam evaporator | Temescal | FC-2000 | |
| Electron beam lithography | Raith | Series 150 | |
| Ethanol | Sigma-Aldrich | 459836 | |
| Acetone | Sigma-Aldrich | 320110 | |
| CR-7 chromium etchant | Cyantek | CR-7 | |
| Scanning electron microscope | Zeiss | Ultra 55 | |
| Atomic force microscope | Veeco | Nanoscope III | |
| Plasma ashing system | Technics | Series 85 RIE | |
| SH-(CH2)8-EG3-OH (SPO) | Prochimia | TH 001-m8.n3-0.2 | |
| SH-(CH2)11-EG3-COOH (SPC) | Prochimia | TH 003m11n3-0.1 | |
| SH-(CH2)11-EG3-NH2 (SPN) | Prochimia | TH 002-m11.n3-0.2 | |
| Surface plasmon resonance system | Biorad | XPR36 | |
| Bare gold chip | Biorad | GLC chip | Plasma ashed to remove the monolayer |
| 1-Ethyl-3-(3-dimethylaminopropyl) carbodiimide | Thermo | 22980 | |
| N-hydroxysuccinimide (NHS) | Thermo | 24510 | |
| Pentylamine-Biotin | Thermo | 21345 | |
| Ethanolamine | Sigma-Aldrich | E9508 | |
| Neutraavidin | Thermo | 31000 | |
| Phosphate buffered saline | Thermo | 28374 | |
| Tween 20 | Sigma-Aldrich | P2287 | |
| Inverted microscope | Zeiss | Axio Observer | Microscope is equipped with 40X oil immersion objective; CO2 and humidity incubation from Pecon GmbH |
| CCD camera | Hamamatsu | Orca R2 | Thermoelectrically cooled (16 bit) |
| Spectrometer | Ocean Optics | QE65Pro | |
| Spectrasuite | Ocean Optics | version1.4 | |
| c-myc peptide HyNic Tag | Solulink | SP-E003 | |
| monoclonal anti-c-myc antibody | Sigma-Aldrich | M4439 | |
| Hybridoma cell line | ATCC | CRL-1729 | |
| Antibiotic Antimycotic Solution (100×) | Sigma-Aldrich | A5955 | |
| Serum free media RPMI 1640 | Invitrogen | 11835-030 | |
| Fetal bovine serum | ATCC | 30-2020 | |
| Rhodamine DHPE | Life Technologies | L-1392 |
Références
- Ludwig, A. -. K., Giebel, B. Exosomes: Small vesicles participating in intercellular communication. The International Journal of Biochemistry & Cell Biology. 44, 11-15 (2012).
- Friedl, P., Gilmour, D. Collective cell migration in morphogenesis, regeneration and cancer. Nature Reviews Molecular Cell Biology. 10, 445-457 (2009).
- Letterio, J. J., Roberts, A. B. Regulation of immune responses by TGF-beta. Annual Review of Immunology. 16, 137-161 (1998).
- Werner, S., Grose, R. Regulation of wound healing by growth factors and cytokines. Physiological Reviews. 83, 835-870 (2003).
- Werner, S., Krieg, T., Smola, H. Keratinocyte-fibroblast interactions in wound healing. Journal of Investigative Dermatology. 127, 998-1008 (2007).
- Bailey, R. C., Kwong, G. A., Radu, C. G., Witte, O. N., Heath, J. R. DNA-encoded antibody libraries: A unified platform for multiplexed cell sorting and detection of genes and proteins. Journal of the American Chemical Society. 129, 1959-1967 (2007).
- Gazagne, A., et al. A Fluorospot assay to detect single T lymphocytes simultaneously producing multiple cytokines. Journal of Immunological Methods. 283, 91-98 (2003).
- Han, Q., et al. Polyfunctional responses by human T cells result from sequential release of cytokines. Proceedings of the National Academy of Sciences of the United States of America. 109, 1607-1612 (2012).
- Han, Q., Bradshaw, E. M., Nilsson, B., Hafler, D. A., Love, J. C. Multidimensional analysis of the frequencies and rates of cytokine secretion from single cells by quantitative microengraving. Lab on a Chip. 10, 1391-1400 (2010).
- Ma, C., et al. A clinical microchip for evaluation of single immune cells reveals high functional heterogeneity in phenotypically similar T cells. Nature Medicine. 17, 738-743 (2011).
- Shirasaki, Y., et al. Real-time single-cell imaging of protein secretion. Scientific Reports. 4, (2014).
- Milgram, S., et al. On chip real time monitoring of B-cells hybridoma secretion of immunoglobulin. Biosensors and Bioelectronics. 26, 2728-2732 (2011).
- Abbas, A., Linman, M. J., Cheng, Q. A. New trends in instrumental design for surface plasmon resonance-based biosensors. Biosensors & Bioelectronics. 26, 1815-1824 (2011).
- Ermakova, A., et al. Detection of a Few Metallo-Protein Molecules Using Color Centers in Nanodiamonds. Nano Letters. 13, 3305-3309 (2013).
- Haes, A. J., Van Duyne, R. P. A nanoscale optical blosensor: Sensitivity and selectivity of an approach based on the localized surface plasmon resonance spectroscopy of triangular silver nanoparticles. Journal of the American Chemical Society. 124, 10596-10604 (2002).
- Horowitz, V. R., Aleman, B. J., Christle, D. J., Cleland, A. N., Awschalom, D. D. Electron spin resonance of nitrogen-vacancy centers in optically trapped nanodiamonds. Proceedings of the National Academy of Sciences of the United States of America. 109, 13493-13497 (2012).
- Sepulveda, B., Angelome, P. C., Lechuga, L. M., Liz-Marzan, L. M. LSPR-based nanobiosensors. Nano Today. 4, 244-251 (2009).
- Barbillon, G., et al. Biological and chemical gold nanosensors based on localized surface plasmon resonance. Gold Bulletin. 40, 240-244 (2007).
- Endo, T., et al. Multiple label-free detection of antigen-antibody reaction using localized surface plasmon resonance-based core-shell structured nanoparticle layer nanochip. Analytical Chemistry. 78, 6465-6475 (2006).
- Endo, T., Kerman, K., Nagatani, N., Takamura, Y., Tamiya, E. Label-free detection of peptide nucleic acid-DNA hybridization using localized surface plasmon resonance based optical biosensor. Analytical Chemistry. 77, 6976-6984 (2005).
- Haes, A. J., Hall, W. P., Chang, L., Klein, W. L., Van Duyne, R. P. A localized surface plasmon resonance biosensor: First steps toward an assay for Alzheimer's disease. Nano Letters. 4, 1029-1034 (2004).
- Jonsson, M. P., Jonsson, P., Dahlin, A. B., Hook, F. Supported lipid bilayer formation and lipid-membrane-mediated biorecognition reactions studied with a new nanoplasmonic sensor template. Nano Letters. 7, 3462-3468 (2007).
- Park, J. H., et al. A regeneratable, label-free, localized surface plasmon resonance (LSPR) aptasensor for the detection of ochratoxin A.. Biosensors & Bioelectronics. 59, 321-327 (2014).
- Mayer, K. M., Hao, F., Lee, S., Nordlander, P., Hafner, J. H. A single molecule immunoassay by localized surface plasmon resonance. Nanotechnology. 21, (2010).
- Endo, T., Yamamura, S., Kerman, K., Tamiya, E. Label-free cell-based assay using localized surface plasmon resonance biosensor. Analytica Chimica Acta. 614, 182-189 (2008).
- Huang, Y. X., Cai, D., Chen, P. Micro- and Nanotechnologies for Study of Cell Secretion. Analytical Chemistry. 83, 4393-4406 (2011).
- Oh, B. R., et al. Integrated Nanoplasmonic Sensing for Cellular Functional Immunoanalysis Using Human Blood. ACS Nano. 8, 2667-2676 (2014).
- Raphael, M. P., Christodoulides, J. A., Delehanty, J. B., Long, J. P., Byers, J. M. Quantitative Imaging of Protein Secretions from Single Cells in Real Time. Biophysical Journal. 105, 602-608 (2013).
- Raphael, M. P., et al. A New Methodology for Quantitative LSPR Biosensing and Imaging. Analytical Chemistry. 84, 1367-1373 (2011).
- Raphael, M. P., et al. Quantitative LSPR imaging for biosensing with single nanostructure resolution. Biophysical Journal. 104, 30-36 (2013).
- Raphael, M. P., et al. A new methodology for quantitative LSPR biosensing and imaging. Analytical Chemistry. 84, 1367-1373 (2012).
- Henn, A. D., et al. Modulation of single-cell IgG secretion frequency and rates in human memory B cells by CpG DNA, CD40L, IL-21, and cell division. Journal of Immunology. 183, 3177-3187 (2009).
- Bramswig, K. H., et al. Soluble Carcinoembryonic Antigen Activates Endothelial Cells and Tumor Angiogenesis. Cancer Research. 73, 6584-6596 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon