Method Article
A técnica de livre-Label para a imagem espaço-temporal do Secreções única célula
Neste Artigo
Resumo
A comunicação inter-celular é crítico para controlar várias actividades fisiológicas dentro e fora da célula. Este documento descreve um protocolo para avaliar a natureza espaço-temporal de secreção das células individuais. Para conseguir isso, uma abordagem multidisciplinar é usado que integra livre-label nanoplasmonic sentindo com imagens de células vivas.
Resumo
Inter-cellular communication is an integral part of a complex system that helps in maintaining basic cellular activities. As a result, the malfunctioning of such signaling can lead to many disorders. To understand cell-to-cell signaling, it is essential to study the spatial and temporal nature of the secreted molecules from the cell without disturbing the local environment. Various assays have been developed to study protein secretion, however, these methods are typically based on fluorescent probes which disrupt the relevant signaling pathways. To overcome this limitation, a label-free technique is required.
In this paper, we describe the fabrication and application of a label-free localized surface plasmon resonance imaging (LSPRi) technology capable of detecting protein secretions from a single cell. The plasmonic nanostructures are lithographically patterned onto a standard glass coverslip and can be excited using visible light on commercially available light microscopes. Only a small fraction of the coverslip is covered by the nanostructures and hence this technique is well suited for combining common techniques such as fluorescence and bright-field imaging.
A multidisciplinary approach is used in this protocol which incorporates sensor nanofabrication and subsequent biofunctionalization, binding kinetics characterization of ligand and analyte, the integration of the chip and live cells, and the analysis of the measured signal. As a whole, this technology enables a general label-free approach towards mapping cellular secretions and correlating them with the responses of nearby cells.
Introdução
Comunicação inter-celular é crucial para a regulação de muitas atividades fisiológicas dentro e fora da célula. Uma variedade de proteínas e vesículas pode ser secretado que posteriormente desencadear processos celulares complexos, tais como a diferenciação, a cicatrização de feridas, a resposta imune, migração, proliferação e. 1-5 O mau funcionamento de vias de sinalização inter-celulares têm sido implicados em numerosas doenças, incluindo o cancro, aterosclerose , e diabetes, para citar alguns.
O ensaio de secreção celular óptima deve ser capaz de espacialmente e temporalmente o mapeamento da proteína segregada de interesse sem interromper as vias de sinalização relevantes. Desta forma relações causais entre os perfis de concentração e a resposta das células receptoras pode ser inferida. Infelizmente, muitas das técnicas baseadas em fluorescência mais geralmente utilizados não satisfazem estes critérios. Proteínas de fusão fluorescentes podem ser utilizadas para etiquetar o analito Within da célula, mas podem interromper a via secretora, ou, se segregado, resulta em uma luz difusa no exterior da célula que é difícil de quantificar. Ensaios baseados em immunosandwich fluorescentes são as técnicas mais vulgarmente utilizadas para a detecção de secreções celulares, mas tipicamente requerem o isolamento de células individuais. 6-11 Além disso, a introdução do anticorpo de detecção, tipicamente interrompe ou termina a experiência e o tamanho das etiquetas de anticorpos, 150 kDa para IgG, é um impedimento para sinalização a jusante.
Devido a estas barreiras é preferível que uma técnica livre rótulo ser utilizado para secreção de proteínas e entre tecnologias de imagem livre de etiquetas existentes, a superfície de ressonância de plasmão (SPR) e sensores localizados de ressonância de plasmon de superfície (LSPR) são excelentes candidatos. 12-17 Estes sensores têm sido amplamente utilizados para estudos de ligação de analisável, exossomas de proteínas e outros biomarcadores. 18-24 Em caso de LSPR, o nanostr plasmonicuctures pode ser modelado lithographically em lamelas de vidro e animado usando luz visível através de configurações padrão de microscopia de campo amplo. Devido à sua presença em nanoescala, a maioria do substrato de vidro está disponível para imagens técnicas comuns, tais como de campo brilhante e microscopia de fluorescência tornando assim estas sondas adequados para integração com microscopia de células vivas. 25-28 Demonstrámos a medição em tempo real de secreção de anticorpos a partir de células de hibridoma utilizando nanoestruturas plasmonic ouro funcionalizado com resoluções espaciais e temporais de 225 mseg e 10 uM, respectivamente. A configuração básica do chip é ilustrado na Figura 1. 28 O percurso de luz de saída do microscópio é dividido entre uma câmara CCD usada para aparência e um espectrómetro de fibra-opticamente acoplada para a determinação quantitativa de ocupação fraccionada de uma dada matriz de nanoestruturas (Figura 2 ).
O PROTOCol apresentada neste documento descreve a concepção experimental para a medição em tempo real das secreções celulares individuais enquanto monitorando simultaneamente a resposta das células utilizando a microscopia de campo brilhante padrão. A abordagem multidisciplinar inclui a fabricação de nanoestruturas, funcionalização das nanoestruturas para a ligação de analitos de elevada afinidade, a optimização da superfície tanto para minimizar a ligação não específica e caracterização das constantes cinéticas usando uma superfície comercial Plasmon Resonance (SPR) instrumento, a integração de linhas celulares sobre o substrato, e a análise de imagens e de dados espectrais. Prevemos que esta técnica seja uma tecnologia capacitadora para o mapeamento espaço-temporal das secreções celulares e suas relações causais com células receptoras.
Protocolo
1. Nanostructure Fabrication
- Escolha de 25 mm de diâmetro, com lamelas de vidro de uma espessura aproximada de 170 fim (N ° 1.5) como substratos para nanofabrication.
- Mergulhar as lamelas em solução de piranha (razão 3: 1 de ácido sulfúrico e peróxido de hidrogénio) durante pelo menos 6 horas. Lavar a piranha lamela embebido com quantidade abundante de ultrapura 18,2 mohms água destilada deionizada (DDW).
CUIDADO: Piranha ácido reage violentamente com materiais orgânicos e devem ser manuseados com extremo cuidado. - Depósito de 10 nm de crómio película fina sobre as lamelas por evaporação e-feixe para evitar os efeitos de carga durante a modelação e de imagem de nanoestruturas.
- Girar a primeira camada da camada dupla de resistir constituído por metacrilato de etil lactato de metilo copolímero (MMA_EL6) a 2.000 rpm durante 45 segundos e, em seguida, cozer a 150 ° C. Girar a segunda camada de poli-metacrilato de metilo (950PMMA_A2) a 3.000 rpm durante 45 segundos, em seguida, cozer a 180 ° C.
- Tamborilarn bicamada resistir usando a litografia por feixe de elétrons (EBL) a 25 kV com uma dose de 300 uC / cm 2 de área. Desenvolver em álcool isopropílico (IPA) / metil-isobutil-cetona (MIBK): 2/1 e enxaguar em IPA.
- Depósito Ti (5 milhas náuticas) / Au (80 nm) filme sobre o substrato usando um evaporador e-feixe.
- Após a deposição de ouro, levante a bicamada copolímero resistir por imersão do substrato em acetona, durante 4 h.
- Inspecione o suporte usando o microscópio eletrônico de varredura (MEV) para confirmar a forma e tamanho nanoestrutura, remover o cromo restante do substrato via etch molhado usando CR-7 etchant durante 60 segundos à temperatura ambiente e depois enxaguar em DDW.
- Projete um espaçamento de centro a centro matriz de 33 mm de deixar espaço para imagens de células entre matrizes. Padrão as nanoestruturas em 20 x 20 padrão para cada matriz com um arremesso de 300 nm usando um escritor e-feixe. Cada chip contém 300 arrays com uma dimensão típica nanoestrutura de altura de 80 ± 2,5 nm e 70 nm ± 2,5 Diameter.
- Inspecione um subconjunto de arrays usando o microscópio de força atômica (AFM) para a verificação do tamanho e uniformidade.
- Anexar um anel de suporte, tipicamente, de silício, para a parte de trás da lamela utilizando um epoxi de cura por UV.
2. Chip Limpeza e Aplicação de auto-montados Monolayer
- Para a limpeza e regeneração das batatas fritas, as cinzas de plasma a uma potência de 40 W em uma mistura de 300 mTorr de 5% de hidrogénio, 95% de árgon, durante 45 segundos após a limpeza da câmara durante 5 min sob as mesmas condições.
- Funcionalizar o nanoestruturas de ouro imediatamente após a calcinação por plasma pela imersão do chip em uma solução etanólica tiol de dois componentes consistindo de uma proporção 3: 1 de SH-(CH2) 8 EG 3 -OH (SPO) e um componente ou com uma amina carboxilo ou grupo funcional, ou seja, SH- (CH2) 11 EG 3 -NH2 (SPN) ou SH- (CH2) 3-COOH 11 EG (SPC).
- Deixe o chip de in a solução tiol O / N para formar uma monocamada auto-montada (SAM).
- Lavar o chip com etanol e seco com azoto gasoso.
- Se necessário, armazenar o chip funcionalizado por até 2 semanas a 4 ° C.
- Quando pronto para uso reagir o SPN ou componente SPC com o ligando utilizando uma química de acordo com o ligando de escolha (ver abaixo).
Nota: Os chips podem ser regenerado e re-funcionalizado dezenas de vezes. Um dado chip pode ser usado por períodos que variam de 6 meses a mais de um ano. O espectro medido em uma determinada matriz são reproduzidas de forma confiável após repetidas regenerações por incineração plasma, seguido de biofunctionalization. 29
3. A funcionalização de superfície e Caracterização Cinética
Nota: usar o chip funcionalizado no instrumento comercial SPR para caracterizar as constantes cinéticas entre o ligando e o analito, bem como para o estudo da resistência de SAM para não específica binding. Existe uma vasta gama de taxas de fluxo e desenhos de microfluidos que permitem para a funcionalização da superfície eficiente. Como temos um SPR disponível comercialmente padronizamos em torno de suas taxas de fluxo recomendados. Notamos que estas taxas de fluxo são típicos de todos os instrumentos da SPR e por isso não são restritivas. O instrumento SPR não é uma necessidade uma vez que todos funcionalização pode ser feito diretamente no chip LSPR, mas fez reduzir a nossa carga de trabalho porque é um instrumento multiplexado ao passo que a nossa configuração microfluídico LSPR não é.
- Funcionalizar um chip nua ouro comercial com a SAM, conforme descrito na Seção 2.
- Se for utilizada uma SAM com base SPC, activar o grupo carboxilo, com uma mistura 1: 1 de 133 mM de 1-etil-3- (3-dimetilaminopropil) carbodiimida (EDC) 33 mM e N-hidroxissuccinimida de (NHS) em DDW durante 10 min.
- Conjugar o grupo carboxilo activado com o anticorpo / ligando de interesse para 300 seg usando um caudal de 30 ul / min. Prepare os ligandos empH 6 tampão fosfato, tipicamente, mas este pode variar dependendo da molécula.
- Após a conjugação ligando, fluxo de 0,1 M de etanolamina em solução salina tamponada com fosfato (PBS) como um desactivador de passo para 300 seg a uma taxa de 30 ul / min. Etanolamina ajuda a minimizar a ligação não específica.
- Introduzir o analito de interesse a um caudal de 100 ul / min usando uma gama de concentrações e calcular as constantes de velocidade cinéticas, utilizando um software de análise cinética.
- Se a ligação não específica é problemático, aumentar a proporção de SPO SPC ou SPN.
Definições 4. LSPR Gerais
- Microscópio configurações:
- Use uma lâmpada de 100 W halogênio para Koehler iluminar a amostra. Usar um filtro de passagem longa (tipicamente 593 nm de corte) no caminho da luz para eliminar comprimentos de onda que não contribuem para o deslocamento de ressonância (Figura 2).
- Para a coleta de dados LSPRi, use um microscópio invertido com um immersio óleo de 40Xobjectivo N (1,4 NA) e uma câmara CCD arrefecida termoelectricamente de 16 bits.
- Coloque um divisor de feixe para a porta de saída do microscópio para obter espectros de aparência e simultaneamente.
- Regule a temperatura controlada palco microscópio para 37 ° C e equilibrar durante 4 h.
- Incorporar uma montagem de incubação adicional sobre o microscópio para regular a concentração de humidade e de CO2 a 5% e 95%, respectivamente.
- Chip preparação e montagem:
- Funcionalizar o chip LSPR como descrito na secção 2, com as relações de SAM de dois componentes óptimos determinados a partir das experiências de SPR.
- Coloque o chip dentro de um titular microfluídico feito sob encomenda da seguinte forma. Coloque o chip em uma parte inferior de alumínio. Sanduíche do chip entre esta parte inferior e uma junta de silicone e um pedaço de plástico transparente superior. Use 4 parafusos para fixar o conjunto.
- Para uma aplicação tiol típico baseado no SPC, queda revestimento 300 � de 1: 1 mixtura de 133 mM de EDC e 33 mM de NHS em DDW para activar os grupos carboxilo do componente tiol SPC.
- Esperar durante 10 min e enxaguar manualmente a superfície com PBS 10 mM.
- Conjugar o grupo carboxilo activado com o ligando (tipicamente um anticorpo ou fragmento de anticorpo) de interesse a gota revestimento 300 ul de solução de ligando.
- Aguarde 30 minutos e enxágüe manualmente com PBS 10 mM.
- Largar coat 300 mL de etanolamina 0,1 M em PBS no chip para minimizar a ligação não específica. Aguarde 10 min.
- Lava-se a etanolamina com PBS contendo 0,005% de Tween 20 (PBS-T20).
- Coloque um pedaço de quartzo acima do chip para reduzir as flutuações nos dados relacionados a um menisco mudança.
- Mantenha o chip molhado com tampão PBS-T20, enquanto a montagem em microscópio.
- Coloque o conjunto de chips LSPR firmemente no suporte de amostras a fase aquecida e prenda o tubo de microfluidos.
- Conecte a tubulação de microfluídica à montagem e de fluxo de buffer (ou meio livre de soro para estudos de células) até um estado de equilíbrio é atingido.
- Permitir que o conjunto de microscópio e a equilibrar durante pelo menos 2 horas.
- Alinhar o chip utilizando joystick de modo que a matriz central é alinhado com a fibra óptica para a espectroscopia. Os dados espectroscópicos são feitas usando um espectrómetro e software de análise espectral.
- Mantenha matrizes em foco durante todo o experimento usando autofocus software, Zeiss Definite Focus ou dispositivo equivalente autofocus.
5. LSPR imagem de secreções-c-myc Anti de Células de hibridoma 9E10
Nota: A linha celular de hibridoma utilizado para este estudo expressam o anticorpo anti-c-myc de forma constitutiva e, portanto, não requerem um gatilho química
- Funcionalizar o nanoestruturas com péptido c-myc. Isto tem um valor de K D de 1,77 nM para os anticorpos anti-c-myc 9E10 secretados pelo clone de hibridoma de células.
- Cultura as células de hibridoma em complete meio de crescimento com 10% de soro fetal de bovino (FBS) e 1% de antibióticos num balão T75 a 37 ° C sob 5% de CO 2. Manter uma densidade celular de 4 x 10 5 células / ml.
- Para os estudos da secreção de células, as células pellet a partir do balão T75 por centrifugação, lava-se duas vezes com RPMI-1640 livre de soro meios (SFM) para remover os anticorpos segregados e ajustar a densidade celular a 4 x 10 6 células / ml.
- Colheita das células e teste de viabilidade antes de introduzir-los para os chips LSPR.
- Introduzir 50 ul da solução de células manualmente sobre os chips LSPR com uma micropipeta. Depois de alguns minutos, de 25 a 50 células aderem à superfície das batatas fritas LSPR.
- Lave as células restantes em solução com fresco SFM usando o sistema de perfusão microfluídico.
- Selecione as matrizes LSPR para imagens que estejam próximas, num raio de 10 mm, mas não se sobrepõem com as células.
- Para assegurar que o sinal é específico para o ANTIB anti-c-myc segregadaodies introduzir o meio de cultura de células com e sem os anticorpos presentes, bem como com os anticorpos, mas com os seus locais de ligação bloqueada pela presença de uma concentração saturante de c-myc péptido na solução.
- Calibrar os sensores no final de cada ensaio com uma solução satura de anticorpos anti-c-myc (250 nm). Isto ajuda na normalização da resposta dos sensores e determinam ocupação fraccionada com base no perfil biofunctionalization de cada prazo.
- Corrigir a deriva na direção X e Y usando software de alinhamento de imagem.
Resultados
Em um estudo típico secreção de células vivas existem vários modos de recolha de dados em curso. A Figura 3 mostra uma sobreposição de uma imagem LSPRi, que destaca as matrizes quadradas, e uma imagem iluminada da luz transmitida que destaca a célula no canto inferior esquerdo. Os dados são tipicamente recolhida durante um período de 3 horas seguido pela introdução de uma solução satura da substância a analisar para o cálculo de normalização descrito abaixo. Imagens de fluorescência também pode ser integrado na rotina de recolha de dados pela comutação automática de um cubo de filtro. Na Figura 4 uma célula corada com o corante fluorescente rodamina DHPE membrana apresenta extensões lamellipodia-like (setas). Se essas extensões foram a sobrepor-se com as matrizes que iriam dar um falso-positivo para a secreção de proteínas. Tendo vários modos de imagem podem ajudar a identificar essas ocorrências.
A Figura 5 mostra dados de espectrometria de antes e réer a introdução de uma solução de saturação (400 nM) de comercialmente adquirido anticorpos anti-c-myc para as matrizes funcionalizados c-myc. Não células estavam presentes nesta experiência. O espectro mostra tanto um desvio para o vermelho e um aumento na intensidade. A diferença entre as áreas sob as curvas de duas resulta em um aumento na intensidade de imagem na matriz de modo LSPRi na câmara CCD. Uma abordagem menos análise de dados quadrados não-linear foi desenvolvido para inferir ocupação fraccionada ligada à superfície de ligandos a partir dos espectros 30,31.
No final da experiência, os valores de intensidade saturado (isto é, ocupação fraccionada ≈ 1) são utilizados para calcular uma resposta normalizada para cada matriz com a seguinte fórmula:
Onde são a intensidade normalizada no ponto do tempo t, a intensidade inicial no início da experiência, intensidade final saturado, e a intensidade medida da matriz no ponto de tempo t , respectivamente.
Os valores normalizados a partir de duas matrizes são mostrados na Figura 6. Uma matriz estava dentro de 10 um da célula sob investigação enquanto a outra, utilizada como controlo, era uma distância de 130 um a partir da célula. O aumento repentino na resposta normalizados da matriz mais próxima à célula, relativamente à resposta plana da matriz de controlo é indicativo de uma explosão localizada de anticorpos segregados.
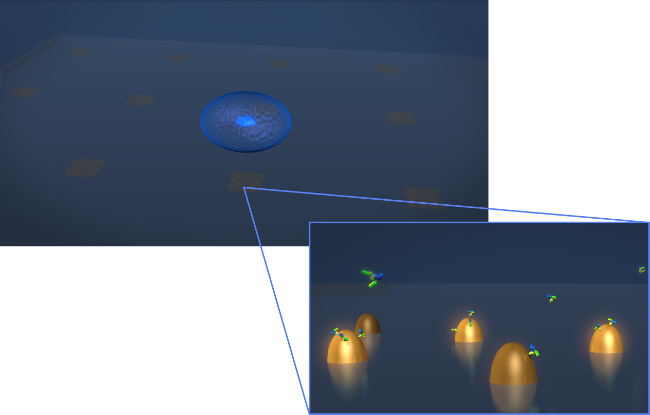
Figura 1. Sensor de design. Um desenho que representa a geometria de uma experiência típica a secreção de células vivas. A célula (esferóide azul) é depositada sobre o chip para LSPR que contém as matrizes de nanoestruturas bioativa de ouro. Na vista ampliada em, a secreção de células de interesse, neste caso mostrado anticorpos como moléculas em forma de Y, é medida à medida que se ligam à superfíciedas nanoestruturas funcionalizadas. Por favor clique aqui para ver uma versão maior desta figura.
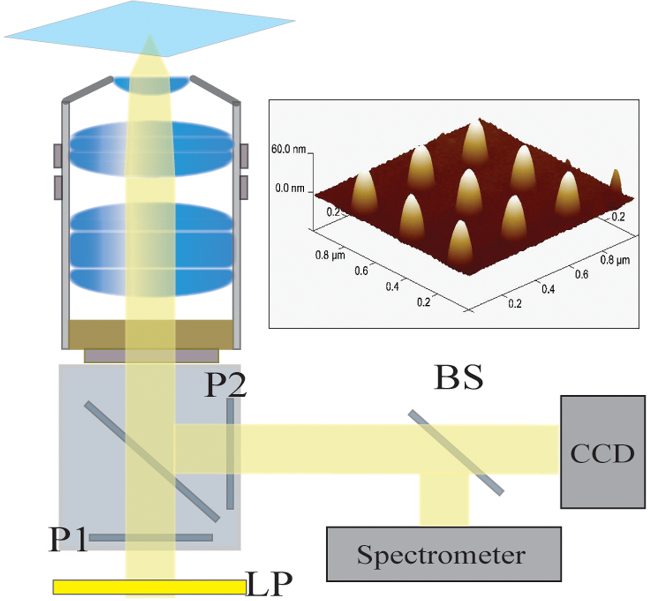
Figura 2. Configuração óptica. A luz iluminada por uma lâmpada halógena é filtrado primeiro por um filtro de passagem longa (LP). A luz é polarizada linearmente (P1) e ilumina a amostra através de um NA objetiva de 40X / 1.4. A luz dispersa é recolhido por o objectivo e passados através de um polarizador cruzado (P2). Um divisor de feixe 50/50 (BS) é inserido no caminho de luz coletada para espectroscópica simultânea e análise de imagens. Top Right:. Uma imagem microscopia de força atômica de 9 nanoestruturas individuais separados por um campo de 300 nm por favor clique aquipara ver uma versão maior desta figura.
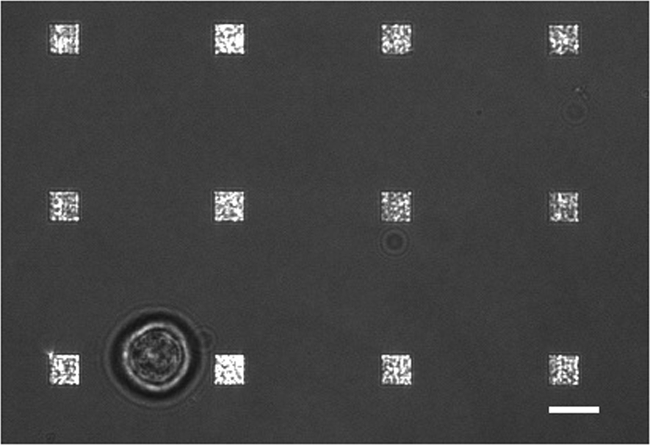
LSPRi Figura 3. Estudo de células vivas. Um fundiu imagem LSPRi luz transmitida e que mostra uma única célula de hibridoma (inferior esquerdo), circundado por 12 matrizes. Esta é uma imagem de contraste melhorado. Barra de escala é de 10 mm. Por favor clique aqui para ver uma versão maior desta figura.
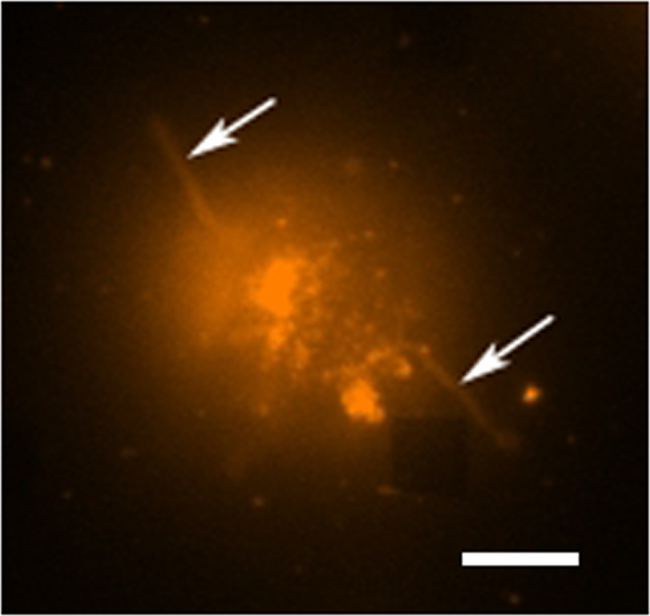
Figura 4. Estudo de fluorescência de células vivas. Uma imagem em cores falsas fluorescente de uma única célula de hibridoma DHPE coradas com rodamina, o qual é um corante de membrana. No modo de imagiologia fluorescente as matrizes não são geralmente visíveis, no entanto, um conjunto próxima é observável como aqui abfalta quadrado no canto inferior direito. A célula pode ser visto para ser separada da matriz embora as extensões tentáculo-like (possivelmente filopodia ou lamellipodia) são estende para fora a partir das células (setas). Barra de escala é de 10 mm. Por favor clique aqui para ver uma versão maior desta figura.
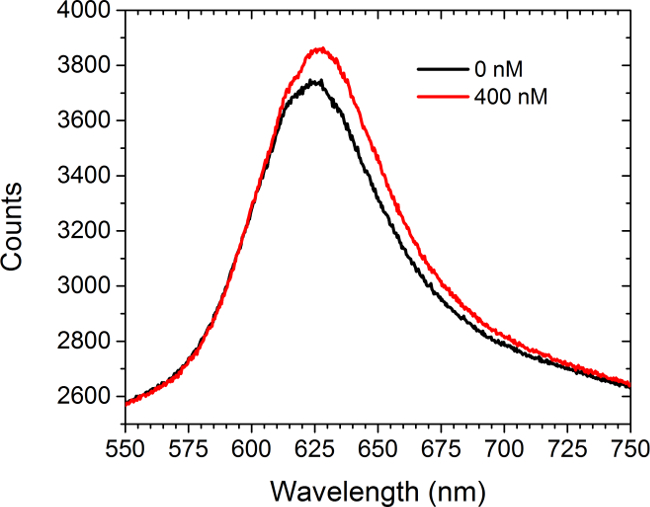
Figura 5. Modalidade espectral. O espectro obtido a partir de uma matriz funcionalizada C-myc antes e após a introdução da solução de 400 nM de anticorpos anti-c-myc. Não células estavam presentes neste estudo. Por favor clique aqui para ver uma versão maior desta figura.

Figura 6. A secreção única célula. A resposta de uma matriz de 15 um localizado dentro de uma única célula e um localizado 130 um de distância (de controlo). Barra de escala é de 10 mm. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
The LSPR imaging technique described in this work has numerous advantages over more traditional methodologies for detecting cell secretions. First, the time resolution of our technique is on the order of seconds whereas the commercial alternative, an immunosandwhich assay known as EliSpot, has a typical time resolution of 2 to 3 days.7,32 As a result we were able to resolve sudden changes in the rate of protein secretion, such as that shown in Figure 6. Second, having arrays distributed over the chip allows for the secreted signal to be tracked in space and time which enables more rigorous comparisons to diffusion-based models of cell secretion. In addition, arrays like the control array shown in Figure 6 can be used to subtract out global changes in the image that typically arise from instrumental factors such as focus drift. Third, our technique requires no modification of the cells. If desired, the experiment can incorporate commonly used tags such as fluorescent proteins, but if there is concern that such tags may negatively affect cell viability or homeostasis the label-free nature of our approach does not require them. Fourth, using the spectroscopic data we have demonstrated that quantitative information regarding the fractional occupancy of surface bound ligands can be calculated.
There are numerous alternative methods to EBL for fabricating metallic nanoparticles. However, we have found that the EBL provides considerable flexibility for optimizing nanostructure and array dimensions to best suit the optics and the cells under investigation. Also critical is the fact that the chips can be readily regenerated by plasma ashing. In this way, a typical chip can be used dozens of times. Biofunctionalization details must be modified for the specific application. The protocol presented here conjugated the surface with relatively small c-myc peptide ligands. Larger ligands such as whole antibodies typically require more spacing and thus a higher SPO to SPN/SPC ratio. Regardless, a well formed SAM layer is essential for preventing non-specific binding in live-cell experiments. In general, larger molecular weight analytes are more readily detected by LSPR. Thus, in its single-cell manifestation, this technique may not be appropriate for detecting the secretion of small proteins, such as cytokines.
The current setup has been used for studying individual non-adherent cells. There are significant number of secreted signaling proteins and vesicles to which the results reported in this work are directly applicable. For example carcinoembryonic antigen (CEA) which for decades now has been a diagnostic marker for cancer. Colon cancer cells are known to secrete CEA at the rates of thousands of molecules/cell/hr and the molecular weight is 180 kDa which exceeds that of IgG antibodies. CEA is believed to be involved in autocrine and paracrine signaling pathways but the spatio-temporal nature of these secretions have never been measured. Our technique can directly address these signaling questions. An extension of this work will be to measure the spatio-temporal nature of CEA secretion from single cells.33 Future work will also focus on integrating LSPRi with two and three dimensional cell cultures of adherent cells. By incorporating multiplexed arrays capable of detecting a number of secreted proteins in parallel, this technique has the potential to open a new window into cell secretions and how they influence neighboring cells.
Divulgações
We thank George Anderson for helpful comments and discussions. This work was supported by the Naval Research Laboratory’s Institute for Nanoscience and the National Research Council Research Associateship Award.
Agradecimentos
The authors have nothing to disclose.
Materiais
| Name | Company | Catalog Number | Comments |
| 25 mm diameter glass coverslips | Bioscience Tools | CSHP-No1.5-25 | 170±5 µm is optimal |
| Poly-methyl methacrylate | Microchem | PMMA 950 A4 | |
| Ethyl lactate methyl metacrylate | Microchem | MMA EL6 | |
| Electron beam evaporator | Temescal | FC-2000 | |
| Electron beam lithography | Raith | Series 150 | |
| Ethanol | Sigma-Aldrich | 459836 | |
| Acetone | Sigma-Aldrich | 320110 | |
| CR-7 chromium etchant | Cyantek | CR-7 | |
| Scanning electron microscope | Zeiss | Ultra 55 | |
| Atomic force microscope | Veeco | Nanoscope III | |
| Plasma ashing system | Technics | Series 85 RIE | |
| SH-(CH2)8-EG3-OH (SPO) | Prochimia | TH 001-m8.n3-0.2 | |
| SH-(CH2)11-EG3-COOH (SPC) | Prochimia | TH 003m11n3-0.1 | |
| SH-(CH2)11-EG3-NH2 (SPN) | Prochimia | TH 002-m11.n3-0.2 | |
| Surface plasmon resonance system | Biorad | XPR36 | |
| Bare gold chip | Biorad | GLC chip | Plasma ashed to remove the monolayer |
| 1-Ethyl-3-(3-dimethylaminopropyl) carbodiimide | Thermo | 22980 | |
| N-hydroxysuccinimide (NHS) | Thermo | 24510 | |
| Pentylamine-Biotin | Thermo | 21345 | |
| Ethanolamine | Sigma-Aldrich | E9508 | |
| Neutraavidin | Thermo | 31000 | |
| Phosphate buffered saline | Thermo | 28374 | |
| Tween 20 | Sigma-Aldrich | P2287 | |
| Inverted microscope | Zeiss | Axio Observer | Microscope is equipped with 40X oil immersion objective; CO2 and humidity incubation from Pecon GmbH |
| CCD camera | Hamamatsu | Orca R2 | Thermoelectrically cooled (16 bit) |
| Spectrometer | Ocean Optics | QE65Pro | |
| Spectrasuite | Ocean Optics | version1.4 | |
| c-myc peptide HyNic Tag | Solulink | SP-E003 | |
| monoclonal anti-c-myc antibody | Sigma-Aldrich | M4439 | |
| Hybridoma cell line | ATCC | CRL-1729 | |
| Antibiotic Antimycotic Solution (100×) | Sigma-Aldrich | A5955 | |
| Serum free media RPMI 1640 | Invitrogen | 11835-030 | |
| Fetal bovine serum | ATCC | 30-2020 | |
| Rhodamine DHPE | Life Technologies | L-1392 |
Referências
- Ludwig, A. -. K., Giebel, B. Exosomes: Small vesicles participating in intercellular communication. The International Journal of Biochemistry & Cell Biology. 44, 11-15 (2012).
- Friedl, P., Gilmour, D. Collective cell migration in morphogenesis, regeneration and cancer. Nature Reviews Molecular Cell Biology. 10, 445-457 (2009).
- Letterio, J. J., Roberts, A. B. Regulation of immune responses by TGF-beta. Annual Review of Immunology. 16, 137-161 (1998).
- Werner, S., Grose, R. Regulation of wound healing by growth factors and cytokines. Physiological Reviews. 83, 835-870 (2003).
- Werner, S., Krieg, T., Smola, H. Keratinocyte-fibroblast interactions in wound healing. Journal of Investigative Dermatology. 127, 998-1008 (2007).
- Bailey, R. C., Kwong, G. A., Radu, C. G., Witte, O. N., Heath, J. R. DNA-encoded antibody libraries: A unified platform for multiplexed cell sorting and detection of genes and proteins. Journal of the American Chemical Society. 129, 1959-1967 (2007).
- Gazagne, A., et al. A Fluorospot assay to detect single T lymphocytes simultaneously producing multiple cytokines. Journal of Immunological Methods. 283, 91-98 (2003).
- Han, Q., et al. Polyfunctional responses by human T cells result from sequential release of cytokines. Proceedings of the National Academy of Sciences of the United States of America. 109, 1607-1612 (2012).
- Han, Q., Bradshaw, E. M., Nilsson, B., Hafler, D. A., Love, J. C. Multidimensional analysis of the frequencies and rates of cytokine secretion from single cells by quantitative microengraving. Lab on a Chip. 10, 1391-1400 (2010).
- Ma, C., et al. A clinical microchip for evaluation of single immune cells reveals high functional heterogeneity in phenotypically similar T cells. Nature Medicine. 17, 738-743 (2011).
- Shirasaki, Y., et al. Real-time single-cell imaging of protein secretion. Scientific Reports. 4, (2014).
- Milgram, S., et al. On chip real time monitoring of B-cells hybridoma secretion of immunoglobulin. Biosensors and Bioelectronics. 26, 2728-2732 (2011).
- Abbas, A., Linman, M. J., Cheng, Q. A. New trends in instrumental design for surface plasmon resonance-based biosensors. Biosensors & Bioelectronics. 26, 1815-1824 (2011).
- Ermakova, A., et al. Detection of a Few Metallo-Protein Molecules Using Color Centers in Nanodiamonds. Nano Letters. 13, 3305-3309 (2013).
- Haes, A. J., Van Duyne, R. P. A nanoscale optical blosensor: Sensitivity and selectivity of an approach based on the localized surface plasmon resonance spectroscopy of triangular silver nanoparticles. Journal of the American Chemical Society. 124, 10596-10604 (2002).
- Horowitz, V. R., Aleman, B. J., Christle, D. J., Cleland, A. N., Awschalom, D. D. Electron spin resonance of nitrogen-vacancy centers in optically trapped nanodiamonds. Proceedings of the National Academy of Sciences of the United States of America. 109, 13493-13497 (2012).
- Sepulveda, B., Angelome, P. C., Lechuga, L. M., Liz-Marzan, L. M. LSPR-based nanobiosensors. Nano Today. 4, 244-251 (2009).
- Barbillon, G., et al. Biological and chemical gold nanosensors based on localized surface plasmon resonance. Gold Bulletin. 40, 240-244 (2007).
- Endo, T., et al. Multiple label-free detection of antigen-antibody reaction using localized surface plasmon resonance-based core-shell structured nanoparticle layer nanochip. Analytical Chemistry. 78, 6465-6475 (2006).
- Endo, T., Kerman, K., Nagatani, N., Takamura, Y., Tamiya, E. Label-free detection of peptide nucleic acid-DNA hybridization using localized surface plasmon resonance based optical biosensor. Analytical Chemistry. 77, 6976-6984 (2005).
- Haes, A. J., Hall, W. P., Chang, L., Klein, W. L., Van Duyne, R. P. A localized surface plasmon resonance biosensor: First steps toward an assay for Alzheimer's disease. Nano Letters. 4, 1029-1034 (2004).
- Jonsson, M. P., Jonsson, P., Dahlin, A. B., Hook, F. Supported lipid bilayer formation and lipid-membrane-mediated biorecognition reactions studied with a new nanoplasmonic sensor template. Nano Letters. 7, 3462-3468 (2007).
- Park, J. H., et al. A regeneratable, label-free, localized surface plasmon resonance (LSPR) aptasensor for the detection of ochratoxin A.. Biosensors & Bioelectronics. 59, 321-327 (2014).
- Mayer, K. M., Hao, F., Lee, S., Nordlander, P., Hafner, J. H. A single molecule immunoassay by localized surface plasmon resonance. Nanotechnology. 21, (2010).
- Endo, T., Yamamura, S., Kerman, K., Tamiya, E. Label-free cell-based assay using localized surface plasmon resonance biosensor. Analytica Chimica Acta. 614, 182-189 (2008).
- Huang, Y. X., Cai, D., Chen, P. Micro- and Nanotechnologies for Study of Cell Secretion. Analytical Chemistry. 83, 4393-4406 (2011).
- Oh, B. R., et al. Integrated Nanoplasmonic Sensing for Cellular Functional Immunoanalysis Using Human Blood. ACS Nano. 8, 2667-2676 (2014).
- Raphael, M. P., Christodoulides, J. A., Delehanty, J. B., Long, J. P., Byers, J. M. Quantitative Imaging of Protein Secretions from Single Cells in Real Time. Biophysical Journal. 105, 602-608 (2013).
- Raphael, M. P., et al. A New Methodology for Quantitative LSPR Biosensing and Imaging. Analytical Chemistry. 84, 1367-1373 (2011).
- Raphael, M. P., et al. Quantitative LSPR imaging for biosensing with single nanostructure resolution. Biophysical Journal. 104, 30-36 (2013).
- Raphael, M. P., et al. A new methodology for quantitative LSPR biosensing and imaging. Analytical Chemistry. 84, 1367-1373 (2012).
- Henn, A. D., et al. Modulation of single-cell IgG secretion frequency and rates in human memory B cells by CpG DNA, CD40L, IL-21, and cell division. Journal of Immunology. 183, 3177-3187 (2009).
- Bramswig, K. H., et al. Soluble Carcinoembryonic Antigen Activates Endothelial Cells and Tumor Angiogenesis. Cancer Research. 73, 6584-6596 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados