Method Article
Una tecnica senza etichetta per l'Imaging spazio-temporale delle secrezioni monocellulari
In questo articolo
Riepilogo
Comunicazione intercellulare è fondamentale per controllare varie attività fisiologiche all'interno e all'esterno della cellula. Questo documento descrive un protocollo per misurare la natura spazio-temporale delle secrezioni unicellulari. Per raggiungere questo obiettivo, è usato un approccio multidisciplinare che integra nanoplasmonic label-free sensing con imaging cellulare dal vivo.
Abstract
Inter-cellular communication is an integral part of a complex system that helps in maintaining basic cellular activities. As a result, the malfunctioning of such signaling can lead to many disorders. To understand cell-to-cell signaling, it is essential to study the spatial and temporal nature of the secreted molecules from the cell without disturbing the local environment. Various assays have been developed to study protein secretion, however, these methods are typically based on fluorescent probes which disrupt the relevant signaling pathways. To overcome this limitation, a label-free technique is required.
In this paper, we describe the fabrication and application of a label-free localized surface plasmon resonance imaging (LSPRi) technology capable of detecting protein secretions from a single cell. The plasmonic nanostructures are lithographically patterned onto a standard glass coverslip and can be excited using visible light on commercially available light microscopes. Only a small fraction of the coverslip is covered by the nanostructures and hence this technique is well suited for combining common techniques such as fluorescence and bright-field imaging.
A multidisciplinary approach is used in this protocol which incorporates sensor nanofabrication and subsequent biofunctionalization, binding kinetics characterization of ligand and analyte, the integration of the chip and live cells, and the analysis of the measured signal. As a whole, this technology enables a general label-free approach towards mapping cellular secretions and correlating them with the responses of nearby cells.
Introduzione
La comunicazione tra cellulare è fondamentale per la regolazione di molte attività fisiologiche sia all'interno che all'esterno della cellula. Una varietà di proteine e vescicole può essere secreto che successivamente innescare processi cellulari complessi come la differenziazione, la guarigione delle ferite, la risposta immunitaria, la migrazione e la proliferazione. 1-5 Anomalie di vie di segnalazione inter-cellulari sono stati implicati in numerosi disturbi tra cui il cancro, l'aterosclerosi , e diabete, solo per citarne alcuni.
La cella ottimale dosaggio secrezione dovrebbe essere capace di spazialmente e temporalmente mappatura della proteina secreta di interesse senza interrompere le vie di segnalazione rilevanti. In questo modo relazioni causali tra i profili di concentrazione e la risposta delle cellule riceventi possono essere dedotti. Purtroppo, molte delle tecniche di fluorescenza a base più comunemente utilizzati non soddisfano questi criteri. Proteine di fusione fluorescenti possono essere usati per codificare l'analita well'ambito cella ma può disturbare la via di secrezione, o se secreto, determina un bagliore diffuso fuori della cellula che è difficile da quantificare. Saggi basati immunosandwich-fluorescenti sono le tecniche più comunemente utilizzati per la rilevazione secrezioni cellulari ma tipicamente richiedono l'isolamento di singole cellule. 6-11 Inoltre, l'introduzione di anticorpi di rilevamento arresta o termina l'esperimento e le dimensioni delle etichette anticorpo tipicamente, 150 kDa per le IgG, è un impedimento alla segnalazione a valle.
A causa di questi blocchi stradali è preferibile che una tecnica libera-label essere utilizzata per le secrezioni di proteine immagine e tra tecnologie senza etichette esistenti, risonanza plasmonica di superficie (SPR) e localizzato risonanza plasmonica di superficie (LSPR) sensori sono ottimi candidati. 12-17 Questi I sensori sono stati ampiamente utilizzati per analita studi di legame di proteine, esosomi e altri biomarcatori. 18-24 Nel caso della LSPR, il nanostr plasmonicheuctures può essere modellata litograficamente su vetrini ed eccitato utilizzando la luce visibile attraverso configurazioni standard a grande campo di microscopia. Grazie alla loro impronta nanoscala, la maggior parte del substrato di vetro è disponibile per tecniche di imaging comuni come campo chiaro e microscopia a fluorescenza rendendo così queste sonde adatte per l'integrazione con la microscopia live-cell. 25-28 Abbiamo dimostrato la misura in tempo reale di secrezioni anticorpi da cellule di ibridoma utilizzando nanostrutture plasmoniche oro funzionalizzato con risoluzioni spaziali e temporali di 225 msec e 10 micron, rispettivamente. La configurazione di base del circuito integrato è illustrato in Figura 1. 28 Il percorso ottico di uscita del microscopio è diviso tra una telecamera CCD utilizzato per immagini e uno spettrometro a fibre otticamente accoppiato per la determinazione quantitativa di occupazione frazionata di un dato array di nanostrutture (figura 2 ).
Il ProtoColo presentato in questo documento descrive il disegno sperimentale per la misura in tempo reale delle secrezioni singola cellula, mentre possono monitorare la risposta delle cellule usando microscopia in campo chiaro standard. L'approccio multidisciplinare comprende la fabbricazione di nanostrutture, funzionalizzazione delle nanostrutture per il legame di analiti alta affinità, ottimizzazione superficie sia per minimizzare legami non specifici e caratterizzare costanti di velocità cinetiche utilizzando una superficie commerciale Plasmon Resonance (SPR) strumento, l'integrazione di linee cellulari sul substrato, e l'analisi di immagini e dati spettrali. Prevediamo questa tecnica come una tecnologia abilitante per la mappatura spazio-temporale delle secrezioni cellulari e le loro relazioni causali con celle riceventi.
Protocollo
1. nanostrutture
- Scegli 25 mm vetrini di diametro con spessore di 170 micron approssimativa (No. 1.5) come substrati per nanofabbricazione.
- Immergere i coprioggetti in soluzione Piranha (rapporto 3: 1 di acido solforico e perossido di idrogeno) per almeno 6 ore. Lavare il piranha vetrino bagnato con abbondante ultrapura 18,2 MW deionizzata acqua distillata (DDW).
ATTENZIONE: L'acido Piranha reagisce violentemente con materiali organici e deve essere maneggiato con estrema cura. - Acconto 10 nm cromo film sottile sui vetrini via e-beam evaporazione per evitare effetti di carica durante il patterning e l'imaging di nanostrutture.
- Spin il primo strato di resist doppio strato costituito da metil metacrilato di etile lattato (MMA_EL6) copolimero a 2.000 rpm per 45 sec e poi cuocere in forno a 150 ° C. Spin il secondo strato di poli-metil metacrilato (950PMMA_A2) a 3.000 rpm per 45 sec poi cuocere in forno a 180 ° C.
- Picchiettion bistrato resist mediante litografia a fascio elettronico (EBL) a 25 kV con una dose di 300 uC / cm 2 zona. Sviluppare in alcool isopropilico (IPA) / metilisobutilchetone (MIBK): 2/1 e sciacquare in IPA.
- Deposito Ti (5 nm) / Au (80 nm) pellicola sul substrato mediante un evaporatore e-beam.
- Dopo la deposizione dell'oro, sollevare il doppio strato copolimero resistere immergendo il substrato in acetone per 4 ore.
- Controllare il supporto con il microscopio elettronico a scansione (SEM) per confermare forma e dimensione nanostruttura, rimuovere il cromo residuo dal substrato mediante attacco umido utilizzando CR-7 mordenzante per 60 sec a temperatura ambiente e poi sciacquare a DDW.
- Progettare un array di spaziatura da centro a centro di 33 micron per lasciare spazio per l'imaging cellulare tra gli array. Motivo nanostrutture a 20 x 20 modello per ogni array con un passo di 300 nm utilizzando uno scrittore e-beam. Ogni chip contiene 300 array a dimensione nanostruttura tipico di altezza 80 ± 2.5 nm e 70 ± 2,5 nm Diameter.
- Controllare un sottoinsieme di array utilizzando il microscopio a forza atomica (AFM) per la verifica delle dimensioni e uniformità.
- Fissare un anello di supporto, tipicamente silicio, sul retro del vetrino utilizzando una resina epossidica polimerizzazione UV.
2. Chip Pulizia e applicazione di auto-assemblati monostrato
- Per la pulizia e rigenerazione dei chip, plasma incenerire a una potenza di 40 W in una miscela di 300 mTorr 5% di idrogeno, 95% argon 45 sec dopo la pulizia della camera per 5 minuti nelle stesse condizioni.
- Funzionalizzare nanostrutture oro immediatamente dopo incenerimento plasma immergendo il chip in una soluzione etanolica tiolo bicomponente costituito da un rapporto 3: 1 di SH-(CH 2) 8 -EG 3 -OH (SPO) e un componente o con un'ammina o carbossilico gruppo funzionale, cioè, SH-(CH 2) 11 -EG 3 -NH 2 (SPN) o SH-(CH 2) 11 -EG 3 -COOH (SPC).
- Lasciare l'i chip din la soluzione tiolo O / N per formare un monostrato auto-assemblato (SAM).
- Risciacquare il chip con etanolo e asciugare con azoto gassoso.
- Se necessario, memorizzare il chip funzionalizzato per 2 settimane a 4 ° C.
- Quando pronto all'uso reagire il SPN o componente SPC con il ligando utilizzando una chimica a seconda del ligando di scelta (vedi sotto).
Nota: I chip possono essere rigenerati e decine di ri-funzionalizzate di volte. Un determinato chip può essere utilizzato per periodi che vanno da 6 mesi a più di un anno. Gli spettri misurati su un dato array vengono riprodotti in modo affidabile dopo ripetuti rigenerazioni di incenerimento plasma, seguito da biofunzionalizzazione. 29
3. funzionalizzazione superficiale e Kinetic Caratterizzazione
Nota: utilizzare il chip funzionalizzati nello strumento SPR commerciale per caratterizzare le costanti di velocità cinetiche tra il ligando e l'analita, così come per studiare la resistenza di SAM non specifico binding. Esiste una vasta gamma di portate e disegni microfluidici che consentono un'efficiente funzionalizzazione superficiale. Dal momento che abbiamo un SPR disponibile in commercio abbiamo standardizzato intorno alle sue portate consigliate. Prendiamo atto che questi flussi sono tipici di tutti gli strumenti SPR e così non è restrittiva. Lo strumento SPR non è una necessità poiché tutto funzionalizzazione può avvenire direttamente sul chip LSPR, ma ha ridotto il nostro carico di lavoro perché è uno strumento multiplato mentre il nostro LSPR configurazione non è microfluidica.
- Funzionalizzare un chip commerciale d'oro nudo con il SAM come descritto nella Sezione 2.
- Se si utilizza un SAM basato SPC, attivare il gruppo carbossilico con una miscela 1: 1 di 133 mM di 1-etil-3- (3-dimetilamminopropil) carbodiimmide (EDC) e 33 mM di N -hydroxysuccinimide (NHS) in DDW per 10 min.
- Coniugare il gruppo carbossilico attivato con l'anticorpo / ligando di interesse per 300 sec utilizzando una portata di 30 microlitri / min. Preparare i ligandi inpH 6 tampone fosfato, tipicamente, ma questo può variare a seconda della molecola.
- Dopo la coniugazione ligando, flusso 0,1 M etanolamina in tampone fosfato salino (PBS) come un passo disattivatore per 300 sec ad una velocità di 30 ml / min. Ethanolamine aiuta a minimizzare il binding non specifico.
- Introdurre l'analita di interesse con una portata di 100 l / min usando una gamma di concentrazioni e calcolare le costanti di velocità cinetiche utilizzando un software di analisi cinetica.
- Se legame non specifico è problematica, aumentare il rapporto di SPO a SPC o SPN.
Impostazioni 4. LSPR generali
- Impostazioni Microscopio:
- Utilizzare una lampada alogena 100 W per Koehler illuminare il campione. Utilizzare un filtro passa lungo (tipicamente 593 nm cutoff) nel percorso ottico per eliminare le lunghezze d'onda che non contribuiscono allo spostamento di risonanza (Figura 2).
- Per la raccolta dei dati LSPRi, utilizzare un microscopio rovesciato con un immersio olio 40Xobiettivo n (1.4 NA) e una camera CCD raffreddati termoelettricamente 16 bit.
- Collocare un divisore di fascio alla porta di uscita del microscopio per ottenere immagini e spettri simultaneamente.
- Impostare la fase di microscopio a temperatura controllata a 37 ° C ed equilibrare per 4 ore.
- Incorporare un assieme incubazione addizionale sul microscopio per regolare la concentrazione di CO 2 e l'umidità a 5% e 95%, rispettivamente.
- Preparazione Chip e montaggio:
- Funzionalizzare il chip LSPR come descritto nella Sezione 2 con le due componenti ottimali rapporti SAM determinate dagli esperimenti SPR.
- Caricare il chip all'interno di un titolare di microfluidica su misura come segue. Posizionare il chip su un pezzo inferiore in alluminio. Sandwich il chip tra questo pezzo inferiore e una guarnizione in silicone e una chiara pezzo superiore di plastica. Utilizzare 4 viti per bloccare il gruppo.
- Per una tipica applicazione tiolo basata SPC, goccia cappotto 300 microlitri di una miscela 1: 1tura di 133 mm di EDC e 33 mm di NHS in DDW per attivare i gruppi carbossilici del componente SPC tiolo.
- Attendere 10 minuti e risciacquare manualmente la superficie con PBS 10 mM.
- Coniugare il gruppo carbossilico attivato con il ligando (tipicamente un frammento di anticorpo o anticorpi) di interesse rivestendo 300 ml di soluzione di ligando goccia.
- Attendere per 30 minuti e risciacquare manualmente con PBS 10 mm.
- Goccia cappotto 300 ml di 0,1 M in PBS etanolamina sul chip per minimizzare legami non specifici. Attendere 10 min.
- Lavare il etanolamina con PBS contenente 0,005% di Tween 20 (PBS-T20).
- Posizionare un pezzo di quarzo sopra il chip per ridurre le fluttuazioni nei dati relativi ad un menisco cambiamento.
- Mantenere il chip bagnato con tampone PBS-T20 durante il montaggio sul microscopio.
- Posizionare il gruppo di chip LSPR saldamente il porta campioni palco riscaldato e collegare il tubo microfluidica.
- Collegare il tubo microfluidica alle bu di assemblaggio e di flussoffer (o media liberi siero per studi sulle cellule) fino uno stato stazionario viene raggiunto.
- Permettere il montaggio e microscopio per stabilizzare almeno 2 ore.
- Allineare il chip utilizzando joystick modo che l'apparato centrale è allineata con la fibra ottica per la spettroscopia. Dati spettroscopici viene presa utilizzando uno spettrometro e software di analisi spettrale.
- Mantenere gli array a fuoco tutto l'esperimento utilizzando il software autofocus, Zeiss Fuoco definitiva o un dispositivo equivalente autofocus.
5. LSPR Imaging di secrezioni anti-c-Myc da 9E10 cellule di ibridoma
Nota: La linea cellulare di ibridoma utilizzato per questo studio esprimono anticorpo anti-c-myc costitutivamente e quindi non richiedono un trigger chimica
- Funzionalizzare le nanostrutture con c-myc peptide. Questo ha un valore K D di 1,77 nM per gli anticorpi anti-c-Myc secrete dalle cellule di ibridoma clone 9E10.
- Cultura le cellule di ibridoma in complete terreno di coltura con 10% di siero fetale bovino (FBS) e 1% di antibiotici in un pallone T75 a 37 ° C sotto 5% CO 2. Mantenere una densità cellulare di 4 × 10 5 cellule / ml.
- Per gli studi di secrezione delle cellule, le cellule pellet dal pallone T75 per centrifugazione, lavare due volte con RPMI-1640 siero media liberi (SFM) per rimuovere gli anticorpi secreti e regolare la densità cellulare di 4 × 10 6 cellule / ml.
- Raccogliere le cellule e di prova di redditività prima di introdurli sulle ai chip LSPR.
- Introdurre 50 ml di soluzione di cellule manualmente sui chip LSPR con una micropipetta. Dopo pochi minuti da 25 a 50 cellule aderiscono alla superficie dei chip LSPR.
- Lavare via le cellule rimanenti in soluzione fresca SFM utilizzando il sistema di perfusione microfluidica.
- Selezionare gli array LSPR per l'imaging che sono vicino, a meno di 10 micron, ma non si sovrappongono con le cellule.
- Per assicurare che il segnale è specifico per il secreto anti-c-myc ANTIBodies introducono i mezzi di coltura cellulare con e senza gli anticorpi presenti così come con gli anticorpi, ma con i loro siti di legame bloccati dalla presenza di una concentrazione saturante di c-myc peptide nella soluzione.
- Calibrare i sensori al termine di ogni corsa con una soluzione satura di anticorpi anti-c-myc (250 nM). Questo aiuta a normalizzare la risposta dei sensori e determinare occupazione frazionato in base al profilo biofunzionalizzazione di ogni corsa.
- Correggere la deriva nella direzione X e Y utilizzando software allineamento dell'immagine.
Risultati
In un tipico studio di secrezione delle cellule vive ci sono diverse modalità di raccolta dei dati in atto. La figura 3 mostra una sovrapposizione di un'immagine LSPRi, che mette in evidenza le matrici quadrate, e un illuminato immagine luce trasmessa, che evidenzia la cella in basso a sinistra. I dati sono tipicamente raccolti su un periodo di 3 ore seguita dall'introduzione di una soluzione saturante dell'analita per il calcolo di normalizzazione descritta di seguito. Imagery fluorescenza può anche essere integrato nella routine di raccolta dati dalla commutazione automatica di un cubo filtro. Nella figura 4 una cella macchiato con la fluorescenza di membrana colorante rodamina DHPE esibisce estensioni lamellipodia-like (frecce). Se tali estensioni dovessero coincidere con le matrici avrebbero dato un falso positivo per la secrezione della proteina. Avere diverse modalità di immagini può aiutare a identificare tali eventi.
Figura 5 mostra i dati di spettrometria di prima e di poppaer l'introduzione di una soluzione saturante (400 nM) di acquistabile anticorpi anti-c-Myc alle matrici funzionalizzate c-myc. Non erano presenti cellule in questo esperimento. Lo spettro mostra sia uno spostamento rosso e un aumento di intensità. La differenza tra le aree sotto le due curve si traduce in un aumento dell'intensità dell'immagine array in modalità LSPRi sulla fotocamera CCD. Un approccio meno analisi dei dati quadrati non lineare è stato sviluppato per inferire occupazione frazionaria di superficie vincolata ligandi dagli spettri. 30,31
Alla fine dell'esperimento, i valori di intensità saturi (cioè, frazionale occupazione ≈ 1) sono utilizzati per calcolare una risposta normalizzata per ogni matrice utilizzando la seguente formula:
Dove sono l'intensità normalizzata al punto di tempo t, intensità iniziale all'inizio dell'esperimento, finale intensità saturato, e l'intensità misurata della matrice al punto di tempo t , rispettivamente.
Valori normalizzati da due array sono mostrati in figura 6. Una matrice era a 10 micron della cella in esame, mentre l'altro, utilizzato come controllo, era una distanza di 130 micron dalla cella. L'improvviso aumento nella risposta normalizzata della matrice più vicina alla cella relativa alla risposta piatta della matrice di controllo è indicativa di una raffica localizzata di anticorpi secreti.
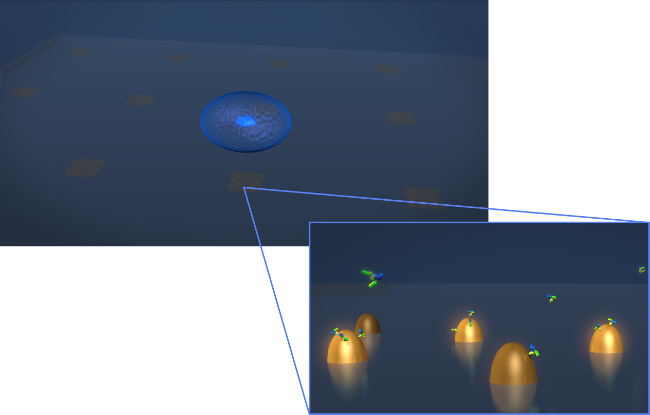
Figura 1. Sensore design. Un disegno raffigurante la geometria di un tipico esperimento secrezione di cellule vive. La cella (sferoide blu) viene depositato sulla al chip LSPR che contiene array di nanostrutture oro biofunctionalized. Nella vista ingrandita-in, la secrezione delle cellule di interesse, in questo caso gli anticorpi indicati come molecole a forma di Y, viene misurata in quanto si legano alla superficiedelle nanostrutture funzionalizzate. Cliccate qui per vedere una versione più grande di questa figura.
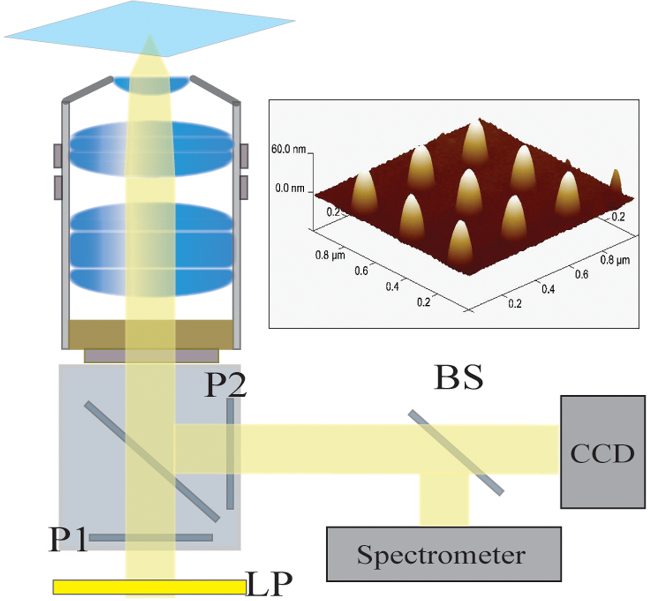
Figura 2. configurazione dell'ottica. La luce illuminato da una lampada alogena viene prima filtrato da un filtro passaggio lungo (LP). La luce viene polarizzata linearmente (P1) e illumina il campione con un obiettivo 40X / 1.4 NA. La luce diffusa viene raccolta dall'obiettivo e passato attraverso un polarizzatore incrociato (P2). Un divisore di fascio 50/50 (BS) è inserito nel percorso ottico raccolti per spettroscopica simultanea e analisi delle immagini. In alto a destra:. Un'immagine microscopia a forza atomica di 9 nanostrutture individuali separati da un passo di 300 nm Clicca quiper visualizzare una versione più grande di questa figura.
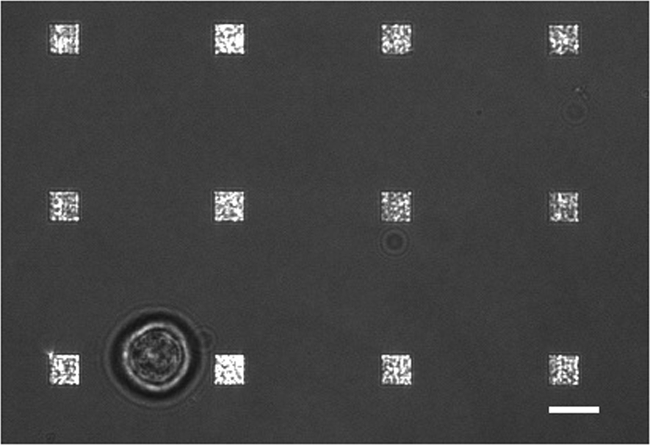
Figura 3. Live Cell LSPRi Studio. Una luce trasmessa e immagine LSPRi mostra una cella ibridomi singolo (in basso a sinistra), circondato da 12 matrici fusa. Questa è un'immagine contrasto migliori. Barra della scala è di 10 micron. Clicca qui per vedere una versione più grande di questa figura.
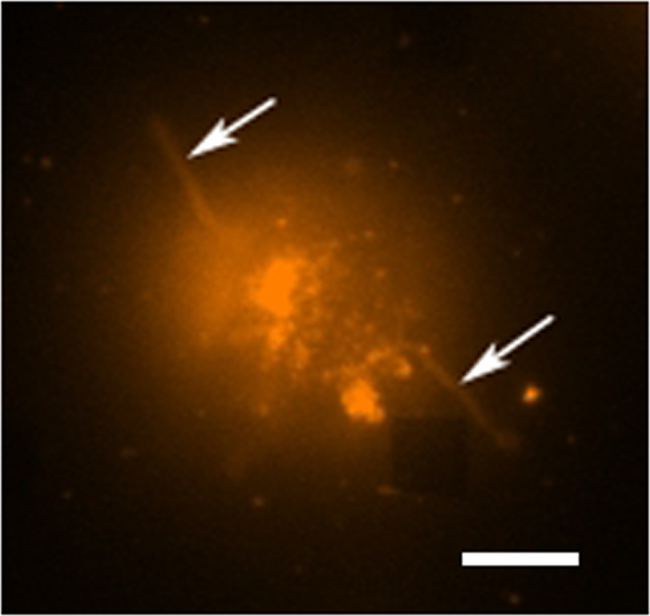
Figura 4. Live Cell Fluorescence Studio. Un fluorescente immagine a falsi colori di una singola cella ibridoma colorati con rodamina DHPE, che è un colorante membrana. In modalità di imaging fluorescente gli array non sono generalmente visibili, tuttavia, una matrice vicina è osservabile qui come abmanca quadrato nell'angolo in basso a destra. La cella può essere visto per essere separato dalla matrice sebbene estensioni tentacolari (possibilmente filopodi o lamellipodi) vengono estende verso l'esterno dalle cellule (frecce). Barra della scala è di 10 micron. Clicca qui per vedere una versione più grande di questa figura.
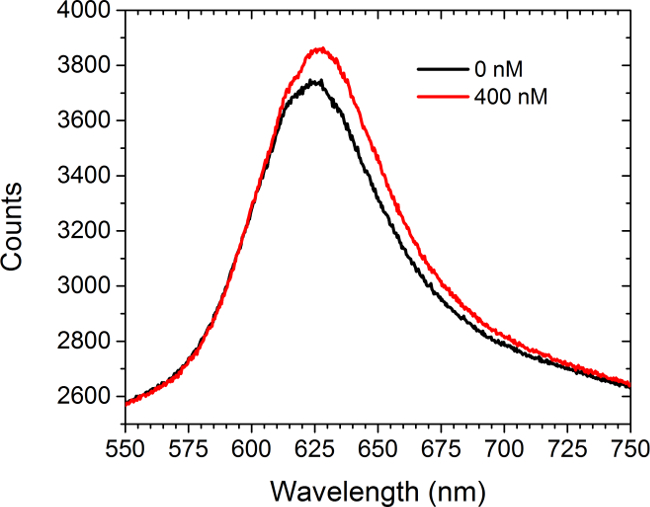
Figura 5. spettrale Modalità. Gli spettri ottenuti da un array funzionalizzato c-myc, prima e dopo l'introduzione della soluzione di 400 nM di anticorpi anti-c-Myc. Nessuna cellula erano presenti in questo studio. Clicca qui per vedere una versione più grande di questa figura.

Figura 6. secrezione Single Cell. La risposta di un array si trova a meno di 15 micron di una singola cellula e quello che si trova 130 micron di distanza (di controllo). Barra della scala è di 10 micron. Clicca qui per vedere una versione più grande di questa figura.
Discussione
The LSPR imaging technique described in this work has numerous advantages over more traditional methodologies for detecting cell secretions. First, the time resolution of our technique is on the order of seconds whereas the commercial alternative, an immunosandwhich assay known as EliSpot, has a typical time resolution of 2 to 3 days.7,32 As a result we were able to resolve sudden changes in the rate of protein secretion, such as that shown in Figure 6. Second, having arrays distributed over the chip allows for the secreted signal to be tracked in space and time which enables more rigorous comparisons to diffusion-based models of cell secretion. In addition, arrays like the control array shown in Figure 6 can be used to subtract out global changes in the image that typically arise from instrumental factors such as focus drift. Third, our technique requires no modification of the cells. If desired, the experiment can incorporate commonly used tags such as fluorescent proteins, but if there is concern that such tags may negatively affect cell viability or homeostasis the label-free nature of our approach does not require them. Fourth, using the spectroscopic data we have demonstrated that quantitative information regarding the fractional occupancy of surface bound ligands can be calculated.
There are numerous alternative methods to EBL for fabricating metallic nanoparticles. However, we have found that the EBL provides considerable flexibility for optimizing nanostructure and array dimensions to best suit the optics and the cells under investigation. Also critical is the fact that the chips can be readily regenerated by plasma ashing. In this way, a typical chip can be used dozens of times. Biofunctionalization details must be modified for the specific application. The protocol presented here conjugated the surface with relatively small c-myc peptide ligands. Larger ligands such as whole antibodies typically require more spacing and thus a higher SPO to SPN/SPC ratio. Regardless, a well formed SAM layer is essential for preventing non-specific binding in live-cell experiments. In general, larger molecular weight analytes are more readily detected by LSPR. Thus, in its single-cell manifestation, this technique may not be appropriate for detecting the secretion of small proteins, such as cytokines.
The current setup has been used for studying individual non-adherent cells. There are significant number of secreted signaling proteins and vesicles to which the results reported in this work are directly applicable. For example carcinoembryonic antigen (CEA) which for decades now has been a diagnostic marker for cancer. Colon cancer cells are known to secrete CEA at the rates of thousands of molecules/cell/hr and the molecular weight is 180 kDa which exceeds that of IgG antibodies. CEA is believed to be involved in autocrine and paracrine signaling pathways but the spatio-temporal nature of these secretions have never been measured. Our technique can directly address these signaling questions. An extension of this work will be to measure the spatio-temporal nature of CEA secretion from single cells.33 Future work will also focus on integrating LSPRi with two and three dimensional cell cultures of adherent cells. By incorporating multiplexed arrays capable of detecting a number of secreted proteins in parallel, this technique has the potential to open a new window into cell secretions and how they influence neighboring cells.
Divulgazioni
We thank George Anderson for helpful comments and discussions. This work was supported by the Naval Research Laboratory’s Institute for Nanoscience and the National Research Council Research Associateship Award.
Riconoscimenti
The authors have nothing to disclose.
Materiali
| Name | Company | Catalog Number | Comments |
| 25 mm diameter glass coverslips | Bioscience Tools | CSHP-No1.5-25 | 170±5 µm is optimal |
| Poly-methyl methacrylate | Microchem | PMMA 950 A4 | |
| Ethyl lactate methyl metacrylate | Microchem | MMA EL6 | |
| Electron beam evaporator | Temescal | FC-2000 | |
| Electron beam lithography | Raith | Series 150 | |
| Ethanol | Sigma-Aldrich | 459836 | |
| Acetone | Sigma-Aldrich | 320110 | |
| CR-7 chromium etchant | Cyantek | CR-7 | |
| Scanning electron microscope | Zeiss | Ultra 55 | |
| Atomic force microscope | Veeco | Nanoscope III | |
| Plasma ashing system | Technics | Series 85 RIE | |
| SH-(CH2)8-EG3-OH (SPO) | Prochimia | TH 001-m8.n3-0.2 | |
| SH-(CH2)11-EG3-COOH (SPC) | Prochimia | TH 003m11n3-0.1 | |
| SH-(CH2)11-EG3-NH2 (SPN) | Prochimia | TH 002-m11.n3-0.2 | |
| Surface plasmon resonance system | Biorad | XPR36 | |
| Bare gold chip | Biorad | GLC chip | Plasma ashed to remove the monolayer |
| 1-Ethyl-3-(3-dimethylaminopropyl) carbodiimide | Thermo | 22980 | |
| N-hydroxysuccinimide (NHS) | Thermo | 24510 | |
| Pentylamine-Biotin | Thermo | 21345 | |
| Ethanolamine | Sigma-Aldrich | E9508 | |
| Neutraavidin | Thermo | 31000 | |
| Phosphate buffered saline | Thermo | 28374 | |
| Tween 20 | Sigma-Aldrich | P2287 | |
| Inverted microscope | Zeiss | Axio Observer | Microscope is equipped with 40X oil immersion objective; CO2 and humidity incubation from Pecon GmbH |
| CCD camera | Hamamatsu | Orca R2 | Thermoelectrically cooled (16 bit) |
| Spectrometer | Ocean Optics | QE65Pro | |
| Spectrasuite | Ocean Optics | version1.4 | |
| c-myc peptide HyNic Tag | Solulink | SP-E003 | |
| monoclonal anti-c-myc antibody | Sigma-Aldrich | M4439 | |
| Hybridoma cell line | ATCC | CRL-1729 | |
| Antibiotic Antimycotic Solution (100×) | Sigma-Aldrich | A5955 | |
| Serum free media RPMI 1640 | Invitrogen | 11835-030 | |
| Fetal bovine serum | ATCC | 30-2020 | |
| Rhodamine DHPE | Life Technologies | L-1392 |
Riferimenti
- Ludwig, A. -. K., Giebel, B. Exosomes: Small vesicles participating in intercellular communication. The International Journal of Biochemistry & Cell Biology. 44, 11-15 (2012).
- Friedl, P., Gilmour, D. Collective cell migration in morphogenesis, regeneration and cancer. Nature Reviews Molecular Cell Biology. 10, 445-457 (2009).
- Letterio, J. J., Roberts, A. B. Regulation of immune responses by TGF-beta. Annual Review of Immunology. 16, 137-161 (1998).
- Werner, S., Grose, R. Regulation of wound healing by growth factors and cytokines. Physiological Reviews. 83, 835-870 (2003).
- Werner, S., Krieg, T., Smola, H. Keratinocyte-fibroblast interactions in wound healing. Journal of Investigative Dermatology. 127, 998-1008 (2007).
- Bailey, R. C., Kwong, G. A., Radu, C. G., Witte, O. N., Heath, J. R. DNA-encoded antibody libraries: A unified platform for multiplexed cell sorting and detection of genes and proteins. Journal of the American Chemical Society. 129, 1959-1967 (2007).
- Gazagne, A., et al. A Fluorospot assay to detect single T lymphocytes simultaneously producing multiple cytokines. Journal of Immunological Methods. 283, 91-98 (2003).
- Han, Q., et al. Polyfunctional responses by human T cells result from sequential release of cytokines. Proceedings of the National Academy of Sciences of the United States of America. 109, 1607-1612 (2012).
- Han, Q., Bradshaw, E. M., Nilsson, B., Hafler, D. A., Love, J. C. Multidimensional analysis of the frequencies and rates of cytokine secretion from single cells by quantitative microengraving. Lab on a Chip. 10, 1391-1400 (2010).
- Ma, C., et al. A clinical microchip for evaluation of single immune cells reveals high functional heterogeneity in phenotypically similar T cells. Nature Medicine. 17, 738-743 (2011).
- Shirasaki, Y., et al. Real-time single-cell imaging of protein secretion. Scientific Reports. 4, (2014).
- Milgram, S., et al. On chip real time monitoring of B-cells hybridoma secretion of immunoglobulin. Biosensors and Bioelectronics. 26, 2728-2732 (2011).
- Abbas, A., Linman, M. J., Cheng, Q. A. New trends in instrumental design for surface plasmon resonance-based biosensors. Biosensors & Bioelectronics. 26, 1815-1824 (2011).
- Ermakova, A., et al. Detection of a Few Metallo-Protein Molecules Using Color Centers in Nanodiamonds. Nano Letters. 13, 3305-3309 (2013).
- Haes, A. J., Van Duyne, R. P. A nanoscale optical blosensor: Sensitivity and selectivity of an approach based on the localized surface plasmon resonance spectroscopy of triangular silver nanoparticles. Journal of the American Chemical Society. 124, 10596-10604 (2002).
- Horowitz, V. R., Aleman, B. J., Christle, D. J., Cleland, A. N., Awschalom, D. D. Electron spin resonance of nitrogen-vacancy centers in optically trapped nanodiamonds. Proceedings of the National Academy of Sciences of the United States of America. 109, 13493-13497 (2012).
- Sepulveda, B., Angelome, P. C., Lechuga, L. M., Liz-Marzan, L. M. LSPR-based nanobiosensors. Nano Today. 4, 244-251 (2009).
- Barbillon, G., et al. Biological and chemical gold nanosensors based on localized surface plasmon resonance. Gold Bulletin. 40, 240-244 (2007).
- Endo, T., et al. Multiple label-free detection of antigen-antibody reaction using localized surface plasmon resonance-based core-shell structured nanoparticle layer nanochip. Analytical Chemistry. 78, 6465-6475 (2006).
- Endo, T., Kerman, K., Nagatani, N., Takamura, Y., Tamiya, E. Label-free detection of peptide nucleic acid-DNA hybridization using localized surface plasmon resonance based optical biosensor. Analytical Chemistry. 77, 6976-6984 (2005).
- Haes, A. J., Hall, W. P., Chang, L., Klein, W. L., Van Duyne, R. P. A localized surface plasmon resonance biosensor: First steps toward an assay for Alzheimer's disease. Nano Letters. 4, 1029-1034 (2004).
- Jonsson, M. P., Jonsson, P., Dahlin, A. B., Hook, F. Supported lipid bilayer formation and lipid-membrane-mediated biorecognition reactions studied with a new nanoplasmonic sensor template. Nano Letters. 7, 3462-3468 (2007).
- Park, J. H., et al. A regeneratable, label-free, localized surface plasmon resonance (LSPR) aptasensor for the detection of ochratoxin A.. Biosensors & Bioelectronics. 59, 321-327 (2014).
- Mayer, K. M., Hao, F., Lee, S., Nordlander, P., Hafner, J. H. A single molecule immunoassay by localized surface plasmon resonance. Nanotechnology. 21, (2010).
- Endo, T., Yamamura, S., Kerman, K., Tamiya, E. Label-free cell-based assay using localized surface plasmon resonance biosensor. Analytica Chimica Acta. 614, 182-189 (2008).
- Huang, Y. X., Cai, D., Chen, P. Micro- and Nanotechnologies for Study of Cell Secretion. Analytical Chemistry. 83, 4393-4406 (2011).
- Oh, B. R., et al. Integrated Nanoplasmonic Sensing for Cellular Functional Immunoanalysis Using Human Blood. ACS Nano. 8, 2667-2676 (2014).
- Raphael, M. P., Christodoulides, J. A., Delehanty, J. B., Long, J. P., Byers, J. M. Quantitative Imaging of Protein Secretions from Single Cells in Real Time. Biophysical Journal. 105, 602-608 (2013).
- Raphael, M. P., et al. A New Methodology for Quantitative LSPR Biosensing and Imaging. Analytical Chemistry. 84, 1367-1373 (2011).
- Raphael, M. P., et al. Quantitative LSPR imaging for biosensing with single nanostructure resolution. Biophysical Journal. 104, 30-36 (2013).
- Raphael, M. P., et al. A new methodology for quantitative LSPR biosensing and imaging. Analytical Chemistry. 84, 1367-1373 (2012).
- Henn, A. D., et al. Modulation of single-cell IgG secretion frequency and rates in human memory B cells by CpG DNA, CD40L, IL-21, and cell division. Journal of Immunology. 183, 3177-3187 (2009).
- Bramswig, K. H., et al. Soluble Carcinoembryonic Antigen Activates Endothelial Cells and Tumor Angiogenesis. Cancer Research. 73, 6584-6596 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon