Method Article
قياس TCR-PMHC التجليد
In This Article
Summary
This manuscript describes how to conduct (single molecule) Förster Resonance Energy Transfer (FRET)- based assays to measure the binding dynamics between T-cell antigen receptor (TCR) and antigenic peptide-loaded MHC molecules as they occur within the immunological synapse of a T-cell in contact with a functionalized planar supported lipid bilayer.
Abstract
T-cells are remarkably specific and effective when recognizing antigens in the form of peptides embedded in MHC molecules (pMHC) on the surface of Antigen Presenting Cells (APCs). This is despite T-cell antigen receptors (TCRs) exerting usually a moderate affinity (µM range) to antigen when binding is measured in vitro1. In view of the molecular and cellular parameters contributing to T-cell antigen sensitivity, a microscopy-based methodology has been developed as a means to monitor TCR-pMHC binding in situ, as it occurs within the synapse of a live T-cell and an artificial and functionalized glass-supported planar lipid bilayer (SLB), which mimics the cell membrane of an Antigen presenting Cell (APC) 2. Measurements are based on Förster Resonance Energy Transfer (FRET) between a blue- and red-shifted fluorescent dye attached to the TCR and the pMHC. Because the efficiency of FRET is inversely proportional to the sixth power of the inter-dye distance, one can employ FRET signals to visualize synaptic TCR-pMHC binding. The sensitive of the microscopy approach supports detection of single molecule FRET events. This allows to determine the affinity and off-rate of synaptic TCR-pMHC interactions and in turn to interpolate the on-rate of binding. Analogous assays could be applied to measure other receptor-ligand interactions in their native environment.
Introduction
فهم أكثر عمقا لكيفية تعترف T-خلايا مستضدات يتطلب النظر في المكان المناسب، وهذا هو، داخل المشبك المناعي شكلت بين T-الخلية وAPC. هنا، لا تتحدد حركية ملزمة الجزيئية إلا من خلال الخصائص الكيميائية الحيوية الكامنة الشركاء تفاعل المشاركين ولكن تعتمد إلى حد كبير على المعلمات الخلوية، والتي تشمل قوات الخلوية، والهندسة المعمارية الغشاء والتفاعلات الجانبية بين بروتينات الغشاء فضلا عن القيود المشبك محددة هندسية 3. النهج البيوكيميائية تقتصر في حل السلطة لأنها تتطلب تعطل واحد على الأقل من الأغشية متشابك المعنية. لهذا السبب وضعت منهجية التصوير القائم على الحنق لمراقبة ملزمة من TCR لpMHCs المستضدية 2. هنا زينت T الخلايا مع المؤتلف وتحديدا موقع المسمى TCRβ التفاعلي سلسلة واحدة الأضداد شظية (SCF V) وتواجه خطة ع المدعومة زجاج طبقات ثنائية الدهون (SLBs)، التي ترعى MHC الدرجة الثانية الجزيئات محملة الببتيد الأنتيجين fluorescently المسمى، والجزيئات costimulatory والبروتينات التصاق. متشابك ملزم بين النتائج PMHC TCR وصفت صبغ المسمى الصبغة في الحنق، والتي يمكن رصدها على الجزء الأكبر ومستوى جزيء واحد من قبل إجمالي الداخلية الإسفار التأمل (TIRF) المجهري.
في هذه المقالة شرح ذلك بالتفصيل كيفية الاستفادة SLBs لمعايرة نقاط الاشتباك العصبي T-الخلية، التحقق من سلامتها من خلال T-خلية فحص الكالسيوم تدفق الوظيفي، والسلوك الحنق القياسات بكميات كبيرة ومع حساسية جزيء واحد، وتحليل البيانات التي حصل عليها. وتقدم توصيات إلى إنتاج بروتينات يتفق بشكل صحيح اللازمة لطبقة ثنائية functionalization. للحصول على معلومات أكثر تحديدا بشأن تشكيل طبقة ثنائية والإعداد للمجهر TIRF مناسبة يرجى الرجوع إلى وصول الجمهور النشر إضافي إن الرب المنشورة العودة إلى الوراء 4.
خيمة "> طبيعة SLBsSLBs Functionalizable يمكن أن تتولد بسهولة من الحويصلات unilamellar (سيارات الدفع الرباعي) التي تحتوي على اثنين من الدهون 1-بالميتويل-2-oleoyl-SN-gylcero-3-phosphocholine (قصيرة: POPC، 90-99٪) والتعطيل 1،2-dioleoyl- - glycero-3 - {[N (5-الأمينية-1-carboxypentyl) iminodiacetic حمض] succinyl} (باختصار: DGS NTA ني، 1-10٪). سيارات الدفع الرباعي تنتشر على شرائح زجاجية نظيفة لتشكيل طبقة ثنائية مستو متجاورة 4. يقدم DGS-NTA ني لترسيخ البروتينات الموسومة polyhistidine عبر بوساطة polyhistidine مجمع تشكيل مع الاصطناعية NTA ني التي تحتوي على مجموعة الرأس (الشكل 1A). للجمعية مستقرة واحد يستبدل عادة المجال عبر الغشاء الأصلي والذيل حشوية من البروتين التصاق ICAM-1 وجزيء costimulatory B7-1 مع علامة واحدة تحتوي على اثني عشر histidines (ICAM-1-12H، -12H B7-1) (الشكل 1B) . الطبقة الثانية جزيء IE ك محملة الببتيد يحتوي على اثنين جزءا لا يتجزأ من غشاء (α و β) سلسلة ببتيدالصورة. وعبر الغشاء / المجالات هيولي كل من سلاسل يتعين استبدالها مع علامة تحتوي على ستة histidines كل (IE ك α β 6H 6H أو IE ك -2x6H). وكبديل لذلك، وتوسيع سلسلة α مع اثني عشر histidines وترك المجال خارج الخلية من β-سلسلة غير محدد (مما أدى إلى IE ك α 0H 12H β أو IE ك -12H) يؤدي إلى نتائج مرضية (الشكل 1B).
وضع العلامات الخاصة بالموقع من pMHCs
من المهم أن تسمية PMHC stoichiometrically والموقع خصيصا من أجل أن تكون قادرة على تحويل قياس الحنق الغلة إلى التوازن ملزمة الثوابت ذات مغزى. ويمكن تحقيق ذلك عن طريق وضع العلامات الكيميائية من الببتيد الاصطناعية التي يتم تحميلها إلى الشق ملزم الببتيد من الموسومة الحامض الاميني المؤتلف MHC الدرجة الثانية الجزيئات 2،5. يتضمن الببتيد جميع المخلفات من حاتمة T-الخلية كما ثالذراع بمثابة-C محطة رابط قصير (GGS)، يليه السيستين (على سبيل المثال في العثة السيتوكروم ج (MCC) الببتيد ANERADLIAYLKQATK- GGSC، يتم وضع علامة على رابط بالخط العريض). ويستخدم هذا السيستين لتسمية الببتيد stoichiometrically مع استخدام المشتقات maleimide صبغ. عند هذه النقطة يجب أن تكرس المزيد من الحيطة للتحقق الكمي صبغ اقتران الببتيد التي تحتوي على السيستين. ويوصى HPLC تنقية للناتج إضافة الببتيد صبغ والتي يجب أن تتبعها electrospray التأين مطياف الكتلة. أي الجماهير سجلت المقابلة لeduct الببتيد (بدون صبغ) تعكس وضع العلامات غير مكتملة. إذا كان هذا صحيحا، يجب أن يخضع الببتيد المنقى HPLC لجولات متتالية من صبغ وضع العلامات حتى يعتبر وضع العلامات الكمي. لاحظ أن MALDI-TOF مطياف الكتلة التي ينبغي تجنبها لهذا الأسلوب ينطوي على أشعة الليزر لعينة التأين. هذا العلاج يتحلل من fluorophores الحساسة المرفقة قبل قراءة الببتيد كتلة الخروج وبالتالي underrepre درجة sents من صبغ الاقتران.
وضع العلامات غير المباشرة حتى الآن في مواقع محددة من TCRs محددة الخلية مع استخدام سلسلة واحدة الأحادية التكافؤ شظايا F V
فإنه لا يزال يشكل تحديا إرفاق الأصباغ إلى الخلية البروتينات المرتبطة سطح الخلايا الحية بطريقة خاصة بالموقع. للتغلب على هذه العقبة لTCRs المعرضة للسطح، وقد تم بناؤها نسخة أحادي التكافؤ سلسلة واحدة (SCF V) من جينات TCRβ الأجسام المضادة وحيدة النسيلة -reactive H57-197 2. التركيب البلوري لهذه الأجسام المضادة في مجمع مع TCR يسمح لتصميم بعقلانية نسخة، حيث يتم استبدال بقايا سيرين على مقربة من محطة سي من الببتيد MHC المرتبطة بها (حيث يتم إرفاق المقابلة الحنق شريك صبغة) ل بقايا السيستين. ثم يقدم السيستين متحولة باعتبارها متقبل لتصريف صبغ (الشكل 2).
منهجيات لتسجيل الحنق
الإقليم الشمالي "> القيم الحنق السائبة هي الأنسب للتحقق من العلاقة بين اختيار المسافات بين صبغ والحنق الكفاءة تقاس في هذه TCR-PMHC نظام 2 ملزمة. وبالإضافة إلى ذلك، والقياسات الحنق السائبة تكشف الاختلافات النوعية والكمية في متشابك الانتماءات TCR-PMHC ( انظر أدناه والقسم بروتوكول 3.2). مقاربات مختلفة لقياس الكفاءة الحنق أدخلت في الأدب 6. وفي يتم تسجيل هذه المادة الحنق عبر(أ) استرداد المانحة بعد متقبل التبييض، وعبر
(ب) توعية الحنق الانبعاثات المتقبلة.
الطريقة الأولى (أ) يتطلب استخدام متقبل الحنق التي يمكن photobleached بسهولة، والجهات المانحة، وهو صامد إلى حد ما. وبالإضافة إلى ذلك فإنه من المهم للتأكد من أن متقبل photobleached لم يعد قادر على تبريد مضان المانحة. كما يتم استخدام قناة الكشف عن نفسها (المانحة) لتقدير، لا تصحيح عوامل لد لا الانحرافات لوني لا بد من النظر فيها، الأمر الذي يجعل هذه المنهجية بسيطة وموثوق بها. ومع ذلك، والقياسات الكمية لا يمكن أن تتكرر على الفور العينة نفسها ولا يمكن تسجيل التغيرات في الحنق على مر الزمن. لتجنب الآثار الناجمة عن الانتشار الجزيئي أو الحركة الخلوية وينبغي أن تهدف خطوة سريعة لتبييض، مما يقلل الوقت يمر بين أول الجهات المانحة الحنق (قبل متقبل تبيض) والحصول على الصور الحنق المانحة الثاني (بعد الحنق متقبل التبييض). فمن نوصي لاستخدام مصدر ضوء ليزر قوية من الحنق متقبل الطول الموجي الإثارة من أجل تقليل الإضاءة وتبيض مرات.
في المقابل، في نهج توعيتهم قياس الانبعاثات الحنق (ب) الجهة المانحة الحنق هو متحمس ويلاحظ انبعاث للمتقبل الحنق في القناة الحنق المتقبلة. يمكن تسجيل التغييرات في إشارة الحنق متقبل مرور الوقت ولكن الانبعاثات من الجهات المانحة الحنق في القناة متقبل الحمراء تحولت (رermed bleedthrough) والحنق متقبل عبر الإثارة عن طريق الإثارة المانحة يجب أن تحدد بدقة وتطرح من تسجيل الحنق قناة المتقبلة. لهذا المقابلة الحنق المانحة والحنق الصور متقبل يجب أن تكون محاذاة مكانيا.
الكشف عن جزيء واحد (سم) الحنق الأحداث
مع استخدام الليزر كمصدر الإثارة، وكاميرا حساسة والموهن الضوضاء TIRF المجهري مضان من fluorophores واحدة يمكن أن تعزى بسهولة مع مرور الوقت. تشبه صحيح للكشف عن أحداث smFRET الجزيئات. ومع ذلك، قد يكون سبب المضاعفات التي الحنق bleedthrough المانحة وعبر إثارة للمتقبل الحنق، والرعاية هكذا عظيمة لابد من اتخاذها عند ضبط الكثافة fluorophore في التجربة smFRET.
في بروتوكول الواردة أدناه (قسم البروتوكول 4) تم اختيار TCR كما الحنق المانحة في وفرة عالية وPMHC كما الحنق متقبل في وفرة منخفضة. للتخفيف FR ET المانحة bleedthrough بما فيه الكفاية، وتزيين 10-30٪ من TCRs مع الفلورسنت SCF V و90-70٪ من TCRs مع غير فلوري SCF V. هنا تم اختيار القناة متقبل الحنق كقناة جزيء واحد لأنه متحد البؤر مع جزيء واحد الحنق القناة. وهذا يساعد على مواءمة الأحداث smFRET مع جزيء واحد الحنق يقبلون، الذي هو أساس التحقق من صحة smFRET.
استخراج متشابك خارج معدلات من خلال القياسات smFRET
photobleaching من كل من الحنق المانحة والحنق متقبل لها ليتم احتساب عند استخراج نصف عمر التفاعلات من جزيء واحد الحنق آثار. عدد ملاحظتها الحنق إشارات في بداية ظهورها بينما واحد الزوج المانحين متقبل N (0) تخفض مع مرور الوقت من قبل كل من غير ملزم للمستقبلات يجند photobleaching من التعقيد و. عدد الباقين على قيد الحياة المجمعات في وقت معين N (ر) ويمكن التعبير رياضيا على النحو التالي:
الصورة = "jove_content"> 
في إكسب المدى photobleaching من (-t / τ التبييض) يوصف الوقت t نتاج عدد من الملاحظات ن والإضاءة ر الوقت مريضا بسبب الوضع مراقبة غير مستمرة، منفصلة (أي تبيض يحدث فقط أثناء إضاءة ). ضمن exp- المدى الحركي (ر / τ إيقاف) الوقت تي هو نتاج عدد من الملاحظات ن والزمن t تأخر لمراقبة الحنق واحدة (أي غير ملزم الحركي يحدث باستمرار). المعادلة 1 يمكن التعبير عنها على النحو التالي:
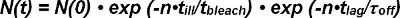
وτ المدى التبييض / τ سوء ديسcribes عدد من الملاحظات حتى يحدث التبييض ويعرف كقيمة التوقع <ن التبييض> وظيفتها الأسية. المعادلة 2 يمكن تبسيط النحو التالي:

يتم تحديد القيمة المتوقعة <ن (ر متخلفة)> من عدد الإطارات N (ر) مع ملاحظتها الحنق أحداث بعد وقت ر مباشرة من التجربة. ذلك يعتمد على الوقت القابل للتعيين بين الملاحظات (ر متخلفة) المختار في التجربة والقيم غير معروفة لτ قبالة (معكوس معدل خارج ك إيقاف) و <ن تبييض>، وقيمة توقع عددا من الملاحظات قبل حدوث تبيض .
وهكذا، حساب القيمة المتوقعة <ن (ر متخلفة)> لمدة سنتين على الأقل قيم ر تأخر يسمح تصميم تجريبي ل<ن تبييض> وτ خارج.
استخراج القيم متشابك 2D-K D من خلال القياسات المأخوذة من الحنق
قياس TCR الإشغال لذلك، أي النسبة بين TCRs المربوطة ومجموع TCRs، أمر أساسي لتحديد القيم متشابك 2D-K D. وفقا لمعادلة 4 هذا المصطلح هو يتناسب طرديا مع قياس الحنق تسفر طالما يخدم TCRs الجهات المانحة الحنق وpMHCs كما يقبلون الحنق.

مع الإشغال = TCR، C = معامل التحويل
C هو ثابت، الذي يعتمد على نظام الحنق وfluorophores استخدامها. ويمكن تجريبيا كما هو مبين أدناه. ويمكن تحويلها إلى 2D-K D وفقا للمعادلة 5 عندماومن المعروف الكثافة الأولية لبروابط TCR قبل إضافة T-الخلايا إلى طبقة ثنائية. هذا هو بسبب كثرة تنقل البروتينات SLB المرفقة وأيضا بسبب SLBs توفير خزان لا ينضب تقريبا بروابط 2.

مع [الأولية PMHC] = كثافة الأولى من PMHC قبل إضافة الخلايا التائية
مع المعادلات 4 و 5 واحد ويمكن الآن بسهولة تحديد متشابك 2D-K D بين TCR وPMHC. ويتم ذلك أكثر موثوق مع القياسات الحنق على أساس الانتعاش المانحة بعد التبييض متقبل (انظر القسم بروتوكول 3.1).
ومع ذلك، لقياس C العلاقة بين شدة الحنق I الحنق (تصحيح للخلفية، الحنق bleedthrough المانحة والحنق متقبل عبر الإثارة) وTCR الإشغال لديها يحدد لاحقا. لهذا، واحديحتاج إلى معرفة نسبة R بين متوسط كثافة مضان من واحد fluorophores TCR المرتبطة الحنق المانحة (على سبيل المثال CY3 أو AF555) ن خ I الحنق المانحة ومتوسط كثافة من جزيء واحد الحنق الأحداث SM I الحنق. R يعتمد على نظام الحنق في السؤال، والمرشحات الانبعاثات والكاميرا المستخدمة للكشف عن مضان.
الإشغال في TCR ويمكن بعد ذلك أن تحدد مباشرة وفقا للمعادلة 6.

مع R = ن خ I الحنق المانحة / SM I الحنق
تقرر R كما 1.45 لنظام H57 scFv- CY3 / PMHC-Cy5 يؤدي إلى:
و= الجزء الأكبر I الحنق / الجزء الأكبر I TCR-CY3 • 1.45
يمكن تحديد العلاقة بين إشغال TCR والعائد الحنق من قبل الحنق المانحة استعادةذ بعد متقبل التبييض. ليتم رسم هذا على حد سواء المعلمات ضد بعضها البعض لعدد من microclusters TCR كما هو مبين في الشكل 4A. والمنحدر من نوبة الخطي يشير إلى عامل التحويل C (من المعادلة 4).
كما هو موضح في الشكل 4A، C يرقى ل(أ) H57 SCF V - CY3 / PMHC-Cy5 نظام الحنق و (ب) تكوين النظام المجهر تطبيقها على 1.995. الإشغال في TCR ويمكن استخلاصه بسهولة كما يلي:
الإشغال TCR ل= الحنق تسفر • 1،995
Protocol
الإنتاج 1. البروتين
1.1. -طبقة ثنائية المقيمين البروتينات: B7-1، ICAM-1، PMHC (على سبيل المثال، ك IE / الببتيد)
- -12H B7-1، ICAM-1-12H
- B7-1-12H صريحة وبنيات-ICAM 1-12H بكميات تصل البروتينات الأم يفرز باستخدام نظام التعبير الفيروسة العصوية.
- تنقية البروتينات من supernatants الثقافة عبر ني NTA التقارب اللوني، تليها MonoQ تبادل أنيون اللوني وS200 استبعاد حجم اللوني.
- تسمية قسامة واحدة من البروتين النقي مع الأصباغ أمين رد الفعل مثل NHS الاستعدادات succinimidyl استر اليكسا فلور 488 (أو FITC)، اليكسا فلور 555 (أو CY3)، اليكسا فلور 647 (أو Cy5).
- بعد S200 استبعاد حجم اللوني تحديد درجة وسم البروتينات أحادى وفقا لمواصفات صبغ الشركة المصنعة بمقارنة امتصاص البروتين في 280 نانومتر، وامتصاص الصبغة في 488 نانومتر (فلور اليكسا 488، FITC)، 555 أو 552 نانومتر(فلور اليكسا 555 أو CY3) أو 647 نانومتر (فلور اليكسا 647 أو Cy5).
ملاحظة: سيتم لاحقا حاجة هذه النسبة لتحديد كثافة البروتين على SLB من إشارة مضان الجزء الأكبر من البروتين المسمى الصبغة. - تخزين البروتينات غير المسماة والمسمى fluorophore في -20 ° C في برنامج تلفزيوني بالإضافة إلى 50٪ الجلسرين.
- PMHC (هنا: IE ك -2x6H أو IE ك -12H)
- Refold الفئة MHC II من الهيئات إدراج أعرب في القولونية في وجود أرخص بكثير للأشعة فوق البنفسجية شطورة الببتيد بديلا، والتي يمكن بعد ذلك يتم تبادلها كميا مع الببتيد fluorophore مترافق من اختيار 5 و 7.
- مجمعات تنقي PMHC refolded بواسطة تقنيات قياسية (اللوني ني NTA تقارب، MonoQ أنيون تبادل اللوني، S200 هلام الترشيح).
- تبادل UV الببتيد شطورة مع الببتيد الفلورسنت 5، 7.
- تنقية الفلورسنت أحادى PMHC مجمعات وومكونا التي كتبها S200 هلام الترشيح. ويرد اللوني تمثيلي في الشكل (3).
- تحقق الكمي الببتيد التحميل من قبل الطيفي.
- متجر البروتينات في -20 ° C في برنامج تلفزيوني / 50٪ الجلسرين.
1.2. جيل من شظايا سلسلة واحدة الأجسام المضادة (SCF V ق)، وإدخال cysteines لوضع العلامات الخاصة بالموقع
- Refold SCF V الصورة من الهيئات إدراج أعرب في القولونية. وهنا يتبع بروتوكول ضعتها Tsumoto وزملاؤه في 8 التي تكشفت الهيئات إدراجها لأول مرة في 6 M guanidinium كلوريد، خفضت بشكل كامل ثم refolded خلال أسبوع من قبل تدريجيا تناقص تركيز كلوريد guanidinium تتكشف البروتين.
- التركيز مطوية بشكل صحيح SCF V باستخدام وحدات تصفية الجزيئية مع قطع الجزيئي 10 كيلو دالتون.
- تنقية التركيز من قبل S200 هلام الترشيح.
- تسمية مركب بسيط SCF V بحضور 0.05 ملي تريس (2-carboxyethyl) الفوسفين (TCEP) مع فلور اليكسا 647 مباشرة بعد تنقيتها. نفذ رد فعل التوسيم الأفضل في نسبة المولي من البروتين: صبغ لا يزيد عن 1: 2 في RT لمدة لا تزيد عن 2 ساعة.
ملاحظة: TCEP هو عامل تخفيض phosphorous- استنادا ولا تتفاعل مع maleimides في هذه التركيزات 9. ويمكن بالتالي أن يكون حاضرا أثناء رد فعل وسم للحفاظ على مجموعة سلفهيدريل المفردة انخفاض حتى يتفاعل مع مشتق صبغ maleimide. - تنقية المسمى أحادى SCF V أخيرا عبر S75 هلام الترشيح. ويرد اللوني تمثيلي في الشكل (3).
- تحديد الصبغة: البروتين نسبة طيفيا.
- متجر البروتينات في -20 ° C في برنامج تلفزيوني / 50٪ الجلسرين.
2. الكالسيوم الجريان القياسات
- خذ قنينة الطازجة التي تحتوي على 50 ميكروغرام FURA-2-AM وحله في 50 ميكرولتر DMSO خالية من المياه.
- تدور باستمرار 10 6 خلايا تي في 5 مل أنبوب البولي بروبلين مستديرة أسفل لمدة 2 دقيقة على 250-400 غرام.
- و resuspend T-الخلايا في 200 ميكرولتر المتوسطة التصوير التي تحتوي على محلول هانك المتوازن الملح بالإضافة إلى الكالسيوم / المغنيسيوم و1٪ ألبومين البيض في RT، إضافة 1 ميكرولتر من-AM FURA-2 الاسهم الحل (1: 200 تمييع)، مزيج تعليق خلية واحتضان في RT لمدة 30 دقيقة.
- غسل خلايا T مرة واحدة في المخزن التصوير. لهذا، وملء الأنبوب الذي يحتوي على الخلايا مع عازلة التصوير في RT وبيليه الخلايا كما هو موضح في الخطوة 2. إزالة طاف و resuspend الخلية بيليه في 200 العازلة التصوير ميكرولتر (أي في مناطق ذات كثافة الخلية النهائية من 5 × 10 6 خلايا مل -1). الخلايا يمكن استخدامها على الفور لقياس الكالسيوم أو تخزينها على الجليد لمدة تصل إلى 3 ساعات.
- خلايا المكان على SLB functionalized في المخزن التصوير (37 ° C). حالما تبدأ الخلايا التائية الاتصال SLB، والحصول على ما يلي مجموعة من الصور كل 15 إلى 30 ثانية لمدة 30 دقيقة:
excitatايون في 340 +/- 5 نانومتر، والكشف عن الانبعاثات في 510 +/- 40 نانومتر
الإثارة في 380 +/- 5 نانومتر، والكشف عن الانبعاثات في 510 +/- 40 نانومتر
DIC (اختياري)
ملاحظة: مرات التعرض الخاصة بكل تعتمد على كثافة مصدر الضوء الإثارة. ويتم الحصول على نتائج مرضية عند شدة بكسل من 340 نانومتر (380 نانومتر) كمية القناة إلى نحو ربع (نصف) من قيمة كثافة ممكنة الحد الأقصى. نضع في اعتبارنا أن القيم FURA-2 متحمس في 340 نانومتر ستزيد وتلك متحمس في 380 نانومتر سيقلل على تنشيط خلايا T. - 20-25 دقيقة في المدى، إضافة 50-100 ميكرولتر من قبل تحسنت مكافحة PMHC منع الأجسام المضادة بتركيز نهائي من 20-50 ميكروغرام مل -1. الأجسام المضادة يشبع كل pMHCs ونتيجة T-خلايا تتوقف على الاعتراف مستضد ووقف الصهر الكالسيوم. مواصلة تسجيل الصور لمدة 5 آخر - 10 دقيقة للحصول على خط الأساس للتركيز الكالسيوم داخل الخلايا، والتي تتطابق مع حالة غير تنشيط للخلايا T < / لى>
- تحديد متوسط إشارة مضان الخلفية في 340 نانومتر و 380 نانومتر الإثارة داخل المنطقة من اهتمام من 1000 بكسل على الأقل، والتي لا تحتوي على الخلية. خلفية طرح كل FURA-2 صور قياس متحمس في 340 نانومتر و 380 نانومتر، وحساب 340 نانومتر / 380 نسب كثافة نانومتر الخلايا الفردية أو مجموعة من الخلايا. تطبيع نسب الكثافة بقسمة جميع النسب من خلال نسبة الأطر الزمنية الماضي خمسة (أي مع كامل الأجسام المضادة الحصار المفروض على PMHC).
- مؤامرة تطبيع FURA-2 نسب مع الزمن. ملاحظة: عندما خلايا وطبقات ثنائية هي في حالة جيدة، نانومتر / 380 نسب كثافة نانومتر FURA-2 340 تبني القيم عادة ما بين 2 و 5، 15-45 ثانية بعد أن يقدم خلايا اتصال مع طبقة ثنائية. نسب ثم ينخفض إلى قيمة تتراوح بين 1.6 و 2 حيث أنها تبقى ثابتة لمدة 20 دقيقة على الأقل أو أكثر. أن تسقط القيم إلى 1 فقط بعد إضافة أجسام مضادة للPMHC. ويرد مثال نموذجي في الشكل 5.
3.1. TCR الديكور مع H57scF V
- تدور باستمرار 10 6 خلايا تي في 5 مل أنبوب البولي بروبلين مستديرة أسفل لمدة 2 دقيقة على 250-400 غرام.
- صب وسائل الإعلام، ونفض الغبار بيليه خلية بلطف وإضافة 0.3 ميكرولتر من SCF V (تركيز ~ 1 ملغ / مل) إلى تعليق خلية. لمعظم الحنق القياسات توظف فقط صبغ المسمى scFv. لجزيء واحد الحنق القياسات تستخدم مزيجا من الخالي من الملصقات scFv (5-9 أجزاء، لا تحتوي على السيستين المفردة) وصبغ المسمى scFv (جزء 1، يحتوي على واحد المفردة يقترن صبغ السيستين).
- احتضان الخلايا على الجليد لمدة 15 دقيقة ويغسل خلايا مرتين خلال الطرد المركزي على التوالي باستخدام العازلة التصوير الجليد الباردة.
ملاحظة: يمكن تخزين الخلايا على الجليد دون خسائر كبيرة في المربوطة SCF V (ر 1/2 من SCF V التفكك في 0 ° C ~ 4 ساعة 2). نقاء خلايا T الأولية المستمدة من TCR-المعدلة وراثيا (واختياريا أيضا Rag-1/2 الفئران ناقص)، وحفزت في المختبر هو أعلى من 98٪ منذ T-الخلايا هي الخلايا الوحيدة المتكاثرة (تصل إلى 7 انقسامات الخلية) ردا على الببتيد، والتي تم إضافتها لتحفيز لثقافة T-الخلية. خلايا B-الخضوع لموت الخلايا المبرمج ولم تعد على قيد الحياة بعد 7-10 أيام من الزراعة. هناك عدد قليل من الخلايا الجذعية البقاء على قيد الحياة حتى الآن يمكن أن تميز بسهولة ضد ليس فقط بسبب التشكل متميزة ولكن أيضا لأنها لا تربط H57 مضادة للTCR بيتا scFV شظية.
3.2. الحنق قياس عبر الانتعاش المانحة بعد متقبل تبيض
ملاحظة: نضع في الاعتبار أن العمر النصفي للمجمعات V TCR-H57 SCF تصل إلى 4 ساعات على الجليد، إلى 50 دقيقة في 22.5 درجة مئوية، وإلى 6.8 دقيقة عند 37 ° C (وإلى حوالي 4 ساعات على الجليد) 2. طالما يخدم H57 SCF V كما الحنق المانحة، والمحاصيل الحنق قياس ليست حساسة لH57 SCF V التفكك، ومع ذلك، فإن إشارة إلى الضوضاء زيادة نسبةمع زيادة التفكك H57.
- إعداد SLB تحتوي على AF647 / pMHCs Cy5 المسمى وكذلك غير المسماة ICAM-1 و B7 وفقا لAxmann وآخرون. 4.
- تبادل PBS من غرفة التصوير مع المتوسط التصوير التي تحتوي على محلول الملح المتوازن بالإضافة إلى الكالسيوم / المغنيسيوم و1٪ ألبومين البيض هانك. لهذا الماصة 400 ميكرولتر من العازلة التصوير في البئر، مزيج بعناية وإزالة 400 ميكرولتر من البئر. كرر هذا الإجراء 3-4 مرات. لا تعرض SLB في الهواء في أي وقت.
- ضع غرفة التصوير على خشبة المسرح المجهر وضبط التركيز حتى الفلورسنت (AF647، Cy5) SLB يأتي إلى رؤية واضحة.
- انشاء TIRF الإضاءة عن طريق ترجمة موازية شعاع تركيزا على المحور البصري للمحيط البؤري الهدف من خلال الانتقال من مرحلة متعدية منظار ل.
- لضبط أشعة الليزر الإثارة في وضع TIRF، إضافة T-خلايا مزينة AF555 / CY3 المسمى SCF V والسماح لهم تسوية على SLB. ملاحظة: يتم استيفاء شروط TIRF الإضاءة عندما الغشاء الخلوي القاعدية هو في التركيز بالإضافة إلى SLB وعدم وجود أجزاء أخرى من الخلايا تأتي في الرأي عند التركيز صعودا. ومع ذلك، إذا لم يتم ضبط TIRF بشكل صحيح، وأجزاء من الفلورسنت غشاء البلازما T-الخلية، التي ليست على اتصال مع SLB، ستظهر باعتباره حلقة. إذا كان هذا هو الحال، وضبط شعاع الليزر مع مرحلة متعدية منظار حتى يتم تحقيق TIRF الإضاءة.
- الحصول على الصور الستة التالية بالترتيب الموضح أدناه وبتتابع سريع (الشكل 6):
(I1، اختياري) الضوء الأبيض، لالتقاط صورة للخلية،
(I2، اختياري) 647 نانومتر الإثارة (الطاقة المنخفضة) لالتقاط صورة للمتقبل الحنق (PMHC) قبل نبض التبييض،
(I3) الإثارة 514 نانومتر (الطاقة المنخفضة) لالتقاط صورة من المانحين الحنق (TCR) السابقة لنبض التبييض،
(I4) 647 نانومتر الإثارة (السلطة العليا) إلى الصورة التبييض ومتقبل الحنق، /> (i5 و) الإثارة 514 نانومتر (الطاقة المنخفضة) لالتقاط صورة من المانحين الحنق (TCR) بعد نبض التبييض،
(I6) الإثارة 647 نانومتر (الطاقة المنخفضة) للتحقق الكامل الحنق متقبل التبييض. - الحفاظ على مر الوقت بين الصور (I3) و (i5 و) قصيرة قدر الإمكان من أجل أن تكون قادرة على ربط الصور لتحليلها لاحقا. الحفاظ الحنق تبيض المانحة على الأقل من خلال توظيف الإثارة عند أدنى مستوى ممكن والطاقة، والتي لا يزال يسمح للتصوير السليم للخلايا T.
- اختيار المنطقة ذات الاهتمام (ROI)، على سبيل المثال، وهو المشبك كامل أو microcluster TCR الفرد، وتحديد متوسط كثافة في (I3) (= I (3)) وفي (i5 و) (= I (5)). لخلفية الطرح، واختيار ROI من نفس البعد خارج بقعة الإضاءة في (3) أو (5) وتحديد متوسط كثافته (I (الخلفية)). لتحديد العائد الحنق تنفيذ العملية التالية:
ز "/> (المعادلة 7)
ملاحظة: تجدر الإشارة إلى أنه فيما يتعلق مستوى الحنق المطلق، فإنه يمكن أن يكون من الضروري تصحيح للتبييض المانحة بين الصور (i5 و) و (I3).
3.3. الحنق قياس الانبعاثات عبر توعيتهم
- أداء المانحة المكاني والمواءمة قناة متقبل مع استخدام الخرز متعدد الألوان، الذي يتألق في كل القنوات الانبعاثات. يمكن تحديد التحول المكاني بين كل القنوات بسبب انحراف لوني من قبل الخرز الفردية وتحديد المواقع الفائقة والتي ستطبق لتصحيح واحدة من القناتين لجميع 2-لون صورة أزواج التالية 10.
- تحديد درجة bleedthrough المانحة مع استخدام وسيلة SLB يحتوي على fluorophore المانحة الحنق وحدها. بل هو أيضا من المجدي استخدام المسمى الحنق الجهات المانحة-T-الخلايا على طبقة ثنائية الدهون مع غير المسماة PMHC. يتم تحديد الخلفية أولا خارج مجال مضيئة للعرض ومن ثم تطرح من كلتا القناتين. بهذه الطريقة متوسط با يتم تحديد شدة لتصحيح ckground اثنين من المقابلة رويس (I قناة المانحة وأنا متقبل قناة). حساب معامل bleedthrough (BTC) على النحو التالي:
 (المعادلة 8)
(المعادلة 8)
ملاحظة: هذا BTC هو ثابت للصبغة معينة وتصفية انشاء الجمع. - حساب الحنق المانحة صورة bleedthrough على النحو التالي:
 (المعادلة 9)
(المعادلة 9) - تحديد متقبل عبر الإثارة عن طريق إثارة وSLB يحتوي على fluorophore الحنق متقبل وحده (على سبيل المثال، IE ك / MCC-فلور اليكسا 647) أولا مع الحنق ضوء الإثارة المانحة (على سبيل المثال، 514 نانومتر)، ثم مع متقبل ضوء الإثارة (على سبيل المثال، 647 نانومتر). استخدام الصور التي تطرح خلفية داخل القناة الحنق متقبل لحساب معامل عبر الإثارة (CEC) على النحو التالي:
ftp_upload / 53157 / 53157eq10.jpg "/> (معادلة 10) - كما تعتمد لجنة الانتخابات المركزية على كثافة الليزر المستخدمة لإثارة المانحة، وتحديد ذلك في كل يوم قياس. استخدام CEC مما أدى لحساب الصورة الناتجة فقط من خلال عبر الإثارة.
 (معادلة 11)
(معادلة 11) - حساب صورة الحنق تصحيح لbleedthrough وعبر الإثارة على النحو التالي:
 (معادلة 12)
(معادلة 12)
ملاحظة: إشارة الحنق المطلقة (ولكن ليس العائد الحنق النسبي) حساسة إلى التفكك من H57 SCF V من غشاء الخلية T-TCR ملزمة. لتجنب خسائر فادحة في التحقيق TCR-الحنق، تهدف إلى إجراء قياسات عند 37 درجة مئوية داخل دقيقة 2 الأولى بعد إضافة خلايا T إلى طبقة ثنائية. القياسات مع الكمي (≥ 95٪) وضع العلامات TCR ممكنة فقط عند أو أقل من 22.5 درجة مئوية في غضون 3 دقيقة الأولى بعدإضافة T الخلايا إلى طبقة ثنائية.
4. واحدة جزيء الحنق القياسات
- ضبط قوة الليزر على حد سواء أن تؤدي إلى كثافة 1-5 كيلو واط / ميكرون 2 في العينة. لمزيد من المعلومات يرجى الرجوع إلى Axmann وآخرون. 4.
- تسمية الخلايا التائية على النحو المبين أعلاه مع مزيج من الخالي من الملصقات SCF V (5-9 أجزاء) وCY3 / المسمى AF555 SCF V (جزء 1). ملاحظة: هذه الطريقة يتم وضع علامة على جزء من TCRs فقط مع الحنق والجهات المانحة. وهذا يقلل من عدد من التفاعلات التي يمكن اكتشافها، ولكن انخفض الضوضاء الناتجة من bleedthrough المانحة أيضا بشكل ملحوظ (بنحو 5 1/2 إلى 10 1/2)، وهو أمر حاسم عندما حل جزيء واحد على حدة الحنق الأحداث.
ملاحظة: التفكك لجنة التحقيق H57 scFV من TCR لا يؤثر على القياسات، كما يحدث في نطاق زمني أكبر من ذلك بكثير (دقيقة إلى ساعة) من التفكك من TCR من متجهة الى SLB PMHC (الثانية الفرعية للمركز الثانينطاق). - وضع SLB يضم pMHCs المسمى AF647 وكذلك ICAM وB7 على المسرح المجهر وضبط التركيز بحيث تأتي طبقة ثنائية إلى رؤية واضحة.
- اختياري: إدراج فتحة شق في مسار الإثارة (كما هو موضح في Axmann وآخرون (4).) لإخفاء غالبية مجال الإضاءة باستثناء المشبك. بهذه الطريقة يمكن غير مقصور IE ك / MCC (C) -Alexa فلور 647 الحنق جزيئات متقبل تتحرك في مجال الإضاءة.
- إضافة H57 SCF V زينت خلايا T إلى طبقة ثنائية (مع العازلة التصوير)، وانتظر حتى تظهر نقاط الاشتباك العصبي في مجال الرؤية.
- تأخذ في تعاقب سريع سلسلة من 10-20 مجموعات الصور باستخدام الكشف 2-اللون:
I1) الإثارة 514 نانومتر
I2) الإثارة 647 نانومتر - فضح الصور ل1-5 مللي ثانية والحصول على أنها مجموعة من الصور.
- لتقييم هوية جزيء واحد الحنق الأحداث، تطبيق نفس التصحيح بشأن bleedthrough المانحة ومتقبل عبر excitaنشوئها. وعلاوة على ذلك، جزيء واحد الحنق الأحداث يجب أن تتماشى مع جزيئات متقبل واحدة ويجب أن تظهر وتختفي في خطوة واحدة (انظر أيضا الشكل 7).
- خارج معدل تقرير
- آثار قياسيا من جزيء واحد الحنق الأحداث لعدة أطر زمنية الاستحواذ.
ملاحظة: في هذا المثال (بخط مائل) معدل من بين 5c.c7 يقاس TCR وك IE / K3 في 25 ° C مع أربعة أوقات مختلفة تأخير (42 ميللي ثانية، 490 ميللي ثانية، 1007 ميللي ثانية، 1989 ميللي ثانية). - قائمة الحنق يتتبع اعتمادا على طول أثر على النحو المبين في الجدول 1.
- تحويل الجدول 1 إلى العكسية التراكمية وظيفة تسوس (الجدول 2) ليصبح (تؤخذ الأرقام الملونة من الجدول 1) المبين.
- لتطبيع وظيفة تسوس الناتجة عن ذلك، تقسيم عدد من آثار الجدول 2 على مجموع كل آثار في ذلك جماعة معينة. رسم القيم تطبيع ضد عدد من الأطر الزمنية. عندما حذف الإطار الزمني الماضي، والذي يحتوي على صفر، ويضمحل يمكن قراءةتركيب إيلي مع الدالة الأسية واحدة (الشكل 8A).
- كما هو مبين في الشكل 8B، رسم القيمة المتوقعة <ن (ر متخلفة)>، أي معكوس السلبي للداعية وظيفة تسوس تحديدها أعلاه ضد وقت التأخير ر تأخر العاملين (في هذا المثال: س = ر تأخر = 0.042 الصورة و y = <ن (ر متخلفة)> = 1 / 0.662 = 1.511، س = 0.49 ق و y = 1 / 0.902 = 1.101، س = 1،007 ق و y = 1 / 1.131 = 0.884، س = 1،989 ق و y = 1 / 1.591 = 0.629).
- صالح τ قبالة و<ن تبييض> على أساس المعادلة 3. ويمكن أن يتم ذلك باستخدام وظيفة مناسبة غير الخطية من برنامج تحليل البيانات العلمية مثل المنشأ.
ملاحظة: الأنسب هو موضح في هذا المثال غلة τ الخروج من 2.12 +/- 0.23 ق و<ن تبييض> من 1.53 +/- 0.06 ثانية. - حساب نصفو الحياة للتفاعل ر 1/2 قبالة مع تي 1/2 قبالة = τ قبالة • قانون الجنسية (2) (في هذا المثال: 1.47 ق).
- آثار قياسيا من جزيء واحد الحنق الأحداث لعدة أطر زمنية الاستحواذ.
- تقرير 2D-K D
- تحديد عامل التحويل C للزوج صبغ الحنق يعملون مع استخدام المعادلة (6) وعلى النحو المبين أعلاه (الشكل 4A).
- تحديد العوائد الحنق لmicroclusters TCR الفردية أو نقاط الاشتباك العصبي بأكمله (أرقام 3B و 5).
- باستخدام المعادلة 4 تحويل جميع عائدات الحنق الفردية في الإشغال TCR (الشكل 4C).
- تطبيق المعادلة 11 لتحويل جميع الإشغالات TCR في 2D-K D الصورة. كما هو مبين أدناه، متشابك الربط غير متجانس. مقياس ذي مغزى لمتشابك K D الصورة هو الوسيط (المشار إليها باللون الأحمر) لجميع microclusters قياس (الشكل 4D).
- حساب 2D-ك على الصورة
- حساب ك على لقانون العمل الجماهيري مع ك = ك على إيقاف / K D وك تجريبيا قبالة والقيم K D.
ملاحظة: ك متشابك خارج للتجربة هو مبين في الشكل (4) (IE ك / MCC التفاعل مع 5c.c7 TCR في 25 ° C) هو 0.41 ق -1. وبالتالي المؤامرة K D (الشكل 4D) ويمكن تحويلها إلى حزب العدالة والتنمية على قطعة كما هو مبين في الشكل 4E.
- حساب ك على لقانون العمل الجماهيري مع ك = ك على إيقاف / K D وك تجريبيا قبالة والقيم K D.
النتائج
تسجيل الكالسيوم داخل الخلايا عن طريق الصبغة الكالسيوم FURA-2، وكذلك التحليل الخلوي لاحق للتحقق من فعالية تنشيطية وبالتالي ظائف في الشكل 4 SLBs. كما يصبح واضحا، وارتفاع مستويات الكالسيوم في الخلايا التائية (معبرا عنها تطبيع FURA-2 340nm / 380nm نسبة مع خط الأساس يجري 1) على الفور بمجرد أن يستقر على SLBs المحفزة. مستويات الكالسيوم العودة إلى مستويات خط الأساس بعد فترة وجيزة من إضافة الأجسام المضادة التي تمنع pMHCs من المشاركة TCR والتي تنتهي تي خلية التنشيط.
الرقم 6 يصور تجربة نموذجية تشمل الحنق الانتعاش المانحة بعد التبييض متقبل، التي تستخدم لقياس إنتاجية الحنق والذي يعمل لحساب القيم 2D-K D (كما هو موضح في الشكل 4). من فضلك لاحظ زيادة في كثافة الحنق المانحة، التي تمثل TCR المسمى عبر AF555، بعد الاستئصال السريع والكامل من الحنق علىالأنواع cceptor (هنا: AF647 المرتبطة pMHCs). كما واضح هو انخفاض شديد في القناة الحنق، أي قناة الحنق متقبل تحت الحنق الإثارة المانحة، بعد الحنق متقبل التبييض. إشارة بالكاد مرئية المتبقية يتوافق مع الحنق bleedthrough المانحة. عائدات الحنق داخل microclusters TCR الفردية أو نقاط الاشتباك العصبي كلها تحسب على أساس أشار قيم الكثافة قياس (الشكل 6B).
الرقم 7 يصور مسار والفاصل الزمني من جزيء الحنق حدث واحد وضوحا في إطارين زمنيين. كما هو موضح أعلاه في مقدمة يحدث مثل هذا السلوك من قبل كل من اضمحلال متشابك TCR-PMHC ملزمة وphotobleaching من. للتمييز بين هذه المساهمات، وهما الأطر الزمنية اكتساب التجريبية يجب أن تكون متنوعة من حيث المدة: بينما لا يزال photobleaching من ثابت، وحدوث تغيرات في الحنق طول مسار الحدث إلا من خلال حركية ملزمة. A الكميات من tracelengths، ث هيك يشكل أساسا لحساب خارج الأسعار وتبيض هو مبين في الشكل 7، ترد في الجداول 1-3.
يتطلب تحديد 2D-K D ق تسجيل معظم الحنق العوائد لTCRs المسمى الحنق الجهات المانحة. مع استخدام C ثابت استنتاجها تجريبيا (الشكل 4)، وهو عائد الحنق قياس لmicrocluster TCR أو المشبك بأكمله يمكن تحويلها إلى TCR الإشغال لذلك، أي نسبة TCRs PMHC تشارك ومجموع (الشكل 4C) . ذات الكثافة PMHC المعروفة موجودة على SLB قبل إضافة خلايا T، ويمكن تطبيقها على القيم لتحديد القيم 2D-K D متشابك (الشكل 4D). ويمكن حساب أسعار الفائدة على مع قانون العمل الجماهيري (2D-ك على = 2D-K قبالة / 2D-K D) من متشابك تحديدها خارج معدل والقيم 2D-KD.
1 "SRC =" / ملفات / ftp_upload / 53157 / 53157fig1.jpg "/>
الشكل 1. مخطط تخطيطي للدهن طبقة ثنائية (SLB) النظام المدعومة من الزجاج مستو. وتتكون (A) SLBs من POPC (90-99٪) والدهون الاصطناعية DGS ني NTA (1-10٪) وتشكل تلقائيا عندما يتم تحميل أسطح زجاجية نظيفة مع حويصلات unilamellar الصغيرة (سيارات الدفع الرباعي)، ويتألف من الدهون المقابلة. (B) وبمجرد تشكيل مثل SLBs يمكن functionalized مع أجزاء قابلة للذوبان الموسومة polyhistidine خارج الخلية المستمدة من pMHCs، costimulatory B7-1 البروتينات وICAM-1 البروتينات التصاق، لتكون بمثابة ناقلات الجنود المدرعة لخلايا تي. لمزيد من المعلومات حول إعداد SLBs الرجوع إلى Axmann وآخرون (4). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

فيقو 2. إعادة فورستر الرنين الطاقة القائمة على نقل فحص ل quantitate TCR-PMHC ملزمة في الموقع. (A) يوضح هيكل مركب من TCR المعقد مع H57 سلسلة واحدة جزء إشراك PMHC النهج القائم على الحنق الموصوفة هنا. لاحظ مسافة قصيرة من حوالي 41A فصل اثنين من fluorophores المقابلة تمر الحنق. يشار إلى مواقع متقبل لfluorophore-maleimides باللون الأخضر والأحمر. (B) ويوضح مبدأ الكشف عن التفاعلات TCR-PMHC في الموقع. فقط -decorated SCF V TCRs وpMHCs (هنا IE ك)، والتي تشكل مجمعات محددة، تؤدي إلى إشارة الحنق قابلة للقياس. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
"/>
الشكل 3. الاستشرابية من النهائي خطوة الترشيح هلام مما أدى إلى أحادى SCF V الصورة وتحميل الببتيد IE ك -2x6H الجزيئات. وتمثل X-محاور حجم الاحتفاظ في مل، Y-محاور تشير الامتصاصية في 280 نانومتر في وحدات التعسفي (AU) . (A) الموقع تحديدا المسمى H57 SCF V مع تعرض اليكسا فلور 555 maleimide لS75 اللوني لفصل الصبغة المتفاعل من البروتين (الخطوة 1.2.5). الكسور المقابلة لفترة احتفاظ 14 to15 مل (الخطوط المتقطعة) تمثل صفت أحادى H57 SCF V. (B) IE ك جزيئات -2x6H المعقد مع الأشعة فوق البنفسجية شطورة ANP الفضاء حامل الببتيد كان المشع أشعة فوق البنفسجية، حضنت مع اليكس الموقع على وجه التحديد 647 المسمى maleimide الببتيد وتعرض أخيرا لS200 اللوني لفصل البروتين من الببتيد المجاني (خطوة 1.1.2.4). الفترة الزمنية الفاصلة بين الخطوط المتقطعة يحتوي على مطوية بشكل صحيح وpMHCs مركب بسيط. (A، B) تم تطبيق 0.7 مل عينة إلى عمود في بداية الروم (0 مل نقطة). وتركزت الكسور التي تم جمعها. تم تحديد نسبة البروتين إلى صبغ التي كتبها photospectrometry قبل غسيل الكلى ضد PBS / 50٪ الجلسرين (للتخزين في -20 درجة). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
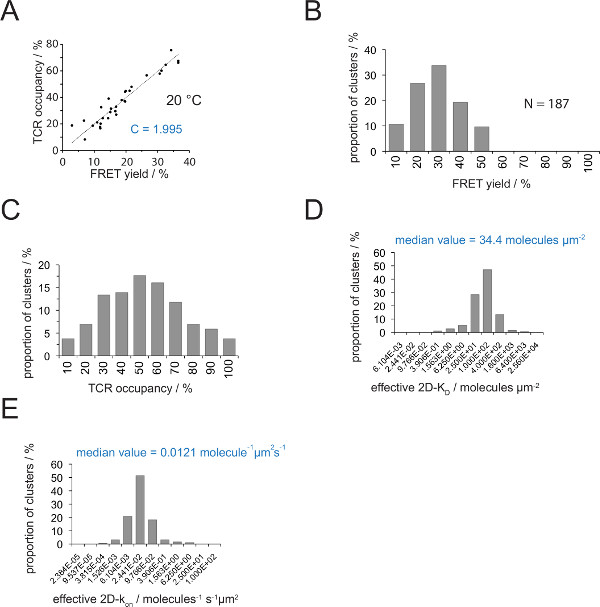
الشكل 4. تحديد 2D-K D الصورة و2D-ك على الصورة. (A) والعلاقة بين العائد الحنق على النحو الذي يحدده الانتعاش المانحة بعد تم قياس تبييض متقبل والإشغال TCR تجريبيا. يمكن تحديد الإشغال TCR للفرد microclusters TCR كما هو موضح في القسم 4.2. يتم عرض تناسب خطية من البيانات عن طريق الخط، المنحدر من الذي يساوي نسبة C بين TCRالإشغال والعائد الحنق. C غير محددة المستمر لنظام الحنق وfluorophores (هنا CY3 وCy5) المستخدمة. في هذا المثال انها اسفرت عن 1.988. (B) الحنق تم تحديد البيانات العائد لmicroclusters TCR الفردية (N = 187، درجة الحرارة = 24 درجة مئوية) من خلال استرداد المانحين متقبل التبييض. الأرقام أدناه الحانات الرسم البياني تشير إلى الحد الأعلى خلال الفترة (C) تحويل البيانات الواردة في (ب) عن طريق ضرب قياس تأكل الغلة مع ثابت C تحديدها في (A). الأرقام أدناه الحانات تشير إلى الحد الأعلى خلال الفترة (D) الرسم البياني (شبه لوغاريتمي، قاعدة = 4) التي تصور توزيع 2D-K D ق قياس للفرد microclusters TCR. يشار إلى متوسط 2D-K D باللون الأزرق. الأرقام أدناه الحانات تشير إلى الحد الأعلى خلال الفترة. (E) والرسم البياني هو مبين في (D) تم تحويلها الباحثالزراعة العضوية 2D-ك على -histogram (شبه لوغاريتمي، قاعدة = 4) توظيف ك متشابك خارج لمدة 24 ° C (0.41 ث -1). يشار إلى تحديد متوسط 2D-ك على قيمة باللون الأزرق. ونشرت بيانات أصلا في Huppa وآخرون. 2 وتصور هنا في شكل جديد. يرجى النقر هنا لمشاهدة نسخة أكبر من هذا الرقم.

5. التحقق من صحة الرقم الوظيفي للSLBs يعمل لتحفيز خلايا T والتصوير. واجهت (A) TCR المعدلة وراثيا الانفجارات T-الخلية محملة FURA-2 مع تنشيطية SLB إيواء pMHCs المستضدية، ICAM-1 و B-7. سجلت الخلوي FURA-2 الانبعاثات متحمس في 340 نانومتر و 380 نانومتر، وكذلك الصور DIC. كما هو مبين، والقيم نسبة كثافة الانبعاثات متحمس في 34وترد 0 و 380 نانومتر في اللوحة اليمنى. يتميز أدت إضافة PMHC منع الأجسام المضادة 14 دقيقة في المدى التجريبي إلى انخفاض في مستويات الكالسيوم داخل الخلايا مماثلة لتلك التي يستريح خلايا T. (B) لمحة الزمني نموذجية من متوسط نسب FURA-2 في الخلايا التائية الاتصال SLBs المحفزة قبل ارتفاعا الأولي في الكالسيوم داخل الخلايا وهو أعلى 2-4 مرات مقارنة بما كان عليه من غير تنشيط خلايا تي T-أو خلايا المحرومين من المستضد بعد الحصار بوساطة الأضداد. الدوائر الخضراء تشير إلى نقاط الوقت هو موضح في (A). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
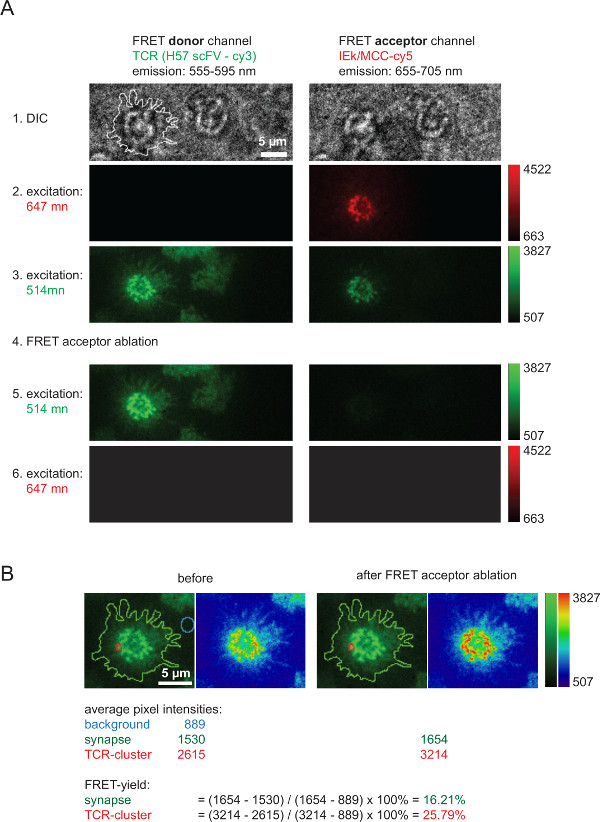
الرقم 6. السائبة تأكل الغلة التي تقاس من خلال الحنق الانتعاش المانحة بعد الحنق متقبل التبييض. (A) يظهر هو مثال نموذجي متشابك الحنق-القياس. كما هو موضح على اليسار وعلى رأسها واكتسب سلسلة من الصور مع استخدام الخائن شعاع الانبعاثات مما أدى إلى المانحة الحنق وقناة الحنق متقبل (للحصول على معلومات أكثر تفصيلا عن شق شعاع الرجوع إلى Axmann آخرون 4). الخط الذي يظهر في الصورة DIC اليسار يشير إلى حدود المشبك T-الخلية. ملاحظة خسارة في كثافة داخل القناة متقبل الحنق هو كذلك الزيادة في كثافة في القناة المانحة الحنق بعد الحنق متقبل تبيض (الخطوة 4). (B) الحنق ويمكن قياس الكفاءة كما هو مبين في مناطق متشابك الفردية أو نقاط الاشتباك العصبي بأكمله. للتفتيش، وتظهر الصور قبل وبعد الحنق متقبل تبييض مع استخدام اثنين من جداول البحث (طرفيات المستعملين المحليين والأخضر والفيزياء). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
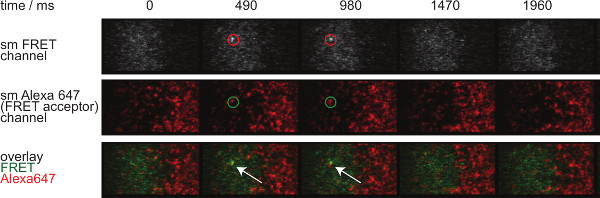
الرقم 7. جزيء واحد الحنق تظهر الأحداث وتختفي الخطوات insingle والمنحازة تماما مع واحد fluorophore متقبل الحنق ويظهر هذا الفاصل الزمني من جزيء واحد الحنق الحدث. تم الحصول على الصور باستخدام كاميرا EMCCD الخلفية مضاءة. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
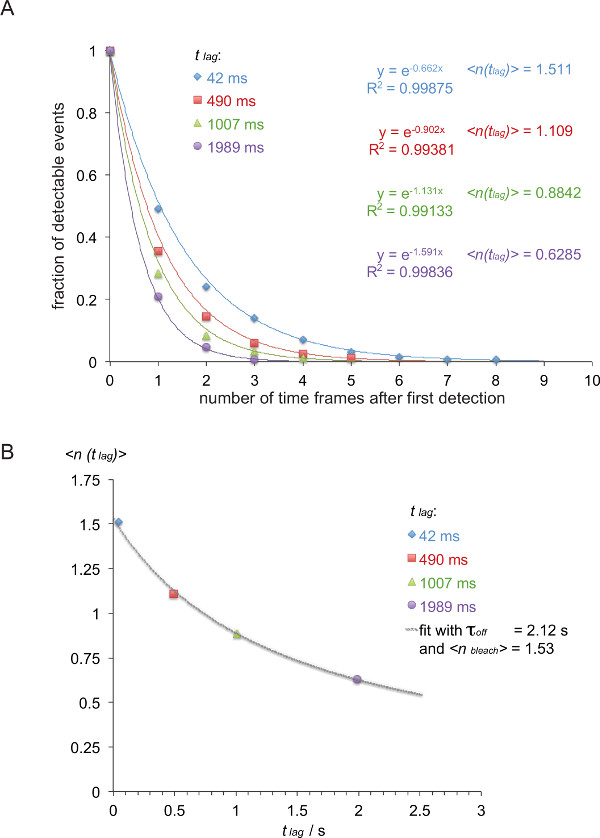
الرقم 8. تحديد τ قبالة = 1 / K الخروج من مسارات smFRET قياسها. (A) المبالغ المتراكمة تطبيع إشارات الحنق يمكن ملاحظتها (مشتقة من H57 SCF V -AF555 زينت 5c.c7 TCR الانفجارات المعدلة وراثيا T-خلية تعترف IE <سوب> ك / K3-AF647 في 24 ° C) لأربع التخلف زمنية مختلفة (42 ميللي ثانية، 490 ميللي ثانية، 1007 ميللي ثانية، 1989 ميللي ثانية) تم التخطيط بوصفها وظيفة من إجمالي عدد الملاحظات. وظائف تناسب أحادية الأسي تثير المقابلة معكوس السلبي للقيم التوقع <ن (ر متخلفة)>. تم التخطيط (B) القيم التوقع ضد التأخير ر تأخر ومزودة باستخدام معادلة <ن (ر متخلفة)> = τ قبالة / {(τ قبالة / <ن تبييض>) + ر تأخر} لانتاج τ قبالة و<ن تبييض>. انقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
قياس البروتين البروتين التفاعلات في الموقع المرغوب فيه جدا وخاصة عند التعامل مع التفاعلات تقارب منخفضة مثل TCR-PMHC ملزمة 11. وذلك لأن سعر الفائدة على وكذلك استقرار هذه التفاعلات تتأثر بشكل كبير بسبب الظروف الخاصة التي ملزم تأخذ مكان. النهج التصوير الحد الأدنى الغازية القائم على الحنق وبالتالي من حيث المبدأ مناسبة تماما لمثل هذه المهام، ولكن تنطوي على عدد من العقبات التي لا بد أولا من التغلب عليها. الضوضاء الناتجة عن تألق ذاتي الخلوية يحد من حساسية القياسات وبالتالي يجب أن تبقى في الحد الأدنى. يخدم TIRF المجهري هذه الحاجة بشكل جيد جدا 12 ولكن يتطلب functionalization الزجاج الشرائح، من الناحية المثالية في شكل مستو المدعومة من الزجاج الدهون طبقة ثنائية مزينة البروتينات من اختيار 13-15. ميزة أخرى لنهج reconstitutive جزئيا هو أن المؤتلف شركاء الحنق-طبقة ثنائية المقيمة يمكن أن يكون أكثر من مترركاز المسمى بسهولة في، الموقع محددة بطريقة كمية وعقلانية مع fluorophores أصغر حجما وأكثر إشراقا مما هو ممكن مع خلية البروتينات أعرب السطح. يتم تمييزها TCRs مع المؤتلف SCF V، والتي لا تؤثر الاعتراف T-الخلية، كما تم اختباره سابقا 2. وعلاوة على ذلك، وتكوين البروتين من SLB، على سبيل المثال كثافة pMHCs واختيار عوامل التبعية يمكن تعديلها لاحتياجات الفرد المحددة. لقد قمنا في السابق تجارب مع كثافة pMHCs المحفزة متفاوتة، ولكن لم يتم الكشف عن اختلافات كبيرة في 2D-K قبالة و2D-K D 2.
حتى الآن هنا تم التعامل الاعتراف MHC الدرجة الثانية الجزيئات فقط، وذلك أساسا بسبب طبيعة المشقوق من الببتيد ملزم، وهو مفتوح في كلا طرفي وبالتالي يستوعب الببتيدات أكبر بما في ذلك رابط لمرفق fluorophore. في بعض الحالات يمكن أن يعمل هذا النهج أيضا لوضع العلامات MHC CLASS I الجزيئات 16 ولكن ينبغي أن تؤخذ بحذر شديد للتحقق من استخدامها في التجارب. لا ينبغي أن يؤثر على حساسية الخلايا التائية نحو مستضدات، والتي يمكن قياسها عن طريق فحوصات انتشار خلايا T، فضلا عن PMHC-TCR حركية ملزمة كما تم قياسها في المختبر عن طريق مأكل سطح الرنين من خلال إضافة رابط وfluorophore ل الببتيد. بدلا من ذلك، والطبقة MHC I الجزيئات نفسها يمكن أن توصف بطريقة خاصة بالموقع مع إدخال السيستين المفردة ضمن تسلسل السلسلة الثقيلة (الملاحظات غير منشورة).
مع استخدام المجسات الجزيئية المناسبة أي متشابك تفاعل البروتين البروتين يمكن من حيث المبدأ أن تدرس بطريقة الموصوفة هنا. مثل هذه التحقيقات، على سبيل المثال، يجب أن يكون SCF V الصورة أو تصميم Ankyrin كرر البروتينات (DARPins) 17، الأحادي، وينبغي ربط هدفهم مستقر دون التأثير على التفاعل في المصالح. وبطبيعة الحال، و المعلومات الهيكليةn غير مرغوب فيه للغاية لتصميم التحقيق العقلاني ولكن لا حاجة على الاطلاق. عند وضع زوج جديد من الشركاء الحنق، فمن المستحسن لتسجيل وتحليل الحنق بكميات كبيرة لأول مرة. مواقع الحجز التسمية قد تختلف إلى حد كبير لتعظيم إشارة الحنق وأيضا للتحقق من أن تقاس الحنق عوائد تختلف بناء على المسافة بين الصبغة. مرة واحدة هو الأمثل النظام، جزيء واحد الحنق قد يتم تسجيل الإشارات عن طريق الحد من وسم الشريك الحنق وفرة عالية ل10-30٪ وتبيض الشريك الحنق وفرة منخفضة حتى الجزيئات المفردة للحل في مجال الإضاءة.
أخيرا وتجدر الإشارة ليس أقلها أن SLBs تقريب بعض وليس كل جوانب غشاء البلازما الفسيولوجية. الصفات مثل انحناء الغشاء والمرونة، وتجزئة المجال إعادة ترتيب هيكل الخلية والحركة المحمولة، فضلا عن مجموعة متنوعة عالية من البروتينات وأعرب سطح الغشاء لا يمثله SLBs ولكن قد تؤثر رانه عملية قيد التحقيق. ستحتاج بذل الكثير من الجهد لاستثمارها لإقامة طرائق التصوير التي تسمح برصد تفاعلات البروتين البروتين لقرار جزيء واحد في نقاط الاشتباك العصبي الفسيولوجية، والتي لا يمكن الوصول إليها لتصوير TIRF.
Disclosures
The authors declare that they have no competing financial interest.
Acknowledgements
وأيد MA كتبها زمالة شرودنغر للصندوق النمساوية العلوم (FWF، J3086-B11)، وذلك بفضل ماكس-بلانك جمعية الدعم المالي والإداري. ودعمت GS وJH من صندوق العلوم والتكنولوجيا فيينا (WWTF، LS13-030).
Materials
| Name | Company | Catalog Number | Comments |
| LB-media | Fisher Scientific | 10000713 | bacterial expression |
| Sf900 II | Life Technologies | 10227402 | insect cell media for baculo virus production |
| Insect-XPRESS with L-glutamine (Lonza) | Fisher Scientific | 10564038 | insect cell media for baculo virus expression |
| Sf9 cells | Life Technologies | 11496-015 | cells for virus production and expansion |
| High Five Cells | Life Technologies | B855-02 | cells for potein expression |
| LB-media | Fisher Scientific | 10000713 | bacterial expression |
| Centramate System | Pall | protein concentartion from large volumes | |
| Centramate cassette 10kDa cutoff | Pall | OS010T12 | protein concentartion from large volumes |
| Amicon Ultra-15 Centrifugal Filter Units | EMD Millipore | UFC900308 | protein concentartion |
| Amicon Ultra-4 Centrifugal Filter Units | EMD Millipore | UFC800308 | protein concentartion |
| Amicon Stirred Ultrafiltration Cell Model 200 mL | EMD Millipore | 5123 | protein concentartion |
| Äkta pure 25L | GE Healthcare | 29-0182-24 | protein purification |
| Superdex 200 10/300 GL | GE Healthcare | 17-5175-01 | protein purification |
| Superdex 75 10/300 GL | GE Healthcare | 17-5174-01 | protein purification |
| Mono Q 5/50GL | GE Healthcare | 17-5166-01 | protein purification |
| Ni Sepharose 6 Fast Flow | GE Healthcare | 17-5318-01 | protein purification |
| Tricorn 10/20 column | GE Healthcare | 28-4064-13 | protein purification |
| Gilson HPLC system | Gilson | purificationof fluorochrome-coupled peptides | |
| Pursuit XRs C18, 5 µm particle size, 21.2*250mm column size | Agilent | A6000250X212 | purificationof fluorochrome-coupled peptides |
| Pursuit XRs C18, 5 µm particle size, 21.2*50 mm column size | Agilent | A6000050G212 | purificationof fluorochrome-coupled peptides |
| Tricorn 10/20 column | GE Healthcare | 28-4064-13 | protein purification |
| Gilson HPLC system | Gilson | purificationof fluorochrome-coupled peptides | |
| Pursuit XRs C18, 5 µm particle size, 21.2*250mm column size | Agilent | A6000250X212 | purificationof fluorochrome-coupled peptides |
| Pursuit XRs C18, 5 µm particle size, 21.2*50 mm column size | Agilent | A6000050G212 | purificationof fluorochrome-coupled peptides |
| Cy3 maleimide | GE Healthcare | PA23031 | site-specific protein labeling via mutant unpaired cysteines |
| Cy5 maleimide | GE Healthcare | PA25031 | site-specific protein labeling via mutant unpaired cysteines |
| Alexa Fluor 555 C2 Maleimide | Life Technologies | A-20346 | site-specific protein labeling via mutant unpaired cysteines |
| Alexa Fluor 647 C2 Maleimide | Life Technologies | A-20347 | site-specific protein labeling via mutant unpaired cysteines |
| Fura-2, AM, cell permeant | Life Technologies | F-1221 | calcium-sensitive dye for cell labeling |
| dimethyl sulfoxide | Sigma Aldrich | 151874 | for dissolving fura-2 am |
| Hank's Balanced Salt Solution plus calcium/magnesium | Fisher Scientific | 10225362 | imaging buffer |
| PBS | Life Technologies | 14190-136 | |
| Bovine Serum Albumin lyophilized powder | Sigma Aldrich | A2153 | supplement for imaging buffer |
| 14-4-4S antibody | affimetrix eBioscience | 14-5980-81 | blocking antibody for H2-I-Ek (recognized by the 5c.c7, 2B4 and AND TCR) |
| 5 ml polypropylene round-bottom tube | Becton Dickinson | FALCON 352063 | |
| 0.22 μm Ultrafree-MC centrifugal filter unit | EMD Millipore | UFC30GV0S | |
| Syringe filter 0.2µm | Millipore | GVWP04700 | |
| TetraSpeck Microspheres, 0.1 µm, fluorescent blue/green/orange/dark red | Life technologies | T-7279 | |
| Microscope for fura-2-based calcium measurements | LEICA | DMI4000B | |
| Microscope for (single molecule) FRET measurements | LEICA/ZEISS/NIKON/OLYMPUS | for details please refer to parallel JoVE contribution by Axmann et al. | |
| planar supported lipid bilayers | for details please refer to parallel JoVE contribution by Axmann et al. | ||
| RPMI 1640, with L-Glutamine | Life Technologies | 11554416 | T-cell media |
| non-essential amino acid 100X | Hyclone | SH30238.01 | T-cell media supplement |
| penicillin/streptomycin/L-glutamine 100x | Life Technologies | 12000226 | T-cell media supplement |
| 2-mercaptoethanol | Sigma Aldrich | M6250 | T-cell media supplement |
| mouse interleukin-2 recombinant protein | BPS Bioscience | 90185-B | T-cell media supplement |
| Research Grade Fetal Bovine Serum | Hyclone | SV30160.03 | T-cell media supplement |
| Origin (analysis program) | OrigenLab | http://www.originlab.com/ | non-linear fitting of two parameters (tauoff, [ntlag]) |
References
- Garcia, K. C., Adams, J. J., Feng, D., Ely, L. K. The molecular basis of TCR germline bias for MHC is surprisingly simple. Nat Immunol.. 10, 143-147 (2009).
- Huppa, J. B., et al. TCR-peptide-MHC interactions in situ show accelerated kinetics and increased affinity. Nature.. 463, 963-967 (2010).
- Huppa, J. B., Davis, M. M. The interdisciplinary science of T-cell recognition. Advances in immunology.. 119, 1-50 (2013).
- Axmann, M., Schuetz, G. J., Huppa, J. B. Single Molecule Microscopy on Planar Supported Bilayers. Journal of Vizualized Experiments J. Vis. Exp.. 101, e53158(2015).
- Xie, J., et al. Photocrosslinkable pMHC monomers stain T cells specifically and cause ligand-bound TCRs to be preferentially transported to the cSMAC. Nat Immunol. 13, 674-680 (2012).
- Jares-Erijman, E. A., Jovin, T. M. FRET imaging. Nat Biotechnol. 21, 1387-1395 (2003).
- Toebes, M., et al. Design and use of conditional MHC class I ligands. Nat Med. 12, 246-251 (2006).
- Tsumoto, K., et al. Highly efficient recovery of functional single-chain Fv fragments from inclusion bodies overexpressed in Escherichia coli by controlled introduction of oxidizing reagent--application to a human single-chain Fv fragment. J Immunol Methods. 219, 119-129 (1998).
- Ruegg, U. T., Rudinger, J. Reductive cleavage of cystine disulfides with tributylphosphine. Methods Enzymol. 47, 111-116 (1977).
- Ruprecht, V., Brameshuber, M., Schütz, G. J. Two-color single molecule tracking combined with photobleaching for the detection of rare molecular interactions in fluid biomembranes. Soft Matter. 6, 568-581 (2010).
- Dustin, M. L., Bromley, S. K., Davis, M. M., Zhu, C. Identification of self through two-dimensional chemistry and synapses. Annu Rev Cell Dev Biol. 17, 133-157 (2001).
- Axelrod, D. Cell-substrate contacts illuminated by total internal reflection fluorescence. The Journal of cell biology. 89, 141-145 (1981).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285, 221-227 (1999).
- Kaizuka, Y., Douglass, A. D., Varma, R., Dustin, M. L., Vale, R. D. Mechanisms for segregating T cell receptor and adhesion molecules during immunological synapse formation in Jurkat T cells. Proc Natl Acad Sci USA. 104, 20296-20301 (2007).
- Varma, R., Campi, G., Yokosuka, T., Saito, T., Dustin, M. L. T cell receptor-proximal signals are sustained in peripheral microclusters and terminated in the central supramolecular activation cluster. Immunity. 25, 117-127 (2006).
- Purbhoo, M. A., Irvine, D. J., Huppa, J. B., Davis, M. M. T cell killing does not require the formation of a stable mature immunological synapse. Nat Immunol. 5, 524-530 (2004).
- Binz, H. K., Stumpp, M. T., Forrer, P., Amstutz, P., Pluckthun, A. Designing repeat proteins: well-expressed, soluble and stable proteins from combinatorial libraries of consensus ankyrin repeat proteins. J Mol Biol. 332, 489-503 (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved