Method Article
Измерение ТКР ПКИКЖ Связывание
В этой статье
Резюме
This manuscript describes how to conduct (single molecule) Förster Resonance Energy Transfer (FRET)- based assays to measure the binding dynamics between T-cell antigen receptor (TCR) and antigenic peptide-loaded MHC molecules as they occur within the immunological synapse of a T-cell in contact with a functionalized planar supported lipid bilayer.
Аннотация
T-cells are remarkably specific and effective when recognizing antigens in the form of peptides embedded in MHC molecules (pMHC) on the surface of Antigen Presenting Cells (APCs). This is despite T-cell antigen receptors (TCRs) exerting usually a moderate affinity (µM range) to antigen when binding is measured in vitro1. In view of the molecular and cellular parameters contributing to T-cell antigen sensitivity, a microscopy-based methodology has been developed as a means to monitor TCR-pMHC binding in situ, as it occurs within the synapse of a live T-cell and an artificial and functionalized glass-supported planar lipid bilayer (SLB), which mimics the cell membrane of an Antigen presenting Cell (APC) 2. Measurements are based on Förster Resonance Energy Transfer (FRET) between a blue- and red-shifted fluorescent dye attached to the TCR and the pMHC. Because the efficiency of FRET is inversely proportional to the sixth power of the inter-dye distance, one can employ FRET signals to visualize synaptic TCR-pMHC binding. The sensitive of the microscopy approach supports detection of single molecule FRET events. This allows to determine the affinity and off-rate of synaptic TCR-pMHC interactions and in turn to interpolate the on-rate of binding. Analogous assays could be applied to measure other receptor-ligand interactions in their native environment.
Введение
Более глубокое понимание того, как Т-клетки распознают антигены требует рассмотрения в нужном месте, то есть, в иммунологической синапса, образованном между Т-клетки и АПК. Здесь молекулярные обязательные кинетики определяется не только присущими биохимических свойств партнеров взаимодействия участвующих, но зависит в значительной степени от сотовых параметров, которые включают в себя клеточные силы, мембранный архитектуры и латеральных взаимодействий между мембранными белками, а также синапсов конкретных геометрических ограничений 3. Биохимические подходы ограничены в разрешающей способности, поскольку они требуют срыва по меньшей мере одного из синаптических мембран, участвующих. По этой причине методика визуализации FRET основе был разработан, чтобы следить за связывание TCR с антигенными pMHCs 2. Здесь Т-клетки украшены рекомбинантного и сайт-специфически помечены TCR & beta;-реактивного единая цепь фрагмент антитела (SCF V) и столкнулся с планом соток стеклянные поддержке липидных двойных слоев (SLBS), которые несут молекулы МНС класса II, загруженные с флуоресцентно-меченного пептида, антигенного костимулирующих молекулы адгезии и белки. Synaptic связывания красителя помечены TCR и красить меченных результатов ПКИКЖ в ладу, которые могут контролироваться на уровне оптом и одной молекулы полного внутреннего отражения флуоресценции (TIRF) микроскопии.
В данной статье подробно описано, как использовать SLBS дл анализа Т-клеточных синапсов, проверки их целостности через функциональную Т-клеток кальцием поток анализа, проведение FRET измерения в объеме и с чувствительностью единичных молекул, и анализировать полученные данные. Рекомендации предлагается производить правильно соотнесены белки, необходимые для двухслойной функционализации. Для получения более подробной информации о формировании двухслойной и настройки подходящего TIRF микроскоп пожалуйста, обратитесь к дополнительному общественного доступа Юпитер публикации, опубликованной в увязке 4.
палатка "> Природа SLBSМодифицируемыми SLBS может быть легко генерируется из однослойных везикул (SUV), содержащий два липидов 1-пальмитоил-2-олеоил-Sn-gylcero-3-фосфохолин (короткий: POPC, 90-99%) и 1,2-dioleoyl- SN - глицеро-3 - {[Н (5-амино-1-карбоксипентил) иминодиуксусной кислоты] сукцинил} (короткий: АРД НТА-Ni, 1-10%). Внедорожники распространяются на чистых стеклах, чтобы сформировать непрерывную плоскую бислой 4. DGS-NTA-Ni служит для закрепления полигистидином тегами белки с помощью полигистидинового-опосредованной комплексообразования с синтетическим НТА-Ni-содержащей глава группы (рис 1А). Для стабильной ассоциации одного, как правило, заменяет родной трансмембранный домен и цитоплазматический хвост адгезии белка ICAM-1 и костимулирующей молекулы В7-1 с одной меткой, содержащей двенадцать гистидинов (ICAM-1-12H, В7-1) -12Н (Фигура 1В) , Пептид-класс загружен молекула II Е. К содержит два мембраной встроены (α β и) полипептидную цепьс. Трансмембранные / цитоплазматические домены обеих цепей должны быть заменены с меткой, содержащей шесть гистидинов друг (IE K α β 6H 6H или IE к -2x6H). В качестве альтернативы, проходящей альфа-цепь с двенадцатью гистидинов и оставляя внеклеточный домен бета-цепи без тегов (давая начало IE к альфа 12H бета 0H или IE K -12Н) приводит к удовлетворительным результатам (рис 1B).
Сайт-специфическая маркировка pMHCs
Важно маркировать рМНС стехиометрически и сайт-специфически, чтобы иметь возможность конвертировать измеренные FRET урожайности в значимые равновесных констант связывания. Это может быть достигнуто путем химического маркировки синтетического пептида, который загружен в пептидной связывания щели рекомбинантного гистидин-меченый молекулами МНС класса II 2,5. Пептид включает в себя все остатки Т-клеточного эпитопа, как WELL как короткий С-концевой линкер (GGS) с последующим цистеина (например, в моли цитохром с (MCC), пептидов ANERADLIAYLKQATK- GGSC, линкер выделены жирным шрифтом). Это цистеин используется для обозначения пептида стехиометрически с использованием производных малеимид-краситель. На данный момент дополнительный уход должен быть посвящен проверке количественную краситель-связь в цистеин-содержащих пептидов. ВЭЖХ-очистки аддукта пептид-краситель рекомендуется и должен быть затем ионизация электрораспылением масс-спектроскопии. Любые записанные массы, соответствующие пептидной эдукта (без красителя) отражают неполную маркировку. Если это так, то ВЭЖХ-очищенный пептид должен быть подвергнут последовательных раундах красителя маркировки до маркировка не считаются количественными. Следует отметить, что MALDI-TOF масс-спектроскопии, следует избегать, так как это метод включает лазерное излучение для ионизации образца. Это лечение распадается прикрепленные чувствительные флуорофоры, прежде чем пептид масса считывается и, таким образом, underrepre сентов градусов красителя сопряжения.
Косвенное же сайт-специфического маркировка клеточных связанного TCR, с использованием одновалентного одноцепочечных фрагментов F V
Он по-прежнему бросает вызов, чтобы прикрепить красители для клеточной поверхности белки, связанные живых клеток в сайт-специфическим образом. Для преодолеть это препятствие для поверхностно-подвергается ТКО, версия одновалентной единая цепь (SCF V) от генов TCR & beta; -reactive моноклональных антител H57-197 2 был построен. Кристаллическая структура этого антитела в комплексе с TCR позволяет рационально сконструировать версию, в которой остаток серина в непосредственной близости к С-концу МНС связанного пептида (где соответствующий FRET партнер краситель прилагается) подменяется остаток цистеина. Этот мутант цистеин затем служит в качестве акцептора для красителя сопряжения (рис 2).
Методологии для записи FRET
нт "> Массовые значения FRET лучше всего подходят для проверки соотношения между расстояниями выбранных среди красителях и FRET эффективность, измеренные в этом TCR-рМНС системы 2 связывания. Кроме того, измерения сыпучих FRET выявить количественные и качественные различия в синаптических сродства ТКР ПКИКЖ ( см ниже и раздел протокола 3.2). Различные подходы к количественной FRET эффективности были введены в литературе 6. В этой статье FRET записывается с помощью(а) восстановление после доноров акцепторной отбеливания, и через
(б) сенсибилизированные FRET акцепторный излучение.
Первый способ (а) требует использование FRET акцептором, что может быть легко photobleached и донора, что является довольно фотостабилен. Кроме того, важно, чтобы убедиться, что photobleached акцептор больше не способен закалки флуоресценции донора. Как же канал обнаружения (донор) используется для количественного коррекция не факторизуютD Нет хроматические аберрации не должны рассматриваться, что делает эту методологию простой и надежный. Тем не менее, количественные измерения не могут быть повторены на том же месте образца и изменения в FRET не могут быть записаны в течение долгого времени. Чтобы избежать последствий, вызванных молекулярной диффузии или подвижности сотовой быстро шаг отбеливания должна быть направлена на, что сводит к минимуму время, которое проходит между первым FRET донора (до акцепторного отбеливания) и приобретения второго изображения FRET доноров (после FRET акцепторной отбеливания). Это рекомендуется использовать мощный источник лазерного излучения лада акцептора возбуждения волны для того, чтобы освещенность и отбеливающие раз.
В противоположность этому, в подходе сенсибилизированной измерения выбросов FRET (б) донор FRET возбуждается и испускание FRET акцептором наблюдается в ладу акцепторной канала. Изменения в FRET акцептора сигнала может быть записана в течение долгого времени, но эмиссии донора FRET в красное смещение канала акцептора (тermed bleedthrough) и FRET акцепторный кросс-возбуждение с помощью возбуждения доноров должны быть точно определены и вычитается из записанного FRET акцепторной канала. Для этого соответствующие FRET донора и акцептора ладу изображения должны быть пространственно совмещены.
Обнаружение одной молекулы (см) FRET события
При использовании лазеров в качестве источника возбуждения, чувствительной камеры и шума ослабляется TIRF микроскопии флуоресценции одиночных флуорофоров можно легко проследить с течением времени. Похожие верно для обнаружения межмолекулярных событий smFRET. Тем не менее, осложнения могут быть вызваны FRET доноров bleedthrough и поперечным возбуждением FRET акцептором, и, таким образом большое внимание должно быть принято при регулировке плотности флуорофора в эксперименте smFRET.
В протоколе приводится ниже (раздел 4) протокол ТКС был выбран в качестве FRET донора в высокой численности и рМНС как FRET акцептором в низкой численности. Для ослабления FRET донор bleedthrough достаточно, украсить 10-30% от ТКР с люминесцентным SCF V и 90-70% от ТКР с нефлуоресцентного SCF V. Здесь акцептор FRET канала было выбрано в качестве канала единичных молекул, поскольку это конфокальной с одной молекулой FRET канал. Это помогает выровнять события smFRET с одной молекулы FRET акцепторов, которая является основой проверки smFRET.
Извлечение синаптические отходящих цены путем измерения smFRET
Фотообесцвечивание обоих FRET донора и акцептора FRET должны быть учтены при извлечении полураспада взаимодействия с одной молекулы FRET следы. На начало их появления в одной паре донор-акцепторного N число наблюдаемых лобзики сигналов (0) уменьшается в течение долгого времени и развязывание рецептор-лиганд и фотообесцвечивания. Число выживших комплексы в данный момент времени N (T) может быть математически выражена следующим образом:

В перспективе фотообесцвечивание ехр (-t / τ) отбеливателя время т описывается произведением числа наблюдений п и освещения времени Т жестокого из-за непостоянной, дискретном режиме наблюдения (т.е. отбеливания происходит только во время освещения ). В кинетической срок exp- (т / τ от) время т является произведением числа наблюдений п и время задержки т для одного наблюдения FRET (т.е., кинетическая развязывание происходит непрерывно). Уравнение 1 может быть выражена как:
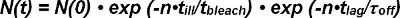
Термин τ отбеливатель / τ плохо дешенных толстых число наблюдений пока не происходит отбеливание и определяется как среднее значение <п отбелить> его экспоненциальной функции. Уравнение 2 может быть упрощена следующим образом:

Среднее значение <п (т отставание)> числа кадров N (T) с наблюдаемыми лобзики событий после времени Т определяется непосредственно из эксперимента. Это зависит от устанавливаемого времени между наблюдениями (т отставание), выбранных в эксперименте и неизвестных значений т выкл (обратной офф-скорости K ВЫКЛ) и <п отбелить>, среднее значение количества наблюдений, прежде чем происходит отбеливание ,
Таким образом, расчет среднего значения <п (т)> лаг, по крайней мере двух значений т задержка позволяет экспериментально определить <п отбелить> и Т от.
Извлечение синаптические значения 2D-К D путем измерения FRET основе
Измерение TCR заполняемость а, т соотношение между связанными ТКО и общего ТКО, занимает центральное место в определении значения синаптических 2D-К D. В соответствии с уравнением 4 этот термин прямо пропорциональна измеренной FRET выход тех пор, как ТКО служит FRET доноров и акцепторов, как pMHCs ладу.

с размещение = TCR, С = коэффициент преобразования
С является константой, зависит от системы рвать и флуорофоры используется. Это может быть определено экспериментально, как показано ниже. а может быть преобразован в 2D-K D в соответствии с уравнением 5, когданачальная плотность TCR лиганды перед добавлением Т-клеток в бислой известно. Это происходит из-за высокой подвижности SLB-прикрепленных белков, а также потому, что SLBS обеспечить почти неисчерпаемого резервуара лигандов 2.

с [рМНС первоначального] = начальная плотность рМНС перед добавлением Т-клеток
С уравнений 4 и 5 теперь можно легко определить синаптической 2D-K D между TCR и рМНС. Это наиболее надежно сделано с измерениями FRET основе восстановления доноров после акцепторного отбеливания (см раздел протокола 3.1).
Тем не менее, для измерения C взаимосвязь между интенсивностью FRET я ладу (с поправкой на фоне, лада донор bleedthrough и FRET акцептором кросс-возбуждения) и ТКС размещение должен быть определен. Для этого, одиннужно знать отношение R между средней интенсивности флуоресценции одиночных ТКР, связанных FRET доноров флуорофорами (например Cy3 или AF555) см я FRET донора и средняя интенсивность одной молекулы FRET события см я ладу. R зависит от системы FRET идет речь, фильтры выбросов и камерой, используемой для регистрации флуоресценции.
ТКР размещение а, то может быть непосредственно определена в соответствии с уравнением 6.

с R = см я FRET доноров / см я ладу
R была определена как 1,45 для системы H57 scFv- Су3 / ПКИКЖ-Cy5 приводит к:
а = основная Я FRET / объемную я TCR-Су3 • 1,45
Взаимосвязь между размещение TCR а и выход FRET может быть определена путем FRET донора восстановитьг, после акцепторного отбеливания. Для этого оба параметра в заговоре против друг друга в течение ряда TCR микрокластеров, как показано на рисунке 4A .В наклона линейной подгонки указывает коэффициент преобразования C (из уравнения 4).
Как показано на фиг.4А, С составляет для (а) H57 SCF V - Cy3 / рМНС-Су5 системы FRET и (б) от приложенного конфигурации системы микроскопа 1,995. ТКР размещение а может быть легко вывести следующим образом:
Размещение ТКС а = FRET выход • 1,995
протокол
1. Белок Производство
1.1. Двухслойные резидентом белки: В7-1, ICAM-1, ПКИКЖ (например, IE K / пептид)
- В7-1 -12Н, ICAM-1-12H
- Экспресс B7-1-12H и ICAM-1-12H конструкции в больших количествах, как, выделяемых нативных белков с использованием системы экспрессии бакуловируса.
- Очищают белки из надосадочной жидкости культуры через Ni-NTA аффинной хроматографии с последующей MonoQ анионообменной хроматографии и S200 гель-проникающей хроматографии.
- Этикетка одну аликвоту очищенного белка с аминными активных красителей, таких как NHS сукцинимидил-эфир препаратов Alexa Fluor 488 (или FITC), Alexa Fluor 555 (или Cy3), Alexa Fluor 647 (или Cy5).
- После S200 гель-хроматографии определить степень маркировки мономерных белков в соответствии с указаниями изготовителя красителя путем сравнения поглощения белка при 280 нм и поглощение красителя при 488 нм (Alexa Fluor 488, FITC), 555 или 552 нм(Alexa Fluor 555 или Су3) или 647 нм (Alexa Fluor 647 или Су5).
Примечание: Этот коэффициент будет позже необходимо определить плотность белка на SLB от объемного сигнала флуоресценции белка красителя, меченного. - Хранить немеченого и флуорофором меченых белков при -20 ° С в PBS плюс 50% глицерина.
- ПКИКЖ (здесь: IE к -2x6H или IE к -12Н)
- Рефолдинга МНС класса II с телец включения, выраженные в E.coli в присутствии значительно более низкой УФ-расщепляться пептида замены, которые впоследствии могут быть количественно обмену с флуорофора-сопряженных пептида выбора 5, 7.
- Очищают отогнутый рМНС комплексы с помощью стандартных методик (Ni-NTA-аффинной хроматографии, MonoQ анионообменной хроматографии, гель-фильтрации S200).
- Заменить УФ расщепляемую пептид флуоресцентной пептида 5, 7.
- Очищают мономерный флуоресцентный ПКИКЖ комплексы Fаконец гель-фильтрацией S200. Представитель хроматограмма показана на рисунке 3.
- Убедитесь, количественный пептид загрузку с помощью спектрофотометрии.
- Магазин белки при -20 ° С в PBS / 50% глицерин.
1.2. Генерация одноцепочечных фрагментов антител (SCF В с), введение цистеина для сайт-специфического мечения
- Рефолдинга SCF В с от телец включений, выраженные в E.coli. Вот это протокол разработанный Tsumoto и коллегами 8 следует, в котором тела включения сначала развернулась в 6 М гуанидин-хлорида, полностью уменьшен и затем повторной укладке в течение недели, постепенно уменьшая концентрацию белка-разворачивания гуанидинийхлорида.
- Концентрат правильно сложенный SCF V с помощью единиц молекулярных фильтров с молекулярной отсечки 10 кД.
- Очищают концентрата гель-фильтрации S200.
- Добавьте мономерного SCF V в присутствии 0,05 мм трис (2-карбоксиэтил) фосфин (ТСЕР) с Alexa Fluor 647 сразу же после очистки. Проведение реакции маркировки лучше при молярном соотношении протеина: краситель не более чем 1: 2 при комнатной температуре в течение не более 2 часов.
Примечание: ТСЕР является фосфором основе восстановитель и не реагирует с малеимидами при этих концентрациях 9. Это может, следовательно, присутствовать при маркировке реакции, чтобы сохранить непарный сульфгидрильной группы уменьшается до тех пор, пока реагирует с производным красителя-малеимид. - Очищают помечены мономерный SCF В конце концов с помощью гель-фильтрации S75. Представитель хроматограмма показана на рисунке 3.
- Определить краситель: белков отношение спектрофотометрически.
- Магазин белки при -20 ° С в PBS / 50% глицерин.
2. Кальций измерения потоков
- Возьмите свежий флакон, содержащий 50 мкг Фура-2-АМ и растворить его в 50 мкл воды без ДМСО.
- Спин вниз 10 6 Т-клеток в 5-мл полипропиленовую круглым дном трубки в течение 2 мин при 250-400 г.
- Ресуспендируют Т-клетки в 200 мкл изображения среды, содержащие сбалансированный раствор Хэнка соли плюс кальций / магний и 1% овальбумина при комнатной температуре добавляют 1 мкл фура-2-AM маточного раствора (1: 200 разведение), смешать клеточной суспензии и инкубируют при комнатной температуре в течение 30 мин.
- Вымойте Т-клетки один раз в буфере изображения. Для этого, заполнить трубку, содержащую клетки с буфером изображения при комнатной температуре и осаждения клеток, как описано в шаге 2. Удалить супернатант и ресуспендируют осадок клеток в 200 мкл буфера изображений (т.е., в конечной плотности клеток 5 × 10 6 клетки мл -1). Клетки могут быть использованы непосредственно для измерения кальция или хранили на льду до 3 ч.
- Место клетки на функционализированной SLB в буфере изображений (37 ° C). Как только Т-клетки начинают связавшись с SLB, приобрести следующий набор изображений каждый от 15 до 30 сек в течение 30 мин:
excitatионов на 340 +/- 5 нм, обнаружение выбросов при 510 нм +/- 40
возбуждение при 380 +/- 5 нм, обнаружение выбросов при 510 нм +/- 40
ДВС (по желанию)
Примечание: Соответствующие время экспозиции зависит от интенсивности источника света возбуждения. Удовлетворительные результаты получены при интенсивности пикселов 340 нм (380 нм) количество каналов в около четверти (одной половины) максимально возможного значения интенсивности. Имейте в виду, что фура-2 значения, возбуждаемые при 340 нм будет увеличиваться, и тех, кто взволнован 380 нм будет уменьшаться при активации Т-клеток. - 20-25 мин в перспективе, добавить 50-100 мкл предварительно нагревают анти-ПКИКЖ блокирующего антитела в конечной концентрации 20-50 мкг в мл -1. Антитело насыщает все pMHCs и, как следствие Т-клетки перестанут распознают антиген и остановить флюса кальций. Продолжить запись изображений на другой. 5 - приобрести базовую внутриклеточной концентрации кальция, что соответствует неактивированной состоянии Т-клеток 10 мин < / LI>
- Определить средний сигнал фоновой флуоресценции при 340 нм и 380 нм возбуждения внутри области, представляющей интерес, по крайней мере 1000 пикселей, который не содержит ячейку. Фон-вычесть все измеренные Фура-2 изображения, возбуждаемые при 340 нм и 380 нм и 340 нм расчета / 380 нм соотношение интенсивностей отдельных клеток или группы клеток. Нормализация отношения интенсивностей путем деления все соотношения через отношение пяти в прошлом сроки (т.е. с полной антитело-блокады рМНС).
- Участок нормализуется Фура-2 отношения со временем. Примечание: Если элементы и бислои находятся в хорошем состоянии, отношение интенсивностей нм Фура-2 340 нм / 380 принять, как правило, значения между 2 и 5, 15-45 секунд после клетки в контакт с бислоя. Коэффициенты затем снизится до значения между 1,6 и 2, где они остаются постоянными в течение по крайней мере 20 мин или дольше. Значения должны упасть до 1 только после добавления анти-рМНС антител. Типичный пример показан на рисунке 5.
3.1. ТКС украшения с H57scF V
- Спин вниз 10 6 Т-клеток в 5-мл полипропиленовую круглым дном трубки в течение 2 мин при 250-400 г.
- Декантировать СМИ, выкидной осадок клеток осторожно и добавить 0,3 мкл SCF V (концентрация ~ 1 мг / мл) к суспензии клеток. Для основной массы FRET измерения используют только краситель меченных ScFv. Для одной молекулы FRET измерения используют смесь немеченого ScFv (от 5 до 9 части, не содержит неспаренный цистеин) и краситель меченных ScFv (1 часть, содержит один непарный цистеин красителя в сочетании).
- Инкубируйте клетки на льду в течение 15 мин и промыть клетки дважды путем последовательного центрифугирования с использованием охлажденного льдом буфера изображений.
Примечание: Клетки можно хранить на льду без значительной потери связанного SCF V (T 1/2 SCF V диссоциации при 0 ° С ~ 4 ч 2). Чистота первичных Т-клетках, полученных из трансгенной TCR-(и, возможно, также Rag-1/2 дефицитных мышей) и стимулировали в пробирке выше 98%, так как Т-клетки являются единственными клетками, пролиферирующие (до 7 делений) в ответ на пептид, который был добавлен для стимуляции к Т-клеточной культуре. B-клетки не подвергаются апоптозу и больше нет в живых после 7-10 дней культивирования. Несколько дендритные клетки выживают, но может быть легко дискриминации не только из-за их отличной морфологии, но и потому, что они не связывают H57 анти-TCR бета ScFv фрагмента.
3.2. FRET измерения с помощью восстановления доноров после отбеливания акцепторной
Примечание: Учтите, что период полураспада TCR-H57 SCF V комплексов составляет 4 ч на льду, до 50 мин при 22,5 ° С и до 6,8 мин при 37 ° С (и примерно до 4 ч на льду) 2. Пока служит H57 SCF В, как FRET донора, измеренные выходы FRET не чувствительны к H57 SCF V диссоциации, однако, сигнал шум увеличиваетсяс повышенной H57 диссоциации.
- Подготовка SLB, содержащий AF647 / Су5 меченные pMHCs а также немеченый ICAM-1 и B7 в соответствии с Axmann др. 4.
- Заменить PBS камеры изображения с изображения среде, содержащей сбалансированный солевой раствор плюс кальций / магний и 1% яичный альбумин Хэнка. Для этого пипетки 400 мкл буфера изображений в колодец, тщательно перемешать и снять 400 мкл из колодца. Повторите эту процедуру 3-4 раза. Не подвергайте SLB воздуха в любое время.
- Поместите камеру изображения на столике микроскопа и настроить фокус, пока люминесцентная (AF647, Су5) SLB не приходит в ясный взгляд.
- Настройка TIRF освещение, переводя сфокусированного луча параллельно оптической оси к периферии фокальной плоскости объективной Виа перемещения поступательного стадии перископ в.
- Для точной настройки лазера возбуждения пучков в режиме TIRF, добавить Т-клеток, украшенные AF555 / Су3 помечены SCF В и пусть им обосноваться на SLB. Примечание: Условия TIRF освещения выполнены, когда базальная мембрана сотовой в фокусе в дополнение к SLB и каких-либо других частях клетки приходят в поле зрения при фокусировке вверх. Тем не менее, если TIRF не отрегулирован, части флуоресцентного Т-клеток плазматической мембраны, которые не находятся в контакте с SLB, появится в виде кольца. Если это так, то отрегулируйте лазерный луч с трансляционной стадии перископ, пока TIRF освещение не будет достигнута.
- Приобрести следующие шесть изображений в указанном порядке и в быстрой последовательности (рис 6):
(i1, опционально) белый свет, чтобы сделать снимок клетки,
(i2, опционально) возбуждения 647 нм (низкая мощность), чтобы сделать снимок лада акцептора (ПКИКЖ) до отбеливателя импульса,
(i3) 514 нм возбуждения (низкая мощность), чтобы сделать снимок донора FRET (TCR) до отбеливателя импульса,
(i4) 647 нм возбуждения (высокая мощность) для фото-отбеливателя лада акцепторной, /> (I5) 514 нм возбуждения (низкая мощность), чтобы сделать снимок донора FRET (ТКС) после отбеливания импульса,
(i6) 647 нм возбуждения (низкая мощность) для проверки полного просветления FRET акцептора. - Хранить время, прошедшее между изображениями (I3) и (I5) как можно короче, чтобы иметь возможность сопоставить изображения для последующего анализа. Держите FRET доноров отбеливание минимум, используя возбуждение при минимально возможном уровне мощности, при которой еще возможно для правильного изображения из Т-клеток.
- Выберите область интереса (ROI), например, всего синапса или индивидуального TCR микрокластера, определить ее среднюю интенсивность в (i3) (= я (3)) и в (i5) (= я (5)). Для вычитания фона, выбрать ROI той же размерности за пределами освещения в месте (3) или (5) и определить его среднюю интенсивность (I (фон)). Чтобы определить выход FRET выполнить следующую операцию:
г "/> (уравнение 7)
Примечание: Следует отметить, что по отношению к абсолютным уровнем FRET, это может быть необходимо для коррекции доноров отбеливания между изображениями (i5) и (I3).
3.3. FRET измерения с помощью сенсибилизированной эмиссии
- Выполнять пространственную донора и акцептора выравнивание канала с использованием разноцветных бусинок, которые флуоресцируют во всех каналах выбросов. Пространственное сдвиг между обоими каналами связи с хроматической аберрации могут быть определены супер-позиционирование отдельных бусин и должен быть применен для коррекции одного из двух каналов для всех следующих 2-цветное изображение пар 10.
- Определить степень доноров bleedthrough с использованием SLB, содержащей лада доноров флуорофора в одиночку. Также возможно использовать FRET-донорно-меченных Т-клеток на липидный бислой с немеченого рМНС. Предпосылки сначала определяется пределами освещенной поле зрения, а затем вычесть из обоих каналов. Таким образом, в среднем ба ckground исправлены интенсивности двух соответствующих трансформирования (I донорской канал, и я акцепторные канал) определяются. Рассчитайте коэффициент bleedthrough (БТД) следующим образом:
 (уравнение 8)
(уравнение 8)
Примечание: Эта БТД является постоянным для определенного красителя и набор фильтров-комбинации. - Рассчитать лада доноров bleedthrough изображение следующим образом:
 (уравнение 9)
(уравнение 9) - Определить акцепторный поперечное возбуждение захватывающей в SLB содержащий FRET акцептора флуорофора одна (например, Е. К / MCC-Alexa Fluor 647) сначала с FRET возбуждающего света донор (например., 514 нм), а затем с акцепторной возбуждающего света (например, 647 нм). Используйте фоновые изображения вычитается в ладу акцепторной канала для вычисления коэффициента кросс-возбуждения (CEC) следующим образом:
ftp_upload / 53157 / 53157eq10.jpg "/> (уравнение 10) - Как ЦИК зависит от интенсивности лазерного возбуждения, используемого для доноров, определить его на каждом измерении день. Используйте полученную ЦИК вычислить образ исключительно сгенерированный через кросс-возбуждения.
 (уравнение 11)
(уравнение 11) - Рассчитать изображение FRET поправкой на bleedthrough и поперечного возбуждения следующим образом:
 (уравнение 12)
(уравнение 12)
Примечание: Абсолютная сигнал FRET (но не относительный выход FRET) является чувствительным к диссоциации H57 SCF V от Т-клеточной мембраны связаны TCR. Чтобы избежать чрезмерных потерь ТКР FRET зонда, направлены на проведение измерений при 37 ° С в течение первого через 2 мин после добавления Т-клеток в бислой. Измерения с количественным (≥ 95%) TCR маркировки возможно только на уровне или ниже 22,5 ° С в течение первых 3 мин послеДобавление Т-клеток в бислой.
4. одной молекулы FRET измерения
- Регулировка мощности обоих лазеров привести к интенсивности 1-5 кВт / мкм 2 в образце. Для получения более подробной информации, пожалуйста, обратитесь к Axmann др. 4.
- Этикетка Т-клетки, как описано выше со смесью немеченого SCF V (5-9 частей) и Су3 / AF555-меченного SCF V (1 часть). Примечание: только таким способом фракция ТКО обозначенному FRET-донора. Это уменьшает количество обнаруживаемых взаимодействий, но шум, создаваемый доноров bleedthrough также значительно снизилось (примерно 5 1/2 до 10 1/2), что очень важно при решении отдельные молекулы FRET одного события.
Примечание: диссоциации зонда H57 ScFv из TCR не влияет на измерения, как это происходит в гораздо большем диапазоне времени (от минут до часов), чем диссоциации TCR от SLB-связанного ПКИКЖ (к югу от секунды к секундеассортимент). - Поставьте SLB с участием AF647-меченных pMHCs а также ICAM и B7 на сцене микроскопа и регулировки фокуса, так что двухслойная приходит в ясный взгляд.
- Дополнительно: Включить щелевое отверстие в пути возбуждения (как показано на Axmann др.) 4, чтобы замаскировать большинство области освещения, кроме синапсе. Таким образом неотбеленные IE K / MCC (С) -Alexa Fluor 647 FRET акцепторных молекул может двигаться в области освещения.
- Добавить H57 SCF V украшенные Т-клетки бислоя (с буфером изображения), и подождите, пока синапсы не появляются в поле зрения.
- Возьмите в быстрой последовательности последовательность 10 до 20 наборов изображений с использованием функции обнаружения 2-цвет:
i1) возбуждение 514 нм
i2) возбуждение 647 нм - Демонстрировать изображения от 1 до 5 мс и приобрести в виде набора изображений.
- Для оценки идентичности одной молекулы FRET события, применить ту же коррекцию относительно доноров и акцепторов bleedthrough кросс-возбужденийния. Кроме того, одна молекула FRET события должны согласовать с одиночными молекулами акцептора и должны появляться и исчезать в одном шаге (смотри также рисунок 7).
- Выкл-скорости определения
- Запись следы одной молекулы FRET события для нескольких временных приобретение кадров.
Примечание: В этом примере (выделено курсивом) отходящий курс между 5c.c7 TCR и Е. К / К3 измеряют при 25 ° С с четырьмя различными временами задержки 42 мс (490 мс, 1007 мс,, 1 989 мс). - Список FRET следы в соответствии с их длинами трасс, как показано в таблице 1.
- Преобразование таблицы 1 в обратной кумулятивной функции распада (таблица 2), как показано (цветные числа взяты из таблицы 1).
- Для нормализации функции, приводя распада, разделите количество следов таблице 2 на сумму всех следов в этой конкретной группы. Участок нормированные значения против количества временных рамок. Когда опуская последнюю сроки, которые содержит ноль, распады можно прочитатьИлийская оснащены одной экспонентой (фиг.8А).
- Как показано на рисунке 8B, построить среднее значение <п (т задержки)>, то есть, отрицательное обратная показателя функции распада определенной выше от времени задержки т отставание занятого (в этом примере: х = т лаг = 0,042 с и у = лаг)> = 1 / 0,662 = 1,511, х = 0,49 с и у = 1 / 0,902 = 1,101, х = 1,007 с и у = 1 / 1.131 = 0.884, х = 1.989 лет и у = 1 / 1,591 = 0,629).
- Fit τ от и <п отбелить> на основе уравнения 3. Это может быть сделано с помощью нелинейного фитинга функцию научной программы анализа данных, такие как Origin.
Примечание: лучше всего подходят показано в этом примере дает т от 2,12 +/- 0,23 с и <п отбелить> 1,53 +/- 0,06 сек. - Рассчитать по коридоруе жизнь взаимодействии T 1/2 от 1/2 с т = τ от от • LN (2) (в этом примере: 1,47 сек).
- Запись следы одной молекулы FRET события для нескольких временных приобретение кадров.
- 2D-Уб определение
- Определить коэффициент преобразования C для пары красителя, используемого FRET с использованием уравнения 6 и как описано выше (фиг.4А).
- Определить доходность FRET для отдельных микрокластерах TCR или целых синапсов (рис 3В и 5).
- С помощью уравнения 4 конвертировать все отдельные выходы FRET в TCR заселенности (рис 4C).
- Применить уравнение 11 преобразовать все заселенности ТКР в 2D-Уб лет. Как указано ниже, связывание синаптической неоднородна. Содержательное мерой синаптической Уб лет является медиана (обозначена красным) всех измеренных микрокластерах (рис 4D).
- Расчет 2D-К на S
- Рассчитать K на с законом действия масс с к о = K выкл / K D и экспериментально определенный K ВЫКЛ и значения К D.
Примечание: синаптических K ВЫКЛ для эксперимента показано на фиг.4 (IE K / MCC, взаимодействующих с TCR 5c.c7 при 25 ° С) 0,41 с -1. Отсюда Уб участок (рис 4D) могут быть преобразованы в ак на участке, как показано на рисунке 4E.
- Рассчитать K на с законом действия масс с к о = K выкл / K D и экспериментально определенный K ВЫКЛ и значения К D.
Результаты
Запись внутриклеточного кальция через красителя фура-2 кальция, а также последующее сотовой анализа, который подтверждает стимулирующий потенцию и, следовательно, функциональность SLBS показаны на рисунке 4. В становится очевидным, уровень кальция расти в Т-клетках (в виде нормализуется фура-2 340 нм отношение / 380 нм с базовой быть 1) сразу же, как только они оседают на стимулирующих SLBS. Уровни кальция возврата к исходному уровню вскоре после добавления антител, которые блокирует pMHCs из TCR зацепления и который заканчивается активацию Т-клеток.
На рисунке 6 показана типичная эксперимент с участием FRET восстановление доноров после акцепторного отбеливания, который используется для измерения урожайности рвать и который служит для вычисления значений 2D-К D (показано на рисунке 4). Пожалуйста, обратите внимание на увеличение интенсивности доноров FRET, который представляет TCR надписью помощью AF555, после быстрого и полного удаления лада аcceptor видов (здесь: AF647, связанные с pMHCs). Также очевидным является сильное снижение в ладу канала, то есть, лада-акцептор канал при возбуждении донора FRET, после FRET акцепторной отбеливания. Едва видны оставшиеся сигнал соответствует FRET доноров bleedthrough. FRET доходность в пределах отдельных микрокластерах TCR или целых синапсов рассчитываются на основе указанных значений измеренных значений интенсивности (рис 6В).
Рисунок 7 изображает траекторию и промежуток времени из одной молекулы FRET случае видимого в двух временных рамок. Как указано выше в введении такое поведение вызвано как распад синаптической TCR-рМНС связывания и фотообесцвечивания. Для различия между этими двумя вкладами, экспериментальные время приобретение кадров должны изменяться по продолжительности: в то время как фотообесцвечивание остается постоянной, изменения в FRET длины траектории событие только вызвано обязательных кинетики. Количественное определение tracelengths, ж HICH является основой для расчета нерабочее ставок и отбеливания, показанных на рисунке 7, представлены в таблицах с 1 по 3.
Определение 2D-K D s требует записи оптом FRET урожайности для FRET-доноров меченых ТКО. При использовании экспериментально выведенной константой С (рис 4), доходность FRET измеряли для TCR микрокластера или всей синапса может быть преобразован в TCR размещение а, т.е., отношение ПКИКЖ-занятых и общей ТКО (рис 4C) , При известных плотностей рМНС присутствующих на SLB перед добавлением Т-клетки, значения могут быть применены для определения значения синаптических 2D-К D (рис 4D). На-ставки могут быть рассчитаны с законом действия масс (2D-К на = 2D-K выкл / 2D-K D) от определенной Synaptic вне курса и ценностей 2D-KD.
1 "SRC =" / файлы / ftp_upload / 53157 / 53157fig1.jpg "/>
Рисунок 1. Схема контур липидной двухслойной системы плоского стекла поддержке (SLB). (A) SLBS состоят из РОРС (90-99%) и синтетический липид АРД Ni-NTA (1-10%) и образуют спонтанно, когда чистые стеклянные поверхности заряжены небольшие однослойные пузырьки (SUV), состоящий из соответствующих липидов. (Б) После образования таких SLBS может быть функционализированный растворимых полигистидином помечены внеклеточных частей, полученных из pMHCs, костимуляторных В7-1 белков и ICAM-1 адгезии протеинов, чтобы служить в качестве АРС для Т-клеток. Для получения более подробной информации о подготовке SLBS см Axmann др. 4. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

FIGU Re 2. Ферстер-резонансная передача энергии на основе анализа для количественного ТКР ПКИКЖ связывания на месте. (A) композитная структура из TCR комплекс с H57 одноцепочечного фрагмента зацепление с рМНС иллюстрирует подход FRET основе описанных здесь. Обратите внимание на короткое расстояние около 41А, разделяющей две соответствующие флуорофоры проходящих ладу. Акцепторные сайты для флуорофорных-малеимиды указаны в зеленый и красный. (Б) Принцип обнаружения ТКР ПКИКЖ взаимодействия в месте показано. Только SCF В -decorated ТКО и pMHCs (здесь Е. К), которые образуют специфические комплексы, приводят к измеримым сигнала ладу. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
"/>
Рисунок 3. Хроматограммы на конечной стадии гель-фильтрации, порождающих мономерных SCF V S и пептид-загружены IE K -2x6H молекул. X-оси представляют объем хранения в мл, Y-оси указывают поглощения при 280 нм в условных единицах (а.е.) . (А) H57 SCF V-сайт-специфически помечены Alexa Fluor 555 малеимид подвергали хроматографии S75, чтобы отделить непрореагировавший краситель от белка (шаг 1.2.5). Фракции, соответствующие интервалу удержания 14 до 15 мл (штриховые линии) представляют помечены мономерного H57 SCF V. (B), т.е. K молекулы -2x6H комплекс с УФ-расщепляться АНП-космической держателя пептида был УФ-облучении, инкубировали с сайта-Alex специально 647 малеимид-меченого пептида и, наконец, подвергают хроматографии S200, чтобы отделить белок от свободного пептида (шаг 1.1.2.4). Интервал между пунктирными линиями содержит правильно сложить и мономерных pMHCs. (А, Б) 0,7 мл образца, нанесенного на колонку в начале ром (0 мл точки). Собранные фракции концентрировали. Соотношение белков к красителя определяется photospectrometry до диализа против PBS / 50% глицерин (для хранения при -20 °). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
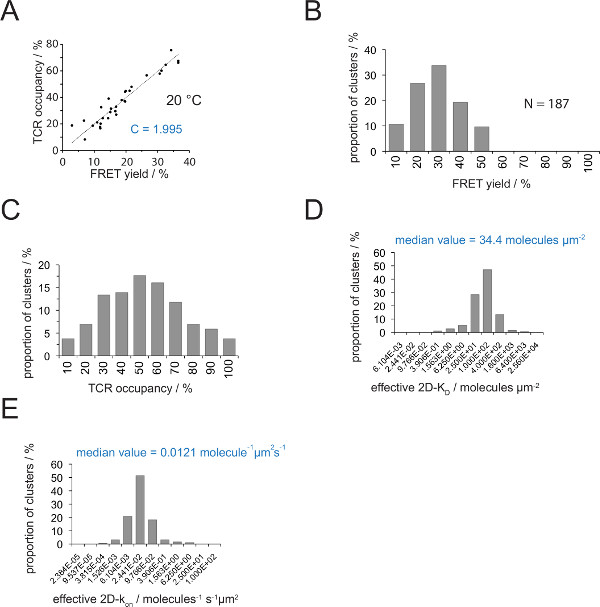
Рисунок 4. Определение 2D-Уб лет и 2D-K на х. (А) корреляция между доходностью FRET, определенной по восстановлению доноров после акцептор отбеливания и размещение ТКО измеряется экспериментально. Размещение ТКС может быть определена для отдельных микрокластерах TCR, как описано в разделе 4.2. Линейный подгонки данных отображается на линии, наклон которой равен коэффициенту C между TCRразмещение и выход ладу. С постоянным специфическим для системы рвать и флуорофоров (здесь Cy3 и Cy5), занятых. В этом примере дали 1,988. (В) FRET давать данные были определены для отдельных микрокластерах TCR (N = 187, температура = 24 ° C) через восстановление доноров акцепторной отбеливания. Цифры ниже гистограммы баров указать верхний предел в интервале. (С) Преобразование данных, приведенных в (B) измеряется путем умножения урожайности FRET с постоянной С определяются в (А). Числа ниже показывают баров верхний предел в интервале. (D) Гистограмма (полулогарифмический, база = 4), изображающая распределение 2D-Уб лет, измеренные для отдельных микрокластерах TCR. Средний 2D-Уб указывается в синем. Числа указывают ниже баров верхний предел в интервале. (Е) Гистограмма показано на (D) превращают Intоа 2D-K на -histogram (полу-логарифмической, базы = 4) с использованием синаптической K ВЫКЛ 24 ° C (0,41 с -1). Определенное средний 2D-K на значение указано в синий цвет. Данные были впервые опубликована в HUPPA др. 2 и визуализируются здесь, в новом формате. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 5. Функциональная проверка SLBS используются для стимуляции Т-клеток и визуализации. (A) TCR-трансгенных Т-клеточные взрывы, нагруженные фура-2 столкнулись с стимулирующего SLB укрывает антигенные pMHCs, ICAM-1 и В-7. Сотовый фура-2 выбросов возбужден при 340 нм и 380 нм, а также DIC записи изображений. Как указано, соотношение значения интенсивностей излучения, возникающего при 340 и 380 нм, показаны на правой панели. Добавление рМНС блокирующие антитела 14 мин в экспериментальной серии привело к снижению уровней внутриклеточного кальция, сравнимых с покоящихся Т-клеток. (Б) типичный временной профиль средней фура-2 соотношений в Т-клетки, контактирующие стимулирующее SLBS характеризуется на начальной повышением внутриклеточного кальция, который составляет от 2 до 4 раз выше, по сравнению с не-активированных Т-клеток или Т-клеток, лишенных антигена после опосредованного антителами блокады. Зеленые кружки моменты времени, показанные на (А). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
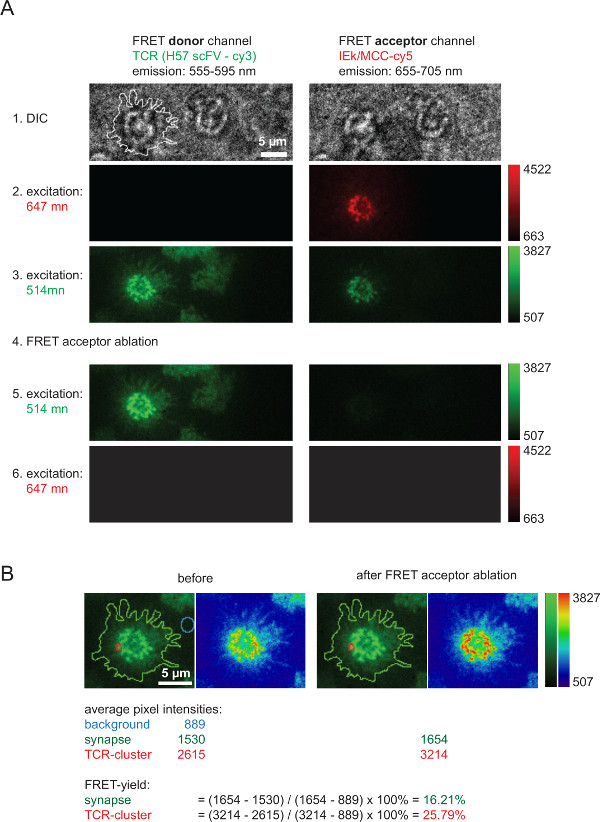
Рисунок 6. Массовая FRET урожаи, как измеряется с помощью FRET восстановления доноров после FRET акцепторной отбеливания. (А) показан пример типичного синаптической FRET-измерения. Как указано слева и сверху серия снимков была приобретена с использованием светоделителем выбросов, приводящей к FRET донора и лобзиком акцепторной канала (для получения более подробной информации о светоделителей см Axmann др 4). Линия показано в левом DIC изображение показывает границу Т-клеток синапса. Обратите внимание на потери в интенсивности в пределах акцептора канала FRET, а это увеличение интенсивности в донорском канала FRET после FRET акцептора отбеливания (этап 4). (В) FRET эффективность может быть определена количественно, как указано для отдельных синаптических регионов или целых синапсов. Для осмотра, изображения до и после отбеливания FRET акцепторной показаны с использованием двух таблиц поиска (СНМП, зеленый и физика). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
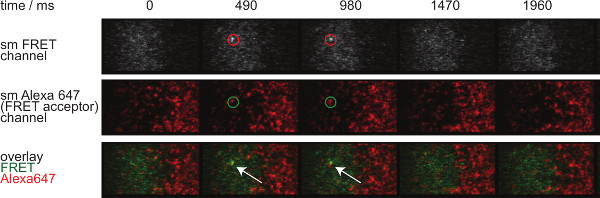
Рисунок 7. одной молекулы FRET события появляются и исчезают insingle шаги и идеально выровнены с одной FRET акцепторного флуорофора. Промежуток времени от одной молекулы FRET событий показана. Изображения были получены с помощью задней подсветкой EMCCD камеру. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
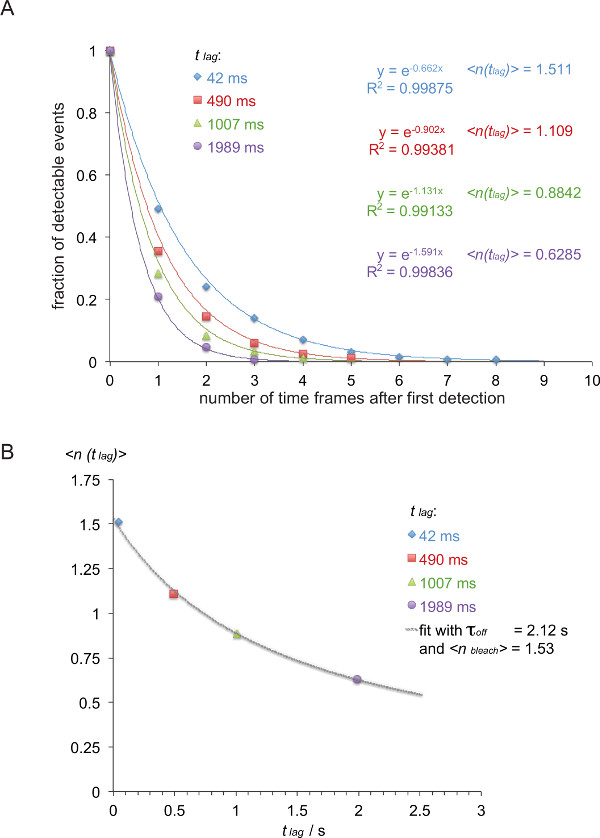
Рисунок 8. Определение т = 1 с / к от из измеренных smFRET траекторий. (A) нормированные совокупные суммы наблюдаемых сигналов FRET (полученных из H57 SCF V -AF555 украшенные 5c.c7 TCR трансгенных Т-клеточные взрывы признания IE K / K3-AF647 при 24 ° С) в течение четырех различных задержек времени (42 мс, 490 мс, 1007 мс, 1989 мс) были нанесены в функции от общего количества наблюдений. Моно-экспоненциальная функции подходят привести к соответствующим негативное обратное средних значений <п (т отставание)>. (B) значения Ожидание были в заговоре против задержки т отставание и устанавливается с помощью уравнения отставание)> = τ от / {(Т выкл / <п отбелить>) + T задержки}, чтобы получить т от и <п отбелить>. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Измерение белок-белковых взаимодействий в месте весьма желательно, особенно при работе с низким сродством взаимодействия, таких как TCR-связывающий рМНС 11. Это потому, что на скорости, а также устойчивость таких взаимодействий значительной степени зависит от конкретных обстоятельств, при которых имеет место связывания. Таким образом, минимально инвазивные FRET подходы изображений в принципе идеально подходит для таких задач, но включать ряд препятствий, которые должны быть сначала преодолеть. Уровень шума сотовой флуоресценции ограничивает чувствительность измерений и, следовательно, должны быть сведены к минимуму. TIRF микроскопии служит эту потребность очень хорошо 12, но требует функционализации стеклянных слайдов, желательно в виде плоской стеклянной поддерживает липидный бислой украшенной белков выбора 13-15. Еще одно преимущество частично преобразовываю- подхода является то, что рекомбинантные двухслойные резидентом FRET партнеры могут быть намного мруды легко помечены в количественном, сайт-специфической и рационально с меньшими и более ярких флуорофорами чем было бы возможно с поверхностно-клеточных белков выражается. ТКО с тегами рекомбинантный SCF В с, что не влияет на признание Т-клеток, как было ранее испытания 2. Кроме того, состав белка в SLB, например плотность pMHCs и выбор вспомогательных факторов можно регулировать своих конкретных потребностей. Ранее мы уже провели эксперименты с различными плотности стимулирующих pMHCs, но не обнаружили существенных различий в 2D-K от 2D-и Уб 2.
Пока здесь признание молекул MHC класса II был нанесен лишь, главным образом из-за характера их пептидсвязывающий щели, которая открыта на обоих концах и, таким образом вмещает большие пептиды в том числе линкера для присоединения флуорофора. В некоторых случаях такой подход может также работать для маркировки МНС CLAсс я молекул 16, но с большой осторожностью должны быть приняты, чтобы проверить их использование в экспериментах. Чувствительность Т-клеток по отношению к антигенам, которые могут быть измерены с помощью пролиферации Т-клеток анализов, а также рМНС-TCR кинетики связывания, как измерено в пробирке с помощью поверхностного плазмонного резонанса не должны зависеть от того линкера и флуорофора пептид. Кроме того, МНС класса I молекул себя могут быть помечены в сайт-специфическим образом с введением непарным цистеина в последовательности тяжелой цепи (неопубликованные наблюдения).
С использованием соответствующих молекулярных зондов любой синаптической белок-белковое взаимодействие могут, в принципе, быть изучены в моде, описанной здесь. Такие зонды, например, SCF В с или Предназначен анкириновых Повторите Белки (белков DARP) 17, должны быть одновалентной и должны связывать свою цель стабильно, не затрагивая взаимодействие интересов. Конечно, структурная ИНФОРМАЦИЯп весьма желательно, рациональной конструкции зонда, но не абсолютно необходимо. При создании новой пары партнеров FRET, рекомендуется записывать и анализировать FRET оптом первым. Сайты привязанности этикетки может варьироваться значительно увеличить сигнал FRET, а также чтобы убедиться, что измеренные FRET доходность различаются в зависимости от расстояния меж- красителя. После того, как система оптимизирована, одна молекула FRET сигналы могут быть записаны путем ограничения маркировку высокого изобилия FRET партнера до 10-30%, а отбеливания низкой численности FRET партнера до тех пор, одиночные молекулы не разрешимы в области освещения.
Последнее, но не менее следует отметить, что SLBS приблизительно некоторые, но не все аспекты физиологической плазматической мембране. Такие качества, как мембранный кривизны и гибкости, домена компартментализацией, цитоскелета перестановок и подвижности клеток, а также высокой различных поверхностно-выражены мембранных белков не представлены SLBS но может влиять тон исследуемого процесса. Много усилий нужно будет вложено в создание методов визуализации, которые позволяют мониторинга белок-белковых взаимодействий с разрешением одной молекулы в физиологических синапсов, которые недоступны для визуализации TIRF.
Раскрытие информации
The authors declare that they have no competing financial interest.
Благодарности
М. была поддержана Шредингера общении Австрийским научным фондом (FWF, J3086-B11) и благодарит Макса Планка общества на финансовую и административную поддержку. С. и И. Н. поддержали Венской науки и техники (КОС фонда, LS13-030).
Материалы
| Name | Company | Catalog Number | Comments |
| LB-media | Fisher Scientific | 10000713 | bacterial expression |
| Sf900 II | Life Technologies | 10227402 | insect cell media for baculo virus production |
| Insect-XPRESS with L-glutamine (Lonza) | Fisher Scientific | 10564038 | insect cell media for baculo virus expression |
| Sf9 cells | Life Technologies | 11496-015 | cells for virus production and expansion |
| High Five Cells | Life Technologies | B855-02 | cells for potein expression |
| LB-media | Fisher Scientific | 10000713 | bacterial expression |
| Centramate System | Pall | protein concentartion from large volumes | |
| Centramate cassette 10kDa cutoff | Pall | OS010T12 | protein concentartion from large volumes |
| Amicon Ultra-15 Centrifugal Filter Units | EMD Millipore | UFC900308 | protein concentartion |
| Amicon Ultra-4 Centrifugal Filter Units | EMD Millipore | UFC800308 | protein concentartion |
| Amicon Stirred Ultrafiltration Cell Model 200 mL | EMD Millipore | 5123 | protein concentartion |
| Äkta pure 25L | GE Healthcare | 29-0182-24 | protein purification |
| Superdex 200 10/300 GL | GE Healthcare | 17-5175-01 | protein purification |
| Superdex 75 10/300 GL | GE Healthcare | 17-5174-01 | protein purification |
| Mono Q 5/50GL | GE Healthcare | 17-5166-01 | protein purification |
| Ni Sepharose 6 Fast Flow | GE Healthcare | 17-5318-01 | protein purification |
| Tricorn 10/20 column | GE Healthcare | 28-4064-13 | protein purification |
| Gilson HPLC system | Gilson | purificationof fluorochrome-coupled peptides | |
| Pursuit XRs C18, 5 µm particle size, 21.2*250mm column size | Agilent | A6000250X212 | purificationof fluorochrome-coupled peptides |
| Pursuit XRs C18, 5 µm particle size, 21.2*50 mm column size | Agilent | A6000050G212 | purificationof fluorochrome-coupled peptides |
| Tricorn 10/20 column | GE Healthcare | 28-4064-13 | protein purification |
| Gilson HPLC system | Gilson | purificationof fluorochrome-coupled peptides | |
| Pursuit XRs C18, 5 µm particle size, 21.2*250mm column size | Agilent | A6000250X212 | purificationof fluorochrome-coupled peptides |
| Pursuit XRs C18, 5 µm particle size, 21.2*50 mm column size | Agilent | A6000050G212 | purificationof fluorochrome-coupled peptides |
| Cy3 maleimide | GE Healthcare | PA23031 | site-specific protein labeling via mutant unpaired cysteines |
| Cy5 maleimide | GE Healthcare | PA25031 | site-specific protein labeling via mutant unpaired cysteines |
| Alexa Fluor 555 C2 Maleimide | Life Technologies | A-20346 | site-specific protein labeling via mutant unpaired cysteines |
| Alexa Fluor 647 C2 Maleimide | Life Technologies | A-20347 | site-specific protein labeling via mutant unpaired cysteines |
| Fura-2, AM, cell permeant | Life Technologies | F-1221 | calcium-sensitive dye for cell labeling |
| dimethyl sulfoxide | Sigma Aldrich | 151874 | for dissolving fura-2 am |
| Hank's Balanced Salt Solution plus calcium/magnesium | Fisher Scientific | 10225362 | imaging buffer |
| PBS | Life Technologies | 14190-136 | |
| Bovine Serum Albumin lyophilized powder | Sigma Aldrich | A2153 | supplement for imaging buffer |
| 14-4-4S antibody | affimetrix eBioscience | 14-5980-81 | blocking antibody for H2-I-Ek (recognized by the 5c.c7, 2B4 and AND TCR) |
| 5 ml polypropylene round-bottom tube | Becton Dickinson | FALCON 352063 | |
| 0.22 μm Ultrafree-MC centrifugal filter unit | EMD Millipore | UFC30GV0S | |
| Syringe filter 0.2µm | Millipore | GVWP04700 | |
| TetraSpeck Microspheres, 0.1 µm, fluorescent blue/green/orange/dark red | Life technologies | T-7279 | |
| Microscope for fura-2-based calcium measurements | LEICA | DMI4000B | |
| Microscope for (single molecule) FRET measurements | LEICA/ZEISS/NIKON/OLYMPUS | for details please refer to parallel JoVE contribution by Axmann et al. | |
| planar supported lipid bilayers | for details please refer to parallel JoVE contribution by Axmann et al. | ||
| RPMI 1640, with L-Glutamine | Life Technologies | 11554416 | T-cell media |
| non-essential amino acid 100X | Hyclone | SH30238.01 | T-cell media supplement |
| penicillin/streptomycin/L-glutamine 100x | Life Technologies | 12000226 | T-cell media supplement |
| 2-mercaptoethanol | Sigma Aldrich | M6250 | T-cell media supplement |
| mouse interleukin-2 recombinant protein | BPS Bioscience | 90185-B | T-cell media supplement |
| Research Grade Fetal Bovine Serum | Hyclone | SV30160.03 | T-cell media supplement |
| Origin (analysis program) | OrigenLab | http://www.originlab.com/ | non-linear fitting of two parameters (tauoff, [ntlag]) |
Ссылки
- Garcia, K. C., Adams, J. J., Feng, D., Ely, L. K. The molecular basis of TCR germline bias for MHC is surprisingly simple. Nat Immunol.. 10, 143-147 (2009).
- Huppa, J. B., et al. TCR-peptide-MHC interactions in situ show accelerated kinetics and increased affinity. Nature.. 463, 963-967 (2010).
- Huppa, J. B., Davis, M. M. The interdisciplinary science of T-cell recognition. Advances in immunology.. 119, 1-50 (2013).
- Axmann, M., Schuetz, G. J., Huppa, J. B. Single Molecule Microscopy on Planar Supported Bilayers. Journal of Vizualized Experiments J. Vis. Exp.. 101, e53158(2015).
- Xie, J., et al. Photocrosslinkable pMHC monomers stain T cells specifically and cause ligand-bound TCRs to be preferentially transported to the cSMAC. Nat Immunol. 13, 674-680 (2012).
- Jares-Erijman, E. A., Jovin, T. M. FRET imaging. Nat Biotechnol. 21, 1387-1395 (2003).
- Toebes, M., et al. Design and use of conditional MHC class I ligands. Nat Med. 12, 246-251 (2006).
- Tsumoto, K., et al. Highly efficient recovery of functional single-chain Fv fragments from inclusion bodies overexpressed in Escherichia coli by controlled introduction of oxidizing reagent--application to a human single-chain Fv fragment. J Immunol Methods. 219, 119-129 (1998).
- Ruegg, U. T., Rudinger, J. Reductive cleavage of cystine disulfides with tributylphosphine. Methods Enzymol. 47, 111-116 (1977).
- Ruprecht, V., Brameshuber, M., Schütz, G. J. Two-color single molecule tracking combined with photobleaching for the detection of rare molecular interactions in fluid biomembranes. Soft Matter. 6, 568-581 (2010).
- Dustin, M. L., Bromley, S. K., Davis, M. M., Zhu, C. Identification of self through two-dimensional chemistry and synapses. Annu Rev Cell Dev Biol. 17, 133-157 (2001).
- Axelrod, D. Cell-substrate contacts illuminated by total internal reflection fluorescence. The Journal of cell biology. 89, 141-145 (1981).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285, 221-227 (1999).
- Kaizuka, Y., Douglass, A. D., Varma, R., Dustin, M. L., Vale, R. D. Mechanisms for segregating T cell receptor and adhesion molecules during immunological synapse formation in Jurkat T cells. Proc Natl Acad Sci USA. 104, 20296-20301 (2007).
- Varma, R., Campi, G., Yokosuka, T., Saito, T., Dustin, M. L. T cell receptor-proximal signals are sustained in peripheral microclusters and terminated in the central supramolecular activation cluster. Immunity. 25, 117-127 (2006).
- Purbhoo, M. A., Irvine, D. J., Huppa, J. B., Davis, M. M. T cell killing does not require the formation of a stable mature immunological synapse. Nat Immunol. 5, 524-530 (2004).
- Binz, H. K., Stumpp, M. T., Forrer, P., Amstutz, P., Pluckthun, A. Designing repeat proteins: well-expressed, soluble and stable proteins from combinatorial libraries of consensus ankyrin repeat proteins. J Mol Biol. 332, 489-503 (2003).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены