Method Article
Medición de TCR-pMHC Encuadernación
En este artículo
Resumen
This manuscript describes how to conduct (single molecule) Förster Resonance Energy Transfer (FRET)- based assays to measure the binding dynamics between T-cell antigen receptor (TCR) and antigenic peptide-loaded MHC molecules as they occur within the immunological synapse of a T-cell in contact with a functionalized planar supported lipid bilayer.
Resumen
T-cells are remarkably specific and effective when recognizing antigens in the form of peptides embedded in MHC molecules (pMHC) on the surface of Antigen Presenting Cells (APCs). This is despite T-cell antigen receptors (TCRs) exerting usually a moderate affinity (µM range) to antigen when binding is measured in vitro1. In view of the molecular and cellular parameters contributing to T-cell antigen sensitivity, a microscopy-based methodology has been developed as a means to monitor TCR-pMHC binding in situ, as it occurs within the synapse of a live T-cell and an artificial and functionalized glass-supported planar lipid bilayer (SLB), which mimics the cell membrane of an Antigen presenting Cell (APC) 2. Measurements are based on Förster Resonance Energy Transfer (FRET) between a blue- and red-shifted fluorescent dye attached to the TCR and the pMHC. Because the efficiency of FRET is inversely proportional to the sixth power of the inter-dye distance, one can employ FRET signals to visualize synaptic TCR-pMHC binding. The sensitive of the microscopy approach supports detection of single molecule FRET events. This allows to determine the affinity and off-rate of synaptic TCR-pMHC interactions and in turn to interpolate the on-rate of binding. Analogous assays could be applied to measure other receptor-ligand interactions in their native environment.
Introducción
Una comprensión más fundamental de cómo las células T reconocen los antígenos requiere que mira en el lugar correcto, es decir, dentro de la sinapsis inmunológica formada entre la célula T y el APC. Aquí, la cinética de unión molecular no sólo están determinadas por las propiedades bioquímicas inherentes de los compañeros de interacción involucrados, pero dependerá en gran medida de parámetros celulares, que incluyen fuerzas celulares, la arquitectura de la membrana y las interacciones laterales entre proteínas de la membrana así como las limitaciones geométricas-sinapsis específica 3. Enfoques bioquímicos están limitados en poder de resolución, ya que requieren la interrupción de al menos una de las membranas sinápticas implicadas. Por este motivo se ha desarrollado una metodología de formación de imágenes basada en FRET para monitorear la unión del TCR a pMHCs antigénicos 2. Aquí las células T están decoradas con un recombinante y el sitio específicamente etiquetados fragmento de anticuerpo de cadena simple-TCRβ reactiva (SCF V) y se enfrentaron con el plan bicapas ar apoyado por el vidrio de lípidos (SLBS), que albergan MHC moléculas clase II cargadas con un péptido antigénico marcado con fluorescencia, moléculas coestimuladoras y proteínas de adhesión. Unión sináptica entre marcado tinte TCR y marcado con tinte resultados pMHC en FRET, que pueden ser monitoreados en un mayor y el nivel de moléculas individuales por Total Interna Fluorescencia de Reflexión (TIRF) microscopía.
En este artículo se explica en detalle cómo utilizar SLBS para ensayar las sinapsis de células T, verificar su integridad a través de un ensayo de flujo de calcio de células T funcional, conducta FRET mediciones a granel y con sensibilidad única molécula, y analizar los datos adquiridos. Las recomendaciones se ofrecen para la producción de proteínas adecuadamente conformados necesarios para funcionalización bicapa. Para obtener información más específica acerca de la formación de bicapa y la configuración de un microscopio TIRF adecuada consulte a un acceso público JoVe publicación adicionales publicados espalda con espalda 4.
tienda "> Naturaleza de SLBSSLBS funcionalizables se pueden generar fácilmente a partir de vesículas unilamelares (SUV) que contienen los dos lípidos-2-oleoil-sn-gylcero-3-fosfocolina 1-palmitoil (corto: POPC, 90-99%) y sn-1,2 dioleoyl- - glicero-3 - {[N (5-amino-1-carboxipentil) iminodiacético ácido] succinil} (corto: DGS NTA-Ni, 10.01%). Todo terrenos repartidos en portaobjetos de vidrio limpios para formar una bicapa plana contigua 4. DGS-NTA-Ni sirve para anclar proteínas marcada con polihistidina a través de la formación de complejo de polihistidina mediada con el NTA-Ni-que contiene grupo de cabeza (Figura 1A) sintético. Por asociación estable de un típicamente sustituye al dominio transmembrana nativa y cola citoplásmica de la proteína de adhesión ICAM-1 y la molécula coestimuladora B7-1 con una etiqueta que contiene doce histidinas (ICAM-1-12H, -12H B7-1) (Figura 1B) . La clase II molécula IE k cargado con péptido contiene dos cadena polipeptídica membrana incorporado (α y β)s. Los transmembrana / dominios citoplásmicos de ambas cadenas tienen que ser reemplazados con una etiqueta que contiene seis histidinas cada uno (IE k α β 6H 6H o IE k -2x6H). Como alternativa, la ampliación de la α-cadena con doce histidinas y dejando el dominio extracelular de la cadena β sin etiquetar (dando lugar a IE k α β 12H 0H o IE k -12H) da lugar a resultados satisfactorios (Figura 1B).
Etiquetado específico del sitio de pMHCs
Es importante para etiquetar el pMHC estequiométricamente y específica de sitio con el fin de ser capaz de convertir los rendimientos medidos FRET en las constantes de unión de equilibrio significativas. Esto se puede lograr por medio del etiquetado química de un péptido sintético que se carga en la hendidura de unión al péptido de histidina recombinante marcada con moléculas MHC de clase II 2,5. El péptido incluye todos los residuos del epítopo de células T como well como un corto C-terminal enlazador (GGS) seguido de cisteína (por ejemplo, en el citocromo c de polilla (MCC) péptido ANERADLIAYLKQATK- GGSC, el enlazador está marcado en negrita). Esta cisteína se utiliza para marcar el péptido estequiométricamente con el uso de derivados de maleimida en colorantes. En este punto, un cuidado especial debe ser dedicado a la verificación cuantitativa tinte acoplamiento al péptido que contiene cisteína. Se recomienda HPLC-purificación del producto de adición de péptido-colorante y tiene que ser seguido por espectroscopia de masas de ionización por electrospray. Cualquier masas grabados correspondientes al educto péptido (sin colorantes) reflejan etiquetado incompleto. Si esto es cierto, el péptido purificado por HPLC debe ser sometido a rondas consecutivas de tinte etiquetado hasta el etiquetado se considera cuantitativo. Tenga en cuenta que la espectroscopia de masas MALDI-TOF se debe evitar ya que este método implica radiación láser para la muestra de ionización. Este tratamiento se desintegra los fluoróforos sensibles conectados antes de que se dio lectura a la masa péptido y así underrepre senta grados de tinte de conjugación.
El marcaje indirecto aún específica de sitio de los TCR unidos a células con el uso de una sola cadena monovalente fragmentos F V
Todavía es un reto para fijar los tintes a teléfonos proteínas asociadas a la superficie de las células vivas de una manera específica de sitio. Para superar este obstáculo para los TCR expuestos en la superficie, una versión monovalente de cadena sencilla (scFv V) de los genes del anticuerpo monoclonal Reactivo TCRβ H57-197 2 se ha construido. La estructura cristalina de este anticuerpo en complejo con el TCR permite diseñar racionalmente una versión, en la que un residuo de serina en estrecha proximidad a la C-terminal del péptido asociado de MHC (donde está conectado el correspondiente colorante pareja FRET) se sustituye por una residuo de cisteína. Esta cisteína mutante sirve entonces como un aceptor para la conjugación colorante (Figura 2).
Metodologías para grabar FRET
nt "> valores de FRET a granel son los más adecuados para verificar la relación entre las distancias inter-dye elegidos y FRET eficiencias medidas en este TCR-pMHC sistema 2 vinculante. Además, las mediciones de FRET a granel revelan diferencias cualitativas y cuantitativas en sinápticas afinidades TCR-pMHC ( ver abajo y sección de protocolo 3.2). Diversos enfoques para cuantificar la eficiencia de FRET se han introducido en la literatura 6. En este artículo FRET se registra a través de(a) la recuperación de los donantes después del blanqueo aceptante, y por medio de
(b) sensibilizado FRET emisión aceptor.
El primer método (a) requiere el uso de un aceptor de FRET que pueden ser photobleached fácilmente, y un donante, que es bastante fotoestable. Además, es importante asegurarse de que el aceptor photobleached ya no es capaz de extinguir la fluorescencia del donador. Como el mismo canal de detección (donante) se utiliza para la cuantificación, sin factores de corrección unad no hay aberraciones cromáticas tienen que ser considerados, lo que hace que esta metodología simple y fiable. Sin embargo, las mediciones cuantitativas no se pueden repetir en el mismo lugar espécimen y los cambios en la FRET no se pueden grabar en el tiempo. Para evitar los efectos causados por la difusión molecular o la motilidad celular una etapa de blanqueo rápido debe estar dirigida para, lo que minimiza el tiempo que pasa entre la primera donante de FRET (antes del blanqueo aceptor) y el segundo de adquisición de imágenes donante de FRET (después de FRET aceptor de blanqueo). Es recomienda emplear una poderosa fuente de luz láser de la longitud de onda de excitación aceptor FRET con el fin de reducir al mínimo la iluminación y el blanqueo de veces.
Por el contrario, en el enfoque de la medición de la emisión sensibilizada FRET (b) el donante de FRET es excitado y la emisión del aceptor de FRET se observa en el canal aceptor de FRET. Los cambios en la señal de aceptor de FRET se pueden grabar con el tiempo pero de emisión del donador FRET en el canal aceptor desplazada al rojo (termed bleedthrough) y FRET aceptora cruzada de excitación a través de la excitación de los donantes tienen que ser determinados y restado del canal aceptor FRET registrada con exactitud. Para ello, los correspondientes FRET donante y aceptor de FRET imágenes tienen que estar alineados espacialmente.
La detección de una sola molécula (cm) de FRET eventos
Con el uso de láseres como fuente de excitación, una cámara sensible y TIRF microscopía de ruido atenuado la fluorescencia de los fluoróforos individuales se pueden rastrear fácilmente con el tiempo. Similar es cierto para la detección de eventos smFRET intermoleculares. Sin embargo, las complicaciones pueden ser causados por FRET bleedthrough donante y cross-excitación del aceptor FRET, y por lo tanto mucho cuidado tiene que ser tomado al ajustar las densidades fluoróforo en el experimento smFRET.
En el protocolo se proporciona a continuación (servicio de protocolo 4) el TCR fue elegido como FRET donantes en alta abundancia y pMHC como FRET aceptora con poca abundancia. Para atenuar FRET donante bleedthrough suficientemente, decorar el 10-30% de los TCR con fluorescente scFv V y 90 a 70% de los TCR con no fluorescente scFv V. Aquí el canal aceptor de FRET fue elegido como único canal molécula porque es confocal con la molécula de FRET solo canal. Esto ayuda a alinear eventos smFRET con aceptores de FRET sola molécula, que es la base de la validación smFRET.
La extracción fuera de las tasas a través de mediciones sinápticas smFRET
Photobleaching tanto FRET donante y aceptor FRET tiene que ser contabilizadas al extraer la vida media de las interacciones de una sola molécula FRET rastros. El número de FRET señales observables en el comienzo de su aparición como único par donador-aceptor N (0) se reduce con el tiempo por tanto unbinding del photobleaching complejo y receptor-ligando. El número de complejos de sobrevivir en un momento dado N (t) se puede expresar matemáticamente como sigue:

En el término exp photobleaching (-t / τ lejía) el tiempo t es descrito por el producto del número de observaciones n y el tiempo de iluminación t enferma a causa del modo de observación no continua, discreta (es decir, solamente se produce la decoloración durante la iluminación ). Dentro de la exp- cinética plazo (t / τ off) el tiempo t es el producto del número de observaciones n y t el tiempo de retardo para una única observación FRET (es decir, unbinding cinética ocurre continuamente). Ecuación 1 se puede expresar como:
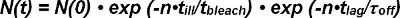
La τ término lejía / τ mal describes el número de observaciones hasta que se produzca el blanqueo y se define como el valor esperado blanquear> de su función exponencial. Ecuación 2 se puede simplificar como sigue:

El valor esperado lag)> del número de cuadros N (t) con FRET-eventos observables después del tiempo t se determina directamente a partir del experimento. Depende del tiempo ajustable entre las observaciones (t lag) elegidos en el experimento y los valores desconocidos para τ off (el inverso de la tasa de descuento k off) y blanquear>, el valor esperado del número de observaciones antes de que ocurra el blanqueo .
Por lo tanto, el cálculo del valor esperado lag)> durante al menos dos valores de t lag permite la determinación experimental de blanquear> y T se fuera.
La extracción de los valores sinápticos 2D-K D a través de mediciones basado en FRET
La medición de la ocupación de un TCR, es decir, la relación entre la envolvente y las TCR TCR totales, es fundamental para determinar los valores sinápticos 2D-K D. Según la ecuación 4 este término es directamente proporcional a la medida FRET producir, siempre y cuando los TCR sirve como donantes y aceptores de FRET pMHCs como FRET.

con una ocupación = TCR, C = factor de conversión
C es una constante, que depende del sistema de FRET y los fluoróforos utilizados. Se puede determinar experimentalmente como se muestra a continuación. una se puede convertir en un 2D-K D según la ecuación 5 cuando elSe sabe densidad inicial de ligandos de TCR antes de la adición de las células T a la bicapa. Esto es debido a la gran movilidad de las proteínas unidas-SLB y también porque SLBS proporcionar un depósito casi inagotable de ligandos 2.

con [pMHC inicial] = densidad inicial de pMHC antes de la adición de las células T
Con las ecuaciones 4 y 5 ahora se puede determinar fácilmente la sináptica 2D-K D entre TCR y pMHC. Esto se hace más fiable con mediciones de FRET basado en la recuperación de los donantes después del blanqueo aceptor (ver sección 3.1 del protocolo).
Sin embargo, para medir C la relación entre la intensidad I FRET FRET (corregida para el fondo, FRET bleedthrough donante y aceptor de FRET transversal de excitación) y TCR ocupación A tiene que ser determinada. Para estetiene que saber la relación R entre la intensidad media de fluorescencia de los fluoróforos individuales asociados-TCR FRET donantes (por ejemplo Cy3 o AF555) sm me traste donante y la intensidad media de una sola molécula FRET eventos sm me preocupe. R depende del sistema de FRET en cuestión, filtros de emisión y de la cámara utilizada para la detección de fluorescencia.
El TCR de ocupación una continuación, se puede determinar directamente según la ecuación 6.

con R = sm me traste donante / sm me traste
R se determinó como 1,45 para el sistema H57 scFv Cy3 / pMHC-Cy5 conduce a:
a = mayor que FRET / mayor que TCR-cy3 • 1.45
La relación entre la ocupación de TCR A y el rendimiento FRET se puede determinar mediante FRET donante recuperary después del blanqueo aceptor. Para ello ambos parámetros se representan uno contra el otro para un número microclusters TCR como se muestra en la Figura 4A .La pendiente de la ajuste lineal indica el factor de conversión C (partir de la ecuación 4).
Como se ha demostrado en la Figura 4A, C asciende para (a) el scFv H57 V - Cy3 / Cy5-pMHC sistema de FRET y (b) la configuración del sistema microscopio aplicado a 1.995. El TCR de ocupación a puede fácilmente deducirse de la siguiente manera:
Ocupación TCR a = FRET ceder • 1.995
Protocolo
1. Producción de Proteínas
1.1. Proteínas bicapa residente: B7-1, ICAM-1, pMHC (por ejemplo, IE k / péptido)
- -12H B7-1, ICAM-1-12H
- B7-1-12H Express y construcciones-ICAM 1-12H en grandes cantidades como proteínas nativas secretadas utilizando un sistema de expresión de baculovirus.
- Purificar proteínas a partir de sobrenadantes de cultivo mediante cromatografía de afinidad Ni-NTA, seguido por cromatografía de intercambio aniónico MonoQ y cromatografía de exclusión de tamaño S200.
- Etiquetar una alícuota de la proteína purificada con colorantes reactivos con amina, tales como NHS preparaciones succinimidil-éster de Alexa Fluor 488 (o FITC), Alexa Fluor 555 (o Cy3), Alexa Fluor 647 (o Cy5).
- Después de la cromatografía de exclusión de tamaño S200 determinar el grado de etiquetado de las proteínas monómeras de acuerdo con las especificaciones del fabricante del tinte mediante la comparación de la absorción de proteína a 280 nm y la absorción del colorante a 488 nm (Alexa Fluor 488, FITC), 555 nm o 552(Alexa Fluor 555 o Cy3) o 647 nm (Alexa Fluor 647 o Cy5).
Nota: más adelante se necesita esta relación para determinar la densidad de proteína en la SLB partir de la señal de fluorescencia mayor parte de la proteína marcada con colorante. - Guarde las proteínas no marcados y marcados con fluoróforo a -20 ° C en PBS más 50% de glicerol.
- pMHC (en este caso IE k -2x6H o IE k -12H)
- Vuelve a doblar MHC de clase II a partir de cuerpos de inclusión expresados en E. coli en presencia de un sustituto péptido mucho más barato UV-escindible, que más tarde puede ser cuantitativamente intercambió con un péptido conjugado con fluoróforo de la opción 5, 7.
- Purificar complejos pMHC replegada mediante técnicas estándar (cromatografía Ni-NTA-afinidad, cromatografía de intercambio aniónico MonoQ, filtración en gel S200).
- Cambie el péptido escindible UV con el péptido fluorescente 5, 7.
- Purificar fluorescente monomérico pMHC complejos finalmente por filtración en gel S200. Un cromatograma representativo se muestra en la Figura 3.
- Verifique la carga péptido cuantitativo por espectrofotometría.
- Proteínas almacenar a -20 ° C en PBS / 50% de glicerol.
1.2. Generación de fragmentos de cadena única de anticuerpo scFv V s (), la introducción de cisteínas para el etiquetado específico del sitio
- Vuelve a doblar scFv V s de cuerpos de inclusión expresados en E. coli. Aquí un protocolo ideado por Tsumoto y sus colegas 8 es seguido en la que los cuerpos de inclusión se despliegan primero en 6 M cloruro de guanidinio, totalmente reducida y luego replegada en el curso de una semana por gradualmente la disminución de la concentración de la proteína de cloruro de guanidinio-despliegue.
- Concéntrese correctamente plegada scFv V utilizando unidades de filtración molecular con un corte molecular de 10 kDa.
- Purificar el concentrado mediante filtración en gel S200.
- Etiquetar monómero scFv V en presencia de tris 0,05 mM (2-carboxietil) fosfina (TCEP) con Alexa Fluor 647 inmediatamente después de la purificación. Realizar la reacción de marcaje mejor en una relación molar de la proteína: colorante de no más de 1: 2 a TA durante no más de 2 hr.
Nota: TCEP es un agente de reducción de fósforo basada y no reacciona con maleimidas en estas concentraciones 9. Es, por tanto, puede estar presente durante la reacción de marcaje para mantener el grupo sulfhidrilo desapareado reducida hasta que reacciona con el derivado de maleimida-dye. - Purificar etiquetada monómero scFv V finalmente a través de filtración en gel S75. Un cromatograma representativo se muestra en la Figura 3.
- Determinar el colorante: proteína espectrofotometría.
- Proteínas almacenar a -20 ° C en PBS / 50% de glicerol.
2. Las mediciones de flujo de calcio
- Tomar un vial nuevo que contenía 50 mg fura-2-AM y disolverla en 50 l DMSO libre de agua.
- Centrifugar 10 6 células T en un tubo de fondo redondo de 5 ml de polipropileno durante 2 minutos a 250-400 g.
- Resuspender las células T en medio formador de imágenes 200 l que contenía solución salina equilibrada de Hank además de calcio / magnesio y 1% ovoalbúmina a TA, añadir 1 l de la-AM fura-2 solución madre (1: 200 dilución), mezclar la suspensión celular y se incuban a TA durante 30 min.
- Lavar las células T una vez en tampón de formación de imágenes. Para esto, llenar el tubo que contiene las células con tampón de formación de imágenes a TA y sedimentar las células como se describe en el paso 2. Eliminar el sobrenadante y resuspender el sedimento de células en 200 l de tampón de formación de imágenes (es decir, a una densidad final de células de 5 x 10 6 células ml -1). Las células pueden ser utilizados inmediatamente para las mediciones de calcio o almacenaron en hielo durante un máximo de 3 hr.
- Colocar las células en un SLB funcionalizado en tampón de imagen (37 ° C). Tan pronto como las células T comienzan en contacto con el SLB, adquirir el siguiente conjunto de imágenes cada 15 a 30 segundos durante 30 minutos:
excitation a 340 +/- 5 nm, la detección de emisión a 510 nm +/- 40
excitación a 380 nm +/- 5, la detección de emisión a 510 nm +/- 40
DIC (opcional)
Nota: Los respectivos tiempos de exposición dependen de la intensidad de la fuente de luz de excitación. Se obtienen resultados satisfactorios cuando las intensidades de los píxeles de 340 nm (380 nm) cantidad de canales a cerca de una cuarta parte (la mitad) del valor de la intensidad al máximo posible. Tenga en cuenta que los valores de fura-2 excitados a 340 nm aumentarán y los entusiasmados a 380 nm se reducirá a la activación de células T. - 20-25 minutos en la carrera, añadir 50-100 l de la anti-pMHC anticuerpo bloqueante pre-calentado a una concentración final de 20-50 mg ml -1. El anticuerpo satura todos los pMHCs y, como consecuencia células T dejará de reconocer el antígeno y dejar de fundente de calcio. Continuar la grabación de imágenes para otro 5 -. 10 min para adquirir la línea de base de la concentración de calcio intracelular, lo que corresponde al estado no activado de las células T < / li>
- Determinar la media de la señal de fluorescencia de fondo a 340 nm y 380 nm de excitación dentro de una región de interés de por lo menos 1.000 píxeles, que no contiene células. De fondo restar todos medidos Fura-2 imágenes excitados a 340 nm y 380 nm y 340 nm calcular / 380 nm ratios de intensidad de las células individuales o un grupo de células. Normalizar relaciones de intensidad dividiendo todas las proporciones a través de la relación de los cinco marcos último tiempo (es decir, con total anticuerpo-bloqueo de la pMHC).
- Normalizado parcela fura-2 ratios contra el tiempo. Nota: Cuando las células y bicapas están en buenas condiciones, nm / 380 nm relaciones de intensidad Fura-2 340 adoptan típicamente valores entre 2 y 5, de 15-45 seg después de las células han puesto en contacto con la bicapa. Ratios luego caer a un valor entre 1,6 y 2 donde permanecen constantes durante al menos 20 minutos o más. Los valores deben caer a 1 sólo después de la adición de anticuerpos anti-pMHC. Un ejemplo típico se muestra en la Figura 5.
3.1. La decoración con el TCR V H57scF
- Centrifugar 10 6 células T en un tubo de fondo redondo de 5 ml de polipropileno durante 2 minutos a 250-400 g.
- Decantar los medios de comunicación, flick el sedimento celular suavemente y añadir 0,3 l de scFv V (concentración ~ 1 mg / ml) a la suspensión celular. Para mayor FRET mediciones sólo se emplean marcado con colorante scFv. Para sola molécula FRET mediciones utilizan una mezcla de scFv marcado (5 a 9 partes, no contiene cisteína no apareado) y marcado con colorante scFv (1 parte, contiene un colorante no apareado cisteína acoplado).
- Se incuban las células en hielo durante 15 min y se lavan las células dos veces a través de sucesivos centrifugación usando tampón de imagen enfriado con hielo.
Nota: Las células pueden ser almacenadas en hielo sin pérdida significativa de límite scFv V (t 1/2 de scFv V disociación a 0 ° C ~ 4 horas 2). La pureza de las células T primarios derivados de TCR transgénico (y opcionalmente también Rag-Media ratones deficientes) y se estimularon in vitro es mayor que 98% desde las células T son las únicas células en proliferación (hasta 7 divisiones celulares) en respuesta al péptido, que se ha añadido para la estimulación a la cultura de células T. Las células B se someten a la apoptosis y que ya no están vivos después de 7-10 días de cultivo. Unas pocas células dendríticas sobreviven todavía pueden ser fácilmente discriminadas no sólo debido a su distinta morfología, sino también porque no se unen al fragmento scFv anti-TCR beta H57.
3.2. FRET medición a través de la recuperación de los donantes después del blanqueo aceptor
Nota: Tenga en cuenta que la vida media de los complejos TCR-H57 SCF V asciende a 4 horas en el hielo, a 50 min a 22,5 ° C y 6,8 minutos a 37 ° C (y hasta alrededor de 4 horas en el hielo) 2. Mientras sirve el H57 scFv V como FRET donantes, los rendimientos FRET medidos no son sensibles a H57 scFv V disociación, sin embargo, la relación señal a ruido aumentacon el aumento de la disociación H57.
- Preparar un SLB contiene AF647 / pMHCs Cy5 marcado, así como ICAM-1 no marcado y B7 según Axmann et al. 4.
- Cambiar el PBS de la cámara de imágenes con medio de imágenes que contiene salina equilibrada solución más calcio / magnesio y 1% ovoalbúmina de Hank. Por esta pipeta 400 l de tampón de imagen en el pozo, mezclar cuidadosamente y eliminar 400 l del pozo. Repita este procedimiento 3-4 veces. No exponga el SLB al aire en cualquier momento.
- Coloque la cámara de imágenes en la platina del microscopio y ajustar el enfoque hasta que la fluorescente (AF647, Cy5) SLB entra en la visión clara.
- Configurar iluminación TIRF traduciendo el haz enfocado paralelo al eje óptico a la periferia del plano focal del objetivo a través de la fase móvil de traslación del periscopio.
- Para afinar los rayos láser de excitación en el modo TIRF, añadir las células T decoradas con AF555 / Cy3 etiquetados scFv V y dejar que ellos se asientan en el SLB. Nota: Las condiciones para la iluminación TIRF se cumplen cuando la membrana celular basal está en el foco, además de la SLB y no hay otras partes de la célula salir a la luz cuando se enfoca hacia arriba. Sin embargo, si TIRF no está correctamente ajustado, partes de la membrana plasmática de las células T fluorescente, que no están en contacto con el SLB, aparecerán como un anillo. Si este es el caso, ajustar el haz de láser con la etapa de traslación del periscopio hasta que se consigue la iluminación TIRF.
- Adquirir los siguientes seis imágenes en el orden indicado y en rápida sucesión (Figura 6):
(i1, opcional) luz blanca, para capturar una imagen de la célula,
(i2, opcional) de excitación 647 nm (baja potencia) para tomar una imagen de la aceptor FRET (pMHC) antes del pulso lejía,
(i3) de excitación 514 nm (baja potencia) para tomar una imagen del donante FRET (TCR) antes del pulso lejía,
(i4) 647 nm de excitación (alta potencia) para la foto-blanqueador aceptor FRET, /> (I5) de excitación 514 nm (baja potencia) para tomar una imagen del donante FRET (TCR) siguiendo el pulso de lejía,
(i6) de excitación 647 nm (baja potencia) para verificar completa blanqueo aceptor FRET. - Mantener el tiempo transcurrido entre las imágenes (i3) y (i5) tan corto como sea posible con el fin de ser capaz de correlacionar las imágenes para su posterior análisis. Mantenga FRET blanqueo donante en un mínimo mediante el empleo de la excitación en el nivel de potencia más bajo posible, que todavía permite la formación de imágenes adecuada de las células T.
- Elija una región de interés (ROI), por ejemplo, toda una sinapsis o un microcluster TCR individual, determinar su intensidad media en (i3) (= I (3)) y en (i5) (= I (5)). Por sustracción de fondo, elegir un retorno de la inversión de la misma dimensión fuera del punto de iluminación en (3) o (5) y determinar su intensidad media (I (fondo)). Para determinar el rendimiento FRET realizar la siguiente operación:
g "/> (ecuación 7)
Nota: Cabe señalar que en relación con el nivel de FRET absoluta, puede ser necesario corregir para el blanqueo de donantes entre las imágenes (i5) y (i3).
3.3. FRET medición a través de la emisión sensibilizada
- Realizar donante espacial y la alineación del canal aceptor con el uso de cuentas multicolores, que emiten fluorescencia en todos los canales de emisión. El desplazamiento espacial entre ambos canales debido a la aberración cromática se puede determinar mediante cuentas individuales súper posicionamiento y tiene que ser aplicada para la corrección de uno de los dos canales para todos los siguientes 2 colores imagen pares 10.
- Determinar el grado de bleedthrough donante con el uso de un SLB que contiene el fluoróforo donante FRET solo. También es factible el uso de las células T marcadas con FRET de donante en una bicapa lipídica con pMHC no marcado. Antecedentes se determina primero fuera del campo iluminado de vista y luego resta de ambos canales. De esta manera el ba promedio intensidades ckground corregida de dos correspondientes regiones de interés (canal de donantes I y I aceptador de canal) se determinan. Calcular el coeficiente de bleedthrough (BTC) como sigue:
 (ecuación 8)
(ecuación 8)
Nota: Esta BTC es una constante para un determinado colorante y el filtro de configuración combinación. - Calcular la imagen bleedthrough donante de FRET como sigue:
 (ecuación 9)
(ecuación 9) - Determinar aceptor cruzada excitación excitando una SLB contiene el fluoróforo aceptor FRET sola (por ejemplo, IE k / MCC-Alexa Fluor 647) primero con FRET luz de excitación de los donantes (por ejemplo., 514 nm) y luego con luz de excitación del aceptor (por ejemplo, 647 nm). Utilice imágenes de fondo-resta dentro del canal aceptor FRET para calcular el coeficiente transversal de excitación (CEC) como sigue:
ftp_upload / 53157 / 53157eq10.jpg "/> (ecuación 10) - Como la CCA depende de la intensidad del láser utilizado para la excitación de los donantes, determinar en cada día de medición. Utilice la CCA resultante de calcular la imagen generada exclusivamente a través de cross-excitación.
 (ecuación 11)
(ecuación 11) - Calcular la imagen FRET corregido para bleedthrough y transversal de excitación como sigue:
 (ecuación 12)
(ecuación 12)
Nota: La señal de FRET Absoluto (pero no el rendimiento FRET relativa) es sensible a la disociación del scFv H57 V de la membrana de células T TCR enlazado. Para evitar la pérdida excesiva de la sonda TCR-FRET, el objetivo de realizar mediciones a 37 ° C dentro de la primera 2 min después de la adición de las células T a la bicapa. Mediciones con cuantitativa (≥ 95%) etiquetado TCR solamente son posibles en o por debajo de 22,5 ° C dentro de la primera 3 min después deAdemás de las células T a la bicapa.
4. Individual molécula FRET mediciones
- Ajustar la potencia de ambos láseres para dar lugar a una intensidad de 1-5 kW / m 2 en la muestra. Para obtener más información, consulte Axmann et al. 4.
- Etiqueta de células T como se indica más arriba con una mezcla de etiqueta scFv V (5-9 piezas) y Cy3 / AF555 marcado scFv V (1 parte). Nota: Esta forma sólo una fracción de los TCR está marcado con el donador de FRET. Esto reduce el número de interacciones detectables, pero el ruido generado a partir de bleedthrough donante es también disminuyó significativamente (en aproximadamente el 5 medio a 10 medio), lo cual es crítico cuando la solución de molécula de FRET solo individuo eventos.
Nota: La disociación de la sonda H57 scFV desde el TCR no afecta a las mediciones, ya que se produce en un intervalo de tiempo mucho más grande (minutos a horas) que la disociación del TCR de destino a SLB pMHC (sub-segundo a segundorango). - Coloque una SLB con pMHCs AF647 marcado así como ICAM y B7 en la platina del microscopio y ajustar el enfoque para que la bicapa entra en la visión clara.
- Opcional: Inserte una abertura de rendija en la vía de excitación (como se muestra en Axmann et al 4.) Para enmascarar la mayoría de la campo de iluminación, excepto la sinapsis. De esta manera no blanqueadas IE k / MCC (C) -Alexa Fluor 647 FRET moléculas aceptoras pueden moverse en el área de la iluminación.
- Añadir células T decoradas H57 scFv a la bicapa (con tampón de formación de imágenes), y esperar hasta que las sinapsis aparecen en el campo de visión.
- Tome en rápida sucesión una secuencia de 10 a 20 conjuntos de imágenes utilizando la detección de 2 colores:
i1) de excitación 514 nm
i2) de excitación 647 nm - Exponga imágenes de 1 a 5 ms y adquirir como un conjunto de imágenes.
- Para evaluar la identidad de una sola molécula FRET eventos, aplique la misma corrección respecto bleedthrough donante y aceptor cruzada excitación. Por otra parte, sola molécula FRET eventos tienen que alinearse con moléculas aceptoras individuales y deben aparecer y desaparecer en un solo paso (véase también la Figura 7).
- Fuera de la tasa de determinación
- Grabe los rastros de una sola molécula FRET eventos para varios marcos de tiempo de adquisición.
Nota: En este ejemplo (en cursiva) la tasa de descuento entre el 5c.c7 TCR y IE k / K3 se mide a 25 ° C con cuatro tiempos diferentes de retardo (42 ms, 490 ms, 1007 ms, 1989 ms). - Lista FRET traza de acuerdo a sus longitudes traza como se muestra en la tabla 1.
- Convertir tabla 1 en una función de decaimiento acumulativa inversa (tabla 2) como se muestra (número de colores se han tomado de la tabla 1).
- Para normalizar la función de decaimiento resultante, dividir el número de trazas de la Tabla 2 por la suma de todos los restos en ese grupo particular. Trazar los valores normalizados contra el número de plazos. Cuando omitiendo el último marco de tiempo, que contiene un cero, las caries pueden ser leídosily equipado con una sola función exponencial (Figura 8A).
- Como se muestra en la Figura 8B, trazar el valor esperado lag)>, es decir, el inverso negativo del exponente de la función de la caries determinado anteriormente contra el t lag tiempo de retardo empleado (en este ejemplo: x = t lag = 0.042 s yy = lag)> = 1 / 0,662 = 1,511, x = 0.49 s e y = 1 / 0,902 = 1,101, x = 1.007 s e y = 1 / 1.131 = 0.884, x = 1.989 s e y = 1 / 1,591 = 0,629).
- Τ Fit apagado y blanquear> basado en la ecuación 3. Esto se puede hacer utilizando una función de ajuste no lineal de un programa de análisis de datos científicos tales como Origin.
Nota: El mejor ajuste se muestra en este ejemplo se obtiene un τ off de 2,12 +/- 0,23 s y un blanquear> de 1,53 +/- 0,06 seg. - Calcular el half vida de la interacción t 1/2 con 1/2 de t = τ off • ln (2) (en este ejemplo: 1,47 s).
- Grabe los rastros de una sola molécula FRET eventos para varios marcos de tiempo de adquisición.
- Determinación 2D-K D
- Determinar el factor de conversión C para el par de colorantes FRET empleado con el uso de la ecuación 6 y como se describe anteriormente (Figura 4A).
- Determinar los rendimientos FRET para microclusters TCR individuales o sinapsis enteros (Figuras 3B y 5).
- Utilizando la ecuación 4 converso todos los rendimientos FRET individuales en ocupaciones TCR (Figura 4C).
- Aplicar la ecuación 11 para convertir todas las ocupaciones de TCR en 2D-K D s. Como se indica más adelante, la unión sináptica es no homogénea. Una medida significativa para sináptica K D s es la mediana (indicado en rojo) de todos los microclusters medidos (Figura 4D).
- Cálculo de 2D-k en s
- Calcula k con la ley de acción de masas con k en k = off / valores KD KD y el k determinado experimentalmente apagado y.
Nota: La k sináptica apagado para el experimento mostrado en la Figura 4 (IE k / MCC interactuar con 5c.c7 TCR a 25 ° C) es 0,41 s -1. Por lo tanto la trama K D (Figura 4D) se puede convertir en ak en parcela como se muestra en la Figura 4E.
- Calcula k con la ley de acción de masas con k en k = off / valores KD KD y el k determinado experimentalmente apagado y.
Resultados
La grabación de calcio intracelular a través del tinte de calcio fura-2, así como el análisis celular subsiguiente para verificar la potencia estimulante y por lo tanto la funcionalidad de SLBS se muestran en la Figura 4. Como se hace evidente, los niveles de calcio se elevan en las células T (expresado como la normalizada relación fura-2 340nm / 380nm con el valor inicial es 1) inmediatamente tan pronto como se instalan en los SLBS estimulantes. Los niveles de calcio regresan a los niveles basales poco después de la adición de un anticuerpo que bloquea pMHCs de compromiso TCR y que termina la activación de células T.
La Figura 6 representa un experimento típico que implica la recuperación donante de FRET después del blanqueo aceptor, que se emplea para medir el rendimiento de FRET y que sirve para calcular los valores de 2D-K D (muestra en la Figura 4). Por favor, tenga en cuenta el aumento de la intensidad de los donantes de FRET, lo que representa TCR marcado a través de AF555, después de la ablación rápida y completa de la FRET unespecies cceptor (aquí: AF647 asociado con pMHCs). También es evidente la fuerte reducción en el canal de FRET, es decir, el canal de FRET aceptor de FRET en virtud de excitación del donante, aceptor de FRET después del blanqueo. La señal restante apenas visible corresponde a FRET bleedthrough donante. Rendimientos FRET dentro microclusters TCR individuales o sinapsis enteras se calculan en base a los valores de intensidad medidos indicados (Figura 6B).
La figura 7 representa una trayectoria y el tiempo transcurrido de una molécula solo evento FRET visible en dos plazos. Como se ha señalado anteriormente en la introducción tal comportamiento se debe tanto a la decadencia de sináptica TCR-pMHC vinculante y fotoblanqueo. Para discriminar entre estas dos contribuciones, los marcos experimentales tiempo de adquisición tienen que ser variado en duración: mientras photobleaching sigue siendo una constante, los cambios en FRET longitud evento trayectoria solamente son causados por la cinética de unión. Una cuantificación de tracelengths, w hich constituye la base para el cálculo de tarifas y fuera de blanqueo que se muestran en la Figura 7, se proporcionan en las Tablas 1 a 3.
Determinación de 2D-K D s requiere la grabación de mayor FRET rendimientos de FRET de donante TCR etiquetados. Con el uso de la constante C experimentalmente deducida (Figura 4), un rendimiento FRET medida para un microcluster TCR o toda una sinapsis se puede convertir en el TCR de ocupación a, es decir, la relación de los TCR pMHC-comprometidos y totales (Figura 4C) . Con densidades pMHC conocidos presentes en el SLB antes de la adición de la célula T, a valores se pueden aplicar para determinar los valores K 2D-D sinápticas (Figura 4D). En-las tasas pueden ser calculadas con la ley de acción de masas (2D-k on = 2D-k off / 2D-K D) del sináptica determinado fuera de ritmo y los valores 2D-KD.
1 "src =" / files / ftp_upload / 53157 / 53157fig1.jpg "/>
Figura 1. Esquema Esquema de la bicapa lipídica sistema compatible de vidrio plano (SLB). SLBS (A) están compuestos de POPC (de 90-99%) y el lípido sintético DGS Ni-NTA (1-10%) y se forman espontáneamente cuando las superficies de vidrio limpias se cargan con pequeñas vesículas unilaminares (SUVs) que consiste en los lípidos correspondientes. (B) Una vez formado, tales SLBS se pueden funcionalizar con porciones solubles marcada con polihistidina extracelulares derivados de pMHCs, coestimuladoras B7-1 proteínas y ICAM-1, proteínas de adhesión para servir como APCs para las células T. Para obtener más información sobre cómo preparar SLBS consulte Axmann et al., 4. Haga clic aquí para ver una versión más grande de esta figura.

Figu re 2. Förster de energía de resonancia a base de Transferencia de ensayo para cuantificar la unión TCR-pMHC in situ. (A) Una estructura compuesta de un TCR complejado con un fragmento de una sola cadena H57 acoplar un pMHC ilustra el enfoque basado en FRET descrito en este documento. Tenga en cuenta la corta distancia de unos 41 bis que separa los dos fluoróforos correspondientes sometidos FRET. Sitios aceptores para fluoróforo-maleimidas se indican en verde y rojo. (B) El principio de la detección de interacciones TCR-pMHC in situ se ilustra. Sólo scFv V -decorated TCR y pMHCs (aquí IE k), que forman complejos específicos, dar lugar a una señal FRET medible. Haga clic aquí para ver una versión más grande de esta figura.
"/>
Figura 3. Los cromatogramas de la última etapa de filtración en gel dando lugar a monoméricas scFv V s y cargadas con péptido IE k -2x6H moléculas. X-ejes representan volumen de retención en ml, ejes Y indican la absorbancia a 280 nm en unidades arbitrarias (AU) . (A) sitio-específica H57 scFv V marcada con Alexa Fluor 555 maleimida se sometió a cromatografía S75 para separar colorante sin reaccionar de la proteína (paso 1.2.5). Las fracciones correspondientes al intervalo de retención 14 to15 ml (líneas de trazos) representan etiquetados monomérica H57 scFv V. (B), es decir k moléculas -2x6H complejados con el ANP-péptido espacio titular de UV-escindible había sido irradiada con UV, se incubaron con forma específica de sitio Alex 647 péptido marcado con maleimida y finalmente se sometió a cromatografía S200 para separar la proteína de péptido libre (etapa 1.1.2.4). El intervalo entre las líneas de trazos contiene correctamente plegada y pMHCs monoméricas. (A, B) 0,7 ml de la muestra se aplicó a la columna en el inicio de la ron (0 ml punto). Las fracciones recogidas se concentraron. La proporción de proteínas de colorante se determina por photospectrometry antes de la diálisis contra PBS / glicerol al 50% (para el almacenamiento a -20 °). Por favor, haga clic aquí para ver una versión más grande de esta figura.
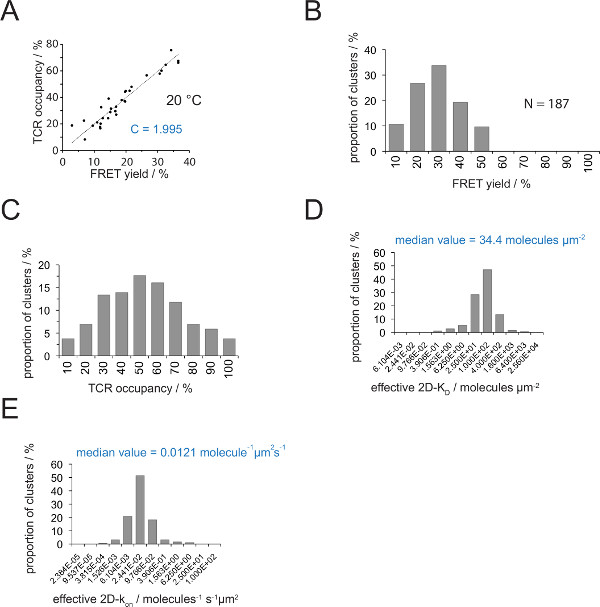
Figura 4. Determinación de 2D-K D s y 2D-k en s. (A) La correlación entre el rendimiento FRET según lo determinado por la recuperación de donante después se midió la decoloración aceptor y la ocupación TCR experimentalmente. Ocupación TCR se puede determinar para microclusters individuales TCR como se explica en la sección 4.2. Un ajuste lineal de los datos se muestran por la línea, la pendiente de la cual es igual a la relación entre C TCRocupación y el rendimiento FRET. C es una constante específica para el sistema de FRET y los fluoróforos (aquí Cy3 y Cy5) empleados. En este ejemplo se produjo 1,988. (B) FRET datos de rendimiento se determinaron para microclusters TCR individuales (N = 187, temperatura = 24 ° C) a través de la recuperación de los donantes de la decoloración de aceptor. Números debajo de las barras de histograma indican el límite superior dentro del intervalo. (C) La conversión de los datos mostrados en (B) multiplicando medido FRET rendimientos con la constante C determina en (A). Números siguientes barras indican el límite superior dentro del intervalo. (D) Histograma (semi-logarítmica, base = 4) que representa la distribución de 2D-K D s medido para microclusters TCR individuales. La mediana de 2D-K D se indica en azul. Números siguientes barras indican el límite superior dentro del intervalo. (E) El histograma se muestra en (D) se convierten intoa 2D-k en -histogram (semi-logarítmica, base = 4) que utiliza el k sináptica fuera de 24 ° C (0.41 s -1). La mediana de 2D-k determinado en el valor se indica en azul. Los datos fueron publicados originalmente en Huppa et al. 2 y se visualizan aquí en un nuevo formato. Por favor haga clic aquí para ver una versión más grande de esta figura.

Figura 5. validación funcional de SLBS emplea para la estimulación de células T y formación de imágenes. (A) TCR transgénicos blastos de células T cargadas con fura-2 se enfrentaron con estimuladora SLB albergar pMHCs antigénicos, ICAM-1 y B-7. Celular fura-2 emisiones entusiasmado a 340 nm y 380 nm, así como imágenes DIC se registraron. Como se ha indicado, valores de la relación de las intensidades de emisión emocionada en el 340 y 380 nm se muestran en el panel derecho. La adición de pMHC anticuerpos de bloqueo 14 min en el plazo experimental resultó en una disminución en los niveles de calcio intracelulares comparables a la de T en reposo células. (B) Un perfil temporal típico de relaciones medias Fura-2 en las células T en contacto SLBS estimuladoras se caracteriza por un aumento inicial de un calcio intracelular que es de 2 a 4 veces mayor en comparación a la de las células T no activadas o células T privadas de antígeno después del bloqueo mediado por anticuerpos. Círculos verdes indican los puntos de tiempo se ilustra en (A). Por favor, haga clic aquí para ver una versión más grande de esta figura.
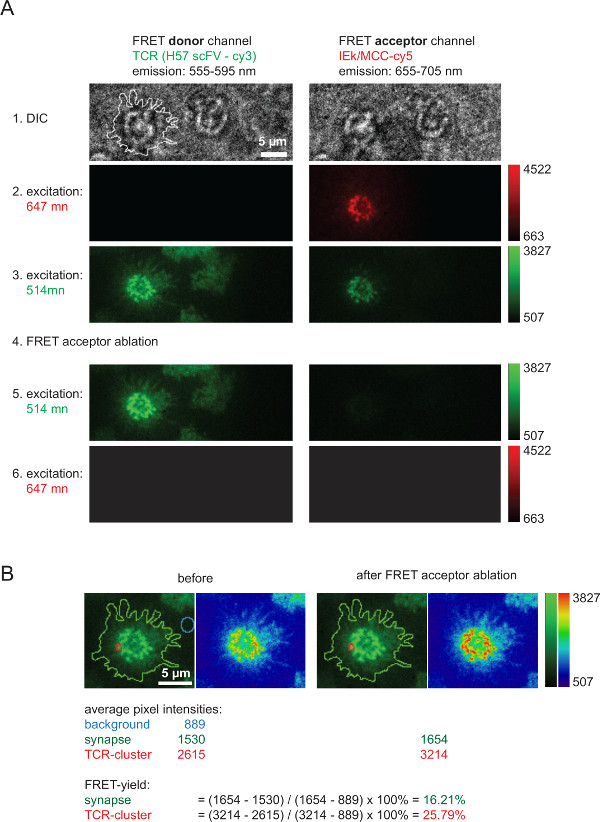
Figura 6. granel FRET rendimientos, medida a través de la recuperación del donante FRET después del blanqueo FRET aceptora. (A) mostrado es un ejemplo de un típico FRET-sináptica de medición. Como se indica en la izquierda y en la parte superior una serie de imágenes fue adquirida con el uso de un divisor de haz de emisión que da lugar a un donante de FRET y un canal aceptor FRET (para información más detallada sobre los divisores de haz se refieren a Axmann et al 4). La línea se muestra en la imagen DIC izquierda indica el límite de la sinapsis de células T. Tenga en cuenta la pérdida de intensidad dentro del canal aceptor de FRET, así es el aumento de la intensidad en el canal de donante de FRET después de FRET aceptor de blanqueo (paso 4). (B) FRET eficiencias pueden ser cuantificados como se indica para las regiones sinápticas individuales o para sinapsis enteras. Para la inspección, las imágenes antes y después de FRET aceptora blanqueo se muestran con el uso de dos tablas de búsqueda (LUT, verde y física). Por favor, haga clic aquí para ver una versión más grande de esta figura.
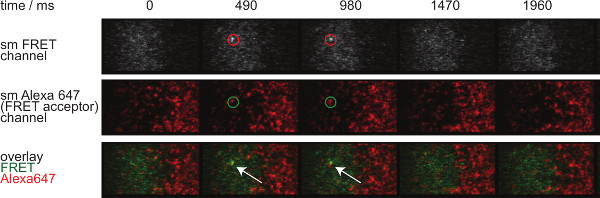
Figura 7. molécula individual FRET eventos aparecen y desaparecen pasos insingle y están perfectamente alineados con un solo fluoróforo aceptor FRET. Se muestra el lapso de tiempo de la molécula solo evento FRET. Las imágenes fueron adquiridas mediante una cámara EMCCD retroiluminado. Por favor haga clic aquí para ver una versión más grande de esta figura.
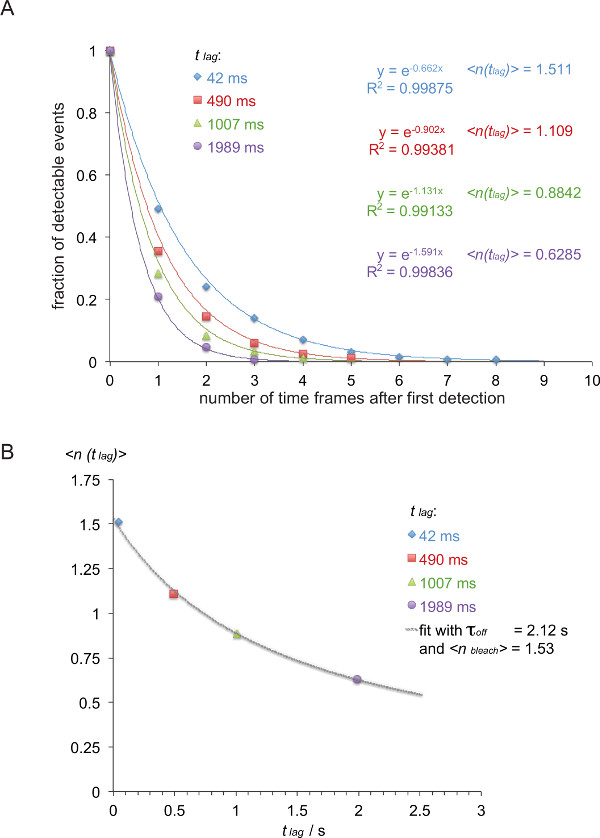
Figura 8. La determinación de τ off = 1 / k fuera de trayectorias smFRET medidos. (A) Los normalizados sumas acumuladas de las señales FRET observables (derivados de H57 scFv V -AF555 decoradas 5c.c7 TCR transgénico de blastos de células T que reconoce IE k / K3-AF647 a 24 ° C) durante cuatro retardos diferentes de tiempo (42 ms, 490 ms, 1007 ms, 1.989 mseg) se representa como una función del número total de observaciones. Funciones de ajuste mono-exponencial dan lugar a que corresponde el inverso negativo de los valores esperados lag)>. (B) Expectativa valores se representaron frente retrasos t lag y equipados con la ecuación lag)> = τ off / {(t off / blanquear>) + t lag} para dar τ y fuera blanquear>. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La medición de las interacciones proteína-proteína in situ es muy deseable, especialmente cuando se trata de interacciones de baja afinidad tales como TCR-pMHC de unión 11. Esto se debe a que la tasa en, así como la estabilidad de tales interacciones se ven influidas significativamente por las circunstancias particulares en las que la unión se lleva a cabo. Enfoques de imagen basados en FRET mínimamente invasivos son, pues, en principio, perfectamente adecuado para este tipo de tareas, sin embargo, implican una serie de obstáculos que primero se deben superar. El ruido generado por la autofluorescencia celular limita la sensibilidad de las mediciones y por lo tanto se debe mantener en un mínimo. Microscopía TIRF sirve esta necesidad muy bien 12, sino que requiere la funcionalización de vidrio toboganes, idealmente en forma de un plano de lípidos bicapa apoyado por el vidrio decorado con proteínas de elección 13-15. Otra ventaja de un enfoque en parte reconstituyente es que los socios de FRET-bicapa residente recombinantes pueden ser mucho mel mineral fácilmente etiquetados en un sitio específico de manera cuantitativa y racional con fluoróforos más pequeños y más brillantes de lo que sería posible con proteínas expresadas en la superficie de células. TCR etiquetados con SCF recombinante V s, que no influyen en el reconocimiento de células T, como se ha probado previamente 2. Además, la composición de proteínas de la SLB, por ejemplo la densidad de pMHCs y la elección de factores accesorios se puede ajustar a las propias necesidades específicas. Hemos realizado previamente experimentos con diferentes densidades de pMHCs estimulantes, pero no hemos detectado diferencias significativas en 2D-k off y 2D-K D 2.
Hasta ahora aquí el reconocimiento de moléculas del MHC de clase II se ha tratado solamente, principalmente debido a la naturaleza de su hendidura de unión de péptidos, que está abierto en ambos extremos y por lo tanto tiene capacidad para péptidos más grandes, incluyendo un enlazador para la unión fluoróforo. En algunos casos como enfoque también podría funcionar para el etiquetado MHC class I moléculas 16, pero mucho cuidado se debe tomar para verificar su uso en experimentos. La sensibilidad de las células T hacia antígenos, que pueden ser medidas a través de ensayos de proliferación de células T, así como el cinética de unión a pMHC-TCR como se mide in vitro por resonancia de plasmón de superficie no debe ser afectada por la adición del enlazador y fluoróforo a el péptido. Alternativamente, las moléculas MHC de clase I puede marcarse a sí mismos de una manera específica de sitio con la introducción de una cisteína no apareado dentro de la secuencia de la cadena pesada (observaciones no publicadas).
Con el uso de sondas moleculares apropiados cualquier interacción proteína-proteína sináptica puede en principio ser estudiado de una manera descrita en este documento. Dichas sondas, por ejemplo, SCF V s o proteínas diseñadas Ankyrin Repetir (DARPins) 17, deben ser monovalentes y deben unirse a su objetivo de forma estable sin afectar a la interacción de los intereses. Por supuesto, informatio estructuraln es altamente deseable para el diseño racional de la sonda pero no es absolutamente necesario. Al establecer un nuevo par de socios FRET, se recomienda para registrar y analizar FRET en mayor primero. Los sitios de fijación de la etiqueta se pueden variar considerablemente para maximizar la señal de FRET y también para verificar que los rendimientos medidos FRET difieren en función de la distancia entre tinte. Una vez que el sistema está optimizado, sola molécula FRET señales pueden ser grabadas mediante la limitación del etiquetado de la pareja FRET alta abundancia a 10-30% y blanqueo de la pareja FRET baja abundancia hasta que moléculas individuales se pueden resolver en el campo de la iluminación.
Por último, pero no menos importante, hay que señalar que SLBS aproximar algunos, pero no todos los aspectos de una membrana plasmática fisiológica. Cualidades tales como curvatura de la membrana y la flexibilidad, la compartimentación de dominio, los reordenamientos del citoesqueleto y la motilidad celular, así como una alta variedad de proteínas de la membrana expresada en la superficie no están representados por SLBS pero podrían influir en tse procesa bajo investigación. Tendrá que ser invertido para establecer modalidades de imagen que permiten monitoreo interacciones proteína-proteína con resolución única molécula en las sinapsis fisiológicas, que son inaccesibles a las imágenes TIRF mucho esfuerzo.
Divulgaciones
The authors declare that they have no competing financial interest.
Agradecimientos
MA fue apoyado por una beca de Schrödinger del Fondo austríaco Ciencia (FWF, J3086-B11) y gracias al Max-Planck-Sociedad para el apoyo financiero y administrativo. GS y JH fueron apoyados por el Fondo de Ciencia y Tecnología de Viena (WWTF, LS13-030).
Materiales
| Name | Company | Catalog Number | Comments |
| LB-media | Fisher Scientific | 10000713 | bacterial expression |
| Sf900 II | Life Technologies | 10227402 | insect cell media for baculo virus production |
| Insect-XPRESS with L-glutamine (Lonza) | Fisher Scientific | 10564038 | insect cell media for baculo virus expression |
| Sf9 cells | Life Technologies | 11496-015 | cells for virus production and expansion |
| High Five Cells | Life Technologies | B855-02 | cells for potein expression |
| LB-media | Fisher Scientific | 10000713 | bacterial expression |
| Centramate System | Pall | protein concentartion from large volumes | |
| Centramate cassette 10kDa cutoff | Pall | OS010T12 | protein concentartion from large volumes |
| Amicon Ultra-15 Centrifugal Filter Units | EMD Millipore | UFC900308 | protein concentartion |
| Amicon Ultra-4 Centrifugal Filter Units | EMD Millipore | UFC800308 | protein concentartion |
| Amicon Stirred Ultrafiltration Cell Model 200 mL | EMD Millipore | 5123 | protein concentartion |
| Äkta pure 25L | GE Healthcare | 29-0182-24 | protein purification |
| Superdex 200 10/300 GL | GE Healthcare | 17-5175-01 | protein purification |
| Superdex 75 10/300 GL | GE Healthcare | 17-5174-01 | protein purification |
| Mono Q 5/50GL | GE Healthcare | 17-5166-01 | protein purification |
| Ni Sepharose 6 Fast Flow | GE Healthcare | 17-5318-01 | protein purification |
| Tricorn 10/20 column | GE Healthcare | 28-4064-13 | protein purification |
| Gilson HPLC system | Gilson | purificationof fluorochrome-coupled peptides | |
| Pursuit XRs C18, 5 µm particle size, 21.2*250mm column size | Agilent | A6000250X212 | purificationof fluorochrome-coupled peptides |
| Pursuit XRs C18, 5 µm particle size, 21.2*50 mm column size | Agilent | A6000050G212 | purificationof fluorochrome-coupled peptides |
| Tricorn 10/20 column | GE Healthcare | 28-4064-13 | protein purification |
| Gilson HPLC system | Gilson | purificationof fluorochrome-coupled peptides | |
| Pursuit XRs C18, 5 µm particle size, 21.2*250mm column size | Agilent | A6000250X212 | purificationof fluorochrome-coupled peptides |
| Pursuit XRs C18, 5 µm particle size, 21.2*50 mm column size | Agilent | A6000050G212 | purificationof fluorochrome-coupled peptides |
| Cy3 maleimide | GE Healthcare | PA23031 | site-specific protein labeling via mutant unpaired cysteines |
| Cy5 maleimide | GE Healthcare | PA25031 | site-specific protein labeling via mutant unpaired cysteines |
| Alexa Fluor 555 C2 Maleimide | Life Technologies | A-20346 | site-specific protein labeling via mutant unpaired cysteines |
| Alexa Fluor 647 C2 Maleimide | Life Technologies | A-20347 | site-specific protein labeling via mutant unpaired cysteines |
| Fura-2, AM, cell permeant | Life Technologies | F-1221 | calcium-sensitive dye for cell labeling |
| dimethyl sulfoxide | Sigma Aldrich | 151874 | for dissolving fura-2 am |
| Hank's Balanced Salt Solution plus calcium/magnesium | Fisher Scientific | 10225362 | imaging buffer |
| PBS | Life Technologies | 14190-136 | |
| Bovine Serum Albumin lyophilized powder | Sigma Aldrich | A2153 | supplement for imaging buffer |
| 14-4-4S antibody | affimetrix eBioscience | 14-5980-81 | blocking antibody for H2-I-Ek (recognized by the 5c.c7, 2B4 and AND TCR) |
| 5 ml polypropylene round-bottom tube | Becton Dickinson | FALCON 352063 | |
| 0.22 μm Ultrafree-MC centrifugal filter unit | EMD Millipore | UFC30GV0S | |
| Syringe filter 0.2µm | Millipore | GVWP04700 | |
| TetraSpeck Microspheres, 0.1 µm, fluorescent blue/green/orange/dark red | Life technologies | T-7279 | |
| Microscope for fura-2-based calcium measurements | LEICA | DMI4000B | |
| Microscope for (single molecule) FRET measurements | LEICA/ZEISS/NIKON/OLYMPUS | for details please refer to parallel JoVE contribution by Axmann et al. | |
| planar supported lipid bilayers | for details please refer to parallel JoVE contribution by Axmann et al. | ||
| RPMI 1640, with L-Glutamine | Life Technologies | 11554416 | T-cell media |
| non-essential amino acid 100X | Hyclone | SH30238.01 | T-cell media supplement |
| penicillin/streptomycin/L-glutamine 100x | Life Technologies | 12000226 | T-cell media supplement |
| 2-mercaptoethanol | Sigma Aldrich | M6250 | T-cell media supplement |
| mouse interleukin-2 recombinant protein | BPS Bioscience | 90185-B | T-cell media supplement |
| Research Grade Fetal Bovine Serum | Hyclone | SV30160.03 | T-cell media supplement |
| Origin (analysis program) | OrigenLab | http://www.originlab.com/ | non-linear fitting of two parameters (tauoff, [ntlag]) |
Referencias
- Garcia, K. C., Adams, J. J., Feng, D., Ely, L. K. The molecular basis of TCR germline bias for MHC is surprisingly simple. Nat Immunol.. 10, 143-147 (2009).
- Huppa, J. B., et al. TCR-peptide-MHC interactions in situ show accelerated kinetics and increased affinity. Nature.. 463, 963-967 (2010).
- Huppa, J. B., Davis, M. M. The interdisciplinary science of T-cell recognition. Advances in immunology.. 119, 1-50 (2013).
- Axmann, M., Schuetz, G. J., Huppa, J. B. Single Molecule Microscopy on Planar Supported Bilayers. Journal of Vizualized Experiments J. Vis. Exp.. 101, e53158(2015).
- Xie, J., et al. Photocrosslinkable pMHC monomers stain T cells specifically and cause ligand-bound TCRs to be preferentially transported to the cSMAC. Nat Immunol. 13, 674-680 (2012).
- Jares-Erijman, E. A., Jovin, T. M. FRET imaging. Nat Biotechnol. 21, 1387-1395 (2003).
- Toebes, M., et al. Design and use of conditional MHC class I ligands. Nat Med. 12, 246-251 (2006).
- Tsumoto, K., et al. Highly efficient recovery of functional single-chain Fv fragments from inclusion bodies overexpressed in Escherichia coli by controlled introduction of oxidizing reagent--application to a human single-chain Fv fragment. J Immunol Methods. 219, 119-129 (1998).
- Ruegg, U. T., Rudinger, J. Reductive cleavage of cystine disulfides with tributylphosphine. Methods Enzymol. 47, 111-116 (1977).
- Ruprecht, V., Brameshuber, M., Schütz, G. J. Two-color single molecule tracking combined with photobleaching for the detection of rare molecular interactions in fluid biomembranes. Soft Matter. 6, 568-581 (2010).
- Dustin, M. L., Bromley, S. K., Davis, M. M., Zhu, C. Identification of self through two-dimensional chemistry and synapses. Annu Rev Cell Dev Biol. 17, 133-157 (2001).
- Axelrod, D. Cell-substrate contacts illuminated by total internal reflection fluorescence. The Journal of cell biology. 89, 141-145 (1981).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285, 221-227 (1999).
- Kaizuka, Y., Douglass, A. D., Varma, R., Dustin, M. L., Vale, R. D. Mechanisms for segregating T cell receptor and adhesion molecules during immunological synapse formation in Jurkat T cells. Proc Natl Acad Sci USA. 104, 20296-20301 (2007).
- Varma, R., Campi, G., Yokosuka, T., Saito, T., Dustin, M. L. T cell receptor-proximal signals are sustained in peripheral microclusters and terminated in the central supramolecular activation cluster. Immunity. 25, 117-127 (2006).
- Purbhoo, M. A., Irvine, D. J., Huppa, J. B., Davis, M. M. T cell killing does not require the formation of a stable mature immunological synapse. Nat Immunol. 5, 524-530 (2004).
- Binz, H. K., Stumpp, M. T., Forrer, P., Amstutz, P., Pluckthun, A. Designing repeat proteins: well-expressed, soluble and stable proteins from combinatorial libraries of consensus ankyrin repeat proteins. J Mol Biol. 332, 489-503 (2003).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados