Method Article
测量TCR-的pMHC结合
摘要
This manuscript describes how to conduct (single molecule) Förster Resonance Energy Transfer (FRET)- based assays to measure the binding dynamics between T-cell antigen receptor (TCR) and antigenic peptide-loaded MHC molecules as they occur within the immunological synapse of a T-cell in contact with a functionalized planar supported lipid bilayer.
摘要
T-cells are remarkably specific and effective when recognizing antigens in the form of peptides embedded in MHC molecules (pMHC) on the surface of Antigen Presenting Cells (APCs). This is despite T-cell antigen receptors (TCRs) exerting usually a moderate affinity (µM range) to antigen when binding is measured in vitro1. In view of the molecular and cellular parameters contributing to T-cell antigen sensitivity, a microscopy-based methodology has been developed as a means to monitor TCR-pMHC binding in situ, as it occurs within the synapse of a live T-cell and an artificial and functionalized glass-supported planar lipid bilayer (SLB), which mimics the cell membrane of an Antigen presenting Cell (APC) 2. Measurements are based on Förster Resonance Energy Transfer (FRET) between a blue- and red-shifted fluorescent dye attached to the TCR and the pMHC. Because the efficiency of FRET is inversely proportional to the sixth power of the inter-dye distance, one can employ FRET signals to visualize synaptic TCR-pMHC binding. The sensitive of the microscopy approach supports detection of single molecule FRET events. This allows to determine the affinity and off-rate of synaptic TCR-pMHC interactions and in turn to interpolate the on-rate of binding. Analogous assays could be applied to measure other receptor-ligand interactions in their native environment.
引言
的T细胞是如何识别抗原的一个更根本的了解,需要寻找合适的地方,那就是,T细胞和APC之间形成的免疫突触内。这里,分子结合动力学不仅受到所涉及但相互作用配偶固有的生化特性决定上取决于细胞参数,其包括蜂窝力,膜结构和膜蛋白之间的横向相互作用以及突触特定几何约束在很大程度上3。生物化学方法在分辨能力,因为它们必要涉及的突触膜中的至少一个的中断限制。基于这个原因,基于FRET的成像方法的开发是为了监测TCR结合于抗原pMHCs 2。这里的T细胞的装饰用重组和位点特异性标记的TCRβ反应性单链抗体片段(SCF V)和面对计划芳玻璃支持的脂质双层(SLBs中),其怀有MHC II型分子装载有荧光标记的抗原性肽,共刺激分子和粘附蛋白。染料标记的TCR和染料标记的pMHC导致FRET,它可以在体和单分子水平通过全内反射荧光(TIRF)显微镜进行监测突触之间的结合。
在本文中它被详细地说明了如何利用SLBs的用于测定T细胞突触,通过功能T细胞钙流测定法验证它们的完整性,进行FRET散装和带单分子灵敏度的测量,并分析所获得的数据。建议是提供给生产所需的双层功能化符合正常的蛋白质。有关双层形成并设置一个合适的TIRF显微镜请参阅公布背对背4的附加 公共接入朱庇特的出版物的更具体的信息。
帐篷"> SLBs的性质可官能的SLBs可以从含有两个脂质1-棕榈酰-2-油酰基-sn- gylcero -3-磷酸胆碱单层囊泡(SUV的)可以容易地生成(简称:POPC,90-99%)和1,2- dioleoyl- SN -甘油基-3 - {〔N-(5-氨基-1-羧基戊基)亚氨基二乙酸]琥珀酰基}(简称:DGS NTA镍,1-10%)。 SUV的铺展在干净的载玻片,以形成一个连续的平面双层4。 DGS-NTA-Ni表面供应通过多组氨酸介导的复合形成与合成含NTA镍头组(图1A)到锚多组氨酸标记的蛋白。为稳定的缔合人们通常替换粘附蛋白,ICAM-1和共刺激分子B7-1与含12个组氨酸(ICAM-1-12H,B7-1 -12H)一个标签的天然跨膜结构域和胞质尾(图1B) 。的肽负载II类分子的IEķ包含两个膜包埋(α和β)的多肽链秒。两条链的跨膜/胞质域必须被替换为含有6个组氨酸的每个(IEķα6Hβ6H或IEķ-2x6H)的标签。作为替代,延长了α链与12组氨酸和离开的β链标记(引起的IEķα12Hβ0H或IEķ-12H)的胞外域产生了令人满意的结果(图1B)。
pMHCs的位点特异性标记
能够测量FRET收率转换成有意义的平衡结合常数,重要的是为了化学计量和位点特异性标记的pMHC。这可以通过加载到重组组氨酸标记的MHC II型分子2,5的肽结合裂隙的合成肽的化学标记来实现。为该肽包含T细胞表位作为瓦特的所有残ELL作为短C-末端接头(GGS),然后加入半胱氨酸(例如,在蛾细胞色素C(MCC)肽ANERADLIAYLKQATK- GGSC,连接体被标记为粗体)。此半胱氨酸是用来与使用马来酰亚胺染料衍生物的化学计量标记肽。此时应加倍小心被用于核查定量染料耦合到含有半胱氨酸的肽。 HPLC纯化的肽 - 染料加合物的建议,并已应遵循的电喷雾质谱。任何记录的质量相当于肽离析物(不含染料)反映不完整的标签。如果这是真的,高效液相色谱纯化肽应进行连续两轮染料标记,直到标签被认为是定量的。需要注意的是,应避免MALDI-TOF质谱法,因为这方法涉及激光辐射样品电离。这种治疗崩解所附敏感的荧光团前肽质量被读出,从而underrepre货物内度染料结合的。
细胞结合的TCR与使用单价单采购商寻找V片段间接尚未站点特定的标签
它仍然具有挑战性的附加染料与细胞活细胞表面相关蛋白以位点特异性方式。为了克服这一障碍的表面暴露的TCR,从TCRβ反应性单克隆抗体H57-197 2的基因单价单链形式(SCF V)已建成。这种抗体与TCR复合物的晶体结构允许合理设计的一个版本,其中,在靠近所述的MHC相关肽(其中对相应FRET伙伴染料附着)的C末端的丝氨酸残基取代一个半胱氨酸残基。这种突变的半胱氨酸然后用作受体染料缀合( 图2)。
方法来记录FRET
核苷酸">批量FRET的值是最适合于验证所选间染料距离之间的关系,并FRET在此TCR-的pMHC测定结合系统2的效率。另外,本体的FRET测量表明突触TCR-的pMHC亲和力的定性和定量的差异(见下文和协议第3.2节)。各种方法定量FRET效率在文献6相继出台。在这篇文章中FRET是通过记录(一)供体恢复受体漂白后,并通过
(二)致敏FRET受体发射。
第一种方法(一)需要使用FRET受体可以很容易地光漂白,和一个供体,这是相当耐光的。此外,它保证了光漂白受体不再能够淬火的供体荧光的是重要的。作为同一检测通道(供体)用于定量,不校正因子的D无色差,必须考虑,这使得这一方法简单,可靠。然而,定量测量不能重复同一标本点和改变FRET不能记录随时间。避免因分子扩散或细胞运动快速漂白步骤的目的应该是为,最大限度地减少了第一FRET供体(受体漂白之前)和第二FRET供体的图像采集(FRET受体漂白后)之间通过的时间的效果。它是建议采用的FRET受体激发波长的强大的激光光源,以最小化照明和漂白次。
相反,在致敏FRET发射测量(B)的方法的FRET供体是兴奋和FRET受体的排放量在FRET受体通道被观察到。变化FRET受体信号可以被记录随着时间的推移,但FRET供体排放到红移受体通道(Termed bleedthrough),并通过供体激发FRET受体交叉激发必须准确地确定,并从记录的FRET受体通道中扣除。对于此相应FRET供体和受体的FRET图像必须在空间上对准。
检测单分子(SM)FRET事件
与使用的激光器作为激发源,一个灵敏的照相机和噪声衰减的TIRF显微镜单荧光团的荧光,可以很容易地追查随时间。类似是真正的分子间smFRET事件的检测。然而,并发症可通过FRET供体bleedthrough和交叉激发FRET受体引起的,因而非常小心先后在smFRET实验调整荧光密度时才能作出。
在下面提供的协议(协议第4部分)的T细胞受体被选为FRET供体中高丰度和的pMHC如FRET受体中低丰度。为了减轻FR的ET供体bleedthrough充分,装饰用荧光SCF V和与非荧光SCF V中的电阻温度系数的90-70%的TCR的10-30%。这里的FRET受体通道被选为单分子信道,因为它是共焦与单分子FRET通道。这有助于对齐smFRET事件与单个分子的FRET受体,它是smFRET验证的基础。
通过smFRET测量提取突触离速率
两者的光漂白FRET供体和受体的FRET必须占提取的从单分子的相互作用FRET痕迹半衰期时为。可观察到的FRET的信号在其外观为单一供体-受体对的N开头的编号(0)是由两个解除绑定的受体-配体复合物和漂白的随时间减小。在给定时间N(叔)尚存复合物的数量可以在数学上表示如下:

在光漂白术语EXP(-t /τ 漂白剂)的时间t通过观测数 n的即照射过程中漂白只发生在产品和照明时间 t 生病由于非连续的,离散的观察模式(描述)。内动力学术语EXP-(吨/τ 关)的时间 t的观测数 n的乘积,时间t 滞后单个FRET观察(即,动力学解绑定连续发生)。等式1可以表示为:
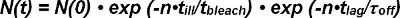
术语τ 漂白剂 /τ 病 DES直到漂白发生,并且定义了它的指数函数的期望值漂白 > cribes观测次数。公式2可以简化如下:

帧的数量N(t)能够以可观察FRET的事件的期望值的滞后)>后时间 t是直接从实验确定。这取决于所选择的实验中观测( 吨滞后)和未知值τ 关(的离速率K掉的倒数)之间可设置的时间和的漂白 >,观测数的期望值漂白发生之前。
因此,期望值滞后)>在 t的至少两个值的计算滞后使得实验测定漂白 >和 τ 关闭。
通过基于FRET的测量,提取突触2D-K D取值
测量TCR占用一个, 即 ,结合的TCR和TCR的总之间的比率,是中央的决定突触2D-K D取值 。根据等式4这个术语是成正比的测量FRET收率只要TCR的充当FRET供体和pMHCs作为FRET受体。

用= TCR入住,C =转换系数
C是常数 ,其取决于FRET的系统上和所使用的荧光团。它可以通过实验确定,如下所示。一个可以根据式(5)被转换成2D-K d出现的TCR配体之前,加入T细胞以双层的初始密度是已知的。这是因为SLB-连接蛋白的高流动性,也因为SLBs中提供配2的几乎取之不尽,用之不竭的水库。

与[ 初始的pMHC]在加入T细胞=的pMHC的初始密度
由于等式4和5中现在可以很容易地确定TCR和的pMHC之间的突触2D- 杀敌 。这是最可靠的完成基于受体漂白(见协议第3.1节)后,供体恢复FRET测量。
然而,为了测量C中的 FRET 强度 I FRET之间的关系(校正为背景,FRET供体bleedthrough和FRET受体交叉激发)和TCR占用一个已被确定。对于这一点,需要知道的单TCR相关FRET供体荧光团(例如Cy3标记或AF555)SM的平均荧光强度之间的比率R 我FRET供体和单分子的平均强度FRET事件SM 我FRET。 - [R取决于FRET系统有问题,排放过滤器和摄像头用于荧光检测的。
TCR的占用一个然后可以根据等式6来直接测定。

与R = SM我FRET供体 / SM我FRET
R的确定为1.45的H57 scFv-的Cy3 /的pMHC-Cy5的系统导致:
A =散装我FRET /散装我TCR-的Cy3•1.45
该TCR占用一个和FRET收益率之间的关系可以用FRET供体决定恢复受体漂白后的年。对于此两个参数绘制对彼此为一些TCR性微所示的线性拟合的图4A .The斜率指示转换因子 C(由方程4)。
这表现在图4A中,C量为(a)该H57 SCF v -输出的Cy3 /的pMHC-Cy5的FRET体系和(b)施加的显微镜系统配置到1.995。该TCR占用一个可以很容易地推断如下:
TCR占用一个= FRET产生•1.995
研究方案
1.蛋白生产
1.1。双层驻留蛋白:B7-1,ICAM-1,的pMHC(例如,IE K /肽)
- B7-1 -12H,ICAM-1-12H
- 明示B7-1-12H和使用杆状病毒表达系统在高数量的分泌天然蛋白质的ICAM-1-12H构建体。
- 净化从通过的Ni-NTA亲和层析培养上清,接着的MonoQ阴离子交换色谱法和S200中大小排阻层析的蛋白质。
- 标记与胺 - 反应性染料如的Alexa Fluor 488(或FITC),的Alexa Fluor 555(或Cy3标记),的Alexa Fluor 647(或Cy5的)的NHS琥珀酰亚胺基酯制剂的纯化的蛋白质的一个等份。
- 后S200大小排阻层析通过比较蛋白质的吸收在280nm和染料的吸收在488nm(的Alexa Fluor 488,FITC),555或552 nm的确定根据染料制造商的规格单体蛋白质的标记程度(的Alexa Fluor 555或Cy3的)或647纳米(的Alexa Fluor 647或Cy5的)。
注意:此比值以后将需要从色素标记蛋白质的堆积荧光信号确定对SLB的蛋白质的密度。 - 存储未标记和荧光团标记的蛋白质在-20℃下在PBS中加50%甘油中。
- 的pMHC(这里:IEķ-2x6H或IEķ-12H)
- 从在一个便宜得多紫外线裂解肽的替代品,它可以在以后进行定量交换选择5,7的荧光团共轭的肽的存在下在大肠杆菌中表达的包涵体再折叠的MHC II类。
- 纯化重折叠的pMHC复合物通过标准技术(的Ni-NTA亲和层析,的MonoQ阴离子交换层析,S200凝胶过滤)。
- 更换紫外裂解肽荧光肽5,7。
- 净化单体荧光的pMHC复合物˚Finally经S200凝胶过滤。的代表性色谱图示于图3。
- 分光光度法验证定量肽负载。
- 商店的蛋白质在-20℃在PBS / 50%甘油中。
1.2。单链抗体片段(SCFνs的 ),引入半胱氨酸的位点特异性标记生成
- 从在大肠杆菌中表达的包涵体再折叠SCFνs的 。在这里,设计由津本等人8的协议之后,其中包涵体首先在6M的盐酸胍的展开,充分还原,然后再折叠在一周的过程中,通过逐渐降低的蛋白质 - 展开氯化胍的浓度。
- 利用分子过滤器单位的10 kDa的截留分子量集中正确折叠SCF 诉
- 纯化浓缩物通过S200凝胶过滤。
- 标签单体SCF V在0.05毫三(2-羧乙基) 膦 (TCEP)的Alexa Fluor 647纯化后立即的存在。进行标记反应最好在蛋白质的摩尔比:染料的不超过1:2在RT不超过2小时以上。
注:TCEP是基于含磷还原剂和马来酰亚胺在这些浓度9没有反应。它可以因此是标记反应保持不成对巯基减少,直到它与染料 - 马来酰亚胺衍生物反应期间存在。 - 净化终于通过S75凝胶过滤标记的单体SCF 诉的代表性色谱图示于图3。
- 确定染料:蛋白质比分光光度计。
- 商店的蛋白质在-20℃在PBS / 50%甘油中。
2.钙通量测量
- 以含50微克呋喃-2-AM一个新的小瓶溶解在50μl无水DMSO。
- 降速10 6 T细胞在5ml的聚丙烯圆底管2分钟在250-400克
- 含有在室温Hank氏平衡盐溶液加钙/镁和1%卵白蛋白重悬T细胞在200μl成像介质中,添加呋喃-2-AM原液1微升(1:200稀释),混合细胞悬液和孵化在RT 30分钟。
- 在成像缓冲器一次洗涤T细胞。对于这一点,填充含有细胞与成像缓冲器在RT管和如在步骤2中所述去除上清,重悬在200μl成像缓冲器(即细胞沉淀,在一个最终细胞5×10 6密度沉淀细胞细胞毫升-1)。细胞可以立即用于钙测量或在冰上储存至多3小时。
- 位置细胞上的官能SLB在成像缓冲器(37℃)。一旦T细胞开始接触的SLB,获得的图像的下面的一组,每15至30秒,30分钟:
excitat离子在340±5纳米,在510 +/- 40nm的发射检测
激发在380±5纳米,在510 +/- 40nm的发射检测
DIC(可选)
注意:各个曝光时间依赖于激励光源的强度。得到满意的结果,当为340nm(380纳米)的信道量的最大可能的强度值的像素强度至约四分之一(二分之一)。请记住,激发为340nm呋喃-2值将增加,这些激发在380nm处将在T细胞活化减少。 - 20-25分钟进入运行,添加50-100微升预热抗的pMHC阻断抗体的在20-50微克毫升-1的终浓度。抗体饱和所有pMHCs并因此T细胞将停止识别抗原和停止熔合钙。继续记录图像另外的5 - 10分钟以获得细胞内钙浓度的基线,对应于T细胞的非激活状态< / LI>
- 确定该平均背景的荧光信号在340nm和中的至少1000个像素的感兴趣区域,其中包含没有细胞内380nm处激发。背景减去激发在340nm和380nm处的所有测量的fura-2图像和计算340毫微米/ 380毫微米强度单个细胞的比率或一组电池。通过将所有的比进行最后五个时间段的比(即与完整抗体封锁的pMHC的),归一化强度比。
- 地块归呋喃2比对的时间。注:当细胞和双层状况良好,呋喃-2 340纳米/ 380 nm的强度比采用,2和5之间的典型值的单元格已与双层接触15-45秒后。比率然后下降到1.6和2之间的值,其中它们保持不变,至少20分钟或更长时间。值之后,才能加入抗的pMHC抗体下降到1。一个典型的例子示于图5。
3.1。 TCR装饰与H57scF V
- 降速10 6 T细胞在5ml的聚丙烯圆底管2分钟在250-400克
- 滗媒体,轻弹细胞沉淀轻轻地添加0.3微升SCF V(浓度〜1毫克/毫升)向细胞悬浮液中。对于批量FRET测量只采用染料标记的单链抗体。对于单分子FRET测量使用未标记的scFv的混合物(5至9份,不包含未配对的半胱氨酸)和染料标记的scFv(1份,含有一个不成对染料偶联半胱氨酸)。
- 冰上孵育细胞15分钟,用冰冷的成像缓冲器通过连续离心洗细胞两次。
注:细胞可以(在0℃〜4小时2 SCF V离解吨1/2)被存储在冰上未经显著损失的结合的SCF 诉初级T-细胞从TCR转基因(和任选也衍生的纯度Rag-1/2缺陷小鼠) 和体外刺激是高于98%,因为T细胞是唯一的细胞响应的肽,其已添加了刺激的T细胞培养增殖(最多7细胞分裂)。 B细胞进行凋亡并且不再后7-10天培育活着。一些树突状细胞存活下来还可以很容易地受到歧视不仅是因为其独特的形态,还因为他们不结合H57抗TCR的β单链抗体片段。
3.2。通过受体漂白后供体恢复FRET测量
注意:请记住的TCR-H57 SCF V复合物的半衰期达4小时在冰上,以50分钟,在22.5℃,并以6.8分钟,在37℃(并至约4小时在冰上)2。只要H57 SCF V餐厅作为FRET供体,测得的FRET产量,不应H57 SCF V解离敏感,但是信噪比增大增加H57解离。
- 制备SLB含有AF647 / Cy5标记pMHCs以及未标记的ICAM-1和B7根据Axmann 等人 4。
- 交换的PBS成像室与含Hank氏平衡盐溶液加钙/镁和1%卵白蛋白成像介质。对于这种吸管400微升成像缓冲入井,混合仔细,从井中取出400微升。重复这个过程3-4次。在SLB不要暴露在空气中,在任何时候。
- 将成像室到显微镜台上,调节焦距,直到荧光(AF647,Cy5的)SLB进入明确的说法。
- 通过经由移动潜望镜的平移阶段的平移平行于光轴与物镜的焦平面的周边聚焦光束设置的TIRF照明。
- 要微调激发激光束TIRF模式,增加T细胞装饰着AF555 / Cy3标记SCF V ,让他们安顿到SLB。注意:条件TIRF照明被满足时基底细胞膜是在焦点除了SLB和聚焦向上时映入眼帘的细胞的任何其他零件。然而,如果TIRF未正确调整,份荧光T细胞质膜,这是不与SLB接触,会出现一个环。如果是这样的情况下,调整所述激光束与潜望镜的平移阶段直到TIRF照明实现。
- 收购所指示的顺序和快速连续地( 图6)以下六幅图像:
(i1的,可选)的白光,采取细胞的图像,
(I2,可选)647 nm激发(低功率)采取FRET受体的图像(的pMHC)之前漂白脉冲,
(I3)514 nm激发(低功率)取该FRET供体的前漂白脉冲的图像(TCR)
(I4)647 nm激发(高功率)光致漂白剂的FRET受体, />(I5)514 nm激发(低功率)取该FRET供体的图像(TCR)以下的漂白脉冲,
(I6)647 nm激发(低功率),以验证完整的FRET受体漂白。 - 保持图像(I3)和(I5)尽可能短之间经过的时间,以便能够对图像以供日后分析相关。保持FRET供体的漂白至少通过采用激发以尽可能低的功率水平,这仍允许在T细胞的适当的成像。
- 挑感兴趣区域(ROI),例如,一个完整的突触或单个TCR微原子的区域中,确定其在(I3)平均强度(= I(3)),并在(I5)(= I(5))。背景扣除,选择相同尺寸的投资回报率在照射点外(3)或(5),并确定其平均强度(I(背景))。要确定FRET产量进行以下操作:
克"/>(方程7)
注意:应该指出的是,相对于绝对FRET水平,它可以是需要校正的图像(I5)之间供体的漂白和(I3)。
3.3。通过致敏排放FRET测量
- 配合使用的五彩珠子,在所有的排放通道发荧光的执行空间供体和受体通道对齐。由于色像差两个通道之间的空间移可以通过超定位个体珠来确定,并已被应用为校正两个通道中的一个的所有以下2色图像对10。
- 确定供体bleedthrough与单独含有FRET供体荧光团的使用一个SLB的程度。它也使用FRET的供体标记的T细胞上与未标记的pMHC脂质双层可行的。背景首先视照明场外面确定,然后从两个通道中减去。以此方式,平均巴两个相应的投资回报ckground校正强度(我捐助渠道,我受主通道)被确定。计算bleedthrough系数(BTC)如下:
 (等式8)
(等式8)
注意:此BTC是一个常数为一定的染料和过滤器设置组合。 - 计算FRET供体bleedthrough图片如下:
 (公式9)
(公式9) - 确定受体交叉激励通过激励一个SLB单独含有FRET受体荧光团(例如,IE K / MCC-的Alexa Fluor 647)先用FRET供体的激发光(例如,514纳米),然后用受体激发光(例如,647纳米)。使用FRET受体通道内扣除背景的图像,以计算出的交叉激发系数(CEC)如下:
ftp_upload / 53157 / 53157eq10.jpg"/>(方程10) - 作为CEC取决于用于供体激发的激光强度,确定它在每个测量日。使用所得的CEC计算通过交叉激励单独生成的图像。
 (方程11)
(方程11) - 计算bleedthrough和交叉激发校正FRET图片如下:
 (方程12)
(方程12)
注:绝对的FRET信号(但不相对FRET收率)是将H57 SCFⅤ的从T细胞的膜结合的TCR的离解敏感。为了避免TCR-FRET探针的过多损失,旨在在加入T细胞的双层之后的第一个2分钟内进行测量,在37℃。测量结果与定量(≥95%)的TCR标记仅可以在等于或低于22.5℃,之后的第一个3分钟内此外T细胞以双层的。
4.单分子荧光共振能量转移测量
- 调整两个激光器的功率以产生以下的1-5千瓦/μm2以下,在检体的强度。欲了解更多信息,请参阅Axmann 等。4。
- 标签T细胞如上概述与未标记SCF V(5-9份)和Cy3标记/ AF555标记的SCF V(1份)的混合。注意:此方式只的TCR的部分指标有FRET的供体。这减少了可检测的相互作用的数目,但是从供体bleedthrough产生的噪声也被显著减少(约5 1/2到 10 1/2),解析各单分子FRET事件时,这是至关重要的。
注意:从TCR的H57的scFv探针的离解不影响测量结果,因为它发生在一个更大的范围内的时间(几分钟到几小时),比的TCR从SLB结合的pMHC(亚秒的解离到第二的范围)。 - 将一个SLB特色AF647标记pMHCs以及ICAM和B7在显微镜舞台上,调整工作重点,双层进入明确的说法。
- 择:插入一个隙缝光圈在励磁途径(如图Axmann 等人4)以掩蔽多数照明的领域以外的突触。这样未漂白的IE K / MCC(C)的氟-Alexa 647 FRET受体分子可以进入照明的面积。
- 添加H57 SCF V装饰T细胞以双层(与成像缓冲器),并等待,直到突触出现在视场。
- 快速连续采取的方法,用2-色检测10到20的图像集的序列:
I1)激发514纳米
I2)激发647纳米 - 暴露的图像1〜5毫秒,获得作为一组图像。
- 为了评估单个分子的身份FRET事件,应用关于施主bleedthrough和受体交叉excita相同的校正化。此外,单分子FRET事件具有以符合单一受体分子,并应出现和消失在一个步骤中( 也参见图7)。
- 离速率测定
- 单分子的记录痕迹FRET数采集时间框架事件。
注意:在本实施例(斜体)的5c.c7之间的解离速率的TCR和IE K / K3是在25℃下用四个不同的延迟时间(42毫秒,490毫秒,1007毫秒,1989毫秒)。 - 根据他们的走线长度列表FRET痕迹如表1所示。
- 转换表1到逆累积衰变函数(表2)所示(有色号码从表1取)。
- 正常化所得衰变函数,由所有痕迹在该特定组的总和除以表2的迹线的数量。绘制相对于时间的帧的数量的归一化值。当省略最后的时间框架,其中包含一个零,该衰变可以读随手装有单指数函数( 图8A)。
- 如图8B所示,绘制期望值滞后)>,即 ,上述对使用的延迟时间t 延迟所确定的衰减函数的指数的负逆(在本例为:x =吨滞后 = 0.042 S和Y = 滞后)> = 1 / 0.662 = 1.511,X = 0.49秒和Y = 1 / 0.902 = 1.101,X = 1.007秒和Y = 1 / 1.131 = 0.884,X = 1.989秒和ÿ = 1 / 1.591 = 0.629)。
- 配合τ 关和的漂白 >根据等式3这可以使用科学的数据分析方案的非线性拟合函数来完成,例如起源。
注意:在本实施例中所示的最佳拟合产生一个τ 关的2.12±0.23秒和一漂白 > 1.53 +/- 0.06秒。 - 计算HAL牛逼1/2的相互作用F的生活过采用t 1/2关闭 =τ 关闭 •LN(2)(在这个例子中:1.47 S)。
- 单分子的记录痕迹FRET数采集时间框架事件。
- 2D- 杀敌的决心
- 确定的转换系数下与使用式(6)所采用的FRET染料对和如上概述(图4A)。
- 确定FRET产量为个别的TCR微聚合或整个突触( 图3B和5)。
- 用公式4转换所有单个FRET产量为TCR占有率( 图4C)。
- 应用公式11把所有的TCR用房成2D- 杀敌秒。正如下文所述,突触结合是不均匀的。突触杀敌个有意义的措施是所有测量微簇( 图4D) 的中位数(以红色表示)。
- 在S 2D-K的计算
- 计算k值与使用K 上 =质量作用定律K掉/ K D和实验测定K掉,并杀敌值。
注意:突触k关闭的实验图 4中所示(与5c.c7 TCR IE K / MCC相互作用在25℃下)为0.41 秒 -1。因此在K 三维图 (图4D)可被转化为AK 的小区 ,如图4E。
- 计算k值与使用K 上 =质量作用定律K掉/ K D和实验测定K掉,并杀敌值。
结果
经由呋喃-2钙染料细胞内钙的记录以及随后的细胞分析以验证刺激的效力和SLBs的示于图4的 ,因此功能性。正如变得明显,钙水平升高在T细胞(表示为标准化呋喃-2 340纳米/ 380nm的比例与基准为1)马上,尽快为他们解决到刺激的SLBs。钙水平增加来自TCR接合和哪些块pMHCs终止的T细胞活化中的抗体后不久返回到基线水平。
图6描绘了一个典型的实验中,涉及受体漂白,这是用来测量FRET的产率和其用于计算2D-K D取值后FRET供体恢复(示于图4)。请注意,增加的FRET供体强度,它代表TCR通过AF555标记,FRET的一个快速而完全消融后,cceptor种(此处与pMHCs有关AF647)。同样明显的是强还原性的FRET通道, 即下FRET供体激发FRET受体通道,FRET受体漂白后。在几乎看不到剩余的信号对应于FRET供体bleedthrough。个别的TCR微聚合或整个突触内FRET收率是根据所指出的测量强度值(图6B)来计算。
图7显示了单分子荧光共振能量转移的事件在两个时间帧可见的轨迹和时间的推移。如在引进上述这样的行为是由突触TCR-的pMHC的两个衰减约束力和漂白造成的。要在这两个贡献区分,实验采集时间框架在持续时间变化:当漂白保持恒定,变化FRET活动轨迹长度仅造成结合动力学。定量tracelengths的,W HICH形式的基础的图 7所示离速率和漂白的计算,在表中提供1至3个。
的2D- 杀敌的决心,需要记录大头FRET收益率FRET供体标记的TCR。与使用实验推导常数 C(图4)的,测量其TCR微原子或整个突触一个FRET产量可以转化成的TCR占用一个 , 即的pMHC接合和总的TCR的比率(图4C) 。与已知的pMHC密度之前加入T细胞的存在于SLB, 一个值可以被用于确定突触2D-K D取值 (图4D)。在速率可以计算出质量作用定律(2D-K于= 2D-K掉/ 2D-K D)从确定的突触离速率和2D-KD值。
1"SRC ="/文件/ ftp_upload / 53157 / 53157fig1.jpg"/>
图1的平面状玻璃支持的脂质双层(SLB)系统的示意图轮廓。 (A)的 SLBs的组成POPC(90-99%)和合成脂质DGS的Ni-NTA(1-10%)的和自发形成当干净的玻璃表面被装入小单层囊泡(SUV的),由相应的脂类。 (乙)一旦形成,这样的SLBs可以与pMHCs衍生的可溶性多组氨酸标签的胞外部分,共刺激B7-1蛋白和ICAM-1粘附蛋白,被官能充当的APCs对T细胞。有关准备SLBs的更多信息,请参阅Axmann 等。4。 请点击此处查看该图的放大版本。

Figu重新2.荧光共振能量转移为基础的检测定量TCR-的pMHC 原位结合。 (A)的复合有一个H57单链片段接合的pMHC一个TCR的复合结构示出在此描述的基于FRET的方法。注意大约41A分离的两个对应的荧光经历FRET短距离。受体位点的荧光团-马来酰亚胺示于绿色和红色。(B)的检测原位的TCR-的pMHC相互作用的原理图示。只有SCF V -decorated的TCR和pMHCs(这里IE K),形成特定的复合物,引起可测量的FRET信号。 请点击此处查看该图的放大版本。
"/>
图3.色谱最后的凝胶过滤步骤从而引发单体SCFνs的和肽加载IEķ-2x6H分子,X轴代表毫升滞留量,Y轴表示吸光度在任意单位280处(非盟) (A)中的H57 SCF V族位置特异性的Alexa Fluor 555马来酰亚胺进行至S75色谱以未反应的染料从蛋白质(步骤1.2.5)分离标记。对应于保留间隔14至15毫升(虚线)的级分代表标记的单体的H57 SCF 诉 (B)中的IEķ-2x6H络合紫外线裂解的ANP-空间保持器肽分子已经紫外照射,孵育位点特异性亚历647马来酰亚胺标记肽,最后进行到S200色谱到蛋白质从游离肽(步骤1.1.2.4)分开。的虚线包含适当折叠和单体pMHCs之间的间隔。(A,B) 0.7 ml的样品施加到柱处的朗姆酒(0 ml的点)的开始。收集的级分浓缩。该蛋白对染料的比例(%)photospectrometry前透析对PBS / 50%甘油决定(储存在-20°)。 请点击此处查看该图的放大版本。
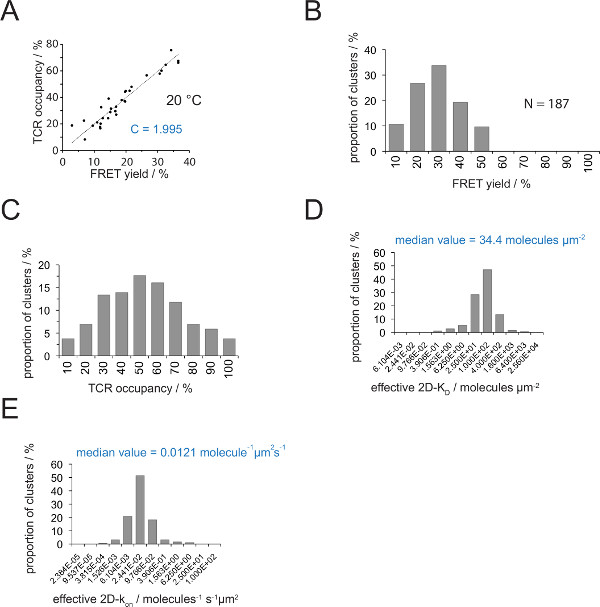
图4.确定2D- 杀敌 S和S上 2D-K。(一)产量FRET供体恢复后受体漂白和TCR入住测量实验所确定的相关性。 TCR入住可针对单个TCR微簇如第4.2章解释来确定。对这些数据的线性拟合由线显示的,其中的斜率等于TCR之间的比 C占用和FRET的收率。C是常数特异于FRET系统和所用的荧光团(这里Cy3和Cy5)。在这个例子中它产生了1.988。(B)的 FRET产量数据被确定为单个TCR微聚合(N = 187,温度= 24℃)通过受体漂白施主恢复。下面直方图条的数字表示的时间间隔内的上限。将所测得的(B)中所示的数据(C)的转换FRET产量与常数 C来确定(A)中 。下面条数字表示间隔内的上限。(D)的柱状图(半对数,基部= 4),描绘了2D- 杀敌小号测定个体的TCR微聚合的分布。中位数2D-K D被表示为蓝色。下面条数字表示间隔内的上限。(E) - (D)中所示的直方图转化INTOA 2D-K 上 -histogram(半对数,基= 4)采用突触K掉24°C(0.41 秒 -1)。 价值的确定中位数2D-K显示在蓝色。数据最初发表于Huppa 等 。2,于此可见在新的格式。 请点击此处查看该图的放大版本。

的SLBs的图5.功能验证用于T细胞刺激和成像。 (A)中载带fura-2 TCR转基因T细胞母细胞被面对刺激SLB窝藏抗原pMHCs,ICAM-1和B-7。蜂窝呋喃-2发射激发在340nm和380nm处以及DIC图像记录。正如指出的,发射强度比的值激发在340和380 nm的显示在右侧面板中。加入的pMHC阻断抗体14分钟到试验运行导致在细胞内钙水平相媲美的静息T细胞的减少。(B)的平均呋喃-2比典型的时间轮廓的T细胞接触刺激的SLBs的特征在于由细胞内钙是2至4倍相比,剥夺抗原的抗体介导的阻断后的非活化的T细胞或T细胞的初始上升。绿色圆圈指示(A)所示的时间点。 请点击此处查看该图的放大版本。
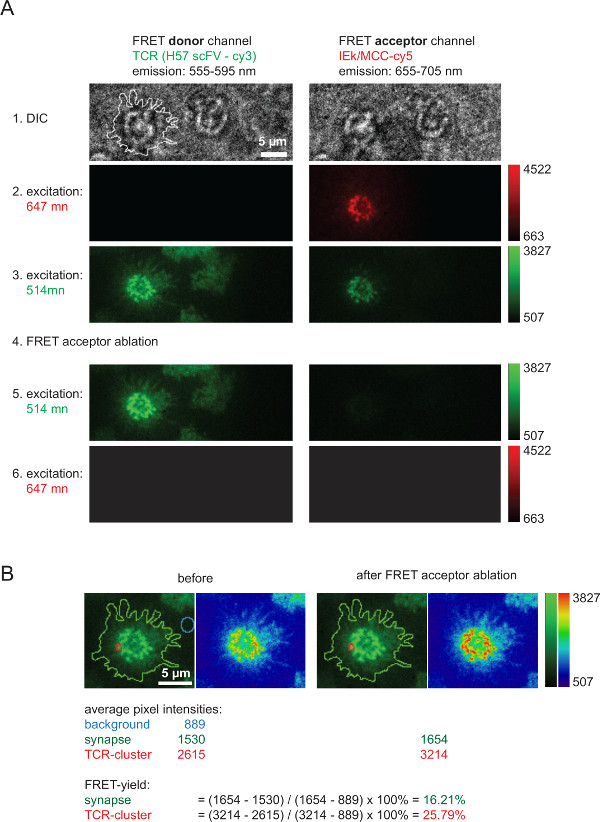
通过FRET受体漂白后FRET供体复苏测图6.大容量FRET产量。 (A)中所示的是一个典型的突触FRET的测量的一个例子。作为表示在左侧,在上面的一系列图像是与使用一个发射光束分离器便出现了FRET供体和一个FRET受体通道的获得(关于分束器的更详细信息参见Axmann 等人 4)。在左侧的DIC图像所示的线表示T细胞突触的边界。注意FRET受体通道内的损失在强度上以及在FRET受体漂白(步骤4)之后的FRET供体通道的增加的强度。(B)的 FRET所指示单个突触区域或为整个突触效率可以量化。对于检查,前后FRET受体漂白后的图像显示与使用两个查找表(LUT,绿色和物理)。 请点击此处查看该图的放大版本。
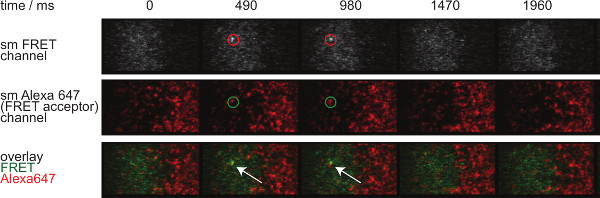
图7.单分子FRET事件出现和消失insingle步骤,是完全与单个FRET受体荧光团一致。显示在单分子荧光共振能量转移事件的时间间隔。采用背照式EMCCD相机获得图像。 请点击此处查看该图的放大版本。
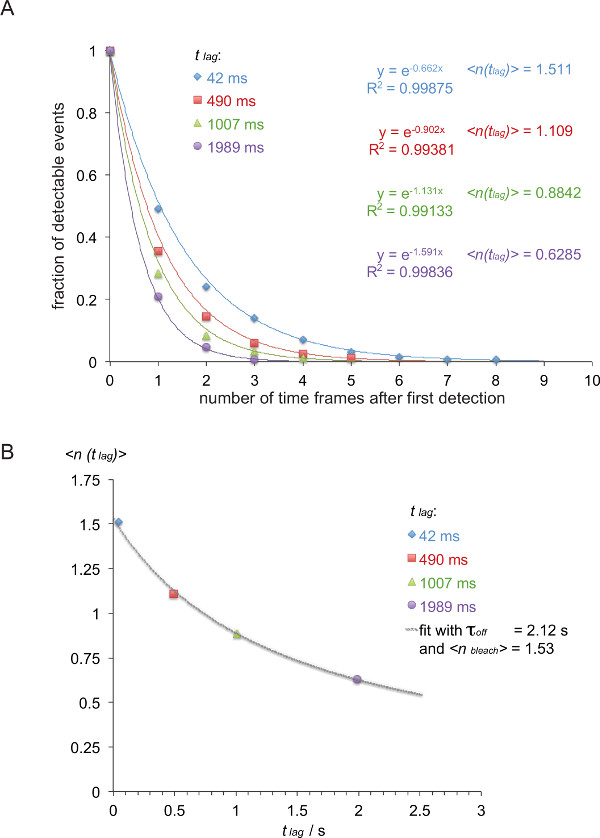
图8.确定τ 关闭 = 1 /距离测量smFRET轨迹K掉。(一)观察到FRET信号(从H57 SCF V -AF555获得的归一化累积和装饰5c.c7 TCR转基因T细胞爆炸识别IE K / K3-AF647,在24℃),用于四种不同的时间滞后(42毫秒,490毫秒,1007毫秒,1989毫秒)被绘制为观测值的总数的函数。单指数拟合函数产生相应的预期值滞后)>的负倒数 。(B) 预期值暗算延迟牛逼的滞后 ,并配用公式滞后)> =τ 关闭/ {(τ 关闭 / 漂白 >)+ T 滞后 }产生τ 关闭, >。 请点击此处查看该图的放大版本。
讨论
测量原位蛋白质-蛋白质相互作用是特别是当以低亲和力相互作用如TCR-的pMHC结合11处理高度期望的。这是因为,结合速率,以及这种相互作用的稳定性显著由特定的情况下使用结合发生的影响。微创基于FRET的成像方法,因此,原则完全适合于这样的任务,但涉及一个数字,首先必须克服的障碍。通过细胞自发荧光产生的噪音限制了测量的灵敏度,因此应保持在最低限度。 TIRF显微镜提供这种需要非常阱 12,但需要的玻璃载玻片的功能化,理想地在装饰有选择13-15中的蛋白质的平面玻璃支持的脂质双层的形式。的局部reconstitutive方法的另一个优点是,重组双层驻留FRET伙伴可以是多米矿石轻松标记的定量,特定地点,合理的方式与更小,更亮的荧光比可能与细胞表面表达的蛋白质。的TCR的标签用重组SCFνs的 ,其不影响T细胞识别,如先前2测试。此外,SLB的蛋白质组合物,例如pMHCs的密度和辅助因子的选择可以调整到一个人的具体需要。我们先前已经进行的实验用不同刺激pMHCs的密度,但并没有发现在2D-K掉和2D-K D 2显著差异。
到目前为止这里识别MHC II型分子的已经处理过只,主要是因为它们的肽结合裂,这是在两端开口的性质,因此可容纳较大的肽,包括连接体为荧光团附着。在某些情况下,这种方法可能也适用于标签MHC CLASS I类分子16,但十分慎重,应采取核实他们在实验中使用。 T细胞对抗原,其可通过T细胞增殖测定,以及所述的pMHC-TCR结合动力学通过表面等离子共振测定的在体外测定的灵敏度不应受到影响通过加入连接体和荧光团的肽。或者,MHC I类分子本身可以与重链(未发表意见)的序列内引入一个未配对的半胱氨酸的被标记以位点特异性方式。
与使用适当的分子探针任何突触蛋白质 - 蛋白质相互作用可以原则上进行研究本文所述的方式。这样的探针,例如,SCFνs的或设计的锚蛋白重复(DARPins)17,应该是一价,并应结合它们的靶稳定地在不影响感兴趣的相互作用。当然,结构information是合理的探针设计非常可取的,但不是绝对必需的。当建立一个新的一对FRET伙伴,建议来记录和第一散装分析FRET。标签附着位点可以变化很大最大化FRET信号和也以验证测量FRET收率不同根据间染料距离。一旦系统进行了优化,单分子FRET信号可以通过限制高丰FRET伴侣的标记至10-30%和漂白低丰度的FRET伙伴直到单分子是可解析在照明领域进行记录。
最后但并非最不重要的,应该指出的是,SLBs的近似一些但不是一个生理质膜的所有方面。品质,如膜曲率和灵活性,域条块,细胞骨架重排和细胞运动以及高的各种表面表达的膜蛋白不是由SLBs中表示的,但可能会影响吨他在调查过程中。将需要付出很大努力,出资设立的成像方式是允许监视与生理突触,未至的全内反射荧光成像单分子分辨率蛋白质 - 蛋白质相互作用。
披露声明
The authors declare that they have no competing financial interest.
致谢
MA是由奥地利科学基金会(FWF,J3086-B11)和感谢的薛定谔奖学金马克斯 - 普朗克协会的财政和行政支持的支持。 GS和JH是由维也纳科技基金(WWTF,LS13-030)的支持。
材料
| Name | Company | Catalog Number | Comments |
| LB-media | Fisher Scientific | 10000713 | bacterial expression |
| Sf900 II | Life Technologies | 10227402 | insect cell media for baculo virus production |
| Insect-XPRESS with L-glutamine (Lonza) | Fisher Scientific | 10564038 | insect cell media for baculo virus expression |
| Sf9 cells | Life Technologies | 11496-015 | cells for virus production and expansion |
| High Five Cells | Life Technologies | B855-02 | cells for potein expression |
| LB-media | Fisher Scientific | 10000713 | bacterial expression |
| Centramate System | Pall | protein concentartion from large volumes | |
| Centramate cassette 10kDa cutoff | Pall | OS010T12 | protein concentartion from large volumes |
| Amicon Ultra-15 Centrifugal Filter Units | EMD Millipore | UFC900308 | protein concentartion |
| Amicon Ultra-4 Centrifugal Filter Units | EMD Millipore | UFC800308 | protein concentartion |
| Amicon Stirred Ultrafiltration Cell Model 200 mL | EMD Millipore | 5123 | protein concentartion |
| Äkta pure 25L | GE Healthcare | 29-0182-24 | protein purification |
| Superdex 200 10/300 GL | GE Healthcare | 17-5175-01 | protein purification |
| Superdex 75 10/300 GL | GE Healthcare | 17-5174-01 | protein purification |
| Mono Q 5/50GL | GE Healthcare | 17-5166-01 | protein purification |
| Ni Sepharose 6 Fast Flow | GE Healthcare | 17-5318-01 | protein purification |
| Tricorn 10/20 column | GE Healthcare | 28-4064-13 | protein purification |
| Gilson HPLC system | Gilson | purificationof fluorochrome-coupled peptides | |
| Pursuit XRs C18, 5 µm particle size, 21.2*250mm column size | Agilent | A6000250X212 | purificationof fluorochrome-coupled peptides |
| Pursuit XRs C18, 5 µm particle size, 21.2*50 mm column size | Agilent | A6000050G212 | purificationof fluorochrome-coupled peptides |
| Tricorn 10/20 column | GE Healthcare | 28-4064-13 | protein purification |
| Gilson HPLC system | Gilson | purificationof fluorochrome-coupled peptides | |
| Pursuit XRs C18, 5 µm particle size, 21.2*250mm column size | Agilent | A6000250X212 | purificationof fluorochrome-coupled peptides |
| Pursuit XRs C18, 5 µm particle size, 21.2*50 mm column size | Agilent | A6000050G212 | purificationof fluorochrome-coupled peptides |
| Cy3 maleimide | GE Healthcare | PA23031 | site-specific protein labeling via mutant unpaired cysteines |
| Cy5 maleimide | GE Healthcare | PA25031 | site-specific protein labeling via mutant unpaired cysteines |
| Alexa Fluor 555 C2 Maleimide | Life Technologies | A-20346 | site-specific protein labeling via mutant unpaired cysteines |
| Alexa Fluor 647 C2 Maleimide | Life Technologies | A-20347 | site-specific protein labeling via mutant unpaired cysteines |
| Fura-2, AM, cell permeant | Life Technologies | F-1221 | calcium-sensitive dye for cell labeling |
| dimethyl sulfoxide | Sigma Aldrich | 151874 | for dissolving fura-2 am |
| Hank's Balanced Salt Solution plus calcium/magnesium | Fisher Scientific | 10225362 | imaging buffer |
| PBS | Life Technologies | 14190-136 | |
| Bovine Serum Albumin lyophilized powder | Sigma Aldrich | A2153 | supplement for imaging buffer |
| 14-4-4S antibody | affimetrix eBioscience | 14-5980-81 | blocking antibody for H2-I-Ek (recognized by the 5c.c7, 2B4 and AND TCR) |
| 5 ml polypropylene round-bottom tube | Becton Dickinson | FALCON 352063 | |
| 0.22 μm Ultrafree-MC centrifugal filter unit | EMD Millipore | UFC30GV0S | |
| Syringe filter 0.2µm | Millipore | GVWP04700 | |
| TetraSpeck Microspheres, 0.1 µm, fluorescent blue/green/orange/dark red | Life technologies | T-7279 | |
| Microscope for fura-2-based calcium measurements | LEICA | DMI4000B | |
| Microscope for (single molecule) FRET measurements | LEICA/ZEISS/NIKON/OLYMPUS | for details please refer to parallel JoVE contribution by Axmann et al. | |
| planar supported lipid bilayers | for details please refer to parallel JoVE contribution by Axmann et al. | ||
| RPMI 1640, with L-Glutamine | Life Technologies | 11554416 | T-cell media |
| non-essential amino acid 100X | Hyclone | SH30238.01 | T-cell media supplement |
| penicillin/streptomycin/L-glutamine 100x | Life Technologies | 12000226 | T-cell media supplement |
| 2-mercaptoethanol | Sigma Aldrich | M6250 | T-cell media supplement |
| mouse interleukin-2 recombinant protein | BPS Bioscience | 90185-B | T-cell media supplement |
| Research Grade Fetal Bovine Serum | Hyclone | SV30160.03 | T-cell media supplement |
| Origin (analysis program) | OrigenLab | http://www.originlab.com/ | non-linear fitting of two parameters (tauoff, [ntlag]) |
参考文献
- Garcia, K. C., Adams, J. J., Feng, D., Ely, L. K. The molecular basis of TCR germline bias for MHC is surprisingly simple. Nat Immunol.. 10, 143-147 (2009).
- Huppa, J. B., et al. TCR-peptide-MHC interactions in situ show accelerated kinetics and increased affinity. Nature.. 463, 963-967 (2010).
- Huppa, J. B., Davis, M. M. The interdisciplinary science of T-cell recognition. Advances in immunology.. 119, 1-50 (2013).
- Axmann, M., Schuetz, G. J., Huppa, J. B. Single Molecule Microscopy on Planar Supported Bilayers. Journal of Vizualized Experiments J. Vis. Exp.. 101, e53158(2015).
- Xie, J., et al. Photocrosslinkable pMHC monomers stain T cells specifically and cause ligand-bound TCRs to be preferentially transported to the cSMAC. Nat Immunol. 13, 674-680 (2012).
- Jares-Erijman, E. A., Jovin, T. M. FRET imaging. Nat Biotechnol. 21, 1387-1395 (2003).
- Toebes, M., et al. Design and use of conditional MHC class I ligands. Nat Med. 12, 246-251 (2006).
- Tsumoto, K., et al. Highly efficient recovery of functional single-chain Fv fragments from inclusion bodies overexpressed in Escherichia coli by controlled introduction of oxidizing reagent--application to a human single-chain Fv fragment. J Immunol Methods. 219, 119-129 (1998).
- Ruegg, U. T., Rudinger, J. Reductive cleavage of cystine disulfides with tributylphosphine. Methods Enzymol. 47, 111-116 (1977).
- Ruprecht, V., Brameshuber, M., Schütz, G. J. Two-color single molecule tracking combined with photobleaching for the detection of rare molecular interactions in fluid biomembranes. Soft Matter. 6, 568-581 (2010).
- Dustin, M. L., Bromley, S. K., Davis, M. M., Zhu, C. Identification of self through two-dimensional chemistry and synapses. Annu Rev Cell Dev Biol. 17, 133-157 (2001).
- Axelrod, D. Cell-substrate contacts illuminated by total internal reflection fluorescence. The Journal of cell biology. 89, 141-145 (1981).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285, 221-227 (1999).
- Kaizuka, Y., Douglass, A. D., Varma, R., Dustin, M. L., Vale, R. D. Mechanisms for segregating T cell receptor and adhesion molecules during immunological synapse formation in Jurkat T cells. Proc Natl Acad Sci USA. 104, 20296-20301 (2007).
- Varma, R., Campi, G., Yokosuka, T., Saito, T., Dustin, M. L. T cell receptor-proximal signals are sustained in peripheral microclusters and terminated in the central supramolecular activation cluster. Immunity. 25, 117-127 (2006).
- Purbhoo, M. A., Irvine, D. J., Huppa, J. B., Davis, M. M. T cell killing does not require the formation of a stable mature immunological synapse. Nat Immunol. 5, 524-530 (2004).
- Binz, H. K., Stumpp, M. T., Forrer, P., Amstutz, P., Pluckthun, A. Designing repeat proteins: well-expressed, soluble and stable proteins from combinatorial libraries of consensus ankyrin repeat proteins. J Mol Biol. 332, 489-503 (2003).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。