Method Article
Medição de TCR-pMHC Binding
Neste Artigo
Resumo
This manuscript describes how to conduct (single molecule) Förster Resonance Energy Transfer (FRET)- based assays to measure the binding dynamics between T-cell antigen receptor (TCR) and antigenic peptide-loaded MHC molecules as they occur within the immunological synapse of a T-cell in contact with a functionalized planar supported lipid bilayer.
Resumo
T-cells are remarkably specific and effective when recognizing antigens in the form of peptides embedded in MHC molecules (pMHC) on the surface of Antigen Presenting Cells (APCs). This is despite T-cell antigen receptors (TCRs) exerting usually a moderate affinity (µM range) to antigen when binding is measured in vitro1. In view of the molecular and cellular parameters contributing to T-cell antigen sensitivity, a microscopy-based methodology has been developed as a means to monitor TCR-pMHC binding in situ, as it occurs within the synapse of a live T-cell and an artificial and functionalized glass-supported planar lipid bilayer (SLB), which mimics the cell membrane of an Antigen presenting Cell (APC) 2. Measurements are based on Förster Resonance Energy Transfer (FRET) between a blue- and red-shifted fluorescent dye attached to the TCR and the pMHC. Because the efficiency of FRET is inversely proportional to the sixth power of the inter-dye distance, one can employ FRET signals to visualize synaptic TCR-pMHC binding. The sensitive of the microscopy approach supports detection of single molecule FRET events. This allows to determine the affinity and off-rate of synaptic TCR-pMHC interactions and in turn to interpolate the on-rate of binding. Analogous assays could be applied to measure other receptor-ligand interactions in their native environment.
Introdução
Uma compreensão mais fundamental de como as células T reconhecem os antígenos requer olhar para o lugar certo, ou seja, dentro da sinapse imunológica formado entre a célula T e do APC. Aqui, a cinética de ligação molecular não são apenas determinadas pelas propriedades bioquímicas intrínsecas dos parceiros de interacção envolvidos, mas dependem em grande medida dos parâmetros celulares, que incluem forças celulares, a arquitectura da membrana e das interacções laterais entre as proteínas da membrana, bem como as restrições geométricas específicas da sinapse 3. Abordagens bioquímicas são limitados em potência de resolução como eles exigem a disrupção de, pelo menos, uma das membranas sinápticas envolvidas. Por esta razão, uma metodologia de imagem baseados em FRET foi desenvolvido para monitorar a ligação do TCR para pMHCs antigênicas 2. Aqui as células T são decorados com um recombinante e de site especificamente rotulado TCRβ-reativa de cadeia simples fragmento de anticorpo (SCF V) e confrontados com plano AR bicamadas lipídicas suportada em vidro (SLBS), que abrigam as moléculas MHC de classe II carregadas com um péptido antigénico marcado por fluorescência, moléculas co-estimulatórias e proteínas de adesão. Synaptic ligação entre TCR e corante marcado marcadas com corante de resultados pMHC em FRET, que podem ser monitorados em um único volume e nível molécula pela Total Internal Reflection fluorescência microscopia (TIRF).
Neste artigo é explicado em detalhe como utilizar SLBS para ensaiar sinapses das células T, verificar sua integridade através de um ensaio de cálcio-flux de células T funcional, conduta FRET medições a granel e com sensibilidade única molécula, e analisar os dados adquiridos. Recomendações são oferecidas para a produção de proteínas adequadamente conformado necessários para bicamada funcionalização. Para obter informações mais específicas sobre a formação de bicamada e configuração de um microscópio TIRF adequado, consulte a uma publicação JoVE acesso público adicional publicada volta para trás 4.
tenda "> Nature de SLBSSLBS functionalizable pode ser prontamente gerado a partir de vesículas unilamelares (SUVs) que contém os dois lípidos 1-palmitoil-2-oleoil-sn-gylcero-3-fosfocolina (curto: POPC, 90-99%) e 1,2-sn dioleoyl- - glicero-3 - {[N- (5-amino-1-carboxipentil) ácido iminodiacético] succinil} (curto: DGS NTA-Ni, 1-10%). SUVs, distribuídos em lâminas de vidro limpas para formar uma bicamada planar contígua 4. DGS-NTA-Ni serve para ancorar proteínas marcadas com poli-histidina-complexo através de formação mediada por poli-histidina, com o NTA-Ni que contém um grupo de cabeça (Figura 1A) sintético. Para uma associação estável substitui tipicamente o domínio transmembranar e a cauda citoplasmática nativa da proteína de adesão ICAM-1 e a molécula co-estimuladora B7-1 com uma etiqueta contendo doze histidinas (ICAM-1-12H, -12H B7-1) (Figura 1B) . O péptido carregado-classe II K IE molécula contém duas cadeias polipéptido incorporado-membrana (α e β)s. Os transmembranares / domínios citoplásmicos de ambas as cadeias têm que ser substituídos com uma etiqueta de seis histidinas contendo cada (IE k α 6H β 6H k -2x6H ou IE). Como uma alternativa, que se prolonga a cadeia com doze α histidinas e deixando o domínio extracelular da cadeia β não marcado (dando origem a IE k α 0H 12H β ou IE k -12H) dá origem a resultados satisfatórios (Figura 1B).
Rotulagem específica do local de pMHCs
É importante para marcar o local e pMHC estequiometricamente-especificamente, a fim de ser capaz de converter os rendimentos medidos em FRET constantes de ligação de equilíbrio significativas. Isto pode ser conseguido pela marcação química de um péptido sintético que é carregado para a fenda de ligação ao péptido de recombinante marcada com histidina moléculas MHC de classe II 2,5. O péptido inclui todos os resíduos do epitopo de célula T como well como um curto C-terminal ligante (GGS) seguido por cisteína (por exemplo, a traça do citocromo c (MCC) péptido ANERADLIAYLKQATK- GGSC, o ligante é marcado em negrito). Esta cisteína é utilizado para marcar o péptido estequiometricamente com o uso de derivados de maleimida com corante. Neste ponto, cuidado extra deve ser dedicada à verificação quantitativa corante de acoplamento para o peptídeo contendo cisteína. HPLC de purificação do aducto de péptido-corante é recomendado e deve ser seguido por espectroscopia de massa por ionização por electropulverização. Quaisquer massas gravados correspondentes ao educto peptídeo (sem corante) refletem rotulagem incompleta. Se isto é verdade, o péptido purificado por HPLC-deve ser submetido a ciclos consecutivos de-marcação com corante até que a rotulagem é considerada quantitativa. Note-se que a espectroscopia de massa MALDI-TOF deve ser evitada dado que este método envolve a radiação laser para uma amostra de ionização. Este tratamento se desintegra as fluorophores sensíveis ligados antes de massa peptídeo é lido e, portanto, underrepre graus Sents de dye-conjugação.
Ainda marcação indirecta do local específico de TCR ligado de células com a utilização de fragmentos de cadeia simples Fv monovalente
Ele ainda é um desafio para anexar corantes para celular proteínas associadas à superfície de células vivas de uma maneira específica do local. Para superar este obstáculo para TCRs expostos à superfície, uma versão monovalente de cadeia única (scFv) a partir dos genes do anticorpo monoclonal TCRβ Reativo H57-197 2 foi construído. A estrutura cristalina deste anticorpo em complexo com o TCR permite conceber racionalmente uma versão, na qual um resíduo de serina em estreita proximidade com o terminal C do péptido associado MHC (em que o corante parceiro de FRET correspondente está ligado) é substituído por um resíduo de cisteína. Este mutante de cisteína, em seguida, serve como um aceitador para a conjugação de corantes (Figura 2).
Metodologias para gravar FRET
nt "> valores FRET em massa são os mais adequados para verificar a relação entre as distâncias inter-dye escolhidos e FRET eficiências medidos neste TCR-pMHC sistema 2 vinculativa. Além disso, as medições FRET granel revelar diferenças qualitativas e quantitativas na sinápticas afinidades TCR-pMHC ( ver abaixo e secção protocolo 3.2). Várias abordagens para quantificar a eficiência FRET foram introduzidos na literatura 6. Neste artigo é registada por meio de FRET(a) doador recuperação após aceitante de branqueamento, e via
(b) emissão de aceitador FRET sensibilizados.
O primeiro método (a) exige a utilização de um aceitador FRET que pode ser facilmente Foto-descoloração, e um doador, a qual é bastante fotoestável. Além disso, é importante assegurar que o aceitador de Foto-descoloração não é mais capaz de extinguir a fluorescência do dador. À medida que o mesmo canal de detecção (doador) é usado para a quantificação, sem factores de correcção umd há aberrações cromáticas devem ser considerados, o que torna esta metodologia simples e confiável. No entanto, as medidas quantitativas não pode ser repetida no mesmo local de amostra e mudanças na FRET não podem ser gravadas ao longo do tempo. Para evitar efeitos causados pela difusão molecular ou motilidade celular um passo de branqueamento rápido deve ser orientado para, o que minimiza o tempo que passa entre o primeiro doador FRET (antes receptor de branqueamento) e a segunda aquisição de imagens FRET doador (depois de FRET receptor de branqueamento). É recomendado empregar uma poderosa fonte de luz laser do comprimento de onda de excitação aceitador FRET, a fim de minimizar a iluminação e de branqueamento vezes.
Em contraste, na abordagem da medição das emissões de FRET sensibilizado (b) o dador FRET é animado e a emissão do aceitador FRET é observado no canal aceitador FRET. Alterações na sinal aceitador FRET pode ser gravado, mas ao longo do tempo de emissão do doador FRET para o canal receptor vermelho-deslocada (termed exsudação) e FRET aceitante cross-excitação via doador excitação tem que ser determinado com exactidão e subtraído do canal receptor de FRET gravado. Para isso as imagens correspondentes aceitador FRET doador e traste tem que ser espacialmente alinhados.
A detecção de única molécula (sm) FRET eventos
Com o uso de lasers como fonte de excitação, uma câmara sensível e microscopia TIRF-ruído atenuado a fluorescência de fluoróforos individuais podem ser facilmente rastreada ao longo do tempo. Semelhante é verdadeiro para a detecção de eventos smFRET intermoleculares. No entanto, as complicações podem ser causados por FRET exsudação dador e trans-excitação do aceitador FRET, e, assim, grande cuidado deve ser tomado ao ajustar as densidades fluoróforo na experiência smFRET.
No protocolo fornecido abaixo (seção de protocolo 4) a TCR foi escolhido como FRET doadores em alta abundância e pMHC como FRET aceitante em baixa abundância. Para atenuar FRET doador suficientemente exsudação, decorar 10-30% dos TCRs com FCE fluorescente V e 90-70% dos TCRs com FCE não fluorescente V. Aqui, o canal de aceitador FRET foi escolhido como único canal molécula porque é confocal com a única molécula FRET canal. Isto ajuda a alinhar com eventos smFRET molécula única aceitadores de FRET, que é a base de validação smFRET.
Extraindo-off taxas sinápticas através de medições smFRET
Fotodegradação de ambos FRET doador e receptor FRET tem que ser contabilizado ao extrair a meia-vida de interações de única molécula FRET vestígios. O número de sinais observáveis FRET no início da sua aparência como par dador-aceitador individuais n (0) é reduzido ao longo do tempo, tanto unbinding do fotobranqueamento e complexo ligando-receptor. O número de sobreviventes complexos num dado momento N (t) pode ser expresso matematicamente como se segue:

No termo fotobranqueamento exp (-t / τ lixívia) o tempo t é descrita pelo produto do número de observações N e o tempo de iluminação t mal por causa da observação de modo não-contínua, discreta (isto é, de branqueamento ocorre apenas durante a iluminação ). Dentro do termo cinética exp- (t / τ desligado) o tempo t é o produto do número de observações n e t o intervalo de tempo para uma única observação FRET (isto é, acontece continuamente unbinding cinética). Equação 1 pode ser expressa como:
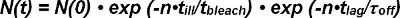
O termo τ lixívia / τ doente describes o número de observações até branqueamento ocorre e é definido como o valor esperado branquear> da sua função exponencial. A equação 2 pode ser simplificada, como se segue:

O valor esperado lag)> do número de quadros de N (t) com FRET eventos observáveis após o tempo t é determinado directamente a partir da experiência. Depende do tempo ajustável entre as observações (t lag) escolhidos no experimento e os valores desconhecidos para τ off (o inverso da taxa de off k off) e branquear>, o valor esperado do número de observações antes de ocorrer branqueamento .
Assim, o cálculo do valor esperado lag)> para, pelo menos, dois valores de t lag permite a determinação experimental de branquear> e τ off.
Extraindo valores sinápticas 2D-K D através de medições baseadas em FRET
Medindo uma ocupação de TCR, isto é, a razão entre os TCRs e ligados no total TCR, é fundamental para a determinação dos valores de K-sinápticos 2D d. De acordo com a equação 4 este termo é directamente proporcional à medida FRET produzir TCR, desde que serve como dadores e aceitantes pMHCs como FRET FRET.

com uma ocupação = TCR, C = fator de conversão
C é uma constante, que depende do sistema de FRET e os fluoróforos utilizado. Ele pode ser determinado experimentalmente, conforme mostrado abaixo. um pode ser convertido num 2D-K D de acordo com a equação 5, quando odensidade inicial de ligandos de TCR, antes da adição de células T para a bicamada é conhecido. Isto é devido à grande mobilidade das proteínas SLB-inscritos e também porque SLBS fornecer um reservatório quase inesgotável de ligantes 2.

com [pMHC inicial] = densidade inicial de pMHC antes da adição de células T
Com equações 4 e 5 pode-se agora facilmente determinar o sináptica 2D-K D entre TCR e pMHC. Isso é feito mais com medições FRET com base na recuperação de doadores após o clareamento receptor (ver seção de protocolo 3.1).
No entanto, à medida C a relação entre a intensidade de FRET FRET I (corrigido para o fundo, de FRET exsudação dador e aceitador FRET cruzada excitação) e TCR ocupação um tem de ser determinado. Para isso, umaprecisa de saber a relação R entre a intensidade média de fluorescência de fluoróforos individuais TCR-associados FRET doadores (por exemplo, Cy3 ou AF555) sm I doador FRET e a intensidade média de molécula única FRET FRET I sm eventos. R depende do sistema de FRET em questão, e filtros de emissão de câmara utilizada para a detecção de fluorescência.
A ocupação de um TCR pode então ser determinado directamente de acordo com a equação 6.

com R = sm I FRET doador / sm I FRET
R foi determinado como 1,45 para o sistema de scFv H57 Cy3 / pMHC-Cy5 leva a:
a = massa I FRET / bulk I TCR-cy3 • 1,45
A relação entre a ocupação de TCR a e o rendimento de FRET pode ser determinado por doador FRET recuperary aceitador após branqueamento. Para esta dois parâmetros são representados graficamente contra o outro para um número de TCR microclusters como mostrado na Figura 4A .A inclinação do ajuste linear indica o factor de conversão C (a partir da equação 4).
Como demonstrado na Figura 4A, C ascende para (a) o V H57 scF - Cy3 / pMHC-Cy5 sistema FRET e (b) a configuração do sistema de microscópio aplicado a 1.995. A ocupação de um TCR pode ser facilmente deduzido da seguinte forma:
A ocupação de um TCR = FRET produzir 1,995 •
Protocolo
Produção 1. Proteína
1.1. Proteínas bicamada residente: B7-1, ICAM-1, pMHC (por exemplo, IE K / péptido)
- -12H B7-1, ICAM-1-12H
- B7-1-12H Express e construções de ICAM-1-12H em grandes quantidades como proteínas nativas segregadas utilizando um sistema de expressão de baculovírus.
- Purifica-se as proteínas a partir de sobrenadantes de cultura por cromatografia de afinidade de Ni-NTA, seguida por cromatografia de permuta aniónica MonoQ e cromatografia de exclusão de tamanho S200.
- Rotular uma alíquota da proteína purificada com corantes reactivos com aminas, tais como preparações de succinimidilo NHS-éster de Alexa Fluor 488 (ou com FITC), Alexa Fluor 555 (ou Cy3), Alexa Fluor 647 (ou Cy5).
- Depois de cromatografia de exclusão de tamanho S200 determinar o grau de marcação de proteínas monoméricas de acordo com as especificações do fabricante do corante através da comparação da absorção da proteína a 280 nm e a absorção do corante a 488 nm (com Alexa Fluor 488, FITC), 555 nm ou 552(Alexa Fluor 555 ou Cy3) ou a 647 nm (Alexa Fluor 647 ou Cy5).
Nota: Esta proporção será mais tarde ser necessários para determinar a densidade de proteína na SLB a partir do sinal de fluorescência grandes quantidades da proteína marcada com corante. - Armazenar as proteínas não marcados e marcados com fluoróforo a -20 ° C em PBS mais 50% de glicerol.
- pMHC (aqui: IE -2x6H k ou IE k -12H)
- Refold MHC de classe II a partir de corpos de inclusão em E. coli expressos na presença de um péptido muito mais barato substituto UV clivável, que pode depois ser quantitativamente trocado com um fluoróforo péptido conjugado de escolha 5, 7.
- Purifica-se complexos pMHC redobradas por técnicas convencionais (cromatografia de Ni-NTA-afinidade, cromatografia de permuta aniónica MonoQ, S200 filtração em gel).
- Troque o peptídeo clivável UV com peptídeo fluorescente 5, 7.
- Purificar fluorescente monomérica pMHC complexos finalmente S200 por filtração em gel. Um cromatograma representativo é mostrado na Figura 3.
- Verifique carregamento peptídeo quantitativa por espectrofotometria.
- Proteínas armazenar a -20 ° C em PBS / glicerol a 50%.
1.2. Geração de fragmentos de anticorpos de cadeia simples (scFv s), introdução de cisteínas para rotulagem especifica de sítio
- Refold scFv a partir de corpos de inclusão é expressa em E. coli. Aqui um protocolo desenvolvido por Tsumoto e colegas 8 é seguido em corpos de inclusão que são desdobradas pela primeira vez em 6 M de cloreto de guanidínio, inteiramente reduzida e em seguida renaturada, no decurso de uma semana por gradualmente diminuindo a concentração do cloreto de guanidínio-desdobramento da proteína.
- Concentre-se devidamente dobrado scF V usando unidades de filtro molecular com um corte molecular de 10 kDa.
- Purifica-se o concentrado por filtração em gel S200.
- Rotular monomérica scF V na presença de 0,05 mM de Tris (2-carboxietil) fosfina (TCEP) com Alexa Fluor 647 imediatamente após a purificação. Realizar a reacção de marcação melhor a uma razão molar de proteínas: corante de não mais do que 1: 2 à temperatura ambiente durante não mais de 2 horas.
Nota: TCEP é um agente de redução de fósforo e com base não reage com maleimidas a estas concentrações 9. Pode, por conseguinte, estar presente durante a reacção de marcação para manter o grupo sulfidrilo desemparelhado reduzida até que reage com o derivado de corante-maleimida. - Purifica-se marcado scFv monomérico, finalmente, através de filtração em gel S75. Um cromatograma representativo é mostrado na Figura 3.
- Determinar o corante: proteína rácio espectrofotometricamente.
- Proteínas armazenar a -20 ° C em PBS / glicerol a 50%.
2. Medições Fluxo de Cálcio
- Tome um frasco fresco contendo 50 ng fura-2-AM e dissolvê-lo em 50 ul DMSO livre de água.
- Girar 10 6 células-T em um tubo de fundo redondo de 5 ml de polipropileno durante 2 minutos a 250-400 g.
- Ressuspender as células T em meio de imagem de 200 ul contendo solução salina equilibrada de Hank + cálcio / magnésio e 1% de ovalbumina, à TA, adicionar 1 mL da solução-mãe de Fura-2-AM (diluição 1: 200), misturar a suspensão de células e incubar à TA durante 30 min.
- Lavam-se as células-T uma vez em tampão de imagem. Para este, encher o tubo contendo as células com tampão de imagiologia à TA e sedimentar as células tal como descrito no passo 2. Remover o sobrenadante e ressuspender o sedimento de células em tampão 200 ul de imagem (isto é, a uma densidade celular final de 5 x 10 6 células ml -1). As células podem ser utilizadas imediatamente para medições de cálcio ou armazenado em gelo durante até 3 horas.
- Células lugar em uma SLB funcionalizada em tampão de imagem (37 ° C). Assim que as células T começar a entrar em contato com o SLB, adquirir o seguinte conjunto de imagens a cada 15 a 30 segundos para 30 min:
excitatião a 340 +/- 5 nm, detecção de emissão de 510 +/- 40 nm
excitação a 380 nm +/- 5, detecção de emissão de 510 +/- 40 nm
DIC (opcional)
Nota: Os respectivos tempos de exposição dependerá da intensidade da fonte de luz de excitação. Resultados satisfatórios são obtidos quando as intensidades de pixel de 340 nm (380 nm) quantidade canal para cerca de um quarto (metade) do valor máximo possível intensidade. Tenha em mente que os valores Fura-2 excitados a 340 nm vai aumentar e aqueles animado com 380 nm vai diminuir após a ativação de células T. - 20-25 min para o prazo, adicionar 50-100 ul do anticorpo anti-pMHC pré-aquecido bloqueando a uma concentração final de 20-50 mg ml -1. O anticorpo satura todos pMHCs e como consequência as células T deixarão de reconhecer antigénio e parar fazendo fluir cálcio. Continuar a gravar imagens para outro. 5 - 10 min para adquirir a linha de base da concentração de cálcio intracelular, o que corresponde ao estado não activado de células T < / li>
- Determinar o sinal de fluorescência média de fundo a 340 nm e 380 nm de excitação dentro de uma região de interesse de pelo menos 1.000 pixels, que não contém nenhuma célula. Background-subtrair todos os fura-2 imagens medidos excitados a 340 nm e 380 nm e 340 nm calcular / 380 rácios de intensidade nm de células individuais ou um grupo de células. Normalizar rácios de intensidade dividindo todas as proporções através da razão entre as cinco quadros última vez (ou seja, com total de anticorpo-bloqueio do pMHC).
- Plot normalizada Fura-2 rácios contra o tempo. Nota: Quando as células e camadas duplas estão em boas condições, nm / 380 nm relações de intensidade Fura-2 340 adotar valores tipicamente entre 2 e 5, 15-45 seg após células fizeram contato com a bicamada. Rácios em seguida, cair para um valor entre 1,6 e 2 onde permanecem constantes durante pelo menos 20 minutos ou mais. Os valores devem cair para 1 somente após a adição de anticorpos anti-pMHC. Um exemplo típico é mostrado na Figura 5.
3.1. Decoração TCR com o H57scF V
- Girar 10 6 células-T em um tubo de fundo redondo de 5 ml de polipropileno durante 2 minutos a 250-400 g.
- Decantar os meios de comunicação, o filme de sedimento de células suavemente e adicionar 0,3 mL de scFv (concentração ~ 1 mg / mL) à suspensão de células. Para grandes quantidades FRET medições empregam apenas corante marcado scFv. Para medições única molécula FRET usar uma mistura de não marcado scFv (5 a 9 partes, não contém cisteína não emparelhado) e corante marcado scFv (1 parte, contém uma cisteína não emparelhado acoplado-dye).
- Incubar as células em gelo durante 15 minutos e lavar as células duas vezes através de centrifugação sucessiva usando tampão de imagiologia gelada.
Nota: As células podem ser armazenadas em gelo sem perda significativa de scFv ligada (t 1/2 de scFv dissociação a 0 ° C ~ 4 h 2). A pureza das células T primárias derivadas de TCR-transgénicos (e opcionalmente também Rag-1/2 ratinhos deficientes) e estimuladas in vitro é superior a 98% uma vez que as células T são as únicas células em proliferação (até 7 divisões celulares), em resposta ao péptido, a qual foi adicionada para a estimulação para a cultura de células-T. Células B de apoptose e já não estão vivos após 7-10 dias de cultura. Algumas células dendríticas sobrevivem ainda pode ser facilmente discriminadas não só por causa de sua morfologia distinta, mas também porque eles não se ligam a H57 anti-TCR beta scFV fragmento.
3.2. FRET medição através da recuperação após doador aceitador de branqueamento
Nota: Tenha em mente que a semi-vida dos complexos V de TCR-H57 SCF ascende a 4 horas em gelo, de 50 min a 22,5 ° C e 6,8 min a 37 ° C (e até cerca de 4 horas em gelo) 2. Contanto que o scFv H57 serve como dador de FRET, os rendimentos medidos de FRET não são sensíveis ao scFv H57 dissociação, no entanto, o sinal de ruído aumentacom o aumento da dissociação H57.
- Prepare uma SLB contendo AF647 / pMHCs marcado com Cy5, bem como ICAM-1 não marcado e B7 acordo com Axmann et ai 4..
- Troque a PBS da câmara de imagem com meio de imagem contendo solução salina equilibrada, mais cálcio / magnésio e 1% de ovalbumina de Hank. Por esta pipeta de 400 uL de tampão de imagens para dentro do poço, misturar cuidadosamente e remover 400 ul a partir do poço. Repita este procedimento 3-4 vezes. Não exponha o SLB para o ar a qualquer momento.
- Coloque a câmara de imagem para o palco microscópio e ajustar o foco até que a fluorescente (AF647, Cy5) SLB entra em visão clara.
- Defina-se a iluminação TIRF ao traduzir o feixe focado paralelo ao eixo óptico para a periferia do plano focal da objectiva através de movimento de translação da fase de periscópio.
- Para ajustar os feixes de laser de excitação no modo TIRF, adicione as células T decorados com AF555 / Cy3 marcado scF V e deixá-los a resolver sobre SLB. Nota: Condições de iluminação TIRF são satisfeitas quando a membrana celular basal está em foco para além do SLB e não outras partes da célula entrar em vista quando o foco para cima. No entanto, não se TIRF é ajustado adequadamente, as partes da membrana plasmática de células T fluorescente, que não estão em contacto com o SLB, aparece como um anel. Se este for o caso, ajustar o feixe de laser com o estágio de translação do periscópio até TIRF iluminação é conseguido.
- Adquirir as seis imagens seguintes na ordem indicada e em rápida sucessão (Figura 6):
(i1, opcional) luz branca, para obter uma imagem da célula,
(i2, opcional) excitação 647 nm (baixa potência) para tomar uma imagem do receptor de FRET (pMHC) antes do impulso lixívia,
(i3) excitação 514 nm (baixa potência) para obter uma imagem do doador FRET (TCR) antes do impulso lixívia,
(i4) excitação a 647 nm (alta potência) para foto-branqueador o aceitante FRET, /> (I5) excitação 514 nm (baixa potência) para obter uma imagem do doador FRET (TCR) após o pulso de água sanitária,
(i6) excitação 647 nm (baixa potência) para verificar completo branqueamento FRET aceitante. - Manter o tempo decorrido entre imagens (i3) e (i5) tão curto quanto possível, a fim de ser capaz de correlacionar as imagens para a análise posterior. Manter dador FRET branqueamento a um mínimo através da utilização de excitação no nível de potência mais baixo possível, que ainda permite a imagiologia apropriada das células-T.
- Escolha uma região de interesse (ROI), por exemplo, uma sinapse inteira ou um microcluster TCR indivíduo, determinar sua intensidade média (i3) (= I (3)) e em (i5) (= I (5)). Para subtração de fundo, escolher um ROI da mesma dimensão fora do local de iluminação em (3) ou (5) e determinar a sua intensidade média (I (fundo)). Para determinar o rendimento FRET realize a seguinte operação:
g "/> (equação 7)
Nota: Deve-se notar que, em relação ao nível de FRET absoluto, pode ser necessário corrigir para o branqueamento dos doadores entre imagens (E5) e (i3).
3.3. FRET medição via emissão sensibilizado
- Realizar espacial dador e aceitador de canal alinhamento com o uso de grânulos coloridos, que fluorescem em todos os canais de emissão. O deslocamento espacial entre ambos os canais devido a aberração cromática pode ser determinada por grânulos individuais de super-posicionar e tem de ser aplicado para a correção de um dos dois canais para todas as seguintes 2 cores imagem de pares 10.
- Determinar o grau de exsudação dador com o uso de um SLB contendo o fluoróforo dador FRET sozinho. Também é possível utilizar as células T do doador FRET marcados numa bicamada lipídica não marcado com pMHC. O fundo é determinada primeiro fora do campo iluminado de vista e, em seguida, subtraído de ambos os canais. Desta forma, o ba média intensidades corrigido-ckground de duas ROIs correspondentes (canal doador I e I aceitante de canal) são determinados. Calcular o coeficiente de exsudação (BTC) como se segue:
 (Equação 8)
(Equação 8)
Nota: Este BTC é uma constante para um determinado conjunto de filtros e corante-combinação. - Calcula-se a imagem exsudação dador FRET como se segue:
 (equação 9)
(equação 9) - Determinar aceitador cruzada de excitação através da excitação de um SLB contendo o fluoróforo FRET aceitador por si só (por exemplo, IE K / MCC-Alexa Fluor 647) em primeiro lugar com FRET leve dadora de excitação (por exemplo., 514 nm) e, em seguida, com aceitador de luz de excitação (por exemplo, 647 nm). Use imagens subtraído-fundo dentro do canal FRET receptor para calcular o coeficiente de cross-excitação (CEC) como segue:
ftp_upload / 53157 / 53157eq10.jpg "/> (equação 10) - À medida que o CEC depende da intensidade do laser utilizado para doador de excitação, que determinam em cada dia de medição. Use a CEC resultante para calcular a imagem unicamente gerada através de cross-excitação.
 (equação 11)
(equação 11) - Calcula-se a imagem de FRET corrigido para exsudação e cross-excitação da seguinte forma:
 (equação 12)
(equação 12)
Nota: sinal de FRET Absoluto (mas não o rendimento em relação FRET) é sensível à dissociação do scFv H57 de membrana de células T TCR ligado. Para evitar a perda excessiva da sonda FRET-TCR, o objectivo de realizar as medições a 37 ° C no primeiro 2 min após a adição das células T à bicamada. Medições com quantitativa (≥ 95%) de rotulagem TCR só são possíveis em ou abaixo de 22,5 ° C durante os primeiros 3 minutos, depoisAlém das células T para a bicamada.
4. medições única molécula de FRET
- Ajustar a potência de ambos os lasers para dar origem a uma intensidade de 1-5 kW / uM 2 na amostra. Para mais informações por favor consulte o Axmann et al. 4.
- As células T do rótulo, conforme descrito acima com uma mistura de não marcado scF V (5-9 partes) e Cy3 / marcado com AF555 scF V (1 parte). Nota: Esta forma apenas uma fracção de TCRs é marcado com o doador FRET. Isto reduz o número de interacções detectáveis, mas o ruído gerado a partir de dador de exsudação é também diminuiu significativamente (em cerca de 5 1/2 a 1/2 a 10), o que é crítico ao resolver molécula único indivíduo FRET eventos.
Nota: A dissociação da sonda H57 scFV do TCR não afecta as medições, tal como ocorre num intervalo de tempo muito maior (minutos a horas) do que a dissociação do TCR ligada a partir de SLB-pMHC (sub-segundo em segundoalcance). - Coloque um SLB caracteriza pMHCs marcado com AF647, bem como ICAM e B7 na platina do microscópio e ajustar o foco de forma que a bicamada entra em visão clara.
- Opcional: Inserir uma abertura de ranhura para a via de excitação (como mostrado na Axmann 4 et al.) Para mascarar a maioria do campo de iluminação com excepção da sinapse. Desta forma, não branqueado IE k / MCC (C) -Alexa Fluor 647 FRET moléculas receptoras pode mover-se para a área de iluminação.
- Adicionar as células T decorados H57 scF V para a bicamada (com tampão de imagem), e aguarde até que as sinapses aparecer no campo de visão.
- Leve em rápida sucessão uma seqüência de 10 a 20 conjuntos de imagens que utilizam a detecção de 2 cores:
i1) excitação 514 nm
i2) excitação 647 nm - Expor imagens por 1 a 5 ms e adquirir como um conjunto de imagens.
- Para avaliar a identidade única molécula FRET eventos, aplique a mesma correção em relação a exsudação doadora e receptora cross-excitação. Além disso, única molécula FRET eventos tem que alinhar com moléculas receptoras individuais, devendo aparecem e desaparecem em uma única etapa (ver também a Figura 7).
- Off-taxa de determinação
- Vestígios recorde de única molécula FRET eventos para vários prazos de aquisição.
Nota: Neste exemplo (em itálico) a taxa de off entre o 5c.c7 TCR e IE k / K3 é medida a 25 ° C com quatro diferentes tempos de atraso (42 ms, 490 ms, 1007 ms, 1989 ms). - Lista de FRET traça de acordo com os seus comprimentos vestigiais, como mostrado na Tabela 1.
- Converter tabela 1 para uma função de decaimento cumulativa inversa (tabela 2), como mostrado (números coloridos são tomadas a partir da tabela 1).
- Para normalizar a função de decaimento resultante, dividir o número de traços de mesa 2 por a soma de todos os vestígios desse grupo particular. Traçar os valores normalizados contra o número de intervalos de tempo. Quando omitindo o último período de tempo, o qual contém um zero, os decaimentos pode ser lidoily equipado com uma única função exponencial (Figura 8A).
- Como mostrado na Figura 8B, traçar o valor esperado lag)>, isto é, o inverso negativo do expoente da função de decaimento acima determinado contra o tlag tempo de atraso utilizado (neste exemplo: x = t lag = 0,042 s e y = lag)> = 1 / 0,662 = 1.511, x = 0,49 s e y = 1 / 0,902 = 1.101, x = 1.007 s e y = 1 / 1.131 = 0.884, x = 1.989 s e y = 1 / 1,591 = 0,629).
- Τ Fit fora e branquear> com base na equação 3. Isto pode ser feito usando uma função de ajuste não linear de um programa de análise de dados científicos tais como a origem.
Nota: O melhor ajuste é mostrado neste exemplo τ produz uma fora de 2,12 +/- 0,23 s e branquear> de 1,53 +/- 0,06 seg. - Calcular o HALf vida da interação t 1/2 com 1/2 off t = τ off • ln (2) (neste exemplo: 1,47 s).
- Vestígios recorde de única molécula FRET eventos para vários prazos de aquisição.
- Determinação 2D-K D
- Determinar o factor de conversão de C para o par corante FRET empregue com a utilização da equação 6 e conforme descrito acima (Figura 4A).
- Determinar os rendimentos Fret para microclusters TCR individuais ou sinapses inteiras (Figuras 3B e 5).
- Usando a equação 4 converso todos os rendimentos FRET individuais em ocupações de TCR (Figura 4C).
- Aplicar equação 11 para converter todas as ocupações de TCR em 2D-K D s. Como é indicado abaixo, a ligação sináptica é não homogêneo. A medida significativa para sináptica K D s é a mediana (indicado em vermelho) de todos os microclusters medidos (Figura 4D).
- Cálculo de 2D-k on s
- Calcule k on com a lei de ação de massas com k on = k off / valores K D K D ea k determinada experimentalmente e off.
Nota: O K sináptica fora para a experiência apresentada na Figura 4 (IE K / MCC interagindo com 5c.c7 TCR a 25 ° C), é de 0,41 s -1. Daí a trama K D (Figura 4D) podem ser convertidos em AK em lote como se mostra na Figura 4E.
- Calcule k on com a lei de ação de massas com k on = k off / valores K D K D ea k determinada experimentalmente e off.
Resultados
A gravação de cálcio intracelular através do corante Fura-2 cálcio, bem como a análise celular subsequente para verificar a potência estimuladora e, consequentemente, a funcionalidade do SLBS são mostrados na Figura 4. Conforme se torna evidente, os níveis de cálcio aumentar em células T (expresso como a fura-2 340 nm razão normalizada / 380nm com linha de base sendo 1) imediatamente assim que resolver sobre as SLBS estimulantes. Os níveis de cálcio voltar aos níveis basais logo após a adição de um anticorpo que bloqueia pMHCs TCR de acoplamento e que termina a activação das células T.
A Figura 6 ilustra uma experiência típica envolvendo recuperação dador FRET aceitador após o branqueamento, que é utilizado para medir o rendimento FRET e que serve para calcular os valores de 2D-K D (mostrada na Figura 4). Note que o aumento em intensidade dador FRET, que representa TCR marcado através de AF555, após ablação rápida e completa de uma a FRETespécies cceptor (aqui: AF647 associado com pMHCs). Também é evidente a redução forte no canal de FRET, ou seja, o canal de FRET-aceitador FRET sob doador de excitação, após aceitador FRET branqueamento. O sinal remanescente pouco visível corresponde a se preocupar doador exsudação. Rendimentos FRET dentro microclusters TCR individuais ou sinapses inteiras são calculados com base nos valores de intensidade medidos indicados (Figura 6B).
A Figura 7 descreve uma trajectória e lapso de tempo de uma única molécula de evento de FRET visível em dois intervalos de tempo. Como descrito acima na introdução tal comportamento é causado por ambos decadência da sináptica TCR-pMHC vinculativo e fotodegradação. Para discriminar entre essas duas contribuições, os prazos de aquisição experimentais tem que ser variada de duração: enquanto fotodegradação continua a ser uma constante, mudanças na FRET comprimento evento trajetória só são causados pelas cinética de ligação. Uma quantificação de tracelengths, W hich constitui a base para o cálculo das taxas de fora do branqueamento e mostrados na Figura 7, são apresentados nas tabelas 1 a 3.
Determinação do 2D-K D s exige a gravação de grandes quantidades FRET rendimentos para FRET doadores TCRs rotulados. Com a utilização do experimentalmente deduzida constante C (Figura 4), com um rendimento de FRET medido para um microcluster TCR ou uma sinapse inteira pode ser convertido para o TCR de ocupação, um ou seja, a proporção de TCR pMHC-envolvidos e totais (Figura 4C) . Com densidades pMHC conhecidos presentes no SLB antes da adição das células-T, A valores podem ser utilizados para determinar os valores de KD 2D-sinápticos (Figura 4D). On-taxas pode ser calculado com a lei de ação de massas (2D-k on = 2D-koff / 2D-K D) da sináptica determinada off-rate e valores 2D-KD.
1 "src =" / files / ftp_upload / 53157 / 53157fig1.jpg "/>
Figura 1. Diagrama esquemático do contorno da bicamada lipídica do sistema suportada em vidro plano (SLB). (A) SLBS são compostos de POPC (90-99%) e o lípido sintético DGS de Ni-NTA (1-10%) e formam-se espontaneamente quando as superfícies de vidro limpas são carregadas com vesículas unilamelares pequenas (SUVs) que consiste dos lípidos correspondentes. (B) Uma vez formados, tais SLBS pode ser funcionalizado com porções marcadas com poli-histidina solúveis extracelulares derivadas de co-estimuladoras B7-1 pMHCs, proteínas e proteínas de adesão ICAM-1, para servir como APCs para células-T. Para obter mais informações sobre como preparar SLBS consulte Axmann et al. 4. Por favor clique aqui para ver uma versão maior desta figura.

Figu re 2. Energia de Förster Ressonância ensaio baseado em Transferência para quantificar a ligação de TCR-pMHC in situ. (A) Uma estrutura compósita de um TCR complexado com um fragmento de cadeia única H57 engatar um pMHC ilustra a abordagem baseada em FRET aqui descrito. Note-se a curta distância de cerca de 41a separa os dois fluoróforos correspondentes submetidos FRET. Sites receptora na fluoróforo-maleimidas são indicados em verde e vermelho. (B) O princípio de detecção de interacções TCR-pMHC in situ é ilustrada. Apenas scF V -decorated TCRs e pMHCs (IE aqui k), que formam complexos específicos, dar origem a um sinal FRET mensurável. Por favor clique aqui para ver uma versão maior desta figura.
"/>
Figura 3. Cromatogramas de ascensão último passo de filtração em gel para dar scFv monoméricos e s carregadas com péptido k -2x6H moléculas IE. Eixos X representam volume de retenção, em ml, eixos Y indicam absorvância a 280 nm em unidades arbitrárias (UA) . (A) Site-H57 especificamente scFv marcado com Alexa Fluor 555 maleimida foi submetido a cromatografia para separar S75 corante que não reagiu a partir da proteína (passo 1.2.5). As fracções correspondentes ao intervalo de retenção de 14 to15 ml (linhas tracejadas) representam marcado H57 scFv monomérico. (B), ou seja moléculas -2x6H k complexados com o ANP-péptido espaço titular UV clivável tinha sido irradiadas com UV, incubadas com o sítio-específico Alex 647 marcado com maleimida péptido e, finalmente, sujeito a cromatografia em S200 para separar a proteína do péptido livre (passo 1.1.2.4). O intervalo entre as linhas tracejadas contém adequadamente dobrados e pMHCs monoméricos. (A, B) 0,7 ml da amostra foi aplicada na coluna no início do rum (0 ponto mL). As fracções recolhidas foram concentradas. A proporção entre proteína e corante foi determinada por photospectrometry antes da diálise contra PBS / glicerol a 50% (para o armazenamento a -20 °). Por favor clique aqui para ver uma versão maior desta figura.
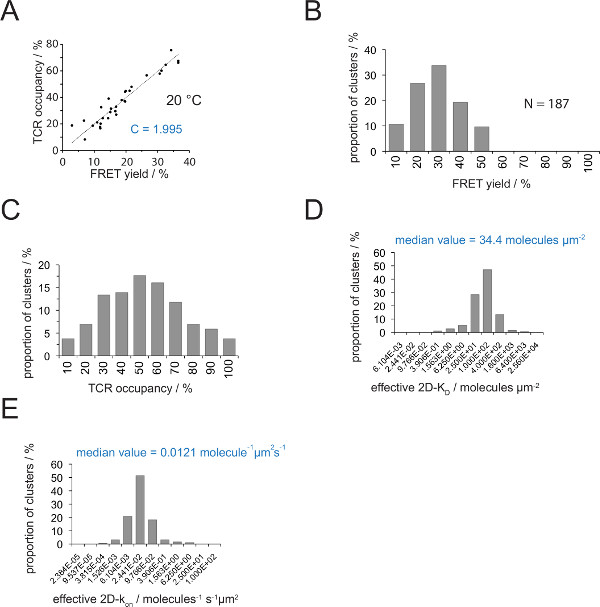
Figura 4. Determinação 2D-K D S e K em 2D-s. (A) A correlação entre o rendimento de FRET como determinado pela recuperação após branqueamento doador aceitador e TCR ocupação foi medida experimentalmente. TCR ocupação pode ser determinada para microclusters TCR individuais como explicado na secção 4.2. Um ajuste linear dos dados é apresentada pela linha, cuja inclinação é igual à relação entre C TCRocupação eo rendimento FRET. C é uma constante específica para o sistema FRET e os fluoróforos (aqui Cy3 e Cy5) empregados. Neste exemplo, produziu 1.988. (B) FRET dados de rendimento foram determinados por microclusters individuais TCR (N = 187, temperatura = 24 ° C) através da recuperação de doador aceitador de branqueamento. Números abaixo de barras de histograma indica o limite superior do intervalo dentro. (C) A conversão dos dados apresentados em (B) multiplicando os rendimentos medidos FRET com a constante C determinada em (a). Números abaixo de barras indicam o limite superior do intervalo dentro. (D) Histograma (semi-logarítmica, base = 4) que descreve a distribuição de 2D-K D s, medida por microclusters TCR individuais. A mediana 2D-K D é indicado no azul. Números abaixo de barras indicam o limite superior do intervalo dentro. (E) O histograma mostrado em (D) foi convertido intoa 2D-k em -histogram (semi-logarítmica, base = 4) utilizando o k sináptica off para 24 ° C (0,41 s -1). O 2D-k mediana determinado sobre o valor é indicada a azul. Os dados foram originalmente publicado em Huppa et al. 2 e são visualizados aqui em um novo formato. Por favor clique aqui para ver uma versão maior desta figura.

Figura 5. Validação funcional de SLBS empregue para a estimulação de células T e de imagem. (A) de blastos de células T transgénicas TCR-carregadas com Fura-2 foram confrontados com estimuladora SLB abrigando pMHCs antigénicos, ICAM-1 e B-7. Foram registrados celular fura-2 emissão animado a 340 nm e 380 nm, bem como imagens DIC. Conforme indicado, os valores da relação das intensidades de emissão animado aos 34 anos0 e 380 nm são apresentados no painel da direita. A adição de pMHC anticorpos de bloqueio 14 min para o ensaio experimental resultou numa diminuição nos níveis de cálcio intracelulares, comparável ao do descanso células-T. (B) Um perfil temporal típico de índices médios Fura-2 em células T em contacto com SLBS estimuladoras é caracterizada por um aumento inicial em uma intracelular de cálcio que é de 2 a 4 vezes mais elevada em comparação com a de células T não activadas ou células T privadas de antigénio após o bloqueio mediada por anticorpos. Círculos verdes indicam pontos no tempo em ilustrados (A). Por favor clique aqui para ver uma versão maior desta figura.
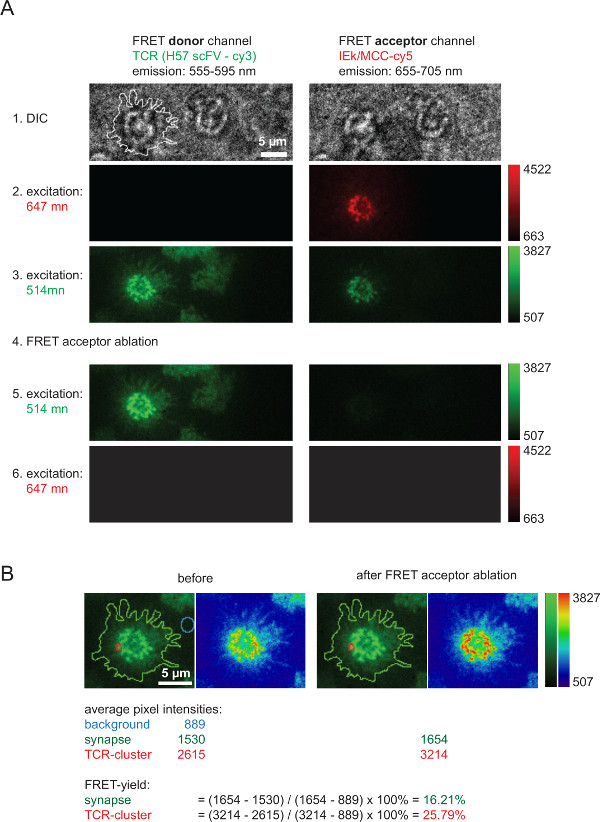
Figura 6. massa FRET rendimentos, medida através da recuperação doador FRET FRET aceitante após o clareamento. (A) é mostrado um exemplo de uma medição de FRET-sináptica normal. Como está indicado no lado esquerdo e na parte superior de uma série de imagens foi adquirida com o uso de um divisor de feixe de emissão dando origem a um dador FRET e um canal de FRET aceitador (para uma informação mais detalhada sobre divisores de feixe referem-se a Axmann et ai 4). A linha mostrada na imagem DIC esquerda indica o limite da sinapse de células T. Note-se a perda de intensidade dentro do canal aceitador FRET bem é o aumento da intensidade do canal de dador FRET após FRET aceitador de branqueamento (etapa 4). (B) FRET eficiências podem ser quantificados como indicado para as regiões sinápticas individuais ou em sinapses inteiras. Para consulta, as imagens antes e depois FRET receptor de branqueamento são mostrados com o uso de duas tabelas de pesquisa (LUTs, verde e física). Por favor clique aqui para ver uma versão maior desta figura.
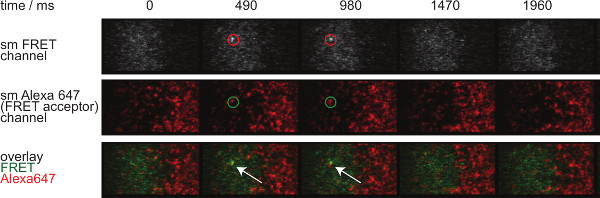
Figura 7. molécula única FRET eventos aparecem e desaparecem passos insingle e estão perfeitamente alinhados com um único fluoróforo aceitador FRET. O lapso de tempo do evento FRET única molécula é mostrado. As imagens foram obtidas utilizando uma câmara EMCCD retro-iluminado. Por favor clique aqui para ver uma versão maior desta figura.
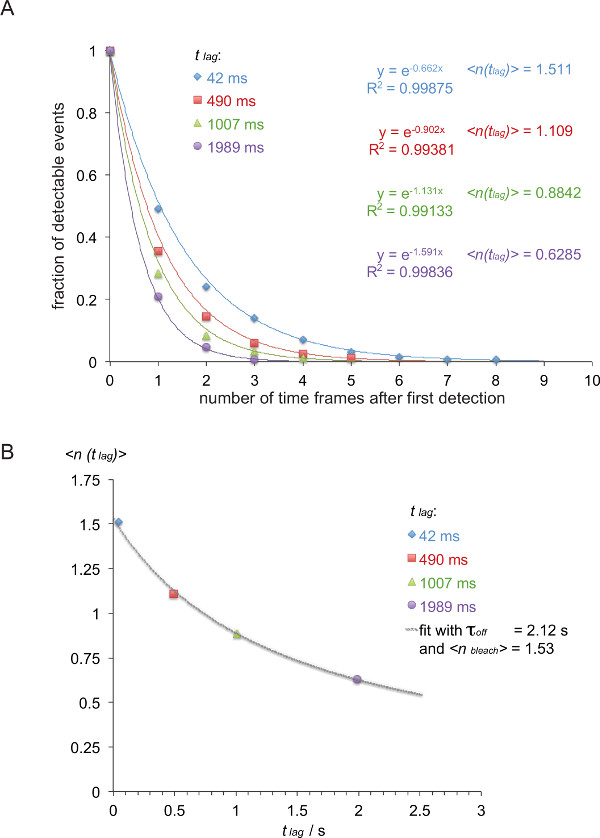
Figura 8. Determinação τ off = 1 / k fora de trajetórias smFRET medidos. (A) As somas cumulativas normalizadas de sinais observáveis (FRET derivados de H57 scF V -AF555 decorados 5c.c7 TCR blastos de células T transgênico reconhecendo IE K / K3-AF647 a 24 ° C) durante quatro desfasamentos de tempo diferentes (42 ms, 490 ms, 1007 ms, 1989 ms) foram representados graficamente como uma função do número total de observações. Funções de ajuste monoexponencial dar origem a que corresponde o inverso negativo dos valores esperados lag)>. (B) valores esperados foram plotados contra atrasos t lag e montado usando a equação lag)> = τ off / {(x off / branquear>) + t lag} para produzir τ off e branquear>. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Medição de interacções proteína-proteína in situ é altamente desejável, especialmente quando se lida com as interacções de baixa afinidade, tais como ligação de TCR-pMHC 11. Isto é porque a taxa de sobre-, bem como a estabilidade de tais interacções são significativamente influenciadas pelas circunstâncias particulares sob as quais ligação ocorre. Abordagens de imagem baseados em FRET minimamente invasivos são, portanto, em princípio, perfeitamente adequado para tais tarefas, ainda envolver uma série de obstáculos que devem ser superados primeiro. O ruído gerado por autofluorescência celular limita a sensibilidade das medidas e deve, portanto, ser mantidos a um mínimo. Microscopia TIRF serve essa necessidade muito bem 12, mas exige a funcionalização de vidro-slides, idealmente sob a forma de uma bicamada lipídica planar suportada em vidro decorado com proteínas de escolha 13-15. Outra vantagem de uma abordagem que é parcialmente reconstitutive parceiros FRET recombinantes bicamada residente pode ser muito mminério facilmente marcada em um, local específico forma quantitativa e racional com fluoróforos menores e mais brilhantes do que seria possível com proteínas expressas na superfície de células. TCRs são marcados com scFv recombinante s, que não influenciam o reconhecimento de células T, como foi anteriormente testada 2. Além disso, a composição de proteína do SLB, por exemplo, a densidade de pMHCs e a escolha dos factores de acessório pode ser ajustado para a necessidades específicas. Temos experiências previamente realizada com diferentes densidades de pMHCs estimulantes, mas não detectaram diferenças significativas em 2D-koff e 2D-K D 2.
Até agora aqui o reconhecimento de moléculas do MHC da classe II tem sido tratado com apenas, principalmente por causa da natureza da sua fenda de ligação peptídeo, que é aberto em ambas as extremidades e, assim, acomoda péptidos maiores, incluindo um ligante para a fixação fluoróforo. Em alguns casos, esta abordagem pode também trabalhar para a rotulagem MHC class I moléculas 16, mas grande cuidado deve ser tomado para verificar a sua utilização em experiências. A sensibilidade das células T contra os antigénios, os quais podem ser medidos através de ensaios de proliferação de células T, assim como a cinética de ligação pMHC-TCR tal como medido in vitro por ressonância de plasma de superfície não deve ser afectada pela adição do ligante e fluoróforo para o péptido. Alternativamente, MHC de classe I próprias moléculas podem ser marcados de uma maneira específica do local, com a introdução de uma cisteína não emparelhado no interior da sequência da cadeia pesada (observações não publicadas).
Com a utilização de sondas moleculares apropriados qualquer interacção proteína-proteína sináptica pode, em princípio, ser estudados de uma forma aqui descrita. Essas sondas, por exemplo, Proteínas Projetado Ankyrin Repetir (DARPins) 17, a SCF V s ou deveria ser monovalente e deve vincular seu alvo de forma estável, sem afetar a interação de interesse. Claro, informatio estruturaln é altamente desejável para a concepção racional de sonda, mas não absolutamente necessário. Ao estabelecer um novo par de FRET parceiros, recomenda-se para gravar e analisar FRET em grandes quantidades em primeiro lugar. Locais de ligação da etiqueta pode variar consideravelmente para maximizar o sinal de FRET e também para verificar que os rendimentos medidos FRET variar em função da distância inter-corante. Uma vez que o sistema é otimizado, única molécula FRET sinais podem ser gravados através da limitação da rotulagem do FRET parceiro alta abundância de 10-30% e branqueamento da FRET parceiro baixa abundância até moléculas individuais são resolvidos no campo da iluminação.
Por último, mas não menos importante, deverá ser notado que SLBS aproximar alguns, mas não todos os aspectos da membrana plasmática fisiológico. Qualidades tais como curvatura da membrana e flexibilidade, domínio compartimentalização, rearranjos do citoesqueleto e a motilidade celular, bem como uma elevada variedade de proteínas de membrana de superfície não-expressos são representados por SLBS mas pode influenciar tele processar sob investigação. Muito esforço terá de ser investido para estabelecer modalidades de imagem que permitem a monitorização interações proteína-proteína com resolução molécula única em sinapses fisiológicas, que são inacessíveis a imagem TIRF.
Divulgações
The authors declare that they have no competing financial interest.
Agradecimentos
MA foi apoiado por uma bolsa de Schrödinger do Fundo austríaco Science (FWF, J3086-B11) e graças a Max-Planck-Sociedade de apoio financeiro e administrativo. GS e JH foram apoiados pelo Fundo de Ciência e Tecnologia de Viena (WWTF, LS13-030).
Materiais
| Name | Company | Catalog Number | Comments |
| LB-media | Fisher Scientific | 10000713 | bacterial expression |
| Sf900 II | Life Technologies | 10227402 | insect cell media for baculo virus production |
| Insect-XPRESS with L-glutamine (Lonza) | Fisher Scientific | 10564038 | insect cell media for baculo virus expression |
| Sf9 cells | Life Technologies | 11496-015 | cells for virus production and expansion |
| High Five Cells | Life Technologies | B855-02 | cells for potein expression |
| LB-media | Fisher Scientific | 10000713 | bacterial expression |
| Centramate System | Pall | protein concentartion from large volumes | |
| Centramate cassette 10kDa cutoff | Pall | OS010T12 | protein concentartion from large volumes |
| Amicon Ultra-15 Centrifugal Filter Units | EMD Millipore | UFC900308 | protein concentartion |
| Amicon Ultra-4 Centrifugal Filter Units | EMD Millipore | UFC800308 | protein concentartion |
| Amicon Stirred Ultrafiltration Cell Model 200 mL | EMD Millipore | 5123 | protein concentartion |
| Äkta pure 25L | GE Healthcare | 29-0182-24 | protein purification |
| Superdex 200 10/300 GL | GE Healthcare | 17-5175-01 | protein purification |
| Superdex 75 10/300 GL | GE Healthcare | 17-5174-01 | protein purification |
| Mono Q 5/50GL | GE Healthcare | 17-5166-01 | protein purification |
| Ni Sepharose 6 Fast Flow | GE Healthcare | 17-5318-01 | protein purification |
| Tricorn 10/20 column | GE Healthcare | 28-4064-13 | protein purification |
| Gilson HPLC system | Gilson | purificationof fluorochrome-coupled peptides | |
| Pursuit XRs C18, 5 µm particle size, 21.2*250mm column size | Agilent | A6000250X212 | purificationof fluorochrome-coupled peptides |
| Pursuit XRs C18, 5 µm particle size, 21.2*50 mm column size | Agilent | A6000050G212 | purificationof fluorochrome-coupled peptides |
| Tricorn 10/20 column | GE Healthcare | 28-4064-13 | protein purification |
| Gilson HPLC system | Gilson | purificationof fluorochrome-coupled peptides | |
| Pursuit XRs C18, 5 µm particle size, 21.2*250mm column size | Agilent | A6000250X212 | purificationof fluorochrome-coupled peptides |
| Pursuit XRs C18, 5 µm particle size, 21.2*50 mm column size | Agilent | A6000050G212 | purificationof fluorochrome-coupled peptides |
| Cy3 maleimide | GE Healthcare | PA23031 | site-specific protein labeling via mutant unpaired cysteines |
| Cy5 maleimide | GE Healthcare | PA25031 | site-specific protein labeling via mutant unpaired cysteines |
| Alexa Fluor 555 C2 Maleimide | Life Technologies | A-20346 | site-specific protein labeling via mutant unpaired cysteines |
| Alexa Fluor 647 C2 Maleimide | Life Technologies | A-20347 | site-specific protein labeling via mutant unpaired cysteines |
| Fura-2, AM, cell permeant | Life Technologies | F-1221 | calcium-sensitive dye for cell labeling |
| dimethyl sulfoxide | Sigma Aldrich | 151874 | for dissolving fura-2 am |
| Hank's Balanced Salt Solution plus calcium/magnesium | Fisher Scientific | 10225362 | imaging buffer |
| PBS | Life Technologies | 14190-136 | |
| Bovine Serum Albumin lyophilized powder | Sigma Aldrich | A2153 | supplement for imaging buffer |
| 14-4-4S antibody | affimetrix eBioscience | 14-5980-81 | blocking antibody for H2-I-Ek (recognized by the 5c.c7, 2B4 and AND TCR) |
| 5 ml polypropylene round-bottom tube | Becton Dickinson | FALCON 352063 | |
| 0.22 μm Ultrafree-MC centrifugal filter unit | EMD Millipore | UFC30GV0S | |
| Syringe filter 0.2µm | Millipore | GVWP04700 | |
| TetraSpeck Microspheres, 0.1 µm, fluorescent blue/green/orange/dark red | Life technologies | T-7279 | |
| Microscope for fura-2-based calcium measurements | LEICA | DMI4000B | |
| Microscope for (single molecule) FRET measurements | LEICA/ZEISS/NIKON/OLYMPUS | for details please refer to parallel JoVE contribution by Axmann et al. | |
| planar supported lipid bilayers | for details please refer to parallel JoVE contribution by Axmann et al. | ||
| RPMI 1640, with L-Glutamine | Life Technologies | 11554416 | T-cell media |
| non-essential amino acid 100X | Hyclone | SH30238.01 | T-cell media supplement |
| penicillin/streptomycin/L-glutamine 100x | Life Technologies | 12000226 | T-cell media supplement |
| 2-mercaptoethanol | Sigma Aldrich | M6250 | T-cell media supplement |
| mouse interleukin-2 recombinant protein | BPS Bioscience | 90185-B | T-cell media supplement |
| Research Grade Fetal Bovine Serum | Hyclone | SV30160.03 | T-cell media supplement |
| Origin (analysis program) | OrigenLab | http://www.originlab.com/ | non-linear fitting of two parameters (tauoff, [ntlag]) |
Referências
- Garcia, K. C., Adams, J. J., Feng, D., Ely, L. K. The molecular basis of TCR germline bias for MHC is surprisingly simple. Nat Immunol.. 10, 143-147 (2009).
- Huppa, J. B., et al. TCR-peptide-MHC interactions in situ show accelerated kinetics and increased affinity. Nature.. 463, 963-967 (2010).
- Huppa, J. B., Davis, M. M. The interdisciplinary science of T-cell recognition. Advances in immunology.. 119, 1-50 (2013).
- Axmann, M., Schuetz, G. J., Huppa, J. B. Single Molecule Microscopy on Planar Supported Bilayers. Journal of Vizualized Experiments J. Vis. Exp.. 101, e53158(2015).
- Xie, J., et al. Photocrosslinkable pMHC monomers stain T cells specifically and cause ligand-bound TCRs to be preferentially transported to the cSMAC. Nat Immunol. 13, 674-680 (2012).
- Jares-Erijman, E. A., Jovin, T. M. FRET imaging. Nat Biotechnol. 21, 1387-1395 (2003).
- Toebes, M., et al. Design and use of conditional MHC class I ligands. Nat Med. 12, 246-251 (2006).
- Tsumoto, K., et al. Highly efficient recovery of functional single-chain Fv fragments from inclusion bodies overexpressed in Escherichia coli by controlled introduction of oxidizing reagent--application to a human single-chain Fv fragment. J Immunol Methods. 219, 119-129 (1998).
- Ruegg, U. T., Rudinger, J. Reductive cleavage of cystine disulfides with tributylphosphine. Methods Enzymol. 47, 111-116 (1977).
- Ruprecht, V., Brameshuber, M., Schütz, G. J. Two-color single molecule tracking combined with photobleaching for the detection of rare molecular interactions in fluid biomembranes. Soft Matter. 6, 568-581 (2010).
- Dustin, M. L., Bromley, S. K., Davis, M. M., Zhu, C. Identification of self through two-dimensional chemistry and synapses. Annu Rev Cell Dev Biol. 17, 133-157 (2001).
- Axelrod, D. Cell-substrate contacts illuminated by total internal reflection fluorescence. The Journal of cell biology. 89, 141-145 (1981).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285, 221-227 (1999).
- Kaizuka, Y., Douglass, A. D., Varma, R., Dustin, M. L., Vale, R. D. Mechanisms for segregating T cell receptor and adhesion molecules during immunological synapse formation in Jurkat T cells. Proc Natl Acad Sci USA. 104, 20296-20301 (2007).
- Varma, R., Campi, G., Yokosuka, T., Saito, T., Dustin, M. L. T cell receptor-proximal signals are sustained in peripheral microclusters and terminated in the central supramolecular activation cluster. Immunity. 25, 117-127 (2006).
- Purbhoo, M. A., Irvine, D. J., Huppa, J. B., Davis, M. M. T cell killing does not require the formation of a stable mature immunological synapse. Nat Immunol. 5, 524-530 (2004).
- Binz, H. K., Stumpp, M. T., Forrer, P., Amstutz, P., Pluckthun, A. Designing repeat proteins: well-expressed, soluble and stable proteins from combinatorial libraries of consensus ankyrin repeat proteins. J Mol Biol. 332, 489-503 (2003).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados