Method Article
TCR-pMHC 바인딩 측정
요약
This manuscript describes how to conduct (single molecule) Förster Resonance Energy Transfer (FRET)- based assays to measure the binding dynamics between T-cell antigen receptor (TCR) and antigenic peptide-loaded MHC molecules as they occur within the immunological synapse of a T-cell in contact with a functionalized planar supported lipid bilayer.
초록
T-cells are remarkably specific and effective when recognizing antigens in the form of peptides embedded in MHC molecules (pMHC) on the surface of Antigen Presenting Cells (APCs). This is despite T-cell antigen receptors (TCRs) exerting usually a moderate affinity (µM range) to antigen when binding is measured in vitro1. In view of the molecular and cellular parameters contributing to T-cell antigen sensitivity, a microscopy-based methodology has been developed as a means to monitor TCR-pMHC binding in situ, as it occurs within the synapse of a live T-cell and an artificial and functionalized glass-supported planar lipid bilayer (SLB), which mimics the cell membrane of an Antigen presenting Cell (APC) 2. Measurements are based on Förster Resonance Energy Transfer (FRET) between a blue- and red-shifted fluorescent dye attached to the TCR and the pMHC. Because the efficiency of FRET is inversely proportional to the sixth power of the inter-dye distance, one can employ FRET signals to visualize synaptic TCR-pMHC binding. The sensitive of the microscopy approach supports detection of single molecule FRET events. This allows to determine the affinity and off-rate of synaptic TCR-pMHC interactions and in turn to interpolate the on-rate of binding. Analogous assays could be applied to measure other receptor-ligand interactions in their native environment.
서문
T 세포가 항원을 인식하는 방법의 근본적인 이해는 T 세포와 APC 사이에 형성된 면역 시냅스 내에서, 즉, 정확한 위치를 찾고 요구한다. 여기서, 분자 결합 동력학은 셀룰러 힘, 막 구조 및 막 단백질 사이의 측 방향 작용뿐만 아니라 시냅스 특정 기하학적 제약들을 포함하는 셀룰러 파라미터에 크게 의존하지만 관련된 상호 작용 파트너의 본질적인 생화학 적 특성에 의해 결정되지 않는다 3. 생화학 적 방법은 그들이 관련된 시냅스 막의 적어도 하나의 중단을 필요로 해상력으로 제한된다. 이러한 이유로 FRET 기반 이미징 방법은 항원 pMHCs 2 TCR의 결합을 모니터하기 위해 개발되었다. 여기에 T - 세포 재조합로 장식되어 및 사이트 특별히 TCRβ 반응 단일 사슬 항체 단편 (SCF의 V) 표시 및 계획에 직면 MHC 클래스 II 형광 표지 된 항원 펩티드와 함께로드 분자, 보조 자극 분자와 접착 단백질을 항구 AR 유리 지원 지질 이중층 (SLB 수). 시냅스는 총 내부 반사 형광 (TIRF) 현미경으로 벌크 및 단일 분자 수준에서 모니터링 할 수 있습니다 FRET의 염료 표지 TCR 및 염색 표지 pMHC 결과 사이의 바인딩.
이 문서는, T 세포에 시냅스를 분석하기위한 SLB 수를 이용하는 기능성 T 세포 칼슘 플럭스 분석을 통해 자신의 무결성을 검증하는 방법을 상세히 설명하고, 실시 대량으로 단일 분자 감도 측정 FRET 및 수집 된 데이터를 분석한다. 권장 사항은 이중층 작용에 필요한 제대로 닮아 단백질을 생산에게 제공됩니다. 이중층의 형성과 적절한 TIRF 현미경 (4)를 다시 다시 게시 추가 공용 액세스 조브 간행물을 참조하시기 바랍니다의 설치에 관한보다 구체적인 내용은.
십t "> SLB 수의 자연Functionalizable SLB 수 용이 두 지질 1- 팔미 토일 -2- 올레 오일 실 -Sn- gylcero -3- 포스 포 함유 단일 층 소포 (SUV의)로부터 생성 될 수있다 (단 : POPC, 90-99%) 및 1,2- dioleoyl- SN을 - 글리세로 -3 - {[N (5- 아미노 -1- 카르복시) 이미 노디 아세트산] 석시} (단 : DGS-NTA 니켈 1-10 %). 깨끗한 유리 슬라이드에 도포 SUV와 인접한 평면 이중층 (4)을 형성한다. DGS-NTA-NI는 합성 NTA - 니켈 함유 헤드 그룹 (그림 1A)와 폴리 히스티딘 매개 복잡한 형성을 통해 폴리 히스티딘 태그가 단백질을 고정하는 역할을한다. 안정 협회 하나를 들어 일반적으로 접착 단백질 ICAM-1과 열두 히스티딘에게 (ICAM-1-12H, B7-1 -12H)를 포함하는 하나의 태그와 공동 자극 분자 B7-1의 기본 횡단 도메인 및 세포질 꼬리를 대체합니다 (그림 1B) . 펩티드 -로드 된 클래스 II 분자 IE에서 k 개의 임베디드 막 (α 및 β) 폴리 펩타이드 쇄를 포함의. 양쪽 사슬의 트랜스 / 세포질 도메인은 각 여섯 개의 히스티딘 (IE K α β 6H 6H 또는 IE 케이 -2x6H)를 포함하는 태그로 대체되어야한다. 다른 열두 히스티딘과 α-체인을 확장하고 태그가 지정되지 않은 (12H의 β의 0H 또는 IE의 케이 -12H α IE의 K 상승을주는) β-체인의 세포 외 도메인을 떠나으로 만족스러운 결과 (그림 1B)을 발생시킨다.
pMHCs의 사이트 별 라벨
그것은 의미있는 평형 결합 상수에 FRET 측정 수율을 변환 할 수하기 위해 화학 양 론적 및 사이트 구체적으로 pMHC 레이블을하는 것이 중요합니다. 이는 재조합 히스티딘 태그가 MHC 클래스 II 분자의 2,5- 펩타이드 결합 틈에로드 합성 펩티드의 화학적 라벨링함으로써 달성 될 수있다. 펩티드 w로서 T 세포 에피토프의 모든 잔기를 포함엘 시스테인 다음에 짧은 C- 말단 링커 (GGS)으로 (예를 들어 나방 시토크롬 C (MCC) 펩타이드 ANERADLIAYLKQATK- GGSC에서, 링커는 굵은 글씨로 표시되어 있습니다). 이 시스테인은 말레이 미드 염료 유도체를 이용하여 화학량 론적으로 펩티드 라벨을 사용한다. 이 점에서 각별한주의가 시스테인 함유 펩타이드 정량 염료 커플 링을 확인에 전념해야한다. 펩타이드 염료 부가의 HPLC 정제를 권장하고 전기 분무 이온화 질량 분석에 의해 따라야한다. (염료없이) 펩타이드 유리체에 해당하는 모든 기록 대중은 불완전한 라벨을 반영한다. 이것이 사실이라면 라벨이 양적 것으로 간주 될 때까지, HPLC 정제 펩타이드는 염료 라벨의 연속 라운드를 실시해야한다. 이 방법은 시료의 이온화를위한 레이저 방사선을 포함 같이 MALDI-TOF 질량 분광법은 피해야합니다. 펩티드 질량 따라서 underrepre 판독되기 전에 처리는 부착 성 형광을 붕괴 염료 결합의 변위량도.
가의 단일 체인 F V 조각의 사용과 셀 바인딩 TCR도의 간접 아직 사이트 별 라벨
아직 사이트 별 방식으로 살아있는 세포의 표면 관련 단백질을 세포하기 위해 염료를 부착 도전하고있다. 표면이 노출 된 TCR도 장애물을 극복하기 위해, 모노클로 날 항체 TCRβ -reactive H57-197 (2)의 유전자 발 가의 단일 쇄 버젼 (SCF V)를 구성하고있다. TCR과 착물이 항체의 결정 구조가 합리적으로 (대응 FRET 파트너 염료가 부착) MHC 관련 펩티드의 C 말단 가까이에있는 세린 잔기가 치환 된 버전을 설계 할 수있다 시스테인 잔류 물. 이 돌연변이 시스테인은 염료의 결합 (그림 2)에 대한 수용체 역할을한다.
방법론은 FRET을 기록하는
NT "> 벌크 FRET 값은 선택된 간 염료의 거리 사이의 관계를 확인하는 것이 가장 적합하며, 시스템 (2) 결합이 TCR-pMHC 측정 효율을 FRET. 또한, 벌크 FRET 측정은 시냅스 TCR-pMHC 유사성의 정량적 차이 (공개 아래 참조) 및 프로토콜 3.2. 문헌 6에 도입 된 FRET 효율을 정량화하기위한 다양한 접근 방법을.이 문서 FRET을 통해 기록에서(a) 도너 복구 셉터 표백 후, 비아
(b)는 FRET 수용체 방출을 증감.
첫 번째 방법 (A)은 용이하게 광 퇴색 될 수 FRET 수용체, 오히려 광 안정성이다 도너의 사용을 필요로한다. 또한 이는 광 퇴색 셉터 더이상 도너 형광 급냉 할 수없는 것을 보장하는 것이 중요하다. 같은 감지 채널 (기증자)를 정량에 사용되는 바와 같이, 어떤 보정 요인 없습니다D 더 색수차는이 방법론 간단하고 신뢰성을 렌더링하는 고려되어야 할 필요가 없습니다. 그러나, 정량적 측정이 동일한 표본 지점에서 반복 될 수없고 FRET의 변화는 시간에 기록 할 수 없다. (수용체 표백 전) 첫 번째 무서워 기증자와 (FRET 수용체 표백 후) 두 번째 FRET 공여 이미지 수집 사이를 통과하는 시간을 최소화 분자 확산 또는 빠른 표백 단계를 목적으로한다 세포 운동에 의해 발생 효과를 방지 할 수 있습니다. 그것은 조명 및 표백 시간을 최소화하기 위해 FRET 셉터 여진 파장의 강력한 레이저 광원을 사용하는 것이 권장된다.
반면, (b) 방출 민감화 FRET 측정 접근법 FRET 도너는 흥분과 FRET 수용체의 발광은 FRET 수용체 채널에서 관찰된다. FRET 수용체 신호의 변화가 적색 편이 수용체 채널로 시간 만 무서워 기증자의 방출을 통해 기록 할 수있다 (Termed bleedthrough) 정확하게 결정하고 기록 FRET 수용체 채널에서 공제 할 필요가 기증자 여기를 통해 수용체 크로스 여기를 FRET. 이를 위해 FRET 도너 대응하고 FRET 셉터 이미지 공간적으로 정렬되어야한다.
단일 분자 검출 (SM) 이벤트를 FRET
여기 원, 민감한 카메라와 노이즈 감쇠 TIRF 현미경으로서 레이저를 이용하여 하나의 형광체의 형광 쉽게 시간 동안 추적 될 수있다. 유사한 분자간 smFRET 이벤트의 검출을위한 사실이다. 그러나 합병증 FRET 도너 bleedthrough 및 FRET 수용체의 가교 자극에 의해 발생하고, 따라서 세심 smFRET 실험에서 형광 밀도를 조정할 때는주의가 필요하다 할 수있다.
아래의 프로토콜 (프로토콜 섹션 4)에서 TCR 낮은 풍부 FRET 수용체 높은 풍부하고 pMHC에 무서워 기증자로 선정되었다. FR을 감쇠충분히, 형광 SCF (V)과 비 형광 SCF의 V를 사용하여 TCR도의 90-70%와 TCR도 10-30 %에 장식 bleedthrough 동부 기증자. 그것은 하나의 분자와 공 초점이 채널을 FRET 때문에 여기 FRET 수용체 채널은 단일 분자 채널로 선택되었다. 이 smFRET 검증의 기초가 무서워 수용체 단일 분자와 smFRET 이벤트를 정렬하는 데 도움이됩니다.
smFRET 측정을 통해 시냅스 오프 비율을 추출
양자의 광표백은 도너와 억 셉터를 FRET는 단일 분자의 상호 작용이 트레이스를 FRET의 반감기를 추출 할 때 고려되어야 할 FRET. 단일 도너 - 억 셉터 페어로서의 외관 N의 시작-FRET 관찰 신호의 수 (0) 수용체 - 리간드 복합체의 양 및 광표백 바인딩 해제하여 시간이 지남에 따라 감소된다. 다음과 같이 주어진 시간 N (t)에서 단지 생존 수는 수학적으로 표현 될 수있다 :

광표백 용어 특급 (-t / τ 표백제)의 시간 t는 즉 표백 만 조명시 발생 관찰 수 (N)의 생성물 및 (인해 비 연속적, 불연속 관찰 모드의 병, 조명 시간 t에 의해 설명된다 ). 운동 기간 exp- (t / τ OFF) 시간 t가 관찰 수 (N)의 곱과 단일 FRET 관찰 (즉, 결합 해제 운동이 연속적으로 발생 함)에 대한 시간 t 래그 내이다. 수학 식 1과 같이 표현 될 수있다 :
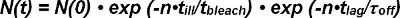
용어 τ 표백제 / τ 아픈 데백화가 발생하고, 기대 값이 백제>로서의 지수 함수 정의 될 때까지 관찰의 수를 cribes. 다음과 같이 수학 식 2를 단순화 할 수있다 :

시간 t-FRET 관찰 후 이벤트와 프레임의 수 N (t)의 기대 값은 래그)> 직접 실험으로부터 결정된다. 이 실험에서 선택된 관측 (t 래그) 및 τ 오프 (OFF k는 오프 - 속도의 역수)에 대한 미지의 값의 설정 가능한 시간에 따라 표백이 발생하기 전에, 관측 횟수의 기대 값을 백제> .
따라서, t의 적어도 두 값의 기대 값 래그)>의 계산 지연이 표백> 오프 τ의 실험적인 결정을 할 수 있습니다.
FRET 기반의 측정을 통해 시냅스 2D-K D 값을 추출
TCR 점유 즉, 바인딩 TCR도 총 TCR도 사이의 비율을 측정, 시냅스 2D-K D의 값을 결정하는 핵심이다. 한 TCR도가 무서워 기증자와 pMHCs 무서워 수용체로의 역할로 산출 프렛 측정에 식 (4)에 따르면이 용어는 직접적으로 비례한다.

= TCR 점유율과, C는 = 환산 계수
C는 FRET 시스템에 의존하고 형광체가 사용되는 상수이다. 아래 그림과 같이이 실험적으로 결정될 수있다. 수학 식 5에있어서, 2D-K D로 전환 될 때종래 이중층에 T 세포의 첨가로 TCR 리간드의 초기 밀도가 공지되어있다. 이는 SLB 부착 단백질의 높은 이동성의 SLB 수이며, 또한 (2)의 리간드는 거의 무진장 저장조를 제공하기 때문이다.

[pMHC의 초기]는 종래의 T 세포에 첨가 pMHC의 초기 밀도를 함께 =
식 4, 5 일 지금 쉽게 TCR 및 pMHC 사이의 시냅스 2D-K D를 확인할 수 있습니다. 이것은 가장 확실 수용체 표백 (프로토콜 3.1 절 참조) 후 기증자의 회복을 기반으로 FRET 측정으로 이루어집니다.
그러나, C에게 내가 FRET FRET 세기 간의 관계를 측정하고 TCR 점유 결정한다 (배경에 대해 보정, FRET 도너 및 억 셉터 bleedthrough 교차 여진은 FRET). 이를 위해, 하나의내가 기증자를 FRET과 단일 분자의 평균 강도 사건이 난 FRET SM FRET 단일 TCR 관련 FRET 기증자 형광 (예를 Cy3 또는 AF555) SM의 평균 형광 강도의 비 (R)를 알 필요가있다. R은 형광 검출에 사용되는 질문, 배출 필터와 카메라의 FRET 체제에 따라 다릅니다.
TCR은 다음 직접 식 6에 따라 결정될 수있다 점유.

R = SM과 내가 FRET 기증자 / SM을 FRET
R은 리드 H57 scFv-를 Cy3 / pMHC-Cy5의 시스템에 대한 1.45로 하였다 :
= 대량 나는 1.45 • / 대량 나는 TCR-CY3을 FRET
TCR 점유 및 FRET 수율 사이의 관계는 FRET 공여체에 의해 결정될 수있다 복구수용체 표백 후 Y. 선형 피팅 그림 4A 국지적 인 슬로프에서와 같이이 두 매개 변수가 숫자 TCR의 microclusters에 대해 서로에 대해 플롯은 (식 4)에서 변환 계수 C를 나타냅니다.
1.995로는 Cy3 / Cy5의 pMHC-FRET 시스템 및 (b) 가해 현미경 시스템 구성 -도 4a에서 설명 된 바와 같이, C가 (a)의 V H57 SCF 대한 금액. TCR은 다음과 같이 용이하게 추론 될 수 점유 :
TCR 점유 = 1.995 • 산출 FRET
프로토콜
1. 단백질 생산
1.1. 이중층 상주 단백질 : B7-1, ICAM-1, pMHC (예를 들어, IE의 K / 펩타이드)
- B7-1 -12H, ICAM-1-12H
- 익스프레스 B7-1-12H 및 배큘로 바이러스 발현 시스템을 이용하여 분비되는 천연 단백질과 같은 높은 양의 ICAM-1-12H 구축합니다.
- MonoQ 음이온 교환 크로마토 그래피 및 S200 크기 배제 크로마토 그래피의 Ni-NTA 친 화성 크로마토 그래피를 통해 배양 상청액으로부터 단백질을 정제 하였다.
- 이러한 알렉사 플 루어 488 (또는 FITC), 알렉사 형석 555 (또는를 Cy3), 알렉사 형석 647 (또는 Cy5에)의 NHS 숙신 에스테르 준비 등의 아민 반응성 염료와 정제 된 단백질 중 하나 나누어지는 레이블.
- S200 크기 배제 크로마토 그래피 후 (알렉사 형석 488, FITC) 488 nm에서 555 또는 552 내지 280 nm에서의 단백질 흡수 염료 흡수를 비교함으로써 염료 제조 회사의 사양에 따라 단량체 성 단백질의 표지 정도를 확인(알렉사 플 루어 555 또는를 Cy3) 또는 647 nm의 (알렉사 플 루어 647 또는 Cy5에).
주 :이 비율은 나중에 염료 - 표지 된 단백질의 대량 형광 신호로부터 SLB의 단백질 농도를 결정하는데 필요하다. - PBS에서 -20 ° C 플러스 50 % 글리세롤의 레이블과 형광 표지 단백질을 저장합니다.
- (여기에 : IE의 케이 -2x6H 또는 IE의 케이 -12H) pMHC
- 이후 정량적 선택 -5,7-의 형광 공역 펩티드와 교환 될 수 훨씬 저렴 UV 분해성 펩티드 대체의 존재 하에서 대장균에서 발현 봉입체로부터 MHC 클래스 II를 폴딩.
- 표준 기법 (의 Ni-NTA 친 화성 크로마토 그래피, MonoQ 음이온 - 교환 크로마토 그래피, S200 겔 여과)에 의한 리 폴딩 pMHC 착체를 정제.
- 형광 펩타이드 5, 7로 자외선 분해 가능한 펩타이드를 교환하십시오.
- pMHC이 F 착물 단량체 형광을 정화inally S200 겔 여과에 의해. 대표적인 크로마토 그램은 그림 3에 표시됩니다.
- 분광 광도법으로 정량 펩타이드 로딩을 확인합니다.
- PBS / 50 % 글리세롤로 -20 ℃에서 저장 단백질.
1.2. 단일 사슬 항체 단편 (SCF의 V s의), 사이트 별 라벨에 대한 시스테인의 도입 세대
- 대장균에서 발현 봉입체로부터 SCF V들 접힘. 여기 Tsumoto 동료 8 고안 프로토콜이 이어진다가되는 봉입체는 제 6 M 구 아니 디늄 클로라이드 펼쳐진다 완전히 점차적으로 주 과정에서 감소하고 폴딩 단백질 전개 구 아니 디늄 클로라이드의 농도를 감소시킨다.
- 10 kDa의 차단과 분자 필터 유닛을 사용하여 제대로 접혀 SCF의 V를 집중한다.
- S200 겔 여과에 의해 농축 물을 정제.
- 단량체 SCF 레이블 (TCEP)의 존재에 B> V. 단백질의 몰 비율로 가장 라벨링 반응을 수행 염료를 더 이상 1 이하의 : 실온에서 2 2 시간 이상 더 이상.
참고 : TCEP가 phosphorous- 기반 환원제이며,이 농도 9시 말레이 미드와 반응하지 않습니다. 이 때문에이 색소 말레이 미드 유도체와 반응 할 때까지 감소 된 부대 설프 하이 드릴기를 유지하는 라벨링 반응 동안 존재할 수있다. - 마지막 S75 겔 여과를 통해 단량체 SCF V 라벨링 정제. 대표적인 크로마토 그램은 그림 3에 표시됩니다.
- 염료를 결정 단백질 비율 분광을.
- PBS / 50 % 글리세롤로 -20 ℃에서 저장 단백질.
2. 칼슘 플럭스 측정
- 50 μg의의 Fura-2-AM을 함유하는 신선한 바이알을 50 μL의 물이없는 DMSO에 용해.
- 250~400g에서 2 분 동안 5 ㎖ 폴리 프로필렌 둥근 바닥 튜브에 106-T 세포를 스핀 다운.
- , (200 희석 1) 세포 현탁액을 혼합하고 배양 RT에 행크 평형 염 용액 플러스 칼슘 / 마그네슘 및 1 % 오브 알부민을 함유하는 200 μL 촬상 매체에 재현 탁 T - 세포의 Fura-2-AM 스톡 용액을 1 μL를 추가 실온에서 30 분 동안.
- 영상 버퍼에 한 번 T - 세포를 씻으십시오. 이를 위해, RT에서 촬상 버퍼 세포를 포함하는 튜브를 채우고 5 × 106의 최종 세포 밀도, 상등액을 제거하고, 즉 200 μL 촬상 완충액 (에서 세포 펠렛을 재현 탁 2 단계에서 설명 된 바와 같이 세포 펠렛 셀 ML -1). 세포는 칼슘 측정 즉시 사용 또는 3 시간까지 얼음 상에 저장 될 수있다.
- 영상 버퍼에 작용 SLB (37 ℃)에 장소 세포. 즉시 T 세포가 SLB 접촉 시작으로, 이미지의 다음 세트를 획득 할 때마다 15 ~ 30 분 30 초에 :
excitat340 ± 5 nm에서 이온, 510 +/- 40 nm에서 방출 검출
380 ± 5 nm에서 여기, 510 +/- 40 nm에서 방출 검출
DIC (선택 사항)
주 : 각각의 노출 시간이 여기 광원의 세기에 의존한다. 만족스러운 결과를 얻을 때 최대로 가능한 강도 값의 1/4 정도 (절반) 내지 340 nm 인 (380 ㎚) 양 채널의 화소 강도. 340 nm에서 여기의 Fura-2 값이 증가하고 380 nm에서 여기 사람들은 T 세포 활성화에 감소 있음을 알아 두셔야합니다. - 실행에 20 ~ 25 분, 20 ~ 50 μg의 ml의 -1의 최종 농도로 미리 예열 방지 pMHC 차단 항체의 50 ~ 100 μl를 추가합니다. 항체는 모든 pMHCs 포화과 결과로 T 세포는 항원을 인식하고 칼슘을 플럭 싱 중지 중단됩니다. 다른 5 이미지를 계속해서 기록 -. T 세포의 비 액티브 상태에 대응하는 세포 내 칼슘 농도의 기준을 획득하기 10 분 < / 리>
- 340 nm의 어떠한 세포를 포함하지 적어도 1,000 픽셀의 관심 영역 내에서 380 nm의 여기에 평균 배경 형광 신호를 결정합니다. 340 nm 내지 380 nm에서 여기 된 모든 측정은 Fura-2 이미지를 배경-빼기, 340 ㎚ / 380 nm의 강도 비율의 개별 셀 또는 셀 그룹을 계산한다. (pMHC 항체의 완전한 폐색, IE) 다섯 전회 프레임의 비율을 통해 모든 비율을 분할함으로써 강도 비 정상화.
- 플롯은 시간에의 Fura-2 비율을 정상화. 참고 : 세포와 이중층이 좋은 상태에있을 때,의 Fura-2 340 나노 미터 / 380 nm의 강도 비율은 일반적으로 세포가 이중층과 접촉을 한 15-45 초 후, 2, 5 사이의 값 채택한다. 비율은 그 때 적어도 20 분 이상 일정하게 유지 1.6과 2 사이의 값으로 떨어. 값은 안티 pMHC 항체의 첨가 후 1 드롭한다. 전형적인 예는도 5에 도시된다.
3.1. H57scF V와 TCR 장식
- 250~400g에서 2 분 동안 5 ㎖ 폴리 프로필렌 둥근 바닥 튜브에 106-T 세포를 스핀 다운.
- 미디어, 영화 세포 펠렛을 부드럽게 가만히 따르다 및 세포 현탁액에 SCF V (농도 ~ 1 ㎎ / ㎖)의 0.3 μl를 추가합니다. 대부분의 경우 측정 만의 scFv를 표지 염료 채용한다 FRET. 단일 분자 측정 레이블의 scFv의 혼합을 사용 FRET를 들어 (5-9 부분은 아무 짝 시스테인을 포함하지 않는다)과 (1 부분은 하나의 짝 염료 결합 시스테인을 포함)의 scFv를 표지 염료.
- 15 분 동안 얼음에서 인큐베이션하고 세포를 빙냉 촬상 버퍼를 이용하여 연속적으로 원심 분리를 통해 세포를 두 번 세척 하였다.
참고 : 셀 (0 ° C ~ 4 시간 2에서 SCF의 V 해리의 T 1/2) 결합 SCF V의 상당한 손실없이 얼음에 저장할 수 있습니다. 임의로 또한 TCR 유전자 변형 (및 주 유래의 T 세포의 순도 Rag-T 세포는 T 세포의 배양에 자극을 위해 첨가 된 펩티드에 응답 () 7 세포 분열까지 증식하는 세포 만이기 때문에 1/2 결핍 마우스) 및 생체 외에서 자극 된 98 %를 초과한다. B 세포는 세포 사멸을 받아야 더 이상 재배 7-10 일 후에 살아 있습니다. 몇 수지상 세포는 아직 쉽게 그들의 독특한 형태의뿐만 아니라 차별을 할 수 있습니다 생존 할뿐만 아니라, 그들은 H57 방지 TCR 베타의 scFv 조각을 결합하지 않기 때문에.
3.2. 수용체 표백 후 기증자 복구를 통해 측정 FRET
참고 : 22.5 ℃에서 50 분으로, TCR-H57 SCF의 V 단지의 반감기가 얼음에 4 시간에 달한다 있다는 사실을 숙지하고, 37 ℃에서 6.8 분에 (얼음에 약 4 시간에) 2. 만큼 H57 SCF V는 역할로 FRET 공여체로서, 측정 FRET 수익률은, 그러나, 잡음 비율 증가에 신호 H57 SCF의 V 해리로 구분하지 않습니다증가 H57 해리와.
- SLB 포함 AF647 / Cy5에 표지 pMHCs을 준비뿐만 아니라 레이블 ICAM-1과 B7 AXMANN 등. 4에 따라.
- 행크의 균형 잡힌 염 용액 플러스 칼슘 / 마그네슘 1 % 오브 알부민을 포함하는 영상 매체를 촬상 챔버의 PBS를 교환한다. 잘으로 이미지 버퍼의 피펫 400 μL를 들어, 조심스럽게 혼합 우물에서 400 μl를 제거합니다. 이 과정을 3 ~ 4 회 반복한다. 언제든지 공기 SLB를 노출시키지 마십시오.
- 현미경 무대에 영상 실을 놓고 형광 (AF647, Cy5에) SLB 분명보기에 올 때까지 초점을 조절합니다.
- 잠망경의 병진 스테이지의 이동을 통해 목적의 초점면의 외주에 광축에 포커싱 된 빔을 병렬 변환하여 TIRF 조명을 설정한다.
- TIRF 모드에서 여기 레이저 빔을 미세 조정하기 위해, AF555으로 장식 된 T 세포를 추가 / Cy3에는 SCF V 레이블 하고는 SLB에 정착 할 수 있습니다. 참고 : 기저 세포막이 SLB 위쪽으로 초점을 때보기에 와서 세포의 다른 부분에 추가로 초점에있을 때 TIRF 조명 조건이 충족된다. TIRF 제대로 조정되지 않은 경우, SLB와 접촉하지 않는 형광 T 세포 세포막의 일부는, 링으로서 나타난다. 이 경우 TIRF 조명이 달성 될 때까지, 잠망경의 병진 스테이지와, 레이저 빔을 조정한다.
- 지정된 순서와 연속으로 빠르게 (그림 6)에서 다음 여섯 가지 이미지를 수집 :
(I1은 옵션) 백색광은, 셀의 이미지를 촬영합니다
(I2는 옵션) 647 nm의 여기 (저전력), 표백제 펄스 이전 (pMHC)를 무서워 수용체의 이미지를 촬영합니다
(I3) 514 nm의 여기 (저전력), 표백제 펄스 전에 무서워 기증자의 이미지 (TCR)를 취할
647 nm의 여기 (고출력) 사진 표백제 FRET 수용체에 (I4) /> (I5) 표백제 펄스 다음 514 nm의 여기 (저전력) FRET 기증자의 이미지를 취할 수 (TCR),
(I6) 647 nm의 여기 (저전력)은 완전한 FRET 수용체 표백을 확인합니다. - 나중에 분석을 위해 이미지를 상관 할 수 있도록 이미지 (I3)과 가능한 한 짧게 (I5) 사이를 통과하는 시간을 유지한다. 여전히 T 세포의 적절한 이미징을 허용 가능한 최저 전력 레벨에서의 음원을 이용하여 최소한 FRET 도너 표백 유지.
- (I3)의 평균 강도를 결정, 관심 (ROI), 예를 들어, 전체 시냅스 또는 개별 TCR의 microcluster의 영역을 선택 (= I (3))와 (I5)에서 (= I (5)). 배경 차감 들면, 스폿 조명 밖에 동일한 차원의 ROI를 픽업 (3), (5) 평균 강도를 판정 (I (배경)). FRET 수율은 다음과 같은 작업을 수행 확인하려면 :
g "/> (식 7)
주 : 절대 FRET 레벨과 관련 그것은 도너와 이미지 (I5) 사이의 표백 및 (I3)를 보정 할 필요가있을 수 있음을 주목해야한다.
3.3. 감작 된 방출을 통해 측정 FRET
- 모든 채널에서 발광 형광 빛깔 비드를 이용하여 공간적 도너와 억 셉터 채널 정렬을 수행한다. 색수차에 의한 두 채널 사이의 공간 시프트 슈퍼 포지셔닝 개별 비드에 의해 결정될 수 있으며, 모든 다음 2 색 화상 쌍 10 개의 채널 중 하나의 보정에 적용 할 수있다.
- 혼자 무서워 기증자 형광을 포함하는 SLB의 사용과 기증자 bleedthrough의 정도를 결정합니다. 또한 비 표지 pMHC와 지질 이중층에 FRET 도너 - 표지 된 T 세포를 사용하는 것이 가능하다. 배경은 첫 번째보기의 조명 분야 외부에서 결정하고 두 채널에서 차감됩니다. 이 방법은 평균 바 ckground 보정 로아 대응하는 2 개의의 강도 (I 기증자 채널을 내가 채널을 채택)가 결정된다. 다음과 같이 bleedthrough 계수 (BTC)를 계산한다 :
 (식 8)
(식 8)
주 :이 BTC 특정 염료 및 필터 설정 조합 일정하다. - 다음과 같이 무서워 기증자 bleedthrough 이미지를 계산한다 :
 (식 9)
(식 9) - (예를 들어, IE의 K / 고객 센터 - 알렉사 플 루어 647) 처음 FRET 기증자 여기 빛 (예., 514 ㎚) 다음 수용체 여기 광으로 (예를 들어, 647 만 FRET 수용체의 형광을 포함하는 흥미로운 SLB에 의해 수용체 크로스 여기를 결정 ㎚). 다음과 같이 크로스 여기 계수 (CEC)를 계산하기 위해 FRET 수용체 채널 내에서 배경-차감 이미지를 사용하여
ftp_upload / 53,157 / 53157eq10.jpg "/> (식 10) - CEC는 도너 여기에 사용되는 레이저의 강도에 따라 같이, 각각의 측정에 일을 결정한다. 오로지 교차 여진을 통해 생성 된 이미지를 계산하기 위해 결과를 사용하여 CEC.
 (식 11)
(식 11) - 다음과 같이 bleedthrough 크로스 여기 보정 FRET 이미지를 계산한다 :
 (식 12)
(식 12)
주 : 절대 FRET 신호 (그러나 상대 FRET 수율) T 세포 막 바인딩 TCR에서 H57 SCF (V)의 해리에 민감합니다. TCR-FRET 프로브의 과도한 감소를 피하기 위해, 이중층으로 T 세포를 첨가 한 후 제 2 분 이내에 37 ℃에서 측정을 수행하고자합니다. 정량 (≥ 95 %) TCR 라벨링 측정은 제 3 분 후의 내에서 22.5 ℃ 이하 만 가능이중층에 T 세포의 첨가.
4. 단일 분자 FRET 측정
- 표본에서 1-5의 kW / μm의 2 강도를 야기 할 두 레이저의 파워를 조정한다. 자세한 내용은 AXMANN 등을 참조하시기 바랍니다. 4.
- 레이블이없는 SCF V (5-9 부)과를 Cy3 / AF555 표지 SCF V (1 부)를 혼합하여 위에서 설명한대로 라벨 T 세포. 참고 : TCR도의 일부가 무서워 - 기증자로 표시되어이 방법을. 이는 검출 가능한 상호 작용의 수를 감소 시키지만, 도너 bleedthrough에서 발생 소음이 개별 단일 분자는 FRET 이벤트를 해석 할 때 중요하다 (약 5 내지 10 1/2 1/2로) 현저하게 감소된다.
참고 :이 훨씬 더 큰 시간 범위에서 SLB-결합 pMHC (서브 초에서 TCR의 해리 이상 (시간 분)에 발생으로 TCR에서 H57의 scFv 프로브의 해리는, 측정에 영향을주지 않습니다 두 번째범위). - 현미경 무대에 AF647 표지 pMHCs뿐만 아니라 ICAM과 B7을 갖춘 SLB를 놓고 이중층 분명보기에 오도록 초점을 조정합니다.
- 선택적 : 시냅스 제외 조명 필드의 대다수를 마스크 (. AXMANN 외 4에 도시 된 바와 같이) 여기에 통로 슬릿 개구를 삽입한다. 표백 IE의 K / 고객 센터 (C) - 알렉사 플 루어 647 FRET 수용체 분자가 조명의 영역으로 이동할 수 있습니다 이쪽으로.
- (이미지 버퍼) 이중층에 H57 SCF V 장식 된 T 세포를 추가하고 시냅스가 시야에 나타날 때까지 기다립니다.
- 연속해서 2 색 검출을 통해 10 내지 20 세트의 이미지 시퀀스를 취
I1) 여기 514 nm의
I2) 여기 647 nm의 - 1 내지 5 밀리 이미지를 노출 및 일련의 이미지로서 획득.
- 이벤트 FRET 단일 분자의 동일성을 평가하기 위해, 도너와 억 셉터 bleedthrough 크로스 excita 관한 동일한 보정을 적용기. 또한, 단일 분자 이벤트가 하나의 수용체 분자와 일치해야하고 표시 한 단계 (또한 그림 7 참조)에서 사라집니다 FRET.
- 오프 속도 결정
- 단일 분자의 기록 추적 여러 획득 시간 프레임에 대한 이벤트를 FRET.
참고 : 5c.c7 사이의 오프 속도는 TCR과 IE의 K / K3는 네 가지 지연 시간 (42 밀리, 490 밀리 초, 1,007 밀리 초, 1989 밀리 초)를 25 ° C에서 측정이 예에서 (이탤릭체). - 표 1에 나타낸 바와 같이 목록 FRET은 트레이스 길이에 따라 추적한다.
- 역 누적 감쇠 기능 표시 (컬러 번호는 표 1에서 발췌)으로 (표 2)에 표 1을 변환합니다.
- 생성 된 감쇠 함수를 정상화, 특정 그룹의 모든 흔적의 합에 의해 테이블 (2)의 흔적 수를 나눈다. 시간 프레임의 수에 대해 정규화 된 값을 플롯. 제로가 포함 된 마지막 시간 프레임을 생략 할 때, 붕괴가 판독 될 수있다ILY 하나의 지수 함수 (도 8a)를 장착.
- X = t 래그 = 0.042 :도 8b에 도시 된 바와 같이, 기대 값 래그)> 즉, 본 실시 예에서 채용 지연 시간 t의 지연에 대해 상기 결정된 감쇠 함수의 지수의 마이너스 역 (플롯 S와 y = 지연)> = 1 / 0.662 = 1.511, X = 0.49 S와 y = 1 / 0.902 = 1.101, X = 1.007 S와 y = 1 / 1.131 = 0.884, X = 1.989 S와 y = 1 / 1.591 = 0.629).
- 착용감이 오프 τ는 원점으로 과학적 데이터 분석 프로그램의 비선형 피팅 함수를 사용하여 수행 할 수 식 3에 기초하여 백제>.
참고 :이 예에서와 같이 최적 2.12 +/- 0.23의 오프 τ를 산출하고, 1.53 +/- 0.06 초 표백>. - 복도를 계산• LN 오프 = τ 오프 T 1/2 오프 1/2 T 상호 작용의 F 수명 (2) (이 예제의 경우 : 1.47 s) 등이 있습니다.
- 단일 분자의 기록 추적 여러 획득 시간 프레임에 대한 이벤트를 FRET.
- 2D-K D 결정
- 식 (6)의 사용과 채용 FRET 염료 쌍 변환 계수 C를 결정하고 (도 4a) 위에서 설명한 바와 같이.
- 개별 TCR의 microclusters 또는 전체 시냅스 (도 3B 및 5)에 대한 FRET 수익률을 결정합니다.
- 식 4 변환을 사용하여 TCR 아큐으로 모든 개별 FRET 수익률 (그림 4C).
- 2D-K D의에 모든 TCR 아큐을 변환하는 식 (11)을 적용합니다. 아래에 나타낸 바와 같이, 시냅스 결합은 불균일하다. 시냅스 K D의를위한 의미있는 조치는 모든 측정 microclusters (그림 4D) (빨간색 표시) 중간이다.
- S에 2D-K의 계산
- K D와 오프 실험적으로 결정 K와 K D 값을 / K =에 K 질량 작용의 법에 케이 계산합니다.
참고 : 그림 4와 같이 실험 오프 시냅스 k는 (IE의 K / 고객 센터는 25 ° C에서 5c.c7 TCR과 상호 작용하는) 0.41의 -1입니다. 도 4E에 도시 된 바와 같이, 따라서 K D 플롯 (도 4d)의 플롯 AK로 변환 할 수있다.
- K D와 오프 실험적으로 결정 K와 K D 값을 / K =에 K 질량 작용의 법에 케이 계산합니다.
결과
의 Fura-2 칼슘 염료 통하여 세포 내 칼슘의 기록뿐만 아니라 후속 셀룰러 분석 자극 효능 및도 4에 도시되어 SLB 수의 따라서 기능을 확인하기 위해. 분명하게 된 바와 같이, 칼슘 농도는 다음과 같이 표현 (T 세포 상승 기준 즉시 즉시이 자극 SLB 수에 정착으로) 1 인 정규화의 Fura-2 시간 조사 / 380 ㎚ 비율. 칼슘 농도가 곧 TCR 결합 이로부터 차단 pMHCs가 T 세포 활성화를 종료 항체의 첨가 후에 기준선 수준으로 복귀.
도 6은 (도 4에 도시) FRET 수율을 측정하기 위해 채용되며, 2D-K D 값을 산출하는 역할을하는 셉터 표백 후 FRET 도너 회복과 관련된 대표적인 실험을 도시한다. 무서워의 신속하고 완전한 절제 후 AF555을 통해 표시 TCR을 나타냅니다 무서워 기증자 강도의 증가를, 양해 해 주시기 바랍니다cceptor 종 (여기서는 pMHCs과 관련된 AF647). 또한 분명이 무서워 채널에 강한 감소는, 즉, FRET 수용체 표백 후 FRET 공여 여기에서 FRET - 수용체 채널. 거의 보이지 나머지 신호는 기증자 bleedthrough을 FRET에 해당합니다. 개별 TCR의 microclusters 또는 전체 시냅스 내 무서워 수익률을 계산 표시된 측정 된 강도 값 (그림 6B)을 기반으로합니다.
그림 7은 두 시간 프레임에서 볼 수 단일 분자 FRET 이벤트의 궤적과 시간 경과를 나타낸다. 도입에 위에서 설명한 것과 같은 행동은 모두 결합 시냅스 TCR-pMHC의 부패와 광표백에 의해 발생합니다. 이러한 두 가지 기여를 구별하기 위해, 실험 획득 시간 프레임은 지속 기간에서 가변 할 수있다 : 광표백은 일정하게 유지하면서, FRET 이벤트 궤도 길이의 변화에만 결합 동력학에 의해 야기된다. tracelengths의 정량, W HICH도 7에 도시 된 오프 - 속도와 표백의 계산을위한 기초를 형성한다, (3) 표 1에 제공된다.
2D-K D의의 결정은 대량의 녹음이 무서워 - 기증자 표시 TCR도에 대한 수율을 FRET이 필요합니다. 실험적으로 유추 상수 C (도 4)의 사용으로, TCR의 microcluster 또는 전체 시냅스 측정 FRET 수율 TCR로 점유 전환 될 수있다, 즉, pMHC - 결합 및 총 TCR도의 비 (도 4C) . 종래 T 세포에 첨가 SLB에 본 공지 pMHC 밀도로, 값은 시냅스 2D-K D 값 (도 4d)를 결정하기 위해 적용될 수있다. 온 속도는 질량 작용의 법칙으로 계산 될 수있다 (에 2D-K = 2D-K / 2D-K D를) 결정 시냅스에서 오프 속도와 2D-KD 값.
1 "SRC ="/ 파일 / ftp_upload / 53157 / 53157fig1.jpg "/>
도 1의 평면 유리 지원 지질 이중층 (SLB) 시스템의 개략 회로도. (A) SLB 수는 해당 지질로 구성된 POPC (90-99%) 및 합성 지질 DGS의 Ni-NTA (1-10%)로 구성하고 깨끗한 유리 표면이 작은 단일 층 소포 (포드 SUV)으로 충전되면 자발적으로 형성된다. (B)가 형성되면, 예컨대 SLB 수는 T 세포에 대한 장갑차 역할을하는 수용성 폴리 히스티딘 - 태그 pMHCs 세포 유래의 부분, 보조 자극 B7-1 단백질과 ICAM-1의 접착 단백질로 작용 화 될 수있다. SLB 수를 준비하는 방법에 대한 자세한 내용은 AXMANN 등. (4)를 참조하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

Figu 2. 포스터 공명 에너지 재 전송 기반의 분석은 TCR-pMHC가 현장에서 바인딩을 정량한다. (A) pMHC 결합 H57 단일 사슬 단편과 복합 TCR의 복합 구조물은 본원에 기재된 FRET 기반 접근법 나타낸다. 약 41A FRET을받은 두 대응하는 형광 물질을 분리하는 짧은 거리를합니다. 형광 - 말레이 미드에 대한 수용체 사이트는 녹색과 빨간색으로 표시됩니다. (B)는 현장에서 TCR-pMHC 상호 작용을 검출하는 원리가 설명된다. 만 SCF V는 특정 복합체를 형성 TCR도 및 pMHCs (여기에 IE의 k)를, -decorated, 측정 FRET 신호에 상승을 제공합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
"/>
도 SCF V S 단량체와 펩티드 -로드 된 IE의 K -2x6H 분자 최종 겔 여과 단계주는 상승 3. 크로마토. X 축이 용액에 보유 체적을 나타내고, Y 축에는 임의의 단위로 280 nm에서 (AU)을 흡광도를 나타낸다 . (A) H57 SCF의 V 부위 - 특이 알렉사 형석 555 말레이 미드 단백질 (단계 1.2.5)에서 미 반응 된 염료를 분리 S75 크로마토 그래피로 표지. 고정 간격으로 14 - 15 ㎖ (점선)에 대응 분획 단량체 H57 SCF의 V 라벨링 나타낸다. UV 분해성 ANP 공간 홀더 펩타이드 복합체 (B) IE의 유전율 -2x6H 분자하면, UV가 조사 된 부위 - 특이 알렉스 함께 배양했다 647 말레이 미드 표지 펩티드 마지막 자유 펩티드 (단계 1.1.2.4)로부터 단백질을 분리하는 S200 크로마토. 포함이 제대로 접혀 점선과 단량체 pMHCs 사이의 간격. (A, B) 0.7 ml의 샘플 럼 (0 mL의 점)의 시작 컬럼에 적용 하였다. 수집 된 분획을 농축 하였다. 단백질을 염색 비율 전에 PBS / 50 % 글리세롤에 대한 투석에 photospectrometry에 의해 결정되었다 (-20 °에서 저장). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
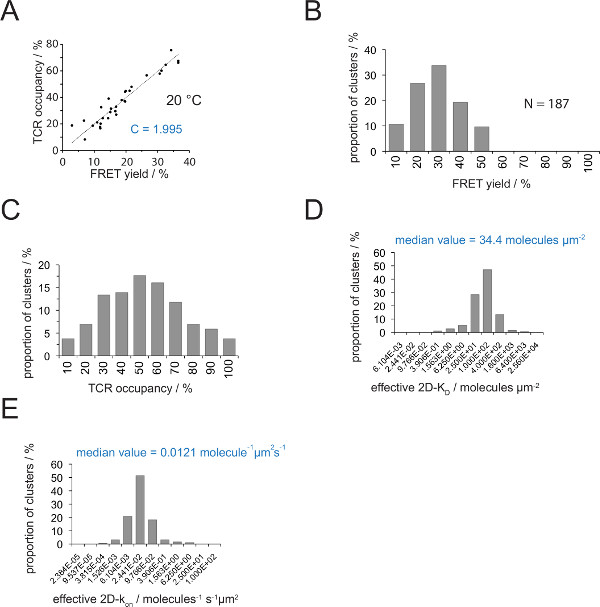
그림 4. 결정 2D-K D S와 S의 2D-K. (A) 수용체의 표백 및 TCR 점유율이 실험적으로 측정 한 후 기증자의 회복에 의해 결정되는 FRET 수익률 사이의 상관 관계. 4.2 절에 설명 된대로 TCR 점유율은 개별 TCR의 microclusters에 대해 판단 할 수있다. 상기 데이터의 선형 피팅을 행함으로써 표시의 기울기는 TCR 간의 비율 C 같다점유하고 무서워 수율. C는 FRET 시스템과 사용 된 형광 (여기를 Cy3와 Cy5에)에 대한 일정한 다릅니다. 이 예는 (B). 1.988를 산출 수율 데이터는 개별 TCR의 microclusters 결정했다 FRET (N = 187, 온도 = 24 ° C) 수용체 표백의 기증자 복구를 통해. 히스토그램 막대 아래 번호 간격 내의 상한을 나타낸다. 측정 곱하여 (B)에 도시 한 데이터 (C)는 변환 (A)가 C에서 결정된 상수 수율 FRET. 바 아래 숫자 간격 내의 상한을 나타낸다. (D) 히스토그램 (세미 - 대수,베이스 = 4)의 개별 TCR microclusters 측정 2D-K D (S)의 분포를 도시. 중간 2D-K (D)는 청색으로 표시됩니다. 바 아래 숫자는 (E) (D)에 도시 한 히스토그램. 간격 내의 상한을 나타내는 INT를 전환시켰다OA 2D-K 24 ° C의 오프 시냅스 K를 사용 -histogram (반 대수,베이스 = 4)에 (0.41 S-1). 값에 결정된 중간 2D-k는 청색으로 표시됩니다. 데이터가 원래 Huppa 등. 2 년에 출판 된 새로운 형식으로 여기에 시각입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

SLB 수의 그림 5. 기능 검증은 T 세포 자극 및 이미징 위해 사용. 의 Fura-2와 함께로드 (A) TCR-트랜스 제닉 T 세포는 항원 폭발 pMHCs, ICAM-1 및 B-7을 자극하는 형질 SLB 직면 하였다. 셀룰러 340 nm의 380 nm에서 흥분의 Fura-2 방출뿐만 아니라 DIC 이미지가 기록되었다. 나타낸 바와 같이, 발광 강도 비의 값은 34로 여기0과 380 nm의는 오른쪽 창에 표시됩니다. 자극 SLB 수 접촉 pMHC이 실험 실행에 항체를 14 분 동안 차단의 첨가는 T 세포 휴식에 필적 세포 내 칼슘 농도의 저하를 초래. (B)의 평균의 Fura-2 비율의 전형적인 시간 프로파일 T를 세포는 특징이있다 항체 - 매개 봉쇄 박탈 후 항원 비 - 활성화 T 세포 또는 T 세포에 비해 2 내지 4 배 높은 세포 내 칼슘의 상승 초기. 녹색 동그라미가 (A)에 예시 된 시점을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
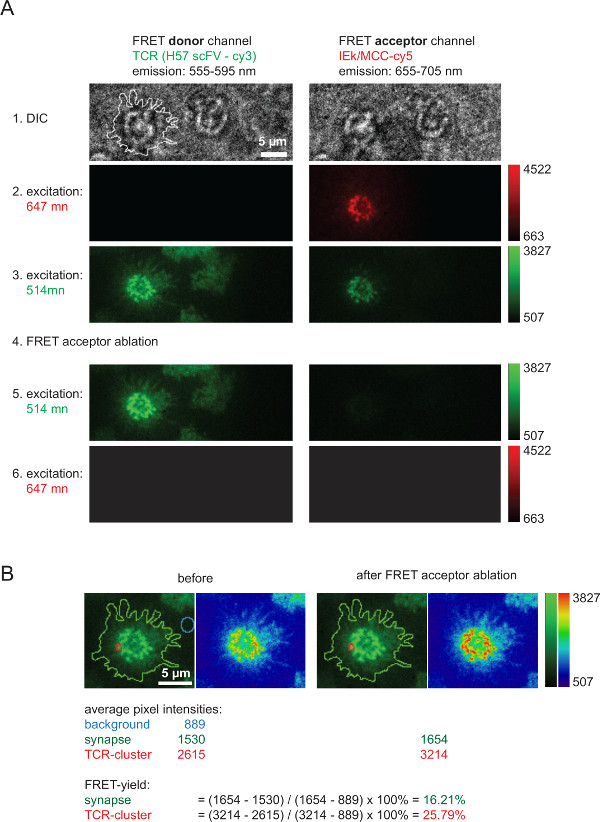
FRET 수용체 표백 후 FRET 기증자 복구를 통해 측정 그림 6. 벌크는 수율을 FRET. 표시됨 (A)는 전형적인 시냅스 무서워 - 측정의 예입니다. 왼쪽과 상단에 표시되어있는 바와 같이 일련의 이미지가 무서워 기증자 및 FRET 수용체 채널에 상승 제공 방출 빔 스플리터를 사용하여 인수 한 (빔 스플리터에 대한 자세한 내용은 AXMANN 참조 등 4). DIC 좌측 이미지에 표시된 선은 T 세포 시냅스의 경계를 나타낸다. (B).도 FRET 수용체 표백 (단계 4) 후 FRET 도너 채널 강도의 증가는 FRET 수용체 채널 내의 강도의 손실을 참고 개별 시냅스 영역 또는 전 시냅스에 대해 나타낸 바와 같이, 효율을 정량화 할 수있다 FRET. 검사의 경우, 이전과 FRET 수용체 표백 후 이미지는 두 개의 룩업 테이블 (LUT를, 녹색과 물리학)의 사용으로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
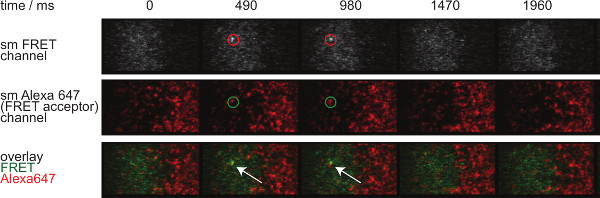
그림 7. 단일 분자 이벤트가 나타나 insingle 단계를 사라와 완벽하게 하나의 FRET 수용체의 형광과 정렬 FRET. 단일 분자 FRET 이벤트의 시간 경과가 표시됩니다. 이미지가 백 조명 EMCCD 카메라를 사용하여 획득 하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
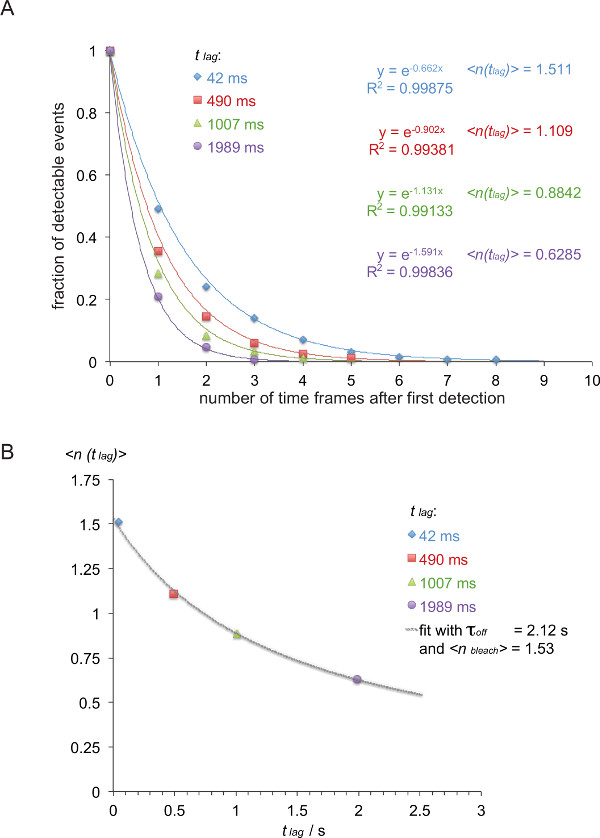
τ를 결정 그림 8. = 1 / 측정 smFRET 궤도에서 떨어져 케이. (A) 5c.c7 TCR 유전자 변형 T 세포 폭발이 IE를 <인식 장식 H57 SCF V -AF555에서 파생 관찰 FRET 신호 (의 정규화 된 누적 금액SUP> / K3-AF647는 네 개의 다른 타임 래그 (42 밀리 초, 490 밀리 초, 밀리 1,007, 1,989 밀리 초) 24 ℃)에서 관측들의 총 수의 함수로서 플로팅 하였다 K. 모노 - 지수 피팅 함수. 기대 값 래그)>의 음극 역 대응을 야기 (B)의 기대 값이 지연 t 지연에 대해 도시하고, 래그)> 식을 이용하여 장착 = τ / 오프 {(표백> / 오프 τ) + T 지연이} τ를 산출하고 표백>.에 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
동일계에서 단백질 - 단백질 상호 작용을 측정하는 것은 이러한 pMHC TCR-11 결합의 낮은 친 화성 상호 작용을 취급 할 때 특히 매우 바람직하다. 온 - 레이트뿐만 아니라 이러한 상호 작용의 안정성은 크게 결합이 일어나는 상황 하에서 특정의 영향 때문이다. 최소 침습 FRET 기반 이미징 방식 완벽 등의 작업에 적합하다 원리에 따라서, 제 아직 극복해야 할 장애물의 수를 포함한다. 자기 형광 세포에 의해 생성 된 잡음은 측정의 감도를 제한하고 따라서 최소한으로 유지되어야한다. TIRF 현미경 적으로 선택 13-15의 단백질과 장식 평면 유리 지원 지질 이중층의 형태로, 잘 (12)이 필요성을 제공하지만 유리 슬라이드의 작용을 필요로한다. 부분적 reconstitutive 접근법의 또 다른 장점은 재조합 이중층 상주 FRET 파트너 훨씬 m 될 수 있다는쉽게 작고 밝은 형광으로 양적, 사이트 별과 합리적인 방식으로 표시 광석 세포 표면 발현 된 단백질로 가능한 것보다. 이전에 2 테스트되었습니다로 TCR도는 재조합 SCF V S, T 세포의 인식에 영향을주지 않는 태그가 있습니다. 또한, SLB의 단백질 조성물은, 예를 들면 pMHCs의 밀도 및 액세서리 인자의 선택은 하나의 특정 요구에 조정될 수있다. 우리는 이전에 자극 pMHCs의 밀도 변화와 실험을 수행했지만, 오프 2D가-K 및 2D-K (D2)에서 유의 한 차이가 발견되지 않았다.
지금까지 여기 MHC 클래스 II 분자의 인식은 주로 때문에 양단이 개구들이 펩타이드 결합 틈의 특성으로 만 처리되었으며, 따라서 형광 물질을 부착하기위한 링커 펩티드를 포함 큰 수용한다. 어떤 경우에는 이러한 접근 방식은 또한 라벨의 MHC CIA 요원에 대한 작동하지 않을 수 있습니다SS 나는 16 분자하지만 큰주의는 실험에 사용을 확인하기 위해주의해야한다. 표면 플라즈몬 공진에 의해 시험 관내에서 측정 된 T 세포 증식 분석법뿐만 아니라 키네틱 결합 pMHC-TCR을 통해 측정 할 수있는 항원을 향해 T 세포의 감도는 링커 및 형광 물질에의 첨가에 의해 영향을 받아서는 안 펩티드. 또한, 내가 자신을 분자 MHC 클래스는 중쇄 (게시되지 않은 관찰)의 순서 내 짝 시스테인의 도입으로 사이트 별 방식으로 표시 할 수 있습니다.
적절한 분자 프로브를 이용하여 임의의 시냅스 단백질 - 단백질 상호 작용은 원칙적으로 본 명세서에 기재된 방법으로 연구 될 수있다. 예를 들어, 이러한 프로브는, SCF V의 또는 설계 Ankyrin 반복 단백질 (DARPins) (17)는 1가 있어야하며 관심의 상호 작용에 영향을주지 않고 안정적으로 자신의 목표를 결합해야합니다. 물론, 구조 informatio를N은 합리적인 프로브 설계에 매우 바람직하지만 절대적으로 필요합니다. FRET 파트너의 새로운 쌍을 설정할 때, 그것은 기록하고 처음으로 대량으로 FRET을 분석하는 것이 좋습니다. 라벨의 부착 위치는 FRET 신호를 최대화하기 위해 상당히 변화 될 수 있고 또한 수율이 FRET 측정 염료 간 거리에 따라 다를 수 있음을 확인하기 위해. 시스템이 최적화되면, 단일 분자는 신호 10-30%에 높은 풍부 FRET 파트너의 표시를 제한하고 단일 분자 조명 분야에서 분해 될 때까지 낮은 풍부 FRET 파트너 표백에 의해 기록 될 수있다 FRET.
마지막으로 그것이 SLB 수 어떤 근사하지만 주목해야하지 생리적 세포막의 모든 측면. 이러한 막 곡률과 유연성, 도메인 구획화, 세포 골격 재 배열 및 세포 운동성뿐만 아니라 표면 발현 막 단백질의 높은 다양한로서 자질 SLB 수로 표현되지 않고 T에 영향을 미칠 수그는 조사를 받고 처리합니다. 많은 노력이 TIRF 영상에 액세스 할 수없는 생리적 인 시냅스에서 단일 분자 해상도와 단백질 - 단백질 상호 작용을 모니터링 허용 영상 방식을 설정하는 데 투자해야합니다.
공개
The authors declare that they have no competing financial interest.
감사의 말
석사 재정 및 행정 지원을위한 오스트리아 과학 기금 (FWF, J3086-B11) 및 감사의 슈뢰딩거의 교제 막스 플랑크 협회에 의해 지원되었다. GS와 JH는 비엔나 과학 기술 기금 (WWTF, LS13-030)에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| LB-media | Fisher Scientific | 10000713 | bacterial expression |
| Sf900 II | Life Technologies | 10227402 | insect cell media for baculo virus production |
| Insect-XPRESS with L-glutamine (Lonza) | Fisher Scientific | 10564038 | insect cell media for baculo virus expression |
| Sf9 cells | Life Technologies | 11496-015 | cells for virus production and expansion |
| High Five Cells | Life Technologies | B855-02 | cells for potein expression |
| LB-media | Fisher Scientific | 10000713 | bacterial expression |
| Centramate System | Pall | protein concentartion from large volumes | |
| Centramate cassette 10kDa cutoff | Pall | OS010T12 | protein concentartion from large volumes |
| Amicon Ultra-15 Centrifugal Filter Units | EMD Millipore | UFC900308 | protein concentartion |
| Amicon Ultra-4 Centrifugal Filter Units | EMD Millipore | UFC800308 | protein concentartion |
| Amicon Stirred Ultrafiltration Cell Model 200 mL | EMD Millipore | 5123 | protein concentartion |
| Äkta pure 25L | GE Healthcare | 29-0182-24 | protein purification |
| Superdex 200 10/300 GL | GE Healthcare | 17-5175-01 | protein purification |
| Superdex 75 10/300 GL | GE Healthcare | 17-5174-01 | protein purification |
| Mono Q 5/50GL | GE Healthcare | 17-5166-01 | protein purification |
| Ni Sepharose 6 Fast Flow | GE Healthcare | 17-5318-01 | protein purification |
| Tricorn 10/20 column | GE Healthcare | 28-4064-13 | protein purification |
| Gilson HPLC system | Gilson | purificationof fluorochrome-coupled peptides | |
| Pursuit XRs C18, 5 µm particle size, 21.2*250mm column size | Agilent | A6000250X212 | purificationof fluorochrome-coupled peptides |
| Pursuit XRs C18, 5 µm particle size, 21.2*50 mm column size | Agilent | A6000050G212 | purificationof fluorochrome-coupled peptides |
| Tricorn 10/20 column | GE Healthcare | 28-4064-13 | protein purification |
| Gilson HPLC system | Gilson | purificationof fluorochrome-coupled peptides | |
| Pursuit XRs C18, 5 µm particle size, 21.2*250mm column size | Agilent | A6000250X212 | purificationof fluorochrome-coupled peptides |
| Pursuit XRs C18, 5 µm particle size, 21.2*50 mm column size | Agilent | A6000050G212 | purificationof fluorochrome-coupled peptides |
| Cy3 maleimide | GE Healthcare | PA23031 | site-specific protein labeling via mutant unpaired cysteines |
| Cy5 maleimide | GE Healthcare | PA25031 | site-specific protein labeling via mutant unpaired cysteines |
| Alexa Fluor 555 C2 Maleimide | Life Technologies | A-20346 | site-specific protein labeling via mutant unpaired cysteines |
| Alexa Fluor 647 C2 Maleimide | Life Technologies | A-20347 | site-specific protein labeling via mutant unpaired cysteines |
| Fura-2, AM, cell permeant | Life Technologies | F-1221 | calcium-sensitive dye for cell labeling |
| dimethyl sulfoxide | Sigma Aldrich | 151874 | for dissolving fura-2 am |
| Hank's Balanced Salt Solution plus calcium/magnesium | Fisher Scientific | 10225362 | imaging buffer |
| PBS | Life Technologies | 14190-136 | |
| Bovine Serum Albumin lyophilized powder | Sigma Aldrich | A2153 | supplement for imaging buffer |
| 14-4-4S antibody | affimetrix eBioscience | 14-5980-81 | blocking antibody for H2-I-Ek (recognized by the 5c.c7, 2B4 and AND TCR) |
| 5 ml polypropylene round-bottom tube | Becton Dickinson | FALCON 352063 | |
| 0.22 μm Ultrafree-MC centrifugal filter unit | EMD Millipore | UFC30GV0S | |
| Syringe filter 0.2µm | Millipore | GVWP04700 | |
| TetraSpeck Microspheres, 0.1 µm, fluorescent blue/green/orange/dark red | Life technologies | T-7279 | |
| Microscope for fura-2-based calcium measurements | LEICA | DMI4000B | |
| Microscope for (single molecule) FRET measurements | LEICA/ZEISS/NIKON/OLYMPUS | for details please refer to parallel JoVE contribution by Axmann et al. | |
| planar supported lipid bilayers | for details please refer to parallel JoVE contribution by Axmann et al. | ||
| RPMI 1640, with L-Glutamine | Life Technologies | 11554416 | T-cell media |
| non-essential amino acid 100X | Hyclone | SH30238.01 | T-cell media supplement |
| penicillin/streptomycin/L-glutamine 100x | Life Technologies | 12000226 | T-cell media supplement |
| 2-mercaptoethanol | Sigma Aldrich | M6250 | T-cell media supplement |
| mouse interleukin-2 recombinant protein | BPS Bioscience | 90185-B | T-cell media supplement |
| Research Grade Fetal Bovine Serum | Hyclone | SV30160.03 | T-cell media supplement |
| Origin (analysis program) | OrigenLab | http://www.originlab.com/ | non-linear fitting of two parameters (tauoff, [ntlag]) |
참고문헌
- Garcia, K. C., Adams, J. J., Feng, D., Ely, L. K. The molecular basis of TCR germline bias for MHC is surprisingly simple. Nat Immunol.. 10, 143-147 (2009).
- Huppa, J. B., et al. TCR-peptide-MHC interactions in situ show accelerated kinetics and increased affinity. Nature.. 463, 963-967 (2010).
- Huppa, J. B., Davis, M. M. The interdisciplinary science of T-cell recognition. Advances in immunology.. 119, 1-50 (2013).
- Axmann, M., Schuetz, G. J., Huppa, J. B. Single Molecule Microscopy on Planar Supported Bilayers. Journal of Vizualized Experiments J. Vis. Exp.. 101, e53158(2015).
- Xie, J., et al. Photocrosslinkable pMHC monomers stain T cells specifically and cause ligand-bound TCRs to be preferentially transported to the cSMAC. Nat Immunol. 13, 674-680 (2012).
- Jares-Erijman, E. A., Jovin, T. M. FRET imaging. Nat Biotechnol. 21, 1387-1395 (2003).
- Toebes, M., et al. Design and use of conditional MHC class I ligands. Nat Med. 12, 246-251 (2006).
- Tsumoto, K., et al. Highly efficient recovery of functional single-chain Fv fragments from inclusion bodies overexpressed in Escherichia coli by controlled introduction of oxidizing reagent--application to a human single-chain Fv fragment. J Immunol Methods. 219, 119-129 (1998).
- Ruegg, U. T., Rudinger, J. Reductive cleavage of cystine disulfides with tributylphosphine. Methods Enzymol. 47, 111-116 (1977).
- Ruprecht, V., Brameshuber, M., Schütz, G. J. Two-color single molecule tracking combined with photobleaching for the detection of rare molecular interactions in fluid biomembranes. Soft Matter. 6, 568-581 (2010).
- Dustin, M. L., Bromley, S. K., Davis, M. M., Zhu, C. Identification of self through two-dimensional chemistry and synapses. Annu Rev Cell Dev Biol. 17, 133-157 (2001).
- Axelrod, D. Cell-substrate contacts illuminated by total internal reflection fluorescence. The Journal of cell biology. 89, 141-145 (1981).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285, 221-227 (1999).
- Kaizuka, Y., Douglass, A. D., Varma, R., Dustin, M. L., Vale, R. D. Mechanisms for segregating T cell receptor and adhesion molecules during immunological synapse formation in Jurkat T cells. Proc Natl Acad Sci USA. 104, 20296-20301 (2007).
- Varma, R., Campi, G., Yokosuka, T., Saito, T., Dustin, M. L. T cell receptor-proximal signals are sustained in peripheral microclusters and terminated in the central supramolecular activation cluster. Immunity. 25, 117-127 (2006).
- Purbhoo, M. A., Irvine, D. J., Huppa, J. B., Davis, M. M. T cell killing does not require the formation of a stable mature immunological synapse. Nat Immunol. 5, 524-530 (2004).
- Binz, H. K., Stumpp, M. T., Forrer, P., Amstutz, P., Pluckthun, A. Designing repeat proteins: well-expressed, soluble and stable proteins from combinatorial libraries of consensus ankyrin repeat proteins. J Mol Biol. 332, 489-503 (2003).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유