Method Article
Mess TCR-pMHC Binding
In diesem Artikel
Zusammenfassung
This manuscript describes how to conduct (single molecule) Förster Resonance Energy Transfer (FRET)- based assays to measure the binding dynamics between T-cell antigen receptor (TCR) and antigenic peptide-loaded MHC molecules as they occur within the immunological synapse of a T-cell in contact with a functionalized planar supported lipid bilayer.
Zusammenfassung
T-cells are remarkably specific and effective when recognizing antigens in the form of peptides embedded in MHC molecules (pMHC) on the surface of Antigen Presenting Cells (APCs). This is despite T-cell antigen receptors (TCRs) exerting usually a moderate affinity (µM range) to antigen when binding is measured in vitro1. In view of the molecular and cellular parameters contributing to T-cell antigen sensitivity, a microscopy-based methodology has been developed as a means to monitor TCR-pMHC binding in situ, as it occurs within the synapse of a live T-cell and an artificial and functionalized glass-supported planar lipid bilayer (SLB), which mimics the cell membrane of an Antigen presenting Cell (APC) 2. Measurements are based on Förster Resonance Energy Transfer (FRET) between a blue- and red-shifted fluorescent dye attached to the TCR and the pMHC. Because the efficiency of FRET is inversely proportional to the sixth power of the inter-dye distance, one can employ FRET signals to visualize synaptic TCR-pMHC binding. The sensitive of the microscopy approach supports detection of single molecule FRET events. This allows to determine the affinity and off-rate of synaptic TCR-pMHC interactions and in turn to interpolate the on-rate of binding. Analogous assays could be applied to measure other receptor-ligand interactions in their native environment.
Einleitung
Ein grundlegendes Verständnis davon, wie T-Zellen erkennen Antigene erfordert der Suche an der richtigen Stelle, das heißt, innerhalb der immunologischen Synapse zwischen der T-Zelle und der APC gebildet. Hier Molekular Bindungskinetik werden nicht nur von den inhärenten biochemischen Eigenschaften der Interaktionspartner beteiligt, aber bestimmt ab zu einem großen Teil auf die Zellparameter, die zellulären Kräfte, Membran-Architektur und lateralen Wechselwirkungen zwischen Membranproteinen sowie Synapse spezifischen geometrischen Beschränkungen beinhalten 3. Biochemische Ansätze zu Auflösungsvermögen, da sie die Zerstörung von mindestens einem der synaptischen Membranen beteiligt notwendig beschränkt. Aus diesem Grund wird ein FRET-basierten Imaging-Methode wurde entwickelt, um zu überwachen Bindung des TCR, um antigene pMHCs 2. Hier T-Zellen mit einem rekombinanten eingerichtet und ortsspezifisch TCR & bgr;-reaktives Einzelketten-Antikörperfragment (SCF V) markiert und mit Plan konfrontiert AR-Glas-gestützten Lipiddoppelschichten (SLBs), die MHC Klasse II-Moleküle mit einem fluoreszierend markierten antigenen Peptid beladen, costimulatorischen Molekülen und Adhäsionsproteine zu beherbergen. Synaptischen Bindung zwischen Farbstoff markierten TCR und farbstoffmarkierten pMHC ergibt FRET, der auf einer Masse und Einzelmolekülebene durch Total Internal Reflection Fluoreszenz (TIRF) -Mikroskopie überwacht werden können.
In diesem Artikel wird im Detail erläutert, wie man SLBs zur Bestimmung von T-Zellsynapsen zu nutzen, überprüfen Sie ihre Integrität über eine funktionelle T-Zell-Calcium-Flux Assay Verhalten FRET-Messungen in der Masse und mit Einzelmolekülempfindlichkeit und die erfassten Daten zu analysieren. Empfehlungen sind auf die Herstellung einwandfrei angepaßt Proteine, die für Doppelschicht Funktionalisierung erforderlich angeboten. Für genauere Informationen bezüglich Doppelschichtbildung und Aufbau eines geeigneten TIRF-Mikroskop bitte zu einem zusätzlichen Zugang der Öffentlichkeit JoVE Publikation veröffentlicht Rücken an Rücken 4 beziehen.
Zelt "> Natur von SLBsFunktionalisierbaren SLBs leicht von unilamellaren Vesikeln (SUVs), welche die beiden Lipide 1-Palmitoyl-2-oleoyl-sn-gylcero-3-phosphocholin erzeugt werden (kurz: POPC, 90-99%) und 1,2-Dioleoyl-sn - glycero-3 - {[N (5-Amino-1-carboxypentyl) Iminodiessigsäure] Succinyl} (kurz: DGS NTA-Ni, 1-10%). SUVs auf sauberen Glasobjektträger verteilt, um eine zusammenhängende planare Doppelschicht 4 zu bilden. DGS-NTA-Ni dazu dient, Polyhistidin-tag-Proteine über Polyhistidin-vermittelte Komplexbildung mit dem synthetischen NTA-Ni-enthaltenden Kopfgruppe (1A) zu verankern. Für stabile Assoziation einer Regel ersetzt die nativen Transmembran-Domäne und den cytoplasmatischen Schwanz des Adhäsionsprotein ICAM-1 und der co-stimulierenden Molekül B7-1 mit einem Tag mit zwölf Histidine (ICAM-1-12h, B7-1 -12H) (1B) . Das Peptid-beladenen Klasse II-Molekül IE k enthält zwei Membran-Embedded (α und β) Polypeptidkettes. Die Trans / zytoplasmatischen Domänen beider Ketten müssen mit einem Tag mit sechs Histidinen jeweils (IE k α 6H β 6H oder IE k -2x6H) ersetzt werden. Als Alternative zur Verlängerung der α-Kette mit zwölf Histidinen und dem Verlassen der extrazellulären Domäne des β-Kette ohne Tags (was zu IE k α 12H β 0H oder IE k -12H) führt zu zufriedenstellenden Ergebnissen (Abbildung 1B).
Standortspezifische Kennzeichnung pMHCs
Es ist wichtig, um die pMHC stöchiometrisch und ortsspezifisch, um zu kennzeichnen, um in der Lage zu mess FRET Renditen in sinnvolle Gleichgewichtsbindungskonstanten zu konvertieren. Dies kann durch chemische Markierung eines synthetischen Peptids, das in die Peptidbindungsspalte von rekombinanten Histidin-markierten MHC Klasse II-Moleküle geladen 2,5 erreicht wird. Das Peptid umfaßt alle Rückstände des T-Zell-Epitop wie well als eine kurze C-terminale Linker (GGS), gefolgt von Cystein (zB in der Motten Cytochrom c (MCC) Peptid ANERADLIAYLKQATK- GGSC, der Linker ist fett markiert). Dieses Cystein wird verwendet, um das Peptid stöchiometrisch unter Verwendung von Maleimid-Farbstoff-Derivate zu bezeichnen. An dieser Stelle sei besonders vorsichtig, um die Überprüfung quantitative Farbstoff Kopplung an die Cystein-enthaltenden Peptid gewidmet sein. HPLC-Reinigung des Peptids Farbstoff Addukt wird empfohlen und ist vom Elektrospray-Ionisations-Massenspektroskopie verfolgt werden. Etwaige zeichneten Massen entsprechend der Peptid Edukt (ohne Farbstoff) zu reflektieren unvollständige Etikettierung. Wenn dies wahr ist, sollte der HPLC-gereinigte Peptid an aufeinander folgenden Runden von Farbstoff-Markierung unterzogen werden, bis die Kennzeichnung gilt quantitativ. Beachten Sie, dass der MALDI-TOF-Massenspektroskopie sollte vermieden werden, da diese Methode beinhaltet Laserstrahlung für die Proben Ionisation werden. Diese Behandlung löst die beigefügten empfindliche Fluorophore vor Peptidmasse wird ausgelesen und damit underrepre SENTS Grade Farbstoff-Konjugation.
Indirekte noch ortsspezifische Markierung von zellgebundenem TCRs mit der Verwendung von monovalenten Einzelketten-Fv-Fragmente
Es ist immer noch eine Herausforderung, Farbstoffe oberflächenassoziierten Proteine lebender Zellen in einer ortsspezifischen Weise Zelle zu befestigen. Diese Hürde für oberflächenexponierten TCRs zu überwinden, wurde eine monovalente einkettige Version (SCF V) aus den Genen des TCR & bgr -reaktive monoklonalen Antikörper H57-197 2 errichtet. Die Kristallstruktur dieses Antikörpers im Komplex mit dem TCR ermöglicht, rational zu entwerfen eine Version, bei der ein Serinrest in der Nähe des C-Terminus der MHC-assoziiertes Peptid (wobei die entsprechenden FRET Partner Farbstoff angebracht ist) ist für eine substituierte Cysteinrest. Diese Mutante Cystein dient dann als Akzeptor für Farbstoff-Konjugation (Abbildung 2).
Methoden zur FRET aufnehmen
nt "> Groß FRET-Werte sind am besten geeignet, um die Beziehung zwischen gewählten Inter-Farbstoff Entfernungen Akkreditierung und FRET-Effizienzen in diesem TCR-pMHC gemessenen Bindungssystem 2. Darüber hinaus Groß FRET-Messungen zeigen, qualitative und quantitative Unterschiede in der synaptischen TCR-pMHC Affinitäten ( siehe unten und Protokoll Abschnitt 3.2). Verschiedene Ansätze zur Quantifizierung der FRET-Effizienzen wurden in der Literatur 6 eingeführt. In über dieser Artikel FRET erfasst(a) Spender Erholung nach Akzeptor Bleichen, und über
(b) sensibilisiert FRET-Akzeptor-Emission.
Das erste Verfahren (a) erfordert die Verwendung eines FRET-Akzeptor, die leicht gebleicht werden können, und einem Spender, der eher photo ist. Zusätzlich ist es wichtig, sicherzustellen, dass die fotogebleicht Akzeptor ist nicht mehr in der Lage ist das Abschrecken der Donor-Fluoreszenz. Da die gleichen Detektionskanal (Donor) ist für die Quantifizierung verwendet, keine Korrekturfaktoren eind keine chromatischen Aberrationen berücksichtigt werden müssen, was dieses Verfahren einfach und zuverlässig macht. Jedoch können quantitative Messungen nicht auf dem gleichen Punkt der Probe wiederholt werden und Veränderungen in der FRET nicht über die Zeit aufgezeichnet werden. Um Effekte durch molekulare Diffusion oder zellulärer Motilität eine schnelle Bleichstufe angestrebt werden, die die Zeit, die zwischen dem ersten FRET-Donor (vor Akzeptor-Bleichen) und dem zweiten FRET-Donor Bildaufnahme (nach FRET-Akzeptor Bleichen) minimiert zu vermeiden. Es ist zu empfehlen, um eine leistungsfähige Laser-Lichtquelle des FRET-Akzeptor Anregungswellenlänge, um die Beleuchtung und Bleichzeiten zu minimieren beschäftigen.
Im Gegensatz dazu in dem Ansatz der sensibilisierten FRET Emissionsmessung (b) der FRET-Donor ist, angeregt und die Emission der FRET-Akzeptor in dem FRET-Akzeptor-Kanal beobachtet. Änderungen im FRET-Akzeptor-Signal kann im Laufe der Zeit aber Emission der FRET-Donor in den roten Bereich verschobenen Akzeptor-Kanal aufgezeichnet werden (termed Durchscheinen) und FRET-Akzeptor Quererregung über Donoranregung müssen genau bestimmt und aus dem aufgezeichneten FRET-Akzeptor-Kanal subtrahiert werden. Hierzu werden die entsprechenden FRET-Donor und FRET-Akzeptor-Bilder sind räumlich ausgerichtet werden.
Detektion von Einzelmolekül (sm) FRET-Ereignissen
Bei der Verwendung von Lasern als Anregungsquelle, einer empfindlichen Kamera und geräusch gedämpft TIRF-Mikroskopie die Fluoreszenz der einzelnen Fluorophore können leicht über die Zeit verfolgt werden. Ähnliches gilt für den Nachweis der intermolekularen smFRET Ereignisse. Jedoch können Komplikationen durch FRET-Donor Durchbluten und Queranregung des FRET-Akzeptor verursacht werden, und daher mit großer Sorgfalt bei der Einstellung der Fluorophor Dichten im smFRET Versuch genommen werden.
In dem Protokoll unten angegeben (Protokoll Abschnitt 4) wurde das TCR als FRET-Donor in hoher Fülle und pMHC als FRET-Akzeptor in geringer Menge ausgewählt. Um FR dämpfenET Spenderdurchscheinen ausreichend, dekorieren 10-30% der TCRs mit fluoreszierenden scF V und 90-70% der TCRs mit nicht-fluoreszierenden scF V. Hier wurde das FRET-Akzeptor-Kanal als Einzelmolekül-Kanal gewählt, weil es mit der konfokalen Einzelmolekül-FRET-Kanal. Dies hilft, smFRET Veranstaltungen mit Einzelmolekül-FRET-Akzeptoren, die die Grundlage der smFRET Validierung auszurichten.
Extrahieren von synaptischen off-Raten durch smFRET Messungen
Photobleaching beider FRET-Donor-Akzeptor und FRET müssen für beim Extrahieren der Halbwertszeit von Wechselwirkungen von Einzelmolekül-FRET-Spuren berücksichtigt werden. Die Anzahl der beobachtbaren FRET-Signale zu Beginn ihres Auftretens als Einzel Donor-Akzeptor-Paar N (0) wird über die Zeit sowohl unverbindlich des Rezeptor-Ligand-Komplex und Photobleich reduziert. Die Zahl der überlebenden Komplexe zu einem bestimmten Zeitpunkt N (t) kann mathematisch wie folgt ausgedrückt werden:

In der Photoblei Ausdruck exp (-t / τ Bleichmittel) ist die Zeit t durch das Produkt aus der Anzahl der Beobachtungen n und der Beleuchtungszeit t schlecht aufgrund der nicht-kontinuierlichen, diskreten Betrachtungsmodus (dh Bleichen während der Beleuchtung tritt nur beschrieben ). Innerhalb der kinetischen Term exp (t / τ off) die Zeitdauer t ist das Produkt aus der Anzahl der Beobachtungen n und dem Zeitpunkt t lag für einen einzelnen FRET Beobachtung (dh kontinuierlich geschieht kinetische freibleibend). Gleichung 1 kann wie folgt ausgedrückt werden:
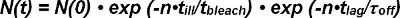
Der Begriff τ Bleichmittel / τ krank describes die Anzahl der Beobachtungen bis Bleich auftritt und ist definiert als der Erwartungswert bleichen> der Exponentialfunktion. Gleichung 2 kann wie folgt vereinfacht werden:

Der Erwartungswert lag)> der Anzahl von Rahmen N (t) mit beobachtbaren FRET-Ereignissen nach der Zeit t wird direkt aus dem Experiment bestimmt. Es hängt von der einstellbaren Zeit zwischen Beobachtungen (t lag) in das Experiment ausgewählt und die unbekannten Werte für τ off (das Inverse der off-Rate k off) und bleichen>, den Erwartungswert der Anzahl der Beobachtungen vor dem Bleichen auftritt .
So Berechnung des Erwartungswertes lag)> für mindestens zwei Werte von t Verzögerung ermöglicht die experimentelle Bestimmung der bleichen> und & tgr; aus.
Extrahieren von synaptischen 2D-K D Werte durch FRET-Messungen
Messen TCR Belegung ein, dh das Verhältnis zwischen gebundenen TCRs und insgesamt TCRs ist von zentraler Bedeutung für die Bestimmung der synaptischen 2D-K D -Werte. Nach der Formel 4 dieser Begriff ist direkt proportional zu der gemessenen FRET Ausbeute solange TCRs dient als FRET-Donoren und pMHCs als FRET-Akzeptoren.

mit a = TCR Belegung, C = Umrechnungsfaktor
C eine Konstante ist, die auf dem FRET-System abhängt, und die verwendeten Fluorophore. Es kann experimentell wie folgt bestimmt werden. ein in eine 2D-K D nach Gleichung 5 umgewandelt, wenn derAnfangsdichte von TCR-Liganden vor der Zugabe von T-Zellen, um die Doppelschicht bekannt ist. Dies ist wegen der hohen Mobilität der SLB-Proteine gebunden und auch, weil SLBs bieten ein nahezu unerschöpfliches Reservoir an Liganden 2.

mit [pMHC Anfangs] = Anfangsdichte von pMHC vor der Zugabe von T-Zellen
Mit den Gleichungen 4 und 5 kann man nun leicht die synaptische 2D-K D zwischen TCR und pMHC. Dies wird am zuverlässigsten mit FRET-Messungen basierend auf Spender Erholung nach Akzeptor Bleichen (siehe Protokoll Abschnitt 3.1) durchgeführt.
Jedoch zur Messung C die Beziehung zwischen der Intensität I FRET FRET (Hintergrund korrigiert, FRET-Donor Durchbluten und FRET-Akzeptor Queranregung) und TCR Belegung a bestimmt werden muss. Dazu werden einbenötigt, um das Verhältnis R zwischen der mittleren Fluoreszenzintensität von einzelnen TCR-assoziierten FRET Donorfluorophore (zB Cy3 oder AF555) sm weiß ich FRET-Donor und die mittlere Intensität des einzelnen Moleküls FRET Ereignisse sm I FRET. R hängt von der FRET-System in Frage, Emissionsfilter und Kamera für die Fluoreszenzdetektion eingesetzt.
Der TCR Belegungsbeginn a kann dann nach Gleichung 6 direkt bestimmt werden.

mit R = sm I FRET-Donor / sm I FRET
R wurde als 1,45 für den H57 scFv- Cy3 / Cy5 pMHC-Systems bestimmt zu:
a = Groß Ich FRET / Groß I TCR-cy3 • 1,45
Die Beziehung zwischen dem TCR Belegung a und der FRET-Ausbeute kann durch FRET-Donor bestimmen erholeny nach dem Akzeptor-Bleichen. Hierzu werden beide Parameter gegeneinander für eine Reihe TCR Mikrocluster aufgetragen, wie in 4A .Die Steigung der linearen Anpassung gezeigt gibt die Umwandlungsfaktor C (aus Gleichung 4).
Wie in 4A gezeigt, C Beträge für (a) die H57 scF V - Cy3 / Cy5 pMHC-FRET-System und (b) der aufgebrachten Mikroskop Systemkonfiguration auf 1.995. Der TCR Belegungsbeginn ein leicht wie folgt abgeleitet werden:
TCR Belegung a = FRET-Ausbeute • 1.995
Protokoll
1. Proteinproduktion
1.1. Doppelschicht-residente Proteine: B7-1, ICAM-1, pMHC (zB IE k / Peptid)
- B7-1 -12H, ICAM-1-12h
- Express B7-1-12H und ICAM-1-12h Konstrukte in hohen Stückzahlen als sezerniert nativen Proteinen unter Verwendung eines Baculovirus-Expressionssystem.
- Reinige Proteine aus Kulturüberständen mittels Ni-NTA-Affinitätschromatographie, gefolgt von MonoQ Anionenaustauschchromatographie und S200 Grßenausschlußchromatographie.
- Beschriften einem Aliquot des gereinigten Proteins mit aminreaktiven Farbstoffe wie NHS Succinimidyl-ester Zubereitungen von Alexa Fluor 488 (oder FITC), Alexa Fluor 555 (oder Cy3), Alexa Fluor 647 (oder Cy5).
- Nach S200 Grßenausschlußchromatographie bestimmt die Kennzeichnung Grad monomeren Proteine gemäß der Farbstoffherstellers durch Vergleich der Proteinabsorption bei 280 nm und die Farbstoffabsorption bei 488 nm (Alexa Fluor 488, FITC), 555 oder 552 nm(Alexa Fluor 555 oder Cy3) oder 647 nm (Alexa Fluor 647 oder Cy5).
Hinweis: Dieses Verhältnis wird später benötigt, um die Proteindichte auf der SLB vom Großfluoreszenzsignal des Farbstoff-markierten Proteins zu bestimmen. - Speicherung der unbeschriftete und Fluorophor-markierten Proteine bei -20 ° C in PBS plus 50% Glyzerin.
- pMHC (hier: IE k -2x6H oder IE k -12H)
- Rückzufalten MHC Klasse II aus Einschlusskörpern in E. coli in Anwesenheit einer viel billiger UV-spaltbare Peptid ersetzen, die später quantitativ mit einem Fluorophor-konjugierten Peptid der Wahl 5, 7 ausgewechselt werden kann ausgedrückt.
- Reinige neugefaltetes pMHC-Komplexe durch Standardtechniken (Ni-NTA-Affinitätschromatographie, MonoQ Anionenaustauscher-Chromatographie, Gelfiltrations-S200).
- Tauschen Sie die UV spaltbare Peptid mit fluoreszierenden Peptid 5, 7.
- Reinige monomeren fluoreszierenden pMHC Komplexe fsprünglich von S200-Gelfiltration. Ein repräsentatives Chromatogramm ist in Abbildung 3 dargestellt.
- Stellen Sie sicher, quantitative Peptidbeladung durch Spektrophotometrie.
- Speicher-Proteine bei -20 ° C in PBS / 50% Glycerin.
1.2. Generation von Einzelketten-Antikörperfragmente (SCF V s), Einführung von Cysteinen durch ortsspezifische Markierung
- Rückzufalten scF V s aus Einschlusskörpern in E. coli exprimiert wird. Hier wird ein Protokoll, das von Tsumoto und Kollegen 8 entwickelt wird, die in dem Einschlusskörper werden zuerst entfaltet in 6 M Guanidiniumchlorid, vollständig reduziert und dann erneut gefaltet im Verlauf einer Woche durch allmähliches Verringern der Konzentration des Proteins Entfaltung Guanidiniumchlorid.
- Konzentrieren Sie sich richtig gefaltet scF V unter Verwendung von Molekularfiltereinheiten mit einem Molekular Cutoff von 10 kDa.
- Ein Reinigen des Konzentrats durch S200-Gelfiltration.
- Beschriften Sie monomeren scF V in Gegenwart von 0,05 mM Tris (2-carboxyethyl) phosphin (TCEP) mit Alexa Fluor 647 unmittelbar nach der Reinigung. Führen die Markierungsreaktion am besten bei einem molaren Verhältnis von Protein: Farbstoff von nicht mehr als 1: 2 bei Raumtemperatur für nicht länger als 2 Stunden.
Anmerkung: TCEP ist ein phosphor- basierte Reduktionsmittel ist und nicht mit Maleimiden bei diesen Konzentrationen 9 reagieren. Es kann daher während der Markierungsreaktion, um die ungepaarten Sulfhydrylgruppe reduziert zu halten, bis es mit dem Farbstoff-Maleimidderivat reagiert vorliegen. - Reinige markierten monomeren scF V schließlich über S75 Gelfiltration. Ein repräsentatives Chromatogramm ist in Abbildung 3 dargestellt.
- Bestimmen Sie den Farbstoff: Protein-Verhältnis spektrophotometrisch.
- Speicher-Proteine bei -20 ° C in PBS / 50% Glycerin.
2. Calcium Fluxmessungen
- Nehmen Sie ein frisches Gefäß, das 50 ug Fura-2-AM und lösen es in 50 ul wasserfreiem DMSO.
- Spin down 10 6 T-Zellen in einem 5 ml Polypropylen-Rundrohr für 2 Minuten bei 250 bis 400 g.
- Resuspendieren T-Zellen in 200 ul Abbildungsmedium enthält Hanks Balanced Salt Solution und Calcium / Magnesium und 1% Ovalbumin bei RT wird mit 1 ul der Fura-2-AM Stammlösung (1: 200 Verdünnung), Mischung der Zellsuspension und inkubiere bei Raumtemperatur 30 min.
- Die T-Zellen in der Bildgebung Puffer waschen. Hierzu füllt die Röhrchen mit den Zellen, die mit Abbildungspuffer bei RT und Pelletierung der Zellen wie in Schritt 2 beschrieben, Entfernen des Überstandes und Zellpellet in 200 ul Abbildungspuffer (dh bei einer endgültigen Zelldichte von 5 x 10 & sup6; Zellen ml -1). Zellen können unmittelbar für die Calciummessungen verwendet oder auf Eis für 3 Stunden gelagert werden.
- Ortszellen auf einem funktionalisierten SLB in Abbildungspuffer (37 ° C). Sobald T-Zellen beginnen Sie den SLB, erwerben Sie den folgenden Satz von Bildern alle 15 bis 30 Sekunden für 30 Minuten:
excitatIonen bei 340 +/- 5 nm, Emission-Detektion bei 510 +/- 40 nm
Anregung bei 380 +/- 5 nm, Emission-Detektion bei 510 +/- 40 nm
DIC (optional)
Hinweis: Die jeweiligen Belichtungszeiten sind abhängig von der Intensität des Anregungslichtquelle. Zufriedenstellende Ergebnisse werden erhalten, wenn die Pixelintensitäten von 340 nm (380 nm) Kanal in Höhe von etwa einem Viertel (eine Hälfte) des maximal möglichen Intensitätswert. Beachten Sie, dass Fura-2-Werte bei 340 nm angeregt wird zunehmen und die bei 380 nm angeregt wird von T-Zell-Aktivierung zu verringern. - 20-25 Minuten in den Lauf, fügen 50-100 ul der vorgewärmten Anti pMHC blockierenden Antikörper in einer Endkonzentration von 20-50 & mgr; g ml -1. Der Antikörper sättigt alle pMHCs und als Folge davon T-Zellen aufhören, Antigen zu erkennen und zu stoppen Flußmittel Calcium. Fortsetzen der Bildaufzeichnung für weitere 5 - 10 Min., Um die Grundlinie der intrazellulären Calciumkonzentration, die mit dem nicht-aktivierten Zustand der T-Zellen entspricht erwerben < / li>
- Bestimmung des durchschnittlichen Hintergrundfluoreszenzsignal bei 340 nm und 380 nm Anregung innerhalb eines Bereiches von Interesse von mindestens 1000 Pixel, die keine Zelle enthält. Hintergrund-subtrahieren alle Mess Fura-2 Bilder bei 340 nm und 380 nm angeregt und berechnen 340 nm / 380 nm Intensitätsverhältnisse von einzelnen Zellen oder eine Gruppe von Zellen. Normalisieren Intensitätsverhältnisse von Teilen aller Verhältnisse durch das Verhältnis der fünf letzten Zeitrahmen (dh mit vollständigen Antikörper-Blockade des pMHC).
- Plot normalisiert Fura-2-Verhältnisse gegen die Zeit. Hinweis: Wenn Zellen und Doppelschichten sind in gutem Zustand, Fura-2 340 nm / 380 nm Intensitätsverhältnisse anzunehmen in der Regel Werte zwischen 2 und 5, 15-45 sec nach Zellen Kontakt mit dem Doppelschicht hergestellt. Verhältnisse fallen dann auf einen Wert zwischen 1,6 und 2, wo sie konstant bleiben für mindestens 20 Minuten oder länger. Werte sollten auf 1 erst nach der Zugabe von Anti-pMHC Antikörper sinken. Ein typisches Beispiel ist in 5 gezeigt.
3.1. TCR-Dekoration mit der H57scF V
- Spin down 10 6 T-Zellen in einem 5 ml Polypropylen-Rundrohr für 2 Minuten bei 250 bis 400 g.
- Dekantiert man die Medien, flick das Zellpellet vorsichtig und fügen 0,3 ul scF V (Konzentration ~ 1 mg / ml) zu der Zellsuspension. Für Groß FRET-Messungen beschäftigen nur Farbstoff markierten scFv. Zur Einzelmolekül-FRET-Messungen kann ein Gemisch von nicht markiertem scFv (5 bis 9 Teile, enthält kein ungepaartes Cystein) und Farbstoff-markierten scFv (1 Teil enthält ein ungepaartes Farbstoff gekoppelt Cystein).
- Die Zellen auf Eis inkubieren für 15 Minuten und waschen Sie die Zellen zweimal durch aufeinander Zentrifugation mit eiskaltem Abbildungspuffer.
Anmerkung: Die Zellen können auf Eis ohne signifikanten Verlust an gebundenem scFv V (t 1/2 von SCF-V-Dissoziation bei 0 ° C ~ 4 h 2) gespeichert werden. Die Reinheit der primären T-Zellen von TCR-transgenen (und gegebenenfalls auch abgeleitete RAG-1/2 defiziente Mäuse) und in vitro stimuliert ist höher als 98%, da T-Zellen sind die einzigen Zellen proliferieren (bis zu 7 Zellteilungen) in Reaktion auf das Peptid, das für die Stimulation des T-Zell-Kultur zugegeben wurde. B-Zellen, Apoptose und sind nicht mehr nach 7-10 Tagen Kultivierung lebendig. Einige dendritischen Zellen überleben, kann aber sogar gegen nicht nur aufgrund ihrer unterschiedlichen Morphologie unterschieden werden, sondern auch, weil sie nicht den H57 Anti-TCR-beta scFv-Fragment zu binden.
3.2. FRET-Messung über Spender Erholung nach Akzeptor Bleichen
Hinweis: Beachten Sie, dass die Halbwertszeit von TCR-H57 scF V-Komplexen beträgt 4 Stunden auf Eis, bis 50 min bei 22,5 ° C und 6,8 Minuten bei 37 ° C (und bis etwa 4 h auf Eis) 2. Solange der H57 scF V dient als FRET-Donor, sind gemessene FRET Ausbeuten unempfindlich H57 scF V Dissoziation jedoch das Signal-Rausch-Verhältnis steigtmit erhöhter H57 Dissoziation.
- Bereiten Sie eine SLB enthält AF647 / Cy5-markierten pMHCs sowie unmarkierten ICAM-1 und B7 nach Axmann et al. 4.
- Tauschen Sie das PBS des bildgebenden Kammer mit bildgebenden Medium, das Balanced Salt Solution Plus Calcium / Magnesium und 1% Ovalbumin Hanks. Aus diesem Pipette 400 ul Abbildungspuffer in den Brunnen, mischen Sie vorsichtig und entfernen Sie 400 ul aus dem Brunnen. Wiederholen Sie diesen Vorgang 3-4 mal. Haben die SLB, um Luft zu jeder Zeit ausgesetzt werden.
- Setzen Sie die Druckkammer auf dem Mikroskoptisch, und stellen Sie den Fokus, bis die Leuchtstoff (AF647, Cy5) SLB in klare Sicht kommt.
- Einrichten TIRF-Beleuchtung durch die Übersetzung der fokussierte Strahl parallel zur optischen Achse mit dem Umfang der Objektivbrennebene durch Verschieben eines Translationsstufe das Periskop ist.
- Die Feinabstimmung der Anregungs Laserstrahlen in TIRF-Modus, fügen Sie T-Zellen, die mit AF555 dekoriert / Cy3 markierten scF V und lassen Sie sie auf das SLB begleichen. Hinweis: Bedingungen für die TIRF-Beleuchtung erfüllt werden, wenn der basalen Zellmembran ist im Fokus neben der SLB und keine anderen Teile der Zelle in den Blick, wenn Fokussierung nach oben zu kommen. Wenn jedoch TIRF nicht richtig eingestellt ist, Teile des fluoreszierenden T-Zell-Plasmamembran, die in Kontakt mit der SLB es nicht sind, wird als Ring erscheint. Wenn dies der Fall ist, stellen Sie den Laserstrahl mit Translationsstufe das Periskop, bis TIRF-Beleuchtung erreicht wird.
- Erwerben Sie die folgenden sechs Bilder in der angegebenen Reihenfolge und in schneller Folge (Abbildung 6):
(i1, optional) weißes Licht, um ein Bild der Zelle übernehmen,
(i2, optional) 647 nm-Anregung (Low Power), um ein Bild des FRET-Akzeptors nehmen (pMHC) vor dem Bleich Puls
(i3) 514 nm-Anregung (Low Power), um ein Bild des FRET-Donors (TCR) vor dem Bleich Puls zu messen,
(i4) 647 nm Anregung (hohe Leistung), um Photobleich die FRET-Akzeptor, /> (I5) 514 nm-Anregung (Low Power), um ein Bild des FRET Gebe (TCR) nach der Bleich Puls
(i6) 647 nm Anregung (Low Power) komplett FRET-Akzeptor Bleichen, um zu überprüfen. - Halten die Zeit zwischen den Bildern (i3) und (i5) so kurz wie möglich übergeben, um in der Lage, die Bilder für die spätere Analyse zu korrelieren. Halten FRET-Donor Bleichen bei einem Minimum durch Verwenden der Anregung bei den niedrigsten möglichen Leistungspegel, der noch ermöglicht die richtige Abbildung der T-Zellen.
- Wählen eine Region von Interesse (ROI), beispielsweise eines ganzen Synapse oder eines einzelnen TCR Mikrocluster, bestimmen seine durchschnittliche Intensität (i3) (= I (3)) und (i5) (= I (5)). Für Hintergrundabzug, wählen Sie eine ROI der gleichen Dimension außerhalb der Beleuchtungsfleck in (3) oder (5) und bestimmen seine durchschnittliche Intensität (I (Hintergrund)). Um festzustellen, die FRET-Ausbeute führen Sie folgende Schritte:
g "/> (Gleichung 7)
Anmerkung: Es wird darauf hingewiesen, dass in Bezug auf die absolute FRET Ebene kann es notwendig sein, für die Geberbleich zwischen Bildern (I5) und (i3) zu korrigieren.
3.3. FRET-Messung über sensibilisierte Emission
- Führen räumliche Donor und Akzeptor Kanal Ausrichtung mit der Verwendung von bunten Perlen, die in allen Emissionskanäle fluoreszieren. Die räumliche Verschiebung zwischen den beiden Kanälen aufgrund der chromatischen Aberration kann durch super Positionierung einzelner Kügelchen bestimmt werden, und ist für die Korrektur von einem der beiden Kanäle für alle folgenden 2-Farben-Bildpaare 10 angewendet werden.
- Bestimmen den Grad der Spenderdurchscheinen mit der Verwendung eines SLB, das die FRET-Donor-Fluorophor allein. Es ist auch denkbar, FRET-Donor-markierten T-Zellen auf eine Lipiddoppelschicht mit unmarkiertem pMHC zu verwenden. Hintergrund wird zunächst außerhalb des beleuchteten Sichtfeld bestimmt und dann subtrahiert von beiden Kanälen. Auf diese Weise ist die durchschnittliche ba ckground korrigierten Intensitäten der beiden entsprechenden ROIs (I Spender Kanal- und ich Akzeptorkanal) bestimmt. Berechnung der Durchbluten Koeffizienten (BTC) wie folgt:
 (Gleichung 8)
(Gleichung 8)
Anmerkung: Diese BTC ist eine Konstante für einen bestimmten Farbstoff und Filtersatz-Kombination. - Berechnen Sie die FRET-Bildgeberdurchscheinen, wie folgt:
 (Gleichung 9)
(Gleichung 9) - Bestimmen Akzeptor Quer Anregung durch Anregen eines SLB, das die FRET-Akzeptor-Fluorophor alleine (zB IE k / MCC-Alexa Fluor 647) zuerst mit FRET-Donor Anregungslicht (z. B. 514 nm) und dann mit Akzeptor-Anregungslicht (zum Beispiel 647 nm). Verwenden Hintergrund-subtrahierten Bilder innerhalb der FRET-Akzeptor-Kanal, um den Queranregungskoeffizienten (CEC) zu berechnen, wie folgt:
ftp_upload / 53157 / 53157eq10.jpg "/> (Gleichung 10) - Da die CEC hängt von der Intensität des Laserstrahls für die Anregung des Donors verwendet wird, zu bestimmen, ist es für jedes Messtag. Verwenden Sie die resultierende CEC, die allein durch Queranregung erzeugten Bildes zu berechnen.
 (Gleichung 11)
(Gleichung 11) - Berechnen Sie die FRET für Durchscheinen und Cross-Anregungs korrigiert, wie folgt:
 (Gleichung 12)
(Gleichung 12)
Anmerkung: Absolute FRET-Signals (jedoch nicht die relative FRET Ausbeute) ist empfindlich für die Dissoziation des H57 scF V von T-Zell-Membran-gebundenen TCR. Übermäßigen Verlust des TCR-FRET Sonde zu vermeiden, sollen die Messungen bei 37 ° C innerhalb der ersten 2 min nach der Zugabe von T-Zellen, um die Doppelschicht durchzuführen. Messungen mit quantitativer (≥ 95%) TCR Kennzeichnung nur bei oder unterhalb von 22,5 ° C innerhalb der ersten 3 min nach einer möglichenZugabe von T-Zellen, um die Doppelschicht.
4. Einzelmolekül-FRET-Messungen
- Einstellen der Leistung beider Laser Anlass zu einer Intensität von 1-5 kW / & mgr; m 2 an der Probe zu geben. Für weitere Informationen wenden Sie sich bitte an Axmann et al beziehen. 4.
- Label T-Zellen, wie oben mit einer Mischung aus unmarkiertem scF V (5-9 Teile) und Cy3 / AF555-markierten scF V (1 Teil) skizziert. Anmerkung: Auf diese Weise nur ein Teil TZR mit der FRET-Donor markiert. Dies reduziert die Anzahl von detektierbaren Wechselwirkungen, aber Rauschen aus Spenderdurchscheinen erzeugt wird ebenfalls deutlich verringert (um etwa 5 1/2 bis 10 1/2), die kritisch ist, bei der Auflösung einzelner Einzel FRET-Events.
Anmerkung: Die Dissoziation des H57 scFV Sonde aus dem TCR beeinflusst nicht die Messung, wie es in einem wesentlich größeren Zeitbereich auftritt (Minuten bis Stunden) als die Dissoziation des TCR von SLB-gebundenen pMHC (sub-Sekunde zu SekundeAngebot). - Legen Sie eine SLB mit AF647-markierten pMHCs sowie ICAM und B7 auf dem Mikroskoptisch, und stellen Sie den Fokus, so dass der Doppelschicht in klare Sicht kommt.
- Optional: Legen Sie eine Schlitzöffnung in die Anregungs Weg, um den Großteil der Beleuchtungsfeld außer der Synapse zu maskieren (wie in Axmann et al. 4 gezeigt). Auf diese Weise ungebleichtem IE k / MCC (C) -Alexa Fluor 647 FRET-Akzeptor-Moleküle können in den Bereich der Beleuchtung zu bewegen.
- In H57 scF V dekoriert T-Zellen, die die Doppelschicht (mit bildgebenden Puffer), und warten Sie, bis Synapsen im Sichtfeld erscheinen.
- Nehmen in schneller Abfolge einer Sequenz von 10 bis 20 Bilddatensätze unter Verwendung von 2-Farberkennung:
i1) Anregung 514 nm
i2) Anregung 647 nm - Aussetzen Bilder für 1 bis 5 msec und als ein Satz von Bildern zu erwerben.
- Um die Identität der Einzelmolekül-FRET-Ereignissen zu beurteilen, gelten die gleichen Korrektur über Spenderdurchscheinen und Akzeptor Quer excitation. Außerdem Einzelmolekül-FRET-Veranstaltungen müssen mit Einzel Akzeptormoleküle auszurichten und sollte erscheinen und verschwinden in einem Schritt (siehe auch Abbildung 7).
- Off-Ratenbestimmung
- Nehmen Sie Spuren von Einzelmolekül-FRET-Ereignissen für mehrere Erfassungszeitrahmen.
Anmerkung: In diesem Beispiel (in Kursivschrift) Die Off-Rate zwischen dem 5c.c7 TCR und IE k / K3 wird bei 25 ° C mit vier verschiedenen Verzögerungszeiten (42 ms, 490 ms, 1007 ms, 1989 ms) gemessen. - Liste FRET Spuren entsprechend ihrer Spurlängen, wie in Tabelle 1 gezeigt.
- Tabelle 1 umzuwandeln in eine inverse kumulative Verfallsfunktion (Tabelle 2) wie gezeigt (farbige Zahlen aus Tabelle 1 entnommen).
- Um die daraus resultierenden Verfallsfunktion zu normalisieren, teilen Sie die Anzahl der Spuren von Tabelle 2 durch die Summe aller Spuren in der jeweiligen Gruppe. Plotten der normierten Werte mit der Anzahl von Zeitrahmen. Beim Weglassen des letzten Zeitrahmen, die eine Null enthält, können die Zerfälle gelesen werdenily mit einem einzigen Exponentialfunktion (8A) angebracht ist.
- Wie in 8B gezeigt, zeichnen den Erwartungswert lag)>, dh die negative Kehrwert der Exponent der Abklingfunktion oben gegen die Verzögerungszeit t lag beschäftigt bestimmt (in diesem Beispiel: x = t lag = 0,042 s und y = LAG)> = 1 / 0,662 = 1,511, x = 0,49 s und y = 1 / 0,902 = 1,101, x = 1,007 s und y = 1 / 1,131 = 0,884, x = 1,989 s und y = 1 / 1,591 = 0,629).
- Sitz τ off und bleichen> anhand von Gleichung 3. Dieses kann mit einem nicht-linearen Anpassungsfunktion eines wissenschaftlichen Datenanalyseprogramm durchgeführt werden, wie Origin.
Hinweis: Die besten in diesem Beispiel gezeigt fit ergibt eine τ off von 2,12 +/- 0,23 s und einer bleichen> von 1,53 +/- 0,06 sec. - Berechnen Sie das half Leben der Interaktion t 1/2 mit t 1/2 off = τ off • ln (2) (in diesem Beispiel: 1,47 s).
- Nehmen Sie Spuren von Einzelmolekül-FRET-Ereignissen für mehrere Erfassungszeitrahmen.
- 2D-K D Bestimmung
- Bestimmung der Umwandlungsfaktor C für die mit der Verwendung von Gleichung 6 eingesetzt FRET-Farbstoffpaar, und wie oben (4A) beschrieben.
- Bestimmen Sie die FRET Renditen für einzelne TCR Mikrocluster oder ganze Synapsen (3B und 5).
- Unter Verwendung von Gleichung 4 Wandeln Sie alle Einzel FRET Renditen in TCR Belegungen (4C).
- Bewerben Gleichung 11, um alle TCR Belegungen in 2D-K D s zu konvertieren. Wie unten angegeben, ist inhomogen synaptischen verbindlich. Eine sinnvolle Maßnahme zur synaptischen K D s ist der Median (rot gekennzeichnet) aller gemessenen Mikrocluster (4D).
- Berechnung von 2D-k auf s
- Berechnen Sie k on mit dem Massenwirkungsgesetz mit k on = k off / K D und der experimentell bestimmten k off und K D Werte.
Anmerkung: Die synaptischen k off für den Versuch in Abbildung 4 dargestellt (IE k / MCC Interaktion mit TCR 5c.c7 bei 25 ° C) beträgt 0,41 s -1. Daher die K D Grundstück (4D) in ak auf der Parzelle, wie in 4E gezeigt, umgewandelt werden.
- Berechnen Sie k on mit dem Massenwirkungsgesetz mit k on = k off / K D und der experimentell bestimmten k off und K D Werte.
Ergebnisse
Die Aufzeichnung der intrazellulären Calcium über den Fura-2 Calciumfarbstoff sowie die anschließende Zellanalyse die stimulierende Wirkung und damit Funktionalität der SLBs sind in Abbildung 4 gezeigt, um zu verifizieren. Wie deutlich wird, steigen die Calciumspiegel in T-Zellen (wie die ausgedrückt normalisierten Fura-2 340 nm / 380 nm Verhältnis zum Ausgangswert gleich 1) sofort, sobald sie auf die stimulierende SLBs begleichen. Calcium-Spiegel wieder auf das Ausgangsniveau kurz nach der Zugabe eines Antikörpers, der Blöcke pMHCs von TCR Engagement und welcher endet T-Zell-Aktivierung.
Figur 6 zeigt einen typischen Versuch mit FRET-Donor-Akzeptor Erholung nach Bleichen, das verwendet wird, um FRET Ausbeuten messen und die 2D-K D -Werte berechnet dient (in 4 gezeigt). Bitte beachten Sie die Zunahme der FRET-Donor Intensität, die TCR stellt über AF555 markiert, nachdem eine schnelle und vollständige Ablation des FRET eincceptor Arten (hier: AF647 mit pMHCs zugeordnet). Außerdem erkennt man die starke Verringerung des FRET-Kanal, dh dem FRET-Akzeptor-Kanal unter FRET Donoranregung nach FRET-Akzeptor Bleichen. Die kaum sichtbaren Restsignal entspricht Spenderdurchscheinen FRET. FRET Renditen innerhalb einzelner TCR Mikrocluster oder ganze Synapsen werden berechnet auf der Grundlage der angegebenen gemessenen Intensitätswerten (6B).
Figur 7 zeigt eine Bahn und Zeitablauf eines einzelnen Moleküls FRET Ereignis in zwei Zeitrahmen sichtbar. Wie oben in der Einleitung dargelegt solches Verhalten wird sowohl durch Zerfall von synaptischen TCR-pMHC-Bindung und Photobleich verursacht. Um zwischen diesen beiden Beiträge zu unterscheiden, haben die Versuchserfassungszeitrahmen zu der Dauer variiert werden, während eine konstante Lichtbleichung verbleibt, werden Änderungen in FRET Ereignis Trajektorienlänge nur durch die Bindungskinetik verursacht. Eine Quantifizierung der tracelengths, w hich die Grundlage für die Berechnung der in 7 gezeigt ist off-Raten und Bleich bildet, sind in den Tabellen 1 bis 3 zur Verfügung gestellt.
Bestimmung der 2D-K D s erfordert Aufzeichnung von Groß FRET Renditen für FRET-Donor markierten TCRs. Mit der Verwendung des experimentell abgeleitete Konstante C (Abbildung 4) kann ein FRET-Ausbeute für eine TCR Microcluster oder eine ganze Synapse, gemessen in die TCR umgewandelt bezugs ein, dh das Verhältnis von pMHC-Eingriff und die Gesamt TCRs (4C) . Mit bekannten pMHC Dichten in der SLB vor der Zugabe der T-Zelle vorhanden ist, können a -Werte aufgetragen, um synaptische 2D-K D -Werte (4D) zu bestimmen. On-Raten können mit dem Massenwirkungsgesetz berechnet werden (2D-k on = 2D-k off / 2D-K D) von der fest synaptischen off-Rate und 2D-KD-Werte.
1 "src =" / files / ftp_upload / 53157 / 53157fig1.jpg "/>
Abbildung 1 Schematische Darstellung der Lipiddoppelschicht-System planare Glasgestützten (SLB). (A) SLBs aus POPC (90-99%) und dem synthetischen Lipid DGS Ni-NTA (1-10%) zusammengesetzt und bilden sich spontan, wenn saubere Glasoberflächen mit kleinen unilamellaren Vesikeln (SUVs) berechnet, die aus den entsprechenden Lipiden. (B) Einmal gebildet, können solche SLBs mit löslichen Polyhistidin-markierten extrazellulären Anteile von pMHCs abgeleiteten kostimulatorischen B7-1-Proteine und ICAM-1-Adhäsionsproteine, funktionalisiert werden, um als APCs für T-Zellen dienen. Für weitere Informationen über die Vorbereitung SLBs siehe Axmann et al. 4. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Figu zu 2. Förster Resonance Energy Transfer basierten Assay zu quantifizieren TCR-pMHC Bindung in situ. (A) eine Verbundstruktur aus einem TCR mit einer H57 einkettiges Fragment Eingriff eines pMHC komplexiert stellt die hierin beschriebene FRET-basierten Ansatz. Beachten Sie die kurze Entfernung von ca. 41A zwischen den beiden entsprechenden Fluorophore unterziehen FRET. Akzeptor-Stellen für die Fluorophor-Maleimide sind in grün und rot angezeigt. (B) Das Prinzip der Erfassung TCR-pMHC Wechselwirkungen in situ dargestellt. Nur scF V -Dekoriert TCRs und pMHCs (hier IE k), die spezifische Komplexe zu bilden, führen zu einer messbaren FRET-Signals. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
"/>
Abbildung 3. Die Chromatogramme der endgültigen Gelfiltrationsschritt was zu monomeren scF V s und Peptid-beladenen IE k -2x6H Moleküle. X-Achsen stellen Rückhaltevolumen in ml, Y-Achsen geben Absorption bei 280 nm in willkürlichen Einheiten (AU) . (A) H57 scF V ortspezifisch mit Alexa Fluor 555 maleimid bis S75 unterzogen, wobei nicht umgesetzte Farbstoff von dem Protein (Schritt 1.2.5) getrennt markiert. Fraktionen, die Retentionsintervall 14 bis 15 ml (gestrichelte Linien) darstellen monomeren H57 scF V markiert. (B), dh k -2x6H Moleküle mit der UV-spaltbare ANP-Abstandshalter-Peptid komplexiert war UV-bestrahlt wurden, mit ortsspezifisch Alex inkubiert 647 Maleinimid-markierten Peptids und schließlich zu S200 unterzogen, wobei das Protein aus freien Peptids (Schritt 1.1.2.4) zu trennen. Der Abstand zwischen den gestrichelten Linien enthält und richtig gefalteten monomeren pMHCs. (A, B) 0,7 ml Probe wurde auf die Säule mit Beginn der rum (0 ml Punkt) aufgebracht. Gesammelten Fraktionen wurden eingeengt. Das Protein-zu-Farbstoff-Verhältnis wurde photospektrometrisch vor der Dialyse gegen PBS / 50% Glycerin bestimmt (für die Lagerung bei -20 °). Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
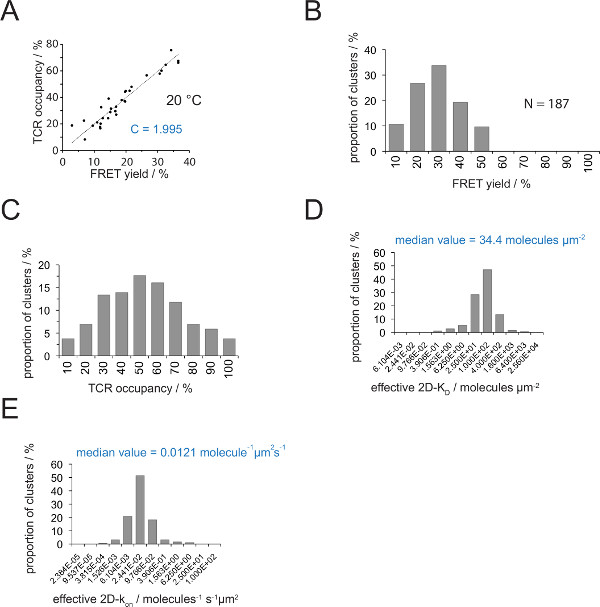
Abbildung 4. Bestimmung 2D-K D s und 2D-k auf s. (A) Die Korrelation zwischen der FRET-Ausbeute von Geberrückgewinnung bestimmt, nachdem Akzeptor Bleichen und TCR Belegung wurde experimentell gemessen. TCR Belegung kann für einzelne TCR Mikrocluster bestimmt werden, wie in Abschnitt 4.2 erläutert. Eine lineare Anpassung der Daten wird durch die Linie angezeigt wird, gleich dem Verhältnis zwischen C TCR ist deren NeigungBelegung und die FRET-Ausbeute. C ist eine Konstante, spezifisch für den FRET-System und den Fluorophoren (hier Cy3 und Cy5) eingesetzt. In diesem Beispiel ergab 1.988. (B) FRET-Ertragsdaten wurden für die einzelnen TCR Mikrocluster ermittelt (N = 187, Temperatur = 24 ° C) durch Spenderrückgewinnung von Akzeptor-Bleichen. Zahlen unter Histogramm-Balken zeigen die obere Grenze innerhalb des Intervalls. (C) Die Umwandlung der in (B) gezeigten Daten durch Multiplizieren gemessenen FRET-Renditen mit der Konstante C bestimmt in (A). Zahlen unter Balken zeigen die obere Grenze innerhalb des Intervalls. (D) Histogramm (halblogarithmischen, base = 4), welches die Verteilung von 2D-K D s für einzelne TCR Mikrocluster gemessen. Die mediane 2D-K D wird blau angezeigt. Zahlen unter Balken zeigen die obere Grenze innerhalb des Intervalls. (E) Die in (D) gezeigt, Histogramm wurde int umgewandeltoa 2D-k auf -histogram (halblogarithmischen, Base = 4) unter Verwendung der synaptischen k off für 24 ° C (0,41 s -1). Der ermittelte Median 2D-k auf Wert wird blau angezeigt. Die Daten wurden ursprünglich in Huppa et al. 2 veröffentlicht und sind hier in einem neuen Format visualisiert. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 5. Funktionelle Validierung SLBs für T-Zellstimulation und Imaging beschäftigt. (A) TCR-transgene T-Zellblasten mit Fura-2 beladen waren mit stimulierenden SLB konfrontiert beherbergen gene pMHCs, ICAM-1 und B-7. Cellular Fura-2-Emission bei 340 nm und 380 nm angeregt sowie DIC Bilder wurden aufgezeichnet. Wie angegeben, Verhältniswerte der Emissionsintensitäten bei 34 erregt0 und 380 nm sind auf der rechten Seite angezeigt. Zugabe pMHC blockierende Antikörper 14 min in die Versuchsreihe führte zu einer Abnahme der intrazellulären Calciumspiegel vergleichbar mit derjenigen von ruhenden T-Zellen. (B) eine typische zeitliche Verlauf des durchschnittlichen Fura-2-Verhältnisse in T-Zellen in Kontakt stimulatorischen SLBs gekennzeichnet durch eine einem anfänglichen Anstieg des intrazellulären Calciums, die 2 bis 4 mal höher ist im Vergleich zu der nicht-aktivierten T-Zellen oder T-Zellen-Antigen nach der Antikörper-vermittelten Blockade beraubt. Grüne Kreise zeigen in (A) veranschaulicht den Zeitpunkten. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
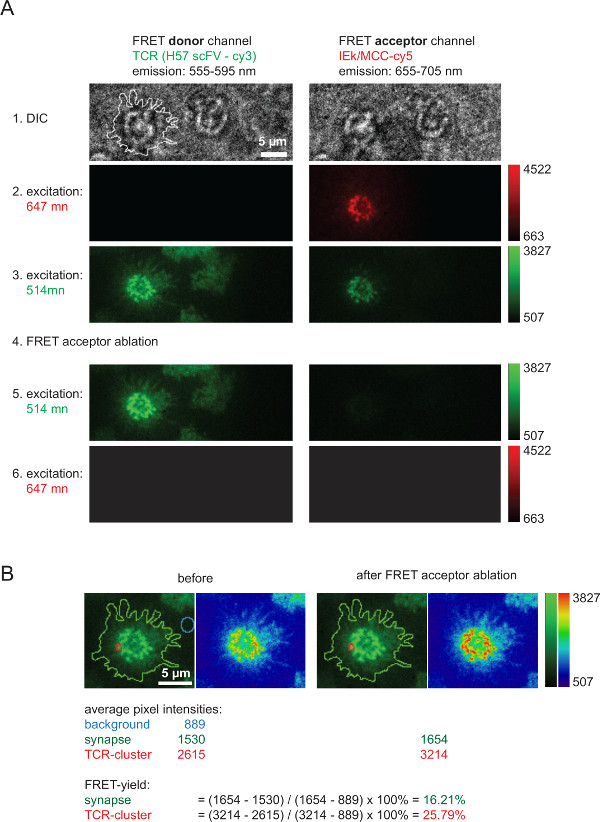
Abbildung 6. Bulk-FRET-Ausbeuten durch FRET-Donor Erholung nach FRET-Akzeptor Bleichen gemessen. (a) ist ein Beispiel eines typischen synaptischen FRET-Messung. Wie auf der linken und auf der Oberseite angedeutet eine Reihe von Bildern mit der Verwendung eines Emissionsstrahlteiler, die zu einem FRET-Donor und ein FRET-Akzeptor-Kanal erworben (für nähere Informationen zu Strahlteiler siehe Axmann et al 4). Der in der linken Bild DIC gezeigte Linie zeigt die Begrenzung der T-Zell-Synapse. Beachten Sie den Intensitätsverlust in der FRET-Akzeptor-Kanal als auch der Anstieg der Intensität in der FRET-Donor Kanals nach FRET Akzeptorbleichen (Schritt 4). (B) FRET-Effizienz quantifiziert für einzelne synaptischen Regionen oder für ganze Synapsen bezeichnet werden. Zur Inspektion werden die Bilder vor und nach der FRET-Akzeptor Bleichen mit dem Einsatz von zwei Suchtabellen (LUTs, grün und Physik) angezeigt. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
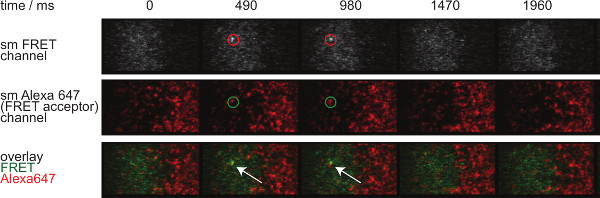
Abbildung 7. Einzelmolekül-FRET-Ereignissen erscheinen und verschwinden insingle Schritte und sind perfekt mit einem einzigen FRET Akzeptor-Fluorophor ausgerichtet ist. Der Zeitablauf der Einzelmolekül-FRET-Event gezeigt. Bilder wurden mit einem rückseitig belichteten EMCCD Kamera erworben. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
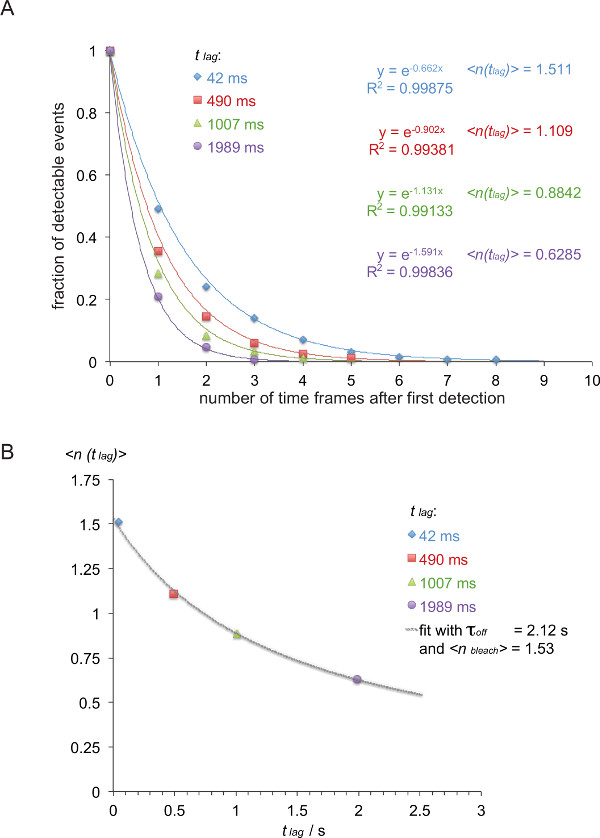
Abbildung 8. Die Bestimmung τ off = 1 / k off aus gemessenen smFRET Trajektorien. (A) Die normierten kumulativen Summen beobachtbaren FRET-Signale (von H57 scF V -AF555 abgeleitet dekoriert 5c.c7 TCR transgene T-Zell-Blasten erkennen IE k / K3-AF647 bei 24 ° C) für vier verschiedene Zeitverzögerungen (42 msec, 490 msec, 1,007 ms 1,989 ms) wurden als Funktion der Gesamtzahl von Beobachtungen aufgetragen. Mono-exponentielle Anpassung Funktionen führen zu entsprechend den negativen Umkehrung der Erwartungswerte lag)>. (B) Prognose-Werte wurden gegen die Verzögerungen t lag aufgetragen und ausgestattet mit Hilfe der Gleichung (t lag)> = τ off / {(& tgr; off / bleichen>) + t lag}, um τ ergeben aus und bleichen>. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
Messung von Protein-Protein-Wechselwirkungen in situ ist sehr erwünscht können insbesondere bei geringen Affinität Wechselwirkungen wie TCR-pMHC Bindung 11. Dies, da die An-Rate als auch die Stabilität eines solchen Wechselwirkungen signifikant durch die besonderen Umstände, unter denen eine Bindung stattfindet, beeinflusst. Minimalinvasive FRET-basierten Imaging-Ansätze sind also im Prinzip perfekt für solche Aufgabenstellungen geeignet, dennoch beinhalten eine Reihe von Hürden, die überwunden werden müssen. Rauschen, das durch zelluläre Autofluoreszenz erzeugten begrenzt die Empfindlichkeit der Messungen und sollte daher auf ein Minimum beschränkt werden. TIRF-Mikroskopie dient dieses Bedürfnis sehr gut 12 erfordert aber die Funktionalisierung von Glasobjektträger, idealerweise in der Form einer ebenen Glasgestützten Lipiddoppelschicht mit Proteinen der Wahl 13-15 eingerichtet. Ein weiterer Vorteil einer teilweise rekonstitutiven Ansatzes ist, dass rekombinante Doppelschicht-Resident FRET-Partner kann sehr viel mErz leicht in quantitativer ortsspezifische und rationelle Weise mit kleineren und heller Fluorophoren markiert, als es mit der Zelloberfläche exprimierten Proteine möglich. TCRs mit rekombinanten scF V s, die T-Zell-Erkennung nicht beeinflussen markiert, wie zuvor 2 getestet wurde. Darüber hinaus ist die Proteinzusammensetzung der SLB, beispielsweise die Dichte pMHCs und die Wahl des Hilfsfaktoren können an einen spezifischen Bedürfnisse angepasst werden. Wir haben zuvor durchgeführten Versuchen mit unterschiedlichen Dichten von stimulierenden pMHCs, aber noch nicht detektierten signifikanten Unterschiede in der 2D-K off und 2D-K D2.
Soweit hier die Erkennung von MHC Klasse II-Moleküle mit nur behandelt, vor allem wegen der Art ihrer Peptidbindungsspalte, die an beiden Enden offen ist und somit Platz für größere Peptide einschließlich eines Linkers für Fluorophor Anlage. In einigen Fällen kann ein solcher Ansatz auch für die Kennzeichnung MHC cla arbeitenss-I-Moleküle 16, aber großer Vorsicht zu treffen, um ihre Verwendung in Experimenten zu überprüfen. Die Empfindlichkeit der T-Zellen gegen Antigene, die durch T-Zell-Proliferations-Assays, sowie die pMHC-TCR Bindungskinetik gemessen wie in vitro durch Oberflächenplasmonresonanz gemessen werden durch die Zugabe des Linkers und Fluorophors beeinflusst das Peptid. Alternativ können MHC-Klasse-I-Molekülen, sich in einer ortsspezifischen Art und Weise mit der Einführung eines ungepaarten Cystein innerhalb der Sequenz der schweren Kette (unveröffentlichte Beobachtungen) markiert werden.
Mit der Verwendung von geeigneten Molekularsonden jedes synaptischen Protein-Protein-Wechselwirkung können prinzipiell in einer hierin beschriebenen Art und Weise untersucht werden. Solche Sonden, beispielsweise sollte scF V s oder Designed Ankyrin Repeat Proteine (DARPins) 17, monovalente und sollte ihre Ziel stabil zu binden, ohne die Interaktion von Interesse. Natürlich Struktur information für rationales Sondendesign sehr wünschenswert, aber nicht unbedingt erforderlich. Bei der Festlegung eines neuen Paares von FRET-Partner, wird empfohlen, zu erfassen und zu analysieren, FRET in Groß ersten. Seiten der Etikettenbefestigungs kann beträchtlich variiert werden, um die FRET-Signals zu maximieren und auch zu überprüfen, ob gemessen FRET Erträge hängen von der inter-Farbstoff der Entfernung ab. Sobald das System optimiert ist, einzelne FRET-Signale können durch die Begrenzung der Markierung von hoher Häufigkeit FRET Partner auf 10-30%, und das Bleichen des niedriger Abundanz FRET Partner bis einzelne Moleküle auflösbar sind auf dem Gebiet der Beleuchtung erfasst werden.
Nicht zuletzt ist darauf hinzuweisen, dass SLBs nähern einige, aber nicht alle Aspekte einer physiologischen Plasmamembran. Eigenschaften wie Membrankrümmung und Flexibilität Domäne Kompartimentierung Umordnung des Cytoskeletts und der Zellbeweglichkeit sowie eine hohe Vielzahl von Oberflächen-exprimierten Membranproteine werden von SLBs dargestellt aber beeinflussen könnten ter untersuchte verarbeiten. Große Anstrengungen müssen investiert, um die bildgebenden Verfahren, die Überwachung der Protein-Protein-Wechselwirkungen mit Einzelmolekülauflösung in physiologischer Synapsen, die unzugänglich für TIRF Bildgebung ermöglichen festzulegen.
Offenlegungen
The authors declare that they have no competing financial interest.
Danksagungen
MA wurde durch ein Schrödinger-Stipendium des Wissenschaftsfonds (FWF, J3086-B11) und dankt der Max-Planck-Gesellschaft für finanzielle und administrative Unterstützung getragen. GS und JH wurden vom Wiener Wissenschafts-, Forschungs- und Technologiefonds (WWTF, LS13-030) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| LB-media | Fisher Scientific | 10000713 | bacterial expression |
| Sf900 II | Life Technologies | 10227402 | insect cell media for baculo virus production |
| Insect-XPRESS with L-glutamine (Lonza) | Fisher Scientific | 10564038 | insect cell media for baculo virus expression |
| Sf9 cells | Life Technologies | 11496-015 | cells for virus production and expansion |
| High Five Cells | Life Technologies | B855-02 | cells for potein expression |
| LB-media | Fisher Scientific | 10000713 | bacterial expression |
| Centramate System | Pall | protein concentartion from large volumes | |
| Centramate cassette 10kDa cutoff | Pall | OS010T12 | protein concentartion from large volumes |
| Amicon Ultra-15 Centrifugal Filter Units | EMD Millipore | UFC900308 | protein concentartion |
| Amicon Ultra-4 Centrifugal Filter Units | EMD Millipore | UFC800308 | protein concentartion |
| Amicon Stirred Ultrafiltration Cell Model 200 mL | EMD Millipore | 5123 | protein concentartion |
| Äkta pure 25L | GE Healthcare | 29-0182-24 | protein purification |
| Superdex 200 10/300 GL | GE Healthcare | 17-5175-01 | protein purification |
| Superdex 75 10/300 GL | GE Healthcare | 17-5174-01 | protein purification |
| Mono Q 5/50GL | GE Healthcare | 17-5166-01 | protein purification |
| Ni Sepharose 6 Fast Flow | GE Healthcare | 17-5318-01 | protein purification |
| Tricorn 10/20 column | GE Healthcare | 28-4064-13 | protein purification |
| Gilson HPLC system | Gilson | purificationof fluorochrome-coupled peptides | |
| Pursuit XRs C18, 5 µm particle size, 21.2*250mm column size | Agilent | A6000250X212 | purificationof fluorochrome-coupled peptides |
| Pursuit XRs C18, 5 µm particle size, 21.2*50 mm column size | Agilent | A6000050G212 | purificationof fluorochrome-coupled peptides |
| Tricorn 10/20 column | GE Healthcare | 28-4064-13 | protein purification |
| Gilson HPLC system | Gilson | purificationof fluorochrome-coupled peptides | |
| Pursuit XRs C18, 5 µm particle size, 21.2*250mm column size | Agilent | A6000250X212 | purificationof fluorochrome-coupled peptides |
| Pursuit XRs C18, 5 µm particle size, 21.2*50 mm column size | Agilent | A6000050G212 | purificationof fluorochrome-coupled peptides |
| Cy3 maleimide | GE Healthcare | PA23031 | site-specific protein labeling via mutant unpaired cysteines |
| Cy5 maleimide | GE Healthcare | PA25031 | site-specific protein labeling via mutant unpaired cysteines |
| Alexa Fluor 555 C2 Maleimide | Life Technologies | A-20346 | site-specific protein labeling via mutant unpaired cysteines |
| Alexa Fluor 647 C2 Maleimide | Life Technologies | A-20347 | site-specific protein labeling via mutant unpaired cysteines |
| Fura-2, AM, cell permeant | Life Technologies | F-1221 | calcium-sensitive dye for cell labeling |
| dimethyl sulfoxide | Sigma Aldrich | 151874 | for dissolving fura-2 am |
| Hank's Balanced Salt Solution plus calcium/magnesium | Fisher Scientific | 10225362 | imaging buffer |
| PBS | Life Technologies | 14190-136 | |
| Bovine Serum Albumin lyophilized powder | Sigma Aldrich | A2153 | supplement for imaging buffer |
| 14-4-4S antibody | affimetrix eBioscience | 14-5980-81 | blocking antibody for H2-I-Ek (recognized by the 5c.c7, 2B4 and AND TCR) |
| 5 ml polypropylene round-bottom tube | Becton Dickinson | FALCON 352063 | |
| 0.22 μm Ultrafree-MC centrifugal filter unit | EMD Millipore | UFC30GV0S | |
| Syringe filter 0.2µm | Millipore | GVWP04700 | |
| TetraSpeck Microspheres, 0.1 µm, fluorescent blue/green/orange/dark red | Life technologies | T-7279 | |
| Microscope for fura-2-based calcium measurements | LEICA | DMI4000B | |
| Microscope for (single molecule) FRET measurements | LEICA/ZEISS/NIKON/OLYMPUS | for details please refer to parallel JoVE contribution by Axmann et al. | |
| planar supported lipid bilayers | for details please refer to parallel JoVE contribution by Axmann et al. | ||
| RPMI 1640, with L-Glutamine | Life Technologies | 11554416 | T-cell media |
| non-essential amino acid 100X | Hyclone | SH30238.01 | T-cell media supplement |
| penicillin/streptomycin/L-glutamine 100x | Life Technologies | 12000226 | T-cell media supplement |
| 2-mercaptoethanol | Sigma Aldrich | M6250 | T-cell media supplement |
| mouse interleukin-2 recombinant protein | BPS Bioscience | 90185-B | T-cell media supplement |
| Research Grade Fetal Bovine Serum | Hyclone | SV30160.03 | T-cell media supplement |
| Origin (analysis program) | OrigenLab | http://www.originlab.com/ | non-linear fitting of two parameters (tauoff, [ntlag]) |
Referenzen
- Garcia, K. C., Adams, J. J., Feng, D., Ely, L. K. The molecular basis of TCR germline bias for MHC is surprisingly simple. Nat Immunol.. 10, 143-147 (2009).
- Huppa, J. B., et al. TCR-peptide-MHC interactions in situ show accelerated kinetics and increased affinity. Nature.. 463, 963-967 (2010).
- Huppa, J. B., Davis, M. M. The interdisciplinary science of T-cell recognition. Advances in immunology.. 119, 1-50 (2013).
- Axmann, M., Schuetz, G. J., Huppa, J. B. Single Molecule Microscopy on Planar Supported Bilayers. Journal of Vizualized Experiments J. Vis. Exp.. 101, e53158(2015).
- Xie, J., et al. Photocrosslinkable pMHC monomers stain T cells specifically and cause ligand-bound TCRs to be preferentially transported to the cSMAC. Nat Immunol. 13, 674-680 (2012).
- Jares-Erijman, E. A., Jovin, T. M. FRET imaging. Nat Biotechnol. 21, 1387-1395 (2003).
- Toebes, M., et al. Design and use of conditional MHC class I ligands. Nat Med. 12, 246-251 (2006).
- Tsumoto, K., et al. Highly efficient recovery of functional single-chain Fv fragments from inclusion bodies overexpressed in Escherichia coli by controlled introduction of oxidizing reagent--application to a human single-chain Fv fragment. J Immunol Methods. 219, 119-129 (1998).
- Ruegg, U. T., Rudinger, J. Reductive cleavage of cystine disulfides with tributylphosphine. Methods Enzymol. 47, 111-116 (1977).
- Ruprecht, V., Brameshuber, M., Schütz, G. J. Two-color single molecule tracking combined with photobleaching for the detection of rare molecular interactions in fluid biomembranes. Soft Matter. 6, 568-581 (2010).
- Dustin, M. L., Bromley, S. K., Davis, M. M., Zhu, C. Identification of self through two-dimensional chemistry and synapses. Annu Rev Cell Dev Biol. 17, 133-157 (2001).
- Axelrod, D. Cell-substrate contacts illuminated by total internal reflection fluorescence. The Journal of cell biology. 89, 141-145 (1981).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285, 221-227 (1999).
- Kaizuka, Y., Douglass, A. D., Varma, R., Dustin, M. L., Vale, R. D. Mechanisms for segregating T cell receptor and adhesion molecules during immunological synapse formation in Jurkat T cells. Proc Natl Acad Sci USA. 104, 20296-20301 (2007).
- Varma, R., Campi, G., Yokosuka, T., Saito, T., Dustin, M. L. T cell receptor-proximal signals are sustained in peripheral microclusters and terminated in the central supramolecular activation cluster. Immunity. 25, 117-127 (2006).
- Purbhoo, M. A., Irvine, D. J., Huppa, J. B., Davis, M. M. T cell killing does not require the formation of a stable mature immunological synapse. Nat Immunol. 5, 524-530 (2004).
- Binz, H. K., Stumpp, M. T., Forrer, P., Amstutz, P., Pluckthun, A. Designing repeat proteins: well-expressed, soluble and stable proteins from combinatorial libraries of consensus ankyrin repeat proteins. J Mol Biol. 332, 489-503 (2003).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten