Method Article
TCR-pMHC Bağlama Ölçüm
Bu Makalede
Özet
This manuscript describes how to conduct (single molecule) Förster Resonance Energy Transfer (FRET)- based assays to measure the binding dynamics between T-cell antigen receptor (TCR) and antigenic peptide-loaded MHC molecules as they occur within the immunological synapse of a T-cell in contact with a functionalized planar supported lipid bilayer.
Özet
T-cells are remarkably specific and effective when recognizing antigens in the form of peptides embedded in MHC molecules (pMHC) on the surface of Antigen Presenting Cells (APCs). This is despite T-cell antigen receptors (TCRs) exerting usually a moderate affinity (µM range) to antigen when binding is measured in vitro1. In view of the molecular and cellular parameters contributing to T-cell antigen sensitivity, a microscopy-based methodology has been developed as a means to monitor TCR-pMHC binding in situ, as it occurs within the synapse of a live T-cell and an artificial and functionalized glass-supported planar lipid bilayer (SLB), which mimics the cell membrane of an Antigen presenting Cell (APC) 2. Measurements are based on Förster Resonance Energy Transfer (FRET) between a blue- and red-shifted fluorescent dye attached to the TCR and the pMHC. Because the efficiency of FRET is inversely proportional to the sixth power of the inter-dye distance, one can employ FRET signals to visualize synaptic TCR-pMHC binding. The sensitive of the microscopy approach supports detection of single molecule FRET events. This allows to determine the affinity and off-rate of synaptic TCR-pMHC interactions and in turn to interpolate the on-rate of binding. Analogous assays could be applied to measure other receptor-ligand interactions in their native environment.
Giriş
T hücreleri antijenleri tanıyan nasıl daha temel bir anlayış T-hücresi ve APC arasında oluşan immunolojik sinaps içinde, yani, doğru yere bakarak gerektirir. Burada moleküler bağlanma kinetiği, sadece selüler kuvvetleri, membran mimari ve zar proteinleri arasındaki yanal etkileşimleri gibi sinaps spesifik geometrik kısıtlamaları bulunmaktadır hücre parametreleri hakkında büyük ölçüde bağlıdır ancak ilgili etkileşme partnerleriyle doğal biyokimyasal özellikleri tarafından belirlenmez 3. Biyokimyasal yaklaşımlar dahil sinaptik membranların en az birinin bozulması gerektirecek gücü çözümünde sınırlıdır. Bu nedenle, bir FRET tabanlı görüntü metodolojisi antijenik pMHCs 2 TCR'nin bağlanmasına izlemek için geliştirilmiştir. İşte T-hücrelerinin bir rekombinant süslenmiştir ve site özellikle TCRβ-reaktif tek zincir antikor fragmanı (SCF V) etiketli ve planı ile karşı karşıya MHC sınıf II flüoresan şekilde etiketlenmiş bir antijenik peptit ile yüklü molekülleri, birlikte uyaran moleküller ve yapışma proteinleri liman ar cam-destekli ikili lipid tabakalarıdır (SLBs). Synaptic Toplam İç Yansıma Floresan (TIRF) mikroskopi bir dökme ve tek bir molekül düzeyinde izlenebilir FRET boya etiketli TCR ve boya etiketli pMHC sonuçları arasında bağlayıcı.
Bu makalede, T-hücresi sinaps tahlil için SLBs kullanmak fonksiyonel T hücre kalsiyum akı tahlil yoluyla kendi bütünlüğünü doğrulamak için nasıl ayrıntılı olarak açıklanmıştır, davranış toplu olarak ve tek bir molekül hassasiyeti ile ölçüm FRET ve elde edilen verileri analiz eder. Öneriler iki tabakalı işlevsellik için gerekli düzgün conformed proteinleri üreten sunulmaktadır. Iki tabakalı oluşumu ve uygun bir TIRF mikroskop 4 arka arkaya yayınlanan bir ek kamu erişim vallahi yayına bakınız kurulumu ile ilgili daha özel bilgiler için.
çadır "> SLBs DoğasıFonksiyonalitesine SLBs hali hazırda iki lipidler 1-palmitoil-2-oleoil-sn-gylcero-3-fosfokolin ihtiva eden tek katmanlı veziküller (SUV) elde edilebilir (kısaca: POPC,% 90-99) ve 1,2-dioleoil-sn - glisero-3 - {[N- (5-amino-1-karboksipentil) iminodiasetik asit] süksinil} (kısaca: DGS NTA-Ni, 1-10%). Temiz cam slaytlar yayılan SUV bitişik düzlemsel bilayeri 4 oluşturmak için. DGS-NTA-Ni sentetik NTA-Ni içeren kafa grubu (Şekil 1A) ile polihistidin aracılı karmaşık oluşumu yoluyla polihistidin-etiketli proteinler demirlemek için hizmet vermektedir. Dengeli birleşiminde, bir için, tipik olarak yapışma proteini ICAM-1 ve on iki histidin (ICAM-1-12H, B7-1 -12H) ihtiva eden bir etiket ile birlikte uyaran molekül B7-1 doğal zar-ötesi domen ve sitoplazmik kuyruk yerine (Şekil 1B) . Peptid-yüklenmiş sınıf II molekülü IE k iki membran gömülü (α ve β) polipeptit zincirini içerens. Her iki zincir transmembran / veya sitoplazmik alan içerecek altı histidini her birinin (IE k α 6H β 6H veya IE k -2x6H) ihtiva eden bir etiket ile değiştirilmesi gerekir. Bir alternatif olarak, on iki histidin ile α-zinciri olarak uzanan ve etiketsiz (12H β 0H veya IE k -12H α IE k sebebiyet veren) β-zinciri hücre-dışı alanını terk olarak tatmin edici sonuçlar (Şekil 1B) yol açar.
PMHCs Site özel etiketleme
Bu anlamlı denge bağlanma sabitleri içine FRET ölçülen verim dönüştürmek mümkün olması için stokiyometrik ve site özellikle pMHC etiketlemek için önemlidir. Bu yeniden birleştirici Histidin ile-etiketlenmiş MHC sınıf II molekülleri 2,5 peptit bağlayıcı yarık içine yüklenen bir sentetik peptidin kimyasal etiketlenmesi sureti ile elde edilebilir. Peptid w T-hücresi epitopunun her edildiği gibi olduğuell sistein ardından kısa bir C-terminal bağlayıcı (GGS) olarak (örn güve sitokrom c (MCC) peptit ANERADLIAYLKQATK- GGSC içinde, bağlayıcı kalın işaretlenir). Bu sistein maleimid-boya türevlerinin kullanımı ile stoikiometrik peptidi etiketlemek için kullanılır. Bu noktada ekstra bakım sistein içeren peptide kantitatif boya-kaplin doğrulayarak tahsis edilmelidir. Peptid-boya adüktü HPLC-temizlemesi tavsiye edilir elektrosprey iyonizasyon kütle spektroskopisi ile takip edilecek olan. (Boya olmadan) peptid Edükt tekabül Herhangi kaydedilmiş kitleler eksik etiketleme yansıtmaktadır. Bu doğru ise, markalama sayısal olarak kabul edilinceye kadar, HPLC ile saflaştırılmış peptid boya etiketleme ardışık mermi tabi tutulmalıdır. Bu yöntem, Örnek iyonizasyon için lazer radyasyonu karıştırmak gibi MALDI-TOF Kütle Spektroskopisi kaçınılması gerektiğini not edin. Peptid kütle böylece underrepre okunur ve önce bu tedavi ekli hassas fluorophores parçalanır boya olan konjügasyon yaratabilecek derece.
Tek değerli tek zincirli F V parçalarının kullanımı ile hücre bağlı TCRlerin Dolaylı henüz sahaya özel etiketleme
Hala bir site-spesifik bir şekilde yaşayan hücrelerin yüzey ilişkili proteinleri hücre boyaların eklemek zordur. Yüzey maruz TCRler için bu engeli aşmak için, TCRβ-reaktif monoklonal antikor H57-197 2 genleri bir tek-değerli tek zincirli versiyonu (scFv) inşa edilmiştir. TCR ile kompleks, bu antikorun kristal yapısı rasyonel (ilgili FRET, ortak olarak, boya bağlı olduğu), MHC bağlantılı peptit, C-terminaline yakın bir yerde bir serin artık madde ile ikame edildiği bir versiyonu, tasarımı sağlar sistein kalıntısı. Bu mutant sistein daha sonra boya konjugasyon (Şekil 2) için bir alıcı görevi görür.
Metodolojileri FRET kaydetmek için
nt "> Toplu FRET değerleri seçilen arası boya mesafeler arasındaki ilişkiyi doğrulamak için en uygun olan ve sistem 2 bağlayıcı bu TCR-pMHC ölçülen verimlilik FRET. Buna ek olarak, toplu FRET ölçümler sinaptik TCR-pMHC afiniteleri niteliksel ve niceliksel farklar (ortaya aşağıya bakınız) ve protokol bölüm 3.2. Literatürde 6 girmiştir FRET verimliliği ölçülmesi için çeşitli yaklaşımlar. Bu yazı FRET aracılığıyla kaydedilir In(a) donör kazanım alıcı kasar sonrası ve üzeri
(b) FRET alıcı emisyon duyarlı.
İlk yöntem (a) kolay photobleached edilebilir FRET alıcı ve oldukça ışığa olan bir verici, kullanımını gerektirir. Buna ek olarak, photobleached alıcı artık verici floresan söndürme kapasitesine sahip olduğundan emin olmak için önemlidir. Aynı tespit kanalı (donör) ölçümü için kullanıldığı gibi, herhangi bir düzeltme, bir faktörlerid hiçbir renk sapmalarını bu metodoloji basit ve güvenilir kılar, hangi dikkate alınması gerekir. Ancak, kantitatif ölçümler aynı numune yerinde tekrar edilemez ve FRET değişiklikler zamanla kaydedilemez. (Alıcı ağartma öncesi) ilk FRET donör ve (FRET alıcı ağartma sonra) ikinci FRET donör görüntü alımı arasında geçen süreyi en aza indirir moleküler difüzyon ya da hızlı bir ağartma aşaması için hedeflenmelidir hücresel hareketlilik, neden etkilerini önlemek için. Bu aydınlatma ve ağartma sürelerini en aza indirmek için FRET alıcı dalgaboyu güçlü bir lazer ışık kaynağı istihdam önerilir.
Buna karşılık, (b) sensitize FRET emisyon ölçümü yaklaşımda FRET donör heyecan ve FRET alıcı emisyon FRET alıcı kanal görülmektedir. FRET alıcı sinyali değişiklikler kırmızı kaymıştır alıcı kanalı içine zaman ama FRET donör emisyon üzerine kaydedilebilir (tERMED bleedthrough) ve doğru bir şekilde tespit edilir ve kaydedilir FRET alıcı kanalından çıkartılır gereken donör ile alıcı uyarım çapraz uyarma FRET. Bunun için FRET donör gelen ve FRET alıcı görüntüleri uzamsal uyumlu olması gerekir.
Tek bir molekülün Algılama (sm) olayları FRET
Uyarım kaynağı, hassas kamera ve gürültü zayıflatılmış TIRF mikroskopi olarak lazerlerin kullanımı ile tek fluorophores floresan kolaylıkla zamanla izlenebilmektedir. Benzer moleküller smFRET etkinlikleri tespiti için de geçerlidir. Bununla birlikte, komplikasyonlar FRET donör bleedthrough ve FRET alıcısının çapraz uyarma neden olduğu ve bu nedenle büyük bir dikkatle smFRET deneyde flüorofor yoğunlukları ayarlarken alınmalıdır olabilir.
Aşağıda verilen protokolü (protokol bölüm 4) TCR düşük bolluk içinde FRET alıcı olarak yüksek bolluk ve pMHC de FRET donör olarak seçildi. FR azaltmak içinYeterince floresan SCF V ve floresan olmayan SCF V TCRlerin 90-70 ile% TCRlerin% 10-30 süslemeleri bleedthrough ET verici. O tek molekül ile konfokal kanal FRET olduğundan burada FRET alıcı kanalı tek bir molekül kanalı olarak seçildi. Bu smFRET doğrulama temelidir FRET alıcıları tek bir molekülün, ile smFRET olayları hizalamak için yardımcı olur.
SmFRET ölçümlerle sinaptik off-oranları ayıklanıyor
Hem photobleaching donör FRET ve alıcı tek bir molekülün gelen etkileşimler izleri FRET yarı ömrünü çıkarılırken hesaba gerekir FRET. Tek verici-alıcı çifti olarak onların görünüm N başında gözlemlenebilir FRET sinyal sayısı (0) reseptör-ligand kompleksi ve photobleaching hem unbinding zaman içinde azalır. Aşağıdaki gibi belirli bir zaman N (t) de kompleksleri hayatta sayısı matematiksel olarak ifade edilebilir:

Photobleaching dönem exp (-t / τ çamaşır suyu), zaman t, yani ağartma sadece aydınlatma sırasında meydana gözlem sayısının n ürünü ve (çünkü sürekli olmayan, ayrık gözlem modunda kötü aydınlatma süresi t açıklanan ). Kinetik dönem exp- (t / τ kapalı) zaman t gözlem sayısının n ürün ve tek FRET gözlem (yani kinetik unbinding sürekli olur) zaman t gecikmesi olduğu içinde. Denklem 1 olarak ifade edilebilir:
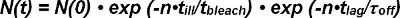
Vadeli τ ağartıcı / τ hasta desağartma oluşur ve beklenti değeri bleach> olarak üstel fonksiyonu tanımlanır kadar gözlem sayısını cribes. Aşağıdaki gibi Denklem 2 basitleştirilmiş olabilir:

T zaman sonra gözlemlenebilir FRET olayları ile kare sayısı N (t) beklenti değeri gecikme)> doğrudan deney belirlenir. Bu deneyde seçilen gözlemler (t gecikme) ve τ kapalı (off k off-oranının tersi) bilinmeyen değerleri arasında ayarlanabilir süresine bağlıdır ve ağartma oluşmadan önce, gözlem sayısının beklenti değerini ağartmak> .
Böylece, t, en az iki değeri için beklenen değeri gecikme)> hesaplanması lag bleach> ve kapatma τ deneysel belirlenmesini sağlar.
FRET tabanlı ölçümlerde aracılığıyla sinaptik 2D-K D değerleri ayıklanıyor
TCR doluluk yani a, bağlı TCRlerin toplam TCRler arasındaki oranı Ölçme, sinaptik 2D-K D değerlerinin tespiti için merkezi. Sürece TCRleri FRET donörler ve pMHCs FRET alıcıları olarak hizmet olarak elde FRET ölçülen denklem 4'e göre, bu terim ile doğru orantılıdır.

a = TCR doluluk ile, C = dönüşüm faktörü
C FRET sistemine bağlıdır ve flüoroforlar kullandığı, bir sabittir. Aşağıda gösterildiği gibi, deneysel olarak tespit edilebilir. Eşitlik 5 uyarınca bir 2D-K, D dönüştürülebilir olduğundaÖnceki iki tabakalı T-hücrelerinin eklenmesinden TCR ligandlarının başlangıç yoğunluğu bilinmektedir. Bunun nedeni SLB bağlı proteinlerin yüksek hareketlilik ve aynı zamanda SLBs ligandlar 2 neredeyse tükenmez haznesini sağlamak çünkü.

[pMHC başlangıç] öncesi T-hücrelerinin eklenmesinden pMHC başlangıç yoğunluğu vardır ile
Denklemler ile 4 ve 5, bir artık kolayca TCR ve pMHC arasındaki sinaptik 2D-K D belirleyebilirsiniz. Bu en güvenilir bir kabul edici ağartma (protokol bölümü 3.1) sonra donör geri göre FRET ölçümleri yapılır.
Ancak, Cl ben FRET FRET yoğunluğu arasındaki ilişkiyi ölçmek ve TCR doluluk bir belirlenmelidir (arka plan için düzeltilmiş, FRET donör bleedthrough ve alıcı çapraz uyarma FRET). Bunun için, tek birBen donör FRET ve tek bir molekülün ortalama yoğunluk olayları ben FRET sm FRET tek TCR-ilişkili FRET donör fluorophores (örneğin Cy3 veya AF555) sm ortalama floresan yoğunluğu arasındaki oran R bilmesi gerekir. R floresan tespiti için kullanılan soru, emisyon filtreleri ve kamerada FRET sistemine bağlıdır.
TCR a daha sonra doğrudan denklem 6'ya göre belirlenebilir doluluk.

R = sm ile ben FRET donör / sm FRET
R neden H57 scFv- Cy3 / pMHC-Cy5 sistemi için 1.45 olarak belirlendi:
a = toplu I 1.45 • / toplu I TCR-Cy3 FRET
TCR doluluk a ve FRET verimi arasındaki ilişki FRET donör ile tespit edilebilir kurtarmakalıcı beyazlatma sonrası y. Doğrusal uyum Şekil 4A hayranlarıyla eğimi de gösterildiği gibi bu iki parametre bir sayı TCR microclusters için birbirlerine karşı çizilir için (denklemi 4 itibaren) dönüşüm faktörü C gösterir.
1.995 kadar Cy3 / pMHC-Cy5 FRET sistemi ve (b) uygulanan mikroskop sistem konfigürasyonuna - Şekil 4A gösterildiği gibi, C (a) H57 SCF V tutarlar. TCR aşağıdaki gibi bir kolaylıkla çıkarılabilir Kişiler:
TCR doluluk a = 1.995 • verim FRET
Protokol
1. Protein Üretimi
1.1. Çift-katlı yerleşik proteinleri: B7-1, ICAM-1, pMHC (ör IE k / peptid)
- B7-1 -12H, ICAM-1-12H
- Hızlı B7-1-12H ve bakulovirüs sentezleme sistemi kullanılarak salgılanan nativ proteinlerin yüksek miktarlarda ICAM-1-12H yapıları.
- MonoQ anyon değiştirme kromatografisi ve S200 boyut dışlama kromatografisi, ardından Ni-NTA afinite kromatografisi ile kültür süpernatanlarından, proteinleri saflaştırmak.
- Alexa Fluor 488 (ya da FITC), Alexa Fluor 555 (ya da Cy3), Alexa Fluor 647 (ya da Cy5) NHS süksinimidil ester preparasyonlar gibi amin-reaktif boyalarla saflaştırılmış proteinin bir kısım etiketleyin.
- S200 boyut dışlama kromatografisi ardından, (Alexa Fluor 488, FITC) 488 nm 'de 555 ya da 552 nm 280 nm dalga boyunda, protein emilimi ve boya emilimi karşılaştırarak boya-üretici spesifikasyonlarına uygun monomerik proteinin etiketlenmesi derecesini belirlemek(Alexa Fluor 555 veya Cy3) ya da 647 nm (Alexa Fluor 647 veya Cy5).
Not: Bu oran daha sonra, boya etiketli proteinin kütle flüoresan sinyal SLB protein yoğunluğu belirlemek için gerekli olacaktır. - PBS içinde -20 ° C artı% 50 gliserol etiketsiz ve fluoroforla işaretlenmiş proteinler saklayın.
- (burada: IE k -2x6H veya IE k -12H) pMHC
- Daha sonra kantitatif seçim 5, 7 bir florofor birleştirilmiş peptid ile değiş tokuş edilebilir bir çok ucuz UV-bölünebilir peptid yerine mevcudiyetinde E. coli'de ifade edilen, enklüzyon gövdelerinden elde MHC sınıf II yeniden katlayın.
- Standart teknikler (Ni-NTA afinite kromatografisi, MonoQ anyon değişim kromatografisi, S200 jel filtrasyon) ile yeniden katlanmış pMHC kompleksleri arıtın.
- Floresan peptide 5, 7 ile UV bölünebilen peptid değiştirin.
- PMHC f kompleksleri monomerik floresan arındırıninally S200 jel filtrasyon yoluyla. Temsili bir kromatogram Şekil 3 'de gösterilmiştir.
- Spektrofotometre ile kantitatif peptid yükleme doğrulayın.
- PBS /% 50 gliserol içinde -20 ° C'de saklayın proteinleri.
1.2. Tek zincirli antikor fragmanları (scFv s), sahaya özel etiketleme için sisteinlerin giriş Üretimi
- E. coli içinde ifade edilen, enklüzyon gövdelerinden elde scFv s yeniden katlayın. Burada Tsumoto ve arkadaşları 8 tarafından oluşturulan bir protokol takip edildiği ara cisimcikler, ilk 6 M guanidinyum klorür katlanmamış halde tamamen kademeli bir hafta boyunca indirgendi ve daha sonra tekrar katlanmış Protein açılımı guanidinyum klorid konsantrasyonu ise.
- 10 KDa bir molekül kesme moleküler filtre üniteleri kullanarak uygun bir şekilde katlanmış scFv konsantre edin.
- S200 jel filtrasyon ile konsantre saflaştınlır.
- Monomerik SCF Etiket fosfin (TCEP) varlığında, b> V. Protein molar oranı, en iyi etiketleme reaksiyonu gerçekleştirmek: boya fazla 1 arasında: oda sıcaklığında 2 2 saat daha uzun süre.
Not: TCEP bir Fosfor bazlı indirgeme maddesi ve bu konsantrasyonlarda en 9 maleimidleri ile reaksiyona girmez. Bu nedenle boyanın-maleimid türevi ile reaksiyona kadar indirgenmiş eşleştirilmemiş sülfhidril grubunu tutmak için etiketleme reaksiyonu sırasında mevcut olabilir. - Son olarak S75 jel filtrasyonu vasıtasıyla monomerik scFv etiketli arıtın. Temsili bir kromatogram Şekil 3 'de gösterilmiştir.
- Boya belirleyin: protein oranı spektrofotometrik.
- PBS /% 50 gliserol içinde -20 ° C'de saklayın proteinleri.
2. Kalsiyum Akı Ölçümleri
- 50 ug fura-2-AM içeren taze bir şişe alın ve 50 ul su içermeyen DMSO içinde çözülür.
- 250-400 g'da 2 dk için 5 ml'lik bir polipropilen yuvarlak dipli bir tüp içinde 10 6 T-hücrelerinin dönerler.
- : (200 seyreltme 1) hücre süspansiyonu karıştırın ve oda sıcaklığında inkübe Hank Dengeli Tuz Çözeltisi artı kalsiyum / magnezyum ve% 1 ovalbümin ihtiva eden 200 ul ortam içinde yeniden süspanse görüntüleme T-hücrelerinin, fura-2-AM stok çözeltisi 1 ul 30 dakika boyunca oda sıcaklığında karıştırıldı.
- Görüntüleme tampon maddesi içinde bir kere, T-hücreleri yıkayın. Bunun için oda sıcaklığında görüntüleme tamponuyla hücreleri içeren tüp girip 5 x 10 6 bir nihai hücre yoğunluğu, Süpernatantı ve örneğin, 200 ul görüntüleme tamponu (hücre pelletini aşama 2'de tarif edildiği gibi hücreler pelet Hücreler mi-1). Hücreler, kalsiyum ölçümleri için hemen kullanılabilir ya da 3 saat kadar süreyle buz üzerinde saklanabilir.
- Görüntüleme tamponunda bir Fonksiyonlu SLB (37 ° C) üzerine yerleştirin hücreleri. En kısa sürede T-hücrelerinin SLB temas başlar başlamaz, görüntü aşağıdaki setini kazanmak her 15 dakika için 30 sn 30:
excitat340 +/- 5 nm iyon, 510 +/- 40 nm emisyon algılama
380 +/- 5 nm uyarma, 510 +/- 40 nm emisyon algılama
DIC (isteğe bağlı)
Not: Bulunduğu maruz kalma süreleri uyarım ışık kaynağının yoğunluğuna bağlıdır. Tatmin edici sonuçlar elde edildiğinde maksimum olası yoğunluk değerinin yaklaşık dörtte biri (bir buçuk) 340 nm (380 nm) kanal tutarı piksel yoğunlukları. 340 nm'de heyecanlı fura-2 değerleri artacak ve 380 nm heyecanlı olanlar T hücre aktivasyonu üzerine azalacağını unutmayın. - Işletime 20-25 dakika, 20-50 ug ml-1 olan bir nihai konsantrasyonda önceden ısıtılmış bir anti-pMHC bloke antikorun 50-100 ul ekle. Antikor bütün pMHCs doyurur ve sonuç olarak T-hücrelerinin antijen tanıma ve kalsiyum flukslama durdurmak için sona erer. Başka bir 5 için görüntü kayıt devam -. T-hücrelerinin aktif olmayan bir duruma karşılık gelen hücre içi kalsiyum konsantrasyonunun taban çizgisi, elde etmek için 10 dakika < / li>
- 340 nm ve herhangi bir hücre içeren, en az 1000 piksel bir ilgi bölgesi içinde 380 nm eksitasyon ortalama geri plan flöresanı sinyalini belirler. 340 nm ve 380 nm'de uyarıldı tüm ölçülen fura-2 görüntü background-çıkarma ve 340 nm / 380 nm yoğunluğu tek tek hücrelerin oranları veya hücre grubunu hesaplar. (PMHC tam antikor blokajı ile yani) son beş zaman dilimlerinde oranı üzerinden tüm oranları bölerek yoğunluk oranları Normale.
- Plot zamana karşı fura-2 oranları normalize. Not: Hücreler ve bilayers iyi durumda olduğunda, fura-2 340 nm / 380 nm şiddet oranları genellikle hücreler bilayeri ile temas yaptık 15-45 sn sonra, 2 ile 5 arasında değerler benimsenmesi. Oranlar sonra en az 20 dakika veya daha uzun süre sabit kalır 1.6 ve 2 arasında bir değere bırakın. Değerler sadece anti-pMHC antikorlarının eklenmesinden sonra 1 damla gerekir. Tipik bir örnek, Şekil 5 'de gösterilmiştir.
3.1. H57scF V ile TCR dekorasyon
- 250-400 g'da 2 dk için 5 ml'lik bir polipropilen yuvarlak dipli bir tüp içinde 10 6 T-hücrelerinin dönerler.
- Ortam, flick hücre pelletini yavaşça boşaltacaktır ve hücre süspansiyonu scFv (konsantrasyon ~ 1 mg / ml), 0.3 ul ekle. Toplu için ölçümler sadece scFv'yi-işaretlenmiş boya çalıştırırız FRET. Tek bir molekül ölçümleri etiketsiz scFv'sinin bir karışımını kullanın FRET (5 ila 9 parça, hiçbir eşleşmemiş sistein içerir) ve (1 kısım, tek eşleşmemiş boya birleştiğinde sistein içerir) scFv'yi etiketli boyası.
- 15 dakika boyunca buz üzerinde kuluçkaya bırakılır ve buz gibi soğuk tampon görüntüleme kullanarak ardışık santrifüjleme yoluyla hücreleri iki kez yıkayın.
Not: Hücreler (0 ° C ~ 4 saat 2 de scFv ayrışma t 1/2) bağlanmış scFv önemli bir kayıp olmaksızın, buz üzerinde saklanır. Isteğe bağlı olarak da, TCR-transgenik (türetilen primer T-hücrelerinin saflığı şiddetiyle sarmıştıT-hücreleri, T-hücre kültürüne uyarılması için eklenmiştir peptide tepki olarak () 7 hücre bölünmesi kadar çoğalan sadece hücreleri olduğundan, 02/01 eksik fareler) ve in vitro olarak uyarılmış% 98'den daha yüksek olduğu. B-hücrelerinin apoptozis geçmesi ve artık yetiştirme 7-10 gün sonra hayatta. Birkaç dendritik hücreler henüz kolayca nedeniyle farklı morfolojisi sadece ayrımcılığa olabilir hayatta değil, aynı zamanda H57, anti-TCR beta scFV fragmanı bağlamaz çünkü.
3.2. Alıcı beyazlatma sonrası donör kurtarma yoluyla ölçümü FRET
Not: 22.5 ° C 'de 50 dakika kadar, TCR-H57 scFv komplekslerin yan-ömrü buz üzerinde 4 saat tekabül akılda tutmak ve 37 ° C'de 6.8 dakika için (ve buz üzerinde yaklaşık 4 saat kadar) 2. Sürece H57 SCF V hizmet olarak FRET verici olarak ölçülen FRET verimleri, ancak gürültü oranı arttıkça sinyal H57 SCF V ayrışma karşı duyarlı değildirartan H57 ayrışma ile.
- Bir SLB içeren AF647 / Cy5 etiketli pMHCs hazırlayın olarak etiketlenmemiş ICAM-1 ve B7 AXMANN ve ark., 4 göre yöntem.
- Hank Dengeli Tuz Çözeltisi artı kalsiyum / magnezyum ve% 1 ovalbümin içeren görüntüleme ortamıyla görüntüleme odasının PBS değiştirin. Kuyuya görüntüleme tamponu bu pipet 400 ul için, iyice karıştırın ve kuyudan 400 ul çıkarın. Bu işlemi 3-4 kez tekrarlayın. Herhangi bir anda havaya SLB maruz bırakmayın.
- Mikroskop sahneye görüntüleme odasına yerleştirin ve floresan (AF647, Cy5) SLB açık görüş girinceye kadar odağı ayarlamak.
- Periskop en öteleme aşamasının hareket yoluyla objektif odak düzlemi çevresine optik eksene odaklanmış ışın paralel çevirerek TIRF aydınlatma ayarlayın.
- TIRF modunda uyarma lazer ışını ince ayar, AF555 süslenmiş T-hücrelerini eklemek / Cy3 SCF V etiketli ve onları SLB üzerine yerleşmek izin verin. Not: bazal hücre zarı SLB ve yukarı doğru odaklama yaparken görünümüne girer hücrenin hiçbir diğer bölümlerine ek olarak odak olduğunda TIRF aydınlatma koşulları karşılanmaktadır. TIRF düzgün ayarlanmış değilse Ancak, SLB ile temas halinde olmayan floresan T hücre plazma membran parçaları, bir halka olarak görünecektir. Bu durumda TIRF aydınlatma elde edilene kadar, en periskop translasyon evre ile lazer ışını ayarlayın.
- Belirtilen sırayla ve peş peşe (Şekil 6) Aşağıdaki altı görüntü elde:
(i1, opsiyonel) beyaz ışık, hücrenin bir görüntüyü çekmek için
(i2, opsiyonel) 647 nm uyarma (düşük güç), ağartıcı darbe öncesinde (pMHC) FRET alıcısı bir görüntü çekmek için
(i3) 514 nm uyarma (düşük güç), ağartıcı darbe öncesinde FRET vericinin bir görüntü (TCR) almak
647 nm uyarma (yüksek güç) foto-ağartıcı FRET alıcı için (i4), /> (I5) ağartıcı darbe aşağıdaki 514 nm eksitasyon (düşük güç) FRET vericinin bir görüntü çekmek için (TCR),
(i6) 647 nm uyarma (düşük güç) tam FRET alıcı beyazlatma doğrulamak için. - Daha sonra analiz için çekimlerin eşleştirilmesi edebilmek için görüntüler (i3) ve mümkün olduğu kadar kısa (i5) arasında geçen süreyi tutun. Yine de T-hücrelerinin düzgün görüntüleme sağlayan olası en düşük güç seviyesinde uyarım kullanılarak en az FRET donör ağartma tutun.
- (I3) 'de ortalama yoğunluğunu belirlemek, faiz (ROI), örneğin, bütün bir sinaps veya bireysel TCR microcluster bir bölge seçin (= I (3)) ve (i5)' de (= I (5)). Arka plan çıkarma için, içinde aydınlatma nokta dışında aynı boyutta bir yatırım getirisi seçin (3) veya (5) ve ortalama yoğunluğunu belirlemek (I (arka plan)). FRET verimi aşağıdaki işlemi gerçekleştirin belirlemek için:
g "/> (denklem 7)
Not: Bu mutlak FRET seviyesine göre, bu verici görüntüleri (i5) arasındaki ağartma ve (i3) düzeltilmesi için gerekli olabileceğine dikkat edilmelidir.
3,3. Hassaslaşmış emisyon ölçümü yoluyla FRET
- Bütün emisyon kanallarında floresan renkli taneler, kullanımı ile mekansal verici ve alıcı kanalı hizalayın. Nedeniyle renk sapmaları her iki kanal arasındaki mekansal vardiya süper konumlandırma bireysel boncuk belirlenebilir ve aşağıdaki 2-renkli görüntü çiftleri 10 iki kanaldan birinin düzeltilmesi için uygulanacak olan.
- Yalnız FRET donör fluorofor içeren bir SLB kullanımı ile donör bleedthrough derecesini belirler. Ayrıca, etiketlenmemiş pMHC olan bir lipid iki katmanının üzerine FRET-verici-etiketli T hücrelerinin kullanımı mümkündür. Geçmiş ilk görüş ışıklı alanı dışında belirlenen ve daha sonra her iki kanalda çıkarılır. Bu şekilde ortalama ba ckground düzeltilmiş ROI karşılık gelen iki yoğunlukları (I verici kanal ve kanal akseptörü) tespit edilir. Aşağıdaki gibi bleedthrough katsayısı (BTC) hesaplayın:
 (denklem 8)
(denklem 8)
Not: Bu BTC belli bir boya ve filtre set-kombinasyon için bir sabittir. - Şöyle FRET donör bleedthrough görüntü hesaplanır:
 (denklem 9)
(denklem 9) - (Örneğin, IE k / MCC-Alexa Fluor 647) ilk FRET donör ikaz ışığı ile (örn., 514 nm) ve daha sonra alıcı ikaz ışığı ile (örneğin, 647 yalnız FRET alıcı fluorofor içeren heyecan verici bir SLB tarafından alıcı çapraz uyarma belirleyin nm). Aşağıdaki gibi çapraz uyarma katsayısı (MSK) hesaplamak için FRET alıcı kanalı içinde arka plan çıkarılır görüntüleri kullanın:
ftp_upload / 53157 / 53157eq10.jpg "/> (denklem 10) - MSK donör uyarım için kullanılan lazer yoğunluğuna bağlı olduğu için, her bir ölçüm gününde belirler. Sadece çapraz uyarma yoluyla üretilen görüntüyü hesaplamak için elde edilen CEC kullanın.
 (denklem 11)
(denklem 11) - Aşağıdaki gibi bleedthrough ve çapraz uyarım için düzeltilmiş FRET görüntü hesaplayın:
 (denklem 12)
(denklem 12)
Not: Mutlak FRET sinyali (ancak görece FRET verim) T-hücresi zara bağlı TCR gelen H57 scFv ayrışması duyarlıdır. TCR-FRET probu aşırı kaybını önlemek için, iki tabakalı T-hücreleri ilave edildikten sonra, ilk 2 dakika içinde 37 ° C 'de ölçümler yapmak için amaçlanmıştır. Kantitatif (≥% 95) TCR etiketleme ile ölçümler ilk 3 dakika sonra içinde veya 22.5 ° C'nin altında sadece mümküniki tabakalı T-hücrelerinin eklenmesi.
4. Tek Molekül FRET Ölçümleri
- Numune de 1-5 kW / um 2 bir yoğunluk meydana getirmesi hem lazerlerin gücü ayarlayın. Daha fazla bilgi için AXMANN ark bakın. 4..
- Etiketsiz SCF V (5-9 parça) ve Cy3 / AF555 etiketli SCF V (1 bölüm) bir karışımı ile yukarıda özetlenen Etiket T-hücrelerinin. Not: Yalnızca TCRler bir kısmı FRET-donör ile işaretlenir Bu şekilde. Bu saptanabilir etkileşimlerin sayısını azaltır, ancak donör bleedthrough üretilen gürültü de bireysel tek bir molekül olayları FRET çözümlerken kritik olan (yaklaşık 5 1/2 1/2 10) tarafından önemli ölçüde azalmıştır.
Not: çok daha büyük bir zaman aralığında SLB bağlı pMHC (alt saniyeden TCR ayrışma daha (saat dakika) oluşur olarak TCR dan H57 scFV probunun ayrışma, ölçümlerini etkilemez ikinciaralık). - Mikroskop sahnede AF647 etiketli pMHCs yanı sıra ICAM ve B7 featuring SLB yerleştirin ve iki katmanlı açık görüş girdiği, böylece odağı ayarlamak.
- İsteğe bağlı: sinaps hariç aydınlatma alanının çoğunluğu maske (. AXMANN et al 4 'de gösterildiği gibi), uyarım yolağına bir yarık açıklığı yerleştirin. Ağartılmamış IE k / MM (C) -Alexa Fluor 647 FRET alıcı molekülleri aydınlatma alana taşıyabilirsiniz Bu şekilde.
- (Görüntüleme tampon) çift tabakaya H57 SCF V dekore T-hücrelerini ekleyin ve sinapslar görüş alanında görünür kadar bekleyin.
- Peş peşe 2 renk algılama kullanarak 10 ile 20 görüntü setleri bir dizi atın:
i1) Uyarma 514 nm
i2) Uyarma 647 nm - 1 ila 5 ms için görüntü Açığa ve görüntülerin kümesi olarak kazanır.
- Olayları FRET tek bir molekülün kimliğini değerlendirmek için, donör ve alıcı bleedthrough çapraz excita konusunda aynı düzeltme uygulamakyon. Ayrıca, tek bir molekül olaylar tek alıcı molekülleri ile uyum var ve görünür ve tek adımda (ayrıca Şekil 7 bakınız) içinde kaybolur FRET.
- Off-oran belirleme
- Tek bir molekülün Kayıt izleri birkaç kazanım zaman dilimlerinde olayları FRET.
Not: 5c.c7 arasındaki off-rate TCR ve IE k / K3, dört farklı gecikme zamanları (42 ms, 490 ms, 1007 ms, 1989 msn) ile 25 ° C'de ölçülen Bu örnekte (italik). - Tablo 1 'de gösterildiği gibi listesi FRET iz sürücü uzunluklarına göre izler.
- Bir ters kümülatif bozunma fonksiyonu gösterilmiştir (renkli numaraları Tablo 1 'den alınmıştır) halinde (tablo 2) içine tablo 1 dönüştürün.
- Ortaya çıkan çürüme fonksiyonunu normale döndürmek için, söz konusu gruptaki tüm izlerin toplamı tarafından masaya 2 izlerinin sayısını bölün. Zaman dilimlerinde sayısı karşı normalize değerleri çizilir. Sıfır içeren son zaman çerçevesi, atlama yaparken, bozunumlarındaki okunabilirharcanmasını tek bir üstel fonksiyon (Şekil 8A) ile donatılmıştır.
- X = t gecikmesi = 0,042: Şekil 8B'de gösterildiği gibi, bir beklenti değeri gecikme)> örneğin, bu örnekte de kullanıldı gecikme süresi t gecikme karşı yukarıda belirlenen bozunum fonksiyonunun üs negatif ters (arsa s ve y = gecikme)> = 1 / 0.662 = 1.511 x = 0,49 s ve y = 1 / 0,902 = 1,101 x = 1,007 s ve y = 1 / 1,131 = 0,884 x = 1,989 s ve y = 1 / 1,591 = 0,629).
- Fit τ kapalı ve bu gibi Menşe olarak bilimsel veri analizi programı lineer olmayan uydurma işlevi kullanılarak yapılabilir denkleme 3. dayanarak bleach>.
Not: Bu örnekte gösterilen en uygun 2.12 +/- 0.23 sn kapalı τ verir ve bir 1.53 +/- 0.06 sn ağartma>. - Hal hesaplayın• ln kapalı = τ kapalı t 1/2 ile 1/2 kapalı t etkileşim f ömrü (2) (bu örnekte: 1.47 s).
- Tek bir molekülün Kayıt izleri birkaç kazanım zaman dilimlerinde olayları FRET.
- 2D-KD belirlenmesi
- Denklem 6 kullanılarak kullanılan FRET boya çifti için dönüşüm faktörü C belirlemek (Şekil 4A), yukarıda belirtildiği gibi.
- Bireysel TCR microclusters veya tüm sinapsların (Şekil 3B ve 5) için FRET verimlerini belirlemek.
- Denklem 4 convert kullanma TCR doluluk içine tüm bireysel FRET verimleri (Şekil 4C).
- 2D-K D s içine tüm TCR doluluk dönüştürmek için denklem 11. uygulayın. Aşağıda belirtildiği gibi, sinaptik bağlama homojen olmayan bir. Sinaptik K D s anlamlı ölçü tüm ölçülen microclusters (Şekil 4D) arasında (kırmızı belirtilmiştir) medyan olduğunu.
- S 2D-k hesaplanması
- K D ve kapalı deneysel olarak belirlenen k ve K D değerlerini kapalı / k = üzerinde k kitlesel eylem hukuka üzerinde k hesaplayın.
Not: Şekil 4'te gösterilen deney için rahatsız sinaptik k (IE k / MCC 25 ° C'de 5c.c7 TCR ile etkileşen) 0,41 s-1. Şekil 4E'de gösterilen Dolayısıyla KD arsa (Şekil 4D), arsa üzerinde ak dönüştürülebilir.
- K D ve kapalı deneysel olarak belirlenen k ve K D değerlerini kapalı / k = üzerinde k kitlesel eylem hukuka üzerinde k hesaplayın.
Sonuçlar
Fura-2 kalsiyum boya ile hücre içi kalsiyum kayıt hem de sonraki hücre analizi uyarıcı güç ve Şekil 4'te gösterilmiştir SLBs dolayısıyla özelliğe doğrulamak için. Belirgin hale gibi, kalsiyum düzeyi olarak ifade edilen (T-hücreleri artış Bazal hemen en kısa sürede uyarıcı SLBs üzerine yerleşmek gibi) 1 olmak normalize fura-2 340nm / 380nm oranı. Kalsiyum seviyesi kısa TCR bağlanmasına olan ve blok pMHCs T-hücresi aktivasyonunu sona erdiren bir antikor ilave edildikten sonra taban çizgisi düzeylerine geri döner.
Şekil 6, (Şekil 4'te gösterilen) FRET verim ölçülmesi için kullanılır ve 2D-KD değerleri hesaplamak için hizmet eder akseptor ağartma sonra FRET donör iyileşme söz konusu eden tipik bir deney tasvir etmektedir. FRET a hızlı ve tam ablasyonu sonrası AF555 aracılığıyla etiketli TCR temsil FRET donör yoğunluğu artışı, unutmayıncceptor türleri (burada: pMHCs ile ilişkili AF647). Ayrıca belirgin FRET kanalında güçlü azalması, yani FRET alıcı beyazlatma sonra FRET donör uyarma altında FRET alıcı kanalı. Zor görünür kalan sinyal verici bleedthrough FRET karşılık gelir. Bireysel TCR microclusters veya tüm sinaps içinde FRET verimleri hesaplanmış belirtilen ölçülen yoğunluk değerleri (Şekil 6B) dayanmaktadır.
Şekil 7, iki zaman dilimlerinde görebilir tek bir molekülün FRET olayının bir yörünge ve zaman atlamalı tasvir etmektedir. Girişte Yukarıda belirtildiği gibi bu tür davranışlar hem bağlayıcı sinaptik TCR-pMHC çürüme ve photobleaching neden olur. Bu iki katılım ayırt etmek için, deneysel kazanım zaman çerçeveleri süresi değişebilir gerekir: photobleaching sabit kalırken, FRET olay yörünge uzunluğu değişiklikler sadece bağlayıcı kinetik kaynaklanır. Tracelengths bir kantitatif w hich Şekil 7'de gösterilen kapanma hızları ve ağartma hesaplanması için temel oluşturur, 3 tablolarda 1 verilmiştir.
2D-K, D s belirlenmesi dökme kayıt FRET verici etiketli TCRler için verim FRET gerektirir. Deneysel olarak çıkarılmış C sabiti (Şekil 4) kullanımı ile, bir TCR microcluster veya bütün bir sinaps için ölçülen FRET verimi TCR içine doluluk dönüştürülebilir bir örneğin, pMHC-yapan ve toplam TCRlerin oranı (Şekil 4C) . Önceden T-hücresi ilavesinden SLB üzerinde mevcut olan, bilinen pMHC yoğunlukları ile, değerlerin sinaptik 2D-Kd değerleri (Şekil 4D) belirlemek için uygulanabilir. On-oranları kitle eylemi yasası ile hesaplanabilir (2D-k = 2D-k / 2D-K D off) tespit sinaptik off-hızı ve 2D-KD değerlerinin.
1 "src =" / files / ftp_upload / 53157 / 53157fig1.jpg "/>
Şekil 1. düzlemsel cam destekli çift katlı lipid (SLB) sistemin şematik anahat. (A) SLBs gelen lipidler oluşan POPC (% 90-99) ve sentetik yağ DGS Ni-NTA (% 1-10) oluşan ve temiz cam yüzeyler küçük tek tabakalı veziküller (SUV'lar) ile şarj olduğunda kendiliğinden oluşturur. (B) Bir kere oluştuktan sonra, bu SLBs T-hücreleri için APC 'lere olarak hizmet etmek için çözünür polihistidin-etiketli hücre dışı pMHCs türetilen kısımlar, birlikte uyaran B7-1 proteinlerinin ve ICAM-1 yapışma proteinleri ile fonksiyonalize edilebilir. SLBs hazırlama hakkında daha fazla bilgi için AXMANN ve ark. 4 bakın. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Figu 2. Förster Rezonans Enerji Transferi yeniden bazlı analiz TCR-pMHC yerinde bağlayıcı ölçmek için. (A) pMHC çekici bir H57 tek zincirli fragmanı ile kompleks bir TCR'nin bir kompozit yapısı, burada tarif edilen FRET dayalı bir yaklaşım görüntülemektedir. Yaklaşık 41A FRET geçiren iki mukabil fluorophores ayıran kısa mesafe unutmayın. Florofor maleimidler için kabul eden siteler yeşil ve kırmızı belirtilmiştir. (B) in situ TCR-pMHC etkileşimlerinin saptanmasında prensibi gösterilmektedir. Sadece SCF V spesifik kompleksler oluşturan TCRler ve pMHCs (burada IE k), -dekore, ölçülebilir bir sinyal FRET doğuran. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
"/>
Şekil SCF V s monomerik ve peptid-yüklü IE k -2x6H moleküllere son jel filtrasyon aşaması veren yükselişi 3. Kromatogramlar. X-eksen ml tutma hacmini temsil Y eksenleri keyfi birimlerinde 280 nm (AU) absorbansı gösterir (A). H57 scFv site spesifik Alexa Fluor 555 maleimid proteini (aşama 1.2.5), reaksiyona girmemiş boya ayırmak için S75 kromatografiye tabi tutuldu ile etiketlenmiş. Tutma aralığı 14 to15 ml (kesik çizgiler) karşılık gelen fraksiyonlar monomerik H57 SCF V etiketli temsil eder. UV parçalanabilen ANP-uzay tutucu peptide ile kompleks (B) IE k -2x6H molekülleri, UV-ışınlanmış edilmiş site, özellikle Alex ile kuluçkaya vardı 647 maleimid-etiketli peptid ve son olarak serbest peptid (aşama 1.1.2.4) proteini ayırmak için S200 kromatografiye tabi tutulmuştur. Içeren uygun bir şekilde katlanmış kesik çizgiler ve monomerik pMHCs arasındaki aralık. (A, B) 0,7 ml'lik bir numune ROM (0 mi noktası) başlangıcında kolonuna uygulandı. Toplanan fraksiyonlar konsantre edilmiştir. Protein-boya oranı önceki PBS /% 50 gliserol karşı diyalize photospectrometry tespit edildi (-20 ° saklama için). Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
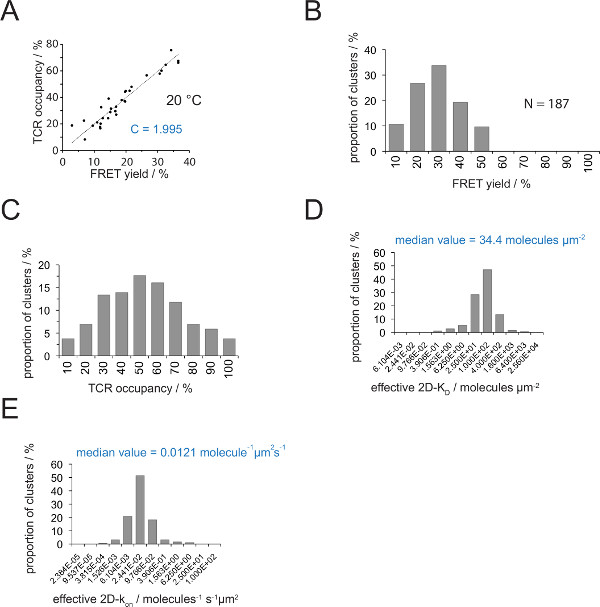
Şekil 4. belirlenmesi 2D-K D s ve s 2D-k. (A) alıcı beyazlatma ve TCR doluluk deneysel ölçüldü sonra donör iyileşme tarafından belirlenen FRET verimi arasındaki korelasyon. Bölüm 4.2'de açıklandığı gibi TCR doluluk bağımsız TCR microclusters için tespit edilebilir. Verilerin doğrusal bir uygunluğu hattı ile gösterilir, eğimi TCR arasındaki oran C eşittirdoluluk ve FRET verimi. C FRET sistemi ve istihdam floroforlar (burada Cy3 ve Cy5) için sürekli özeldir. Bu örnekte (B). 1.988 vermiştir verim verileri tek tek TCR microclusters belirlenmiştir FRET (N = 187, sıcaklık = 24 ° C) alıcı ağartma verici kurtarma yoluyla. Histogram bar altındaki rakamlar, aralığı içinde, üst sınırını gösterir. Ölçülen çarpılarak (B) 'de gösterilen veri (C) dönüştürme (A) C tespit sabit olan verimleri FRET. Barlar altında Sayılar aralığında üst sınırı gösterir. (D) Histogram (yarı-logaritmik taban = 4) Bireysel TCR microclusters için ölçülen 2D-K D s dağılımını gösteren. Medyan 2D-K D mavi gösterilir. Çubuklar altındaki rakamlar, (E) (D) 'de gösterilen histogram. Aralığı içinde, üst sınırını gösterir int dönüştürüldüoa 2D-k 24 ° C kapalı sinaptik k istihdam -histogram (yarı-logaritmik, üs = 4) üzerine (0.41 s -1). Değeri belirlenen medyan 2D-k mavi gösterilir. Veriler aslen Huppa ve ark., 2 yayınlandı ve yeni bir formatta burada görselleştirilmektedir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

SLBs Şekil 5. Fonksiyonel doğrulama T-hücresi uyarılması ve görüntüleme için kullanılır. Fura-2 yüklü (A) TCR-transgenik T hücre blastları antijenik pMHCs, ICAM-1 ve B-7 barındıran uyarıcı ile SLB karşıya. Hücresel 340 nm ve 380 nm heyecanlı fura-2 emisyonu yanı sıra DIC görüntüleri kaydedildi. Belirtildiği gibi, emisyon yoğunluklarının oranı değerleri, 34 ° C'de uyarılan0 ve 380 nm sağ panelde gösterilir. Uyarıcı SLBs temas pMHC deneysel çalışma halinde antikorların 14 dakika bloke eklenmesi T hücrelerinin dinlenme karşılaştırılabilir hücre içi kalsiyum seviyelerinde bir azalmaya neden olmuştur. (B) ortalama fura-2 oranlar tipik bir zaman profilini, T-hücreleri, özelliği, antikor aracılı bloke edildikten sonra, antigenin yoksun olmayan, aktive edilmiş T-hücreleri veya T-hücreleri ile karşılaştırıldığında 2 ila 4 kat daha fazla hücre içi kalsiyumda bir ilk artış ile. Yeşil çevreler (A) 'da gösterildiği zaman noktalarını gösterir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
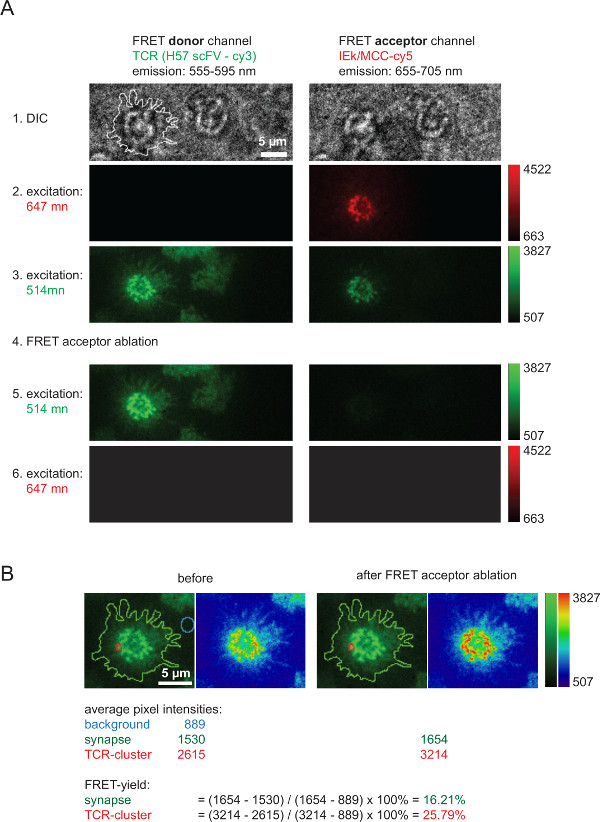
FRET alıcı kasar sonra FRET donör kurtarma yoluyla ölçülen Şekil 6. Toplu verimlerini FRET. gösterilir (A), tipik bir sinaptik FRET ölçüm bir örnektir. Soldaki ve üstünde gösterildiği gibi görüntüleri bir dizi, bir FRET donör ve alıcı FRET kanalına sebebiyet veren bir emisyon ışın ayırıcı kullanımı ile elde edilmiştir (ışın bölücülerin ilgili daha ayrıntılı bilgi için AXMANN bakın ark 4). Sol DIC resimde gösterilen hat T-hücresi sinaps sınırını gösterir. (B). Da FRET akseptör ağartma (aşama 4) sonra, FRET verici kanal yoğunluğunda bir artış olduğunu FRET alıcı kanalı içinde yoğunluğu kaybı Not bağımsız sinaptik bölgelere ya da tüm sinaps için belirtildiği gibi verimleri nicelendirilebilir FRET. Muayene için önce ve FRET alıcı kasar sonrası görüntüleri iki arama tabloları (LUT, yeşil ve fizik) kullanımı ile gösterilir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
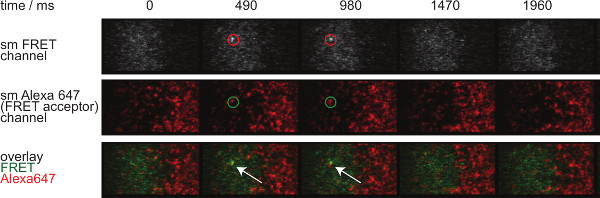
Şekil 7. Tek molekül olaylar görünür ve insingle adımları kaybolur ve mükemmel bir tek FRET alıcı fluorofor ile hizalanmış FRET. Tek bir molekülün FRET olayı time lapse gösterilir. Görüntüler arka aydınlatmalı EMCCD kamera kullanılarak elde edildi. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
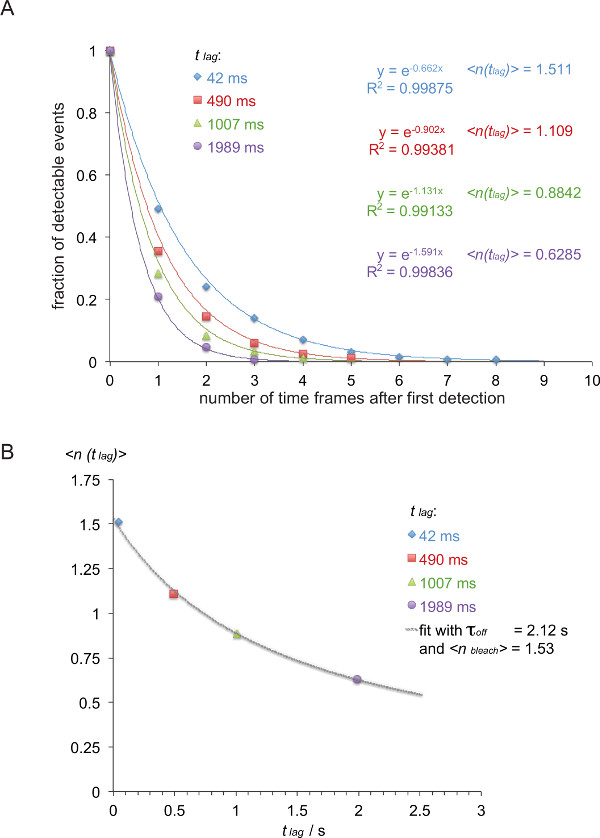
Τ kapalı belirlenmesi Şekil 8. = 1 / ölçülen smFRET yörüngeleri kapalı k. (A) 5c.c7 TCR transgenik T hücre patlamaların IE V -AF555 türetilmiş gözlemlenebilir FRET sinyallerinin (normalize kümülatif toplamlarısup> / K3-AF647 dört farklı zaman gecikmelerinin (42 ms, 490 ms, 1007 msn, 1989 msn) 24 ° C) toplam gözlem sayısının bir fonksiyonu olarak çizilmiştir k. Mono-üstel uyum fonksiyonlar. Beklenti değerlerine gecikme)> olumsuz tersini karşılık doğuran (B) Beklenen değerler gecikmeler t lag karşı çizildi ve lag)> denklemi kullanılarak monte = τ kapalı / {(bleach> / kapalı τ) + t gecikmesi} τ kapalı verim ve ağartıcı>. için bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Tartışmalar
In situ protein-protein etkileşimlerinin ölçülmesi gibi TCR-pMHC 11 bağlayıcı düşük afiniteli etkileşimler ile ilgili özellikle arzu edilmektedir. On-rate yanı sıra etkileşimlerin stabilitesi önemli ölçüde bağlanma gerçekleşir altında belirli koşullar tarafından etkilenmektedir olmasıdır. Minimal invaziv FRET tabanlı görüntüleme yaklaşımları mükemmel gibi görevler için uygun prensipte böylece, henüz ilk aşılması gereken engellerin bir dizi içerir. Hücresel otofloresansı tarafından oluşturulan gürültü ölçüm hassasiyeti sınırlar ve dolayısıyla, en azından tutulmalıdır. TIRF mikroskopi ideal seçim 13-15 proteinleri ile dekore edilmiş bir düzlemsel cam destekli çift katlı lipid şeklinde, çok iyi 12 bu ihtiyaca hizmet ama cam slaytlar fonksiyonalizasyonunu gerektirir. Kısmen reconstitutive yaklaşımın diğer bir avantajı, rekombinant bilayeri yerleşik FRET ortakları çok m olabilir olduğunuKolayca küçük ve parlak fluorophores ile kantitatif site-spesifik ve akılcı etiketlenmiş cevher hücre yüzey proteinleri ifade ile mümkün olacağını daha. Daha önce 2 test gibi TCR'ler rekombinant SCF V s, T-hücre tanıma etkisi yoktur hangi ile etiketlenmiş. Ayrıca, SLB protein bileşimi, örneğin, pMHCs yoğunluk ve aksesuar faktörler seçimi birinin spesifik ihtiyaçlarına göre ayarlanabilir. Biz daha önce uyarıcı pMHCs yoğunluklarını değişen deneyler, ama kapalı 2D-k ve 2D-K D 2 önemli farklılıklar tespit değil.
Şimdiye kadar Burada MHC sınıf II molekülleri tanıma esas olarak her iki ucu açık olan kendi peptit bağlanma yarığı, doğası gereği, yalnızca ele alınmıştır ve bu nedenle fluorofor bağlanması için bir bağlayıcı içeren daha büyük bir peptitler barındırmaktadır. Bazı durumlarda bu tür bir yaklaşım, aynı zamanda etiketleme MHC cla için işe yarayabilecekss Ben 16 molekülleri ama büyük dikkat deneylerde kullanılmasını doğrulamak için alınmalıdır. Yüzey plazmon rezonansı ile, in vitro olarak ölçülen T hücresi çoğalma tahlillerinde, hem de kinetik bağlanma pMHC-TCR ile ölçülebilir antijenlere karşı T-hücreleri, duyarlılığı bağlayıcı ve florofora ilavesiyle etkilenmemelidir peptit. Seçenek olarak ise, I molekülleri kendilerini MHC sınıf, ağır zincirin (yayınlanmamış gözlemler) dizisi içinde, bir bozulmamış sistein giriş ile bir site-spesifik bir tarzda etiketlenebilir.
Uygun moleküler probların kullanımı ile, herhangi bir sinaptik protein-protein etkileşimi, ilke olarak, burada tarif edilen bir şekilde, incelenebilir. Örneğin bu tür sondalar, SCF V s veya tasarlanan Ankirin tekrarlayın Proteinler (DARPins) 17, tek değerli olmalı ve ilgi etkileşimini etkilemeden stabil hedeflerini bağlamak gerekir. Tabii ki, yapısal information, rasyonel Sonda tasarımı için yüksek ölçüde istenir fakat mutlaka gerekli değildir. FRET ortakları yeni bir çift kurarken, bu kayıt ve ilk toplu FRET analiz etmek önerilir. Etiket eki Yer FRET sinyalini maksimize etmek için önemli ölçüde değişebilir ve aynı zamanda FRET ölçülen verimleri arası boya mesafeye göre farklılık doğrulamak için. Sistem optimize sonra, tek bir molekül sinyalleri% 10-30 yüksek bolluk FRET ortağı etiketleme sınırlandırılması ve tek moleküller aydınlatma alanında çözülebilir kadar düşük bolluk FRET ortağı beyazlatma tarafından kaydedilen olabilir FRET.
Son ama en az o SLBs bazı yaklaştığı dikkat ama edilmelidir değil fizyolojik plazma zarı tüm yönleriyle. Membran kavis ve esneklik, alan bölümlendirme ile, iskelet yeniden düzenlemeleri ve hücre hareketi gibi yüzey olarak eksprese edilen membran proteinlerinin yüksek çeşitli gibi nitelikleri SLBs ile temsil değildir, ancak t etkileyebilirO soruşturma altında işlem. Çok çaba TIRF görüntüleme erişilemez fizyolojik sinaps, tek bir molekül çözünürlüğü ile protein-protein etkileşimleri izleme izin görüntüleme yöntemlerini kurmak için yatırım gerekecektir.
Açıklamalar
The authors declare that they have no competing financial interest.
Teşekkürler
MA mali ve idari destek Avusturya Bilim Fonu'nun (FWF, J3086-B11) ve bir teşekkür Schrödinger bursu Max-Planck-Toplum tarafından desteklenmiştir. GS ve JH Viyana Bilim ve Teknoloji Fonu (WWTF, LS13-030) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| LB-media | Fisher Scientific | 10000713 | bacterial expression |
| Sf900 II | Life Technologies | 10227402 | insect cell media for baculo virus production |
| Insect-XPRESS with L-glutamine (Lonza) | Fisher Scientific | 10564038 | insect cell media for baculo virus expression |
| Sf9 cells | Life Technologies | 11496-015 | cells for virus production and expansion |
| High Five Cells | Life Technologies | B855-02 | cells for potein expression |
| LB-media | Fisher Scientific | 10000713 | bacterial expression |
| Centramate System | Pall | protein concentartion from large volumes | |
| Centramate cassette 10kDa cutoff | Pall | OS010T12 | protein concentartion from large volumes |
| Amicon Ultra-15 Centrifugal Filter Units | EMD Millipore | UFC900308 | protein concentartion |
| Amicon Ultra-4 Centrifugal Filter Units | EMD Millipore | UFC800308 | protein concentartion |
| Amicon Stirred Ultrafiltration Cell Model 200 mL | EMD Millipore | 5123 | protein concentartion |
| Äkta pure 25L | GE Healthcare | 29-0182-24 | protein purification |
| Superdex 200 10/300 GL | GE Healthcare | 17-5175-01 | protein purification |
| Superdex 75 10/300 GL | GE Healthcare | 17-5174-01 | protein purification |
| Mono Q 5/50GL | GE Healthcare | 17-5166-01 | protein purification |
| Ni Sepharose 6 Fast Flow | GE Healthcare | 17-5318-01 | protein purification |
| Tricorn 10/20 column | GE Healthcare | 28-4064-13 | protein purification |
| Gilson HPLC system | Gilson | purificationof fluorochrome-coupled peptides | |
| Pursuit XRs C18, 5 µm particle size, 21.2*250mm column size | Agilent | A6000250X212 | purificationof fluorochrome-coupled peptides |
| Pursuit XRs C18, 5 µm particle size, 21.2*50 mm column size | Agilent | A6000050G212 | purificationof fluorochrome-coupled peptides |
| Tricorn 10/20 column | GE Healthcare | 28-4064-13 | protein purification |
| Gilson HPLC system | Gilson | purificationof fluorochrome-coupled peptides | |
| Pursuit XRs C18, 5 µm particle size, 21.2*250mm column size | Agilent | A6000250X212 | purificationof fluorochrome-coupled peptides |
| Pursuit XRs C18, 5 µm particle size, 21.2*50 mm column size | Agilent | A6000050G212 | purificationof fluorochrome-coupled peptides |
| Cy3 maleimide | GE Healthcare | PA23031 | site-specific protein labeling via mutant unpaired cysteines |
| Cy5 maleimide | GE Healthcare | PA25031 | site-specific protein labeling via mutant unpaired cysteines |
| Alexa Fluor 555 C2 Maleimide | Life Technologies | A-20346 | site-specific protein labeling via mutant unpaired cysteines |
| Alexa Fluor 647 C2 Maleimide | Life Technologies | A-20347 | site-specific protein labeling via mutant unpaired cysteines |
| Fura-2, AM, cell permeant | Life Technologies | F-1221 | calcium-sensitive dye for cell labeling |
| dimethyl sulfoxide | Sigma Aldrich | 151874 | for dissolving fura-2 am |
| Hank's Balanced Salt Solution plus calcium/magnesium | Fisher Scientific | 10225362 | imaging buffer |
| PBS | Life Technologies | 14190-136 | |
| Bovine Serum Albumin lyophilized powder | Sigma Aldrich | A2153 | supplement for imaging buffer |
| 14-4-4S antibody | affimetrix eBioscience | 14-5980-81 | blocking antibody for H2-I-Ek (recognized by the 5c.c7, 2B4 and AND TCR) |
| 5 ml polypropylene round-bottom tube | Becton Dickinson | FALCON 352063 | |
| 0.22 μm Ultrafree-MC centrifugal filter unit | EMD Millipore | UFC30GV0S | |
| Syringe filter 0.2µm | Millipore | GVWP04700 | |
| TetraSpeck Microspheres, 0.1 µm, fluorescent blue/green/orange/dark red | Life technologies | T-7279 | |
| Microscope for fura-2-based calcium measurements | LEICA | DMI4000B | |
| Microscope for (single molecule) FRET measurements | LEICA/ZEISS/NIKON/OLYMPUS | for details please refer to parallel JoVE contribution by Axmann et al. | |
| planar supported lipid bilayers | for details please refer to parallel JoVE contribution by Axmann et al. | ||
| RPMI 1640, with L-Glutamine | Life Technologies | 11554416 | T-cell media |
| non-essential amino acid 100X | Hyclone | SH30238.01 | T-cell media supplement |
| penicillin/streptomycin/L-glutamine 100x | Life Technologies | 12000226 | T-cell media supplement |
| 2-mercaptoethanol | Sigma Aldrich | M6250 | T-cell media supplement |
| mouse interleukin-2 recombinant protein | BPS Bioscience | 90185-B | T-cell media supplement |
| Research Grade Fetal Bovine Serum | Hyclone | SV30160.03 | T-cell media supplement |
| Origin (analysis program) | OrigenLab | http://www.originlab.com/ | non-linear fitting of two parameters (tauoff, [ntlag]) |
Referanslar
- Garcia, K. C., Adams, J. J., Feng, D., Ely, L. K. The molecular basis of TCR germline bias for MHC is surprisingly simple. Nat Immunol.. 10, 143-147 (2009).
- Huppa, J. B., et al. TCR-peptide-MHC interactions in situ show accelerated kinetics and increased affinity. Nature.. 463, 963-967 (2010).
- Huppa, J. B., Davis, M. M. The interdisciplinary science of T-cell recognition. Advances in immunology.. 119, 1-50 (2013).
- Axmann, M., Schuetz, G. J., Huppa, J. B. Single Molecule Microscopy on Planar Supported Bilayers. Journal of Vizualized Experiments J. Vis. Exp.. 101, e53158(2015).
- Xie, J., et al. Photocrosslinkable pMHC monomers stain T cells specifically and cause ligand-bound TCRs to be preferentially transported to the cSMAC. Nat Immunol. 13, 674-680 (2012).
- Jares-Erijman, E. A., Jovin, T. M. FRET imaging. Nat Biotechnol. 21, 1387-1395 (2003).
- Toebes, M., et al. Design and use of conditional MHC class I ligands. Nat Med. 12, 246-251 (2006).
- Tsumoto, K., et al. Highly efficient recovery of functional single-chain Fv fragments from inclusion bodies overexpressed in Escherichia coli by controlled introduction of oxidizing reagent--application to a human single-chain Fv fragment. J Immunol Methods. 219, 119-129 (1998).
- Ruegg, U. T., Rudinger, J. Reductive cleavage of cystine disulfides with tributylphosphine. Methods Enzymol. 47, 111-116 (1977).
- Ruprecht, V., Brameshuber, M., Schütz, G. J. Two-color single molecule tracking combined with photobleaching for the detection of rare molecular interactions in fluid biomembranes. Soft Matter. 6, 568-581 (2010).
- Dustin, M. L., Bromley, S. K., Davis, M. M., Zhu, C. Identification of self through two-dimensional chemistry and synapses. Annu Rev Cell Dev Biol. 17, 133-157 (2001).
- Axelrod, D. Cell-substrate contacts illuminated by total internal reflection fluorescence. The Journal of cell biology. 89, 141-145 (1981).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285, 221-227 (1999).
- Kaizuka, Y., Douglass, A. D., Varma, R., Dustin, M. L., Vale, R. D. Mechanisms for segregating T cell receptor and adhesion molecules during immunological synapse formation in Jurkat T cells. Proc Natl Acad Sci USA. 104, 20296-20301 (2007).
- Varma, R., Campi, G., Yokosuka, T., Saito, T., Dustin, M. L. T cell receptor-proximal signals are sustained in peripheral microclusters and terminated in the central supramolecular activation cluster. Immunity. 25, 117-127 (2006).
- Purbhoo, M. A., Irvine, D. J., Huppa, J. B., Davis, M. M. T cell killing does not require the formation of a stable mature immunological synapse. Nat Immunol. 5, 524-530 (2004).
- Binz, H. K., Stumpp, M. T., Forrer, P., Amstutz, P., Pluckthun, A. Designing repeat proteins: well-expressed, soluble and stable proteins from combinatorial libraries of consensus ankyrin repeat proteins. J Mol Biol. 332, 489-503 (2003).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır