Method Article
جنبا إلى جنب علم البصريات الوراثي وتجميد كسر طبق الاصل Immunolabeling لدراسة ترتيب المدخلات معين من الغلوتامات المستقبلات في اللوزة ماوس
In This Article
Summary
This article illustrates how the expression of neurotransmitter receptors can be quantified and the pattern analyzed at synapses with identified pre and postsynaptic elements using a combination of viral transduction of optogenetic tools and the freeze-fracture replica immunolabeling technique.
Abstract
وقد تم تجميد كسر الإلكترون المجهري تقنية كبيرة في مجال البحوث التركيبية لأكثر من 40 عاما. ومع ذلك، فإن عدم وجود وسائل فعالة لدراسة التركيب الجزيئي للأغشية تنتج انخفاضا كبيرا في استخدامها. في الآونة الأخيرة، كان هناك انتعاش كبير في تجميد كسر المجهر الإلكتروني وذلك بفضل تطور وسائل فعالة للكشف عن البروتينات الغشاء لا يتجزأ من العلامات immunogold. واحدة من هذه الطرق كما هو معروف المنظفات بالفاعلات-تجميد كسر طبق الاصل Immunolabeling (FRIL).
الجمع بين تقنية FRIL مع علم البصريات الوراثي يسمح تحليل مترابط من الخصائص الهيكلية والوظيفية من نقاط الاشتباك العصبي المركزي. باستخدام هذا النهج فمن الممكن لتحديد وتوصيف الخلايا العصبية على حد سواء قبل وبعد المشبكي من التعبير كل منهما من channelrhodopsin المعلمة والواسمات الجزيئية محددة. ظهور مميز للتخصص الغشاء بعد المشبكي من glutamatergic المشابك مزيد يسمح، على وضع العلامات على مستقبلات الغلوتامات ionotropic، لتحديد وتحليل توزيع intrasynaptic هذه المستقبلات. هنا، نقدم وصفا خطوة بخطوة الإجراءات اللازمة لإعداد النسخ المتماثلة تقرن وكيفية immunolabel لهم. سنناقش أيضا المحاذير والقيود المفروضة على تقنية FRIL، ولا سيما تلك المرتبطة التحيز أخذ العينات المحتملة. استنساخ عالية وبراعة تقنية FRIL، عندما جنبا إلى جنب مع علم البصريات الوراثي، ويوفر طريقة فعالة جدا لتوصيف مختلف جوانب انتقال متشابك في رقائق الخلايا العصبية التي تم تحديدها في الدماغ.
هنا، ونحن نقدم مثالا كيف تم استخدام هذا النهج لاكتساب فهم أعمق للعلاقات هيكل وظيفة من نقاط الاشتباك العصبي مثير في الخلايا العصبية للجماهير الخلية مقحم من اللوزة الماوس. على وجه الخصوص، قمنا بدراسة التعبير عن مستقبلات الغلوتامات ionotropic في المدخلات المحددة أوiginated من داخل الصفيحة الخلفية المهادية ونوى الركبي الإنسي. عرضت هذه المشابك لنقل المعلومات الحسية ذات الصلة للتعلم الخوف والخضوع التغييرات البلاستيك على تكييف الخوف.
Introduction
وقد تحدى تعريف العمارة الوظيفية biomembranes على نطاق واسع نانومتر في السنوات الأخيرة من خلال تطوير عدد من التقنيات immunolabeling مناسبة لانتقال المجهر الإلكتروني. ومع ذلك، هذه التقنيات، على سبيل المثال، قبل وimmunogold التضمين آخر، لديها عدد من القيود الهامة، والتي تشمل الكشف عن الفقراء من المستضدات و / أو تقييم كمي محدود من البروتينات بغشاء. هذه القيود تصبح حرجة ولا سيما في التحقيق في التركيب الدقيق للجهاز العصبي، والتي تتميز بدرجة عالية من التنوع الخلية وعدم التجانس المشبك. نتائج هذا التباين من التنوع على حد سواء الهيكلية والوظيفية التي تمليها العناصر قبل وبعد المشبكي والتعبير التفاضلية، والإثراء، أو تفاعل يشير البروتينات، مثل المستقبلات، النقل، والجزيئات المستجيب.
نهج جديد لimmunolabe مباشرةوقدم لينغ من بروتينات الغشاء لا يتجزأ أو عبر ربط في النسخ المتماثلة للتجمد كسر المنظفات بالفاعلات (FRIL) في الأصل من قبل فوجيموتو عقدين من الزمن منذ 1. هذه الطريقة الأصلي كان، ومع ذلك، العديد من القيود، أي تجزئة شديد من النسخ المتماثلة، مما أعاق الارتباطات ذات مغزى من الجزيئات المسمى مع خلايا معين بشكل فردي في الأنسجة المعقدة مثل الدماغ. منذ ما يقرب من 10 عاما، Shigemoto وFukazawa تحسن تدريجيا تقنية 2. وبموازاة ذلك عن طريق جهود من مجموعة أخرى من العلماء في مختبرات بولدر في جامعة ولاية كولورادو، الذي أيضا تحسن كبير في التقنية، ولا سيما لدراسة تقاطعات الفجوة 3.
التحسن في بروتوكولات تجميد كسر والآلات، وكذلك إدخال التجميد السريع (تحت ضغط عال)، والآن يسمح للمحققين لإنتاج نسخ طبق الأصل متصلة من العينات من الحجم الكبير نسبيا ومرحباصور ذات جودة غ من معظم المكونات الخلوية من دون قيود والتحف التي تنتجها تثبيتات الكيميائية القوية.
تقدم تقنية FRIL ميزة كبيرة من كمي للغاية في تحديد الموقع من واحد أو أكثر من البروتينات (في نفس الوقت) في تشريحيا معين والخلايا التي تم تحديدها cytologically داخل أنسجة معقدة مثل الدماغ، مع ميزة إضافية من وجهة نظر مستو من قبل وبعد المشبكي عناصر في نسخة طبق الأصل واحد. ولذلك، فإن تقنية FRIL، رغم ما تتمتع به العديد من العقبات التقنية، يبشر لعدد من الاكتشافات العلمية الهامة جدا، لا سيما بالنسبة للارتباط الخصائص التركيبية والوظيفية من نقاط الاشتباك العصبي الفردية. خلال العقود القليلة الماضية، وقد تم الحصول على الكثير من المعلومات عن هيكل، الجزيئية الماكياج، وظيفة فسيولوجية من نقاط الاشتباك العصبي. بعد نقاط الاشتباك العصبي هي شكليا وجزيئيا متنوعة للغاية اعتمادا على السلطة الفلسطينية قبل وبعد المشبكيالخلايا العصبية الإيجار 4. فقط من أجل حفنة من أنواع المشبك كانت دراسات هيكل الوظائف أنجزت حتى الآن 5-7. يعزى هذا بشكل كبير إلى القيود التقنية التي حالت دون تحديد دقيق لطبيعة العناصر قبل وبعد المشبكي.
وقد وفرت تحليل التركيبية الأفكار الهامة في تنوع التخصصات الغشاء بعد المشبكي عبر متشابك اتصالات متميزة سواء من حيث حجم متشابك والمحتوى في المستقبلات العصبية 6، والتي لديها تأثير كبير على قوة ومرونة انتقال متشابك. وعلاوة على ذلك، مجموعة كبيرة من البحوث تشير إلى أن عدد ionotropic مستقبلات الغلوتامات التي أعرب عنها في أنواع مختلفة من المشبك وينظم بطريقة afferent- والهدف التي تعتمد 7-10.
هنا، ويرد الأسلوب الذي يسمح تحليل هيكل ومستقبلات تكوين التخصصات الغشاء بعد المشبكي ممن يملكون تحديدالعناصر قبل المشبكي د وظيفة. ويستغل هذا التوجه التعبير قبل المشبكي من البروتينات الحساسة للضوء وضعت مؤخرا الطحالب، مثل channelrhodopsin2 (ChR2)، وتقنية FRIL لتحليل نمط التعبير بعد المشبكي من α-أمينو-3-هيدروكسي-5-ميثيل-4-isoxazolepropionic حمض (أمبا روبية) و N-ميثيل مد اسبارتاتي (NMDA روبية) مستقبلات الغلوتامات. ويتجلى هذا في نقاط الاشتباك العصبي التي شكلتها المحاور القادمة من الخلفية نوى الركبي مهادي-وسطي (PIN / MGN) على الخلايا العصبية للجماهير الخلية مقحم من اللوزة (ITC). الخلايا العصبية ITC صغيرة خلايا GABAergic شائك تنظيمهم في مجموعات المحيطة بمجمع اللوزية basolateral (جيش تحرير بلوشستان) 11، 12. ومن المعروف أن الخلايا العصبية المركز للحصول على مدخلات مثير من الخلايا العصبية الرئيسية جيش تحرير بلوشستان واستهداف النواة المركزية (CEA)، وبالتالي يعمل بمثابة بوابة المثبطة لتدفق المعلومات بين جيش تحرير بلوشستان وCEA 12-15.
في الآونة الأخيرة، أثبتنا أن تكنولوجيا المعلوماتالخلايا العصبية C الموجود في الكتلة ميديو الظهري بين جيش تحرير بلوشستان وCEA أيضا الحصول على المدخلات مثير مباشرة ومتقاربة من المناطق القشرية المهادية والزمانية الحسية، والتي يتم تعديلها على الخوف التعلم خلال بافلوف السمعي تكييف خوف 16. تكييف الخوف هو واحد من أشكال فهم أفضل للتعلم النقابي من حيث آليات الدماغ. في تكييف الخوف، حافزا مشروط محايد في البداية (CS، على سبيل المثال، لهجة) يقترن مع التحفيز مكره غير المشروط (الولايات المتحدة، على سبيل المثال، صدمة القدم معتدل) مما أدى إلى وجود ارتباط CS-الولايات المتحدة ومكيفة استجابة الخوف 17، 18. مثير المدخلات من كل من المناطق المهادية والقشرة المخية الحديثة، التي تحمل المعلومات التي تمثل CS والولايات المتحدة، على التوالي، كانت معروفة لتتلاقى على الخلايا العصبية الهرمية للنواة الجانبية من اللوزة (LA)، والخضوع ليونة 19. كشفت عملنا السابق أن إدخال المعلومات الحسية هي أيضا بالتوازي تنقل إلى الخلايا العصبية ITC 16.
وكخطوة أولى على طريق التحليل الجزيئي الآلية من المدخلات الحسية الفردية نقاط الاشتباك العصبي على الخلايا العصبية مركز التجارة الدولية، وكنا فيروس الغدة المرتبطة (AAV) للتعبير عن ChR2 الكلمات الدلالية مع بروتين فلوري أصفر (YFP). تم حقن AAV في PIN / MGN وتم تحديد محطات محوار من قبل التعبير عنها من ChR2-YFP. كنا على حد سواء وجوه الناتجة عن تقنية FRIL لتقييم كثافة بعد المشبكي أمبا-R و NMDA روبية في نقاط الاشتباك العصبي شكلت مع الخلايا العصبية مركز التجارة الدولية عن طريق محطات محوار PIN / MGN.
Protocol
وقد تمت الموافقة على الإجراءات التي تجرى على الحيوانات من قبل Regierungspraesidium توبنغن، ولاية بادن فورتمبيرغ، ألمانيا، والتي التجارب على الحيوانات مجلس أخلاقيات مهنة النمساوية، وكان وفقا لتوجيه الاتحاد الأوروبي بشأن استخدام الحيوانات في البحوث.
1. اللمسي حقن AAV-Channelrhodopsin2-YFP
أجريت الحقن التجسيمي وفقا لبروتوكول نشرت سابقا 20: ملاحظة.
- إعداد أدوات معقمة لها في تسخين 180 درجة مئوية لمدة 1.5 ساعة.
- سحب حادة الماصات الزجاجية (~ 50 ميكرون قطر) لحقن باستخدام مجتذب مسرى مكروي الأفقي مع مجموعة من المعلمات التالية: الحرارة = قيمة التعلية - 20، سحب = 0، السرعة = 100، الوقت = 200، الضغط = 200.
ملاحظة: يجب قيمة تعلية يتم تحديدها لكل الكثير من الماصات الزجاجية التي تم شراؤها وفقا للتعليمات التي تقدمها الشركة المصنعة micropipette مجتذب. - بريمكس 1 ميكرولتر من حل الفيروس و 0.2 ميكرولتر من حل سريع الأخضر 0.1٪ (لرؤية أفضل من الحل في ماصة الزجاج) في الفوسفات العقيمة المالحة العازلة (PBS، 25 مم، 0.9٪ كلوريد الصوديوم، ودرجة الحموضة 7.4). ملء ماصة الزجاج باستخدام 10 ميكرولتر ماصة وهلام فيل النصائح. لبناء الفيروسي، واستخدام rAAV-hSyn-ChR2 (H134R) -eYFP (المصلي 2/9).
- تخدير الماوس باستخدام جهاز تخدير الحيوانات الصغيرة (3٪ الأيزوفلورين في الأكسجين لتحريض). استعمال. لهذه الدراسة، استخدم 3 الفئران البرية من نوع الذين تتراوح أعمارهم بين ~ 6 أسابيع.
- حلق الرأس بين الأذنين والعينين وتطهير مع حل بوفيدون اليود مقرها.
- تطبيق مرهم العين لمنع جفاف العين أثناء التخدير. تحت الجلد حقن الفأر مع مسكن (القائم على ميلوكسيكام، 0.1 مل من 5 ملغ / مل حل).
- ضع الماوس في إطار المجسم والحفاظ على التخدير عن طريق جهاز غازات التخدير (2٪ الأيزوفلورين في الأكسجين للصيانة). تحقق عمق التخدير بسبب عدم الانسحاب أطرافهممنعكس قبل المتابعة.
- الحفاظ على ظروف معقمة قدر المستطاع أثناء إجراء العمليات الجراحية بأكمله. ارتداء المتاح وجه قناع، ثوب الجراحية والقفازات.
- جعل شق الجلد من حوالي 1 سم في أعلى الرأس باستخدام مقص 20. سحب الجلد بلطف إلى الجانب باستخدام الملقط حادة، مع تحديد المشابك لفضح سطح الجمجمة والجمجمة نظيفة مع H 2 O 2.
- مواقع الحقن علامة على الجمجمة باستخدام علامة دائمة غيض غرامة. حفر حفرة صغيرة (حوالي 1 ملم في القطر) في الجمجمة في موقع ملحوظ. لمن جانب واحد حقن PIN / MGN في هذا مسمار، واستخدام الإحداثيات التالية: من bregma (مم): الخلفية 3.0 الجانبية ± 1.8، 3.8 البطنية.
- جبل شغل ماصة الزجاج على إطار المجسم اتصال إلى جهاز حقن الضغط وتقديم ماصة للbregma الموقف.
- قطع غيض من ماصة الزجاج باستخدام ملقط غرامة طرف على التوالي. التأكد من غيض ماصة مفتوح من قبل applyinالجا البقول قليل من الضغط ومراقبة قذف قطرات من محلول الفيروس.
- انتقل إلى إحداثيات حقن المطلوب وحقن نصف محتوى ماصة (~ 0.5 ميكرولتر) باستخدام الإعدادات التالية على جهاز حقن الضغط: ضغط 20 رطل، ومتوسط طول النبض 30 مللي ثانية، ومتوسط عدد النبضات 50.
- ترك ماصة في مكان ~ 1 دقيقة قبل ببطء (1 مم / دقيقة) يتراجع ذلك.
- الجمجمة نظيفة مع برنامج تلفزيوني (الرقم الهيدروجيني 7.4) وإزالة المشابك. برفق الجلد معا، وخياطة شق (3-4 عقدة). تطبيق مطهر (بوفيدون اليود القائم) حول الجرح.
- وقف التخدير ولا تترك الماوس غير المراقب حتى مستيقظا تماما. حافظ على الفئران احد يضم. بعد العمل الجراحي، ومواصلة مراقبة الوضع الصحي. إذا لزم الأمر مسكن إدارة.
- إبقاء الحيوانات لمدة 4 أسابيع قبل تثبيت الدماغ لضمان مستويات مناسبة من التعبير الفيروسي.
2. تحضير العينات
- تثبيت الدماغ </ قوي>
- إعداد تثبيتي
- ل1 لتر من تثبيتي، تزن 10 غرام من امتصاص العرق وإضافته إلى 300 مل من H 2 O. منزوع الأيونات الحرارة إلى 55-60 درجة مئوية ل~ 10 دقيقة مع التقليب المستمر.
- إيقاف الحرارة وإضافة 7-8 قطرات من 4 N هيدروكسيد الصوديوم. ينبغي أن يصبح حل واضح في ~ 10 دقيقة.
- ندعه يبرد إلى RT، إضافة 150 مل من محلول مشبع من حمض البكريك وإحضاره إلى 500 مل مع H 2 O. منزوع الأيونات
- إضافة 500 مل من 0.2 M الفوسفات عازلة (PB). تصفية مع ورق الترشيح. ضبط درجة الحموضة إلى 7.4 مع هيدروكسيد الصوديوم.
- تبريد تثبيتي إلى 6 درجات مئوية، واحفظها في عبوات زجاجية داكنة مدة لا تزيد على يوم واحد في 6 درجة مئوية.
- Transcardiac نضح
- تخدير الفئران مع حقنة داخل الصفاق من ثيوبنتال (120 ملغم / كغم من وزن الجسم). تأكد من أن يتم تخدير عميق الحيوان عن طريق التحقق من refl انسحاب دواسةالسابق، والتي ينبغي أن تكون غائبة. وضع الحيوان على ظهره على طاولة نضح مع الأطراف الأربعة مكبلة.
- فتح جدار البطن طوليا مع مقص حادة في نهاية وجعل اثنين من التخفيضات الإضافية أفقيا على طول الحدود الذيلية من القفص الصدري، لفضح الحجاب الحاجز. قطع الحجاب الحاجز وقطع جدار الصدر على الحدود osteocartilageneous على كلا الجانبين. رفع نهاية الذيلية للبلاطة المركزي من جدار الصدر تحتوي على القص لفضح القلب.
- إزالة التامور، وجعل قطع دقيقة صغير في طرف من البطين الأيسر إلى الاعتراف قنية من جهاز نضح. استخدام قنية حادة مع القطر الداخلي 0.6 ملم. تمرير قنية بلطف من خلال البطين حتى يظهر تلميح إلى الأبهر الصاعد وتأمين قنية مع المشبك. للسماح الدم وperfusates للخروج من مجرى الدم، واجراء خفض في الأذين الأيمن.
- الفئران يروي transcardially يستخدم مضخة تحوي بمعدل تدفق5 مل / دقيقة في البداية مع برنامج تلفزيوني (25 ملم، 0.9٪ كلوريد الصوديوم، ودرجة الحموضة 7.4) لحوالي 1 دقيقة، تليها تثبيتي الجليد البارد لمدة 7 دقائق.
- بعد التثبيت، وقطع رأس الفأر مع زوج من مقص ثم قطع الجلد من خلال خط الوسط من الرقبة إلى الأنف. إزالة العضلات للكشف تماما عن الجمجمة.
- باستخدام مقص حاد، وجعل قطع طولية من خلال القذالي والعظام الجداريين بدءا من ماغنوم الثقبة. باستخدام الملقط غرامة إزالة هذه العظام لفضح المخيخ كله. ثم جعل قطع طولية أخرى من خلال الجدارية وعظم جبهي حتى عظم الأنف وإزالتها مع ملاقط لفضح الدماغ كله.
- باستخدام ملعقة إزالة الدماغ دون الإضرار بها، ووضعه في الجليد الباردة 0.1 م PB.
- إعداد تثبيتي
- باجتزاء وتقليم من العينات
- خفض كتلة الاكليلية ما يقرب من 5-6 ملم مع شفرات الحلاقة التي تحتوي على مجال الاهتمام. الغراء وضعها على حاملوvibroslicer مع الغراء cyanoacrylate. توجيه كتلة الأنسجة بحيث تواجه القشرة المخية الحديثة شفرة تهتز. أقسام الاكليلية شريحة، التي تحتوي على اللوزة، في 140 ميكرون مع vibroslicer (الشكل 1A) في الجليد الباردة 0.1 م PB، وجمعها في طبق 6-جيدا في المخزن نفسه.
- تحت مجهر تشريحي، وتقليم خارج المنطقة من اهتمام (هنا، الكتلة paracapsular ميديو الظهري من مركز التجارة الدولية، انظر الشكل 1B) من شريحة. هل هذا في طبق بتري المغلفة مع المطاط الصناعي السيليكون ومليئة 0.1 م PB، وذلك باستخدام مشرط العيون. تأكد من أن الكتل قلص تناسب في حفرة للهل (حوالي 1.5 مم) (الشكل 1B).
- نقل كتل قلصت إلى حل cryoprotection (30٪ الجلسرين في 0.1 م PB) O / N في 6 درجة مئوية.
3. ارتفاع ضغط التجميد
ملاحظة: يتكون FRIL من 6 خطوات أساسية (الشكل 2): 1) تجميد السريع مع الضغط العالي (في 2300 - 2600 بار) من العينة. 2) الكسر من العينة. الطائرة كسر عموما يتبع جوهر مسعور المركزي الأغشية المجمدة، تقسيمها إلى قسمين منشورات نصف غشاء: نصف التي تقع متاخمة لجبلة (P-الوجه) ونصف التي تقع مجاورة للمساحة خارج الخلية أو exoplasmic (E- وجه). 3) النسخ المتماثل للعينة التي كتبها فراغ ترسب من البلاتين والكربون. 4) منظفات الهضم من الأنسجة. 5) Immunogold وضع العلامات. 6) تحليل النسخة المتماثلة باستخدام المجهر الإلكتروني النافذ.
- إعداد حاملات النحاس
ملاحظة: يتم التعامل معها من خلال المراحل المتتالية لإجراء FRIL، تحتاج إلى أن تكون محمولة على ناقلات المعادن (الذهب أو النحاس) العينات. تختلف شركات الطيران هذه في الحجم والتصميم وفقا لطريقة كسر ونوع الآلات المستخدمة. نحن هنا تستخدم ناقلات النحاس (الشكل 1B، E) ويتوقف "الجدول نسخة المزدوج". (انظر الشكل 3B)، التي تنتج عندما فتحت كسر الشد من خلال العينة المجمدة (الشكل 2). وهذا يسمح للاحتفاظ وتكرار كلا الجانبين من عينة كسر.- شركات النحاس البولندية مع مزيل تشويه باستخدام ورقة من الجلد الشمواه.
- مكان الناقلين في وعاء زجاجي ونظيفة مرتين مع المنظفات غير الأيونية (درجة الحموضة ~ 1.5) في حمام مائي sonicating، ثم يغسل على نطاق واسع في مياه الحنفية يليه الماء منزوع الأيونات ثم شطف مرتين مع الإيثانول.
- يصوتن شركات الطيران النحاس في الأسيتون لمدة 15 دقيقة.
- وضع شركات على الورق مرشح لتجف.
- إرفاق حلقة من الشريط على الوجهين إلى الناقل النحاس (الشكل 1C)، والذي سيكون بمثابة عقد جيدا ل(الناقل القابضة) كتلة قلصت.
- تجميد العينة
ملاحظة: التعامل مع النيتروجين السائل مع الرعاية ويرتدي نظارات واقية مناسبة.- بدوره على ارتفاع ضغط مجاناوحدة زينغ (الشكل 1F) لا يقل عن 1.5 ساعة قبل البدء مع تجميد العينة.
- بدء التدفئة عن طريق الضغط على زر "AIR سخان"، وخبز خارج لمدة 50 دقيقة. تعيين درجة حرارة الجو إلى 80 درجة مئوية.
- ربط خزان النتروجين إلى وحدة تجميد ارتفاع الضغط واضغط على زر "النيتروجين" لملء داخل ديوار مع النيتروجين السائل. و"النيتروجين المستوى" مصباح تضيء. بدء التبريد عن طريق الضغط على زر "التبريد".
- اضغط على "محرك الأقراص في" عند "مستوى النيتروجين" ويخرج. تأكد من أن النظام الهيدروليكي يتحرك المكبس ذهابا وإيابا 3 مرات.
- اضغط على زر "AUTO"، وعلى زر "النيتروجين". في أقرب وقت "جاهزة" تضيء، وحدة تجميد الضغط العالي مستعدة لارتفاع ضغط التجمد.
- وضع كتلة قلصت في حفرة من الشريط على الوجهين (الشكل 1B) باستخدام حلقة سلك البلاتين الذي انصهر AGماصة معشوقة.
- إزالة الفائض من الحل cryoprotectant استعمال ورق الترشيح أو فرشاة.
ملاحظة: هذا الإجراء مهم أيضا لإزالة فقاعات الهواء التي قد تشكل حول النسيج والتي يمكن أن تسبب تشويه للشكل الأنسجة و / أو التركيب الدقيق. - تحت مجهر تشريحي، تغطية الناقل عقد مع ناقل آخر، بحيث محصورة كتلة الأنسجة بين الشركتين.
- إدراج الناقل شطيرة في حامل عينة من حدة ارتفاع ضغط تجميد (1D الشكل). تضاف حامل العينة في وحدة ارتفاع ضغط تجميد (نصيحة لأسفل) وثبته عن طريق الشد في حامل العينة.
- بدء دورة التجميد عن طريق الضغط على زر "جيت السيارات". العمل في أسرع وقت ممكن، وإزالة حامل العينة وغمر طرف مع النيتروجين السائل في صندوق معزول. تزج نصائح من اثنين من أزواج من الملقط في النيتروجين السائل لتبريدها.
- إزالة بعناية عشرالبريد الناقل شطيرة من صاحب العينة ووضعها في cryovial قبل المبردة. تأكد من أن شركات الطيران يتم التعامل فقط مع ملقط تبريد النيتروجين السائل. يجب مثقبة Cryovials للسماح النيتروجين لتتدفق من القارورة (الشكل 1G).
- كرر الخطوات من 3.2.6 إلى 3.2.11 حتى تم تجميد جميع العينات المطلوبة. متعددة الناقل السندويشات التي تحتوي على نفس نوع العينة ويمكن تخزين في نفس القارورة.
- تخزين cryovials المحتوية على شركات الطيران في cryotank حتى التكرار (الشكل 1H).

الشكل 1. الأنسجة إعداد وتجميد الضغط العالي. (A) Vibroslicer تستخدم لقسم الأنسجة. (ب) قسم دماغ الفأر الاكليلية الناتجة تحتوي على الجانب اللوزة الذي أبداه الجانب مع ميلانالناقل opper مزودة بحلقة من الشريط على الوجهين. يشير مربع متقطع مجال الاهتمام الذي يحتوي على مجموعة paracapsular سطي من مركز التجارة الدولية. قطر الثقب في الشريط على الوجهين ما يقرب من 1.5 مم. (ج) أدوات لإعداد حاملات النحاس. من أعلى إلى اليسار بطريقة اتجاه عقارب الساعة: الشريط على الوجهين، ملاقط، مثقب وناقلات النحاس، ومقص. (D) الإدراج الناقل شطيرة في حامل العينة لارتفاع ضغط التجمد. يتم وضع شطيرة الناقل في حفرة من صاحب العينة. (E) ناقلات النحاس دون ومع عصابة من الشريط على الوجهين و "الناقل ساندويتش". (F) وحدة الضغط العالي تجميد مع خزان الضغط تغذية النيتروجين السائل لذلك. (G) وcryovial لتخزين الأنسجة المجمدة. ملاحظة الثقوب في موقف أعلى من المتوسط من القارورة السماح غاز النيتروجين في التدفق من القارورة (رأس السهم). (H) Cryotank لتخزين الأنسجة المجمدة. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
4. تجميد الكسر والنسخ المتماثل
- إعداد البنادق شعاع الالكترون
- قبل إدخال البنادق شعاع الالكترون، وإزالة الدرع مع "لوحة منحرف". وضع "وضع مقياس" لمركزه خيوط في تشاك كوليت من خلال السفلي الغطاء الكاثود.
ملاحظة: يستخدم نهاية قطرها أكبر من مقياس الإعداد من أجل بندقية الكربون في حين أن نهاية القطر الأصغر للمدفع البلاتين. - حرك خيوط جديدة على مقياس حتى "صفيحة الضغط" ويمكن تضييق نهايات خيوط، وضمان أن لفائف خيوط لا تكمن في زاوية.
- إزالة مقياس إعداد وإدراج قضيب الكربون. اصلاحها من خلال تشديد التعاونتشاك llet من قضيب حامل المبخر، وضمان أن ارتفاع نهاية قضيب في الوسط من لفائف الثاني من الأسفل. لبندقية البلاتين، يجب أن يكون ارتفاع نهاية قضيب بلاتين في وسط لفائف خيوط الثاني من القمة.
- استبدال لوحة منحرف وإدراج البنادق في وحدة كسر التجميد. تنظيف البنادق مع الرمال الناسف بعد الاستخدام.
- قبل إدخال البنادق شعاع الالكترون، وإزالة الدرع مع "لوحة منحرف". وضع "وضع مقياس" لمركزه خيوط في تشاك كوليت من خلال السفلي الغطاء الكاثود.
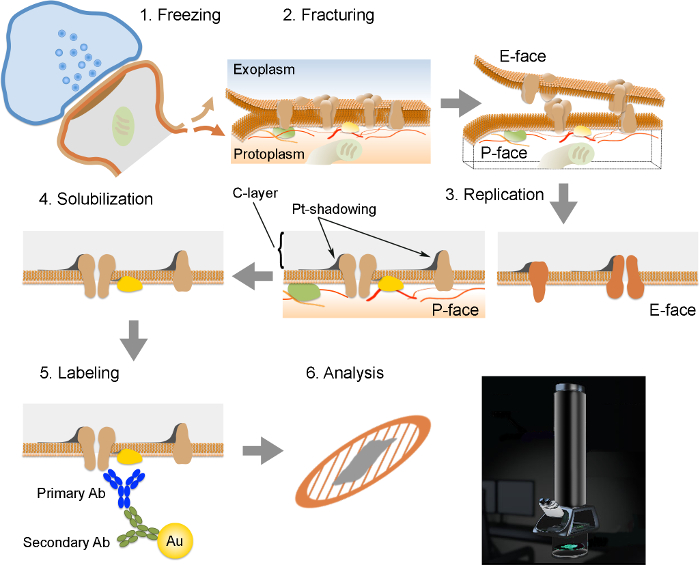
الشكل 2. رسم توضيحي لخطوات مفتاح تقنية FRIL.
لمحة عامة عن مختلف الخطوات اللازمة لإعداد وتحليل الاصل. (1) تجميد ارتفاع ضغط الأنسجة. (2) الكسر. خلال كسر من الأنسجة المجمدة، يتم تقسيم طبقة ثنائية المادة الدهنية للأغشية البلازما إلى نصفين في واجهة مسعور. ويتم تخصيص البروتينات في الغشاء البلازمي على إما exoplasmic (وجه E) أو بروتوالأغشية بلازمي (P-الوجه). (3) النسخ المتماثل. تبخر الكربون (C) مصائد الدهون والبروتينات على سطح الأنسجة الممزقة. وهي مغلفة المواد مع 2 نانومتر البلاتين / الكربون لتلقي بظلالها على زاوية 60 درجة، وبعد ذلك مع طبقة الكربون 15 نانومتر آخر الذي يقوي هيكل النسخة المتماثلة (C-طبقة، وحزب العمال-التظليل). (4) الإذابة. ثم يتم بالفاعلات الأنسجة لا المحاصرين من قبل غشاء المتماثلة مع SDS-حل. (5) وصفها. البروتينات من الفائدة يمكن تصور على نسخة باستخدام مجمع مصنوعة من الاجسام المضادة المحددة الابتدائية (الابتدائية أ ب) والأجسام المضادة الثانوية (أب الثانوي) مترافق مع جسيمات الذهب (الاتحاد الافريقي). استخدام أحجام مختلفة من جزيئات الذهب يسمح الكشف عن بروتين أكثر من واحد في نفس الاصل. (6) بعد immunolabeling، يتم جمع النسخ المتماثلة على شبكات سلكية النحاس وتحليلها باستخدام المجهر الإلكتروني النافذ في 80 - 100 كيلو فولت الرجاء أنقرك هنا لمشاهدة نسخة أكبر من هذا الرقم.
- انشاء وحدة كسر التجميد
- التبديل على وحدة كسر التجميد (الشكل 3A) من خلال تحويل MAINS إلى 1. للحصول على وصف مفصل للإجراءات تجميد كسر والتكرار، انظر تعليمات التشغيل المقدمة من قبل الشركة المصنعة.
- قبل تبريد جهاز تجميد كسر، خبز من نظام التبريد بأكمله من وحدة مع الهواء الدافئ. اضغط على زر "ذوبان" في 010 جهاز إم تي سي (درجة الحرارة وحدة تحكم) (الشكل 3A)، والسماح للعملية تشغيل خبز خارج لمدة 45 دقيقة.
- تفعيل محطة فراغ. تعمل وحدة كسر التجميد عادة في مجموعة فراغ ~ 10 -6 - 10 -7 ميليبار.
- ملء خزان النيتروجين وتوصيله إلى وحدة كسر التجميد. تأكد من أن حامل صمام الجافة وأيضا تنظيف دخول الخزان قبل الإدراج من صاحب صمام (الرطوبة يمكن أن تتداخل مع vacuuم وبيان N 2 ملء الخزان).
- بدء التبريد من خلال تحديد درجة الحرارة إلى -115 درجة مئوية. التبريد يستغرق حوالي 45 دقيقة.
- إدراج البنادق شعاع الالكترون وضبط التيار والجهد للوصول إلى المعايير التالية للتبخر:
بندقية الكربون: تناوب على موقف 90 درجة، ومعدل تراكم الكربون 0،1-0،2 نانومتر / ثانية
بندقية الكربون البلاتين: دوران من موقف 60 درجة، ومعدل تراكم 0،06-،1 نانومتر / ثانية
ملاحظة: إذا تم استخدام بندقية لأول مرة بعد تبادل الكربون أو البلاتين قضيب، ديغا لمدة 3 دقائق قبل الاستخدام.
- كسر والتكرار
- إدراج المجمدة الناقل السندويشات في جدول نسخة مزدوجة التأكد تتم كل التلاعبات في النيتروجين السائل.
- نقل الجدول نسخة مزدوجة لسفينة ديوار وإصلاحه إلى مرحلة استقبال العينة بزاوية مقدارها 45 درجة. ينبغي أن يكون مستوى النيتروجين السائل دائما فوق طاولة نسخة مزدوجة.
- التقاط الجدول نسخة مزدوجة مع مناور الطاولة وأدخله في وحدة كسر التجميد على خشبة المسرح الباردة. انتظر حوالي 20 دقيقة للسماح للحرارة من الجدول نسخة مزدوجة لضبط ل-115 درجة مئوية.
- تأكد من أن الفراغ هو أقل من 10 -6 م بار ودرجة حرارة -115 درجة مئوية.
- كسر النسيج اليدوي بواسطة عكس اتجاه عقارب الساعة دوران عجلة متصلة الكفن وضعت فوق الطاولة نسخة مزدوجة. عندما يتحول الكفن، فإنه يفرض على طاولة نسخة مزدوجة لفتح، وتمزيق النسيج.
- اضغط على زر "التوتر العالي" في إدارة القيمة المكتسبة (الوحدة شعاع الالكترون السيطرة التبخر) 030 جهاز لوحدة كسر التجميد (الشكل 3A).
- تكرار الأسطح المكشوفة من الأنسجة الممزقة (الشكل 3C) عن طريق التبخر من الكربون (الدورية) وذلك عن طريق بندقية شعاع الالكترون المتمركزة على زاوية 90 درجة إلى سماكة 5 نانومتر، تليها SHADO أحادي الاتجاهجناح مع البلاتين الكربون في زاوية 60 درجة إلى سمك 2 نانومتر. وأخيرا، تطبيق 15 نانومتر طبقة سميكة من الكربون من زاوية 90 درجة (الدورية).
- استخدام المعلمات التالية للتبخر:
1ST الكربون: تناوب على موقف 90 درجة. سرعة 0،1-0،2 نانومتر / ثانية؛ 5 نانومتر
2ND الكربون البلاتين: موقف 60 درجة. سرعة 0،06-،1 نانومتر / ثانية؛ 2 نانومتر
الكربون 3RD: تناوب على موقف 90 درجة. سرعة 0،3-0،5 نانومتر / ثانية؛ 15 نانومتر - إزالة عينات تكرارها من وحدة كسر التجميد ونقلها إلى السيراميك 12-جيدا لوحة (الشكل 4A) مليئة TBS (تريس مخزنة المالحة، ودرجة الحموضة 7.4).
- استخدام البلاتين حلقة الأسلاك، وإزالة الأنسجة تكرارها من الناقل العينة (الشكل 4A).
- كرر الخطوات من 4.3.1 إلى 4.3.10 حتى يتم نسخ كافة العينات.
 ص /> الشكل 3. تشميد والنسخ المتماثل.
ص /> الشكل 3. تشميد والنسخ المتماثل.
(A) وحدة كسر التجميد. تحتوي على آلة عدة وحدات التحكم ومراقبة. يتم إدخال العينات إلى الغرفة من خلال منفذ على الجانب الأيسر من الغرفة. تم توصيل حاويات النيتروجين السائل المضغوط إلى وحدة كسر التجميد لتبريد المرحلة. الصور أدناه الحدث الهائل آراء اثنين من وحدات (UPC 010 وMDC 010) والشاشة التي تظهر المعلمات خلال التبخر من طبقة الكربون الثانية. (ب) تم افتتاح (يسار) وإغلاق (يمين) آراء الجدول نسخة مزدوجة. يتم إدراج "الناقل السندويشات" في فتحات من الجدول (المشار إليها السهام). منع الأسلحة الصغيرة "الناقل السندويشات" من السقوط خلال التلاعب. (C) عينة كسور وتكرارها. تظهر النسخ المتماثلة الأفلام سوداء رقيقة على الجزء العلوي من الأنسجة الممزقة.53 / 53853fig3large.jpg "الهدف =" _ فارغة "> الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- SDS-الهضم من النسخة المتماثلة
- نقل متماثلة إلى قارورة زجاجية 4 مل مليئة 1 مل من العازلة SDS-الهضم (2.5٪ كبريتات لوريل الصوديوم، و 20٪ سكروز في 15 ملي تريس، ودرجة الحموضة 8.3). ملخص لمدة 18 ساعة على 80 درجة مئوية مع الهز (45 السكتة الدماغية / دقيقة).
- نقل النماذج المقلده، لأنبوب جديد مليئة العازلة SDS-الهضم وتخزينها في RT.
5. Immunolabeling
ملاحظة: يتم تنفيذ كافة حضانات في RT مع اهتزاز لطيف، باستثناء حضانات مع الأجسام المضادة.
- غسل النسخة المتماثلة لمدة 10 دقيقة في المخزن SDS-الهضم الطازجة.
- غسل النسخة المتماثلة مرة واحدة مع 2.5٪ BSA (البقري ألبومين المصل) في TBS لمدة 5 دقائق، ثم 3 × 10 دقيقة مع 0.1٪ في جيش صرب البوسنة TBS.
- حجب المواقع غير الملزمة محددة في TBS مع 5٪ BSA لمدة 1 ساعة.
- تطبيق المضادة الأوليةالهيئات مخففة في 2٪ BSA-TBS. أداء حضانات في 30 قطرة ميكرولتر (الشكل 4B) في غرفة رطبة عند 15 درجة مئوية لمدة 72 ساعة (الشكل 4C).
- لهذه الدراسة، عملية كلا النسخ المتماثلة من الأنسجة الممزقة. احتضان نسخة متماثلة واحدة مع بولكلونل الأجسام المضادة خنزير غينيا التي أثيرت ضد الأحماض الأمينية 717-754 من الفأرة GluR1 مشتركة بين جميع مفارز أمبا-R (التخفيف: 1: 200) أو الأجسام المضادة الماوس وحيدة النسيلة التي أثيرت ضد بروتين الانصهار المؤتلف تغطية الأحماض الأمينية 660 - 811 من الوحيدات NR1 من NMDA-R (التخفيف: 1: 500)، والأجسام المضادة الأرنب بولكلونل أثيرت ضد هذا البروتين الفلوري الأخضر (التخفيف: 1: 300).
- احتضان النسخة المتماثلة الأخرى مع الأجسام المضادة الأرنب بولكلونل أثيرت ضد الببتيد الاصطناعية الموافق الأحماض الأمينية 384-398 من الفئران مستقبلات μ للمواد الأفيونية (التخفيف: 1: 500).
- يغسل في TBS مع 0.05٪ BSA (3 × 5 دقائق).
- تطبيق الأجسام المضادة الثانوية. لهذا ش الدراسة حد ذاته الذهب (5 نانومتر لionotropic مستقبلات الغلوتامات، مستقبلات 10 لμ-الأفيونية و / أو 15 نانومتر لChR2-YFP) مترافق الأضداد مخففة في TBS مع 2٪ BSA. تمييع الأجسام المضادة الثانوية 1:30 واحتضان إلى انخفاض 30 ميكرولتر في 15 ° CO / N.
- غسل 3 × 5 دقائق في 0.05٪ BSA-TBS في RT.
- غسل 2 × 5 دقائق في الماء عالى النقاء.
- جبل متماثلة على formvar المغلفة شريط مواز 100 خط شبكة (الشكل 4D).
6. تحليل طبق الاصل
- صورة المقلده مع المجهر الإلكتروني انتقال (تيم) في 80 أو 100 كيلو فولت. الحصول على صور رقمية من خلال (مشحونة جهاز جانب) وكاميرا CCD.
- حاليا، والعثور على المناطق المقابلة على الصور من كل من النسخ المتماثلة باستخدام المعالم (الشكل 4E). تحليل الصور الرقمية باستخدام صورة J. تحديد المنطقة بعد المشبكي وعدد من الجزيئات المسمى immunogold الموجهة ضد مستقبلات تحليلها.
الصفحة = "1"> 
الشكل 4. Immunolabeling من الاصل.
(أ) أدوات لمعالجة وغسل النسخ المتماثلة. والسيراميك لوحة ال 12 أيضا (أعلى اليمين) و 2 أنواع من ماصات زجاجية (أعلى اليسار). يتم استخدام ماصة الزجاج مع قمة الجولة (أسفل اليسار) لنقل طبق الأصل، ويتم استخدام ماصة مع قضيب البلاتين (مركز القاع) لتتكشف النسخ المتماثلة. نسخة طبق الأصل في غسل العازلة (أسفل اليمين). ويتم (ب) Immunolabeling من النسخ المتماثلة في قطرات (30 ميكرولتر) وضعت على قطعة صغيرة من بارافيلم في بئر لزراعة الأنسجة لوحة 6 جيدا. لاحظ أنه نسخة طبق الأصل تغطيها انخفاض الأجسام المضادة العازلة التي تحتوي على. لمنع التبخر، يتم تركيب قطعة مبللة من المناديل الورقية حول الحافة الداخلية من البئر. (C) حاضنة للخطوة immunolabeling. تتم حضانات بها في 15 درجة مئوية. (D) نسخة طبق الأصل التي شنت على 100- المغلفة formvarشريط خط مواز الشبكة. (E) منخفضة الميكروسكوب التكبير من زوج من النسخ المتماثلة. وتشير الساحات المنتشرة في ثلاثة معالم نموذجية لتحديد موقع في النسخ المتماثلة المقابلة. شريط الحجم: 10 ميكرون. وتظهر جميع البيانات كما يعني ± ووزارة شؤون المرأة الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
تقنية FRIL، عند دمجها مع التعبير عن المحركات علم البصريات الوراثي المنشأ الميكروبي 21، أي قنوات متكاملة في غشاء البلازما ونقلها anterogradely على طول محاور فعال، ويسمح لدراسة كميا التعبير بعد المشبكي من أمبا-R و NMDA روبية في مجموعة فرعية محددة من نقاط الاشتباك العصبي. ويظهر هذا هنا لالمحاور القادمة من نواة مهادي مميزة (على سبيل المثال، PIN / MGN) على الخلايا العصبية مركز التجارة الدولية في اللوزة. ويمكن هذا النهج تحليل الجزيئي من نقاط الاشتباك العصبي المدخلات الحسية الفردية على الخلايا العصبية مركز التجارة الدولية، وهي مجموعة من الخلايا التي كانت الحرارية إلى توصيف التشريحية والجزيئية تفصيلا حتى الآن.
بعد أربعة أسابيع حقن المجسم من rAAV-ChR2-YFP في PIN / MGN، محاور ChR2-YFP إيجابية معصب المكتظة في لوس انجليس، ومنطقة amygdalostriatal الانتقالية (ASTRIA) وسطي paracapsular أنا مجموعة TC في اللوزة، وجود نمط ثابت تماما مع تتبع الدراسات السابقة 16، 22، ونحن أيضا الكشف عن الذهب مكثفة immunolabeling لChR2-YFP على P وجه من المحاور والمحطات في تجميد كسر نسخة من rAAV-ChR2-YFP- حقن الفئران (الشكل 5A)، ولكن ليس في النسخ المتماثلة من الفئران غير المحقونة. التخصص الغشاء بعد المشبكي من نقاط الاشتباك العصبي glutamatergic في نسخة متماثلة ويمكن ملاحظة باعتبارها الكتلة الجسيمات intramembrane (العفاريت) على وجه E من غشاء البلازما 2، 23، وغالبا ما يرافقه ف وجه غشاء البلازما قبل المشبكي في 7 (الشكل 5B-C). هذه الميزات يسمح لتحديد التخصص بعد المشبكي من نقاط الاشتباك العصبي glutamatergic التي شكلتها محطات محوار PIN / MGN (الشكل 5 و 6). نحن المسمى أمبا روبية مع الأجسام المضادة التي تعترف جميع مفارز أربعة (GluA1-4)، في حين تم الكشف عن NMDA روبية استخدام أجسام مضادة ضد الوحيدات NR1 الأساسية.
ntent "FO: المحافظة على together.within الصفحات =" 1 "> نظرا لعدم وجود أدوات للكشف على نفس الاصل سواء قدمت هذه المشابك مع العمود الفقري شجيري أو أعمدة من الخلايا العصبية مركز التجارة الدولية، ونحن المسمى وجه نسخة المقابلة لμ مستقبلات -opioid، باسم الخلايا العصبية ITC تعبر عن مستويات عالية postsynaptically هذه المستقبلات 24، وهذا يتطلب تحديد ملامح بعد المشبكي نفسها في اثنين من النسخ المتماثلة (الشكل 5C-F والشكل 6A-D) باستخدام استراتيجية التي توظف المعالم (الشكل 4E) .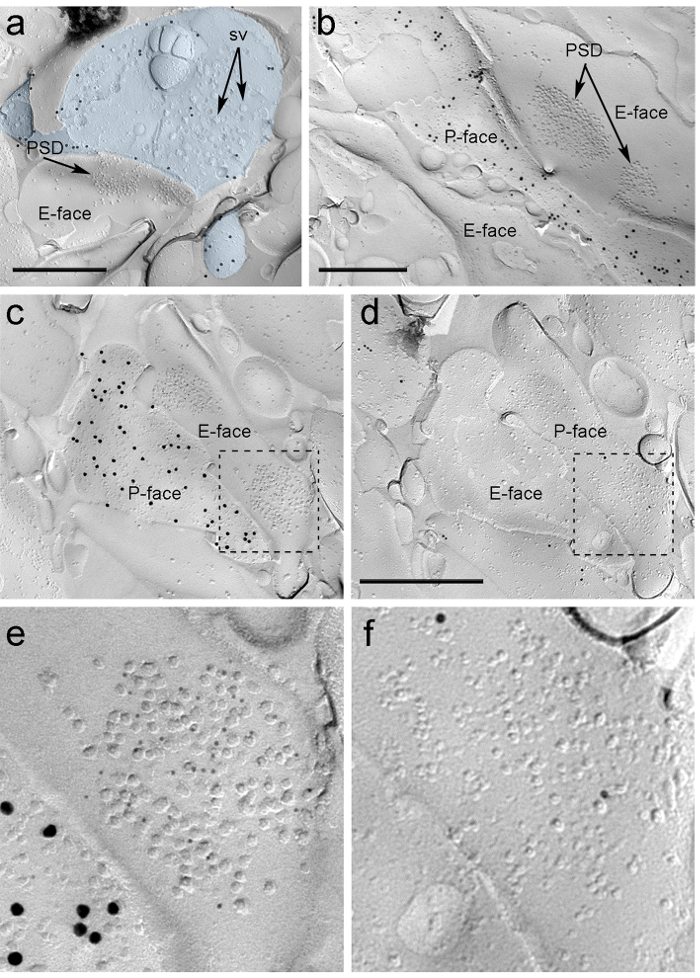
الرقم 5. الكشف عن ChR2-YFP وIonotropic جلوتاماتي المستقبلات على طبق من Immunogold الجسيمات. (A) ومحطة عبر بكسر محور عصبي (الضوء الأزرق) وأجزاء صغيرة من لP وجه وصفت مع 15 نانومتر جزيئات الذهب الكشف عن ChR2-YFP. داخل المحطة، وغشاء سو الحويصلات المشبكية عديدة يمكن ملاحظة (اس). ملاحظة خصوصية immunolabeling في جزء كبير يقتصر على غشاء البلازما. وضع العلامات لChR2 يحدد المحطة أنها ناشئة من رقم التعريف الشخصي / MGN. محطة يشكل المشبك غير المتماثلة مع العمود الفقري. التخصص الغشاء بعد المشبكي (PSD) على وجه E يظهر مجموعة مميزة من الجزيئات intramembrane وهو المسمى مع 5 نانومتر جزيئات الذهب الكشف عن أمبا روبية. يظهر (ب) ف مواجهة محور عصبي ChR2 معربا عن (المسمى مع 15 جزيئات الذهب نانومتر) على الحدود مع اثنين من التشعبات، واحد منهم امتلاك اثنين من عناصر أمنية المسمى مع 5 نانومتر جزيئات الذهب الكشف عن NMDA روبية. (CD) وجوه مقابل الأغشية قبل وبعد المشبكي من المشبك PIN / MGN ومركز التجارة الدولية. (ج) ف وجه محطة يعبر عن ChR2 (المسمى مع جزيئات الذهب 15 نانومتر)، ويمتد على وجه E اثنين من اعمدة الجذعية، واحدة منها تحتوي على اثنين من عناصر أمنية وصفت لأمبا روبية (5 الجسيمات نانومتر الذهب). ( D) والمقابلة ف وجه التشعبات اثنين من هو المسمى لمستقبلات μ-الأفيونية (10 الجسيمات نانومتر الذهب). (EF) وجهات النظر تضخم من المناطق التي حددتها الخطوط المتقطعة. أشرطة النطاق: 500 نانومتر الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
تم العثور على Immunoparticles لأمبا روبية في نقاط الاشتباك العصبي PIN / MGN ومركز التجارة الدولية في جميع أنحاء الكتلة IMP، مما يشير إلى توزيع متجانس ضمن التخصص بعد المشبكي (الشكل 5E). وأعلى بكثير (أونبايريد اختبار t ع <0.018) لوحظ كثافة أمبا-R وضع العلامات في PIN / MGN المشابك على العمود الفقري مركز التجارة الدولية (715 ± 38 جزيئات الذهب / ميكرون 2، ن = 32) مقابل نقاط الاشتباك العصبي على التشعبات مركز التجارة الدولية (590 ± 44 جزيئات الذهب / ميكرون 2، ن = 32). وعموما، أظهرت كثافة أمبا روبية في PIN نقاط الاشتباك العصبي / MGN-مركز التجارة الدولية منخفضة نسبياالتباين (معامل التباين، السيرة الذاتية = 0.37) بما يتفق مع توزيع متجانس.
وكثيرا ما نظرن توزيع Immunoparticles لNMDA روبية في نقاط الاشتباك العصبي PIN / MGN ومركز التجارة الدولية بشكل غير متساو ضمن مجموعات IMP بعد المشبكي (الشكل 5B). وكانت كثافة NMDA-R وضع العلامات المماثلة (أونبايريد اختبار t ع = 0.39) بين PIN / MGN المشابك على العمود الفقري مركز التجارة الدولية (1070 ± 153 جزيئات / ميكرون 2 ذهبية، ن = 8) والتشعبات مركز التجارة الدولية (812 ± 183 جزيئات الذهب / ميكرون 2، ن = 9). على عكس ما لوحظ لأمبا روبية، وكانت كثافة NMDA روبية في PIN نقاط الاشتباك العصبي / MGN ومركز التجارة الدولية شديدة التباين (CV = 0.54).

الشكل 6. أمبا-R و NMDA روبية Immunolabeling في حددت نقاط الاشتباك العصبي PIN / MGN ومركز التجارة الدولية.
(AB) وجوه مقابل الأغشية قبل وبعد المشبكي من PIN / MGN ومركز التجارة الدوليةالمشبك قدمت على العمود الفقري شجيري التي ف وجه من محطة يعبر عن ChR2 (المسمى مع 15 جزيئات الذهب نانومتر) ويسمى مديرية الأمن العام على العمود الفقري شجيري لأمبا روبية (5 الجسيمات نانومتر الذهب). (CD) وجهات النظر تضخم من المناطق التي حددها خط متقطع. تم تدوير هذه المناطق حوالي 45 درجة عكس اتجاه عقارب الساعة للسماح لرؤية أفضل من مديرية الأمن العام. (E) Scatterplots من عدد الجزيئات أمبا-R مقابل منطقة متشابك في العمود الفقري مركز التجارة الدولية والتشعبات. في كل الهياكل، وقد لوحظ وجود علاقة إيجابية. (F) Scatterplots من عدد الجزيئات NMDA-R ضد منطقة متشابك في العمود الفقري مركز التجارة الدولية والتشعبات. تم الكشف عن ارتباط إيجابي كبير فقط في العمود الفقري شجيري. أشرطة النطاق: 500 نانومتر الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
لانف وجه من غشاء البلازما قبل المشبكي في كثير من الأحيان مضافين في جزء الكتلة IMP بعد المشبكي، ونحن يمكن أن يقدر منطقة متشابك من 30٪ فقط من نقاط الاشتباك العصبي (العمود الفقري: تعني منطقة 0.032 ميكرون 2، ومجموعة: 0،007-0،063 ميكرون 2، ن = 8؛ التشعبات: 0.047 ميكرون 2، ومجموعة: 0،024-0،166 ميكرون 2، ن = 11). وكانت هذه في مجموعة مماثلة لنقاط الاشتباك العصبي التي سبق تحليلها glutamatergic الدماغ الانتهائي 25.
في كل من العمود الفقري والتشعبات، ارتبط عدد من immunoparticles الذهب لأمبا روبية في نقاط الاشتباك العصبي الفردية بإيجابية مع منطقة متشابك (سبيرمان، العمود الفقري: ص = 0.88، التشعبات: ص = 0.60، ف <0.0001) (الشكل 6E). على العكس من ذلك، تم العثور على عدد من immunoparticles الذهب لNMDA-R لربط مع منطقة متشابك في العمود الفقري (سبيرمان، العمود الفقري: ص = 0.90، ف <0.002) ولكن ليس في التشعبات (ص = 0.21، ع = 0.29) (الشكل 6F ).
Discussion
وقد تم تجميد كسر الإلكترون المجهري تقنية كبيرة في مجال البحوث التركيبية لأكثر من 40 عاما. ومع ذلك، فإن عدم وجود وسائل فعالة لدراسة التركيب الجزيئي للأغشية تنتج انخفاضا كبيرا في استخدامها. في الآونة الأخيرة، كان هناك انتعاش كبير في تجميد كسر المجهر الإلكتروني ويرجع ذلك إلى تطوير وسائل فعالة للكشف عن البروتينات الغشاء لا يتجزأ من immunogold وسم 1، 2، وهي تقنية FRIL.
تقنية FRIL تمتلك العديد من المزايا مقارنة مع الطرق التركيبية immunogold أخرى. أولا، بروتينات يمكن الوصول إليها بسهولة إلى أجسام زيادة حساسية. ثانيا، تعرض جزء كبير من التخصصات غشاء البلازما، مثل الغشاء بعد المشبكي، على سطح ثنائي الأبعاد النسخة المتماثلة يسمح التفتيش على التوزيع المكاني والتواصل الجسدي من جزيئات الفائدة دون إعادة الإعمار شاقة وتستغرق وقتا طويلا من سيريأقسام آل سامسونج. ثالثا، توفر كل شطر من غشاء البلازما يزيد من عدد من البروتينات التي يمكن أن توصف عن كل بنية الفرد، وقدم الأجسام المضادة المناسبة المتاحة. على كسر، وهي مغلفة وجه مسعور من الغشاء انقسام مع الكربون البلاتين أن يرسخ المجالات البروتين المتبقية على سطح كسر. وهذا ما يمنع وصول الأجسام المضادة لمستضدات في هذه المجالات. على سبيل المثال على P-وجه نسخة طبق الأصل فقط الحواتم التي تواجه الفضاء جبلي يمكن الكشف عنها بواسطة الأجسام المضادة، في حين على وجه E الحواتم فقط التي تواجه الفضاء exoplasmic يمكن أن تكون ملزمة من قبل الأجسام المضادة (انظر الشكل 2).
من ناحية أخرى، يعاني تقنية FRIL أيضا من بعض القيود 2. كما تحدث كسور بشكل عشوائي، فإنه قد يكون من الصعب على استهداف الخلايا أو هياكل محددة. وهذا يمكن أن يؤدي أيضا إلى وجود تحيز أخذ العينات، على سبيل المثال، في جمع المشبك، نظرا لاحتمال مختلفة من FRActuring على طول الغشاء هياكل مع انحناء مختلفة (على سبيل المثال، العمود الفقري مقابل مهاوي). وعلاوة على ذلك، وتخصيص بروتينات الغشاء إلى واحد من وجوه اثنين لا يمكن التنبؤ بها. ولذلك، فإن توزيع البروتين إلى P وجه أو وجه E، ولا سيما بالنسبة للدراسات الكمية، يجب أن يكون بعناية فحص باستخدام الأجسام المضادة رد الفعل إلى مجالات الخلايا وخارج الخلية. وأخيرا، وتحديد في النسخة المتماثلة من بعض الهياكل، مثل محطات محوار قبل المشبكي، يمكن أن يكون صعبا عندما تستند فقط على ملامح شكلية. ومع ذلك، فإن استخدام أجسام مضادة محددة للبروتينات علامة أو تنبيغ من بروتينات الغشاء لا يتجزأ الموسومة أو القنوات باستخدام ناقلات فيروسية العروض أدوات إضافية لتسهيل التعرف على الأغشية الممزقة. على سبيل المثال، أخذت هذه الدراسة الاستفادة من تنبيغ ChR2-YFP في الخلايا العصبية المهادية لتحديد efferents محور عصبي في اللوزة المخية أو وصفها لمستقبلات μ-الأفيونية لتكشف لي بعد المشبكيmbranes من الخلايا العصبية مركز التجارة الدولية.
من أجل أداء هذه التقنية FRIL بنجاح، يجب توخي الحذر خاصة فيما يتعلق تثبيت الأنسجة. تثبيت الأنسجة قوي (> 2٪ امتصاص العرق) يمكن أن يؤدي إلى ارتفاع معدل الاصابة بكسور عبر وانخفاض في حساسية وضع العلامات. من ناحية أخرى، تثبيتات ضعيفة تجعل التعامل مع الأنسجة وإعداد (على سبيل المثال، قطع أجزاء) صعبا. ومن المهم أيضا للسيطرة على أن سمك الكتل قلص يطابق سمك الشريط على الوجهين. إذا كان سمك العينة أقل من ذلك الشريط، قد أسطح الأنسجة لا نعلق على سطح حاملات معدنيين، وليس بكسر بالتالي العينة المجمدة. إذا كان النسيج هو أكثر سمكا، وسوف يتم ضغطها مع التشوهات الهيكلية التي لا مفر منها عندما يتم شطيرة من شركات الطيران النحاس اثنين. درجة الحرارة التي يتم تقسيم العينة (في هذا البروتوكول، -115 درجة مئوية) يلعب أيضا دورا هاماعلى بنية متماثلة. ارتفاع درجات الحرارة قد تؤدي إلى ارتفاع معدل القطع الأثرية مثل تكاثف بخار الماء على سطح الأنسجة قبل أو أثناء عملية التبخير. درجات حرارة منخفضة (<-125 درجة مئوية) قد تزيد من خطر تقسيم الخروج من المواد خلال كسر. هذه المواد قد تقع على سطح العينة أو البقاء على اتصال به. هذه رقائق من المواد هي أيضا المغلفة وتتناقض إنتاج البقع الداكنة على الصورة. يمكن كسر في درجات حرارة منخفضة أيضا تؤثر على وتيرة من كسور عبر وخاصة لهياكل غرامة صغيرة مثل العمود الفقري شجيري. خطوة مهمة أخرى في إعداد النماذج المقلدة هي المنظفات الهضم. إذا كان الهضم غير مكتمل، تظهر الأنسجة غير المهضومة بقع غامقة على النسخة المتماثلة وهو يفند تحليل هيكل في تيم. وعلاوة على ذلك، يمكن للأنسجة غير مهضوم غير تحديدا فخ أو ربط الأجسام المضادة، مما يزيد من العلامات الخلفية. من ناحية أخرى، واستخدام المنظفاتالصورة للهضم الأنسجة يمكن أن تفسد الجزيئات المرتبطة النسخة المتماثلة تغيير هياكلها الثانوية والثالثية. لذلك، بالنسبة لبعض المضادات قد يكون من الضروري لتخفيف تدريجيا تركيز SDS مع خطوات الغسيل إضافية.
لimmunolabeling، وتوافر أحجام مختلفة من جسيمات الذهب مترافق الأجسام المضادة الثانوية يسمح للكشف في نفس الوقت، ولكن فقط نوعيا، بروتينات متعددة، حتى في microdomains محددة من غشاء البلازما، مثل التخصص بعد المشبكي. ولكن نظرا لعائق الفراغية، الدراسات الكمية وتقتصر عادة على الكشف عن جزيء واحد فقط. حجم الجسيمات الذهب يمكن أن تؤثر أيضا على وضع العلامات فعالية.
لتفسير وصفها في FRIL، ينبغي أن يوضع في الاعتبار أن الجسيمات immunogold يمكن أن يكون موجودا في أي مكان داخل نصف الكرة الأرضية مع دائرة نصف قطرها 20-25 نانومتر من المستضد نتيجة لشكل معقد مرنةإد بواسطة الأجسام المضادة الأولية والثانوية 26. لمزيد من المعلومات حول نظرية وممارسة FRIL والتقنيات ذات الصلة، نشير للقارئ أيضا على المواد المنهجية الأخرى 27، 28.
وقد استخدمت هذه التقنية FRIL مؤخرا عن التحليلات الكمية عالية الدقة للتوطين مستقبلات الغلوتامات في السكان المشبك متنوعة 29، 30. وعلاوة على ذلك، قدرت حساسية الكشف عن تقنية FRIL لأمبا روبية تصل إلى الجسيمات immunogold واحد لكل أمبا وظيفي واحد قناة -R 29. وبالتالي، فإن هذا النهج هو عموما مفيد جدا لقياس وتحليل نمط التعبير بعد المشبكي من أمبا-R و NMDA روبية في نقاط الاشتباك العصبي المركزي. هنا، أثبتنا إمكانية تطبيقه في نقاط الاشتباك العصبي PIN / MGN ومركز التجارة الدولية، وهو موقع أهم المرجح لنقل المعلومات الولايات المتحدة خلال تكييف الخوف. باستخدام الأجسام المضادة التي أثيرت ضد بقايا الأحماض الأمينية الخلية الحفظ جدا من مفارز أمبا مستقبلات حمض الغلوتاميكA1-GluA4، وجدنا حتى توزيع جزيئات الذهب ضمن مجموعات IMP الموافق التخصصات الغشاء بعد المشبكي. وكانت كثافة أمبا روبية في العمود الفقري المركز أعلى بكثير بالمقارنة مع نقاط الاشتباك العصبي رمح مستهدفة من قبل PIN / MGN afferents المهادية. في كل من العمود الفقري ورمح نقاط الاشتباك العصبي، تم الكشف عن وجود علاقة إيجابية بين وضع العلامات لأمبا-R و المنطقة بعد المشبكي، وهي سمة مشتركة لنقاط الاشتباك العصبي glutamatergic أخرى 25. التباين المنخفض في كثافة أمبا روبية في نقاط الاشتباك العصبي PIN / MGN ومركز التجارة الدولية يشير إلى توزيع متجانس مماثلة لنقاط الاشتباك العصبي الأخرى التي شكلتها efferents مهادي 7، ولكنها مختلفة من نقاط الاشتباك العصبي القشرية 25. على العكس من ذلك، كانت كثافة NMDA روبية أكثر تنوعا ولم تختلف بين العمود الفقري ورمح نقاط الاشتباك العصبي مما يشير إلى تنظيم مختلفة من أمبا روبية. في المستقبل، فإن استنساخ عالية من التقنية FRIL لا تسمح فقط لتقييم التركيب الجزيئي القاعدية من نقاط الاشتباك العصبي المركزي ولكن قد يسهل الكشف عن جhanges في أعداد مستقبلات الغلوتامات ionotropic والتوزيع تحت المشبك بعد التعلم الخوف، واستكمال التسجيلات السابقين فيفو من خصائص قبل وبعد المشبكي هذه المدخلات.
وفي الختام، فإن هذا النهج يمكن أن تستخدم من قبل باحثين آخرين للحصول على نظرة ثاقبة العلاقات هيكل وظيفة من نقاط الاشتباك العصبي مثير المدخلات المحددة في العديد من الدوائر العصبية الأخرى التي عملت على تفكيك أصل المدخلات وطبيعة وتكوين العناصر بعد المشبكي أمر بالغ الأهمية ولكن مشكلة .
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
Funding was provided by the Austrian Science Fund FWF grant No. P-22969-B11 to F. Ferraguti, and by the Charitable Hertie Foundation and the Werner Reichardt Centre for Integrative Neuroscience and by the DFG (CIN-Exc. 307) to I. Ehrlich.
Materials
| Name | Company | Catalog Number | Comments |
| Surgery | |||
| Stereotactic frame | Stoelting, USA | 51670 | can be replaced by other stereotactic frame for mice |
| Steretoxic frame mouse adaptor | Stoelting, USA | 51625 | |
| Gas anesthesia mask for mice | Stoelting, USA | 50264 | no longer available, replaced by item no. 51609M |
| Pressure injection device, Toohey Spritzer | Toohey Company, USA | T25-2-900 | other pressure injection devices (e.g. Picospritzer) can be used |
| Kwik Fill glass capillaries | World Precision Instruments, Germany | 1B150F-4 | |
| Anesthesia machine, IsoFlo | Eickemeyer, Germany | 213261 | |
| DC Temperature Controler and heating pad | FHC, USA | 40-90-8D | |
| Horizontal Micropipette Puller Model P-1000 | Sutter Instruments, USA | P-1000 | |
| Surgical tool sterilizer, Sterilizator 75 | Melag, Germany | 08754200 | |
| rAAV-hSyn-ChR2(H134R)-eYFP (serotype 2/9) | Penn Vector Core, USA | AV-9-26973P | |
| fast green | Roth, Germany | 0301.1 | |
| Isoflurane Anesthetic, Isofuran CP (1ml/ml) | CP Pharma, Germany | ||
| Antiseptic, Betadine (providone-iodine) | Purdure Products, USA | BSOL32 | can be replaced by other disinfectants |
| Analgesic, Metacam Solution (5mg/ml meloxicam) | Boehringer Ingelheim, Germany | can be replaced by other analgesics | |
| Bepanthen eye ointment | Bayer, Germany | 0191 | can be replaced by other eye ointments |
| Drill NM3000 (SNKG1341 and SNIH1681) | Nouvag, Switzerland | ||
| Sutranox Suture Needle | Fine Science Tools, Germany | 12050-01 | |
| Braided Silk Suture | Fine Science Tools, Germany | 18020-60 | |
| Name | Company | Catalog Number | Comments |
| Tissue preparation | |||
| Paraformaldehyde EM grade | Agar Scientific Ltd., United Kingdom | AGR1018 | |
| Saturated picric acid solution | Sigma-Aldrich, USA | P6744-1GA | |
| Na2HPO4-2H20 | Merck Millipore, Germany | 1065860500 | |
| NaH2PO4-2H2O | Merck Millipore, Germany | 1063451000 | |
| NaCl | Merck Millipore, Germany | 1064041000 | |
| 4N NaOH | Carl Roth, Germany | T198.1 | |
| Thiopental | Sandoz, Austria | 5,133 | |
| Glycerol | Sigma-Aldrich, USA | G5516-500ML | |
| GenPure ultrapure water system | Thermo Fisher Scientific, USA | 50131235 | |
| Peristaltic pump | ISMATEC, Germany | ISM 930C | |
| Filter Paper | MACHEREY-NAGEL, Germany | MN 615 1/4 | |
| Vibroslicer, VT1000S | Leica Microsystems, Austria | ||
| Ophthalmic scalpel | Alcon Laboratories, USA | can be replaced by other ophthalmic scalpels | |
| Perfusion cannula | Vieweg, Germany | F560088-1 | can be replaced by similar items from other companies |
| Name | Company | Catalog Number | Comments |
| High-pressure Freezing | |||
| Copper carriers | Engineering Office M. Wohlwend, CH | 528 | |
| Sidol Polish | Henkel, Germany | can be replaced by same item from other companies | |
| Chamois skin | Household supply store | ||
| Hole punch, 1,5mm | Stubai, Austria | can be replaced by same item from other companies | |
| Denatured ethanol | Donauchem, Austria | can be replaced by same item from other companies | |
| Aceton | Roth, Germany | 9372.5 | CAUTION! |
| High Pressure Freezing Machine HPM 010 | BalTec, CH; now Leica Microsystems | HPM010 | not produced any more, substituted by LeicaEM HPM100 |
| Stereo-microscope | Olympus, Japan | SZX10 | |
| Liquid nitrogen | CAUTION! | ||
| Cryo-vials | Roth, Germany | E309.1 | can be replaced by same item from other companies |
| CryoCane | Nalge Nunc International,USA | 5015-0001 | can be replaced by same item from other companies |
| CryoSleeve | Nalge Nunc International,USA | 5016-0001 | can be replaced by same item from other companies |
| Liquid nitrogen storage vessel | Cryopal, France | GT38 | can be replaced by same item from other companies |
| Non-ionic detergent (Lavocid) | Werner & Mertz Professional, Germany | ||
| Name | Company | Catalog Number | Comments |
| Freeze-fracture and Replication | |||
| Sandblaster, Mikromat 200-1 | JOKE Joisten & Kettenbaum, Germany | SANDURET 2-K | can be replaced by same item from other companies |
| Siliciumcarbid SIC 360, grain size 25 - 21µ | JOKE Joisten & Kettenbaum, Germany | 955932 | |
| Freeze Fracture System BAF 060 | BalTec, CH; now Leica Microsystems | BAF060 | |
| Ceramic 12 well plate | Gröpel, Austria | 14511 | can be replaced by same item from other companies |
| Trizma base | SIGMA, USA | T1503 | can be replaced by same item from other companies |
| Trizma hydrochloride | SIGMA, USA | T3253 | can be replaced by same item from other companies |
| Sodium chloride | Merck, Germany | 1,064,041,000 | can be replaced by same item from other companies |
| SDS, Sodium lauryl sulfate | Roth, Germany | 5136.1 | CAUTION! ; can be replaced by same item from other companies |
| Sucrose | Merck, Germany | 1,076,871,000 | can be replaced by same item from other companies |
| TRIS | Roth, Germany | 5429.3 | can be replaced by same item from other companies |
| Universal Hybridization Oven | Binder, Germany | 7001-0050 | can be replaced by same item from other companies |
| Name | Company | Catalog Number | Comments |
| Immunolabelling | |||
| BSA | SIGMA, USA | A9647 | can be replaced by same item from other companies |
| Anti-GFP Antibody | Molecular Probes, USA | A11122 | |
| Anti-pan-AMPAR Antibody | Frontier Institute, Japan | pan AMPAR-GP-Af580-1 | |
| Anti-NMDAR1 Antibody, clone 54.1 | Merck Millipore, Germany | MAB363 | |
| Opioid Receptor-Mu (MOR) Antibody | ImmunoStar, USA | 24216 | |
| EM goat anti-guinea pig, 5nm; secondary antibody | BBInternational, | EM.GAG5 | |
| EM goat anti-rabbit, 15nm; secondary antibody | BBInternational, | EM.GAR15 | |
| Donkey anti-rabbit, 10nm, secondary antibody | AURION, Netherlands | DAR 10nm | |
| Copper grids, 100 Parallel Bar | Agar scientific, UK | G2012C | |
| Incubator | Major Science, USA | MO-RC | can be replaced by same item from other companies |
| Pioloform Powder | Agar scientific, UK | R1275 | |
| Chloroform | Roth, Germany | 3313.1 | CAUTION! ; can be replaced by same item from other companies |
| Name | Company | Catalog Number | Comments |
| EM analysis | |||
| Philips CM120 TEM | Philips/FEI | ||
| Morada CCD camera | Soft Imaging Systems, Germany | ||
| iTEM Ver. 5.2, imaging software | Soft Imaging Systems, Germany | ||
References
- Fujimoto, K. SDS-digested freeze-fracture replica labeling electron microscopy to study the two-dimensional distribution of integral membrane proteins and phospholipids in biomembranes: practical procedure, interpretation and application. Histochem Cell Biol. 107 (2), 87-96 (1997).
- Masugi-Tokita, M., Shigemoto, R. High-resolution quantitative visualization of glutamate and GABA receptors at central synapses. Curr Opin Neurobiol. 17 (3), 387-393 (2007).
- Rash, J. E., Yasumura, T. Direct immunogold labeling of connexins and aquaporin-4 in freeze-fracture replicas of liver, brain, and spinal cord: factors limiting quantitative analysis. Cell Tissue Res. 296 (2), 307-321 (1999).
- Emes, R. D., Grant, S. G. Evolution of synapse complexity and diversity. Annu Rev Neurosci. 35, 111-131 (2012).
- Matsuzaki, M., et al. Dendritic spine geometry is critical for AMPA receptor expression in hippocampal CA1 pyramidal neurons. Nat Neurosci. 4 (11), 1086-1092 (2001).
- Rollenhagen, A., Lübke, J. H. The morphology of excitatory central synapses: from structure to function. Cell Tissue Res. 326 (2), 221-237 (2006).
- Tarusawa, E., et al. Input-specific intrasynaptic arrangements of ionotropic glutamate receptors and their impact on postsynaptic responses. J Neurosci. 29 (41), 12896-12908 (2009).
- Nusser, Z., et al. Cell type and pathway dependence of synaptic AMPA receptor number and variability in the hippocampus. Neuron. 21 (3), 545-559 (1998).
- Nyìri, G., Stephenson, F. A., Freund, T. F., Somogyi, P. Large variability in synaptic N-methyl-D-aspartate receptor density on interneurons and a comparison with pyramidal-cell spines in the rat hippocampus. Neuroscience. 119 (2), 347-363 (2003).
- Nicholson, D. A., Geinisman, Y. Axospinous synaptic subtype-specific differences in structure, size, ionotropic receptor expression, and connectivity in apical dendritic regions of rat hippocampal CA1 pyramidal neurons. J Comp Neurol. 512 (3), 399-418 (2009).
- Millhouse, O. E. The intercalated cells of the amygdala. J Comp Neurol. 247 (2), 246-271 (1986).
- Busti, D., et al. Different fear states engage distinct networks within the intercalated cell clusters of the amygdala. J Neurosci. 31 (13), 5131-5144 (2011).
- Amano, T., Unal, C. T., Paré, D. Synaptic correlates of fear extinction in the amygdala. Nat Neurosci. 13 (4), 489-494 (2010).
- Duvarci, S., Pare, D. Amygdala microcircuits controlling learned fear. Neuron. 82 (5), 966-980 (2014).
- Jüngling, K., et al. Neuropeptide S-mediated control of fear expression and extinction: role of intercalated GABAergic neurons in the amygdala. Neuron. 59 (2), 298-310 (2008).
- Asede, D., Bosch, D., Lüthi, A., Ferraguti, F., Ehrlich, I. Sensory inputs to intercalated cells provide fear-learning modulated inhibition to the basolateral amygdala. Neuron. 86 (2), 541-554 (2015).
- Maren, S. Neurobiology of Pavlovian fear conditioning. Annu Rev Neurosci. 24, 897-931 (2001).
- Pape, H. C., Pare, D. Plastic synaptic networks of the amygdala for the acquisition, expression, and extinction of conditioned fear. Physiol Rev. 90 (2), 419-463 (2010).
- Sigurdsson, T., et al. Long-term potentiation in the amygdala: a cellular mechanism of fear learning and memory. Neuropharmacology. 52 (1), 215-227 (2007).
- Bosch, D., Asede, D., Ehrlich, I. Ex-vivo optogenetic dissection of fear circuits in brain slices. J. Vis. Exp. (110), e53628 (2016).
- Fenno, L., Yizhar, O., Deisseroth, K. The development and application of optogenetics. Annu Rev Neurosci. 34, 389-412 (2011).
- Bienvenu, T. C. M., et al. Large intercalated neurons of amygdala relay noxious sensory information. J. Neurosci. 35 (5), 2044-2057 (2015).
- Sandri, C., Akert, K., Livingston, R. B., Moor, H. Particle aggregations at specialized sites in freeze-etched postsynaptic membranes. Brain Res. 41 (1), 1-16 (1972).
- Likhtik, E., Popa, D., Apergis-Schoute, J., Fidacaro, G. A., Paré, D. Amygdala intercalated neurons are required for expression of fear extinction. Nature. 454 (7204), 642-645 (2008).
- Fukazawa, Y., Shigemoto, R. Intra-synapse-type and inter-synapse-type relationships between synaptic size and AMPAR expression. Curr Opin Neurobiol. 22 (3), 446-452 (2012).
- Amiry-Moghaddam, M., Ottersen, O. P. Immunogold cytochemistry in neuroscience. Nat Neurosci. 16 (7), 798-804 (2013).
- Fukazawa, Y., Masugi-Tokita, M., Tarusawa, E., Hagiwara, A., Shigemoto, R., Cavalier, A., et al. SDS-digested Freeze-fracture replica labelling (SDS-FRL). Handbook of Cryo-Preparation Methods for Electron Microscopy. , 567-586 (2007).
- Severs, N. J. Freeze-fracture electron microscopy. Nat Protoc. 2 (3), 547-576 (2007).
- Tanaka, J., et al. Number and density of AMPA receptors in single synapses in immature cerebellum. J Neurosci. 25 (4), 799-807 (2005).
- Mansouri, M., et al. Distinct subsynaptic localization of type 1 metabotropic glutamate receptors at glutamatergic and GABAergic synapses in the rodent cerebellar cortex. Eur J Neurosci. 41 (2), 157-167 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved