Method Article
Combinados Optogenética y congelación-fractura Réplica Immunolabeling para Analizar Arreglo-entrada específica de glutamato receptores en el ratón amígdala
En este artículo
Resumen
This article illustrates how the expression of neurotransmitter receptors can be quantified and the pattern analyzed at synapses with identified pre and postsynaptic elements using a combination of viral transduction of optogenetic tools and the freeze-fracture replica immunolabeling technique.
Resumen
microscopía electrónica de congelación-fractura ha sido una técnica importante en la investigación ultraestructural por más de 40 años. Sin embargo, la falta de medios eficaces para estudiar la composición molecular de las membranas produjo una disminución significativa en su uso. Recientemente, ha habido un renacimiento importante en congelación-fractura de microscopía electrónica gracias al desarrollo de medios eficaces para revelar las proteínas integrales de membrana, mediante el etiquetado inmunoelectrónica. Uno de estos métodos es conocido como detergente solubilizadas Freeze-fractura Replica Immunolabeling (FRIL).
La combinación de la técnica de FRIL con optogenética permite un análisis de correlación de las propiedades estructurales y funcionales de las sinapsis centrales. Con este enfoque es posible identificar y caracterizar las neuronas tanto pre- y postsinápticos por su respectiva expresión de un canalrodopsina etiquetado y marcadores moleculares específicos. El aspecto distintivo de la especialización de la membrana postsináptica glutamatérgico sinapsis permite además, al etiquetado de los receptores de glutamato ionotrópicos, para cuantificar y analizar la distribución intrasynaptic de estos receptores. A continuación, se da una descripción paso a paso de los procedimientos necesarios para preparar réplicas pareadas y cómo inmunomarcador ellos. También discutiremos las salvedades y limitaciones de la técnica FRIL, en particular los relacionados con los posibles sesgos de muestreo. La alta reproducibilidad y la versatilidad de la técnica FRIL, cuando se combina con la optogenética, ofrece un enfoque muy importante en la caracterización de los diferentes aspectos de la transmisión sináptica en microcircuitos neuronales identificados en el cerebro.
Aquí, proporcionamos un ejemplo de cómo se utilizó este método para obtener información sobre las relaciones estructura-función de las sinapsis excitadoras en las neuronas de las masas de células intercalares de la amígdala ratón. En particular, hemos investigado la expresión de los receptores de glutamato ionotrópicos en las entradas identificadas oiginated del intralaminar posterior del tálamo y el núcleo geniculado medial. Estas sinapsis, se mostró a transmitir información sensorial relevante para el aprendizaje y el miedo a sufrir cambios de plástico sobre el condicionamiento del miedo.
Introducción
La definición de la arquitectura funcional de biomembranas en escala nanométrica se ha cuestionado en los últimos años por el desarrollo de una serie de técnicas immunolabeling adecuadas para microscopía electrónica de transmisión. Sin embargo, estas técnicas, por ejemplo, antes y después de la incorporación de inmunoelectrónica, tienen una serie de limitaciones importantes, que incluyen la mala detección de antígenos y / o evaluación cuantitativa limitado de proteínas unidas a membrana. Estas limitaciones se hacen particularmente crítico en la investigación de la estructura fina del sistema nervioso, que se caracteriza por un alto grado de diversidad de células y la heterogeneidad sinapsis. Esta heterogeneidad resultados de la diversidad estructural y funcional dictada por los elementos pre y postsinápticos y por la expresión diferencial, el enriquecimiento, o la interacción de las proteínas de señalización, tales como receptores, transportadores, y las moléculas efectoras.
Un nuevo enfoque para immunolabe directaling de las proteínas integrales de membrana o reticulados en réplicas de congelación-fractura solubilizada con detergente (FRIL) fue introducido originalmente por Fujimoto hace dos décadas 1. Este método original tenía, sin embargo, varias limitaciones, es decir, la fragmentación severa de réplicas, lo cual obstaculizó correlaciones significativas de moléculas marcadas con células organizadas en tejidos complejos de forma individual, como el cerebro. Hace aproximadamente 10 años, y Shigemoto Fukazawa mejora progresiva de la técnica 2. Esto fue acompañado de esfuerzos por parte de otro grupo de científicos de los laboratorios de Boulder de la Universidad del Estado de Colorado, que también mejoraron significativamente la técnica, en particular, para el estudio de las uniones comunicantes 3.
La mejora en los protocolos de congelación-fractura y máquinas, así como la introducción de congelación rápida (a alta presión), ahora permite a los investigadores para producir réplicas ininterrumpida de especímenes de tamaño relativamente grande y high imágenes de calidad de la mayoría de los componentes celulares sin las limitaciones y artefactos producidos por fuertes fijaciones químicas.
La técnica FRIL ofrece la gran ventaja de un altamente cuantitativo en la identificación in situ de una o más proteínas (simultáneamente) en histológicamente asignada y células citológicamente identificados dentro de los tejidos complejos tales como el cerebro, con la ventaja adicional de una vista en planta de pre- y postsináptica elementos en una única réplica. Por lo tanto, la técnica de FRIL, a pesar de sus numerosos obstáculos técnicos, mantiene la promesa para un número de avances científicos muy importantes, en particular para la correlación de las propiedades estructurales y funcionales de las sinapsis individuales. Durante las últimas décadas, una gran cantidad de información que se haya obtenido sobre la estructura, composición molecular, y la función fisiológica de las sinapsis; sin embargo, las sinapsis son morfológica y molecularmente muy diversas dependiendo del pa pre y post-sinápticaalquiler neuronas 4. Sólo un puñado de tipos de sinapsis fueron los estudios de estructura-función logrado hasta ahora 5-7. Esto fue principalmente debido a limitaciones técnicas que impedían una identificación precisa de la naturaleza de los elementos pre y postsinápticos.
El análisis ultraestructural ha proporcionado una perspectiva crítica en la variabilidad de las especializaciones de la membrana postsináptica a través de los contactos sinápticos distintas, tanto en términos de tamaño y contenido sináptica en receptores de neurotransmisores 6, que tiene un gran impacto en la fuerza y la plasticidad de la transmisión sináptica. Por otra parte, una gran cantidad de investigaciones indica que el número de receptores de glutamato ionotrópicos expresadas en diferentes tipos de sinapsis se regula de una manera afferent- y dependiente de la diana 7-10.
Aquí, un método se describe que permite el análisis de la estructura y composición del receptor especializaciones de membrana postsinápticos con definird elementos presinápticos y función. Este enfoque se aprovecha de expresión presináptica de luz proteínas de algas sensibles recientemente desarrollados, como channelrhodopsin2 (ChR2), y de la técnica de FRIL para analizar el patrón de expresión postsináptica de α-amino-3-hidroxi-5-metil-4-isoxazolpropiónico ácido (AMPA-R) y N-metil-D-aspartato (NMDA-R) receptores de glutamato. Esto se demuestra en las sinapsis formadas por los axones procedentes de los núcleos del tálamo-geniculado medial posterior (PIN / MGN) en las neuronas de las masas de células intercalares de la amígdala (ITC). Neuronas ITC son pequeñas células GABAérgicas espinosas organizados en grupos que rodean el complejo amigdalino basolateral (BLA) 11, 12. Neuronas ITC son conocidos para recibir entradas excitadoras desde BLA neuronas principales y para apuntar el núcleo central (CEA), lo que funciona como una puerta inhibidora para el flujo de información entre el BLA y CEA 12-15.
Recientemente, hemos demostrado que las TIC neuronas ubicadas en el clúster medio-dorsal entre BLA y CEA también reciben entradas excitadoras directos y convergentes de las regiones corticales del tálamo y temporales sensoriales, que se modifican en el miedo pavloviano aprendizaje durante el condicionamiento del miedo auditivo 16. El condicionamiento del miedo es una de las formas más entendidos de aprendizaje asociativo en términos de los mecanismos del cerebro. En el condicionamiento del miedo, un estímulo condicionado inicialmente neutro (CS, por ejemplo, un tono) está emparejado con un estímulo aversivo incondicionado (EI, por ejemplo, un choque ligero en los pies), resultando en una asociación EC-EI y condicionado respuesta de miedo 17, 18. Excitatorios aportaciones de ambas áreas del tálamo y neocorticales, que transportan información que representa el CS y Estados Unidos, respectivamente, se sabe que convergen en las neuronas piramidales del núcleo lateral de la amígdala (lA) y se someten a la plasticidad 19. Nuestro trabajo anterior reveló que la información de entrada sensorial es también retransmitida en paralelo a las neuronas ITC 16.
Como un primer paso hacia un análisis molecular mecanicista de la entrada sensorial individuo sinapsis en las neuronas del ITC, se utilizó un virus adeno-asociado (AAV) para expresar ChR2 etiquetado con la proteína fluorescente amarilla (YFP). El AAV se inyectó en el PIN / MGn y los terminales de los axones se identificaron por su expresión de ChR2-YFP. Utilizamos ambas caras generadas por la técnica FRIL para evaluar la densidad postsináptica de AMPA y NMDA-R-R en las sinapsis formadas con ITC neuronas por terminales de los axones PIN / MGN.
Protocolo
Los procedimientos que implican sujetos animales han sido aprobados por la Regierungspraesidium Tubinga, Estado de Baden-Württemberg, Alemania, y por el Consejo de Ética de Experimentación Animal de Austria, y estaban de acuerdo con la directiva de la UE sobre el uso de animales en la investigación.
1. estereotáctica Las inyecciones de AAV-Channelrhodopsin2-YFP
NOTA: inyecciones estereotácticas se llevaron a cabo de acuerdo con un protocolo previamente publicado 20.
- Preparar herramientas estériles por calentamiento a 180 ° C durante 1,5 horas.
- Tire afilados pipetas de vidrio (~ 50 m de diámetro) para inyecciones utilizando un extractor de microelectrodo horizontal conjunto con los siguientes parámetros: Heat = valor Ramp - 20, Pull = 0, velocidad = 100, Tiempo = 200, Presión = 200.
NOTA: valor de rampa tiene que ser determinada para cada lote de pipetas de vidrio adquiridos de acuerdo con las instrucciones proporcionadas por el fabricante micropipeta extractor. - Premezcla 1 l de solución de virus y 0,2 l de solución de verde rápido 0,1% (para una mejor visibilidad de la solución en la pipeta de vidrio) en solución salina de tampón fosfato estéril (PBS; 25 mM, 0,9% de NaCl, pH 7,4). Llenar la pipeta de vidrio usando una pipeta de 10 l y el gel-fil consejos. Para el constructo viral, usar rAAV-hsyn-ChR2 (H134R) -eYFP (serotipo 2/9).
- Anestesiar ratón usando un pequeño aparato de anestesia para animales (3% isoflurano en oxígeno para la inducción). Utilizar. Para este estudio, utilice 3 ratones de tipo salvaje de entre unas 6 semanas.
- Afeitarse la cabeza entre las orejas y los ojos y desinfectar con una solución a base de povidona yodada.
- Aplique un ungüento para los ojos para evitar el secado de los ojos durante la anestesia. Por vía subcutánea inyectar ratón con analgésicos (basado en meloxicam, 0,1 ml de una solución de 5 mg / ml).
- Coloque el ratón en el marco estereotáxico y mantener la anestesia a través de un aparato de anestesia de gas (2% de isoflurano en oxígeno para el mantenimiento). Comprobar la profundidad de anestesia por la falta de una retirada del miembroreflejo antes de continuar.
- Mantener condiciones estériles lo mejor posible durante todo el procedimiento quirúrgico. Use una mascarilla desechable, una bata quirúrgica y guantes.
- Hacer una incisión en la piel de aproximadamente 1 cm en la parte superior de la cabeza con unas tijeras 20. Tire con cuidado de la piel a un lado el uso de fórceps romos, fijar con abrazaderas para exponer la superficie del cráneo y el cráneo limpio con H 2 O 2.
- Marcar los puntos de inyección en el cráneo utilizando un marcador permanente de punta fina. Perforar un agujero pequeño (aproximadamente 1 mm de diámetro) en el cráneo en el lugar marcado. Para la inyección unilateral PIN / MGn en esta ganadería, utilice las siguientes coordenadas: desde el bregma (mm): 3.0 posterior, lateral ± 1,8, 3,8 ventral.
- Monte llena pipeta de vidrio sobre el marco estereotáctico conectado a un dispositivo de inyección a presión y llevar la pipeta a la posición bregma.
- Rompa la punta de la pipeta de vidrio usando pinzas finas punta recta. Asegúrese de que la punta de la pipeta está abierto por aplga pulsos pocos de presión y la observación de extrusión de gotas de solución de virus.
- Ir a las coordenadas deseadas de inyección e inyectar la mitad del contenido de la pipeta (~ 0,5 l) usando los siguientes ajustes en el dispositivo de inyección de presión: presión de 20 psi, la longitud de pulso promedio de 30 ms, número medio de pulsos 50.
- Deja pipeta en el lugar durante ~ 1 min antes lentamente (1 mm / min) retraer él.
- cráneo limpia con PBS (pH 7,4) y retirar las abrazaderas. tire suavemente la piel, y suturar la incisión (3 - 4 nudos). Aplicar desinfectante (povidona yodada base) alrededor de la herida.
- Detener la anestesia y no dejar desatendido el ratón hasta que esté completamente despierto. Mantener los ratones alojados individualmente. Después de la operación, seguirá de cerca el estado de salud; si es necesario administrar analgésico.
- Mantenga a los animales durante 4 semanas antes de la fijación del cerebro para asegurar niveles adecuados de expresión viral.
2. Preparación de las muestras
- La fijación del cerebro </ Strong>
- Preparación del fijador
- Para 1 litro de fijador, pesar 10 g de paraformaldehído y añadirlo a 300 ml de H2O desionizada Calentar a 55 - 60 ºC durante ~ 10 min con agitación continua.
- Apagar el fuego y añadir 7 - 8 gotas de NaOH 4N. La solución debería quedar claro en ~ 10 min.
- Dejar enfriar a temperatura ambiente, añadir 150 ml de una solución saturada de ácido pícrico y llevarlo a 500 ml con H2O desionizada
- Añadir 500 ml de tampón fosfato 0,2 M (PB). Filtro con papel de filtro. Ajustar el pH a 7,4 con NaOH.
- Se enfría el fijador a 6 ºC, almacenarlo en botellas de vidrio oscuro por no más de un día a 6 ºC.
- perfusión transcardiaca
- Anestesiar los ratones con una inyección intraperitoneal de (peso 120 mg / kg de peso corporal) tiopental. Asegúrese de que el animal se anestesió profundamente marcando la refl retirada del pedalex, que debe estar ausente. Colocar el animal sobre su espalda en una mesa de perfusión con las cuatro extremidades atadas.
- Abra la pared abdominal longitudinalmente con unas tijeras de punta roma y hacer dos recortes adicionales lateralmente a lo largo del borde caudal de la caja torácica, para exponer el diafragma. Cortar el diafragma y cortar la pared torácica en la frontera osteocartilageneous en ambos lados. Levantar el extremo caudal de la losa central de la pared torácica que contiene el esternón para exponer el corazón.
- Retire el pericardio, hacer un pequeño corte preciso en la punta del ventrículo izquierdo a admitir la cánula del aparato de perfusión. Utilice una cánula roma con un diámetro interno de 0,6 mm. Pasar la cánula suavemente a través del ventrículo hasta la punta aparezca en la aorta ascendente y asegurar la cánula con una abrazadera. Para permitir que la sangre y perfundidos para salir de la corriente de la sangre, hacer un corte en la aurícula derecha.
- ratones perfundir transcardially usando una bomba peristáltica a una velocidad de flujode 5 ml / min a primero con PBS (25 mM, 0,9% de NaCl, pH 7,4) durante aproximadamente 1 min, seguido de fijador enfriada con hielo de 7 min.
- Después de la fijación, cortar la cabeza de ratón con un par de tijeras y luego se corta la piel a través de la línea media del cuello a la nariz. Retire el músculo para exponer completamente el cráneo.
- Con unas tijeras afiladas, hacer un corte longitudinal a través del occipital y interparietales partir del foramen magnum. Con unas pinzas finas quitan estos huesos para exponer todo el cerebelo. A continuación, hacer otro corte longitudinal a través de los huesos parietal y frontal hasta que el hueso nasal y sacarlos con pinzas para exponer todo el cerebro.
- Usando una espátula quitar el cerebro sin dañarlo, y lo coloca en helado 0,1 M PB.
- Preparación del fijador
- Seccionar y el recorte de los especímenes
- Corte un bloque de corona de aproximadamente 5 - 6 En mm con hojas de afeitar que contengan el área de interés. Pegarlo en el soporte dela vibroslicer con un pegamento de cianoacrilato. Orientar el bloque de tejido de forma que el neocórtex se enfrenta a la cuchilla vibrante. Rebanada coronal secciones, que contienen la amígdala, a 140 m con el vibroslicer (Figura 1A) en helado 0,1 M PB y recogerlos en una placa de 6 pocillos en el mismo tampón.
- Bajo un microscopio estereoscópico, recortar la región de interés (en este caso, el clúster paracapsular medio-dorsal de la CCI, véase la Figura 1B) de la rebanada. Para ello, en una placa de Petri recubierta con elastómero de silicona y lleno de 0,1 M PB, utilizando un bisturí oftálmica. Asegúrese de que los bloques recortados encajan en el orificio del espaciador (aproximadamente 1,5 mm) (Figura 1B).
- Mueve los bloques recortados en disolución de criopreservación (30% de glicerol en 0,1 M PB) O / N a 6 ºC.
3. La congelación de alta presión
NOTA: El FRIL consiste en 6 pasos esenciales (Figura 2): 1) de congelación rápida con alta presión (al 2,300 - 2,600 bar) de la muestra. 2) La fracturación de la muestra. El plano de fractura sigue en general el núcleo hidrofóbico central de membranas congeladas, dividir en dos valvas de entramado de membrana: un medio que se encuentra adyacente al protoplasma (P-cara) y un medio que se encuentra adyacente al espacio extracelular o exoplasmic (E- cara). 3) la replicación de la muestra por vacío-deposición de platino y carbono. 4) Detergente-digestión del tejido. 5) Inmunoelectrónica etiquetado. 6) Análisis de la réplica usando un microscopio electrónico de transmisión.
- Preparación de los portadores de cobre
NOTA: Para ser manejados a través de las etapas sucesivas del procedimiento de FRIL, las muestras deben ser montados sobre soportes de metal (oro o cobre). Estos portadores varían en tamaño y diseño de acuerdo con el modo de fractura y el tipo de máquinas utilizadas. Aquí hemos utilizado portadores de cobre (Figura 1 B, E) y una "tabla de réplica doble" con bisagras; (véase la Figura 3B), que cuando se abre produce una fractura a la tracción a través de la muestra congelada (Figura 2). Esto permite retener y replicar ambos lados de la muestra fracturados.- portadores de cobre polacas con un removedor de empañar el uso de una hoja de piel de gamuza.
- Coloque los soportes en un bote de vidrio y limpia dos veces con un detergente no iónico (pH ~ 1,5) en un baño de agua de sonicación, a continuación, se lavan extensivamente en el agua del grifo y después con agua desionizada y después se enjuagan dos veces con etanol.
- Sonicar los portadores de cobre en acetona durante 15 min.
- Coloque los soportes en papel de filtro para secar.
- Coloque un anillo de cinta adhesiva de doble cara para un portador de cobre (Figura 1C), que servirá como la celebración de bien para el (portador de retención) del bloque recortado.
- La congelación de la muestra
NOTA: Manejar nitrógeno líquido con el cuidado y el uso de gafas protectoras apropiadas.- Encienda la alta presión libreunidad de chispa (Figura 1F) al menos 1,5 horas antes de comenzar con la congelación de la muestra.
- Iniciar la calefacción pulsando el botón "calentador de aire", y hornear por 50 minutos. Ajuste la temperatura del aire a 80 ° C.
- Conectar el depósito de nitrógeno a la unidad de congelación de alta presión y pulse el botón "NITRÓGENO" para llenar el interior Dewar con nitrógeno líquido. Los "NIVEL DE NITRÓGENO" se encienda. Iniciar el enfriamiento pulsando el botón de "refrigeración".
- Pulse la tecla "DRIVE IN" botón cuando el "nivel de nitrógeno" se apaga. Compruebe que el sistema hidráulico mueve el pistón hacia atrás y adelante 3 veces.
- Presione el botón "AUTO", y el botón "NITRÓGENO". Tan pronto como "LISTO" se ilumina, la unidad de congelación de alta presión está listo para la congelación de alta presión.
- Coloque un bloque recortado en el agujero de la cinta de doble cara (Figura 1B) usando un asa de alambre de platino que se ha derretido en agpipeta muchacha.
- Eliminar el exceso de la solución de crioprotector usando papel de filtro o un cepillo.
NOTA: Este procedimiento también es importante para eliminar las burbujas de aire que puedan formarse alrededor de los tejidos y que podrían causar distorsión de la forma del tejido y / o ultrasonografía. - Bajo un microscopio estereoscópico, cubrir el soporte de sujeción con otra compañía, de modo que el bloque de tejido se intercala entre las dos compañías.
- Inserte el portaunidades de sándwich en el soporte de la muestra de la unidad de congelación de alta presión (Figura 1D). Inserte el soporte de la muestra en la unidad de congelación de alta presión (punta hacia abajo) y fijarlo mediante atornillado en el soporte de la muestra.
- Iniciar el ciclo de congelación presionando el botón "Jet-Auto". Trabajando lo más rápido posible, retire el soporte de la muestra y sumergir la punta con nitrógeno líquido en una caja aislada. Sumergir la punta de los dos pares de pinzas en el nitrógeno líquido para enfriar ellos.
- Retirar con cuidado THe-portadora sándwich de la portamuestras y colocarlo en un criovial previamente enfriado. Asegúrese de que los transportistas solamente se manejan con pinzas enfriado con nitrógeno líquido. Crioviales deben ser perforados para que el nitrógeno fluya fuera del vial (Figura 1G).
- Repita los pasos 3.2.6 a 3.2.11 hasta que todas las muestras deseadas han sido congelados. Múltiples portadora sándwiches que contienen el mismo tipo de muestra se pueden almacenar en el mismo vial.
- Almacenar los crioviales que contienen los portadores en una cisterna criogénica hasta que la replicación (Figura 1H).

Figura 1. Preparación del tejido y de congelación de alta presión. (A) Vibroslicer utilizan para la sección del tejido. (B) Una sección de cerebro de ratón coronal resultante que contiene el lado amígdala se muestra a lado con acOpper portador equipado con un anillo de cinta de doble cara. El cuadro de trazos indica el área de interés que contiene el cluster paracapsular medial de la CCI. El diámetro del agujero en la cinta de doble cara es de aproximadamente 1,5 mm. (C) Herramientas para la preparación de los portadores de cobre. Desde la parte superior izquierda en sentido horario: cinta de doble cara, pinzas, golpeador, portadores de cobre, y las tijeras. (D) Inserción del portaunidades de sándwich en el soporte de la muestra para la congelación de alta presión. El portador-sándwich se coloca en el orificio del soporte de la muestra. Portadores de cobre (E) sin y con un anillo de cinta adhesiva de doble cara y el "carrier-sandwich". (F) unidad de congelación de alta presión con alimentación de depósito presurizado de nitrógeno líquido a la misma. (G) Un criovial para abastecerse de los tejidos congelados. Nota de los agujeros en la posición media-alta del vial permitiendo que el gas nitrógeno fluya fuera del vial (punta de flecha). (H) Cryotank para almacenar el tejido congelado. Por favor, haga clic aquí para ver una versión más grande de esta figura.
4. Freeze-fractura y replicación
- Preparación de los cañones de haz electrónico
- Antes de insertar los cañones de haz electrónico, quitar el escudo con la "placa de desviación". Coloque el "medidor de ajuste" para centrar el filamento en la pinza de sujeción a través de la cubierta del cátodo inferior.
NOTA: El extremo de mayor diámetro del calibre de ajuste se utiliza para la pistola de carbono mientras que el extremo de menor diámetro es por el arma de platino. - Deslice el nuevo filamento sobre el medidor hasta que "las láminas de presión" puede sujetar los extremos del filamento, lo que garantiza que la bobina de filamento no se encuentra en un ángulo.
- Retire el calibre de ajuste e inserte la varilla de carbono. Fijarlo apretando el coChuck llet del soporte de la varilla del evaporador, asegurando que la altura del extremo de la varilla se encuentra en el medio de la segunda bobina de la parte inferior. Para la pistola de platino, la altura del extremo de la varilla de platino debe estar en el medio de la segunda bobina de filamento desde la parte superior.
- Vuelva a colocar la placa de desviación e insertar las armas en la unidad de fractura por congelación. Limpiar las pistolas con un arena-Blaster después de su uso.
- Antes de insertar los cañones de haz electrónico, quitar el escudo con la "placa de desviación". Coloque el "medidor de ajuste" para centrar el filamento en la pinza de sujeción a través de la cubierta del cátodo inferior.
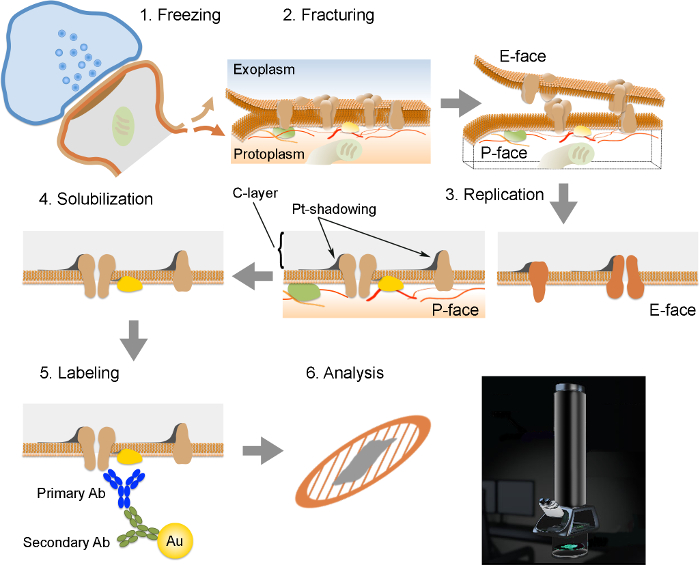
Figura 2. Ilustración de los pasos clave de la Técnica FRIL.
Esquema de los diferentes pasos necesarios para la preparación y análisis de réplica. (1) de congelación de alta presión de tejido. (2) La fracturación. Durante la fractura de tejido congelado, la bicapa lipídica de las membranas de plasma se divide en dos mitades en la interfase hidrófoba. Las proteínas en la membrana plasmática se asignan a ya sea la exoplasmic (E-cara) o protomembranas plasmáticas (P-cara). (3) La replicación. La evaporación de carbono (C) atrapa lípidos y proteínas sobre la superficie del tejido fracturado. El material se recubre con 2 nm de platino / carbono para sombra en un ángulo de 60 °, y luego con otra capa de carbono 15 nm que fortalece la estructura de la réplica (C-capa, Pt-shadowing). (4) La solubilización. El tejido no atrapado por la membrana réplica luego se solubiliza con SDS-solución. (5) El etiquetado. Las proteínas de interés pueden ser visualizadas en réplica utilizando un complejo hecho de anticuerpos específicos primarios (Primary AB) y anticuerpos secundarios (Ab secundario) conjugados con una partícula de oro (Au). El uso de diferentes tamaños de partículas de oro permite la detección de más de una proteína en la misma réplica. (6) Después de inmunomarcación, réplicas se recogieron en rejillas de malla de cobre y se analizaron con un microscopio electrónico de transmisión a 80 -. 100 kV favor CLICk aquí para ver una versión más grande de esta figura.
- Puesta en marcha de la unidad de fractura por congelación
- Conectar la unidad de fractura por congelación (Figura 3A) girando RED a 1. Para una descripción detallada de los procedimientos de congelación-fractura y replicación, ver manual de instrucciones proporcionadas por el fabricante.
- Antes de enfriar el dispositivo de congelación-fractura, hornear a cabo todo el sistema de refrigeración de la unidad con aire caliente. Presione el botón de "descongelación" en el dispositivo 010 de MTC (unidad de control de temperatura) (Figura 3A) y deje que el proceso de hornear por 45 minutos.
- Active la estación de vacío. La unidad de fractura de congelación por lo general opera en un rango de vacío de ~ 10 -6 - 10 -7 mbar.
- Llene el tanque de nitrógeno y conectarlo a la unidad de fractura por congelación. Compruebe que el soporte de la válvula es seco y también limpiar la entrada del tanque antes de la inserción del soporte de válvula (humedad puede interferir con vacuum y la indicación de N 2 de llenado del depósito).
- Iniciar la refrigeración mediante el establecimiento de la temperatura de -115 ° C. El enfriamiento tarda aproximadamente 45 minutos.
- Inserte los cañones de haz electrónico y ajustar la intensidad y la tensión para llegar a los siguientes parámetros para la evaporación:
arma de carbono: la rotación en posición 90 °, la tasa de acumulación de carbono en 0,1 - 0,2 nM / seg
arma de carbono-platino: la rotación fuera, la posición 60 °, tasa de acumulación de 0,06 - 0,1 nM / seg
NOTA: Si se utiliza un arma por primera vez después del intercambio de la barra de carbón o platino, desgasifique durante 3 minutos antes de su uso.
- Fracturación y la replicación
- Inserte carrier-bocadillos congelados en doble mesa de réplica, asegurándose que todas las manipulaciones se realizan en nitrógeno líquido.
- La tabla de transferencia doble réplica a un frasco de Dewar y fijarlo al receptor platina en un ángulo de 45 °. El nivel de nitrógeno líquido siempre debe estar por encima de la mesa doble réplica.
- Recoger la mesa doble réplica con el manipulador de la tabla e insertarla en la unidad de fractura por congelación en la etapa de frío. Espere aproximadamente 20 min para permitir que la temperatura de la tabla de doble réplica para ajustar a -115 ° C.
- Verificar que el vacío es inferior a 10 -6 mbar y la temperatura es de -115 ° C.
- Fracturar el tejido mediante la rotación manual de las agujas del reloj de la rueda conectada a la cubierta colocada encima de la mesa de doble réplica. Cuando la cubierta se convierte, obliga a la mesa de doble réplica para abrir, fracturando el tejido.
- Presione el botón de "alta tensión" en el (unidad de control del haz de electrones de evaporación) 030 EVM dispositivo de la unidad de fractura por congelación (Figura 3A).
- Replicar las superficies expuestas de los tejidos fracturada (Figura 3C) por evaporación de carbono (de rotación) por medio de un cañón de haz electrónico colocado en un ángulo de 90 ° hasta un espesor de 5 nm, seguido de una shado unidireccionalala con platino-carbono en un ángulo de 60 ° hasta un espesor de 2 nm. Por último, aplicar una capa de 15 nm de espesor de carbono de un ángulo de 90 ° (rotación).
- Utilice los siguientes parámetros para la evaporación:
1º de carbono: la rotación en, posición de 90 °; velocidad de desde 0,1 hasta 0,2 nm / seg; 5 nm
2º de carbono-platino: la posición 60 °; velocidad de 0,06 a 0,1 nm / seg; 2 nm
3º de carbono: la rotación en, posición de 90 °; velocidad de 0,3 - 0,5 Nm / seg; 15 nm - Retirar las muestras replicadas de la unidad de fractura por congelación y transferirlos a una placa de 12 pocillos de cerámica (Figura 4A) lleno de TBS (Tris solución salina tamponada, pH 7,4).
- El uso de una varilla de alambre asa de platino, eliminar el tejido replicado desde el soporte de muestra (Figura 4A).
- Repita los pasos 4.3.1 a 4.3.10 hasta que todas las muestras se han replicado.
 r /> Figura 3. Freeze-fracturación y replicación.
r /> Figura 3. Freeze-fracturación y replicación.
(A) La unidad de fractura por congelación. La máquina contiene varias unidades de control y un monitor. Las muestras se introducen en la cámara a través de un puerto en el lado izquierdo de la cámara. Un contenedor de nitrógeno líquido a presión está conectada a la unidad de fractura por congelación para enfriar la etapa. Imágenes a continuación muestran vistas ampliadas de dos de las unidades (UPC 010 y 010 MDC) y el monitor de visualización de parámetros durante la evaporación de la segunda capa de carbono. (B) abierto (izquierda) y puntos de vista cerrados (derecha) de la tabla de doble réplica. Los "carrier-sandwiches" se insertan en las ranuras de la tabla (indicados por flechas). Las armas pequeñas impiden "carrier-sandwiches" se caiga durante la manipulación. (C) Una muestra fracturada y replicado. Réplicas aparecen películas delgadas negras en la parte superior del tejido fracturado.53 / 53853fig3large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
- SDS-digestión de la réplica
- Transferencia de réplica a un vial de vidrio de 4 ml llena con 1 ml de tampón de SDS-digestión (2,5% Lauril sulfato de sodio, 20% de sacarosa en Tris 15 mM, pH 8,3). Recopilación durante 18 horas a 80 ° C con agitación (45 tiempos / min).
- Transferencia réplicas a un nuevo tubo lleno de SDS-tampón de digestión y se almacena a temperatura ambiente.
5. Immunolabeling
NOTA: Todas las incubaciones se realizaron a temperatura ambiente con agitación suave, a excepción de las incubaciones con anticuerpos.
- Lavar la réplica de 10 min en tampón fresco SDS-digestión.
- Lavar la réplica de una vez con 2,5% de BSA (albúmina de suero bovino) en TBS durante 5 min, y después 3 x 10 min con 0,1% de BSA en TBS.
- Bloquear los sitios de unión no específica en TBS con BSA al 5% durante 1 hora.
- Aplicar contra primariacuerpos diluyeron en 2% BSA-TBS. Realizar las incubaciones en una gota l 30 (Figura 4B) en una cámara húmeda a 15 ° C durante 72 hr (Figura 4C).
- Para este estudio, el proceso de ambas réplicas del tejido fracturado. Incubar una réplica con un anticuerpo policlonal de cobaya producido contra los aminoácidos 717 - 754 del ratón GluR1 común a todas las subunidades AMPA-R (dilución: 1: 200) o un anticuerpo monoclonal de ratón generados contra una proteína de fusión recombinante que cubren los aminoácidos 660 - 811 de la subunidad NR1 del NMDA-R (dilución: 1: 500), y un anticuerpo policlonal de conejo contra la proteína fluorescente verde (dilución: 1: 300).
- Incubar la otra réplica con un anticuerpo policlonal de conejo generado contra un péptido sintético correspondiente a los aminoácidos 384 - 398 de la μ-opioide receptor de rata (dilución: 1: 500).
- Lavar en TBS con 0,05% de BSA (3 x 5 min.).
- Aplicar anticuerpos secundarios. Por esta u estudioel oro se (5 nm para los receptores de glutamato ionotrópicos, 10 para receptores opioides μ-y / o de 15 nm para ChR2-YFP) anticuerpos conjugados diluida en TBS con BSA al 2%. Diluir anticuerpos secundarios 1:30 y se incuban en una caída de 30 l a 15 ° CO / N.
- Lavar 3 x 5 min en 0,05% de BSA-TBS a temperatura ambiente.
- Lavar 2 x 5 min en agua ultrapura.
- Réplica Montar en 100 líneas de rejilla de barras paralelas-Formvar recubierto (Figura 4D).
6. Análisis de la reproducción
- réplicas imagen con un microscopio electrónico de transmisión (TEM) a 80 o 100 kV. Adquirir imágenes digitales a través de una cámara CCD (dispositivo de carga acoplada).
- Fuera de línea, encontrar regiones correspondientes en las imágenes de ambas réplicas utilizando puntos de referencia (Figura 4E). Analizar las imágenes digitales utilizando Image J. determinar el área postsináptica y el número de partículas de inmunomarcaje marcado dirigidos contra el receptor analizado.

Figura 4. Immunolabeling de réplica.
Herramientas (A) para la manipulación y el lavado de las réplicas. Una placa de 12 pocillos de cerámica (arriba a la derecha) y 2 tipos de pipetas de vidrio (arriba a la izquierda). La pipeta de vidrio con punta redonda (parte inferior izquierda) se utiliza para transferir réplica, y la probeta con la barra de platino (parte inferior central) se utiliza para desplegar réplicas. Una réplica en tampón de lavado (parte inferior derecha). (B) Immunolabeling de réplicas se lleva a cabo en gotas (30 l) colocados en un pequeño trozo de parafina en un pozo de un cultivo de tejidos de 6 pocillos. Tenga en cuenta que una réplica está cubierto por una la gota de anticuerpos tampón que contiene. Para evitar la evaporación, una pieza humedecida de papel de seda se coloca alrededor del borde interior del pozo. (C) Incubadora para la etapa de marcado inmunológico. Las incubaciones se llevaron a cabo a 15 ° C. (D) Una réplica montado en un Formvar recubierto 100-la línea de rejilla de barras paralelas. (E) micrografías bajo aumento de un par de réplicas. Los cuadrados de puntos indican tres puntos de referencia típicos para identificar una ubicación en las réplicas correspondientes. Barra de escala: 10 micras. Se muestran todos los datos como media ± SEM Haga clic aquí para ver una versión más grande de esta figura.
Resultados
La técnica de FRIL, cuando se combina con la expresión de los actuadores optogenética de origen microbiano 21, es decir, canales integrados en la membrana plasmática y eficazmente transportados anterogradely a lo largo de los axones, permite examinar cuantitativamente la expresión postsináptica de AMPA-R y de NMDA-R en un subgrupo definido de las sinapsis. Esto se muestra aquí por los axones procedentes de los núcleos del tálamo distinta (por ejemplo, el PIN / MGn) sobre las neuronas ITC en la amígdala. Este enfoque permite un análisis molecular de las sinapsis de entrada sensoriales individuales en neuronas ITC, un grupo de células que han sido refractarios a una caracterización anatómica y molecular detallada hasta el momento.
Cuatro semanas después de la inyección estereotáctica del rAAV-YFP-ChR2 en el PIN / MGn, los axones ChR2-YFP-positivas densamente inervadas la LA, la zona de transición amygdalostriatal (Astria) y el paracapsular I medial Clúster de TC en la amígdala, un patrón totalmente coherente con el trazado anterior estudia 16, 22. También se detectó una intensa oro immunolabeling para la ChR2-YFP en el P-cara de los axones y terminales en réplica de congelación-fractura de rAAV-ChR2-YFP- ratones inyectados (figura 5A), pero no en las réplicas de los ratones no inyectados. La especialización de la membrana postsináptica de las sinapsis glutamatérgicas en una réplica se puede observar como un grupo de partículas intramembrane (PIM) en el E-cara de la membrana plasmática 2, 23, y con frecuencia se acompaña de la P-cara de su membrana plasmática presináptica 7 (Figura 5B-C). Permitieron identificar la especialización post-sináptica de las sinapsis glutamatérgicas formados por terminales de los axones PIN / MGN Estas características (Figura 5 y 6). Hemos marcado AMPA-R con un anticuerpo que reconoce todas las cuatro subunidades (GluA1-4), mientras que de NMDA-R se detectaron utilizando un anticuerpo contra la subunidad NR1 esencial.
ntent "fo: keep-together.within-page =" 1 "> Debido a la falta de herramientas para detectar en la misma réplica si estas sinapsis se hicieron con las espinas dendríticas o ejes de las neuronas del ITC, que marcó la cara réplica correspondiente para μ los receptores de opioides, como las neuronas ITC expresan postsináptico altos niveles de estos receptores 24. Esto requiere la identificación de los mismos perfiles postsinápticos en las dos réplicas (Figura 5C-F y la Figura 6A-D) usando una estrategia que emplea puntos de referencia (Figura 4E) .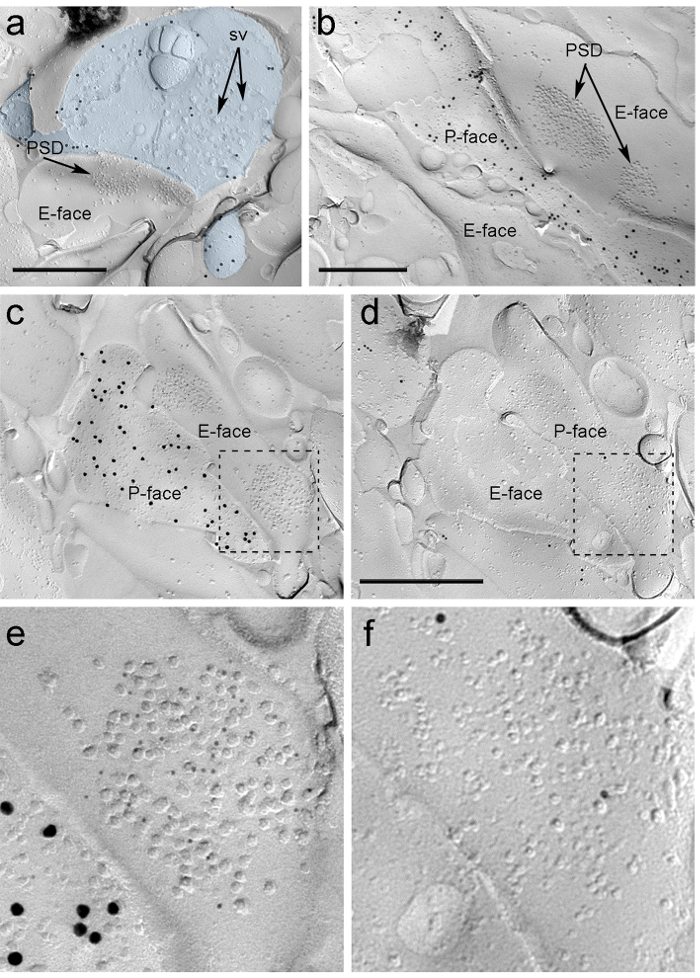
Figura 5. Detección de ChR2-YFP y glutamato ionotrópicos receptores en la reproducción por Inmunoelectrónica partículas. (A) Un terminal del axón-transversal fracturada (azul claro) y pequeñas porciones de su P-cara marcada con 15 nm de partículas de oro que detectan ChR2-YFP. Dentro de la terminal, la membrana of numerosas vesículas sinápticas se pueden observar (sv). Tenga en cuenta la especificidad de la inmunomarcación en gran parte restringidos a la membrana plasmática. Las etiquetas de los ChR2 identifica el terminal como originarios del PIN / GNM. El terminal forma una sinapsis asimétrica con una columna vertebral. La especialización membrana postsináptica (PSD) en el E-rostro muestra un racimo característico de partículas intramembrane y se etiqueta con 5 nm de partículas de oro que revelan AMPA-R. (B) El P-cara de un axón ChR2 que expresan (marcado con 15 partículas de oro nm) se muestra que bordea dos dendritas, uno de ellos posee dos PSDs marcadas con 5 nm partículas de oro que revelan NMDA-R. (CD) las caras opuestas de las membranas pre y postsinápticos de una sinapsis PIN / MGN-ITC. (C) El P-cara del terminal expresa ChR2 (marcado con partículas de oro 15 nm) y se extiende sobre el E-cara de dos ejes dendríticas, uno de ellos contiene dos PSDs etiquetados para AMPA-R (5 partículas nm de oro). ( D) El correspondiente P-cara de los dos dendritas está etiquetado para los receptores opioides μ-partículas (10 nm de oro). (EF) vistas ampliadas de las áreas señaladas por las líneas punteadas. Las barras de escala:. 500 nm Haga clic aquí para ver una versión más grande de esta figura.
Se encontraron inmunopartículas para AMPA-R en las sinapsis PIN / MGN-ITC en todo el clúster IMP, lo que sugiere una distribución homogénea dentro de la especialización post-sináptica (Figura 5E). A significativamente mayor (prueba t no pareada p <0,018) densidad de etiquetado AMPA-R se observó en PIN / MGn sinapsis en espinas ITC (715 ± 38 partículas de oro / micras 2, n = 32) en comparación con las sinapsis Onto dendritas ITC (590 ± 44 partículas de oro / micras 2, n = 32). En general, la densidad del AMPA-R en las sinapsis PIN / MGN-ITC mostró una relativamente bajavarianza (coeficiente de variación, CV = 0,37) de acuerdo con una distribución homogénea.
Inmunopartículas de NMDA-R en las sinapsis PIN / MGN-ITC se observa a menudo distribuidos de manera desigual dentro de las agrupaciones IMP postsinápticos (Figura 5B). La densidad de etiquetado NMDA-R fue similar (no pareada t-test p = 0,39) entre el PIN / MGn sinapsis en las espinas del ITC (1070 ± 153 partículas de oro / micras 2, n = 8) y las dendritas ITC (812 ± 183 partículas de oro / m 2, n = 9). A diferencia de lo observado para AMPA-R, la densidad de NMDA-R en las sinapsis PIN / MGN-ITC fue muy variable (CV = 0,54).

Figura 6. AMPA y NMDA-R-Rs Immunolabeling en Identificadas Las sinapsis PIN / MGN-ITC.
(AB) caras opuestas de las membranas pre y postsinápticos de un NIP / MGN-ITCsinapsis hecho en una espina dendrítica en el que el P-cara del terminal expresa ChR2 (marcado con partículas de oro de 15 nm) y el PSD en una espina dendrítica está etiquetado para AMPA-R (5 nm partículas de oro). (CD) vistas ampliadas de las áreas descritas por la línea discontinua. Estas áreas han sido girado aproximadamente 45 ° en sentido antihorario para permitir una mejor vista de la PSD. (E) Diagramas de dispersión del número de partículas AMPA-R frente a la zona sináptica en las espinas y las dendritas ITC. En ambas estructuras, se ha observado una correlación positiva. (F) Diagramas de dispersión del número de partículas de NMDA-R contra la zona sináptica en las espinas y las dendritas ITC. Una correlación positiva significativa se detectó sólo en las espinas dendríticas. Las barras de escala:. 500 nm Haga clic aquí para ver una versión más grande de esta figura.
Porqueel P-cara de la membrana plasmática presináptica menudo superpuestos, en parte, la agrupación IMP postsináptica, podríamos estimar el área sináptica de sólo el 30% de las sinapsis (espinas: significan área de 0.032 m 2, rango: 0,007 a 0,063 m 2, n = 8; dendritas: 0,047 m 2, rango: 0,024 a 0,166 m 2, n = 11). Estos fueron en un rango similar como se ha analizado anteriormente glutamatérgica telencephalic sinapsis 25.
En ambas espinas y las dendritas, el número de oro para inmunopartículas AMPA-R en las sinapsis individuales se correlacionó positivamente con el área sináptica (Spearman, espinas: r = 0,88, dendritas: r = 0,60, p <0,0001) (Figura 6E). Por el contrario, se encontró el número de inmunopartículas oro para NMDA-R que se correlaciona con la zona sináptica en las espinas (Spearman, espinas dorsales: r = 0,90, p <0,002), pero no en las dendritas (r = 0,21, p = 0,29) (Figura 6F ).
Discusión
microscopía electrónica de congelación-fractura ha sido una técnica importante en la investigación ultraestructural por más de 40 años. Sin embargo, la falta de medios eficaces para estudiar la composición molecular de las membranas produjo una disminución significativa en su uso. Recientemente, ha habido un renacimiento importante en la microscopía electrónica de congelación-fractura debido al desarrollo de medios eficaces para revelar las proteínas integrales de membrana, mediante el etiquetado inmunoelectrónica 1, 2, a saber, la técnica de FRIL.
La técnica FRIL posee varias ventajas sobre otros métodos ultraestructurales de inmunomarcaje. En primer lugar, las proteínas son fácilmente accesibles a los anticuerpos aumentando la sensibilidad. En segundo lugar, la exposición de gran parte de especializaciones de la membrana plasmática, tales como la membrana postsináptica, en la superficie de dos dimensiones de la réplica permite la inspección de la distribución espacial y la contigüidad física de moléculas de interés sin reconstrucción laborioso y requiere mucho tiempo de seriAl secciones ultrafinas. En tercer lugar, la disponibilidad de las dos mitades de la membrana plasmática aumenta el número de proteínas que se pueden etiquetar para cada estructura individual, anticuerpos adecuados proporcionados están disponibles. Tras la fractura, la cara hidrofóbica de la membrana de separación se recubre con carbono-platino que afianza dominios de proteína restantes en la superficie fracturada. Esto impide el acceso de los anticuerpos a los antígenos en estos dominios. Por ejemplo en el P-cara de una réplica de sólo epítopos que se enfrenta el espacio protoplasmática pueden ser detectados por los anticuerpos, mientras que en el E-cara solamente que los epítopos frente al espacio exoplasmic puede estar unido por anticuerpos (ver Figura 2).
Por otra parte, la técnica de FRIL también sufre de ciertas limitaciones 2. Como fracturas se producen al azar, puede ser difícil a las células diana o estructuras específicas. Esto también puede conducir a un sesgo de muestreo, por ejemplo, en la recolección de sinapsis, dada la diferente probabilidad de fracturing a lo largo de la membrana de las estructuras con curvatura diferente (por ejemplo, frente a los ejes espinas). Por otra parte, la asignación de las proteínas de membrana a una de las dos caras es impredecible. Por lo tanto, la distribución de una proteína a la P-cara o E-cara, particularmente para los estudios cuantitativos, debe ser cuidadosamente examinada usando anticuerpos reactivos con los dominios intracelular y extracelular. Por último, la identificación de la réplica de ciertas estructuras, tales como terminales de los axones presinápticos, puede ser difícil cuando se basan solamente en las características morfológicas. Sin embargo, el uso de anticuerpos específicos para las proteínas marcadoras o la transducción de proteínas integrales de membrana etiquetados o canales usando vectores virales ofrece herramientas adicionales para facilitar la identificación de las membranas fracturados. Por ejemplo, este estudio se aprovechó de la transducción de ChR2-YFP en las neuronas del tálamo para identificar sus eferentes axonal en la amígdala o el etiquetado de los receptores opioides μ-para revelar mi postsinápticambranes de neuronas ITC.
Con el fin de realizar la técnica FRIL con éxito, la atención se debe tener especial relativo a la fijación del tejido. la fijación del tejido Strong (> paraformaldehído 2%) puede dar lugar a una alta tasa de fracturas-cruz y una disminución en la sensibilidad de etiquetado. Por otro lado, las fijaciones débiles hacen que la manipulación de tejidos y la preparación (por ejemplo, el corte de secciones) difícil. También es importante controlar que el grosor de los bloques recortados coincide con el espesor de la cinta de doble cara. Si el espesor de la muestra es menor que la de la cinta, las superficies del tejido podrían no se adhieren a la superficie de los dos soportes de metal, por consiguiente, la muestra congelada no está fracturado. Si el tejido es más grueso, se comprime con distorsiones estructurales inevitables cuando se realiza el sándwich de los dos portadores de cobre. La temperatura a la que se fracturó la muestra (en este protocolo, -115 ° C) juega también un papel importanteen la estructura de la réplica. Las temperaturas más altas pueden producir una mayor tasa de artefactos tales como condensación del vapor de agua en la superficie del tejido antes o durante la evaporación. Las temperaturas más bajas (<-125 ° C) puede aumentar el riesgo de escisión del material durante la fracturación. Este material puede caer sobre la superficie de la muestra o mantenerse en contacto con ella. Estas escamas de material también son recubiertos y contrastada producir manchas oscuras en la imagen. Fracturando a temperaturas más bajas también puede afectar a la frecuencia de fracturas transversales-particularmente para las pequeñas estructuras finas, como las espinas dendríticas. Un paso crítico aún más en la preparación de réplicas es el detergente digestión. Si la digestión es incompleta, el tejido no digerido aparece como manchas oscuras en la réplica, confundiendo el análisis de la estructura en el TEM. Por otra parte, el tejido no digerido puede atrapar anticuerpos o se unen de forma no específica, aumentando el etiquetado de fondo. Por otro lado, el uso de detergentes para la digestión de tejidos puede desnaturalizar las moléculas asociadas a la réplica de la alteración de sus estructuras secundaria y terciaria. Por lo tanto, para ciertos antígenos podría ser necesario para diluir gradualmente la concentración de SDS con etapas de lavado adicionales.
Para immunolabeling, la disponibilidad de diferentes tamaños de partícula de oro conjugado con anticuerpos secundarios permite detectar al mismo tiempo, pero sólo cualitativamente, múltiples proteínas, incluso en microdominios específicos de la membrana plasmática, tales como la especialización postsináptica. Sin embargo, debido al impedimento estérico, los estudios cuantitativos se limitan generalmente a la detección de una sola molécula. El tamaño de la partícula de oro también puede afectar a la eficacia de etiquetado.
Para la interpretación de la etiqueta en FRIL, se debe tener en cuenta que la partícula inmunoelectrónica puede estar situado en cualquier lugar dentro de un hemisferio con un radio de 20 a 25 nm a partir del antígeno debido a la forma compleja flexiblesed por el anticuerpo primario y secundario 26. Para más información sobre la teoría y la práctica de FRIL y técnicas relacionadas, remitimos al lector también a otros artículos metodológicos 27, 28.
La técnica FRIL se ha utilizado recientemente para alta resolución análisis cuantitativos de la localización del receptor de glutamato en diversas poblaciones de la sinapsis 29, 30. Por otra parte, la sensibilidad de detección de la técnica FRIL para la AMPA-R se estima tan alta como una partícula inmunoelectrónica por uno AMPA funcional -R canal 29. Por lo tanto, este enfoque es en general muy útil para cuantificar y analizar el patrón de expresión postsináptica de AMPA y NMDA-R-R en las sinapsis centrales. Aquí, hemos demostrado su aplicabilidad en las sinapsis PIN / MGN-ITC, un sitio más probable es importante para la transmisión de información de Estados Unidos durante el condicionamiento del miedo. El uso de un anticuerpo generado contra los residuos de aminoácidos extracelulares altamente conservadas de las subunidades del receptor de AMPA GluA1-GluA4, encontramos una distribución uniforme de las partículas de oro dentro de las agrupaciones IMP correspondientes a las especializaciones de la membrana postsináptica. La densidad de AMPA-R en las espinas ITC fue significativamente mayor en comparación con las sinapsis de eje dirigidos por PIN / MGN aferentes talámicas. En ambos sinapsis de la columna vertebral y el eje, se detectó una correlación positiva entre el etiquetado de AMPA-R y el área postsináptica, una característica común a otras sinapsis glutamatérgicas 25. La baja variación en la densidad de AMPA-R en las sinapsis PIN / MGN-ITC indica una distribución homogénea similar a otras sinapsis formadas por eferentes talámicas 7, pero diferente de las sinapsis corticales 25. Por el contrario, la densidad de NMDA-R es más variable y no hubo diferencia entre la columna vertebral y el eje de las sinapsis que sugiere una regulación diferente de la AMPA-R. En el futuro, la alta reproducibilidad de la técnica FRIL no sólo permitirá evaluar la composición molecular basal de las sinapsis centrales, pero puede facilitar la detección de cambios en el número de receptores de glutamato ionotrópicos y distribución subsináptica Después de aprender el miedo, como complemento de las grabaciones de ex-vivo de propiedades pre y postsinápticos de estas entradas.
En conclusión, este enfoque podría ser utilizado por otros investigadores para obtener información sobre las relaciones estructura-función de las sinapsis excitadoras-entrada específica en muchos otros circuitos neuronales en el que desentrañar el origen de los insumos y la naturaleza y composición de los elementos postsinápticos es crucial, pero problemático .
Divulgaciones
The authors declare that they have no competing financial interests.
Agradecimientos
Funding was provided by the Austrian Science Fund FWF grant No. P-22969-B11 to F. Ferraguti, and by the Charitable Hertie Foundation and the Werner Reichardt Centre for Integrative Neuroscience and by the DFG (CIN-Exc. 307) to I. Ehrlich.
Materiales
| Name | Company | Catalog Number | Comments |
| Surgery | |||
| Stereotactic frame | Stoelting, USA | 51670 | can be replaced by other stereotactic frame for mice |
| Steretoxic frame mouse adaptor | Stoelting, USA | 51625 | |
| Gas anesthesia mask for mice | Stoelting, USA | 50264 | no longer available, replaced by item no. 51609M |
| Pressure injection device, Toohey Spritzer | Toohey Company, USA | T25-2-900 | other pressure injection devices (e.g. Picospritzer) can be used |
| Kwik Fill glass capillaries | World Precision Instruments, Germany | 1B150F-4 | |
| Anesthesia machine, IsoFlo | Eickemeyer, Germany | 213261 | |
| DC Temperature Controler and heating pad | FHC, USA | 40-90-8D | |
| Horizontal Micropipette Puller Model P-1000 | Sutter Instruments, USA | P-1000 | |
| Surgical tool sterilizer, Sterilizator 75 | Melag, Germany | 08754200 | |
| rAAV-hSyn-ChR2(H134R)-eYFP (serotype 2/9) | Penn Vector Core, USA | AV-9-26973P | |
| fast green | Roth, Germany | 0301.1 | |
| Isoflurane Anesthetic, Isofuran CP (1ml/ml) | CP Pharma, Germany | ||
| Antiseptic, Betadine (providone-iodine) | Purdure Products, USA | BSOL32 | can be replaced by other disinfectants |
| Analgesic, Metacam Solution (5mg/ml meloxicam) | Boehringer Ingelheim, Germany | can be replaced by other analgesics | |
| Bepanthen eye ointment | Bayer, Germany | 0191 | can be replaced by other eye ointments |
| Drill NM3000 (SNKG1341 and SNIH1681) | Nouvag, Switzerland | ||
| Sutranox Suture Needle | Fine Science Tools, Germany | 12050-01 | |
| Braided Silk Suture | Fine Science Tools, Germany | 18020-60 | |
| Name | Company | Catalog Number | Comments |
| Tissue preparation | |||
| Paraformaldehyde EM grade | Agar Scientific Ltd., United Kingdom | AGR1018 | |
| Saturated picric acid solution | Sigma-Aldrich, USA | P6744-1GA | |
| Na2HPO4-2H20 | Merck Millipore, Germany | 1065860500 | |
| NaH2PO4-2H2O | Merck Millipore, Germany | 1063451000 | |
| NaCl | Merck Millipore, Germany | 1064041000 | |
| 4N NaOH | Carl Roth, Germany | T198.1 | |
| Thiopental | Sandoz, Austria | 5,133 | |
| Glycerol | Sigma-Aldrich, USA | G5516-500ML | |
| GenPure ultrapure water system | Thermo Fisher Scientific, USA | 50131235 | |
| Peristaltic pump | ISMATEC, Germany | ISM 930C | |
| Filter Paper | MACHEREY-NAGEL, Germany | MN 615 1/4 | |
| Vibroslicer, VT1000S | Leica Microsystems, Austria | ||
| Ophthalmic scalpel | Alcon Laboratories, USA | can be replaced by other ophthalmic scalpels | |
| Perfusion cannula | Vieweg, Germany | F560088-1 | can be replaced by similar items from other companies |
| Name | Company | Catalog Number | Comments |
| High-pressure Freezing | |||
| Copper carriers | Engineering Office M. Wohlwend, CH | 528 | |
| Sidol Polish | Henkel, Germany | can be replaced by same item from other companies | |
| Chamois skin | Household supply store | ||
| Hole punch, 1,5mm | Stubai, Austria | can be replaced by same item from other companies | |
| Denatured ethanol | Donauchem, Austria | can be replaced by same item from other companies | |
| Aceton | Roth, Germany | 9372.5 | CAUTION! |
| High Pressure Freezing Machine HPM 010 | BalTec, CH; now Leica Microsystems | HPM010 | not produced any more, substituted by LeicaEM HPM100 |
| Stereo-microscope | Olympus, Japan | SZX10 | |
| Liquid nitrogen | CAUTION! | ||
| Cryo-vials | Roth, Germany | E309.1 | can be replaced by same item from other companies |
| CryoCane | Nalge Nunc International,USA | 5015-0001 | can be replaced by same item from other companies |
| CryoSleeve | Nalge Nunc International,USA | 5016-0001 | can be replaced by same item from other companies |
| Liquid nitrogen storage vessel | Cryopal, France | GT38 | can be replaced by same item from other companies |
| Non-ionic detergent (Lavocid) | Werner & Mertz Professional, Germany | ||
| Name | Company | Catalog Number | Comments |
| Freeze-fracture and Replication | |||
| Sandblaster, Mikromat 200-1 | JOKE Joisten & Kettenbaum, Germany | SANDURET 2-K | can be replaced by same item from other companies |
| Siliciumcarbid SIC 360, grain size 25 - 21µ | JOKE Joisten & Kettenbaum, Germany | 955932 | |
| Freeze Fracture System BAF 060 | BalTec, CH; now Leica Microsystems | BAF060 | |
| Ceramic 12 well plate | Gröpel, Austria | 14511 | can be replaced by same item from other companies |
| Trizma base | SIGMA, USA | T1503 | can be replaced by same item from other companies |
| Trizma hydrochloride | SIGMA, USA | T3253 | can be replaced by same item from other companies |
| Sodium chloride | Merck, Germany | 1,064,041,000 | can be replaced by same item from other companies |
| SDS, Sodium lauryl sulfate | Roth, Germany | 5136.1 | CAUTION! ; can be replaced by same item from other companies |
| Sucrose | Merck, Germany | 1,076,871,000 | can be replaced by same item from other companies |
| TRIS | Roth, Germany | 5429.3 | can be replaced by same item from other companies |
| Universal Hybridization Oven | Binder, Germany | 7001-0050 | can be replaced by same item from other companies |
| Name | Company | Catalog Number | Comments |
| Immunolabelling | |||
| BSA | SIGMA, USA | A9647 | can be replaced by same item from other companies |
| Anti-GFP Antibody | Molecular Probes, USA | A11122 | |
| Anti-pan-AMPAR Antibody | Frontier Institute, Japan | pan AMPAR-GP-Af580-1 | |
| Anti-NMDAR1 Antibody, clone 54.1 | Merck Millipore, Germany | MAB363 | |
| Opioid Receptor-Mu (MOR) Antibody | ImmunoStar, USA | 24216 | |
| EM goat anti-guinea pig, 5nm; secondary antibody | BBInternational, | EM.GAG5 | |
| EM goat anti-rabbit, 15nm; secondary antibody | BBInternational, | EM.GAR15 | |
| Donkey anti-rabbit, 10nm, secondary antibody | AURION, Netherlands | DAR 10nm | |
| Copper grids, 100 Parallel Bar | Agar scientific, UK | G2012C | |
| Incubator | Major Science, USA | MO-RC | can be replaced by same item from other companies |
| Pioloform Powder | Agar scientific, UK | R1275 | |
| Chloroform | Roth, Germany | 3313.1 | CAUTION! ; can be replaced by same item from other companies |
| Name | Company | Catalog Number | Comments |
| EM analysis | |||
| Philips CM120 TEM | Philips/FEI | ||
| Morada CCD camera | Soft Imaging Systems, Germany | ||
| iTEM Ver. 5.2, imaging software | Soft Imaging Systems, Germany | ||
Referencias
- Fujimoto, K. SDS-digested freeze-fracture replica labeling electron microscopy to study the two-dimensional distribution of integral membrane proteins and phospholipids in biomembranes: practical procedure, interpretation and application. Histochem Cell Biol. 107 (2), 87-96 (1997).
- Masugi-Tokita, M., Shigemoto, R. High-resolution quantitative visualization of glutamate and GABA receptors at central synapses. Curr Opin Neurobiol. 17 (3), 387-393 (2007).
- Rash, J. E., Yasumura, T. Direct immunogold labeling of connexins and aquaporin-4 in freeze-fracture replicas of liver, brain, and spinal cord: factors limiting quantitative analysis. Cell Tissue Res. 296 (2), 307-321 (1999).
- Emes, R. D., Grant, S. G. Evolution of synapse complexity and diversity. Annu Rev Neurosci. 35, 111-131 (2012).
- Matsuzaki, M., et al. Dendritic spine geometry is critical for AMPA receptor expression in hippocampal CA1 pyramidal neurons. Nat Neurosci. 4 (11), 1086-1092 (2001).
- Rollenhagen, A., Lübke, J. H. The morphology of excitatory central synapses: from structure to function. Cell Tissue Res. 326 (2), 221-237 (2006).
- Tarusawa, E., et al. Input-specific intrasynaptic arrangements of ionotropic glutamate receptors and their impact on postsynaptic responses. J Neurosci. 29 (41), 12896-12908 (2009).
- Nusser, Z., et al. Cell type and pathway dependence of synaptic AMPA receptor number and variability in the hippocampus. Neuron. 21 (3), 545-559 (1998).
- Nyìri, G., Stephenson, F. A., Freund, T. F., Somogyi, P. Large variability in synaptic N-methyl-D-aspartate receptor density on interneurons and a comparison with pyramidal-cell spines in the rat hippocampus. Neuroscience. 119 (2), 347-363 (2003).
- Nicholson, D. A., Geinisman, Y. Axospinous synaptic subtype-specific differences in structure, size, ionotropic receptor expression, and connectivity in apical dendritic regions of rat hippocampal CA1 pyramidal neurons. J Comp Neurol. 512 (3), 399-418 (2009).
- Millhouse, O. E. The intercalated cells of the amygdala. J Comp Neurol. 247 (2), 246-271 (1986).
- Busti, D., et al. Different fear states engage distinct networks within the intercalated cell clusters of the amygdala. J Neurosci. 31 (13), 5131-5144 (2011).
- Amano, T., Unal, C. T., Paré, D. Synaptic correlates of fear extinction in the amygdala. Nat Neurosci. 13 (4), 489-494 (2010).
- Duvarci, S., Pare, D. Amygdala microcircuits controlling learned fear. Neuron. 82 (5), 966-980 (2014).
- Jüngling, K., et al. Neuropeptide S-mediated control of fear expression and extinction: role of intercalated GABAergic neurons in the amygdala. Neuron. 59 (2), 298-310 (2008).
- Asede, D., Bosch, D., Lüthi, A., Ferraguti, F., Ehrlich, I. Sensory inputs to intercalated cells provide fear-learning modulated inhibition to the basolateral amygdala. Neuron. 86 (2), 541-554 (2015).
- Maren, S. Neurobiology of Pavlovian fear conditioning. Annu Rev Neurosci. 24, 897-931 (2001).
- Pape, H. C., Pare, D. Plastic synaptic networks of the amygdala for the acquisition, expression, and extinction of conditioned fear. Physiol Rev. 90 (2), 419-463 (2010).
- Sigurdsson, T., et al. Long-term potentiation in the amygdala: a cellular mechanism of fear learning and memory. Neuropharmacology. 52 (1), 215-227 (2007).
- Bosch, D., Asede, D., Ehrlich, I. Ex-vivo optogenetic dissection of fear circuits in brain slices. J. Vis. Exp. (110), e53628 (2016).
- Fenno, L., Yizhar, O., Deisseroth, K. The development and application of optogenetics. Annu Rev Neurosci. 34, 389-412 (2011).
- Bienvenu, T. C. M., et al. Large intercalated neurons of amygdala relay noxious sensory information. J. Neurosci. 35 (5), 2044-2057 (2015).
- Sandri, C., Akert, K., Livingston, R. B., Moor, H. Particle aggregations at specialized sites in freeze-etched postsynaptic membranes. Brain Res. 41 (1), 1-16 (1972).
- Likhtik, E., Popa, D., Apergis-Schoute, J., Fidacaro, G. A., Paré, D. Amygdala intercalated neurons are required for expression of fear extinction. Nature. 454 (7204), 642-645 (2008).
- Fukazawa, Y., Shigemoto, R. Intra-synapse-type and inter-synapse-type relationships between synaptic size and AMPAR expression. Curr Opin Neurobiol. 22 (3), 446-452 (2012).
- Amiry-Moghaddam, M., Ottersen, O. P. Immunogold cytochemistry in neuroscience. Nat Neurosci. 16 (7), 798-804 (2013).
- Fukazawa, Y., Masugi-Tokita, M., Tarusawa, E., Hagiwara, A., Shigemoto, R., Cavalier, A., et al. SDS-digested Freeze-fracture replica labelling (SDS-FRL). Handbook of Cryo-Preparation Methods for Electron Microscopy. , 567-586 (2007).
- Severs, N. J. Freeze-fracture electron microscopy. Nat Protoc. 2 (3), 547-576 (2007).
- Tanaka, J., et al. Number and density of AMPA receptors in single synapses in immature cerebellum. J Neurosci. 25 (4), 799-807 (2005).
- Mansouri, M., et al. Distinct subsynaptic localization of type 1 metabotropic glutamate receptors at glutamatergic and GABAergic synapses in the rodent cerebellar cortex. Eur J Neurosci. 41 (2), 157-167 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados