Method Article
複合光遺伝学および凍結破砕レプリカ免疫標識をマウス扁桃体におけるグルタミン酸受容体の入力固有の配置を検討すること
要約
This article illustrates how the expression of neurotransmitter receptors can be quantified and the pattern analyzed at synapses with identified pre and postsynaptic elements using a combination of viral transduction of optogenetic tools and the freeze-fracture replica immunolabeling technique.
要約
フリーズフラクチャー電子顕微鏡は、40年以上にわたり超微細構造研究の主要な技術となっています。しかし、膜の分子組成を研究するための有効な手段の欠如は、その使用の大幅な下落をもたらしました。最近、免疫金標識によって内在性膜タンパク質を明らかにするために効果的な方法の開発にフリーズフラクチャー電子顕微鏡のおかげで主要な復活がありました。これらの方法の一つは、界面活性剤で可溶化フリーズフラクチャーレプリカ免疫標識(FRIL)として知られています。
光遺伝学とFRIL技術の組み合わせは、中枢シナプスの構造的および機能的特性の相関分析を行うことができます。このアプローチを使用することは、タグ付けされたチャネルロドプシン、特定の分子マーカーのそれぞれの発現の両方によって前およびシナプス後ニューロンを同定し、特徴付けることが可能です。 glutamatのシナプス後膜の特殊化の独特の外観ERGICシナプスはさらに、これらの受容体のintrasynaptic分布を定量化し、分析するために、イオンチャネル型グルタミン酸受容体の標識化の際に、ことができます。ここでは、ペアの複製とどのようにそれらを免疫標識する準備に必要な手順をステップバイステップの説明を与えます。我々はまた、潜在的なサンプリングバイアスに関連する特定のものをFRIL技術の注意事項と制限事項について説明します。光遺伝学と組み合わせたFRIL技術、高い再現性と汎用性は、脳内の特定された神経細胞の微細回路におけるシナプス伝達の異なる局面の特徴付けのための非常に強力なアプローチを提供しています。
ここでは、このアプローチは、マウスの扁桃体のインターカレートされた細胞塊のニューロンに興奮性シナプスの構造と機能の関係への洞察を得るために使用された方法の例を提供します。特に、我々は、識別された入力でイオンチャネル型グルタミン酸受容体の発現を調査していますか視床後部髄板内と内側膝状核からiginated。これらのシナプスは、恐怖の学習に関連する感覚情報を中継すると恐怖条件付けの際にプラスチック製の変化を受けることが示されました。
概要
ナノメートルスケールでの生体膜の機能アーキテクチャの定義は、透過型電子顕微鏡に適した免疫標識技術の多数の開発によって近年で挑戦されています。しかしながら、これらの技術は、 例えば、前後埋め込 み免疫抗原の不十分な検出および/ または膜結合タンパク質の制限された定量的評価を含む重要な制約の数を持っています。これらの制限は、細胞の多様性とシナプスの異質性の高いことを特徴としている神経系の微細構造の調査では特に重要になります。そのような受容体、トランスポーター、およびエフェクター分子として前およびシナプス後要素によって、および示差的発現、濃縮、またはシグナル伝達タンパク質の相互作用によって決定される構造的および機能的多様性の両方からのこの不均一性が生じます。
直接immunolabeのための新しいアプローチ界面活性剤で可溶化フリーズフラクチャーレプリカ(FRIL)の積分または架橋膜タンパク質の玲はもともと20年前に1藤本によって導入されました。このオリジナルの方法は、脳のような複雑な組織で個別にマッピングされた細胞を用いて標識された分子の意味のある相関を妨げレプリカのしかし、いくつかの制限、 すなわち、重度の断片化を、持っていました。約10年前、Shigemotoと深沢は次第に技術2を改善しました 。これは、かなりギャップジャンクション3の研究のために、特に、技術を向上させコロラド州立大学のボールダー研究所の科学者の他のグループからの努力、と並行ました。
凍結破砕プロトコルや機械の改善、ならびに(高圧下で)凍結クイックの導入は、今研究者は比較的大きなサイズの標本の切れ目のないレプリカを生成することができますし、ハイテク制限および強力な化学凝視によって生成されるアーティファクトのない最も細胞成分のGH品質の画像。
FRIL技術は、組織学的にマッピングされ、前とシナプス後の平面図の追加の利点を持つ脳のような複雑な組織内細胞学的に同定された細胞、中に1つまたは複数のタンパク質(同時に)の定量性の高いその場での識別の大きな利点を提供しています単一のレプリカ内の要素。したがって、FRIL技術は、その多くの技術的なハードルにもかかわらず、特に個々のシナプスの構造的および機能的特性の相関のために、非常に重要な科学的ブレークスルーの数のための約束を保持しています。過去数十年の間に、大量の情報は構造、分子メイクアップ、およびシナプスの生理機能に得られています。まだシナプスは前とシナプス後PAに応じて、形態学的および分子的に非常に多様です家賃ニューロン4。唯一のシナプスタイプの一握りのための構造-機能研究は、これまでの5-7達成しました。これは主に前とシナプス後要素の性質の正確な同定を防ぐ技術的な制約によるものでした。
超微細構造解析は、シナプス伝達の強度と可塑性に大きな影響を持っている神経伝達物質受容体6における明確なシナプスの接点間の両方シナプスのサイズと内容の点ではシナプス後膜の特殊化の変動性、に重要な洞察を提供してきました。また、研究の大きな体は、シナプスの異なる種類で発現イオンチャネル型グルタミン酸受容体の数がafferent-とターゲット依存的7-10に調節されていることを示しています。
ここでは、メソッドが定義とシナプス後膜の特殊化の構造と受容体組成の分析を可能に概説されていますDシナプス前要素と機能。このアプローチは、α - アミノ-3-ヒドロキシ-5-メチル-4- isoxazolepropionicのシナプス後の発現のパターンを分析するために、このようなchannelrhodopsin2(にChR2)として最近開発された感光性藻類タンパク質のシナプス前の発現、及びFRIL技術を利用します酸(AMPA-RS)と、N-メチル-D-アスパラギン酸(NMDA-RS)グルタミン酸受容体。これは、扁桃体(ITC)のインターカレートされた細胞塊のニューロンに後部視床内側膝状核(PIN / MGN)由来の軸索により形成されたシナプスで実証されています。 ITCニューロンは基底扁桃複合体(BLA)11,12を囲むクラスタに編成小さなとげのGABA作動性細胞である。ITCニューロンがBLA主要ニューロンの興奮性入力を受信し、(CEA)の中心核を標的とすることが知られており、このような阻害ゲートとして機能しますBLAとCEA 12-15との間の情報の流れのために。
最近、我々はITことを実証しましたBLAとCEAとの間に内外背側クラスターに位置するCニューロンはまた、恐怖はパブロフの聴覚恐怖条件16時の学習の際に変更された感覚視床および時間的な皮質領域から直接収束興奮入力を受け取ります。恐怖条件付けは、脳のメカニズムの面で連合学習の最もよく理解形態の一つです。恐怖条件付けでは、最初に中性の条件刺激(CS、 例えば、トーン)は、CS-US協会とコンディショニング恐怖反応17、18が得られ嫌悪無条件刺激(米国、 例えば、穏やかな足ショック)と対になっている。興奮CSと米国を表す情報を運ぶ視床および新皮質領域の両方からの入力は、それぞれ、扁桃体(LA)の外側核の錐体ニューロンに収束すると可塑19を受けることが知られていました。私たちの前の仕事は、感覚入力情報も並行してITCニューロンに中継されることが明らかになりました 16アップ。
ITCニューロンへの個々の感覚入力シナプスのメカニズムの分子解析に向けた最初のステップとして、我々は黄色蛍光タンパク質(YFP)でタグ付けにChR2を発現するためにアデノ随伴ウイルス(AAV)を使用しました。 AAVは、PIN / MGNに注入し、軸索末端を、にChR2-YFPの発現によって同定しました。私たちは、PIN / MGNの軸索末端によりITCニューロンが形成されたシナプスにおけるシナプス後AMPA-RやNMDA-Rの密度を評価するために、FRIL技術によって生成された両面を使用しました。
プロトコル
動物を対象とする手順はRegierungspraesidiumテュービンゲン、バーデン=ヴュルテンベルク州、ドイツ、州によっておよびオーストリアの動物実験倫理委員会によって承認され、研究における動物の使用に関するEU指令に従ったされています。
AAV-Channelrhodopsin2-YFPの1定位注射
注:定位注射は、以前に公開されたプロトコール20に従って実施しました。
- 1.5時間180ºCでそれらを加熱することにより、滅菌のツールを準備します。
- 次のパラメータで設定し、水平微小電極プラーを使用して、注射用の鋭い(〜50μmの直径)ガラスピペットを引き出し:熱=ランプ値を - 20、= 200 = 0、ベロシティ= 100、時間= 200、圧力を引き出します。
注:ランプ値は、マイクロピペットプラーの製造元の指示に従って、購入したガラスピペットのロットごとに決定する必要があります。 - ウイルス溶液と滅菌リン酸緩衝生理食塩水(; 25mMの、0.9%のNaCl、pH7.4のPBS)中の(ガラスピペット内の溶液の優れた視認性のための)0.1%ファーストグリーン液0.2μlにプレミックス1μlの。 10μlのピペットとゲルフィルのヒントを使用して、ガラスピペットを埋めます。ウイルス構築物については、のrAAV-HSYN-のChR2(H134R)-eYFP(血清型2/9)を使用します。
- 小動物麻酔装置(誘導のための酸素の3%イソフルラン)を使用して、マウスを麻酔。つかいます。この研究のために、〜6週齢3野生型マウスを使用します。
- 耳と目の間に頭を剃るとポビドンヨードベースの溶液で消毒します。
- 麻酔中に目の乾燥を防ぐために、眼軟膏を適用します。皮下鎮痛剤でマウスを注入(メロキシカムベースの5mg / ml溶液を0.1ml)。
- 定位フレームにマウスを置き、ガス麻酔器(メンテナンスのための酸素中2%イソフルラン)を介して麻酔を維持します。四肢の撤退の欠如によって麻酔深度をチェック続行する前にレフ。
- 全体の外科手術中に可能な限り最高の滅菌状態を維持します。使い捨てフェイスマスク、手術用ガウンと手袋を着用してください。
- はさみ20を使用して、頭の上に約1cmの皮膚切開を行います。静かにH 2 O 2と頭蓋骨表面ときれいな頭蓋骨を露出するようにクランプで固定し、鈍鉗子を使用して、側に皮膚を引っ張ります。
- 先端の細い永久的なマーカーを使用して頭蓋骨上のマーク注射部位。マークされたサイトで頭蓋骨に小さな穴(直径約1ミリメートル)を開けます。ブレグマからさ(mm):3.0後方、1.8±横、3.8腹側このスタッドで一方的なPIN / MGNの注射のために、次の座標を使用します。
- マウントは、圧力注入装置に接続された定位固定フレームにガラスピペットを充填し、位置をブレグマピペットをもたらします。
- 微細なストレートチップピンセットを用いてガラスピペットの先端を折り。 applyinによりピペットチップが開いていることを確認しますGAいくつかの圧力パルスとウイルス液の液滴の押し出しを観察します。
- 目標噴射座標に移動し、圧力噴射装置で次の設定を使用してピペットコンテンツ(〜0.5マイクロリットル)の半分を注入:圧力20psiで、平均パルス長さ30ミリ秒、パルス50の平均数。
- それを後退ゆっくり(1ミリメートル/分)の前〜1分間の場所にピペットを残します。
- PBSでクリーン頭蓋骨(pHは7.4)とクランプを取り外します。優しく一緒に皮膚を引っ張って、切開縫合(3から4ノット)。傷の周りに消毒剤(ベースポビドンヨード)を適用します。
- 麻酔を停止し、完全に目を覚ましまで無人マウスを放置しないでください。シングル収容されたマウスを保管してください。術後、健康状態を監視し続けます。必要に応じた管理者の鎮痛剤。
- ウイルス発現の適切なレベルを確保するために、脳の固定の前に4週間のために動物を保管してください。
2.試料の調製
- 脳固定</強いです>
- 固定液の調製
- 固定剤の1 Lの場合、パラホルムアルデヒドの10グラムの重量を量る、脱イオンH 2 Oの300ミリリットルに追加連続的に攪拌しながら10分〜60ºC - 55ヒート。
- 熱を切り、7追加 - 4 N NaOHを8滴を。解決策は〜10分で明らかになるであろう。
- ピクリン酸の飽和溶液の150ミリリットルを追加し、それを室温に冷却してみましょうし、脱イオンH 2 Oで500ミリリットルにそれを持って来ます
- 0.2 Mリン酸緩衝液(PB)の500ミリリットルを追加します。濾紙でフィルタリングします。 NaOHでpHを7.4に調整します。
- 6ºCに固定液を冷却し、6ºCで1日以上ないために暗いガラス瓶に保存します。
- 経心臓灌流
- チオペンタール(120 mg / kg体重)の腹腔内注射でマウスを麻酔。動物が深くペダル離脱REFLをチェックすることによって麻酔されていることを確認し不在であるべき元、。縛ら四肢で灌流テーブルの上にその背中に動物を置きます。
- 平滑末端はさみで縦方向に腹壁を開き、ダイヤフラムが露出するように、横方向に胸郭の尾側の国境に沿って2つの追加のカットを行います。ダイアフラムを離れてカットし、両側のosteocartilageneous国境で胸壁を切りました。心臓を露出するために胸骨を含む胸壁の中央スラブの尾の端を持ち上げます。
- 灌流装置のカニューレを認めざるを左心室の先端に小さな正確なカットを行い、心膜を削除します。 0.6mmの内径と鈍いカニューレを使用してください。先端が上行大動脈に表示されるまで、心室を通して穏やかにカニューレをパスし、クランプでカニューレを固定します。血液と灌流液が血流を終了できるようにするには、右心房内のカットを行います。
- 流量で、蠕動ポンプを使用して経マウスを灌流7分間氷冷固定液に続いて約1分間PBSで最初に5ミリリットル/分(25 mMの、0.9%のNaCl、pH7.4)で、の。
- 固定後、ハサミでマウスの頭部を切断した後、首から鼻に正中線を通って皮膚をカット。完全に頭蓋骨を露出させるために筋肉を削除します。
- 鋭いハサミを使用して、後頭部と大後頭孔から始まる壁間の骨を通る長手方向のカットを行います。細かいピンセットを使用すると、全体小脳を露出するためにこれらの骨を取り除きます。その後、鼻骨まで頭頂と前頭骨を介して他の長手方向のカットをすると脳全体を露出するようにピンセットでそれらを削除します。
- へらを使用すると、それを損傷することなく、脳を取り出し、氷冷した0.1 M PBに配置します。
- 固定液の調製
- セクショニングと標本のトリミング
- 関心のある領域を含むかみそりの刃を持つ6ミリメートル - 約5の冠状ブロックをカット。のホルダーにそれをのりシアノアクリレート系接着剤でvibroslicer。新皮質は、振動翼を向くように組織ブロックを向けます。氷冷0.1 M PB中vibroslicer( 図1A)と140ミクロンで扁桃体を含むスライスの冠状切片、、、、同じ緩衝液中で6ウェル皿にそれらを収集。
- 実体顕微鏡下では、関心領域をトリムスライスから(ここでは、ITCの内外背paracapsularクラスタは、 図1Bを参照してください)。眼科用メスを用いて、シリコーンエラストマーで被覆し、0.1 M PBで満たされたペトリ皿にこれを行います。トリミングされたブロックは、スペーサ(約1.5ミリメートル)( 図1B)の穴に収まることを確認します。
- 6ºCで凍結保護溶液(0.1 M PB中の30%グリセロール)O / Nにトリミングされたブロックを移動します。
3.高圧凍結
注:FRILは6重要なステップで構成されています( 図2):高圧(2300で1)急速凍結 - 試料の2600バール)。試料の2)破砕。原形質(P-面)に隣接している半分と外またはexoplasmicスペースに隣接している半分(E-:破断面は、一般的に2つの半膜リーフレットにそれらを分割、凍結した膜の中心疎水性コアを以下の面)。 3)白金及び炭素の真空蒸着法により試料の複製を。組織の4)洗剤消化。 5)イムノゴールドラベリング。透過型電子顕微鏡を用いてレプリカ6)分析。
- 銅担体の調製
注:FRIL手順の連続段階を経て処理される、検体は、金属(金または銅)キャリアに装着する必要があります。これらのキャリアは、破砕し、中古機械の種類のモードに応じてサイズやデザインに変わります。ここでは、銅のキャリア( 図1B、E)とヒンジ付き「ダブルレプリカ表」を使用しました;開いたときには、凍結標本( 図2)を介して引っ張り破断を生成する、( 図3B参照)。これは、骨折した試験片の両側を保持し、複製することを可能にします。- セーム皮のシートを使用して変色除去とポーランドの銅キャリア。
- ガラスポットとクリーンに入れキャリア二回超音波処理水浴中の非イオン性界面活性剤(pH約1.5)とは、その後広範囲に脱イオン水、続いて水道水で洗った後、エタノールで二回すすいでください。
- 15分間アセトン中の銅キャリアを超音波処理します。
- 乾燥するために濾紙上にキャリアを置きます。
- トリミングされたブロック(キャリアを保持する)のためによく保持となる銅キャリア( 図1C)に両面テープのリングを取り付けます。
- 検体の凍結
注:注意して液体窒素を処理し、適切なゴーグルを身に着けています。- 無料の高圧をオンにします熱意ユニット( 図1F)、検体の凍結始まる前に少なくとも1.5時間。
- 「風ヒーター」ボタンを押して、加熱を開始し、50分間ベークアウト。 80℃まで気温を設定します。
- 高圧冷凍ユニットへの窒素タンクを接続し、液体窒素で内部デュワーを埋めるために「窒素」ボタンを押してください。 「窒素LEVEL」ランプが点灯します。 「冷却」ボタンを押すことで冷却を開始します。
- 「窒素濃度が「出て行くときにボタン "IN DRIVE」を押してください。油圧システムは、前後に3回ピストンを動かしていることを確認してください。
- 「AUTO」ボタンを押すと、「窒素」ボタンを押してください。すぐに "READY"が点灯として、高圧冷凍ユニットは、高圧凍結の準備ができています。
- AGに溶融した白金線のループを使用して両面テープ( 図1B)の穴にトリミングされたブロックを配置小娘ピペット。
- ろ紙やブラシを使用して、凍結保護剤過剰の溶液を除去します。
注:この手順は、組織の周りに形成してもよいし、組織の形状および/または超微細構造の歪みを引き起こす可能性がある気泡を除去することも重要です。 - 組織ブロックは、2つのキャリアの間に挟まれるように、実体顕微鏡下では、他のキャリアとキャリア保持をカバーしています。
- 高圧冷凍ユニット( 図1D)の試料ホルダーへのキャリアサンドイッチを挿入します。高圧冷凍ユニットに試料ホルダーを挿入します(先端を下)と試料ホルダーにねじ込んで固定します。
- 「ジェット・オート」ボタンを押して、冷凍サイクルを開始します。可能な限り迅速に作業を、試料ホルダーを削除して、絶縁された箱の中に液体窒素で先端を沈めます。それらを冷却するために液体窒素中で鉗子の二対の先端を浸します。
- 慎重に目を削除します試料ホルダーから電子キャリアサンドイッチと予め冷却クライオバイアルに入れてください。キャリアが唯一の液体窒素で冷却されたピンセットで扱われていることを確認します。クライオバイアルは、窒素がバイアル( 図1G)から流出できるようにするために穿孔されるべきです。
- すべての希望するサンプルが凍結されるまで繰り返して、3.2.11に3.2.6を繰り返します。サンプルの同じタイプを含む複数のキャリアのサンドイッチは、同じバイアル中で保存することができます。
- レプリケーション( 図1H)までcryotankのキャリアを含むクライオバイアルに保管してください。

図1.組織調製し、高圧凍結。(A)Vibroslicerはセクションに組織を使用。 (B)扁桃体を含む得られた冠状マウス脳切片は、交流と並んで示されopperキャリアは、両面テープのリングを装備します。破線のボックスには、ITCの内側paracapsularクラスタが含まれている関心のある領域を示しています。両面テープの穴の直径は約1.5mmです。 (C)銅キャリアの製造のためのツール。両面テープ、ピンセット、パンチャー、銅キャリア、およびはさみ:時計回りで左上から。 (D)高圧凍結用試料ホルダーへのキャリアサンドイッチの挿入。キャリアサンドイッチは試料ホルダの穴の中に配置されます。 (E)銅キャリア両面テープのリングと「キャリア・サンドイッチ」なしとしています。 (F)加圧タンクがそれに液体窒素を供給するとともに高圧冷凍ユニット。 (G)凍結組織をストックするクリオバイアル。窒素ガスをバイアル(矢じり)から流出することを可能にバイアルの上部中央位置の穴に注意してください。 >(H)Cryotankは凍結組織を保存するため。 この図の拡大版をご覧になるにはこちらをクリックしてください。
4.フリーズフラクチャーおよびレプリケーション
- 電子ビーム銃の調製
- 電子ビーム銃を挿入する前に、「偏向板」でシールドを取り外します。下カソードカバーを介してコレットチャックにフィラメントをセンタリングするための「設定ゲージ」を配置します。
注:小径端白金銃のためのものであるのに対し、設定ゲージの大径側端部は、カーボンガンのために使用されます。 - 「圧力ラミナ」まで、ゲージの上に新しいフィラメントをスライドさせてフィラメントコイルが角度で位置していないことを確認して、フィラメントの両端をクランプすることができます。
- 設定ゲージを取り外し、炭素棒を挿入します。共締めてそれを修正します蒸発器ロッドホルダーのlletチャック、ロッドの端部の高さは下から2番目のコイルの中央にあることを確実にします。プラチナ銃の場合、プラチナロッドの端部の高さは、上から第2フィラメントコイルの中央にあるべきです。
- 偏向板を交換し、凍結破砕ユニットに銃を挿入します。使用後砂ブラスターと銃をきれいにしてください。
- 電子ビーム銃を挿入する前に、「偏向板」でシールドを取り外します。下カソードカバーを介してコレットチャックにフィラメントをセンタリングするための「設定ゲージ」を配置します。
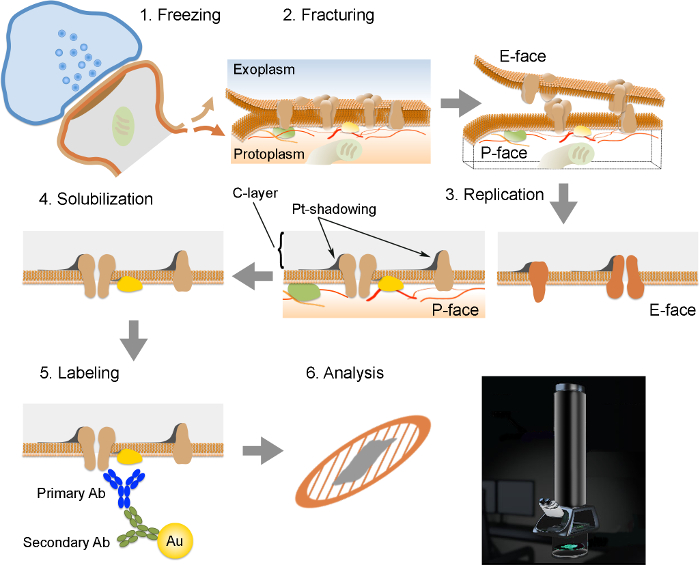
図FRIL技術の重要なステップの2.イラスト。
レプリカの調製および分析のために必要なさまざまな手順の概要。 (1)組織の高圧凍結を。 (2)破砕。凍結組織の破壊時に、原形質膜の脂質二重層は、疎水性界面に二等分に分割されます。原形質膜中のタンパク質はexoplasmic(E-面)またはプロトのいずれかに割り当てられています形質膜(P-顔)。 (3)レプリケーション。炭素(C)の蒸発は、骨折、組織の表面上に、脂質及びタンパク質を捕捉します。材料は、60°の角度でシャドーイングのために2 nmの白金/炭素でコーティングされ、その後、レプリカ(C-層、白金 - シャドウイング)の構造を強化する別の15 nmの炭素層とされています。 (4)可溶化。レプリカ膜に捕捉されていない組織は、その後、SDS溶液で可溶化します。 (5)ラベリング。目的のタンパク質は、特異的一次抗体(一次抗体)及び金粒子(金)とコンジュゲート二次抗体(二次抗体)からなる複合体を使用して、レプリカ上で可視化することができます。金粒子の異なるサイズの使用は、同じレプリカで複数のタンパク質の検出を可能にします。 (6)免疫標識した後、複製は、銅メッシュグリッド上に収集され、80での透過型電子顕微鏡で分析- 100 kVのCLICくださいこの図の拡大版をご覧になるにはこちらをk個。
- 凍結破砕装置のセットアップ
- 凍結破砕および複製手順の詳細については1に主電源を回すことにより凍結破砕装置( 図3A)のスイッチをオンにし、メーカーが提供する取扱説明書を参照してください。
- 凍結破砕装置を冷却する前に、暖かい空気とのユニットの冷却システム全体を焼きます。プレスMTC 010デバイス(温度制御ユニット)( 図3A)の「解凍」ボタンと45分間ベークアウト処理の実行をしてみましょう。
- 真空ステーションを有効にします。 10 -7ミリバール-凍結骨折部は通常、約10 -6の真空範囲で動作します。
- 窒素タンクを記入し、凍結破砕ユニットに接続します。バルブホルダが乾燥していることを確認し、また、バルブホルダの挿入前タンクのエントリをきれいに(湿度がvacuuに干渉することができますタンクのN 2充填のメートルと表示)。
- ℃〜-115に温度を設定することにより、冷却を開始します。冷却は約45分かかります。
- 電子ビーム銃を挿入し、蒸発させるための次のパラメータに到達するために電流と電圧を調整します。
カーボン銃:上の回転、位置90°、炭素蓄積の率0.1から0.2ナノメートル/秒
炭素 - 白金銃:オフの回転、位置60°、蓄積0.06のレート - 0.1ナノメートル/秒
注:ガンは、炭素または白金棒の交換後に初めて使用された場合、使用する前に、3分間脱気。
- 破砕およびレプリケーション
- すべての操作は、液体窒素中で行われていることを確認することの二重のレプリカテーブルに凍結されたキャリア・サンドイッチを挿入します。
- デュワー瓶に二重のレプリカ表を移し、45°の角度で試料ステージの受信機にそれを修正。液体窒素レベルは常に二重レプリカテーブルの上でなければなりません。
- テーブルマニピュレータとの二重のレプリカテーブルをピックアップし、コールドステージ上に凍結破砕ユニットに挿入します。ダブルレプリカ表の温度は-115℃に調整できるようにするために約20分を待ちます。
- 真空は10 -6ミリバール未満であり、温度は-115℃であることを確認してください。
- ダブルレプリカテーブルの上に置いシュラウドに接続されたホイールの手動反時計回りの回転によって組織を骨折。シュラウドが回転すると、それは、組織を破砕、開くにはダブルレプリカ表を強制します。
- 凍結破砕装置( 図3A)のEVM 030デバイス(電子ビーム蒸着制御ユニット)の「ハイテンション」ボタンを押してください。
- 一方向SHADO続いて、5nmの厚さに対して90°の角度で位置する電子ビーム銃による炭素(回転)を蒸 発させることにより破砕組織( 図3C)の露出表面を複製2nmの厚さに60°の角度で白金炭素と翼。最後に、90°の角度(回転)から炭素の15 nmの厚さの層を適用します。
- 蒸発させるための次のパラメータを使用します。
第一炭素:上の回転、位置90°;スピード0.1から0.2ナノメートル/秒。 5 nmの
第二炭素 - 白金:位置60°;スピード0.06から0.1 nmの/秒。 2 nmの
第三炭素:上の回転、位置90°;スピード0.3から0.5ナノメートル/秒。 15 nmの - (トリス、pHが7.4を緩衝食塩水)凍結破壊ユニットから複製標本を削除し、セラミック12ウェルプレートTBSで満たされた( 図4A)に転送します。
- 白金耳の線材を使用して、試料キャリア( 図4A)から複製された組織を除去します。
- すべてのサンプルが複製されるまで繰り返して、4.3.10に4.3.1を繰り返します。
 R /> 図3.凍結破砕およびレプリケーション。
R /> 図3.凍結破砕およびレプリケーション。
(A)凍結破砕装置。マシンはいくつかのコントロールユニットとモニターが含まれています。試験片は、チャンバの左側のポートを介してチャンバ内に導入されます。加圧された液体窒素の容器は、ステージを冷却するために凍結破砕ユニットに接続されています。ショー拡大単位(UPC 010とMDC 010)のうちの2つのビューと第2の炭素層の蒸発時にパラメータを表示するモニター下の画像。 (B)がオープン(左)と二重レプリカ表の(右)ビューを閉じました。 「キャリアサンドイッチ "は(矢印で示す)は、テーブルのスロットに挿入されています。小型武器は、操作中に脱落から「キャリア・サンドイッチ」を防ぎます。 (C)骨折とレプリケートサンプル。レプリカは、骨折した組織の上に薄く黒いフィルムが表示されます。53 / 53853fig3large.jpg "ターゲット=" _空白 ">この図の拡大版をご覧になるにはこちらをクリックしてください。
- レプリカのSDS-消化
- SDS-消化緩衝液(2.5%ラウリル硫酸ナトリウム、15 mMトリス、pHが8.3で20%ショ糖)の1mlで満たさを4mlガラスバイアルに移しレプリカ。 (45ストローク/分)を振盪しながら80℃で18時間ダイジェスト。
- RTでSDS-消化緩衝液や店舗で満たされた新しいチューブにレプリカを転送します。
5.免疫標識
注:すべてのインキュベーションは、抗体とのインキュベーションを除いて、穏やかに振とうしながら室温で行われています。
- 新鮮なSDS-消化緩衝液中で10分間のレプリカを洗ってください。
- TBS中の2.5 5分間TBS中の%のBSA(ウシ血清アルブミン)、その後3×10分間0.1で%BSAで一度複製を洗います。
- 1時間、5%BSAを含むTBS中の非特異的結合部位をブロックします。
- 一次抗を適用します体は、2%BSA-TBSで希釈しました。 72時間15°C( 図4C)で湿潤チャンバー内30μlの低下( 図4B)でインキュベーションを行います。
- この研究のために骨折した組織から、プロセスの両方のレプリカを。アミノ酸660をカバーする組換え融合タンパク質に対して惹起またはマウスモノクローナル抗体(200:1希釈)すべてのAMPA-Rサブユニットに共通のマウスのGluR1の754 - アミノ酸717に対して惹起モルモットポリクローナル抗体で1レプリカをインキュベート - NMDA-RのNR1サブユニットの811(希釈1:500)、および緑色蛍光タンパク質に対して惹起されたウサギポリクローナル抗体(希釈1:300)。
- (1:500希釈)ラットμオピオイド受容体の398 - 酸384アミノ酸に対応する合成ペプチドに対するウサギポリクローナル抗体を用いて他のレプリカをインキュベートします。
- 0.05%BSAを含むTBS中で洗浄(3×5分)。
- 二次抗体を適用します。この研究のuのためにSE金の2%BSAを含むTBSで希釈したコンジュゲート抗体(イオンチャネル型グルタミン酸受容体、μオピオイド受容体に対する10および/またはにChR2-YFPのための15 nmのための5 nm)を。二次抗体を1:30希釈し、15℃のCO / Nで30μlのドロップでインキュベートします。
- RTで0.05%BSA-TBSで3×5分間洗浄します。
- 超純水で2×5分間洗浄します。
- ホルムバールコーティングされた100行の並列バーグリッド( 図4D)のマウントレプリカ。
6.レプリカ解析
- 80または100キロボルトでの透過型電子顕微鏡(TEM)による像のレプリカ。 CCD(電荷結合素子)カメラを介してデジタル画像を取得します。
- オフラインでは、ランドマークを使用して、両方のレプリカ( 図4E)からの画像に対応する領域を見つけます。 J.は、シナプス後領域と分析受容体に対する免疫金標識粒子の数を決定するイメージを使用してデジタル画像を分析します。

図4.レプリカの免疫標識。
(A)のレプリカを操作し、洗浄するためのツール。セラミック12ウェルプレート(右上)とガラスピペットの2種類(左上)。丸い先端(左下)を有するガラスピペットは、レプリカを転送するために使用され、白金ロッド(下部中央)を有するピペットはレプリカを展開するために使用されます。洗浄緩衝液中のレプリカ(右下)。レプリカの(B)免疫標識は、組織培養6ウェルプレートのウェルにパラフィルムの小片上に配置された小滴(30μL)中で行われます。レプリカは、抗体を含む緩衝液滴で覆われていることに注意してください。蒸発を防ぐために、ティッシュペーパーの湿潤部分はウェルの内縁の周囲に取り付けられています。 (C)免疫標識ステップのためのインキュベーター。インキュベーションは15℃で行われます。 (D)ホルムバール被覆に搭載されたレプリカ100-ライン並列バーグリッド。 (E)のレプリカのペアから低倍率の顕微鏡写真。点線の四角は、対応するレプリカ内の位置を特定するために3つの代表的なランドマークを示しています。スケールバー:10μmです。すべてのデータが示されている平均値±SEM 、この図の拡大版をご覧になるにはこちらをクリックしてください。
結果
FRIL技術は、微生物起源21、 すなわち、原形質膜に統合し、効果的に軸索に沿って順行性輸送チャネルの光遺伝学アクチュエータの発現と組み合わせたときに、定義されたサブグループで定量的にAMPA-RやNMDA-Rのシナプス後の発現を調べることができますシナプスの。これは、扁桃体におけるITCニューロン上に( 例えば、PIN / MGN)の別個の視床核由来の軸索のためにここに表示されます。このアプローチは、ITCニューロン、これまで詳細な解剖学的および分子特性に不応性であったセルのグループへの個々の感覚入力のシナプスの分子分析を可能にします。
PIN / MGNへのrAAV-のChR2-YFPの定位注射後4週間、にChR2-YFP陽性の軸索は密に私はLA、amygdalostriatal遷移領域(アストリア)と内側paracapsularを神経支配します扁桃体におけるTCクラスタ、以前のトレースの研究16、22と完全に一致したパターン。我々はまたのrAAV-にChR2-YFP-から凍結破砕レプリカに軸索と端末のP-面上にChR2-YFPのための免疫標識強烈な金を検出注射したマウス( 図5A)ではなく、非注射したマウスからのレプリカインチレプリカでのグルタミン酸作動性シナプスのシナプス後膜の特殊化は、原形質膜2、23のE-面上の膜内粒子(インプレッション)のクラスタとして観察することができ、多くの場合、そのシナプス前血漿膜7のP-顔を伴っています( 図5B、C)。これらの機能は、PIN / MGNの軸索末端( 図5及び6)によって形成されたグルタミン酸作動性シナプスのシナプス後特化を同定することを可能にしました。我々は、NMDA-Rは必須のNR1サブユニットに対する抗体を用いて検出したのに対し、すべての4つのサブユニット(GluA1-4)を認識する抗体でAMPA-Rの標識。
「FO:キープtogether.within-ページを= "ntent 1">は、これらのシナプスは樹状突起棘またはITCニューロンのシャフトで作られたかどうか、同じレプリカで検出するためのツールの不足のため、我々はμのために、対応するレプリカ顔をラベル付けITCニューロンは、これらの受容体24のシナプス後部を高レベルで発現するようなオピオイド受容体は、これは、ランドマークを用いた戦略を使用して2つの複製( 図5C-F及び図6A-D)と同じシナプス後のプロファイルの識別を必要とした ( 図4E) 。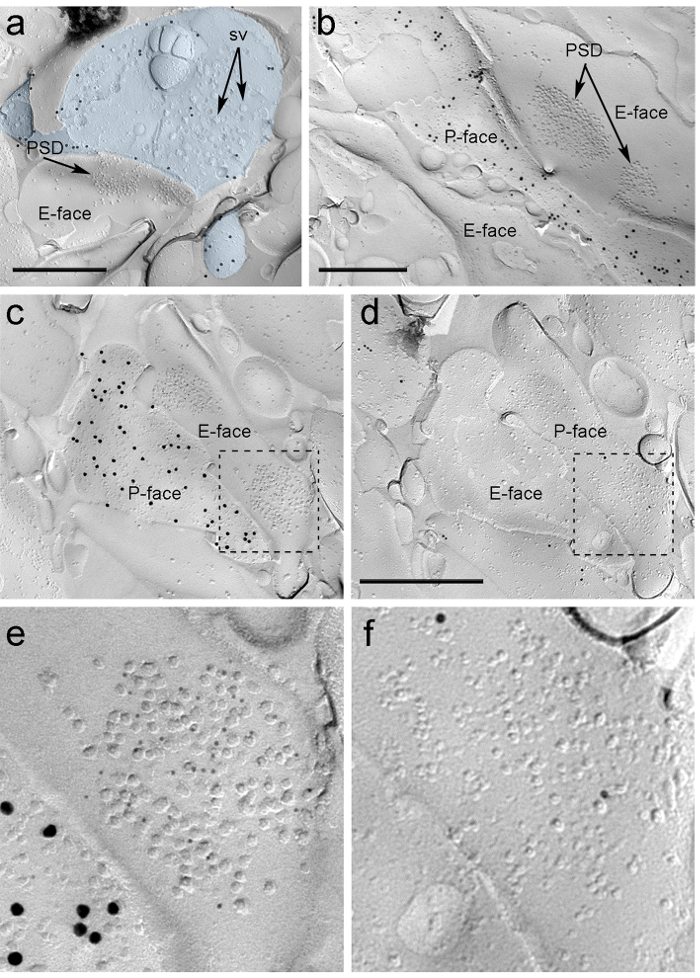
図5.イムノゴールド粒子によるレプリカ上にChR2-YFPおよびイオンチャネル型グルタミン酸受容体の検出。(A)クロス破砕軸索末端(水色)とにChR2-YFPを検出する15 nmの金粒子で標識され、そのP-顔の小さな部分。端末内、膜OF多数のシナプス小胞を観察することができる(SV)。形質膜に限定され、大部分の免疫標識の特異性を注意してください。 ChR2のためのラベリングは、PIN / MGNから発信などの端末を識別します。端末は、背骨と非対称シナプスを形成しています。 E-顔にシナプス後膜の特殊化(PSD)は、膜内粒子の特性クラスタを示し、AMPA-Rのを明らかに5 nmの金粒子で標識されています。 (B)(15 nmの金粒子で標識された)にChR2を発現する軸索のP-面は2樹状突起、NMDA-Rのを明らかに5 nmの金粒子で標識された2のPSDを有するそれらのいずれかに隣接示されています。 (CD)PIN / MGN-ITCのシナプスの前およびシナプス後膜の両面。 (C)末端のP-faceがにChR2を発現し(15 nmの金粒子で標識された)と2つの樹状突起のシャフト、AMPA-ルピー(5 nmの金粒子)のために標識2のPSDを含むそれらのいずれかのE-顔の上に延びています。 ( D)2樹状突起の対応するP-faceがμオピオイド受容体(10 nmの金粒子)のために標識されます。 (EF)破線で概説された領域の拡大図。スケールバー:500 nmで、この図の拡大版をご覧になるにはこちらをクリックしてください。
PIN / MGN-ITCのシナプスにおけるAMPA-RのためのImmunoparticlesは、シナプス後特化( 図5E)内の均一な分布を示唆している、すべてのIMPクラスタ上で発見されました。 AMPA-Rラベルの有意に高い(対応のないt検定のp <0.018)の密度は、PIN / MGNで観察されたシナプスに比べITCの棘(715±38金粒子/μm2であり、n = 32)にシナプスITCの樹状突起上に(590 ±44金粒子/μm2であり、n = 32)。全体的に、PIN / MGN-ITCシナプスにおけるAMPA-Rの濃度が比較的低いを示しました分散(変動係数、CV = 0.37)均一な分布と一致しました。
PIN / MGN-ITCシナプスにおけるNMDA-RのためのImmunoparticlesは、多くの場合、不均一シナプス後IMPクラスター( 図5B)内に分布が観察されました。 NMDA-Rラベルの密度は(不対t検定p = 0.39)PIN / MGNは、ITCの棘上にシナプス間で同様であった(1070±153金粒子/μm2であり、n = 8)およびITCの樹状突起(812±183金粒子/ μm2であり、n = 9)。 AMPA-Rのために観察されたものとは異なり、PIN / MGN-ITCシナプスにおけるNMDA-Rの密度は(= 0.54 CV)非常に変動しました。

図6. AMPA-Rや特定されたPIN / MGN-ITCシナプスにおけるNMDA-Rの免疫標識。
(AB)PIN / MGN-ITCの前およびシナプス後膜の両面シナプスは、端末のP-顔がにChR2(15 nmの金粒子で標識された)を発現し、樹状突起棘上にPSDは、AMPA-ルピー(5 nmの金粒子)のために標識された樹状突起棘の上に作られました。 (CD)破線で概説された領域の拡大図。これらの領域は、PSDのより良いビューを可能にするために、約45°反時計回りに回転させてきました。 (E)ITCの棘と樹状突起におけるシナプス面積に対するAMPA-R粒子の数の散布図。両方の構造では、正の相関が観察されています。 (F)ITCの棘と樹状突起におけるシナプス面積に対するNMDA-R粒子の数の散布図。有意な正の相関が唯一の樹状突起棘で検出されました。スケールバー:500 nmで、この図の拡大版をご覧になるにはこちらをクリックしてください。
なぜなら面積0.032 平方 μm、範囲を意味する:多くの場合、部分的にシナプス後IMPクラスタを重ねシナプス前細胞膜のP-顔は、我々はシナプス(棘の30%のみのシナプス面積を推定できた0.063 平方 μmに0.007を、N = 8;樹状突起:0.047μm2で、範囲:0.166μmの2から0.024、N = 11)。以前に分析終脳グルタミン酸が25をシナプスこれらは、同様の範囲内でした。
両方の棘と樹状突起では、個々のシナプスにおけるAMPA-Rのためのゴールドimmunoparticlesの数が積極シナプス面積と相関していた(スピアマン、棘:R = 0.88、樹状突起:R = 0.60、P <0.0001)( 図6E)。逆に、NMDA-Rのためのゴールドimmunoparticlesの数はスパインにおけるシナプス面積と相関することが見出された(スピアマン、棘:R = 0.90、P <0.002)ではなく、樹状突起(R = 0.21、P = 0.29)( 図6F )。
ディスカッション
フリーズフラクチャー電子顕微鏡は、40年以上にわたり超微細構造研究の主要な技術となっています。しかし、膜の分子組成を研究するための有効な手段の欠如は、その使用の大幅な下落をもたらしました。近年、免疫標識1、2、すなわちFRIL技術によって内在性膜タンパク質を明らかにするのに有効な方法の開発にフリーズフラクチャー電子顕微鏡の主要な回復がありました。
FRIL技術は、他の免疫超の方法に比べていくつかの利点を有しています。まず、タンパク質は、高感度化抗体に容易にアクセス可能です。第二に、レプリカの二次元表面上のそのようなシナプス後膜などの細胞膜の特殊化、大部分の露出がセリの面倒で時間のかかる再構成することなく、目的の分子の空間分布と物理的連続の検査を可能にしますアル超薄切片。第三に、原形質膜の両半分の利用可能性は、適切な抗体が入手可能で設け、各個々の構造のために標識することができるタンパク質の数を増加させます。破砕の際、分割膜の疎水性面は、破断面上に残ったタンパク質ドメインをentrenches炭素白金で被覆されています。これは、これらのドメイン内の抗原に対する抗体のアクセスを防止します。レプリカのP面上に、例えば原形質空間に面するだけエピトープが、一方のみの抗体によって結合され得るexoplasmic空間に面するエピトープE面に、抗体によって検出することができる( 図2参照 )。
一方、FRIL技術も一定の限界2被ります。骨折がランダムに発生すると、特定の細胞または構造を標的とすることは困難かもしれません。これはまた、FRAの異なる確率を考えると、シナプスコレクションに、例えば 、サンプリングバイアスにつながることができます異なる曲率(シャフト対例えば、棘)を有する構造の膜に沿ってcturing。また、二つの面の一方の膜タンパク質の割り当てが予測不可能です。そのため、特に定量的研究のためのP-顔やE-顔へのタンパク質の分布は、慎重に細胞内および細胞外ドメインに反応する抗体を用いて検討する必要があります。唯一の形態学的特徴に基づいたときに最後に、このようなシナプス前軸索終末のような特定の構造のレプリカで識別は、困難な場合があります。しかし、マーカータンパク質に特異的な抗体の使用またはウイルスベクターを用いてタグ付けされた内在性膜タンパク質またはチャネルの形質導入は、骨折した膜の同定を容易にするために追加のツールを提供します。例えば、この研究では、シナプス後私を明らかにするためにμオピオイド受容体に対する扁桃体や標識におけるそれらの軸索遠心性神経を識別するために、視床ニューロンでのChR2-YFPの導入の利点を取りましたITCニューロンのmbranes。
正常FRIL技術を実行するために、特別な注意が組織固定に関して取られるべきです。強い組織固定(> 2%パラホルムアルデヒド)は、クロス骨折の高い速度と標識感度の低下をもたらすことができます。一方、弱い凝視は、組織の取り扱いと準備(セクションの例えば、切断)困難を作ります。トリミングブロックの厚さは、両面テープの厚さと一致するように制御することも重要です。試験片の厚さは、テープよりも低い場合には、組織の表面は、2つの金属担体の表面に付着していない場合があり、その結果、凍結試料が破断されていません。組織が厚い場合、2つの銅キャリアのサンドイッチが行われたとき、それは避けられない構造の歪みで圧縮されます。 (このプロトコールにおいて、C〜115)試料を破断する温度も重要な役割を果たしていますレプリカの構造に関する。より高い温度は、前又は蒸発の間に組織の表面上の水蒸気の凝縮としてアーチファクトのより高い速度を生成することができます。より低い温度(<-125℃)破壊時の材料から分裂のリスクを高めることができます。この材料は、試料の表面上に落下またはそれへの接続を維持することができます。材料のこれらのフレークは、画像上のダークスポットを生成するコーティングし、対比されます。より低い温度で破砕することも、特に、樹状突起棘のような小さな微細構造のためクロス骨折の頻度に影響を与えることができます。レプリカの製造における更なる重要なステップは、界面活性剤の消化です。消化が不完全である場合は、未消化の組織は、TEMでの構造の分析を混乱させる、レプリカ上のような暗いパッチを表示されます。また、未消化の組織は、バックグラウンド標識を大きくする、非特異的にトラップまたは結合する抗体をすることができます。一方、使用洗剤の組織消化のためのsが、その二次および三次構造を変えるレプリカに関連する分子を変性させることができます。したがって、特定の抗原のためにそれは徐々に追加の洗浄工程でSDSの濃度を希釈する必要があるかもしれません。
免疫標識のために、二次抗体と結合金粒子の異なるサイズの利用可能性はあっても、そのようなシナプス後特化などの原形質膜の特定のマイクロドメインに、同時に検出することができますが、定性的にのみ、複数のタンパク質。しかし、立体障害のために、定量的な研究は、一般的にただ一つの分子の検出に限定されています。金粒子のサイズはまた、標識効率に影響を与えることができます。
FRILでのラベリングの解釈については、それが原因で柔軟性のある複雑な形にイムノゴールド粒子は抗原20から25ナノメートルの半径を有する半球内のどこにでも配置することができることを心に留めておくべきです一次および二次抗体26によって編。 FRILと関連技術の理論と実践の詳細については、我々は他の方法論の記事27、28にも読者を参照してください。
FRIL技術は最近30、多様なシナプス集団29におけるグルタミン酸受容体の局在化の高解像度の定量分析のために使用されている。また、AMPA-RのためのFRIL法の検出感度は、一つの機能AMPAごとに免疫粒子として高いと推定されました-Rチャンネル29。したがって、このアプローチは、定量化し、中央のシナプスにおけるAMPA-RやNMDA-Rのシナプス後発現パターンを分析するために全体的に非常に便利です。ここで、我々は、PIN / MGN-ITCのシナプスで最も可能性の高い重要な恐怖条件付けの間に米国の情報を中継するためのサイトをその適用性を実証しました。 AMPA受容体サブユニットのGluの高度に保存された細胞外アミノ酸残基に対する抗体を用いてA1-GluA4は、我々は、シナプス後膜の特殊化に対応したIMPクラスタ内の金粒子の均一な分布を発見しました。 ITCの棘におけるAMPA-Rの密度は、PIN / MGN視床求心性神経が標的とシャフトのシナプスに比べて有意に高かったです。両方の背骨とシャフトシナプスで、AMPA-Rのための標識及びシナプス後領域との間に正の相関が、他のグルタミン酸作動性シナプス25に共通の特徴を検出しました。 PIN / MGN-ITCのシナプスにおけるAMPA-Rの密度の低い分散は、皮質のシナプス25から視床遠心性神経7によって形成された他のシナプスに似てますが、別の均一な分布を示しています。逆に、NMDA-Rの密度は、より多くの変数であり、AMPA-Rのとは異なる規制を示唆している背骨とシャフトのシナプス間で差がなかったです。将来的には、FRIL技術の高い再現性が中枢シナプスの基礎分子組成を評価することを可能にするだけでなく、Cの検出を容易にすることができます恐怖学習後のイオンチャネル型グルタミン酸受容体の数とシナプス下分布のhanges、これらの入力の前と後シナプス特性のex vivoでの録音を補完します。
結論として、このアプローチは、入力起点をほぐしている他の多くの神経回路における入力特異的興奮性シナプスの構造 - 機能関係への洞察を得るために他の研究者によって使用することができ、シナプス後要素の性質及び組成は重要しかし問題があります。
開示事項
The authors declare that they have no competing financial interests.
謝辞
Funding was provided by the Austrian Science Fund FWF grant No. P-22969-B11 to F. Ferraguti, and by the Charitable Hertie Foundation and the Werner Reichardt Centre for Integrative Neuroscience and by the DFG (CIN-Exc. 307) to I. Ehrlich.
資料
| Name | Company | Catalog Number | Comments |
| Surgery | |||
| Stereotactic frame | Stoelting, USA | 51670 | can be replaced by other stereotactic frame for mice |
| Steretoxic frame mouse adaptor | Stoelting, USA | 51625 | |
| Gas anesthesia mask for mice | Stoelting, USA | 50264 | no longer available, replaced by item no. 51609M |
| Pressure injection device, Toohey Spritzer | Toohey Company, USA | T25-2-900 | other pressure injection devices (e.g. Picospritzer) can be used |
| Kwik Fill glass capillaries | World Precision Instruments, Germany | 1B150F-4 | |
| Anesthesia machine, IsoFlo | Eickemeyer, Germany | 213261 | |
| DC Temperature Controler and heating pad | FHC, USA | 40-90-8D | |
| Horizontal Micropipette Puller Model P-1000 | Sutter Instruments, USA | P-1000 | |
| Surgical tool sterilizer, Sterilizator 75 | Melag, Germany | 08754200 | |
| rAAV-hSyn-ChR2(H134R)-eYFP (serotype 2/9) | Penn Vector Core, USA | AV-9-26973P | |
| fast green | Roth, Germany | 0301.1 | |
| Isoflurane Anesthetic, Isofuran CP (1ml/ml) | CP Pharma, Germany | ||
| Antiseptic, Betadine (providone-iodine) | Purdure Products, USA | BSOL32 | can be replaced by other disinfectants |
| Analgesic, Metacam Solution (5mg/ml meloxicam) | Boehringer Ingelheim, Germany | can be replaced by other analgesics | |
| Bepanthen eye ointment | Bayer, Germany | 0191 | can be replaced by other eye ointments |
| Drill NM3000 (SNKG1341 and SNIH1681) | Nouvag, Switzerland | ||
| Sutranox Suture Needle | Fine Science Tools, Germany | 12050-01 | |
| Braided Silk Suture | Fine Science Tools, Germany | 18020-60 | |
| Name | Company | Catalog Number | Comments |
| Tissue preparation | |||
| Paraformaldehyde EM grade | Agar Scientific Ltd., United Kingdom | AGR1018 | |
| Saturated picric acid solution | Sigma-Aldrich, USA | P6744-1GA | |
| Na2HPO4-2H20 | Merck Millipore, Germany | 1065860500 | |
| NaH2PO4-2H2O | Merck Millipore, Germany | 1063451000 | |
| NaCl | Merck Millipore, Germany | 1064041000 | |
| 4N NaOH | Carl Roth, Germany | T198.1 | |
| Thiopental | Sandoz, Austria | 5,133 | |
| Glycerol | Sigma-Aldrich, USA | G5516-500ML | |
| GenPure ultrapure water system | Thermo Fisher Scientific, USA | 50131235 | |
| Peristaltic pump | ISMATEC, Germany | ISM 930C | |
| Filter Paper | MACHEREY-NAGEL, Germany | MN 615 1/4 | |
| Vibroslicer, VT1000S | Leica Microsystems, Austria | ||
| Ophthalmic scalpel | Alcon Laboratories, USA | can be replaced by other ophthalmic scalpels | |
| Perfusion cannula | Vieweg, Germany | F560088-1 | can be replaced by similar items from other companies |
| Name | Company | Catalog Number | Comments |
| High-pressure Freezing | |||
| Copper carriers | Engineering Office M. Wohlwend, CH | 528 | |
| Sidol Polish | Henkel, Germany | can be replaced by same item from other companies | |
| Chamois skin | Household supply store | ||
| Hole punch, 1,5mm | Stubai, Austria | can be replaced by same item from other companies | |
| Denatured ethanol | Donauchem, Austria | can be replaced by same item from other companies | |
| Aceton | Roth, Germany | 9372.5 | CAUTION! |
| High Pressure Freezing Machine HPM 010 | BalTec, CH; now Leica Microsystems | HPM010 | not produced any more, substituted by LeicaEM HPM100 |
| Stereo-microscope | Olympus, Japan | SZX10 | |
| Liquid nitrogen | CAUTION! | ||
| Cryo-vials | Roth, Germany | E309.1 | can be replaced by same item from other companies |
| CryoCane | Nalge Nunc International,USA | 5015-0001 | can be replaced by same item from other companies |
| CryoSleeve | Nalge Nunc International,USA | 5016-0001 | can be replaced by same item from other companies |
| Liquid nitrogen storage vessel | Cryopal, France | GT38 | can be replaced by same item from other companies |
| Non-ionic detergent (Lavocid) | Werner & Mertz Professional, Germany | ||
| Name | Company | Catalog Number | Comments |
| Freeze-fracture and Replication | |||
| Sandblaster, Mikromat 200-1 | JOKE Joisten & Kettenbaum, Germany | SANDURET 2-K | can be replaced by same item from other companies |
| Siliciumcarbid SIC 360, grain size 25 - 21µ | JOKE Joisten & Kettenbaum, Germany | 955932 | |
| Freeze Fracture System BAF 060 | BalTec, CH; now Leica Microsystems | BAF060 | |
| Ceramic 12 well plate | Gröpel, Austria | 14511 | can be replaced by same item from other companies |
| Trizma base | SIGMA, USA | T1503 | can be replaced by same item from other companies |
| Trizma hydrochloride | SIGMA, USA | T3253 | can be replaced by same item from other companies |
| Sodium chloride | Merck, Germany | 1,064,041,000 | can be replaced by same item from other companies |
| SDS, Sodium lauryl sulfate | Roth, Germany | 5136.1 | CAUTION! ; can be replaced by same item from other companies |
| Sucrose | Merck, Germany | 1,076,871,000 | can be replaced by same item from other companies |
| TRIS | Roth, Germany | 5429.3 | can be replaced by same item from other companies |
| Universal Hybridization Oven | Binder, Germany | 7001-0050 | can be replaced by same item from other companies |
| Name | Company | Catalog Number | Comments |
| Immunolabelling | |||
| BSA | SIGMA, USA | A9647 | can be replaced by same item from other companies |
| Anti-GFP Antibody | Molecular Probes, USA | A11122 | |
| Anti-pan-AMPAR Antibody | Frontier Institute, Japan | pan AMPAR-GP-Af580-1 | |
| Anti-NMDAR1 Antibody, clone 54.1 | Merck Millipore, Germany | MAB363 | |
| Opioid Receptor-Mu (MOR) Antibody | ImmunoStar, USA | 24216 | |
| EM goat anti-guinea pig, 5nm; secondary antibody | BBInternational, | EM.GAG5 | |
| EM goat anti-rabbit, 15nm; secondary antibody | BBInternational, | EM.GAR15 | |
| Donkey anti-rabbit, 10nm, secondary antibody | AURION, Netherlands | DAR 10nm | |
| Copper grids, 100 Parallel Bar | Agar scientific, UK | G2012C | |
| Incubator | Major Science, USA | MO-RC | can be replaced by same item from other companies |
| Pioloform Powder | Agar scientific, UK | R1275 | |
| Chloroform | Roth, Germany | 3313.1 | CAUTION! ; can be replaced by same item from other companies |
| Name | Company | Catalog Number | Comments |
| EM analysis | |||
| Philips CM120 TEM | Philips/FEI | ||
| Morada CCD camera | Soft Imaging Systems, Germany | ||
| iTEM Ver. 5.2, imaging software | Soft Imaging Systems, Germany | ||
参考文献
- Fujimoto, K. SDS-digested freeze-fracture replica labeling electron microscopy to study the two-dimensional distribution of integral membrane proteins and phospholipids in biomembranes: practical procedure, interpretation and application. Histochem Cell Biol. 107 (2), 87-96 (1997).
- Masugi-Tokita, M., Shigemoto, R. High-resolution quantitative visualization of glutamate and GABA receptors at central synapses. Curr Opin Neurobiol. 17 (3), 387-393 (2007).
- Rash, J. E., Yasumura, T. Direct immunogold labeling of connexins and aquaporin-4 in freeze-fracture replicas of liver, brain, and spinal cord: factors limiting quantitative analysis. Cell Tissue Res. 296 (2), 307-321 (1999).
- Emes, R. D., Grant, S. G. Evolution of synapse complexity and diversity. Annu Rev Neurosci. 35, 111-131 (2012).
- Matsuzaki, M., et al. Dendritic spine geometry is critical for AMPA receptor expression in hippocampal CA1 pyramidal neurons. Nat Neurosci. 4 (11), 1086-1092 (2001).
- Rollenhagen, A., Lübke, J. H. The morphology of excitatory central synapses: from structure to function. Cell Tissue Res. 326 (2), 221-237 (2006).
- Tarusawa, E., et al. Input-specific intrasynaptic arrangements of ionotropic glutamate receptors and their impact on postsynaptic responses. J Neurosci. 29 (41), 12896-12908 (2009).
- Nusser, Z., et al. Cell type and pathway dependence of synaptic AMPA receptor number and variability in the hippocampus. Neuron. 21 (3), 545-559 (1998).
- Nyìri, G., Stephenson, F. A., Freund, T. F., Somogyi, P. Large variability in synaptic N-methyl-D-aspartate receptor density on interneurons and a comparison with pyramidal-cell spines in the rat hippocampus. Neuroscience. 119 (2), 347-363 (2003).
- Nicholson, D. A., Geinisman, Y. Axospinous synaptic subtype-specific differences in structure, size, ionotropic receptor expression, and connectivity in apical dendritic regions of rat hippocampal CA1 pyramidal neurons. J Comp Neurol. 512 (3), 399-418 (2009).
- Millhouse, O. E. The intercalated cells of the amygdala. J Comp Neurol. 247 (2), 246-271 (1986).
- Busti, D., et al. Different fear states engage distinct networks within the intercalated cell clusters of the amygdala. J Neurosci. 31 (13), 5131-5144 (2011).
- Amano, T., Unal, C. T., Paré, D. Synaptic correlates of fear extinction in the amygdala. Nat Neurosci. 13 (4), 489-494 (2010).
- Duvarci, S., Pare, D. Amygdala microcircuits controlling learned fear. Neuron. 82 (5), 966-980 (2014).
- Jüngling, K., et al. Neuropeptide S-mediated control of fear expression and extinction: role of intercalated GABAergic neurons in the amygdala. Neuron. 59 (2), 298-310 (2008).
- Asede, D., Bosch, D., Lüthi, A., Ferraguti, F., Ehrlich, I. Sensory inputs to intercalated cells provide fear-learning modulated inhibition to the basolateral amygdala. Neuron. 86 (2), 541-554 (2015).
- Maren, S. Neurobiology of Pavlovian fear conditioning. Annu Rev Neurosci. 24, 897-931 (2001).
- Pape, H. C., Pare, D. Plastic synaptic networks of the amygdala for the acquisition, expression, and extinction of conditioned fear. Physiol Rev. 90 (2), 419-463 (2010).
- Sigurdsson, T., et al. Long-term potentiation in the amygdala: a cellular mechanism of fear learning and memory. Neuropharmacology. 52 (1), 215-227 (2007).
- Bosch, D., Asede, D., Ehrlich, I. Ex-vivo optogenetic dissection of fear circuits in brain slices. J. Vis. Exp. (110), e53628 (2016).
- Fenno, L., Yizhar, O., Deisseroth, K. The development and application of optogenetics. Annu Rev Neurosci. 34, 389-412 (2011).
- Bienvenu, T. C. M., et al. Large intercalated neurons of amygdala relay noxious sensory information. J. Neurosci. 35 (5), 2044-2057 (2015).
- Sandri, C., Akert, K., Livingston, R. B., Moor, H. Particle aggregations at specialized sites in freeze-etched postsynaptic membranes. Brain Res. 41 (1), 1-16 (1972).
- Likhtik, E., Popa, D., Apergis-Schoute, J., Fidacaro, G. A., Paré, D. Amygdala intercalated neurons are required for expression of fear extinction. Nature. 454 (7204), 642-645 (2008).
- Fukazawa, Y., Shigemoto, R. Intra-synapse-type and inter-synapse-type relationships between synaptic size and AMPAR expression. Curr Opin Neurobiol. 22 (3), 446-452 (2012).
- Amiry-Moghaddam, M., Ottersen, O. P. Immunogold cytochemistry in neuroscience. Nat Neurosci. 16 (7), 798-804 (2013).
- Fukazawa, Y., Masugi-Tokita, M., Tarusawa, E., Hagiwara, A., Shigemoto, R., Cavalier, A., et al. SDS-digested Freeze-fracture replica labelling (SDS-FRL). Handbook of Cryo-Preparation Methods for Electron Microscopy. , 567-586 (2007).
- Severs, N. J. Freeze-fracture electron microscopy. Nat Protoc. 2 (3), 547-576 (2007).
- Tanaka, J., et al. Number and density of AMPA receptors in single synapses in immature cerebellum. J Neurosci. 25 (4), 799-807 (2005).
- Mansouri, M., et al. Distinct subsynaptic localization of type 1 metabotropic glutamate receptors at glutamatergic and GABAergic synapses in the rodent cerebellar cortex. Eur J Neurosci. 41 (2), 157-167 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved