Method Article
Combinato optogenetic e Freeze-frattura Replica immunomarcatura per esaminare specifica disposizione-Input di glutammato recettori nell'amigdala mouse
In questo articolo
Riepilogo
This article illustrates how the expression of neurotransmitter receptors can be quantified and the pattern analyzed at synapses with identified pre and postsynaptic elements using a combination of viral transduction of optogenetic tools and the freeze-fracture replica immunolabeling technique.
Abstract
microscopia elettronica freeze-frattura è stata una tecnica importante nella ricerca ultrastrutturali per oltre 40 anni. Tuttavia, la mancanza di mezzi efficaci per studiare la composizione molecolare delle membrane ha prodotto un calo significativo nel suo utilizzo. Recentemente, c'è stata una grande rinascita in freeze-frattura di microscopia elettronica grazie allo sviluppo di modi efficaci per rivelare proteine integrali di membrana mediante l'etichettatura immunogold. Uno di questi metodi è noto come detergente-solubilizzato Fermo-frattura Replica immunomarcatura (FRIL).
La combinazione della tecnica FRIL con optogenetics consente un'analisi correlata delle proprietà strutturali e funzionali delle sinapsi centrali. Usando questo approccio, è possibile identificare e caratterizzare neuroni sia pre-e post-sinaptici dai rispettivi espressione di un channelrhodopsin etichettato e marcatori molecolari specifici. L'aspetto distintivo della specializzazione membrana post-sinaptica di GlutamatErgic sinapsi consente inoltre, su etichettatura dei recettori del glutammato ionotropi, per quantificare e analizzare la distribuzione intrasynaptic di questi recettori. Qui, diamo una descrizione step-by-step delle procedure richieste per la preparazione repliche associato e come immunolabel loro. Discuteremo anche gli avvertimenti e le limitazioni della tecnica FRIL, in particolare quelli associati con potenziali errori di campionamento. L'elevata riproducibilità e la versatilità della tecnica FRIL, quando combinato con optogenetics, offre un approccio molto potente per la caratterizzazione dei diversi aspetti della trasmissione sinaptica a microcircuiti neuronali identificate nel cervello.
Qui, forniamo un esempio di come questo approccio è stato utilizzato per acquisire conoscenze in relazioni struttura-funzione delle sinapsi eccitatorie in neuroni delle masse di cellule intercalate dell'amigdala mouse. In particolare, abbiamo studiato l'espressione dei recettori del glutammato ionotropici agli ingressi identificate oiginated dal intralaminare posteriore del talamo e nuclei genicolati mediale. Queste sinapsi sono stati mostrati per trasmettere informazioni sensoriali rilevanti per l'apprendimento e la paura di subire cambiamenti plastici sulla paura condizionata.
Introduzione
La definizione dell'architettura funzionale di biomembrane a scala nanometrica è stata contestata negli ultimi anni dallo sviluppo di una serie di tecniche immunomarcatura adatti per la microscopia elettronica a trasmissione. Tuttavia, queste tecniche, ad esempio, pre e post-embedding immunogold, hanno un certo numero di importanti limitazioni, che includono scarsa rilevazione di antigeni e / o valutazione quantitativa limitata di proteine di membrana. Queste limitazioni diventano particolarmente critico nelle indagini della struttura fine del sistema nervoso, caratterizzato da un elevato grado di diversità delle cellule e sinapsi eterogeneità. Questa eterogeneità risultati di diversità sia strutturale e funzionale dettata dagli elementi pre-e post-sinaptici e con l'espressione differenziale, arricchimento, o interazione di proteine di segnalazione, come ad esempio i recettori, i trasportatori e le molecole effettrici.
Un nuovo approccio per immunolabe direttaling di proteine di membrana integrali o reticolate in repliche freeze-frattura detergente-solubilizzato (FRIL) è stata originariamente introdotta da Fujimoto due decenni fa 1. Questo metodo originale aveva, tuttavia, alcune limitazioni, per esempio, una grave frammentazione delle repliche, che hanno ostacolato le correlazioni significative di molecole marcate con celle mappate individualmente in tessuti complessi come il cervello. Circa 10 anni fa, e Shigemoto Fukazawa progressivamente migliorato la tecnica 2. Questo è stato di pari passo con gli sforzi di un altro gruppo di scienziati presso i laboratori Boulder della Colorado State University, che ha anche migliorato in modo significativo la tecnica, in particolare per lo studio delle giunzioni 3.
Il miglioramento protocolli freeze-fratturazione e macchine, nonché l'introduzione di congelamento rapido (ad alta pressione), consente ora investigatori di produrre repliche ininterrotta di esemplari di dimensioni relativamente grandi e hiimmagini di qualità gh della maggior parte dei componenti cellulari, senza le limitazioni ed i manufatti prodotti dai forti fissazioni chimici.
La tecnica FRIL offre il grande vantaggio di una elevata quantitativa nell'identificazione situ di uno o più proteine (simultaneamente) in istologicamente mappati e cellule citologicamente individuati all'interno dei tessuti complessi come il cervello, con il vantaggio aggiuntivo di una vista in pianta di pre- e postsinaptico elementi in una singola replica. Pertanto, la tecnica FRIL, nonostante i suoi molti ostacoli tecnici, mantiene la promessa per un numero di molto significative scoperte scientifiche, in particolare per la correlazione delle proprietà strutturali e funzionali di singole sinapsi. Durante gli ultimi decenni, una grande quantità di informazioni sono state ottenute sulla struttura, molecolare compongono, e la funzione fisiologica di sinapsi; eppure sinapsi sono morfologicamente e molecolarmente molto diversi a seconda della pa pre e post-sinapticaaffitto neuroni 4. Solo per una manciata di tipi di sinapsi sono stati studi struttura-funzione realizzato finora 5-7. Ciò è dovuto principalmente al vincoli tecnici che impedivano una precisa identificazione della natura degli elementi pre- e postsinaptici.
Analisi ultrastrutturale ha fornito spunti critici nella variabilità delle specializzazioni post-sinaptici di membrana attraverso contatti sinaptici distinti, sia in termini di dimensioni sinaptica e contenuti in recettori per i neurotrasmettitori 6, che ha un grande impatto sulla forza e la plasticità della trasmissione sinaptica. Inoltre, un grande corpo di ricerca indica che il numero di recettori del glutammato ionotropici espressi a diversi tipi di sinapsi è regolata in modo afferent- e bersaglio-dipendenti 7-10.
Qui, un metodo viene descritto che permette l'analisi della composizione struttura e recettori di membrana specializzazioni postsinaptici Con definireelementi presinaptici d e funzione. Questo approccio sfrutta espressione presinaptica di recente sviluppo proteine algali sensibili alla luce, come Channelrhodopsin2 (ChR2), e della tecnica FRIL per analizzare il pattern di espressione postsinaptico di α-ammino-3-idrossi-5-metil-4-isoxazolepropionic L'acido (AMPA-R) e N-metil-D-aspartato (NMDA-R) recettori del glutammato. Questo è dimostrato a livello delle sinapsi formate da assoni provenienti dai nuclei posteriori genicolati talamo-mediali (PIN / MGN) sui neuroni delle masse di cellule intercalate dell'amigdala (ITC). Neuroni ITC sono piccole celle GABAergici spinosi organizzate in cluster che circondano il complesso basolaterale amigdaloideo (BLA) 11, 12. Neuroni ITC sono noti per ricevere input eccitatori da BLA neuroni principali e di indirizzare il nucleo centrale (CEA), fungendo così da un cancello inibitorio per il flusso di informazioni tra il BLA e CEA 12-15.
Recentemente, abbiamo dimostrato che l'ITNeuroni C situati nel cluster medio-dorsale tra il BLA e CEA ricevono anche gli ingressi eccitatori diretti e convergenti da sensoriali regioni corticali del talamo e temporali, che sono modificati sulla paura di apprendimento durante pavloviano paura condizionata uditivo 16. La paura condizionata è una delle forme più comprensibili di apprendimento associativo in termini di meccanismi cerebrali. Nel condizionamento alla paura, un inizialmente neutrale stimolo condizionato (CS, ad esempio, un tono) è accoppiato con uno stimolo avversivo incondizionato (Stati Uniti, ad esempio, una scossa piede dolce) con un conseguente associazione CS-US e condizionato risposta di paura 17, 18. Excitatory ingressi da entrambe le aree talamiche e neocorticale, che trasportano le informazioni che rappresentano il CS e gli stati Uniti, rispettivamente, erano noti per convergere su neuroni piramidali del nucleo laterale dell'amigdala (lA) e a subire la plasticità 19. Il nostro lavoro precedente ha rivelato che le informazioni di input sensoriale è anche in parallelo trasmesso ai neuroni ITC 16.
Come primo passo verso una analisi molecolare meccanicistica di input sensoriali singole sinapsi sui neuroni ITC, abbiamo utilizzato un virus adeno-associato (AAV) per esprimere ChR2 etichettato con la proteina fluorescente gialla (YFP). Il AAV è stata iniettata PIN / MGN ei terminali assoni sono stati identificati dal loro espressione di ChR2-YFP. Abbiamo utilizzato entrambe le facce generati dalla tecnica FRIL per valutare la densità di post-sinaptici AMPA-R e NMDA-R a livello delle sinapsi formate con ITC neuroni di terminali degli assoni PIN / MGN.
Protocollo
Le procedure che coinvolgono soggetti animali sono stati approvati dal Regierungspraesidium Tübingen, Stato del Baden-Württemberg, in Germania, e dalla sperimentazione animale Etico Consiglio austriaca, ed erano in conformità con la direttiva UE sull'uso degli animali nella ricerca.
1. stereotassica iniezioni di AAV-Channelrhodopsin2-YFP
NOTA: iniezioni stereotassica sono state effettuate secondo un protocollo precedentemente pubblicato 20.
- Preparare strumenti sterili riscaldandoli a 180 ° C per 1,5 ore.
- Tirare taglienti pipette di vetro (~ 50 micron di diametro) per preparazioni iniettabili con un estrattore microelettrodo orizzontale impostato con i seguenti parametri: Calore = valore di rampa - 20, Pull = 0, velocità = 100, Tempo = 200, pressione = 200.
NOTA: il valore di rampa deve essere determinato per ogni lotto di pipette di vetro acquistate in base alle istruzioni fornite dal produttore micropipetta estrattore. - Premix 1 ml di soluzione di virus e 0,2 ml di soluzione verde veloce 0,1% (per una migliore visibilità della soluzione nella pipetta di vetro) in fosfato sterile salina tamponata (PBS; 25 mM, 0,9% NaCl, pH 7,4). Riempire la pipetta di vetro utilizzando un 10 microlitri pipetta e gel-fil punte. Per il costrutto virale, utilizzare rAAV-hSyn-ChR2 (H134R) -eYFP (sierotipo 2/9).
- Anestetizzare il mouse utilizzando un piccolo dispositivo di animali anestesia (3% isoflurano in ossigeno per induzione). Uso. Per questo studio, usare 3 topi wild-type di età compresa tra ~ 6 settimane.
- Radersi la testa tra le orecchie e gli occhi e disinfettare con una soluzione basata iodopovidone.
- Applicare una pomata oculare per evitare l'essiccazione degli occhi durante l'anestesia. Sottocutanea iniettare mouse con analgesici (meloxicam-based, 0,1 ml di una soluzione 5 mg / ml).
- Posizionare il mouse nella cornice stereotassica e mantenere l'anestesia tramite un dispositivo di anestesia di gas (2% isoflurano in ossigeno per la manutenzione). Controllare la profondità dell'anestesia dalla mancanza di un ritiro artoreflex prima di continuare.
- Mantenere condizioni sterili nel miglior modo possibile durante tutta la procedura chirurgica. Indossare una maschera facciale usa e getta, un camice e guanti chirurgici.
- Effettuare una incisione cutanea di circa 1 cm sulla parte superiore della testa con le forbici 20. Tirare delicatamente la pelle a lato con pinze smussato, fissare con fascette per esporre superficie del cranio e cranio pulito con H 2 O 2.
- siti di iniezione segno sul cranio con un bel pennarello indelebile punta. Praticare un piccolo foro (circa 1 mm di diametro) nel cranio nel sito marcata. Per unilaterale iniezione PIN / MGN in questo stallone, utilizzare le seguenti coordinate: dal bregma (mm): 3,0 posteriori, laterali ± 1.8, 3.8 ventrali.
- Mount riempito pipetta di vetro sul telaio stereotassico collegato ad un dispositivo di iniezione a pressione e portare la pipetta per bregma posizione.
- Rompere la punta della pipetta di vetro con pinza sottile punta diritta. Assicurarsi che la punta della pipetta è aperto da che appga impulsi pochi pressione e osservando estrusione di gocce di soluzione di virus.
- Vai alle coordinate iniezione desiderati e iniettare la metà del contenuto della pipetta (~ 0,5 ml) utilizzando le seguenti impostazioni del dispositivo di iniezione a pressione: pressione 20 psi, lunghezza di impulso media 30 ms, il numero medio di impulsi 50.
- Lasciare pipetta in posizione per ~ 1 min prima lentamente (1 mm / min) richiamo della medesima.
- cranio pulito con PBS (pH 7,4) e rimuovere i morsetti. Tirare delicatamente la pelle insieme, e suturare l'incisione (3 - 4 nodi). Applicare il disinfettante (iodopovidone based) intorno alla ferita.
- Arrestare il anestesia e non lasciare incustodita il mouse fino a quando completamente sveglio. Mantenere topi singolo-alloggiati. Dopo l'intervento, continuerà a monitorare lo stato di salute; se necessario amministrare analgesico.
- Mantenere gli animali per 4 settimane prima della fissazione del cervello al fine di garantire adeguati livelli di espressione virale.
2. Preparazione del campione
- Cervello fissazione </ Strong>
- Preparazione del fissativo
- Per 1 L di fissativo, pesare 10 g di paraformaldeide e aggiungerlo a 300 ml di H 2 O. deionizzata Calore a 55 - 60 ° C per ~ 10 minuti con agitazione continua.
- Spegnere il fuoco e aggiungere 7 - 8 gocce di 4 N NaOH. La soluzione dovrebbe diventare chiaro nel ~ 10 min.
- Lasciare raffreddare a RT, aggiungere 150 ml di una soluzione satura di acido picrico e portarlo a 500 ml con H 2 O. deionizzata
- Aggiungere 500 ml di 0,2 M tampone fosfato (PB). Filtro con carta da filtro. Regolare il pH a 7,4 con NaOH.
- Raffreddare il fissativo a 6 ° C, conservare in bottiglie di vetro scuro per non più di un giorno a 6 ° C.
- transcardiac perfusione
- Anestetizzare topi con un'iniezione intraperitoneale di tiopentale (120 mg / kg di peso corporeo). Assicurarsi che l'animale è profondamente anestetizzato controllando il rifl pedale ritiroex, che dovrebbe essere assente. Posto l'animale sul dorso su un tavolo perfusione con quattro estremità legato.
- Aprire la parete addominale longitudinalmente con le forbici smussato-end e fare due ulteriori tagli lateralmente lungo il confine caudale della gabbia toracica, per esporre il diaframma. Tagliare il diaframma e tagliare la parete toracica al confine osteocartilageneous su entrambi i lati. Sollevare la fine caudale della lastra centrale della parete toracica contenente sterno per esporre il cuore.
- Rimuovere il pericardio, fare un piccolo taglio preciso nella punta del ventricolo sinistro di ammettere la cannula della perfusione. Usare una cannula smussata con un diametro interno di 0,6 mm. Far passare la cannula dolcemente attraverso il ventricolo fino alla punta appare in aorta ascendente e fissare la cannula con una fascetta. Per consentire il sangue e perfusates per uscire dal flusso sanguigno, fare un taglio nell'atrio destro.
- topi profumato transcardially utilizzando una pompa peristaltica ad una portata5 ml / min dapprima con PBS (25 mM, 0,9% NaCl, pH 7,4) per circa 1 min, seguito da fissativo ghiaccio fredda per 7 min.
- Dopo la fissazione, tagliare la testa del mouse con un paio di forbici e poi tagliare la pelle attraverso la linea mediana dal collo a naso. Rimuovere il muscolo per esporre completamente il cranio.
- Utilizzando forbici affilate, fare un taglio longitudinale occipitale e le ossa interparietale partire dal foro occipitale. Utilizzando una pinzetta sottile rimuovere queste ossa per esporre tutto il cervelletto. Poi fare un altro taglio longitudinale parietale e ossa frontali fino all'osso nasale e rimuoverle con una pinzetta per esporre l'intero cervello.
- Utilizzando una spatola rimuovere il cervello senza danneggiarlo, e metterlo in ghiacciata 0.1 M PB.
- Preparazione del fissativo
- Sezionamento e rifilatura dei provini
- Tagliare un blocco coronale di circa 5 - 6 mm con lamette contenenti l'area di interesse. Incollarla sul supporto diil vibroslicer con una colla cianoacrilato. Orientare il blocco di tessuto in modo che la neocorteccia affaccia sulla lama vibrante. Fetta sezioni coronali, contenenti l'amigdala, a 140 micron con il vibroslicer (Figura 1A) in ghiacciata 0,1 M PB, e raccoglierli in un piatto da 6 pozzetti nello stesso tampone.
- Sotto uno stereomicroscopio, tagliare fuori la regione di interesse (qui, il cluster paracapsular medio-dorsale della ITC, vedi Figura 1B) dalla fetta. Fate questo in una capsula di Petri con rivestimento in elastomero siliconico e riempito con 0,1 M PB, utilizzando un bisturi oftalmico. Assicurarsi che i blocchi tagliati inseriscono nel foro del distanziale (circa 1,5 mm) (Figura 1B).
- Spostare i blocchi tagliati in soluzione crioprotezione (30% glicerolo in 0,1 M PB) O / N a 6 ° C.
3. congelamento ad alta pressione
NOTA: Il FRIL è composto da 6 fasi essenziali (Figura 2): 1) congelamento rapido ad alta pressione (a 2.300 - 2.600 bar) del campione. 2) fratturazione del campione. Il piano di frattura generalmente segue il nucleo centrale idrofobico delle membrane congelati, dividendoli in due volantini semi-membrana: un mezzo che si trova adiacente al protoplasm (P-viso) e mezzo che si trova adiacente allo spazio extracellulare o exoplasmic (E- faccia). 3) La replica della provetta sottovuoto deposizione di platino e carbonio. 4) Detergente-digestione dei tessuti. 5) l'etichettatura Immunogold. 6) Analisi della replica utilizzando un microscopio elettronico a trasmissione.
- Preparazione dei vettori di rame
NOTA: Per essere gestita attraverso le fasi successive della procedura FRIL, i campioni devono essere montati su metallo (oro o rame) i vettori. Questi vettori variano in dimensioni e disegno secondo la modalità di fratturazione e tipo di macchine usate. Qui abbiamo utilizzato vettori di rame (Figura 1B, E) e una "tabella di replica doppio" cerniera; (vedere Figura 3B), che una volta aperto produce una frattura di trazione attraverso il campione congelato (Figura 2). Questo permette di mantenere e replicare entrambi lati del campione fratturati.- portatori di rame polacchi con un dispositivo di rimozione appannamento utilizzando un foglio di pelle di camoscio.
- vettori luogo in un vaso di vetro e pulita due volte con un detergente non ionico (pH ~ 1.5) in un bagno d'acqua sonicating, poi ampiamente lavare in acqua corrente e poi con acqua deionizzata e poi sciacquare due volte con etanolo.
- Sonicare i portatori di rame in acetone per 15 min.
- Posizionare i supporti su carta da filtro ad asciugare.
- Fissare un anello di nastro biadesivo ad un vettore di rame (Figura 1C), che servirà come la tenuta bene per il (carrier tenuta) blocco tagliato.
- Il congelamento del campione
NOTA: maneggiare azoto liquido con cura e indossare occhiali appropriati.- Accendere l'alta pressione liberaUnità zing (Figura 1F) almeno 1,5 ore prima di iniziare con il congelamento del campione.
- Inizia il riscaldamento premendo il tasto "riscaldatore ad aria", e cuocere per 50 min. Impostare la temperatura dell'aria a 80 ° C.
- Collegare il serbatoio di azoto all'unità di congelamento ad alta pressione e premere il tasto "AZOTO" per riempire l'interno Dewar con azoto liquido. La spia "AZOTO LEVEL" su. Inizia raffreddamento premendo il tasto "raffreddamento".
- Premere il tasto "DRIVE IN" quando il "AZOTO LEVEL" si spegne. Verificare che il sistema idraulico muove il pistone avanti e indietro 3 volte.
- Premere il pulsante "AUTO" e il pulsante "AZOTO". Non appena "READY" si accende, l'unità di congelamento ad alta pressione è pronto per l'alta pressione di congelamento.
- Collocare un blocco tagliato nel foro del nastro biadesivo (Figura 1B) utilizzando un'ansa filo di platino che è stato sciolto in agpipetta lass.
- Rimuovere l'eccesso di soluzione crioprotettore utilizzando carta da filtro o una spazzola.
NOTA: Questa procedura è importante anche per rimuovere le bolle d'aria che possono formare intorno al tessuto e che potrebbe provocare una distorsione della forma tessuti e / o ultrastruttura. - Sotto uno stereomicroscopio, coprire il vettore tenuta con un altro vettore, in modo che il blocco di tessuto è inserita tra i due vettori.
- Inserire il carrier-panino nel supporto del campione di gruppo ad alta pressione di congelamento (Figura 1D). Inserire il supporto del campione nel gruppo ad alta pressione di congelamento (punta verso il basso) e fissarlo avvitando nel supporto del campione.
- Avviare il ciclo di congelamento premendo il tasto "Jet-Auto". Lavorando più rapidamente possibile, rimuovere il portacampione e immergere la punta con azoto liquido in una scatola isolata. Immergere la punta delle due coppie di pinze in azoto liquido per raffreddarli.
- Rimuovere con attenzione esimoe carrier-panino da parte del titolare del campione e collocarlo in una provetta Microbank ™ pre-raffreddata. Assicurarsi che i vettori sono curati solo con una pinza raffreddato con azoto liquido. Cryovials dovrebbero essere forati per consentire l'azoto di fuoriuscire dal flacone (Figura 1G).
- Ripetere i punti 3.2.6 a 3.2.11 fino a quando tutti i campioni desiderati sono stati congelati. Molteplici carrier-panini contenenti lo stesso tipo di campione possono essere memorizzati nella stessa fiala.
- Conservare le cryovials contenenti i vettori in un cryotank finché la replica (Figura 1 ora).

Figura 1. Preparazione del tessuto e di congelamento ad alta pressione. (A) Vibroslicer utilizzati per la sezione di tessuto. (B) Un risultante sezione cervello di topo coronale contenente lato amigdala mostrato a fianco con accarrier Opper dotato di un anello di nastro biadesivo. La casella tratteggiata indica l'area di interesse che contiene il cluster paracapsular mediale della ITC. Il diametro del foro del nastro biadesivo è di circa 1,5 mm. (C) gli utensili per la preparazione di supporti in rame. Da in alto a sinistra in senso orario: nastro biadesivo, pinzette, perforatore, vettori di rame, e forbici. (D) Inserimento del carrier-panino nel portacampione per alta pressione di congelamento. Il vettore-panino viene inserito nel foro del supporto del campione. Vettori di rame (E) senza e con un anello di nastro biadesivo e il "carrier-sandwich". (F) unità alta pressione congelamento con serbatoio pressurizzato alimentando azoto liquido ad esso. (G) A esageratamente per fare scorta dei tessuti congelati. Notare i fori nella posizione superiore-metà del flaconcino permettendo azoto gassoso di fluire dalla fiala (freccia). (H) Cryotank per la memorizzazione del tessuto congelato. Si prega di cliccare qui per vedere una versione più grande di questa figura.
4. Fermo-frattura e replica
- Preparazione dei cannoni a fascio di elettroni
- Prima di inserire i cannoni del fascio elettronico, rimuovere lo scudo con il "deflettore". Posizionare il "misuratore impostazione" per centrare il filamento nella pinza di serraggio attraverso il coperchio catodico inferiore.
NOTA: L'estremità di diametro maggiore della sagoma impostazione viene utilizzata per la pistola di carbonio mentre l'estremità di diametro minore è la pistola platino. - Far scorrere il nuovo filamento sul manometro fino "lamine pressione" può serrare le estremità del filamento, assicurando che la bobina filamento non sta in un angolo.
- Rimuovere il calibro e inserire l'asta di carbonio. Risolvere il problema stringendo il cochuck llet del porta aste evaporatore, assicurando che l'altezza dell'estremità dell'asta è a metà della seconda bobina dal basso. Per la pistola platino, l'altezza dell'estremità dell'asta platino dovrebbe essere al centro della seconda bobina filamento dall'alto.
- Sostituire il deflettore e inserire le pistole nell'unità frattura congelamento. Pulire le armi con una sabbiatrice dopo l'uso.
- Prima di inserire i cannoni del fascio elettronico, rimuovere lo scudo con il "deflettore". Posizionare il "misuratore impostazione" per centrare il filamento nella pinza di serraggio attraverso il coperchio catodico inferiore.
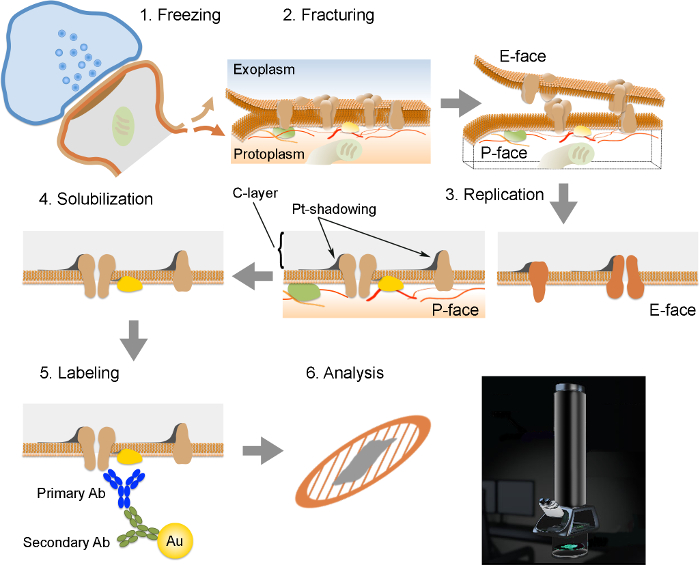
Figura 2. Illustrazione dei passaggi chiave della tecnica FRIL.
Schema delle diverse fasi necessarie per la preparazione e l'analisi di replica. (1) il congelamento ad alta pressione del tessuto. (2) fratturazione. Durante frattura di tessuto congelato, il doppio strato lipidico delle membrane plasmatiche è divisa in due metà all'interfaccia idrofoba. Le proteine della membrana plasmatica sono allocati sulla sia il exoplasmic (E-viso) o protomembrane plasmiche (P-viso). (3) replica. L'evaporazione di carbonio (C) intrappola lipidi e proteine sulla superficie del tessuto fratturato. Il materiale è rivestita con 2 nm platino / carbonio per shadowing ad un angolo di 60 °, e poi con un altro strato di carbonio 15 nm che rinforza la struttura della replica (C-strato, Pt-shadowing). (4) solubilizzazione. Il tessuto non intrappolato dalla membrana replica è quindi solubilizzato con SDS-soluzione. (5) Etichettatura. Le proteine di interesse possono essere visualizzati sulla replica utilizzando un complesso costituito da anticorpi specifici primari (primaria AB) e anticorpi secondari (Ab secondario) coniugati con una particella d'oro (Au). L'uso di diverse dimensioni delle particelle d'oro permette la rilevazione di più di una proteina sulla stessa replica. (6) Dopo immunomarcatura, le repliche sono raccolti su griglie di maglia di rame e analizzate con un microscopio elettronico a trasmissione a 80 -. 100 kV prega CLICk qui per vedere una versione più grande di questa figura.
- Messa a punto di unità di frattura freeze
- Accendere l'unità di frattura congelamento (figura 3A) ruotando MAINS a 1. Per una descrizione dettagliata delle procedure di congelamento-frattura e di replica, vedere istruzioni per l'uso fornite dal produttore.
- Prima di raffreddamento del dispositivo di blocco-frattura, cuocere l'intero sistema di raffreddamento dell'unità di aria calda. Premere il tasto "Scongelamento" nel dispositivo MTC 010 (unità di controllo della temperatura) (Figura 3A) e far funzionare il processo di cottura per 45 minuti.
- Attivare la stazione di vuoto. L'unità frattura congelamento normalmente opera in un intervallo vuoto di ~ 10 -6 - 10 -7 mbar.
- Riempire il serbatoio di azoto e collegarlo all'unità frattura congelamento. Verificare che il titolare della valvola è secco e anche pulire l'ingresso del serbatoio prima dell'inserimento del supporto della valvola (umidità può interferire con vacuum e indicazione di N 2 riempimento del serbatoio).
- Inizia raffreddamento impostando la temperatura a -115 ° C. Raffreddamento dura circa 45 min.
- Inserire i cannoni a fascio di elettroni e regolare corrente e tensione per raggiungere i seguenti parametri per evaporazione:
pistola di carbonio: rotazione su, posizione a 90 °, tasso di accumulazione di carbonio 0.1 - 0.2 nm / sec
pistola Carbon-platino: la rotazione off, posizione 60 °, tasso di accumulazione 0,06-0,1 nm / sec
NOTA: Se una pistola viene utilizzato per la prima volta dopo la sostituzione della canna in carbonio o platino, degassare per 3 minuti prima dell'uso.
- Fratturazione e la replica
- Inserire congelati Carrier-sandwich in doppia tabella di replica assicurandosi che tutte le manipolazioni sono fatto in azoto liquido.
- Trasferire doppia tabella di replica di una nave Dewar e fissarlo al ricevitore fase del campione con un angolo di 45 °. Il livello di azoto liquido deve essere sempre al di sopra del tavolo doppia replica.
- Sollevare il tavolo doppio della replica con il manipolatore tavolo e inserirla nell'unità frattura congelamento sul palco freddo. Attendere circa 20 minuti per permettere alla temperatura del tavolo doppio replica di adattarsi a -115 ° C.
- Verificare che il vuoto è inferiore a 10 -6 mbar e la temperatura è -115 ° C.
- Fratturare il tessuto dal manuale rotazione antioraria della ruota collegata alla Sindone posto sopra il tavolo doppia replica. Quando la Sindone si trasforma, costringe la tabella doppia replica per aprire, fratturandosi il tessuto.
- Premere il tasto "alta tensione" nella (unità di controllo di evaporazione a fascio elettronico) 030 dispositivo EVM dell'unità frattura congelamento (Figura 3A).
- Replicare le superfici esposte del tessuto fratturato (Figura 3C) per evaporazione di carbonio (rotazione) per mezzo di un cannone elettronico posizionato ad un angolo di 90 ° ad uno spessore di 5 nm, seguita da una SHADO unidirezionaleala con platino-carbonio con un angolo di 60 ° ad uno spessore di 2 nm. Infine applicare una nm spesso strato di carbonio 15 da un angolo di 90 ° (girevole).
- Utilizzare i seguenti parametri per l'evaporazione:
1a carbonio: rotazione, posizione a 90 °; velocità 0.1 - 0.2 nm / sec; 5 nm
2 ° carbonio-platino: posizione di 60 °; Velocità ,06-0,1 nm / sec; 2 nm
3a carbonio: rotazione, posizione a 90 °; Velocità 0,3-,5 nm / sec; 15 nm - Rimuovere i campioni replicati dall'unità frattura congelamento e trasferirli ad una ceramica 12-pozzetti (Figura 4A) riempito con TBS (Tris tamponata salina, pH 7,4).
- Utilizzando una vergella un'ansa di platino, rimuovere il tessuto replicato dal supporto del campione (Figura 4A).
- Ripetere i punti da 4.3.1 a 4.3.10 fino a quando tutti i campioni sono stati replicati.
 r /> Figura 3. Fermo-fratturazione e di replica.
r /> Figura 3. Fermo-fratturazione e di replica.
(A) L'unità frattura congelamento. La macchina contiene diverse unità di controllo e un monitor. I campioni vengono introdotti nella camera attraverso una porta sul lato sinistro della camera. Un contenitore di azoto liquido in pressione viene collegato all'unità frattura congelamento per raffreddare la fase. Immagini sottostanti mostrano in scala ingrandita di due delle unità (UPC 010 e MDC 010) e il monitor visualizzazione dei parametri durante l'evaporazione del secondo strato di carbonio. (B) aperto (a sinistra) e chiusi (a destra) vista del tavolo doppia replica. Le "carrier-sandwich" sono inseriti nelle fessure del tavolo (indicati dalle frecce). Le armi di piccolo calibro impediscono "carrier-sandwich" di cadere durante la manipolazione. (C) Un campione fratturato e replicato. Le repliche appaiono pellicole in bianco sottili sulla parte superiore del tessuto fratturato.53 / 53853fig3large.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.
- SDS-digestione della replica
- replica Trasferire in una fiala di vetro 4 ml riempita con 1 ml di tampone SDS-digestione (2,5% di sodio laurilsolfato, 20% di saccarosio in 15 mM Tris, pH 8,3). Digest per 18 ore a 80 ° C con agitazione (45 tempi / min).
- Trasferimento repliche in un tubo riempito con tampone SDS-digestione e conservare a RT.
5. immunomarcatura
NOTA: Tutte le incubazioni vengono eseguite a temperatura ambiente agitando delicatamente, ad eccezione di incubazione con anticorpi.
- Lavare la replica per 10 min in tampone SDS-digestione fresco.
- Lavare la replica una volta con 2,5% BSA (albumina sierica bovina) in TBS per 5 minuti, quindi 3 x 10 minuti con 0,1% BSA in TBS.
- Blocco non specifici siti di legame in TBS con 5% di BSA per 1 ora.
- Applicare l'anti primariacorpi diluiti in 2% BSA-TBS. Eseguire incubazioni in una microlitri goccia 30 (Figura 4B) in una camera umida a 15 ° C per 72 ore (Figura 4C).
- Per questo studio, processo sia repliche dal tessuto fratturato. Incubare una replica con un anticorpo policlonale di cavia sollevata contro gli amminoacidi 717 - 754 del mouse GluR1 comune a tutte le sottounità AMPA-R (diluizione 1: 200) o un anticorpo monoclonale di topo sollevati contro una proteina di fusione ricombinante che copre gli amminoacidi 660 - 811 della subunità NR1 del NMDA-R (diluizione 1: 500), e un anticorpo policlonale di coniglio contro la proteina fluorescente verde (diluizione 1: 300).
- Incubare l'altra replica con un anticorpo policlonale di coniglio contro un peptide sintetico corrispondente agli amminoacidi 384 - 398 del ratto recettore μ-oppioidi (diluizione 1: 500).
- Lavare in TBS con 0,05% di BSA (3 x 5 min.).
- Applicare anticorpi secondari. Per questo studio uSE oro (5 nm per ionotropi recettori del glutammato, recettori 10 per μ-oppioidi e / o 15 nm per ChR2-YFP) anticorpi coniugati diluiti in TBS con il 2% BSA. Diluire anticorpi secondari 01:30 e incubare in un calo del 30 ml a 15 ° CO / N.
- Lavare 3 x 5 min a 0,05% BSA-TBS a temperatura ambiente.
- Lavare 2 x 5 minuti in acqua ultrapura.
- Replica Mount on-line 100 bar in parallelo griglia Formvar rivestite (Figura 4D).
6. Analisi Replica
- repliche di immagine con un microscopio elettronico a trasmissione (TEM) a 80 o 100 kV. Acquisire le immagini digitali attraverso un CCD (Charged Coupled Device) della fotocamera.
- Offline, trovare le regioni corrispondenti sulle immagini da entrambe le repliche che utilizzano punti di riferimento (Figura 4E). Analizzare le immagini digitali utilizzando Immagine J. determinare l'area post-sinaptica e il numero di particelle immunogold marcato diretto contro il recettore analizzato.

Figura 4. immunomarcatura di replica.
Strumenti (A) per la manipolazione e lavaggio repliche. A 12-pozzetti in ceramica (in alto a destra) e 2 tipi di pipette di vetro (in alto a sinistra). La pipetta di vetro con punta tonda (in basso a sinistra) è utilizzato per trasferire replica, e la pipetta con perno di platino (basso al centro) è utilizzato per svolgersi repliche. Una replica a tampone di lavaggio (in basso a destra). (B) immunomarcatura di repliche viene effettuata in gocce (30 microlitri) posti su un piccolo pezzo di parafilm in un pozzetto di una coltura tissutale 6 pozzetti. Si noti che una replica è coperto da una goccia di anticorpi tampone contenente. Per evitare l'evaporazione, un pezzo inumidito di carta velina è montato attorno al bordo interno del pozzo. (C) Incubatore per il passo immunomarcatura. Le incubazioni sono effettuate a 15 ° C. (D) Una replica montato su un formvar rivestite 100-linea della griglia barra di parallelo. (E) micrografie basso ingrandimento da una coppia di repliche. I quadrati tratteggiate indicano tre punti di riferimento tipici per identificare una posizione nelle repliche corrispondenti. barra della scala: 10 micron. Tutti i dati sono mostrati come media ± sem Cliccate qui per vedere una versione più grande di questa figura.
Risultati
La tecnica FRIL, quando combinato con l'espressione di attuatori optogenetic di origine microbica 21, vale a dire, i canali integrati nella membrana plasmatica ed efficace trasportati anterogradely lungo gli assoni, permette di esaminare quantitativamente l'espressione post-sinaptica di AMPA-R e NMDA-R in un sottogruppo definito delle sinapsi. Questo è mostrato qui per gli assoni provenienti da nuclei del talamo distinti (ad esempio, PIN / MGN) sui neuroni ITC nell'amigdala. Questo approccio consente una analisi molecolare di singole sinapsi di input sensoriali sui neuroni ITC, un gruppo di cellule che sono stati refrattari ad una caratterizzazione anatomica e molecolare dettagliato finora.
Quattro settimane dopo l'iniezione stereotassica del rAAV-ChR2-YFP nella PIN / MGN, assoni ChR2-YFP-positivi densamente innervati il LA, l'area amygdalostriatal di transizione (Astria) e il paracapsular I mediale TC cluster nel amigdala, un modello pienamente coerente con tracciamento studi precedenti 16, 22. Abbiamo anche rilevato intenso oro immunomarcatura per il ChR2-YFP sul P-faccia degli assoni e terminali in freeze-frattura replica da rAAV-ChR2-YFP- topi iniettati (Figura 5A), ma non in repliche di topi non iniettati. La specializzazione membrana post-sinaptica di sinapsi glutammatergica in una replica può essere osservata come un gruppo di particelle intramembrane (PIM) sulla E-faccia della membrana plasmatica 2, 23, ed è spesso accompagnata dalla P-faccia della sua membrana plasmatica presinaptica 7 (Figura 5B-C). Queste caratteristiche hanno permesso di identificare la specializzazione postsinaptica delle sinapsi glutammatergica formate da terminali degli assoni PIN / mgN (figura 5 e 6). Abbiamo etichettato AMPA-R con un anticorpo che riconosce tutti i quattro subunità (GluA1-4), mentre NMDA-R sono state rilevate utilizzando un anticorpo contro l'essenziale subunità NR1.
S copi "fo: keep-together.within-page =" 1 "> A causa della mancanza di strumenti per rilevare sulla stessa replica se queste sinapsi sono stati realizzati con spine dendritiche o alberi di neuroni ITC, abbiamo identificato il volto replica corrispondente per μ recettori oppioidi, come neuroni esprimono ITC postsinaptica elevati livelli di questi recettori 24. Questo necessari all'identificazione degli stessi profili postsinaptici nei due repliche (Figura 5C-F e Figura 6A-D) utilizzando una strategia che impiega punti di riferimento (Figura 4E) .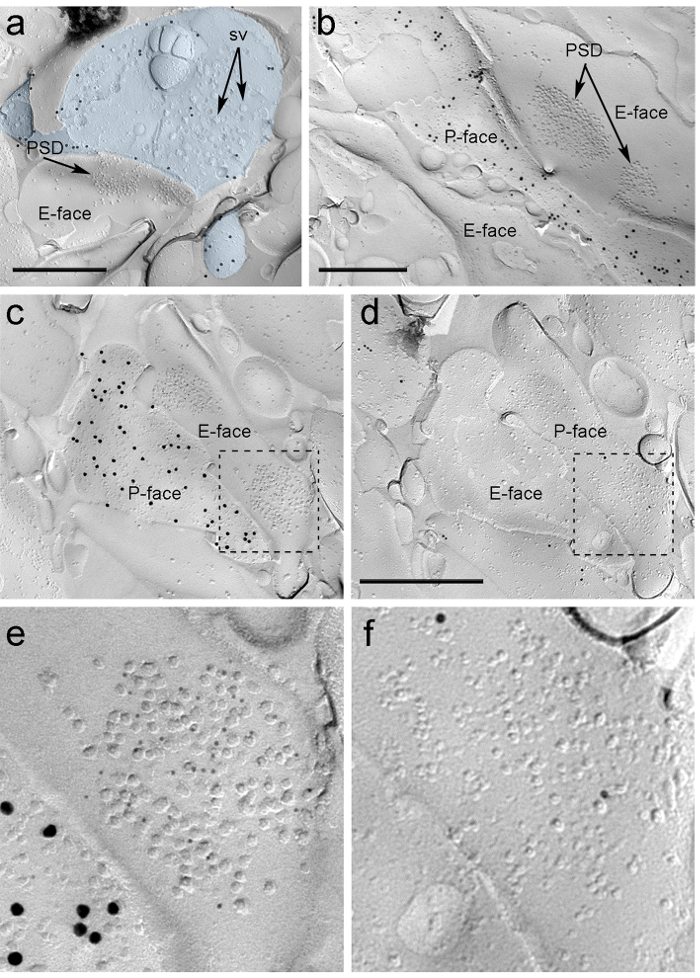
Figura 5. Individuazione di ChR2-YFP e ionotropi glutammato recettori sulla replica da Immunogold particelle. (A) un terminale cross-fratturato assone (azzurro) e piccole porzioni del suo P-faccia marcato con particelle d'oro 15 nm rilevazione ChR2-YFP. All'interno del terminale, la membrana of numerose vescicole sinaptiche possono essere osservati (sv). Nota la specificità del immunomarcatura in gran parte ristretta alla membrana plasmatica. Etichettatura per ChR2 identifica il terminale come proveniente da PIN / MGN. Il terminale forma un sinapsi asimmetrica con una spina dorsale. La specializzazione membrana post-sinaptica (PSD) sulla E-viso mostra un cluster caratteristica di particelle intramembrane ed è identificata con particelle d'oro 5 nm rivelano AMPA-R. (B) Il P-volto di un assone ChR2 che esprimono (marcato con 15 particelle d'oro nm) viene mostrato al confine con due dendriti, uno di loro possiede due PSD marcati con particelle d'oro 5 nm rivelano NMDA-R. (CD) facce opposte delle membrane pre e post-sinaptici di una sinapsi PIN / MGN-ITC. (C) Il P-faccia del terminale esprime ChR2 (marcato con particelle d'oro 15 nm) e si estende per l'E-volto di due alberi dendritiche, uno dei quali contiene due PSD etichettati per AMPA-R (5 particelle nm oro). ( D) La corrispondente P-face dei due dendriti è etichettato per i recettori μ-oppioidi (10 particelle nm oro). (EF) viste ingrandite delle zone indicate dalle linee tratteggiate. Barre di scala:. 500 nm Clicca qui per vedere una versione più grande di questa figura.
Immunoparticelle per AMPA-R nelle sinapsi PIN / MGN-ITC sono stati trovati in tutto il cluster IMP, suggerendo una distribuzione omogenea all'interno della specializzazione post-sinaptica (Figura 5E). A significativamente più alta (spaiato t-test p <0.018) Densità di etichettatura AMPA-R è stata osservata in PIN / MGN sinapsi su spine ITC (715 ± 38 particelle d'oro / micron 2, n = 32) rispetto alle sinapsi Onto dendriti ITC (590 ± 44 particelle d'oro / micron 2, n = 32). Nel complesso, la densità di AMPA-R in PIN sinapsi / MGN-ITC ha mostrato un relativamente bassovarianza (Coefficiente di variazione, CV = 0,37) conformemente ad una distribuzione omogenea.
Immunoparticelle per NMDA-R nelle sinapsi PIN / MGN-ITC sono stati spesso osservato equamente distribuiti all'interno di cluster IMP post-sinaptici (Figura 5B). La densità di etichettatura NMDA-R è stata simile (spaiato t-test p = 0.39) tra il PIN / MGN sinapsi su spine ITC (1070 ± 153 particelle d'oro / micron 2, n = 8) e dendriti ITC (812 ± 183 particelle d'oro / micron 2, n = 9). A differenza di quanto osservato per AMPA-R, la densità di NMDA-R in PIN sinapsi / MGN-ITC era molto variabile (CV = 0,54).

Figura 6. AMPA-R e NMDA-Rs immunomarcatura a identificati PIN / MGN-ITC sinapsi.
(AB) facce opposte delle membrane pre e post-sinaptici di un PIN / MGN-ITCsinapsi fatta su una spina dendritica in cui il P-faccia del terminale esprime ChR2 (etichettato con 15 particelle d'oro nm) e la PSD su una spina dendritica è etichettato per AMPA-R (5 particelle nm oro). (CD) viste ingrandite delle aree contornate dalla linea tratteggiata. Queste zone sono stati ruotati di circa 45 ° in senso antiorario per permettere una migliore visione del PSD. (E) a dispersione del numero di particelle AMPA-R contro zona sinaptica in spine ITC e dendriti. In entrambe le strutture, una correlazione positiva è stata osservata. (F) a dispersione del numero di particelle NMDA-R contro zona sinaptica in spine ITC e dendriti. Una significativa correlazione positiva è stata rilevata solo in spine dendritiche. Barre di scala:. 500 nm Clicca qui per vedere una versione più grande di questa figura.
Perchéil P-faccia della membrana plasmatica presinaptica spesso sovrapposto nella parte del cluster PIM post-sinaptica, potremmo stimare l'area sinaptica di solo il 30% delle sinapsi (spine: significano zona 0,032 micron 2, gamma: 0,007-0,063 um 2, n = 8; dendriti: 0,047 micron 2, gamma: 0.024 a 0,166 micron 2, n = 11). Questi erano in una gamma simile come precedentemente analizzato glutamatergica telencefalico sinapsi 25.
In entrambe le spine e dendriti, il numero di immunoparticelle oro per AMPA-R in singole sinapsi era correlata positivamente con l'area sinaptica (Spearman, spine: r = 0.88, dendriti: r = 0.60, p <0,0001) (Figura 6E). Viceversa, il numero di immunoparticelle oro per NMDA-Rs è risultata correlare con la zona sinaptica spine (Spearman, spine: r = 0,90, p <0.002) ma non in dendriti (r = 0,21, p = 0,29) (Figura 6F ).
Discussione
microscopia elettronica freeze-frattura è stata una tecnica importante nella ricerca ultrastrutturali per oltre 40 anni. Tuttavia, la mancanza di mezzi efficaci per studiare la composizione molecolare delle membrane ha prodotto un calo significativo nel suo utilizzo. Recentemente, vi è stata una notevole ripresa della microscopia elettronica freeze-frattura a causa dello sviluppo di mezzi efficaci per rivelare proteine integrali di membrana mediante etichettatura immunogold 1, 2, cioè la tecnica FRIL.
La tecnica FRIL possiede diversi vantaggi rispetto ad altri metodi ultrastrutturali immunogold. In primo luogo, le proteine sono facilmente accessibili agli anticorpi aumentando la sensibilità. In secondo luogo, l'esposizione di gran parte delle specializzazioni di membrana plasmatica, come la membrana postsinaptica, sulla superficie bidimensionale della replica permette l'ispezione della distribuzione spaziale e contiguità fisica di molecole di interesse senza ricostruzione laborioso e richiede tempo di serisezioni al ultrasottili. In terzo luogo, la disponibilità di entrambe le metà della membrana plasmatica aumenta il numero di proteine che possono essere identificate per ogni singola struttura, forniti anticorpi adatti sono disponibili. Su fratturazione, la faccia idrofoba della membrana scissione è rivestito con carbonio-platino che consolida domini proteici rimanenti sulla superficie fratturata. Questo impedisce l'accesso di anticorpi diretti contro antigeni in questi domini. Per esempio sulla P-faccia di una replica soli epitopi di fronte allo spazio protoplasmatica possono essere rilevati da anticorpi, mentre sul E-faccia solo epitopi fronte spazio exoplasmic può essere vincolato da anticorpi (vedere Figura 2).
D'altra parte, la tecnica FRIL soffre anche di alcune limitazioni 2. Come fratture si verificano in modo casuale, potrebbe essere difficile per colpire le cellule o strutture specifiche. Questo può anche portare ad una distorsione di campionamento, ad esempio, in raccolta sinapsi, data la diversa probabilità di fracturing lungo la membrana di strutture con diversa curvatura (ad esempio spine contro alberi). Inoltre, l'assegnazione di proteine di membrana ad una delle due facce è imprevedibile. Pertanto, la distribuzione di una proteina per la P-faccia o E-face, in particolare per studi quantitativi, deve essere attentamente esaminata utilizzando anticorpi reattivi ai domini intracellulari ed extracellulari. Infine, l'identificazione nella replica di alcune strutture, quali terminali assoni presinaptici, può essere difficile quando basata solo sulle caratteristiche morfologiche. Tuttavia, l'uso di anticorpi specifici per proteine marker o la trasduzione di proteine integrali di membrana categoria o canali utilizzando vettori virali offre ulteriori strumenti per facilitare l'identificazione delle membrane fratturati. Ad esempio, questo studio ha approfittato della trasduzione del ChR2-YFP nei neuroni del talamo per identificare i loro efferenze assonale nella amigdala e l'etichettatura per i recettori μ-oppioidi per rivelare me postsinapticombranes di neuroni ITC.
Al fine di eseguire la tecnica FRIL con successo, particolare attenzione dovrebbe essere presa per quanto riguarda la fissazione dei tessuti. Strong fissaggio del tessuto (> 2% paraformaldeide) può causare un alto tasso di cross-fratture e una diminuzione della sensibilità etichettatura. D'altra parte, fissazioni deboli rendono la manipolazione dei tessuti e preparazione (ad esempio, il taglio di sezioni) difficile. E 'anche importante controllare che lo spessore dei blocchi rifilati corrisponde allo spessore del nastro biadesivo. Se lo spessore del provino è inferiore a quella del nastro, la superficie del tessuto non potrebbero attaccarsi alla superficie dei due vettori di metallo, di conseguenza il campione congelato non si rompe. Se il tessuto è più spessa, verrà compresso con distorsioni strutturali inevitabili quando è fatto il panino dei due vettori di rame. La temperatura alla quale il campione è fratturato (in questo protocollo, -115 ° C) gioca un ruolo importantesulla struttura della replica. Temperature elevate possono produrre un più alto tasso di manufatti quali condensa del vapore acqueo sulla superficie del tessuto prima o durante l'evaporazione. Temperature più basse (<-125 ° C) può aumentare il rischio di scissione di materiale durante la fratturazione. Questo materiale può cadere sulla superficie del campione o rimanere in contatto con esso. Questi fiocchi di materiale sono anche rivestito e contrastato producendo macchie scure sull'immagine. Frattura a temperature più basse può anche influenzare la frequenza di cross-fratture in particolare per le piccole strutture pregiati come spine dendritiche. Un ulteriore passo critico nella preparazione di repliche è detergente-digestione. Se la digestione è incompleta, il tessuto non digerito appare come macchie scure sulla replica, confondere l'analisi della struttura al TEM. Inoltre, il tessuto non digerito può non specificamente-trap o legare gli anticorpi, aumentando l'etichettatura di sfondo. D'altra parte, l'uso di detersivos per la digestione tessuto può denaturare le molecole associate replica alterarne le strutture secondarie e terziarie. Pertanto, per alcuni antigeni potrebbe essere necessario diluire gradualmente la concentrazione di SDS con fasi di lavaggio aggiuntivi.
Per immunomarcatura, la disponibilità di diverse dimensioni di particelle d'oro coniugata ad anticorpi secondari permette di rilevare contemporaneamente, ma solo qualitativamente, più proteine, anche in microdomini specifici della membrana plasmatica, come la specializzazione postsinaptico. Tuttavia, a causa dell'impedimento sterico, studi quantitativi sono generalmente limitati alla rilevazione di una sola molecola. La dimensione della particella oro può anche influenzare l'efficacia etichettatura.
Per l'interpretazione del etichettatura FRIL, va tenuto presente che la particella immunogold può essere posizionato ovunque all'interno di una semisfera con raggio di 20-25 nm dalla dell'antigene causa della forma complessa flessibilecati da l'anticorpo primario e secondario 26. Per ulteriori informazioni sulla teoria e la pratica della FRIL e tecniche correlate, rimandiamo il lettore anche ad altri articoli metodologici 27, 28.
La tecnica FRIL è stata utilizzata di recente per alta risoluzione analisi quantitative della localizzazione dei recettori del glutammato in diverse popolazioni sinapsi 29, 30. Inoltre, la sensibilità di rilevazione della tecnica FRIL per AMPA-R è stato stimato alto come una particella immunogold per uno AMPA funzionale -R canale 29. Quindi, questo approccio è nel complesso molto utile per quantificare e analizzare il pattern di espressione post-sinaptica di AMPA-R e NMDA-R a sinapsi centrali. Qui, abbiamo dimostrato la sua applicabilità a livello delle sinapsi PIN / MGN-ITC, un sito molto probabilmente importante per la trasmissione di informazioni degli Stati Uniti durante il condizionamento alla paura. Utilizzando un anticorpo sollevata contro i residui amminoacidici extracellulari altamente conservati delle subunità del recettore AMPA GluA1-GluA4, abbiamo trovato una distribuzione uniforme delle particelle d'oro all'interno di cluster IMP corrispondenti alle specializzazioni membrana post-sinaptica. La densità di AMPA-R in spine ITC era significativamente più alta rispetto a sinapsi albero mirati da PIN / MGN afferenze del talamo. Ad entrambe le sinapsi della colonna vertebrale e degli alberi, è stata rilevata una correlazione positiva tra l'etichettatura per AMPA-R e l'area post-sinaptici, una caratteristica comune ad altre sinapsi glutammatergica 25. La varianza bassa densità di AMPA-R in sinapsi PIN / MGN-ITC indica una distribuzione omogenea simile ad altre sinapsi formate da efferenze talamo 7, ma diverso da sinapsi corticali 25. Al contrario, la densità di NMDA-R è stato più variabile e non differiva tra la colonna vertebrale e dell'albero sinapsi che suggeriscono un regolamento diverso da quello AMPA-R. In futuro, l'alta riproducibilità della tecnica FRIL non solo permetterà di valutare la composizione molecolare basale di sinapsi centrali, ma può facilitare il rilevamento di cHANGES nel numero dei recettori ionotropici del glutammato e distribuzione subsinaptico dopo aver appreso la paura, che completano le registrazioni ex-vivo di proprietà pre e post-sinaptici di questi ingressi.
In conclusione, questo approccio potrebbe essere utilizzato da altri ricercatori per ottenere informazioni in rapporti struttura-funzione delle sinapsi eccitatorie specifico ingresso in molti altri circuiti neurali in cui districare l'origine degli ingressi e la natura e la composizione di elementi postsinaptici è cruciale ma problematico .
Divulgazioni
The authors declare that they have no competing financial interests.
Riconoscimenti
Funding was provided by the Austrian Science Fund FWF grant No. P-22969-B11 to F. Ferraguti, and by the Charitable Hertie Foundation and the Werner Reichardt Centre for Integrative Neuroscience and by the DFG (CIN-Exc. 307) to I. Ehrlich.
Materiali
| Name | Company | Catalog Number | Comments |
| Surgery | |||
| Stereotactic frame | Stoelting, USA | 51670 | can be replaced by other stereotactic frame for mice |
| Steretoxic frame mouse adaptor | Stoelting, USA | 51625 | |
| Gas anesthesia mask for mice | Stoelting, USA | 50264 | no longer available, replaced by item no. 51609M |
| Pressure injection device, Toohey Spritzer | Toohey Company, USA | T25-2-900 | other pressure injection devices (e.g. Picospritzer) can be used |
| Kwik Fill glass capillaries | World Precision Instruments, Germany | 1B150F-4 | |
| Anesthesia machine, IsoFlo | Eickemeyer, Germany | 213261 | |
| DC Temperature Controler and heating pad | FHC, USA | 40-90-8D | |
| Horizontal Micropipette Puller Model P-1000 | Sutter Instruments, USA | P-1000 | |
| Surgical tool sterilizer, Sterilizator 75 | Melag, Germany | 08754200 | |
| rAAV-hSyn-ChR2(H134R)-eYFP (serotype 2/9) | Penn Vector Core, USA | AV-9-26973P | |
| fast green | Roth, Germany | 0301.1 | |
| Isoflurane Anesthetic, Isofuran CP (1ml/ml) | CP Pharma, Germany | ||
| Antiseptic, Betadine (providone-iodine) | Purdure Products, USA | BSOL32 | can be replaced by other disinfectants |
| Analgesic, Metacam Solution (5mg/ml meloxicam) | Boehringer Ingelheim, Germany | can be replaced by other analgesics | |
| Bepanthen eye ointment | Bayer, Germany | 0191 | can be replaced by other eye ointments |
| Drill NM3000 (SNKG1341 and SNIH1681) | Nouvag, Switzerland | ||
| Sutranox Suture Needle | Fine Science Tools, Germany | 12050-01 | |
| Braided Silk Suture | Fine Science Tools, Germany | 18020-60 | |
| Name | Company | Catalog Number | Comments |
| Tissue preparation | |||
| Paraformaldehyde EM grade | Agar Scientific Ltd., United Kingdom | AGR1018 | |
| Saturated picric acid solution | Sigma-Aldrich, USA | P6744-1GA | |
| Na2HPO4-2H20 | Merck Millipore, Germany | 1065860500 | |
| NaH2PO4-2H2O | Merck Millipore, Germany | 1063451000 | |
| NaCl | Merck Millipore, Germany | 1064041000 | |
| 4N NaOH | Carl Roth, Germany | T198.1 | |
| Thiopental | Sandoz, Austria | 5,133 | |
| Glycerol | Sigma-Aldrich, USA | G5516-500ML | |
| GenPure ultrapure water system | Thermo Fisher Scientific, USA | 50131235 | |
| Peristaltic pump | ISMATEC, Germany | ISM 930C | |
| Filter Paper | MACHEREY-NAGEL, Germany | MN 615 1/4 | |
| Vibroslicer, VT1000S | Leica Microsystems, Austria | ||
| Ophthalmic scalpel | Alcon Laboratories, USA | can be replaced by other ophthalmic scalpels | |
| Perfusion cannula | Vieweg, Germany | F560088-1 | can be replaced by similar items from other companies |
| Name | Company | Catalog Number | Comments |
| High-pressure Freezing | |||
| Copper carriers | Engineering Office M. Wohlwend, CH | 528 | |
| Sidol Polish | Henkel, Germany | can be replaced by same item from other companies | |
| Chamois skin | Household supply store | ||
| Hole punch, 1,5mm | Stubai, Austria | can be replaced by same item from other companies | |
| Denatured ethanol | Donauchem, Austria | can be replaced by same item from other companies | |
| Aceton | Roth, Germany | 9372.5 | CAUTION! |
| High Pressure Freezing Machine HPM 010 | BalTec, CH; now Leica Microsystems | HPM010 | not produced any more, substituted by LeicaEM HPM100 |
| Stereo-microscope | Olympus, Japan | SZX10 | |
| Liquid nitrogen | CAUTION! | ||
| Cryo-vials | Roth, Germany | E309.1 | can be replaced by same item from other companies |
| CryoCane | Nalge Nunc International,USA | 5015-0001 | can be replaced by same item from other companies |
| CryoSleeve | Nalge Nunc International,USA | 5016-0001 | can be replaced by same item from other companies |
| Liquid nitrogen storage vessel | Cryopal, France | GT38 | can be replaced by same item from other companies |
| Non-ionic detergent (Lavocid) | Werner & Mertz Professional, Germany | ||
| Name | Company | Catalog Number | Comments |
| Freeze-fracture and Replication | |||
| Sandblaster, Mikromat 200-1 | JOKE Joisten & Kettenbaum, Germany | SANDURET 2-K | can be replaced by same item from other companies |
| Siliciumcarbid SIC 360, grain size 25 - 21µ | JOKE Joisten & Kettenbaum, Germany | 955932 | |
| Freeze Fracture System BAF 060 | BalTec, CH; now Leica Microsystems | BAF060 | |
| Ceramic 12 well plate | Gröpel, Austria | 14511 | can be replaced by same item from other companies |
| Trizma base | SIGMA, USA | T1503 | can be replaced by same item from other companies |
| Trizma hydrochloride | SIGMA, USA | T3253 | can be replaced by same item from other companies |
| Sodium chloride | Merck, Germany | 1,064,041,000 | can be replaced by same item from other companies |
| SDS, Sodium lauryl sulfate | Roth, Germany | 5136.1 | CAUTION! ; can be replaced by same item from other companies |
| Sucrose | Merck, Germany | 1,076,871,000 | can be replaced by same item from other companies |
| TRIS | Roth, Germany | 5429.3 | can be replaced by same item from other companies |
| Universal Hybridization Oven | Binder, Germany | 7001-0050 | can be replaced by same item from other companies |
| Name | Company | Catalog Number | Comments |
| Immunolabelling | |||
| BSA | SIGMA, USA | A9647 | can be replaced by same item from other companies |
| Anti-GFP Antibody | Molecular Probes, USA | A11122 | |
| Anti-pan-AMPAR Antibody | Frontier Institute, Japan | pan AMPAR-GP-Af580-1 | |
| Anti-NMDAR1 Antibody, clone 54.1 | Merck Millipore, Germany | MAB363 | |
| Opioid Receptor-Mu (MOR) Antibody | ImmunoStar, USA | 24216 | |
| EM goat anti-guinea pig, 5nm; secondary antibody | BBInternational, | EM.GAG5 | |
| EM goat anti-rabbit, 15nm; secondary antibody | BBInternational, | EM.GAR15 | |
| Donkey anti-rabbit, 10nm, secondary antibody | AURION, Netherlands | DAR 10nm | |
| Copper grids, 100 Parallel Bar | Agar scientific, UK | G2012C | |
| Incubator | Major Science, USA | MO-RC | can be replaced by same item from other companies |
| Pioloform Powder | Agar scientific, UK | R1275 | |
| Chloroform | Roth, Germany | 3313.1 | CAUTION! ; can be replaced by same item from other companies |
| Name | Company | Catalog Number | Comments |
| EM analysis | |||
| Philips CM120 TEM | Philips/FEI | ||
| Morada CCD camera | Soft Imaging Systems, Germany | ||
| iTEM Ver. 5.2, imaging software | Soft Imaging Systems, Germany | ||
Riferimenti
- Fujimoto, K. SDS-digested freeze-fracture replica labeling electron microscopy to study the two-dimensional distribution of integral membrane proteins and phospholipids in biomembranes: practical procedure, interpretation and application. Histochem Cell Biol. 107 (2), 87-96 (1997).
- Masugi-Tokita, M., Shigemoto, R. High-resolution quantitative visualization of glutamate and GABA receptors at central synapses. Curr Opin Neurobiol. 17 (3), 387-393 (2007).
- Rash, J. E., Yasumura, T. Direct immunogold labeling of connexins and aquaporin-4 in freeze-fracture replicas of liver, brain, and spinal cord: factors limiting quantitative analysis. Cell Tissue Res. 296 (2), 307-321 (1999).
- Emes, R. D., Grant, S. G. Evolution of synapse complexity and diversity. Annu Rev Neurosci. 35, 111-131 (2012).
- Matsuzaki, M., et al. Dendritic spine geometry is critical for AMPA receptor expression in hippocampal CA1 pyramidal neurons. Nat Neurosci. 4 (11), 1086-1092 (2001).
- Rollenhagen, A., Lübke, J. H. The morphology of excitatory central synapses: from structure to function. Cell Tissue Res. 326 (2), 221-237 (2006).
- Tarusawa, E., et al. Input-specific intrasynaptic arrangements of ionotropic glutamate receptors and their impact on postsynaptic responses. J Neurosci. 29 (41), 12896-12908 (2009).
- Nusser, Z., et al. Cell type and pathway dependence of synaptic AMPA receptor number and variability in the hippocampus. Neuron. 21 (3), 545-559 (1998).
- Nyìri, G., Stephenson, F. A., Freund, T. F., Somogyi, P. Large variability in synaptic N-methyl-D-aspartate receptor density on interneurons and a comparison with pyramidal-cell spines in the rat hippocampus. Neuroscience. 119 (2), 347-363 (2003).
- Nicholson, D. A., Geinisman, Y. Axospinous synaptic subtype-specific differences in structure, size, ionotropic receptor expression, and connectivity in apical dendritic regions of rat hippocampal CA1 pyramidal neurons. J Comp Neurol. 512 (3), 399-418 (2009).
- Millhouse, O. E. The intercalated cells of the amygdala. J Comp Neurol. 247 (2), 246-271 (1986).
- Busti, D., et al. Different fear states engage distinct networks within the intercalated cell clusters of the amygdala. J Neurosci. 31 (13), 5131-5144 (2011).
- Amano, T., Unal, C. T., Paré, D. Synaptic correlates of fear extinction in the amygdala. Nat Neurosci. 13 (4), 489-494 (2010).
- Duvarci, S., Pare, D. Amygdala microcircuits controlling learned fear. Neuron. 82 (5), 966-980 (2014).
- Jüngling, K., et al. Neuropeptide S-mediated control of fear expression and extinction: role of intercalated GABAergic neurons in the amygdala. Neuron. 59 (2), 298-310 (2008).
- Asede, D., Bosch, D., Lüthi, A., Ferraguti, F., Ehrlich, I. Sensory inputs to intercalated cells provide fear-learning modulated inhibition to the basolateral amygdala. Neuron. 86 (2), 541-554 (2015).
- Maren, S. Neurobiology of Pavlovian fear conditioning. Annu Rev Neurosci. 24, 897-931 (2001).
- Pape, H. C., Pare, D. Plastic synaptic networks of the amygdala for the acquisition, expression, and extinction of conditioned fear. Physiol Rev. 90 (2), 419-463 (2010).
- Sigurdsson, T., et al. Long-term potentiation in the amygdala: a cellular mechanism of fear learning and memory. Neuropharmacology. 52 (1), 215-227 (2007).
- Bosch, D., Asede, D., Ehrlich, I. Ex-vivo optogenetic dissection of fear circuits in brain slices. J. Vis. Exp. (110), e53628 (2016).
- Fenno, L., Yizhar, O., Deisseroth, K. The development and application of optogenetics. Annu Rev Neurosci. 34, 389-412 (2011).
- Bienvenu, T. C. M., et al. Large intercalated neurons of amygdala relay noxious sensory information. J. Neurosci. 35 (5), 2044-2057 (2015).
- Sandri, C., Akert, K., Livingston, R. B., Moor, H. Particle aggregations at specialized sites in freeze-etched postsynaptic membranes. Brain Res. 41 (1), 1-16 (1972).
- Likhtik, E., Popa, D., Apergis-Schoute, J., Fidacaro, G. A., Paré, D. Amygdala intercalated neurons are required for expression of fear extinction. Nature. 454 (7204), 642-645 (2008).
- Fukazawa, Y., Shigemoto, R. Intra-synapse-type and inter-synapse-type relationships between synaptic size and AMPAR expression. Curr Opin Neurobiol. 22 (3), 446-452 (2012).
- Amiry-Moghaddam, M., Ottersen, O. P. Immunogold cytochemistry in neuroscience. Nat Neurosci. 16 (7), 798-804 (2013).
- Fukazawa, Y., Masugi-Tokita, M., Tarusawa, E., Hagiwara, A., Shigemoto, R., Cavalier, A., et al. SDS-digested Freeze-fracture replica labelling (SDS-FRL). Handbook of Cryo-Preparation Methods for Electron Microscopy. , 567-586 (2007).
- Severs, N. J. Freeze-fracture electron microscopy. Nat Protoc. 2 (3), 547-576 (2007).
- Tanaka, J., et al. Number and density of AMPA receptors in single synapses in immature cerebellum. J Neurosci. 25 (4), 799-807 (2005).
- Mansouri, M., et al. Distinct subsynaptic localization of type 1 metabotropic glutamate receptors at glutamatergic and GABAergic synapses in the rodent cerebellar cortex. Eur J Neurosci. 41 (2), 157-167 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon