Method Article
Optogenetic ve donma-fraktür çoğaltma ile immün Fare amigdalada glutamat reseptörlerinin giriş-özel bir düzenleme incelemek için bir araya
Bu Makalede
Özet
This article illustrates how the expression of neurotransmitter receptors can be quantified and the pattern analyzed at synapses with identified pre and postsynaptic elements using a combination of viral transduction of optogenetic tools and the freeze-fracture replica immunolabeling technique.
Özet
Freeze-kırık elektron mikroskobu 40 yılı aşkın bir süredir ultrastrüktürel araştırma önemli bir teknik olmuştur. Ancak, membran moleküler kompozisyon çalışmak için etkin araçların eksikliği kullanımında önemli bir düşüş üretti. Son zamanlarda, immünolojik etiketleme ile yekpare zar proteinleri ortaya çıkarmak için etkin yolların geliştirilmesi için donma-fraktür elektron mikroskobu sayesinde önemli bir canlanma olmuştur. Bu yöntemlerden biri, deterjan-çözünür donma-fraktür çoğaltma immün (FRIL) olarak da bilinir.
optogenetics ile FRIL tekniğinin kombinasyonu merkez sinapsların yapısal ve fonksiyonel özelliklerinin ilişkili analiz sağlar. Bu yaklaşımı kullanarak, tespit ve etiketli channelrhodopsin ilgili ifadesi ve özel moleküler belirteçleri ile öncesi ve postsinaptik nöronların iki karakterize edilmesi mümkün olur. glutamat postsinaptik membran uzmanlık ayırt edici bir görünümerjik ölçmek ve bu reseptörlerin intrasynaptic dağılımının analizi için, daha sinapsların iyonotropik glutamat reseptörlerinin etiketlenmesi üzerine verir. Burada, eşleşmiş kopyaları ve bunların nasıl immunolabel hazırlamak için gerekli prosedürlerin adım adım tanımını verir. Biz de, potansiyel örnekleme önyargıları ile ilişkili özellikle de FRIL tekniğinin uyarılar ve sınırlamalar ele alınacaktır. optogenetics ile kombine edildiğinde FRIL tekniği yüksek tekrarlanabilirlik ve çok yönlülük, beyinde tespit nöronal mikrodevreler sinaptik iletim farklı yönlerini karakterizasyonu için çok güçlü bir yaklaşım sunuyor.
Burada, bu yaklaşım fare amigdala interkalar hücre kütlelerinin nöronlar da uyarıcı sinaps yapı-işlev ilişkilerinin içgörü kazanmak için nasıl kullanıldığını bir örnek oluşturmaktadır. Özellikle, belirlenen girişlerin iyonotropik glutamat reseptörlerinin ekspresyonunu araştırdık veyatalamik arka intralaminar ve medial genikülat çekirdeklerine iginated. Bu sinapslar korku öğrenme için uygun duyusal bilgiyi röle ve korku klima üzerine plastik değişikliklere gösterilmiştir.
Giriş
nanometre ölçeğinde biyomembranlar fonksiyonel mimarisi tanımı transmisyon elektron mikroskobu için uygun immün bir takım teknikler geliştirilmesi ile son yıllarda öne sürülmüştür. Bununla birlikte, bu teknikler, örneğin, ön ve son gömme immünolojik, antijenlere ve / veya zar-bağlı protein sınırlı kantitatif bir değerlendirme zayıf algılama dahil önemli sınırlamalar, bir dizi vardır. Bu sınırlamalar, hücre çeşitliliği ve sinaps heterojen yüksek derecede ile karakterizedir sinir sistemi, ince yapısı soruşturma özellikle kritik hale gelir. Ön ve postsinaptik elemanları ya da diferansiyel ekspresyonu, zenginleştirme veya bu reseptörlerin taşıyıcılar ve efektör molekülleri olarak sinyal proteinleri arasındaki etkileşim tarafından dikte yapısal ve işlevsel farklılıklara bu heterojenite sonuçlanır.
Doğrudan immunolabe için yeni bir yaklaşımDeterjan-çözünür donma-fraktür kopyaları (FRIL) integral ya da çapraz-bağlanmış membran proteinlerinin Ling ilk iki yıl önce 1 Fujimoto tarafından ortaya atılmıştır. Bu orijinal bir yöntem vardı, ancak, çeşitli sınırlamalar, yani beyin gibi karmaşık dokularda ayrı ayrı eşlenen hücreleri ile etiketlenmiş moleküllerin anlamlı korelasyon engel kopyaları, şiddetli parçalanması. Yaklaşık 10 yıl önce, Shigemoto ve Fukazawa giderek tekniği 2 düzeldi. Bu da önemli ölçüde gap junction 3 çalışması için, özellikle tekniği geliştirilmiş Colorado State University Boulder laboratuarlarında, bilim adamları başka bir grup çabaları paralel edildi.
dondurularak kırılma protokolleri ve makinelerde iyileştirme, hem de (yüksek basınç altında) Hızlı dondurma giriş, Hi araştırmacılar nispeten büyük boyutta ve örneklerin kesintisiz kopyalarını üretmek için izin verirsınırlamaları ve güçlü kimyasal tespitler tarafından üretilen eserler olmadan en hücresel bileşenlerin gh kaliteli görüntüler.
FRIL tekniği öncesi ve postsinaptik bir plan görünüşüdür ek avantajı, beyin gibi, karmaşık doku içinde bir ya da daha fazla eşleştirilmiş histolojik olarak (aynı anda) protein ve sitolojik tanımlanan hücrelerin in situ tespiti bir yüksek kantitatif büyük avantajı sunar tek bir çoğaltma unsurları. Bu nedenle, FRIL tekniği, birçok teknik engellere rağmen, özellikle bireysel sinapsların yapısal ve fonksiyonel özelliklerinin korelasyonu için, çok önemli bilimsel buluşlar bir dizi için umut vaat ediyor. Son birkaç on yılda, büyük bir bilgi anlaşma moleküler makyaj, yapısı üzerinde elde edilmiştir, ve sinapsların fizyolojik fonksiyonu; Henüz sinaps morfolojik ve moleküler oldukça çeşitli öncesi ve postsinaptik pa bağlı olankira nöronlar 4. Sadece sinaps türleri bir avuç yapı-fonksiyon şimdiye kadar yapılan çalışmalar 5-7 başarılı idi. Bu durum öncesi ve postsinaptik unsurların doğa kesin bir kimlik engelledi teknik kısıtlamalar çoğunlukla oldu.
Ultrastrüktürel analiz sinaptik iletim gücü ve plastisite üzerinde büyük bir etkisi vardır nörotransmiter reseptörleri 6 farklı sinaptik kişileri arasında hem sinaptik boyutu ve içeriği bakımından postsinaptik membran uzmanlık değişkenliği, içine kritik bilgi sağlamaktadır. Bundan başka, bir araştırma büyük bir gövde sinaps farklı ifade iyonotropik glutamat reseptörlerinin sayısının afferent- ve hedef-bağlı bir şekilde 7-10 düzenlendiğini gösterir.
Burada, bir yöntem define postsinaptik membran uzmanlık yapısı ve reseptör kompozisyon analizi izin veren ana hatlarıylad presinaptik elemanları ve işlevi. Bu yaklaşım, Channelrhodopsin2 (CHR2) geliştirilen yeni ışığa duyarlı alg proteinler, presinaptik ifade yararlanır ve FRIL tekniğin α-amino-3-hidroksi-5-metil-4-isoxazolepropionic postsinaptik sentezleme modelini analiz asit (AMPA-R) ve N-metil-D-aspartat (NMDA-R) glutamat reseptörleri. Bu amigdala (ITC) ve interkelatlaşmış hücre kütlelerinin nöronlar üzerine arka talamik-medial genikülat çekirdekleri (PIN / MGN) kaynaklanan aksonlar oluşturduğu sinaps gösterilmiştir. ITC nöronlar bazolateral amigdaloid kompleksi (BLA) 11, 12 çevreleyen kümeler düzenlenen küçük dikenli GABAerjik hücrelerdir. ITC nöronlar BLA ana nöronlardan eksitatör sinyaller almak ve (CEA) merkez çekirdeğini hedef bilinmektedir, bu nedenle bir inhibitör kapısı olarak işlev bilgi için BLA ve CEA 12-15 arasında akar.
Son zamanlarda, biz IT gösterdiBLA ve CEA arasında medio-dorsal kümede bulunan C nöronlar da korku Pavlovian işitsel korku klima 16 sırasında öğrenme üzerine değiştirilmiş duyusal talamik ve temporal kortikal bölgelerde, direkt ve yakınsak eksitatör sinyaller alırlar. Korku şartlandırma beyin mekanizmaları açısından birleştirici öğrenme en iyi anlaşılan biçimlerinden biridir. Korku klima, başlangıçta nötr koşullandırılmış uyaran (CS, örneğin, bir ton) bir CS-ABD dernek sonuçlanan bir caydırıcı koşulsuz uyarıcı (ABD, örneğin, bir hafif ayak şoku) ile eşleştirilmiş ve korku tepkisi 17, 18 şartına bağlıdır. Eksitatör CS ve ABD temsil eden bilgiyi taşıyan talamik ve neokortikal alanlar, hem giriş, sırasıyla, amigdala (LA) yanal çekirdeğin piramidal nöronlar üzerine yakınsama ve plastisite 19 geçmesi biliniyordu. Bizim önceki çalışma duyusal giriş bilgileri ITC nöronlar geçirilen paralel de olduğunu ortaya koydu 16 kadar.
Bireysel duyusal girdi mekanistik moleküler analiz doğru bir ilk adım ITC nöronlar üzerine sinapsların, biz ChR2 sarı floresan protein (YFP) ile etiketlenmiş ifade etmek için bir adeno-ilişkili virüs (AAV) kullanılır. AAV PIN / MGN enjekte edildi ve akson terminalleri ChR2 YFP bunların ifadesi ile belirlenmiştir. Biz PIN / MGN akson terminalleri tarafından ITC nöronlar ile oluşturulan sinaps postsinaptik AMPA-R ve NMDA-R yoğunluğunu değerlendirmek için FRIL tekniği ile üretilen, her iki yüzü kullanılır.
Protokol
Hayvan denekleri Prosedürleri Regierungspraesidium Tübingen, Baden-Württemberg, Almanya, devlet tarafından ve Avusturya Hayvan Deneyleri Etik Kurulu tarafından onaylanan ve araştırma hayvanların kullanımına ilişkin AB direktifi doğrultusunda vardı edilmiştir.
AAV-Channelrhodopsin2-YFP 1. stereotaktik Enjeksiyonlar
Not: stereotaktik enjeksiyon daha önce yayınlanan bir protokolün 20 uyarınca gerçekleştirilmiştir.
- 1.5 saat boyunca 180 ° C'de ısıtarak steril aletler hazırlayın.
- Aşağıdaki parametrelerle belirlenen yatay mikroelektrot çektirmenin kullanarak enjeksiyonlar için keskin (~ 50 mikron çapında) cam pipetler çekin: Isı = Rampa değeri - 20 = 200 = 0, Hız = 100, Zaman = 200, Basınç çekin.
NOT: Rampa değeri mikropipet çektirmenin üreticisi tarafından sağlanan talimatlara göre satın alınan cam pipetler her lot için tespit edilmesi gerekmektedir. - Karışımlar virüsü çözeltisi 1 ul steril fosfat tamponlu tuzlu su içinde (cam pipet çözeltisi daha iyi görülmesi için)% 0.1, hızlı yeşil çözelti, 0.2 ul (PBS, 25 mM,% 0.9 NaCl, pH 7.4) eklenmiştir. 10 ul pipet ve jel-fil ipuçlarını kullanarak cam pipet doldurun. Viral yapı için, rAAV-hSyn-ChR2 (H134R) -eYFP (serotip 2/9) kullanın.
- küçük bir hayvan anestezi cihazı (indüksiyon için oksijen içinde% 3 izofluran) kullanarak fare anestezisi. Kullanın. Bu çalışma için, ~ 6 hafta arası 3 yabani tip farelere kullanımı.
- kulak ve göz arasındaki tıraş ve povidon-iyot bazlı solüsyon ile dezenfekte edin.
- anestezi sırasında gözlerin kurumasını önlemek için bir göz merhemi sürün. Deri altına analjezik ile fare enjekte (meloksikam göre, 5 mg / ml solüsyon, 0.1 mi).
- stereotaktik çerçeve fare yerleştirin ve bir gaz anestezi cihazı (bakım için oksijen içinde% 2 izofluran) üzerinden anestezi korumak. Bir uzuv çekilmesi eksikliği tarafından anestezi derinliğini kontrol edinDevam etmeden önce refleks.
- tüm cerrahi prosedür sırasında mümkün olan en iyi şekilde steril koşullar oluşturmak. tek kullanımlık yüz maskesi, cerrahi önlük ve eldiven giyin.
- Makas 20 kullanarak başın üstünde yaklaşık 1 cm'lik bir cilt kesi olun. Yavaşça H 2 O 2 ile kafatası yüzeyi ve temiz kafatası açığa çıkarmak için kelepçeler ile düzeltmek, künt forseps kullanarak tarafına cilt çekin.
- ince uçlu kalıcı bir kalem kullanarak kafatası Mark enjeksiyon siteleri. İşaretli yerinde kafatası içine küçük bir delik (çapı yaklaşık 1 mm) delin. bregmadan (mm): 3,0 posterior 1.8 ± yan, 3.8 ventral bu damızlık tek taraflı PIN / MGN enjeksiyonu için aşağıdaki koordinatları kullanın.
- Dağı bir basınçlı enjeksiyon cihazına bağlı stereotaktik çerçeve üzerine cam pipet dolu ve konumunu bregma pipet getirmek.
- ince düz uçlu forseps kullanarak cam pipet ucu kesiyorum. emin pipet olun kurmuyorum tarafından açıkga az basınç bakliyat ve virüs çözelti damlaları gözlemleyerek ekstrüzyon.
- İstenen enjeksiyon koordinatlarına gidin ve basınçlı enjeksiyon cihazda aşağıdaki ayarları kullanarak pipet içeriği (~ 0.5 ul) yarısını enjekte: basıncı 20 psi, ortalama nabız uzunluğu 30 ms, bakliyat 50 ortalama sayısı.
- bu geri çekme yavaş (1 mm / dakika) önce yaklaşık 1 dakika boyunca yer pipet bırakın.
- PBS (pH 7.4) ve kelepçeleri sökün Temiz kafatası. Yavaşça birlikte cilt çekin ve kesi sütür (3-4 knot). yaranın etrafındaki dezenfektan (tabanlı povidon iyot) uygulayın.
- anestezi durdurun ve tamamen uyanık kadar sahipsiz fareyi bırakmayın. Tek yer fareler tutun. Ameliyat sonrası sağlık durumunu izlemek için devam edin; Gerekli administer analjezik eğer.
- Viral ifade seviyelerine uygun sağlamak için beyin tespitten önce 4 hafta boyunca hayvanları tutmak.
2. Numune Hazırlama
- Beyin tespit </ Strong>
- Fiksatif hazırlanması
- Fiksatif 1 L için, paraformaldehid, 10 g ağırlığında ve deiyonize H2O 300 ml eklemek Sürekli karıştırılarak, 10 dakika ~ 60 ° C - 55 ısı.
- ısı kapatın ve 7 eklemek - 4 N NaOH 8 damla. solüsyon 10 dakika açık hale gelmelidir.
- Pikrik asit doymuş çözeltisi 150 ml ekleyin, bu oda sıcaklığına soğumaya bırakın ve deiyonize H2O ile 500 ml getirmek
- 0.2 M fosfat tamponu (PB) 500 ml ilave edilir. filtre kağıdı ile filtre. NaOH ile 7.4'e pH ayarlayın.
- 6 ºC fiksatif soğutun 6 ºC değil birden fazla gün için koyu cam şişelerde saklayın.
- transkardiyak perfüzyon
- tiyopental (120 mg / kg vücut ağırlığı) intraperitonal enjeksiyonu ile fareler anestezi. Hayvan derinden pedal çekilme reflektör kontrol ederek emin anestezi olunyokluğunda gereken ex. aşağı bağlı dört ekstremite ile perfüzyon masaya sırtında hayvan yerleştirin.
- künt uç makasla uzunlamasına karın duvarı açın ve diyafram maruz yanal göğüs kafesinin kaudal sınırında iki ek kesimler yapmak. diyaframı kesip ve her iki tarafta osteocartilageneous sınırında göğüs duvarı kesti. kalp maruz sternum içeren göğüs duvarı merkez döşeme kaudal ucunu kaldırın.
- perfüzyon aparatının kanül itiraf sol ventrikül ucunda küçük bir hassas kesim yapmak, perikard çıkarın. 0.6 mm'lik bir iç çapa sahip kör bir kanül kullanın. ucu çıkan aort içine görünür kadar ventrikül ile nazikçe kanül Pass ve bir kelepçe ile kanül sabitleyin. kan akışından çıkmak için kan ve guruplarına izin vermek için, sağ atrium bir kesim yapmak.
- Serpmek farenin transkardiyal bir akış oranında bir peristaltik pompa kullanılarak7 dakika boyunca buzla soğutulmuş bir sabitleyici ve ardından yaklaşık olarak 1 dakika boyunca PBS ile ilk 5 ml / dk (25 mM,% 0.9 NaCl, pH 7.4) 'in.
- Tespit edildikten sonra, bir makas ile fare kafasını koparmak ve daha sonra boyundan burun orta hat boyunca deri kesme. tam kafatası açığa çıkarmak için kas çıkarın.
- keskin bir makas kullanarak, oksipital ve foramen magnum başlayarak interparietal kemikler yoluyla uzunlamasına kesim yapmak. ince cımbız bu kemikleri kaldırmak kullanarak tüm beyincik ortaya çıkarmak. Sonra burun kemiği kadar parietal ve frontal kemiklerin aracılığıyla başka uzunlamasına kesim yapmak ve tüm beyni ortaya çıkarmak için cımbız ile bunları kaldırın.
- Bir spatula ile zarar vermeden beyin kaldırmak ve buz soğukluğunda 0.1 N PB yerleştirin.
- Fiksatif hazırlanması
- Kesit ve örneklerin kırpma
- ilgi alanı içeren jilet 6 mm - yaklaşık 5 koronal blok kesin. sahibinin üzerine tutkalBir siyanoakrilat yapıştırıcı ile vibroslicer. neocortex titreşimli bıçak bakacak şekilde doku bloğu yönlendirmek. Buz soğukluğunda 0.1 N PB vibroslicer (Şekil 1A) ile 140 uM amigdala içeren ve aynı tampon maddesi içinde bir 6-yuvalı tabak içinde toplayan dilim koronal kesitler.
- Bir stereomikroskop altında, ilgi bölgesi dışında Döşeme dilim (burada, ITC medio-dorsal paracapsular küme, Şekil 1B bakınız). bir göz neşter kullanılarak, 0.1 M PB ile silikon elastomer kaplı ve dolu bir Petri kabındaki yapın. Kesilmiş bloklar aralama (yaklaşık 1.5 mm) (Şekil 1B) deliğe uygun olduğundan emin olun.
- 6 ° C'de O / N (0.1 M PB% 30 gliserol) Kriyoprezervasyon çözeltisi içine kesilmiş blokları taşımak.
3. Yüksek Basınç Dondurma
NOT: FRIL 6 temel adımlardan oluşur (Şekil 2): Yüksek basınçlı (2300 at 1) Hızlı dondurma - numunenin 2.600 bar). numunenin 2) çatlatmaya. protoplazma (P-yüze) bitişik yatıyor yarım ve hücre dışı veya exoplasmic alana bitişik yatıyor bir buçuk (E-: Kırık düzlem genellikle iki yarım zar bildiriler ayırmayı, dondurulmuş membranların merkezi hidrofobik çekirdek izler yüz). platin ve karbon vakum birikimi ile numunenin 3) Çoğaltma. doku 4) Deterjan-sindirim. 5) immunogold etiketleme. bir transmisyon elektron mikroskobu kullanılarak çoğaltma 6) analizi.
- Bakır taşıyıcıların hazırlanması
NOT: FRIL prosedürü takip eden aşamalardan ele alınması için, numuneler, metal (altın veya bakır) taşıyıcı üzerine monte edilmesi gerekir. Bu firmalar kırılma ve kullanılan makinelerin Çeşidi moduna göre boyut ve tasarım değişir. Burada bakır taşıyıcı (Şekil 1B, E) ve menteşeli "çift kopya tablosu" kullanılır; açıldığında dondurulmuş numune ile çekme kınlmasına (Şekil 2) meydana getiren (Şekil 3B). Bu korumak ve kırık numunenin her iki tarafını çoğaltmak için izin verir.- güderi deri sayfasını kullanarak bir kararmaz çıkarıcı ile Polonyalı bakır taşıyıcıları.
- iki kez sonikasyon su banyosu içinde, iyonik olmayan bir deterjan (pH-1.5) olan bir cam kap ve temiz bir yer taşıyıcılar, daha sonra geniş bir deiyonize su ve ardından dokunun su içinde yıkama ve sonra etanol ile iki kez yıkayın.
- 15 dakika boyunca aseton içinde bakır taşıyıcılar sonikasyon.
- kuru filtre kağıdı üzerinde taşıyıcıları yerleştirin.
- Kesilmiş blok (tutma taşıyıcı) için iyi tutan olarak hizmet verecek bir bakır taşıyıcı (Şekil 1C), çift taraflı bant bir halkasını takın.
- Numunenin dondurulması
NOT: Dikkatli ve uygun gözlük takan sıvı azot tutun.- ücretsiz yüksek basınç açmavınlama birimi (Şekil 1F) örnek donma başlamadan önce en az 1.5 saat.
- "HAVA ISITICI" düğmesine basarak ısıtmayı başlatın ve 50 dakika dışarı pişirin. 80 ° C'ye ayarlayın hava sıcaklığı.
- yüksek basınçlı dondurma birimine azot tankı bağlayın ve sıvı azot ile içini Dewar doldurmak için "AZOT" düğmesine basın. "AZOT DÜZEYİ" lambası yanar. "Soğutma" düğmesine basarak soğutma başlayın.
- "AZOT DÜZEYİ" dışarı çıktığı zaman düğme "sürücü" tuşuna basın. Hidrolik sistem geri ve ileri 3 kez pistonu hareket ettiğini kontrol edin.
- "AUTO" tuşuna ve "AZOT" düğmesine basın. En kısa sürede "HAZIR" yanar gibi yüksek basınçlı dondurma ünitesi yüksek basınç donma hazırdır.
- Ag içine erimiş olmuştur çift taraflı bant (Şekil 1B) bir platin tel döngü kullanarak deliğe bir kesilmiş blok yerleştirinlass pipet.
- Filtre kağıdı veya fırça kullanarak, dondurarak saklama çözeltisi fazlalığı çıkarın.
Not: Bu yordam dokusu etrafında oluşabilir ve doku şekil ve / veya ultrastrüktürü bozulmasını neden olabilecek hava kabarcıklarını çıkarmak için de önemlidir. - Doku bloğu, iki taşıyıcı arasında sandviç için bir stereo mikroskop altında, bir taşıyıcı madde ile birlikte tutma taşıyıcısını kapsamaktadır.
- Yüksek basınçlı dondurma ünitesi (Şekil 1D) numune tutucu içine taşıyıcı sandviç yerleştirin. yüksek basınçlı dondurma ünitesine numune tutucu yerleştirin (aşağı ucu) ve numune tutucuya vidalayarak sabitleyin.
- "Jet-Auto" düğmesine basarak donma döngüsü başlatmak. mümkün olduğunca çabuk çalışarak, numune tutucu kaldırmak ve yalıtılmış bir kutunun içine sıvı azot ile ucu daldırın. soğutmak için sıvı azot içinde forseps iki çift ipuçları bırakın.
- Dikkatle th kaldırmake numune tutucu gelen taşıyıcı sandviç ve bir ön-soğutulmuş cryovial yerleştirin. taşıyıcılar sadece sıvı azot soğutmalı forseps ile işlenir olduğundan emin olun. Cryovials azot şişeye (Şekil 1G) dışarı akmasına izin verecek şekilde delikli edilmelidir.
- İstenen tüm örnekler dondurulmuş olan yineleyerek 3.2.11 için 3.2.6 adımları. örnek aynı tip ihtiva eden birden fazla taşıyıcı sandviç aynı şişe içinde muhafaza edilebilir.
- Çoğaltma (Şekil 1H) kadar cryotank taşıyıcıları içeren cryovials saklayın.

Şekil 1. Doku Hazırlanması ve yüksek basınçlı Dondurucu. (A) Vibroslicer bölümüne bir doku da kullanılabilir. (B) ac ile yan amigdala gösterilen yan içeren bir ortaya çıkan koronal fare beyin bölümüOpper taşıyıcı çift taraflı bant bir halka ile donatılmıştır. kesik kutu ITC medial paracapsular küme içeren ilgi alanını belirtir. Çift taraflı bant deliğin çapı yaklaşık olarak 1.5 mm'dir. Bakır taşıyıcıların hazırlanması için (C) araçlar. çift taraflı bant, cımbız, zımba, bakır taşıyıcı ve makas: sol üst saat yönünde seçin. Yüksek basınçlı dondurma örnek tutucu içine taşıyıcı sandviç (D) Ekleme. Taşıyıcı sandviç numune tutucusunun deliğine yerleştirilir. Olmadan ve çift taraflı bant bir halka ve "taşıyıcı sandviç" ile (E) Bakır taşıyıcılar. (F), basınçlı tankı kendisine sıvı azot beslenmesi Yüksek basınç donma ünitesi. Cryovial (G) donmuş dokuları stok. Azot gazı bir şişe (ok başı) üzerinden akmasına izin şişenin üst-orta pozisyonda delikler edin. (H) Cryotank dondurulmuş doku saklamak için. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
4. Donma-kırık ve Çoğaltma
- Elektron ışını silahların hazırlanması
- elektron demeti silah yerleştirmeden önce, "saptırıcı plaka" ile koruyucuyu çıkarın. Alt katot kapağından pens aynası içine filamanın ortalamak için "ayarı göstergesi" koyun.
Not: daha küçük çaplı ucu platin silah için ise ayar göstergesi büyük çaplı ucu C tabancası için kullanılır. - "Basınç lamina" kadar göstergesi üzerinden yeni filament kaydırın filament bobin bir açıyla yalan yok sağlanması, filamanın uçlarını kelepçe olabilir.
- Ayar göstergesi çıkarın ve karbon çubuk yerleştirin. co sıkarak Fix itçubuğun ucunun yüksekliği alttan ikinci bobin ortasında sağlamak evaporatör çubuk sahibinin LLET ayna. Platin tabancası için, platin çubuğunun ucunun yüksekliği en üstten ikinci iplik bobininin ortasında olmalıdır.
- saptırıcı plakasını değiştirin ve donma kırık ünitesine silahları yerleştirin. kullanıldıktan sonra bir kum blaster ile silah temizleyin.
- elektron demeti silah yerleştirmeden önce, "saptırıcı plaka" ile koruyucuyu çıkarın. Alt katot kapağından pens aynası içine filamanın ortalamak için "ayarı göstergesi" koyun.
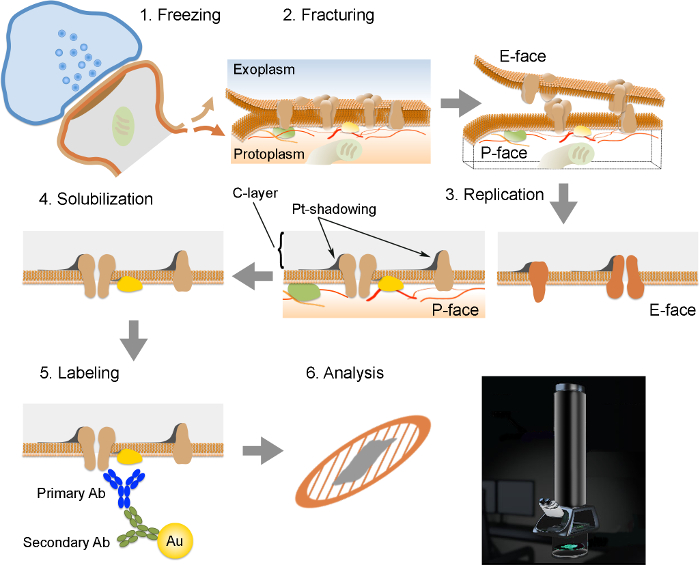
Şekil FRIL Tekniği Önemli Adımlar 2. İllüstrasyon.
hazırlanması ve kopya analizi için gerekli olan farklı adımların Anahat. doku (1) Yüksek basınç dondurma. (2) çatlama. dondurulmuş doku kırılma sırasında plazma zarlarının lipid iki katmanlı hidrofobik ara yüzeyde ikiye ayrılmıştır. plazma membranında Proteinler ya exoplasmic (E-yüz) ya da proto üzerine tahsis edilmiştirplazmik zarlar (P-yüz). (3) Çoğaltma. Karbon (C) buharlaştırılması kırılan doku yüzeyine lipidler ve proteinlerin yakalar. Malzeme yineleme yapısını (Cı-tabaka Pt gölgeleme) güçlendiren bir 15 mil C-tabaka ile daha sonra 60 ° açıyla gölgeleme 2 mil platin / karbon ile kaplanmış, ve. (4) hidrolizi. çoğaltma membran ile sıkışmasını Doku daha sonra, SDS-çözeltisi ile çözünürleştirilir. (5) Etiketleme. ilgi konusu olan proteinlerin spesifik primer antikorlar (birincil antikor) ile bir altın parçacık (Au) ile konjuge sekonder antikor (Sekonder antikor) yapılmış bir kompleksi kullanılarak çoğaltma görselleştirilebilir. Altın çeşitli boyutlardaki partiküllerin kullanımı aynı yineleme birden fazla protein algılanmasını sağlar. (6) immunolabeling sonra, maketler bakır örgü ızgaralar üzerine toplanır ve 80 bir transmisyon elektron mikroskobu ile incelenmiştir -. 100 kV tiklayiniz LütfenBu rakamın büyük halini görmek için buraya k.
- Donma kırık biriminin kurmak
- Dondurarak kırık ve çoğaltma prosedürlerinin ayrıntılı bilgi için 1'e MAINS çevirerek donma kırık birimi (Şekil 3A) açın üretici tarafından sağlanan işletme talimatlarına bakınız.
- , Donma-fraktür soğutma cihazı önce, sıcak hava ile birimin tüm soğutma sistemi üzerinden fırında. MTC 010 cihazda "Çözülme" butonuna (sıcaklık kontrol ünitesi) (Şekil 3A) basın ve 45 dakika fırında dışarı işlemi çalıştırmak.
- Vakum istasyonu etkinleştirin. 10 -7 mbar - donma kırık birimi genellikle ~ 10 -6 bir vakum aralığında çalışır.
- azot tankını doldurun ve donma kırık birimine bağlayın. valf tutucu kuru olduğunu kontrol edin ve ayrıca valf sahibinin yerleştirilmeden önce tankın girişini temizleyin (nem Vacuu engelleyebilirm ve N göstergesi tankının 2 dolum).
- -115 ° C sıcaklık ayarlayarak soğutma başlayın. Soğutma yaklaşık 45 dakika sürer.
- elektron demeti silah takın ve buharlaşma için aşağıdaki parametreleri ulaşmak için mevcut ve gerilimini ayarlamak:
Karbon tabanca: rotasyon, pozisyon 90 ° karbon birikim oranı 0,1-0,2 nm / sn
Karbon-platin tabanca: kapalı dönme, konum 60 °, birikim 0.06 oranı - 0,1 nm / sn
NOT: Bir silah karbon veya platin çubuk, kullanmadan önce 3 dakika süreyle gazının değişimi sonra ilk kez kullanılması durumunda.
- Kırılma ve çoğaltma
- Tüm manipülasyonlar sıvı nitrojen içinde yapılır emin çift yineleme tabloya donmuş taşıyıcı sandviç yerleştirin.
- Bir Dewar gemiye çift kopya tablo aktarın ve 45 ° 'lik bir açıyla örnek sahne alıcıya bunu düzeltmek. sıvı azot seviyesi daima çift kopya tablosunun üzerinde olmalıdır.
- masa manipülatör çift kopya masa Pick up ve soğuk sahneye donma kırık sokun. çift kopya tablosunun sıcaklığı -115 ° C'ye kadar uyum sağlamak için yaklaşık 20 dakika bekleyin.
- Vakum 10 -6 mbar altında ve sıcaklık -115 ° C olup olmadığını kontrol edin.
- çift kopya tablonun üstünde örtü bağlı tekerleğin manuel saat yönünün tersine dönüş dokuyu kırığı. kefen döndüğünde, doku kırılma, açmak için çift kopya tablosunu zorlar.
- Donma kırık birimi (Şekil 3A) EVM 030 cihaz (elektron demeti buharlaştırma kontrol ünitesi) 'de "Yüksek gerilim" düğmesine basın.
- Tek yönlü bir Shado ardından, 5 nm kalınlığında bir 90 ° 'lik açı ile yerleştirilmiş bir elektron ışını tabancası ile karbon (döner) buharlaştırılmasıyla kırılmış doku (Şekil 3C) açıkta kalan yüzeylerini çoğaltma2 nm kalınlığında bir 60 ° açı ile platin karbon kanadı. Son olarak, 90 ° açı (dönen) için karbon 15 nm kalınlığında bir tabaka uygulayın.
- buharlaşma için aşağıdaki parametreleri kullanın:
1 karbon: rotasyon, pozisyon 90 °; hız 0,1-0,2 nm / sn; 5 mil
2 karbon-platin: pozisyon 60 °; Hız 0,06-0,1 nm / sn; 2 nm
3 karbon: rotasyon, pozisyon 90 °; Hız 0.3 - 0.5 nm / sn; 15 mil - (Tris, pH 7.4 tamponlu tuz) dondurma parçalama ünitesinden çoğaltılmış örnekleri çıkarın ve seramik 12 plaka TBS ile doldurulmuş (Şekil 4A) aktarın.
- Bir platin döngü filmaşin kullanarak, numune taşıyıcı (Şekil 4A) çoğaltılır doku kaldırmak.
- Tüm örnekler çoğaltılmış kadar tekrarlayın 4.3.10 için 4.3.1 adımları.
 r /> Şekil 3. Freeze-çatlatma ve Çoğaltma.
r /> Şekil 3. Freeze-çatlatma ve Çoğaltma.
(A), dondurma parçalama birimi. Makine birkaç kontrol üniteleri ve bir monitör içerir. Örnekler bölmenin sol tarafında bir bağlantı noktası üzerinden hazneye yerleştirilir. Bir basınçlı sıvı azot kabı aşamasını soğumaya Donma ünitesine bağlanır. gösteri genişlemiş birimlerin iki görünümleri (UPC 010 ve MDC 010) ve ikinci karbon tabakasının buharlaşması esnasında parametrelerini görüntüleyen monitör altında Görüntüler. (B) (solda) Açılmış ve çift kopya tablonun kapalı (sağ) bakıldı. "Taşıyıcı sandviç" tablonun yuvalarına takılır (oklarla gösterilen). küçük silah manipülasyon sırasında düşmesini "taşıyıcı sandviç" engeller. (C) Bir kırık ve çoğaltılmış örnek. Replicas kırık doku üstünde ince siyah filmler görünür.53 / 53853fig3large.jpg "target =" _ blank "> bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
- Çoğaltma SDS-sindirimi
- SDS-sindirim tamponu (% 2.5 sodyum lauril sülfat, 15 mM Tris içinde% 20 sukroz, pH 8.3), 1 ml doldurulmuş 4 ml bir cam şişeye aktarın çoğaltma. (45 strok / dakika) çalkalanarak 80 ° C'de 18 saat Digest.
- Oda sıcaklığında SDS-sindirim tamponu ve mağaza ile dolu yeni bir tüp aktarın kopyaları.
5. ile immün
NOT: Bütün inkübasyonlar antikorlar ile inkubasyon haricinde hafifçe çalkalanarak oda sıcaklığında gerçekleştirilir.
- Taze, SDS-sindirim tamponu içinde 10 dakika süreyle çoğaltma yıkayın.
- TBS 2.5 5 dakika TBS içinde% BSA (sığır serum albümini), ve daha sonra 3 x 10 dakika,% 0.1 BSA ile bir kez yineleme yıkayın.
- 1 saat süre ile% 5 BSA ile TBS içinde blok spesifik olmayan bağlanma siteleri.
- Birincil anti-uygulagövdeleri% 2 BSA-TBS içinde seyreltilmiştir. 72 saat boyunca 15 ° C'de (Şekil 4C) nemli bir oda içinde 30 ul damla (Şekil 4B) inkubasyon gerçekleştirin.
- Kırık doku Bu çalışmada, süreç hem kopyaları için. amino asitler 660 kapsayan bir rekombinant füzyon proteinine karşı yükseltilmiş ya da bir fare monoklonal antikoru (200: 1: seyrelti) her AMPA-R alt birimlerinin ortak fare GluR1 754 - 717 amino asit karşı ortaya çıkartılan bir gine domuzu poliklonal antikor ile bir yineleme inkübe - NMDA R NR1 alt biriminin 811 (seyreltme: 1: 500) ve yeşil fluoresan proteine karşı ortaya çıkartılan bir tavşan poliklonal antikoru (seyreltme: 1: 300).
- (: 1: 500 seyreltme) sıçan μ-opioid reseptörü 398 - asitleri 384 amino tekabül eden bir sentetik peptide karşı ortaya çıkartılan bir tavşan poliklonal antikoru, diğer çoğaltma inkübe edin.
- % 0.05 BSA ile TBS içinde yıkayın (3 x 5 dak.).
- sekonder antikor uygulayın. Bu çalışmada u içinSE, altın (iyonotropik glutamat reseptörleri için 5 nM, 10 μ-opioid reseptörleri ve / veya ChR2 YFP 15 nm),% 2 BSA ile TBS içinde seyreltildi eşlenik antikorlar. İkincil antikorların 1:30 seyreltin ve 15 ° CO / N bir 30 ul damla kuluçkaya yatmaktadır.
- Oda sıcaklığında,% 0.05 BSA-TBS içinde 3 x 5 dk yıkayın.
- ultra saf su içinde 2 x 5 dakika yıkanır.
- Formvar kaplı 100 hattına paralel çubuk ızgara (Şekil 4D) üzerine monte çoğaltma.
6. Kopya Analizi
- 80 veya 100 kV bir transmisyon elektron mikroskobu (TEM) ile görüntü kopyaları. CCD (şarj bağlantılı cihaz) kamera aracılığıyla dijital görüntü kazanır.
- Çevrim, işaretlerini kullanarak her iki kopyaları (Şekil 4E) görüntüleri üzerinde bölgeleri karşılık bulmak. Görüntü J. postsinaptik alanı ve analiz reseptörlerine karşı immünolojik etiketli parçacıkların sayısını belirler kullanarak dijital görüntüleri analiz edin.

Şekil 4. Replica ile immün.
Manipüle ve kopyaları yıkama için (A) Araçlar. Bir seramik 12-plaka (sağ üstte) ve cam pipetler 2 tip (sol üst). yuvarlak ucu (sol altta) ile cam pipet yineleme aktarmak için kullanılır, ve platin çubuk (altta ortada) ile pipet kopyaları açılmak kullanılır. Yıkama tampon maddesi içinde bir kopyası (sağ alt). Kopyaları (B) ile immün doku kültürü 6 oyuklu plaka iyi Parafilmlerin küçük bir parça üzerine yerleştirilmiş damla (30 ul) içinde gerçekleştirilir. Bir kopya tampon içeren antikorların bir damla ile kaplıdır unutmayın. Buharlaşmayı önlemek için kağıt mendil nemli parça oyuk iç kenarı boyunca monte edilir. Immün aşama (c) inkübatörü. İnkübasyonlar 15 ° C de yapılır. (D) üzerine monte edilmiş bir kopyası, bir formvar kaplı 100-hat paralel çubuk ızgara. (E) kopyaları bir çift Düşük büyütme mikrograflar. noktalı kareler gelen kopyaları bir konum belirlemek için üç tipik simge gösterir. Ölçek çubuğu: 10 mikron. Tüm veriler gösterilir ortalama ± sem bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
Sonuçlar
FRIL tekniği, mikrobiyal orijinli 21, örneğin, plazma membranında entegre ve etkili aksonları boyunca anterogradely taşınan kanallar Optogenetic aktüatörlerin ifadesi ile bir araya getirildiğinde, belirli bir alt grup niceliksel olarak AMPA-R ve NMDA-R postsinaptik ifade incelemeye olanak sağlar sinaps. Bu amigdala ITC nöronlar üzerine (örneğin, PIN / MGN) farklı talamik çekirdeklere kaynaklanan aksonlar için burada gösterilir. Bu yaklaşım, ITC nöronlar, şimdiye kadar ayrıntılı bir anatomik ve moleküler karakterizasyonu dirençli olan hücrelerin bir grup üzerinde ayrı ayrı duyusal girdi sinaps moleküler analiz edilmesini sağlar.
Dört hafta PIN / MGN içine rAAV-ChR2 YFP stereotaktik enjeksiyonundan sonra, ChR2 YFP pozitif aksonlar yoğun LA, amygdalostriatal geçiş alanı (Astria) ve medial paracapsular I inerve Amigdala TC küme, önceki izleme ile tamamen uyumlu bir desen 22, 16 inceler. Biz de rAAV-ChR2 YFP- gelen donma-kırık çoğaltma akson ve terminallerin P-yüzünde ChR2 YFP için immün yoğun altın tespit enjekte edilen fareler (Şekil 5A), ancak olmayan enjekte edilmiş farelerden alınan yinelemede. Bir yineleme glutamaterjik sinaps postsinaptik membran uzmanlık plazma zarı 2, 23 E-yüzünde zar içi parçacıklar (IMPS) bir küme olarak görülebilir ve sıklıkla presinaptik plazma zarı 7 P yüze eşlik ediyor (Şekil 5B-C). PIN / MGN akson terminalleri tarafından oluşturulan glutamaterjik sinaps postsinaptik uzmanlık belirlemek için izin Bu özellikler (Şekil 5 ve 6). Bu NMDA Rs esas NR1 alt birimine karşı bir antikor kullanılarak tespit edilmiştir, oysa tüm dört alt birimden (GluA1-4) tanıyan bir antikor ile AMPA-R etiketli.
"Fo: keep-together.within-page =" ntent 1 "> Bu sinapsların dendritik dikenler veya ITC nöronların milleri ile yapılmış olup aynı çoğaltma tespit araçlarının eksikliği nedeniyle, biz u için gelen çoğaltma yüzünü etiketli ITC nöronlar bu reseptörlerin 24 postsynaptically yüksek seviyelerde ifade şekilde -opioid reseptörleri. Bu yerler kullanan bir strateji kullanarak iki yineleme (Şekil 5C-F Şekil 6A-B) 'de, aynı postsinaptik profillerin tespit gerekir (Şekil 4E) .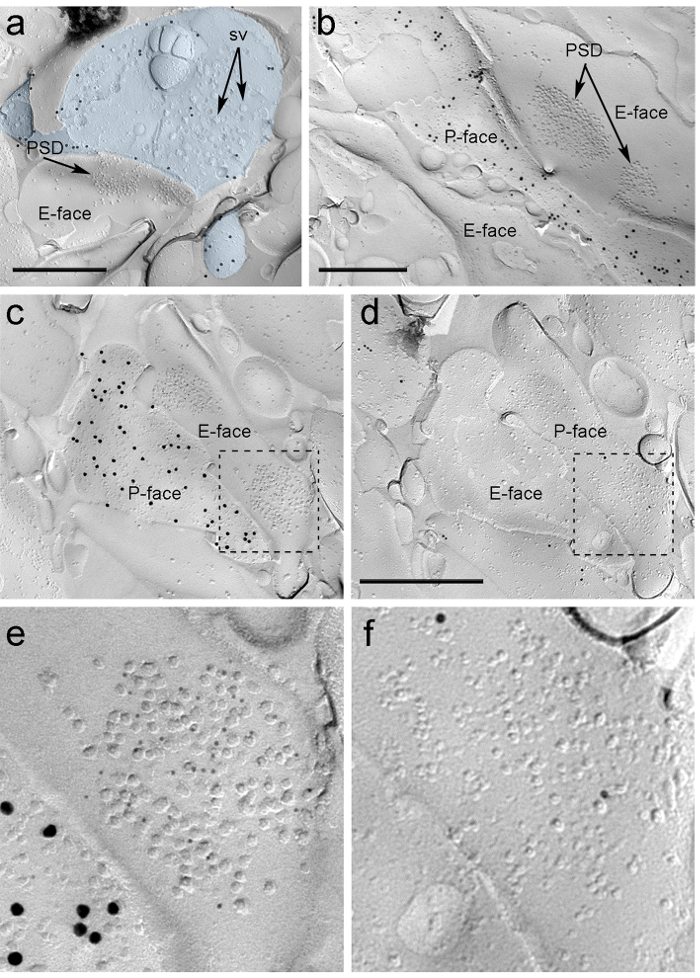
Şekil 5. immunogold Parçacıklar tarafından Replica üzerinde ChR2 YFP ve iyonotropik glutamat reseptörlerinin, algılama. (A) çapraz kırık akson terminali (açık mavi) ve ChR2 YFP tespit 15 nm altın parçacıkları ile etiketlenmiş olan P-yüzünün küçük porsiyonlarda. terminal içinde membran Of sayıda sinaptik kesecikler gözlenebilir (SV). plazma membran ile sınırlı büyük ölçüde immunolabeling özgüllüğünü edin. ChR2 için Etiketleme PIN / MGN oluşan en terminali tanımlar. Terminal bir omurga ile asimetrik sinaps oluşturur. E-yüzünde postsinaptik zar uzmanlık (PSD) zar içi parçacıkların karakteristik kümesini gösterir ve AMPA-R ortaya 5 nm altın parçacıkları ile etiketlenir. (B) (15 nm altın parçacıkları ile etiketlenmiş), bir ChR2 ifade akson p-yüzü, iki dendrit onları NMDA Rs ortaya 5 nm altın parçacıkları ile etiketlenmiş iki PİO'ların sahip birini çevreleyen gösterilmiştir. (CD) PIN / MGN-ITC sinaps öncesi ve postsinaptik membran Karşısı yüzleri. (C) terminalinin P-yüzü (15 nm altın parçacıkları ile etiketli) ChR2 ifade ve iki dendritik milleri, onları AMPA-R (5 nm altın parçacıkları) için etiketli iki PSDS içeren birinin e-yüze boyunca uzanır. ( D) iki dendritler karşılık gelen P-yüz μ-opioid reseptörlerin (10 nm altın parçacıkları) etiketlenmiştir. (EF) kesik çizgilerle belirtilen alanların Genişletilmiş manzarası. Ölçek çubukları:. 500 nm bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
PIN / MGN-ITC sinapslarda AMPA-R için İmmün parçacıklar postsinaptik uzmanlık (Şekil 5E) içinde homojen bir dağılım düşündüren, tüm IMP küme üzerinde bulundu. Bir anlamlı olarak daha yüksek (eşleşmemiş t-testi p <0.018) AMPA-R etiketleme yoğunluğu PIN / MGN gözlendi ITC dikenler üzerine sinapsların (715 ± 38 altın parçacıkları / mikron 2, n = 32) ITC dendritler üzerine sinapsların karşılaştırıldığında (590 ± 44 altın parçacıkları / um 2, n = 32). Genel olarak, PIN / MGN-ITC sinapsların AMPA-R yoğunluğu nispeten düşük gösterdiVaryans (varyans katsayısı, CV = 0.37) homojen bir dağılım tutarlı.
PIN / MGN-ITC sinapslarda NMDA Rs İmmün genellikle düzensiz postsinaptik IMP kümeleri (Şekil 5B) içinde dağıtılan gözlenmiştir. NMDA-R etiketleme yoğunluğu (eşleşmemiş t-testi, p = 0.39) PIN / MGN ITC dikenler üzerine sinapsların arasında benzerdi (1070 ± 153 altın parçacıkları / mikron 2, n = 8) ve ITC dendritler (812 ± 183 altın parçacıkları / um2, n = 9). AMPA-R gözlendi aksine ne PIN / MGN-ITC sinapsların NMDA-R yoğunluğu (CV = 0.54) çok değişken oldu.

Belirlenen PIN / MGN-ITC Sinapslar de Şekil 6. AMPA-R ve NMDA-R ile immün.
(AB) PIN / MGN-ITC öncesi ve postsinaptik membran Karşısı yüzleriTerminalin P-yüzü ChR2 ifade eden bir dendritik omurga üzerine yapılan sinaps (15 nm altın parçacıkları ile etiketli) ve dendritik omurga üzerine PSD AMPA-R (5 nm altın parçacıkları) etiketlenmiştir. (CD) kesikli çizgi ile belirtilen alanların Genişletilmiş manzarası. Bu alanlar PSD daha iyi bir görünüm sağlamak için yaklaşık 45 ° saat yönünün tersine döndürülmüş edilmiştir. (E) ITC omurgada ve dendrit sinaptik alanına karşılık AMPA-R parçacıkların sayısının saçılım. Her iki yapılarda, pozitif bir korelasyon gözlenmiştir. (F) ITC omurgada ve dendrit sinaptik alanına karşı NMDA R parçacıkların sayısının saçılım. Anlamlı bir pozitif korelasyon sadece dendritik dikenler tespit edildi. Ölçek çubukları:. 500 nm bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
çünkügenellikle kısmen postsinaptik IMP küme üste presinaptik plazma zarı P-yüz, biz sinapsların sadece% 30 sinaptik alanını tahmin olabilir (dikenler: parkı 0.032 mikron 2, aralık ortalama: 0.007 mikron 2 0.063 n = 8; dendritler: 0.047 mikron 2, aralığı: 0.024 11 mikron 2 0.166 kadar, n =). Daha önce analiz telencephalic glutamaterjik 25 sinapsların Bunlar benzer bir aralıkta idi.
Her iki dikenler ve dendritler, bireysel sinapslarda AMPA-R için altın immün parçacıkları sayısının pozitif sinaptik alanı ile korelasyon (Spearman, dikenler: r = 0.88, dendritler: r = 0.60, p <0.0001) (Şekil 6E). Ancak dendritler (r = 0.21, p = 0.29) (Şekil 6F içinde: Tersine, NMDA-R altın immün parçacıkları sayısını dikenler (r = 0.90, p <0.002 Spearman, dikenler) sinaptik alanı ile ilişkili olduğu bulunmuştur ).
Tartışmalar
Freeze-kırık elektron mikroskobu 40 yılı aşkın bir süredir ultrastrüktürel araştırma önemli bir teknik olmuştur. Ancak, membran moleküler kompozisyon çalışmak için etkin araçların eksikliği kullanımında önemli bir düşüş üretti. Son zamanlarda, bağlı immünolojik etiketleme 1, 2, yani FRIL tekniği ile yekpare zar proteinleri ortaya çıkarmak için etkin yolların geliştirilmesi için donma-fraktür elektron mikroskopisi büyük bir canlanma olmuştur.
FRIL teknik diğer immünolojik ultrastrüktürel metotlardan fazla birkaç avantaj sahiptir. İlk olarak, proteinler, duyarlılığı artırmak antikorlara kolaylıkla temin edilebilir. İkincisi, çoğaltma iki boyutlu yüzey üzerinde böyle postsinaptik membranın olarak plazma zarı uzmanlık, büyük kısmının poz seri 'zahmetli ve zaman alıcı yeniden olmadan ilgi moleküllerin mekansal dağılımı ve fiziksel bitişiklik denetlenmesine izin veriral ince kesitler. Üçüncü olarak, plazma zarının iki yarısı mevcudiyeti, her bir yapı için etiketlenebilir proteinlerin sayısı, Resim uygun antikorlar mevcuttur arttırır. kırılma üzerine bölme zarın hidrofobik yüzü kırık yüzey üzerinde kalan protein etki güçlendirmektedir karbon platin ile kaplanır. Bu durum, bu etki antijenlerine karşı antikorların erişimi engeller. Bir yineleme P-yüzünde Örneğin protoplazma alan bakan tek epitopu ise, sadece antikor ile bağlı olabilir exoplasmic alan bakan epitoplar e-yüzünde, antikorlar ile tespit edilebilir (bakınız Şekil 2).
Öte yandan, FRIL tekniği de bazı sınırlamalar 2 uğrar. kırıklar rasgele olarak belirli hücreler ya da yapıların hedef zor olabilir. Bu aynı zamanda fra farklı olasılık verilen, sinaps koleksiyonunda, örneğin bir örnekleme yanlılığı, yol açabilirFarklı eğrilik (milleri karşı örneğin, dikenler) yapıların zar boyunca cturing. Ayrıca, iki yüzlerinden birine zar proteinlerinin ayırma tahmin edilemez. Bu nedenle, P-yüze ya da E-yüzüne bir protein dağılımı, özellikle de niceliksel çalışmalar için, dikkatle hücre içi ve hücre dışı etki reaktif antikorları kullanılarak incelendi gerekir. sadece morfolojik özelliklere dayalı Son olarak, bu tür presinaptik akson terminalleri gibi bazı yapıların yinelemedeki tanımlanması zor olabilir. Bununla birlikte, işaret proteinleri için spesifik antikorların kullanımı veya etiketli integral membran proteinleri ya da ek araçlar viral vektörler sunar kullanılarak kanalların iletim kırılan membran belirlenmesini kolaylaştırmak için. Örneğin, bu çalışmada, postsinaptik Beni ortaya μ-opioid reseptörleri için amigdala ve etiketleme aksonal eferent nöronları tespit etmek talamik nöronlarda ChR2 YFP transdüksiyonu yararlandıITC nöron mbranes.
başarılı bir şekilde FRIL tekniği gerçekleştirmek için, özellikle dikkat doku fiksasyon ilgili alınmalıdır. Güçlü doku fiksasyonu (>% 2 paraformaldehid) çapraz kırık yüksek oranda ve etiketleme duyarlılığında azalmaya neden olabilir. Öte yandan, zayıf tespitler doku işleme ve hazırlama (bölümlerin örneğin, kesme) zorlaştırır. Kesilmiş blok kalınlığı çift taraflı bant kalınlığını eşleştiğini kontrol etmek de önemlidir. Numunenin kalınlığı bandının daha düşük ise, doku yüzeyleri iki metal taşıyıcı yüzeyine bağlanır olabilir, buna bağlı olarak, dondurulmuş numune parçalanmış değildir. Doku kalın ise iki bakır taşıyıcıların sandviç yapıldığında, bu kaçınılmaz yapısal bozukluklar ile sıkıştırılmış olacaktır. Numune kırılmış olan sıcaklık (Bu protokol, -115 ° C), aynı zamanda önemli bir rol oynamaktadırçoğaltma yapısı. Daha yüksek sıcaklıklar, bu tür önceki ya da buharlaşma sırasında doku yüzeyi üzerinde su buharının yoğunlaşması eserler daha yüksek bir oranı üretebilir. Düşük sıcaklıklar (<-125 ° C) kırılma sırasında malzemenin kapalı bölme riskini artırabilir. Bu malzeme numune yüzeyi üzerine düşmesine ya da ona bağlı kalabilir. Malzemenin bu pulları da kaplanmış ve görüntü üzerinde koyu lekeler üreten tezat vardır. Daha düşük sıcaklıklarda, özellikle kırılma dendritik dikenler küçük ince yapılar için enine kırık sıklığını etkileyebilir. kopyaları hazırlanmasında bir başka kritik bir adım deterjan sindirim olduğunu. sindirim eksik ise, sindirilmemiş doku TEM de yapının analizini karıştırıcı, çoğaltma koyu lekeler belirir. Ayrıca, sindirilmemiş doku arka plan etiketleme artan non-spesifik tuzak veya bağlanan antikorlar olabilir. deterjan Diğer yandan, kullanımıDoku sindirimi için s ikincil ve üçüncül yapıları değiştirerek çoğaltma ilişkili molekülleri denatüre olabilir. Bu nedenle, bazı antijenler için yavaş yavaş ilave yıkama adımları ile SDS seyreltilmesi için gerekli olabilir.
immunolabeling, ikincil antikorlara konjuge altın partikülü farklı boyutlarda mevcudiyeti, aynı zamanda tespit sağlar, ama sadece nitel, hatta postsinaptik uzmanlık olarak plazma zarının spesifik mikro bölgeler çok sayıda proteinler. Ancak, sterik engel nedeniyle, sayısal çalışmalar genel olarak tek bir molekülün saptanması ile sınırlıdır. altın parçacığı boyutu da markalama etkinliğini etkileyebilir.
FRIL etiketleme yorumlanması için, bunun nedeni esnek karmaşık forma immunogold parçacık antijen 20-25 nm yarıçaplı bir hemisfer içinde herhangi bir yerde bulunabilir akılda tutulmalıdırBirincil ve ikincil antikor 26 ile ed. Teori ve FRIL ve ilgili tekniklerin uygulamaya hakkında daha fazla bilgi için, diğer metodolojik makaleler 27, 28'e de okuyucu bakın.
FRIL tekniği son zamanlarda 30. Ayrıca, AMPA-R için FRIL tekniğinin algılama hassasiyeti bir işlevsel AMPA başına bir immunogold parçacık olarak yüksek olarak tahmin edilmiştir çeşitli sinaps popülasyonlarında 29, glutamat reseptör lokalizasyonu yüksek çözünürlüklü sayısal analizler için kullanılmıştır -R kanal 29. Böylece, bu yaklaşım ölçmek ve merkezi sinapslarda AMPA-R ve NMDA-R postsinaptik ifade desen analiz etmek genel olarak çok faydalıdır. Burada, PIN / MGN-ITC sinaps uygulanabilirliğini, korku klima sırasında ABD bilgi geçişi için büyük olasılıkla önemli bir site gösterdi. AMPA reseptör alt birimlerinin Glu yüksek derecede korunmuş hücre-dışı amino asit kalıntıları karşı artan bir antikor kullanılarakA1-GluA4, biz postsinaptik membran uzmanlık karşılık gelen IMP kümeler içinde altın parçacıkları eşit dağılımını bulundu. ITC dikenler AMPA-R yoğunluğu PIN / MGN talamik afferentleri tarafından hedeflenen şaft sinaps göre anlamlı derecede yüksek bulundu. Her iki omurga ve şaft sinaps, AMPA-R için etiketleme ve postsinaptik alanı arasında pozitif bir korelasyon, diğer glutamat sinaps 25 ortak bir özellik tespit edildi. PIN / MGN-ITC sinapslarda AMPA-R yoğunluğu düşük varyans kortikal sinaps 25 den talamik efferentler 7 tarafından oluşturulan diğer sinaps benzer, ancak farklı bir homojen dağılımını göstermektedir. Tersine, NMDA-R yoğunluğu daha değişken ve AMPA-R farklı bir düzenleme düşündüren omurga ve mil sinaps arasında fark yoktu. Gelecekte, FRIL tekniği yüksek tekrarlanabilirliği sadece merkezi sinaps bazal molekül bileşimi değerlendirmek için izin vermez, ancak c saptanmasını kolaylaştırabilirkorku öğrendikten sonra iyonotropik glutamat reseptör numaraları ve subsynaptic dağılımındaki Hanges, bu girdilerin öncesi ve postsinaptik özellikleri ex-vivo kayıtları tamamlayan.
girdilerin kökeni ve postsinaptik unsurların doğa ve kompozisyon disentangling önemli ama sorunlu olduğu Sonuç olarak, bu yaklaşım diğer birçok nöral devrelerde giriş özgü uyarıcı sinaps yapı-işlev ilişkilerinin içine anlayışlar kazanmak için diğer araştırmacılar tarafından kullanılabilir .
Açıklamalar
The authors declare that they have no competing financial interests.
Teşekkürler
Funding was provided by the Austrian Science Fund FWF grant No. P-22969-B11 to F. Ferraguti, and by the Charitable Hertie Foundation and the Werner Reichardt Centre for Integrative Neuroscience and by the DFG (CIN-Exc. 307) to I. Ehrlich.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Surgery | |||
| Stereotactic frame | Stoelting, USA | 51670 | can be replaced by other stereotactic frame for mice |
| Steretoxic frame mouse adaptor | Stoelting, USA | 51625 | |
| Gas anesthesia mask for mice | Stoelting, USA | 50264 | no longer available, replaced by item no. 51609M |
| Pressure injection device, Toohey Spritzer | Toohey Company, USA | T25-2-900 | other pressure injection devices (e.g. Picospritzer) can be used |
| Kwik Fill glass capillaries | World Precision Instruments, Germany | 1B150F-4 | |
| Anesthesia machine, IsoFlo | Eickemeyer, Germany | 213261 | |
| DC Temperature Controler and heating pad | FHC, USA | 40-90-8D | |
| Horizontal Micropipette Puller Model P-1000 | Sutter Instruments, USA | P-1000 | |
| Surgical tool sterilizer, Sterilizator 75 | Melag, Germany | 08754200 | |
| rAAV-hSyn-ChR2(H134R)-eYFP (serotype 2/9) | Penn Vector Core, USA | AV-9-26973P | |
| fast green | Roth, Germany | 0301.1 | |
| Isoflurane Anesthetic, Isofuran CP (1ml/ml) | CP Pharma, Germany | ||
| Antiseptic, Betadine (providone-iodine) | Purdure Products, USA | BSOL32 | can be replaced by other disinfectants |
| Analgesic, Metacam Solution (5mg/ml meloxicam) | Boehringer Ingelheim, Germany | can be replaced by other analgesics | |
| Bepanthen eye ointment | Bayer, Germany | 0191 | can be replaced by other eye ointments |
| Drill NM3000 (SNKG1341 and SNIH1681) | Nouvag, Switzerland | ||
| Sutranox Suture Needle | Fine Science Tools, Germany | 12050-01 | |
| Braided Silk Suture | Fine Science Tools, Germany | 18020-60 | |
| Name | Company | Catalog Number | Comments |
| Tissue preparation | |||
| Paraformaldehyde EM grade | Agar Scientific Ltd., United Kingdom | AGR1018 | |
| Saturated picric acid solution | Sigma-Aldrich, USA | P6744-1GA | |
| Na2HPO4-2H20 | Merck Millipore, Germany | 1065860500 | |
| NaH2PO4-2H2O | Merck Millipore, Germany | 1063451000 | |
| NaCl | Merck Millipore, Germany | 1064041000 | |
| 4N NaOH | Carl Roth, Germany | T198.1 | |
| Thiopental | Sandoz, Austria | 5,133 | |
| Glycerol | Sigma-Aldrich, USA | G5516-500ML | |
| GenPure ultrapure water system | Thermo Fisher Scientific, USA | 50131235 | |
| Peristaltic pump | ISMATEC, Germany | ISM 930C | |
| Filter Paper | MACHEREY-NAGEL, Germany | MN 615 1/4 | |
| Vibroslicer, VT1000S | Leica Microsystems, Austria | ||
| Ophthalmic scalpel | Alcon Laboratories, USA | can be replaced by other ophthalmic scalpels | |
| Perfusion cannula | Vieweg, Germany | F560088-1 | can be replaced by similar items from other companies |
| Name | Company | Catalog Number | Comments |
| High-pressure Freezing | |||
| Copper carriers | Engineering Office M. Wohlwend, CH | 528 | |
| Sidol Polish | Henkel, Germany | can be replaced by same item from other companies | |
| Chamois skin | Household supply store | ||
| Hole punch, 1,5mm | Stubai, Austria | can be replaced by same item from other companies | |
| Denatured ethanol | Donauchem, Austria | can be replaced by same item from other companies | |
| Aceton | Roth, Germany | 9372.5 | CAUTION! |
| High Pressure Freezing Machine HPM 010 | BalTec, CH; now Leica Microsystems | HPM010 | not produced any more, substituted by LeicaEM HPM100 |
| Stereo-microscope | Olympus, Japan | SZX10 | |
| Liquid nitrogen | CAUTION! | ||
| Cryo-vials | Roth, Germany | E309.1 | can be replaced by same item from other companies |
| CryoCane | Nalge Nunc International,USA | 5015-0001 | can be replaced by same item from other companies |
| CryoSleeve | Nalge Nunc International,USA | 5016-0001 | can be replaced by same item from other companies |
| Liquid nitrogen storage vessel | Cryopal, France | GT38 | can be replaced by same item from other companies |
| Non-ionic detergent (Lavocid) | Werner & Mertz Professional, Germany | ||
| Name | Company | Catalog Number | Comments |
| Freeze-fracture and Replication | |||
| Sandblaster, Mikromat 200-1 | JOKE Joisten & Kettenbaum, Germany | SANDURET 2-K | can be replaced by same item from other companies |
| Siliciumcarbid SIC 360, grain size 25 - 21µ | JOKE Joisten & Kettenbaum, Germany | 955932 | |
| Freeze Fracture System BAF 060 | BalTec, CH; now Leica Microsystems | BAF060 | |
| Ceramic 12 well plate | Gröpel, Austria | 14511 | can be replaced by same item from other companies |
| Trizma base | SIGMA, USA | T1503 | can be replaced by same item from other companies |
| Trizma hydrochloride | SIGMA, USA | T3253 | can be replaced by same item from other companies |
| Sodium chloride | Merck, Germany | 1,064,041,000 | can be replaced by same item from other companies |
| SDS, Sodium lauryl sulfate | Roth, Germany | 5136.1 | CAUTION! ; can be replaced by same item from other companies |
| Sucrose | Merck, Germany | 1,076,871,000 | can be replaced by same item from other companies |
| TRIS | Roth, Germany | 5429.3 | can be replaced by same item from other companies |
| Universal Hybridization Oven | Binder, Germany | 7001-0050 | can be replaced by same item from other companies |
| Name | Company | Catalog Number | Comments |
| Immunolabelling | |||
| BSA | SIGMA, USA | A9647 | can be replaced by same item from other companies |
| Anti-GFP Antibody | Molecular Probes, USA | A11122 | |
| Anti-pan-AMPAR Antibody | Frontier Institute, Japan | pan AMPAR-GP-Af580-1 | |
| Anti-NMDAR1 Antibody, clone 54.1 | Merck Millipore, Germany | MAB363 | |
| Opioid Receptor-Mu (MOR) Antibody | ImmunoStar, USA | 24216 | |
| EM goat anti-guinea pig, 5nm; secondary antibody | BBInternational, | EM.GAG5 | |
| EM goat anti-rabbit, 15nm; secondary antibody | BBInternational, | EM.GAR15 | |
| Donkey anti-rabbit, 10nm, secondary antibody | AURION, Netherlands | DAR 10nm | |
| Copper grids, 100 Parallel Bar | Agar scientific, UK | G2012C | |
| Incubator | Major Science, USA | MO-RC | can be replaced by same item from other companies |
| Pioloform Powder | Agar scientific, UK | R1275 | |
| Chloroform | Roth, Germany | 3313.1 | CAUTION! ; can be replaced by same item from other companies |
| Name | Company | Catalog Number | Comments |
| EM analysis | |||
| Philips CM120 TEM | Philips/FEI | ||
| Morada CCD camera | Soft Imaging Systems, Germany | ||
| iTEM Ver. 5.2, imaging software | Soft Imaging Systems, Germany | ||
Referanslar
- Fujimoto, K. SDS-digested freeze-fracture replica labeling electron microscopy to study the two-dimensional distribution of integral membrane proteins and phospholipids in biomembranes: practical procedure, interpretation and application. Histochem Cell Biol. 107 (2), 87-96 (1997).
- Masugi-Tokita, M., Shigemoto, R. High-resolution quantitative visualization of glutamate and GABA receptors at central synapses. Curr Opin Neurobiol. 17 (3), 387-393 (2007).
- Rash, J. E., Yasumura, T. Direct immunogold labeling of connexins and aquaporin-4 in freeze-fracture replicas of liver, brain, and spinal cord: factors limiting quantitative analysis. Cell Tissue Res. 296 (2), 307-321 (1999).
- Emes, R. D., Grant, S. G. Evolution of synapse complexity and diversity. Annu Rev Neurosci. 35, 111-131 (2012).
- Matsuzaki, M., et al. Dendritic spine geometry is critical for AMPA receptor expression in hippocampal CA1 pyramidal neurons. Nat Neurosci. 4 (11), 1086-1092 (2001).
- Rollenhagen, A., Lübke, J. H. The morphology of excitatory central synapses: from structure to function. Cell Tissue Res. 326 (2), 221-237 (2006).
- Tarusawa, E., et al. Input-specific intrasynaptic arrangements of ionotropic glutamate receptors and their impact on postsynaptic responses. J Neurosci. 29 (41), 12896-12908 (2009).
- Nusser, Z., et al. Cell type and pathway dependence of synaptic AMPA receptor number and variability in the hippocampus. Neuron. 21 (3), 545-559 (1998).
- Nyìri, G., Stephenson, F. A., Freund, T. F., Somogyi, P. Large variability in synaptic N-methyl-D-aspartate receptor density on interneurons and a comparison with pyramidal-cell spines in the rat hippocampus. Neuroscience. 119 (2), 347-363 (2003).
- Nicholson, D. A., Geinisman, Y. Axospinous synaptic subtype-specific differences in structure, size, ionotropic receptor expression, and connectivity in apical dendritic regions of rat hippocampal CA1 pyramidal neurons. J Comp Neurol. 512 (3), 399-418 (2009).
- Millhouse, O. E. The intercalated cells of the amygdala. J Comp Neurol. 247 (2), 246-271 (1986).
- Busti, D., et al. Different fear states engage distinct networks within the intercalated cell clusters of the amygdala. J Neurosci. 31 (13), 5131-5144 (2011).
- Amano, T., Unal, C. T., Paré, D. Synaptic correlates of fear extinction in the amygdala. Nat Neurosci. 13 (4), 489-494 (2010).
- Duvarci, S., Pare, D. Amygdala microcircuits controlling learned fear. Neuron. 82 (5), 966-980 (2014).
- Jüngling, K., et al. Neuropeptide S-mediated control of fear expression and extinction: role of intercalated GABAergic neurons in the amygdala. Neuron. 59 (2), 298-310 (2008).
- Asede, D., Bosch, D., Lüthi, A., Ferraguti, F., Ehrlich, I. Sensory inputs to intercalated cells provide fear-learning modulated inhibition to the basolateral amygdala. Neuron. 86 (2), 541-554 (2015).
- Maren, S. Neurobiology of Pavlovian fear conditioning. Annu Rev Neurosci. 24, 897-931 (2001).
- Pape, H. C., Pare, D. Plastic synaptic networks of the amygdala for the acquisition, expression, and extinction of conditioned fear. Physiol Rev. 90 (2), 419-463 (2010).
- Sigurdsson, T., et al. Long-term potentiation in the amygdala: a cellular mechanism of fear learning and memory. Neuropharmacology. 52 (1), 215-227 (2007).
- Bosch, D., Asede, D., Ehrlich, I. Ex-vivo optogenetic dissection of fear circuits in brain slices. J. Vis. Exp. (110), e53628 (2016).
- Fenno, L., Yizhar, O., Deisseroth, K. The development and application of optogenetics. Annu Rev Neurosci. 34, 389-412 (2011).
- Bienvenu, T. C. M., et al. Large intercalated neurons of amygdala relay noxious sensory information. J. Neurosci. 35 (5), 2044-2057 (2015).
- Sandri, C., Akert, K., Livingston, R. B., Moor, H. Particle aggregations at specialized sites in freeze-etched postsynaptic membranes. Brain Res. 41 (1), 1-16 (1972).
- Likhtik, E., Popa, D., Apergis-Schoute, J., Fidacaro, G. A., Paré, D. Amygdala intercalated neurons are required for expression of fear extinction. Nature. 454 (7204), 642-645 (2008).
- Fukazawa, Y., Shigemoto, R. Intra-synapse-type and inter-synapse-type relationships between synaptic size and AMPAR expression. Curr Opin Neurobiol. 22 (3), 446-452 (2012).
- Amiry-Moghaddam, M., Ottersen, O. P. Immunogold cytochemistry in neuroscience. Nat Neurosci. 16 (7), 798-804 (2013).
- Fukazawa, Y., Masugi-Tokita, M., Tarusawa, E., Hagiwara, A., Shigemoto, R., Cavalier, A., et al. SDS-digested Freeze-fracture replica labelling (SDS-FRL). Handbook of Cryo-Preparation Methods for Electron Microscopy. , 567-586 (2007).
- Severs, N. J. Freeze-fracture electron microscopy. Nat Protoc. 2 (3), 547-576 (2007).
- Tanaka, J., et al. Number and density of AMPA receptors in single synapses in immature cerebellum. J Neurosci. 25 (4), 799-807 (2005).
- Mansouri, M., et al. Distinct subsynaptic localization of type 1 metabotropic glutamate receptors at glutamatergic and GABAergic synapses in the rodent cerebellar cortex. Eur J Neurosci. 41 (2), 157-167 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır