Method Article
Combiné optogénétiques et Cryo-fracture Replica immunomarquage examiner l'aménagement spécifique à l'entrée de Glutamate Receptors dans l'amygdale Souris
Dans cet article
Résumé
This article illustrates how the expression of neurotransmitter receptors can be quantified and the pattern analyzed at synapses with identified pre and postsynaptic elements using a combination of viral transduction of optogenetic tools and the freeze-fracture replica immunolabeling technique.
Résumé
microscopie électronique Cryo-fracture a été une technique importante dans la recherche ultrastructurale depuis plus de 40 ans. Cependant, le manque de moyens efficaces pour étudier la composition moléculaire des membranes a produit une baisse significative de son utilisation. Récemment, il y a eu un renouveau majeur dans le gel-fracture microscopie électronique grâce au développement des moyens efficaces pour révéler les protéines membranaires intégrales par immunomarquage. Une de ces méthodes est connu comme détergent solubilisé Cryo-fracture Replica immunomarquage (FRIL).
La combinaison de la technique avec FRIL optogénétique permet une analyse corrélative des propriétés structurales et fonctionnelles des synapses centrales. En utilisant cette approche, il est possible d'identifier et de caractériser les neurones à la fois avant et post-synaptiques par leur expression respective d'un channelrhodopsin marqués et des marqueurs moléculaires spécifiques. L'aspect distinctif de la spécialisation de la membrane postsynaptique de glutamatergique synapses permet en outre, lors de l'étiquetage des récepteurs ionotropiques du glutamate, pour quantifier et analyser la répartition intrasynaptic de ces récepteurs. Ici, nous donnons une description étape par étape des procédures requises pour préparer des répliques apparié et comment les immunolabel. Nous allons également discuter des mises en garde et les limites de la technique de FRIL, en particulier ceux associés à des biais d'échantillonnage potentiels. La reproductibilité élevée et la polyvalence de la technique de FRIL, lorsqu'il est combiné avec optogénétique, offre une approche très puissante pour la caractérisation des différents aspects de la transmission synaptique à microcircuits neuronaux identifiés dans le cerveau.
Ici, nous fournissons un exemple comment cette approche a été utilisée pour mieux comprendre les relations structure-fonction des synapses excitateurs à neurones des masses de cellules intercalées de l'amygdale de la souris. En particulier, nous avons étudié l'expression des récepteurs ionotropiques du glutamate au niveau des entrées identifiées ouiginated du intralaminaire postérieur du thalamus et des noyaux géniculés médiales. Ces synapses ont été montrés pour relayer l'information sensorielle pertinente pour l'apprentissage de la peur et de subir des changements en plastique sur la peur conditionné.
Introduction
La définition de l'architecture fonctionnelle de biomembranes à l'échelle nanométrique a été contestée au cours des dernières années par le développement d'un certain nombre de techniques de immunomarquage appropriés pour la microscopie électronique à transmission. Cependant, ces techniques, par exemple, pré- et post-enrobage immunomarquage, ont un certain nombre de limitations importantes, qui comprennent une mauvaise détection des antigènes et / ou l' évaluation quantitative limitée des protéines membranaires. Ces limitations deviennent particulièrement critique dans l'enquête sur la structure fine du système nerveux, qui se caractérise par un haut degré de diversité de cellules et synapse hétérogénéité. Résultats Cette hétérogénéité de la diversité à la fois structurelle et fonctionnelle dicté par les éléments pré- et post-synaptiques et par l'expression différentielle, l'enrichissement, ou l'interaction des protéines de signalisation, tels que les récepteurs, les transporteurs et les molécules effectrices.
Une nouvelle approche pour immunolabe directeling des protéines membranaires intégrales ou réticulés dans cryofracturation répliques détergentes-solubilisé (FRIL) a été initialement introduit par Fujimoto il y a deux décennies 1. Cette méthode originale avait cependant plusieurs limites, à savoir, la fragmentation sévère des répliques, qui ont entravé les corrélations significatives des molécules marquées avec des cellules mappés individuellement dans des tissus complexes comme le cerveau. Il y a environ 10 ans, Shigemoto et Fukazawa progressivement amélioré la technique 2. Cela a été de pair avec les efforts d'un autre groupe de scientifiques dans les laboratoires Boulder de l'Université d' État du Colorado, qui ont amélioré de manière significative aussi la technique, en particulier pour l'étude des jonctions lacunaires 3.
L'amélioration des protocoles de congélation-fracturation et machines, ainsi que l'introduction de congélation rapide (sous haute pression), permet désormais aux chercheurs de produire des répliques ininterrompue de spécimens de taille relativement grande et salutdes images de qualité gh de la plupart des composants cellulaires sans les limitations et les artefacts produits par de fortes fixations chimiques.
La technique FRIL offre le grand avantage d'une très quantitative identification in situ d'une ou plusieurs protéines (simultanément) dans histologiquement cartographiée et des cellules cytologiquement identifiés dans les tissus complexes , tels que le cerveau, avec l'avantage supplémentaire d'une vue plane de pré- et post - synaptique éléments dans une seule réplique. Par conséquent, la technique de FRIL, malgré ses nombreux obstacles techniques, tient la promesse d'un certain nombre de percées scientifiques très importantes, en particulier pour la corrélation des propriétés structurelles et fonctionnelles des synapses individuelles. Au cours des dernières décennies, un grand nombre d'informations ont été obtenues sur la structure, moléculaire forment, et la fonction physiologique des synapses; encore synapses sont morphologiquement et moléculairement très diverses selon le pa pré et post-synaptiquelouer neurones 4. Seulement pour une poignée de types de synapses étaient des études structure-fonction accomplies jusqu'à présent 5-7. Cela est principalement dû à des contraintes techniques qui ont empêché une identification précise de la nature des éléments pré- et post-synaptiques.
L' analyse ultrastructurale a fourni des renseignements cruciaux sur la variabilité des spécialisations membranaires postsynaptiques à travers des contacts synaptiques distincts à la fois en termes de taille synaptique et contenu dans les récepteurs des neurotransmetteurs 6, qui a un grand impact sur la force et la plasticité de la transmission synaptique. En outre, un grand corps de recherche indique que le nombre de récepteurs ionotropiques du glutamate exprimés à différents types de synapse est régulée de façon afferent- et dépendante de la cible 7-10.
Ici, une méthode est décrite qui permet l'analyse de la composition de la structure et le récepteur des spécialisations membranaires postsynaptiques avec Defined éléments et la fonction présynaptique. Cette approche tire profit de l'expression présynaptique des protéines d'algues développées récemment sensibles à la lumière, tels que Channelrhodopsin2 (CHR2) et de la technique de FRIL pour analyser le schéma d'expression postsynaptique d'α-amino-3-hydroxy-5-méthyl-4-isoxazolepropionique l'acide (AMPA-R) et de N-méthyl-D-aspartate (NMDA-R), les récepteurs du glutamate. Cela est démontré au niveau des synapses formées par des axones provenant des postérieurs noyaux géniculés thalamique-médial (PIN / MGN) sur les neurones des masses de cellules intercalées de l'amygdale (ITC). Les neurones de l' ITC sont de petites cellules GABAergiques épineux organisés en grappes entourant le complexe amygdalien basolatéral (BLA) 11, 12. Neurones ITC sont connus pour recevoir des entrées excitateurs de BLA neurones principaux et de cibler le noyau central (ACÉ), fonctionnant ainsi comme une porte inhibitrice pour le flux d' informations entre la BLA et aCÉ 12-15.
Récemment, nous avons démontré que ITNeurones C situés dans le cluster médio-dorsale entre BLA et aCÉ reçoivent également des entrées excitatrices directes et convergentes des régions corticales thalamiques et temporelles sensorielles, qui sont modifiés sur la peur d' apprentissage au cours pavlovien auditive conditionnement de la peur 16. La peur conditionné est l'une des formes les mieux comprises de l'apprentissage associatif en termes de mécanismes cérébraux. En conditionnement de la peur, un stimulus conditionné initialement neutre (CS, par exemple, une tonalité) est associé à un stimulus aversif inconditionnée (Etats - Unis, par exemple, un choc de pied doux) résultant en une association CS-US et conditionnés réaction de peur 17, 18. Excitateurs les entrées des deux régions thalamiques et du néocortex, qui portent des informations représentant le SC et, respectivement, étaient connues pour converger vers les neurones pyramidaux du noyau latéral de l'amygdale (lA) et de subir une plasticité 19. Nos travaux antérieurs ont révélé que des informations d'entrée sensorielle est également en parallèle relayé aux neurones de l'ITC 16.
En tant que première étape vers une analyse moléculaire mécaniste de l'entrée sensorielle individuelle synapses sur les neurones du CCI, nous avons utilisé un virus adéno-associé (AAV) pour exprimer ChR2 marqué par la protéine fluorescente jaune (YFP). AAV a été injecté dans le PIN / MGN et les terminaisons axonales ont été identifiés par leur expression de CHR2-YFP. Nous avons utilisé les deux faces générées par la technique de FRIL pour évaluer la densité de AMPA-R postsynaptiques et NMDA-R au niveau des synapses formées avec les neurones de l'ITC par les terminaisons axonales PIN / MGN.
Protocole
Les procédures impliquant des sujets animaux ont été approuvés par le Regierungspraesidium Tübingen, État du Bade-Wurtemberg, en Allemagne, et par le Comité d'éthique de l'expérimentation animale autrichienne, et étaient conformes à la directive européenne sur l'utilisation des animaux dans la recherche.
1. stéréotaxique Injections de AAV-Channelrhodopsin2-YFP
NOTE: Les injections stéréotaxiques ont été effectuées selon un protocole précédemment publié 20.
- Préparer des outils stériles en les chauffant à 180 ° C pendant 1,5 heure.
- Tirez tranchants (~ 50 um de diamètre) pipettes en verre pour les injections à l'aide d'un extracteur de microélectrodes horizontal fixé avec les paramètres suivants: Heat = valeur Ramp - 20, Pull = 0, vitesse = 100, Temps = 200, pression = 200.
REMARQUE: la valeur de rampe doit être déterminée pour chaque lot de pipettes de verre achetés selon les instructions fournies par le fabricant micropipette extracteur. - Prémélange 1 pl de solution de virus et 0,2 ul de solution verte rapide à 0,1% (pour une meilleure visibilité de la solution dans la pipette de verre) dans une solution saline de tampon phosphate stérile (PBS; 25 mM, NaCl à 0,9%, pH 7,4). Remplir la pipette en verre à l'aide d'une pipette 10 ul et gel-fil conseils. Pour la construction virale, utilisez rAAV-Hsyn-ChR2 (H134R) -eYFP (sérotype 2/9).
- Anesthetize souris à l'aide d'un petit appareil d'anesthésie des animaux (3% de l'isoflurane dans de l'oxygène pour l'induction). Utilisation. Pour cette étude, utiliser 3 souris de type sauvage âgés environ 6 semaines.
- Raser la tête entre les oreilles et les yeux et désinfecter avec une solution à base de povidone-iode.
- Appliquer une pommade oculaire pour éviter le dessèchement des yeux pendant l'anesthésie. Injecter par voie sous- cutanée à la souris avec analgésique (selon le méloxicam, 0,1 ml d'une solution à 5 mg / ml).
- Placez la souris dans le cadre stéréotaxique et maintenir une anesthésie par un dispositif d'anesthésie au gaz (2% de l'isoflurane dans de l'oxygène pour l'entretien). Contrôler la profondeur d'anesthésie par le manque d'un retrait du membreréflexe avant de continuer.
- Maintenir des conditions stériles du mieux que possible pendant toute la procédure chirurgicale. Porter un masque facial jetable, une blouse chirurgicale et des gants.
- Faire une incision de la peau d'environ 1 cm sur le dessus de la tête avec des ciseaux 20. Tirez doucement sur la peau sur le côté en utilisant des pinces émoussées, fixer avec des pinces pour exposer la surface du crâne et le crâne propre avec H 2 O 2.
- sites d'injection Marquer sur le crâne à l'aide d'un marqueur permanent pointe fine. Percez un petit trou (environ 1 mm de diamètre) dans le crâne sur le site marqué. Pour l'injection unilatérale PIN / MGN dans ce stud, utilisez les coordonnées suivantes: de bregma (mm): 3.0 postérieures, latérales ± 1,8, 3,8 ventrales.
- Mont rempli pipette en verre sur le cadre stéréotaxique relié à un dispositif d'injection sous pression et amener la pipette à la position bregma.
- Casser la pointe de la pipette de verre en utilisant pince fine pointe droite. Assurez-vous que la pointe de la pipette est ouverte par applyinLes impulsions ga peu de pression et en observant l'extrusion de gouttes d'une solution de virus.
- Aller aux coordonnées d'injection désirées et injecter la moitié du contenu de la pipette (~ 0,5 pi) en utilisant les paramètres suivants sur le dispositif d'injection de pression: la pression de 20 psi, la longueur moyenne d'impulsion de 30 ms, le nombre moyen d'impulsions 50.
- Laissez pipette en place pour ~ 1 min avant de lentement (1 mm / min) rétracter.
- Nettoyer le crâne avec du PBS (pH 7,4) et retirer des pinces. Tirez doucement sur la peau ensemble, et suturer l'incision (3 - 4 nœuds). Appliquer un désinfectant (povidone-iode à base) autour de la plaie.
- Arrêtez l'anesthésie et ne pas laisser la souris sans surveillance jusqu'à ce que complètement éveillé. Gardez les souris hébergés individuellement. Après l'opération, continuer à surveiller l'état de santé; si nécessaire administrer analgésique.
- Garder les animaux pendant 4 semaines avant la fixation du cerveau pour assurer des niveaux appropriés d'expression virale.
2. Préparation des échantillons
- Fixation du cerveau </ Strong>
- Préparation de la fixatif
- Pour 1 litre de fixateur, peser 10 g de paraformaldehyde et l' ajouter à 300 ml d' eau déminéralisée 2 O. Chauffer à 55 - 60 ° C pendant environ 10 min sous agitation continue.
- Eteignez le feu et ajouter 7 - 8 gouttes de 4 N NaOH. La solution doit devenir clair dans ~ 10 min.
- Laisser refroidir à la température ambiante, ajouter 150 ml d'une solution saturée d'acide picrique et l' amener à 500 ml avec H 2 O. désionisée
- Ajouter 500 ml de 0,2 M de tampon phosphate (PB). Filtre avec du papier filtre. Ajuster le pH à 7,4 avec NaOH.
- Refroidir le fixateur à 6 ºC, le stocker dans des bouteilles en verre foncé pour ne pas plus d'un jour à 6 ºC.
- transcardiaque perfusion
- Anesthésier les souris avec une injection intraperitoneale de thiopental (120 mg / kg de poids corporel). Assurez-vous que l'animal est profondément anesthésié en cochant la réfl de retrait de la pédaleex, qui devrait être absent. Placez l'animal sur le dos sur une table de perfusion avec les quatre extrémités attachées vers le bas.
- Ouvrez la paroi abdominale longitudinalement avec des ciseaux émoussée-end et faire deux coupes supplémentaires latéralement le long de la frontière caudale de la cage thoracique, pour exposer le diaphragme. Coupez le diaphragme et couper la paroi thoracique à la frontière osteocartilageneous des deux côtés. Soulevez l'extrémité caudale de la dalle centrale de la paroi thoracique contenant le sternum pour exposer le cœur.
- Retirer le péricarde, faire une petite coupe précise dans la pointe du ventricule gauche pour admettre la canule de l'appareil de perfusion. Utiliser une canule émoussée d'un diamètre intérieur de 0,6 mm. Passez la canule doucement à travers le ventricule jusqu'à la pointe apparaît dans l'aorte ascendante et fixer la canule avec une pince. Pour permettre au sang et perfusats pour sortir du flux sanguin, faire une coupe dans l'oreillette droite.
- perfuser des souris par voie transcardiaque avec une pompe péristaltique à un débit d'écoulementde 5 ml / min dans un premier temps avec du PBS (25 mM, NaCl à 0,9%, pH 7,4) pendant environ 1 min, puis refroidi à la glace fixatif pendant 7 min.
- Après fixation, couper la tête de la souris avec une paire de ciseaux, puis couper la peau grâce à la ligne médiane du cou au nez. Retirez le muscle pour exposer entièrement le crâne.
- En utilisant des ciseaux pointus, faire une coupe longitudinale à travers l'occipital et les os interpariétales à partir du foramen magnum. En utilisant des pinces fines supprimer ces os pour exposer l'ensemble cervelet. Ensuite, faire une autre coupe longitudinale à travers le pariétal et les os frontaux jusqu'à l'os nasal et retirez-les avec des pincettes pour exposer l'ensemble du cerveau.
- Avec une spatule enlever le cerveau sans l'endommager, et placez-le dans de la glace-froid 0,1 M PB.
- Préparation de la fixatif
- Sectionnement et le rognage des spécimens
- Couper un bloc coronale d'environ 5 - 6 mm avec des lames de rasoir contenant la zone d'intérêt. Collez sur le support dela vibroslicer avec une colle cyanoacrylate. Orientez le bloc de tissu de telle sorte que le néocortex fait face à la lame vibrante. Slice coupes coronales, contenant l'amygdale, à 140 um avec le vibroslicer (figure 1A) dans de la glace-froid 0,1 M PB, et recueillir dans un plat à 6 puits dans le même tampon.
- En vertu d' un stéréomicroscope, découper la région d'intérêt (ici, le cluster paracapsular médio-dorsale de l'ITC, voir la figure 1B) de la tranche. Pour ce faire, dans une boîte de Pétri revêtue d'élastomère de silicone et rempli de 0,1 M PB, à l'aide d'un scalpel ophtalmique. Assurez - vous que les blocs taillés entrent dans le trou de l'entretoise (environ 1,5 mm) (figure 1B).
- Déplacer les blocs taillés dans la solution de cryoprotection (30% de glycérol dans 0,1 M PB) O / N à 6 ºC.
3. La congélation à haute pression
NOTE: Le FRIL se compose de 6 étapes essentielles (Figure 2): 1) congélation rapide à haute pression (à 2,300 - 2,600 bar) de l'échantillon. 2) Fracturing de l'échantillon. Le plan de fracture suit généralement le noyau central hydrophobe des membranes congelées, les scindant en deux demi-membrane tracts: demi qui se trouve à côté du protoplasma (P-face) et une demi qui se trouve à côté de l'espace extracellulaire ou exoplasmique (E- visage). 3) La réplication de l'échantillon par dépôt sous vide du platine et du carbone. 4) Le détergent digestion du tissu. 5) immunomarquage. 6) Analyse de la réplique à l'aide d'un microscope électronique à transmission.
- Préparation de supports en cuivre
REMARQUE: Pour être traitées à travers les étapes successives de la procédure de FRIL, les échantillons doivent être montés sur le métal des supports (or ou cuivre). Ces transporteurs varient en taille et la conception en fonction du mode de fracturation et le type de machines utilisées. Ici , nous avons utilisé des supports de cuivre (figure 1B, E) et une "table réplique double" charnière; (voir la figure 3B), qui lors de l' ouverture produit une fracture à la traction à travers l'échantillon congelé (Figure 2). Ceci permet de conserver et de reproduire les deux côtés de l'échantillon fracturé.- transporteurs de cuivre polonais avec un dissolvant de ternissement en utilisant une feuille de peau de chamois.
- La place des supports dans un pot de verre et nettoyer deux fois avec un détergent non-ionique (pH ~ 1,5) dans un bain d'eau de sonication, puis lavez abondamment à l'eau du robinet puis à l'eau déminéralisée puis rincer deux fois avec de l'éthanol.
- Soniquer les supports de cuivre dans de l'acétone pendant 15 minutes.
- Placez les supports sur papier filtre pour sécher.
- Fixer un anneau de ruban adhésif double face à un support en cuivre (figure 1C), qui servira de puits de support pour le (support maintenant) bloc garni.
- La congélation de l'échantillon
REMARQUE: Manipuler l'azote liquide avec soin et porter des lunettes appropriées.- Allumez la haute pression libreunité de zing (figure 1F) au moins 1,5 h avant de commencer avec le gel de l' échantillon.
- Démarrez le chauffage en appuyant sur le bouton "CHAUFFE AIR", et cuire au four pour 50 min. Réglez la température de l'air à 80 ° C.
- Connecter le réservoir d'azote à l'unité de congélation à haute pression et appuyez sur le bouton "AZOTE" pour remplir l'intérieur Dewar avec de l'azote liquide. Les allume "AZOTE LEVEL" de la lampe. Démarrer le refroidissement en appuyant sur le bouton «refroidissement».
- Appuyez sur le "DRIVE IN" bouton lorsque le "NIVEAU AZOTE" sort. Vérifier que le système hydraulique déplace le piston avant et en arrière 3 fois.
- Appuyez sur le bouton "AUTO" et le bouton "AZOTE". Dès que "READY" allume, l'unité de congélation à haute pression est prêt pour la congélation à haute pression.
- Placez un bloc garni dans le trou du ruban adhésif double face (figure 1B) en utilisant une boucle de fil de platine qui a été fondu dans agpipette lass.
- Retirer l'excédent de la solution cryoprotectrice en utilisant du papier filtre ou une brosse.
NOTE: Cette procédure est également important d'éliminer les bulles d'air qui peuvent se former autour du tissu et qui pourrait provoquer une distorsion de la forme et / ou ultrastructure tissus. - Sous un stéréomicroscope, recouvrir le support de fixation avec un autre support, de sorte que le bloc de tissu est pris en sandwich entre les deux transporteurs.
- Insérer le support en sandwich dans le porte-échantillon de l'unité de congélation à haute pression (figure 1D). Insérez le porte-échantillon dans l'unité de congélation à haute pression (la pointe vers le bas) et fixez-le en vissant dans le porte-échantillon.
- Initier le cycle de congélation en appuyant sur le bouton "Jet-Auto". Travailler aussi rapidement que possible, retirer le porte-échantillon et plonger la pointe avec de l'azote liquide dans une boîte isotherme. Immerger les pointes des deux paires de pinces dans l'azote liquide pour les refroidir.
- Retirez délicatement the porte-sandwich au porte-échantillon et le placer dans un cryovial pré-réfrigérés. Assurez-vous que les transporteurs ne sont manipulés avec une pince à l'azote liquide refroidi. Cryotubes doivent être perforés pour permettre à l'azote de s'écouler du flacon (figure 1G).
- Répétez les étapes 3.2.6 à 3.2.11 jusqu'à ce que tous les échantillons souhaités ont été gelés. sandwichs porteurs multiples qui contiennent le même type d'échantillon peuvent être stockés dans le même flacon.
- Stocker les cryotubes contenant les transporteurs dans un réservoir cryogénique jusqu'à ce que la réplication (Figure 1H).

Figure 1. Préparation des tissus et à haute pression de congélation. (A) Vibroslicer utilisés pour la section du tissu. (B) une section de cerveau de souris coronale résultante contenant le côté amygdale représenté côte à côte avec acsupport opper équipé d'un anneau de ruban adhésif double face. La boîte en pointillés indique la zone d'intérêt qui contient le cluster paracapsular médial de l'ITC. Le diamètre du trou dans le ruban adhésif double face est d'environ 1,5 mm. (C) Outils pour la préparation des supports de cuivre. De haut à gauche dans le sens horaire: ruban adhésif double face, une pince à épiler, perforateur, transporteurs de cuivre, et des ciseaux. (D) d' insertion du support en sandwich dans le porte-échantillon pour la congélation à haute pression. Le porte-sandwich est placé dans le trou du porte-échantillon. (E) transporteurs de cuivre sans et avec un anneau de ruban adhésif double face et le "support-sandwich". (F) unité de congélation à haute pression avec réservoir sous pression alimentant l' azote liquide à elle. (G) A cryovial de stocker les tissus congelés. Noter que les trous dans la position moyenne supérieure du flacon, permettant au gaz d'azote à l'écoulement du flacon (tête de flèche). (H) cryoréservoir pour stocker le tissu congelé. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
4. Cryo-fracture et réplication
- Préparation des canons à faisceau d'électrons
- Avant d'insérer les canons à faisceau d'électrons, retirer le bouclier avec la «plaque de déviation". Placez le "calibre réglage" pour centrer le filament dans la pince de serrage à travers le couvercle de cathode inférieur.
NOTE: L'extrémité de plus grand diamètre de la jauge de réglage est utilisé pour le pistolet de carbone tandis que l'extrémité de plus petit diamètre est au pistolet de platine. - Faites glisser le nouveau filament sur la jauge jusqu'à ce que "les lames de pression" peut serrer les extrémités du filament, veillant à ce que la bobine de filament ne se trouve pas à un angle.
- Retirez le gabarit de réglage et insérer la tige de carbone. Fixez en serrant la coMandrin llet du support de tige de l'évaporateur, en veillant à ce que la hauteur de l'extrémité de la tige se trouve au milieu de la seconde bobine à partir du bas. Pour le pistolet de platine, la hauteur de l'extrémité de la tige du platine doit être au milieu de la seconde bobine de filament à partir du haut.
- Remplacer la plaque de déviation et insérer des armes dans l'unité de fracture par congélation. Nettoyer les canons avec un sable-blaster après usage.
- Avant d'insérer les canons à faisceau d'électrons, retirer le bouclier avec la «plaque de déviation". Placez le "calibre réglage" pour centrer le filament dans la pince de serrage à travers le couvercle de cathode inférieur.
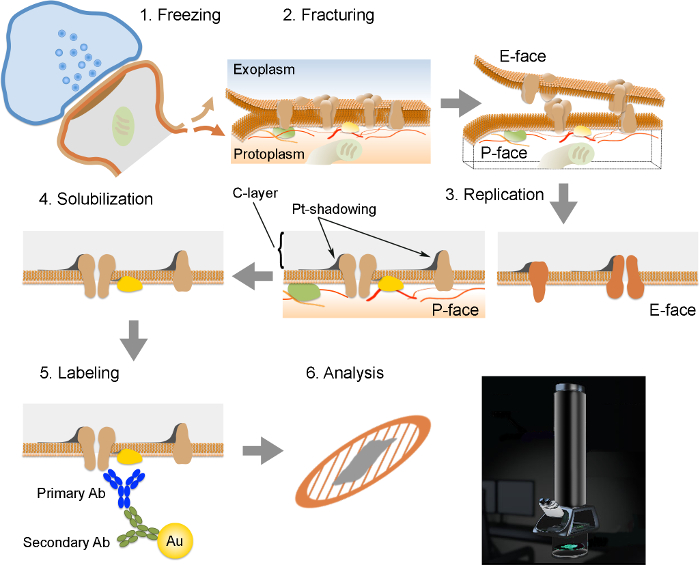
Figure 2. Illustration des étapes clés de la Technique de FRIL.
Aperçu des différentes étapes nécessaires à la préparation et l'analyse de la réplique. (1) la congélation à haute pression de tissu. (2) Fracturation. Au cours de fracturation du tissu congelé, la bicouche lipidique des membranes plasmiques est divisé en deux moitiés à l'interface hydrophobe. Les protéines de la membrane plasmique sont attribuées sur soit le exoplasmique (E-face) ou protomembranes plasmiques (P-face). (3) La réplication. L'évaporation du carbone (C), emprisonne des lipides et des protéines à la surface du tissu fracturé. Le matériau est revêtu de 2 nm de platine / carbone pour l'observation à un angle de 60 °, puis une autre couche de carbone de 15 nm, ce qui renforce la structure de la réplique (C-couche Pt-shadowing). (4) la solubilisation. Le tissu non piégé par la membrane de la réplique est ensuite solubilisé avec SDS-solution. (5) l'étiquetage. Les protéines d'intérêt peuvent être visualisées sur réplique à l'aide d'un complexe composé d'anticorps spécifiques primaires (Ab primaire) et des anticorps secondaires (Ac secondaire) conjugués à une particule d'or (Au). L'utilisation de différentes tailles de particules d'or permet la détection de plus d'une protéine sur la même réplique. (6) Après immunomarquage, les répliques sont recueillies sur des grilles de maille de cuivre et analysés avec un microscope électronique à transmission à 80. - 100 kV S'il vous plaît click ici pour voir une version plus grande de cette figure.
- Mise en place de l' unité de fracture gel
- Mettez l'unité de fracture par congélation (Figure 3A) en tournant MAINS à 1. Pour obtenir une description détaillée des procédures de fracture par congélation et de réplication, voir instructions de service fournies par le fabricant.
- Avant le refroidissement du dispositif cryofracture, cuire le système de refroidissement de l'unité avec de l'air chaud. Appuyez sur le bouton "Dégel" dans le dispositif 010 MTC (unité de contrôle de la température) (figure 3A) et laisser le processus d' étuvage course pour 45 min.
- Activez la station de vide. L'unité de fracture par congélation opère habituellement dans une plage de vide ~ 10 -6 à 10 -7 mbar.
- Remplir le réservoir d'azote et le connecter à l'unité de fracture par congélation. Vérifiez que le support de la vanne est sec et nettoyer également l'entrée du réservoir avant l'insertion du support de valve (humidité peut interférer avec VACUUm et une indication de N2 remplissage du réservoir).
- Commencez refroidissement en réglant la température à -115 ° C. Le refroidissement prend environ 45 min.
- Insérez les canons à faisceau d'électrons et ajuster le courant et la tension pour atteindre les paramètres suivants pour l'évaporation:
pistolet de carbone: rotation sur, la position 90 °, le taux d'accumulation de carbone 0,1 à 0,2 nm / sec
Carbon-platine pistolet: rotation off, la position 60 °, le taux d'accumulation de 0,06 à 0,1 nm / sec
NOTE: Si une arme à feu est utilisée pour la première fois après l'échange de la tige de carbone ou de platine, dégazer pendant 3 min avant utilisation.
- Fracturation et réplication
- Insérez Carrier-sandwichs surgelés en tableau à double réplique en vous assurant toutes les manipulations sont effectuées dans de l'azote liquide.
- Transfert à double table réplique à un vase de Dewar et le fixer au récepteur de l'étape de l'échantillon à un angle de 45 °. Le niveau d'azote liquide doit toujours être au-dessus de la double table des répliques.
- Ramassez la double table réplique avec le manipulateur de tables et l'insérer dans l'unité de fracture par congélation sur la scène froide. Attendez environ 20 minutes pour permettre à la température de la double table des répliques pour régler à -115 ° C.
- Vérifiez que le vide est inférieur à 10 -6 mbar et la température est -115 ° C.
- Fracture du tissu par rotation manuelle dans le sens antihoraire de la roue reliée à l'enveloppe placée au-dessus de la double table des répliques. Lorsque le capot tourne, il force la double table réplique pour ouvrir, fracturer le tissu.
- Appuyez sur le bouton "haute tension" dans le (unité faisceau électronique de contrôle de l' évaporation) 030 dispositif EVM de l'unité de fracture par congélation (Figure 3A).
- Reproduire les surfaces exposées du tissu fracturé (figure 3C) par évaporation du carbone ( en rotation) au moyen d'un canon à faisceau d'électrons positionné à un angle par rapport à une épaisseur comprise entre 5 nm et 90 °, suivie d'une shado unidirectionnell'aile avec du platine-carbone à un angle de 60 ° par rapport à une épaisseur de 2 nm. Enfin, appliquer une couche épaisse de 15 nm de carbone à partir d'un angle de 90 ° (rotation).
- Utilisez les paramètres suivants pour l'évaporation:
1er carbone: rotation sur, la position 90 °; vitesse de 0,1 à 0,2 nm / sec; 5 nm
2e carbone-platine: la position 60 °; la vitesse de 0,06 à 0,1 nm / sec; 2 nm
3ème carbone: rotation sur, la position 90 °; vitesse de 0,3 à 0,5 nm / sec; 15 nm - Retirer les échantillons répliqués à partir de l'unité de fracture par congélation et les transférer sur une plaque de 12 puits en céramique (figure 4A) rempli avec du TBS (Tris solution saline tamponnée, pH 7,4).
- À l' aide d' une tige de fil de la boucle de platine, enlever le tissu reproduit à partir du support d'échantillons (figure 4A).
- Répétez les étapes 4.3.1 à 4.3.10 jusqu'à ce que tous les échantillons ont été répliquées.
 r /> Figure 3. Gel-fracturation et la réplication.
r /> Figure 3. Gel-fracturation et la réplication.
(A) L'unité de fracture par congélation. La machine comporte plusieurs unités de commande et un moniteur. Les échantillons sont introduits dans la chambre à travers un orifice sur le côté gauche de la chambre. Récipient d'azote liquide sous pression est relié à l'unité de fracture par congélation pour refroidir la scène. Images ci-dessous montrent une vue agrandie de deux des unités (UPC 010 et MDC 010) et le moniteur affichant les paramètres lors de l'évaporation de la seconde couche de carbone. ( À droite) vues fermées de la double table de réplique (B) Ouvert ( à gauche) et. Les "supports" sandwichs sont insérés dans les fentes de la table (indiquées par des flèches). Les armes de petit calibre empêchent "support-sandwiches" de tomber lors de la manipulation. (C) Un échantillon fracturé et répliqué. Répliques apparaissent minces films noirs sur le dessus du tissu fracturé.53 / 53853fig3large.jpg "target =" _ blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
- SDS-digestion de la réplique
- Transfert réplique dans un flacon en verre de 4 ml remplie de 1 ml de tampon SDS-digestion (2,5% Laurylsulfate de sodium, 20% de saccharose dans du Tris 15 mM, pH 8,3). Digest pendant 18 heures à 80 ° C sous agitation (45 temps / min).
- Transfert des répliques à un nouveau tube rempli de tampon SDS-digestion et conserver à la température ambiante.
5. immunomarquage
REMARQUE: Toutes les incubations sont réalisées à température ambiante avec une agitation douce, à l'exception des incubations avec les anticorps.
- Laver la réplique pendant 10 min dans un tampon SDS-digestion frais.
- Laver la réplique une fois avec 2,5% de BSA (sérum albumine bovine) dans du TBS pendant 5 min, puis 3 x 10 minutes avec 0,1% de BSA dans du TBS.
- des sites de liaison non spécifiques de bloc dans TBS avec 5% de BSA pendant 1 heure.
- Appliquer anti- primaireorganismes dilués dans 2% de BSA-TBS. Effectuer incubations dans un 30 goutte ul (figure 4B) dans une chambre humide à 15 ° C pendant 72 heures (figure 4C).
- Pour cette étude, processus à la fois des répliques du tissu fracturé. Incuber une réplique avec un anticorps polyclonal de Guinée porcin dirigé contre les acides aminés 717 - 754 de la souris GluR1 commun à toutes les sous-unités AMPA-R (dilution 1: 200) ou un anticorps monoclonal de souris dirigés contre une protéine de fusion recombinante couvrant les acides aminés 660 - 811 de la sous-unité NR1 du NMDA-R (dilution: 1: 500), et un anticorps polyclonal de lapin dirigé contre la protéine fluorescente verte (dilution: 1: 300).
- Incuber l'autre réplique avec un anticorps polyclonal de lapin dirigé contre un peptide synthétique correspondant aux acides aminés 384 - 398 du récepteur μ opioïde chez le rat (dilution 1: 500).
- Laver dans du TBS avec 0,05% de SAB (3 x 5 min.).
- Appliquer des anticorps secondaires. Pour cette étude use or (5 nm pour ionotropiques récepteurs du glutamate, des récepteurs 10 pour μ-opioïdes et / ou 15 nm pour ChR2-YFP) anticorps conjugués dilués dans du TBS avec 2% de BSA. Diluer Anticorps secondaires 1:30 et incuber dans une chute de 30 pi à 15 ° CO / N.
- Laver 3 x 5 min à 0,05% de BSA-TBS à température ambiante.
- Laver 2 x 5 min dans de l'eau ultrapure.
- Mont réplique sur formvar revêtu 100 lignes barres parallèles grille (Figure 4D).
6. Analyse Replica
- Réplique d'image avec un microscope électronique à transmission (MET) à 80 ou 100 kV. Acquérir des images numériques grâce à un CCD (dispositif à couplage de charge) caméra.
- Hors ligne, trouver des régions correspondantes sur les images des deux répliques à l' aide des repères (Figure 4E). Analyser les images numériques en utilisant J. Image Déterminer la zone postsynaptique et le nombre de particules de immunomarquage marqués dirigés contre le récepteur analysé.

Figure 4. immunomarquage de réplique.
(A) Outils pour la manipulation et le lavage des répliques. Une plaque de 12 puits en céramique (en haut à droite) et 2 types de pipettes en verre (en haut à gauche). La pipette en verre avec bout rond (en bas à gauche) est utilisé pour transférer réplique, et de la pipette avec la tige de platine (en bas au centre) est utilisé pour déployer des répliques. Une réplique dans un tampon de lavage (en bas à droite). (B) immunomarquage des répliques est effectuée en gouttes (30 pi) placés sur un petit morceau de parafilm dans un puits d'une culture de tissu plaque de 6 puits. A noter qu'une réplique est recouvert d'une goutte de la mémoire tampon contenant des anticorps. Pour empêcher l'évaporation, une feuille humide de papier de soie est monté autour du bord intérieur du puits. (C) incubateur pour l'étape d'immunomarquage. Les incubations sont réalisées à 15 ° C. (D) Une réplique monté sur un formvar revêtu 100-ligne grille de barre parallèle. (E) à faible grossissement des micrographies d'une paire de répliques. Les carrés en pointillés indiquent trois points de repère typiques pour identifier un emplacement dans les répliques correspondantes. Barre d'échelle: 10 um. Toutes les données sont présentées en moyenne ± sem S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Résultats
La technique FRIL, lorsqu'elle est combinée avec l' expression d'actionneurs optogénétiques d'origine microbienne 21, c. -à- canaux intégrés dans la membrane plasmique et efficacement transportées anterogradely le long des axones, permet d'examiner quantitativement l'expression postsynaptique de AMPA-R et NMDA-R à un sous - groupe défini des synapses. Ceci est montré ici pour axones provenant de noyaux thalamiques distincts (par exemple, le code PIN / MGN) sur les neurones de l' ITC dans l'amygdale. Cette approche permet une analyse moléculaire des synapses individuelles d'entrée sensorielles sur les neurones du CCI, un groupe de cellules qui ont été réfractaires à une caractérisation anatomique et moléculaire détaillée à ce jour.
Quatre semaines après l'injection stéréotaxique du rAAV-CHR2-YFP dans le PIN / MGN, axones ChR2-YFP-positifs densément innervés la LA, la zone de transition amygdalostriatal (Astria) et le paracapsular médial I Cluster de TC dans l'amygdale, un modèle pleinement compatible avec le traçage précédente étudie 16, 22. Nous avons également détecté l' or intense immunomarquage pour le ChR2-YFP sur le P-face des axones et des terminaux cryofracturation réplique de rAAV-CHR2-YFP- souris injectées (figure 5A), mais pas dans des répliques de souris non injectées. La spécialisation de la membrane postsynaptique des synapses glutamatergiques dans une réplique peut être observé comme un amas de particules intramembranaires (PGI) sur l'E-face de la membrane plasmique 2, 23, et est souvent accompagné par le P-face de sa membrane plasmique présynaptique 7 (figure 5B-C). Ces caractéristiques ont permis d'identifier la spécialisation postsynaptique des synapses glutamatergiques formées par les terminaisons axonales PIN / MGN (figure 5 et 6). Nous avons étiqueté AMPA-R avec un anticorps qui reconnaît les quatre sous-unités (GluA1-4), tandis NMDA-R ont été détectés en utilisant un anticorps dirigé contre la sous-unité NR1 essentielle.
ntent "fo: keep-together.within-page =" 1 "> En raison du manque d'outils pour détecter sur la même réplique que ces synapses ont été faites avec des épines ou des arbres de neurones ITC dendritiques, nous marqué le visage de la réplique correspondante pour μ récepteurs opioïde, comme les neurones du CCI expriment des niveaux élevés de postsynaptique ces récepteurs 24. Ce nécessaires à l'identification des mêmes profils postsynaptiques dans les deux répliques (Figure 5C-F et la figure 6A-D) en utilisant une stratégie qui utilise des repères (Figure 4E) .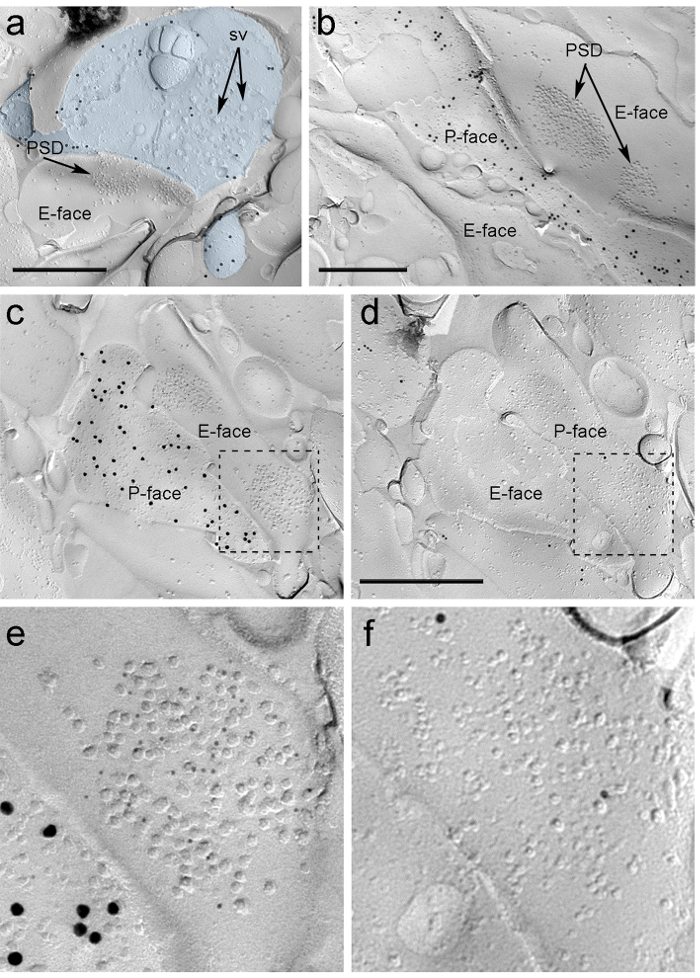
Figure 5. Détection de ChR2-YFP et ionotropiques Glutamate Receptors sur Replica par immunomarquage particules. (A) Un terminal axone cross-fracture (bleu clair) et de petites portions de son P-face marquée avec des particules d'or 15 nm détection ChR2-YFP. Dans le terminal, la membrane ode nombreuses vésicules synaptiques f peuvent être observées (sv). Noter la spécificité de l'immuno-marquage en grande partie limitée à la membrane plasmique. Étiquetage pour ChR2 identifie le terminal comme provenant du PIN / MGN. Le terminal forme une synapse asymétrique avec une colonne vertébrale. La spécialisation de la membrane postsynaptique (PSD) sur le E-face montre un cluster caractéristique de particules intramembranaires et est marquée avec des particules d'or 5 nm révélant AMPA-R. (B) Le P-face d'un axone ChR2 exprimant (marqué avec 15 particules d' or nm) est représentée en bordure de deux dendrites, l' un d'entre eux possédant deux PSDs marquées avec des particules d'or 5 nm révélant NMDA-R. (CD) des faces opposées des membranes pré- et post - synaptiques d'une synapse PIN / MGN-ITC. (C) Le P-face du terminal exprime ChR2 (marquée avec des particules d'or 15 nm) et étend sur la E-face de deux arbres dendritiques, l' un d'entre eux contenant deux PSDs étiquetés pour AMPA-R (5 particules nm d'or). ( D) Le P-de face correspondant des deux dendrites est marquée pour les récepteurs μ-opioïdes (10 particules nm d'or). (EF) vues agrandies des zones définies par les lignes en pointillés. Barres d'échelle:. 500 nm S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Immunoparticles pour AMPA-R dans les synapses PIN / MGN-ITC ont été trouvés dans le groupe IMP, ce qui suggère une répartition homogène au sein de la spécialisation post - synaptique (Figure 5E). A significativement plus élevée (test t apparié p <0,018) la densité de l' étiquetage AMPA-R a été observée dans PIN / MGN synapses sur les épines de l' ITC (715 ± 38 particules d'or / um 2, n = 32) par rapport aux synapses SUR DES dendrites ITC (590 ± 44 particules d'or / um 2, n = 32). Dans l'ensemble, la densité de AMPA-R en PIN synapses / MGN-ITC a montré une relativement faiblela variance (coefficient de variation CV = 0,37), compatible avec une répartition homogène.
Immunoparticles pour NMDA-R dans les synapses PIN / MGN-ITC ont souvent été observés inégalement répartis au sein des clusters IMP postsynaptiques (figure 5B). La densité de l' étiquetage NMDA-R était similaire (apparié test t p = 0,39) entre PIN / MGN synapses sur les épines de l' ITC (1070 ± 153 particules d'or / um 2, n = 8) et dendrites ITC (812 ± 183 particules d'or / 2 pm, n = 9). Contrairement à ce qui a été observé pour AMPA-R, la densité de NMDA-R en PIN synapses / MGN-ITC était très variable (CV = 0,54).

Figure 6. AMPA-R et NMDA-Rs immunomarquage à Synapses identifiés PIN / MGN-ITC.
(AB) Les faces opposées des membranes pré- et post - synaptiques d'un code PIN / MGN-ITCsynapse fait sur une colonne vertébrale dendritique dans lequel le P-face du terminal exprime ChR2 (marqué avec 15 particules d'or nm) et le PSD sur une colonne vertébrale dendritique est étiqueté pour AMPA-R (5 particules nm d'or). (CD) des vues agrandies des zones définies par la ligne en pointillés. Ces zones ont été tourné d'environ 45 ° vers la gauche pour permettre une meilleure vue de la PSD. (E) Diagrammes de dispersion des particules du nombre de AMPA-R par rapport à la zone synaptique dans les épines et les dendrites ITC. Dans les deux structures, une corrélation positive a été observée. (F) Diagrammes de dispersion des particules du nombre de NMDA-R contre la zone synaptique dans les épines et les dendrites ITC. Une corrélation positive significative a été détectée seulement dans les épines dendritiques. Barres d'échelle:. 500 nm S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Carle P-face de la membrane plasmique présynaptique souvent recouvert en partie le cluster IMP postsynaptique, nous avons pu estimer la zone synaptique de seulement 30% des synapses (épines: surface moyenne 0,032 pm 2, plage: 0,007 à 0,063 pm 2, n = 8; dendrites: 0,047 um 2, plage: 0,024 à 0,166 pm 2, n = 11). Ceux - ci étaient dans une gamme similaire glutamatergique télencéphalique analysé précédemment synapses 25.
Dans les deux épines et les dendrites, le nombre de immunoparticules d'or pour AMPA-R dans les synapses individuelles était positivement corrélée avec la zone synaptique (Spearman, épines: r = 0,88, dendrites: r = 0,60, p <0,0001) (figure 6E). A l' inverse, le nombre d'immunoparticules d'or pour NMDA-R a été trouvé une corrélation avec la région synaptique dans les épines (Spearman, épines: r = 0,90, p <0,002) , mais pas dans les dendrites (r = 0,21, p = 0,29) (figure 6F ).
Discussion
microscopie électronique Cryo-fracture a été une technique importante dans la recherche ultrastructurale depuis plus de 40 ans. Cependant, le manque de moyens efficaces pour étudier la composition moléculaire des membranes a produit une baisse significative de son utilisation. Récemment, il y a eu un renouveau majeur dans la microscopie électronique cryofracturation en raison du développement de moyens efficaces pour révéler les protéines membranaires intégrales par marquage immunologique 1, 2, à savoir la technique de FRIL.
La technique de FRIL possède plusieurs avantages par rapport à d'autres méthodes ultrastructurales immunomarquage. Tout d'abord, les protéines sont facilement accessibles aux anticorps augmentant la sensibilité. En second lieu, l'exposition d'une grande partie des spécialisations de la membrane plasmique, tels que la membrane postsynaptique, sur la surface à deux dimensions de la réplique permet l'inspection de la distribution spatiale et de la contiguïté physique de molécules d'intérêt sans reconstruction laborieuse et prend du temps de serisections al ultraminces. En troisième lieu, la disponibilité des deux moitiés de la membrane plasmatique augmente le nombre de protéines qui peuvent être marqués pour chaque structure individuelle, des anticorps appropriés fournis sont disponibles. Lors de la fracturation, la face hydrophobe de la membrane de séparation est revêtue avec du carbone-platine qui enchâsse domaines protéiques restant sur la surface fracturée. Ceci empêche l'accès des anticorps dirigés contre des antigènes dans ces domaines. Par exemple sur le P-face d'une réplique seulement épitopes tournée vers l'espace protoplasmique peuvent être détectés par des anticorps, alors que sur le E-face seulement épitopes face à l'espace exoplasmique peut être lié par des anticorps (voir la figure 2).
D'autre part, la technique de FRIL souffre également de certaines limitations 2. Les fractures se produisent de façon aléatoire, il peut être difficile de cibler des cellules ou des structures spécifiques. Cela peut également conduire à un biais d'échantillonnage, par exemple, dans la collecte de synapse, compte tenu de la probabilité différente de fracturing le long de la membrane des structures avec une courbure différente (par exemple, par rapport à des épines des arbres). En outre, la répartition des protéines de la membrane à une des deux faces est imprévisible. Par conséquent, la distribution d'une protéine à la P-face ou E-face, en particulier pour les études quantitatives, doit être soigneusement examinée en utilisant des anticorps réactifs à des domaines intracellulaires et extracellulaires. Enfin, l'identification dans la réplique de certaines structures, telles que les terminaisons axonales présynaptiques, peut être difficile quand basée uniquement sur des caractéristiques morphologiques. Cependant, l'utilisation d'anticorps spécifiques pour des protéines marqueurs ou la transduction des protéines membranaires intégrales composées ou des canaux en utilisant des vecteurs viraux offre des outils supplémentaires pour faciliter l'identification des membranes fracturés. Par exemple, cette étude a profité de la transduction du ChR2-YFP dans les neurones thalamiques pour identifier leurs efférents axonales dans l'amygdale ou l'étiquetage pour les récepteurs μ-opioïdes pour révéler me postsynaptiquembranes des neurones de l'ITC.
Afin de réaliser la technique de FRIL avec succès, une attention particulière doit être prise au sujet de la fixation des tissus. fixation du tissu Strong (> 2% de paraformaldehyde) peut se traduire par un taux élevé de fractures transversales et une diminution de la sensibilité à l'étiquetage. D'un autre côté, les fixations faibles rendent la manipulation des tissus et la préparation (par exemple, la coupe de sections) difficile. Il est également important de contrôler que l'épaisseur des blocs taillés correspond à l'épaisseur de la bande à double face. Si l'épaisseur de l'échantillon est inférieure à celle de la bande, les surfaces du tissu peuvent ne pas attacher à la surface des deux supports métalliques, par conséquent, les échantillons congelés ne sont pas fracturé. Si le tissu est plus épais, il sera compressé avec des distorsions structurelles inévitables lorsque le sandwich des deux supports en cuivre est effectuée. La température à laquelle l'échantillon est fracturé (dans ce protocole, -115 ° C) joue également un rôle importantsur la structure de la réplique. Des températures plus élevées peuvent produire un taux d'artefacts tels que la condensation ultérieure de la vapeur d'eau sur la surface du tissu avant ou pendant l'évaporation. Des températures plus basses (<-125 ° C) peut augmenter le risque de séparation du matériau lors de la fracturation. Ce matériau peut tomber sur la surface de l'échantillon ou de rester connecté à elle. Ces flocons de matériau sont également revêtu et contrasté produisant des taches sombres sur l'image. Fractures à des températures plus basses peut également affecter la fréquence des fractures transversales particulièrement pour les petites structures fines telles que les épines dendritiques. Une étape critique en outre dans la préparation de répliques est le détergent digestion. Si la digestion est incomplète, le tissu non digérés apparaît comme des taches sombres sur la réplique, confondant l'analyse de la structure au TEM. En outre, le tissu non digérés peut non spécifique des anticorps de piégeage ou se lient, en augmentant l'étiquetage de fond. D'autre part, l'utilisation d'un détergents à la digestion du tissu peut dénaturer les molécules associées à la réplique, modifiant leurs structures secondaires et tertiaires. Par conséquent, pour certains antigènes, il pourrait être nécessaire de diluer progressivement la concentration de SDS avec des étapes de lavage supplémentaires.
Pour les immuno-marquage, la disponibilité de différentes tailles de particules d'or conjuguée à des anticorps secondaires permet de détecter en même temps, mais que de manière qualitative, de multiples protéines, même dans des microdomaines particuliers de la membrane plasmique, tels que la spécialisation postsynaptique. Toutefois, en raison de l'encombrement stérique, les études quantitatives sont généralement limitées à la détection d'une seule molécule. La taille de la particule d'or peut également affecter l'efficacité de marquage.
Pour l'interprétation de l'étiquetage en FRIL, il faut garder à l'esprit que la particule de immunomarquage peut être situé n'importe où dans un hémisphère avec un rayon de 20-25 nm de l'antigène en raison de la forme complexe soupleed par l'anticorps primaire et secondaire 26. Pour de plus amples informations sur la théorie et la pratique de FRIL et techniques connexes, nous renvoyons le lecteur aussi à d' autres articles méthodologiques 27, 28.
La technique de FRIL a récemment été utilisé pour des analyses quantitatives à haute résolution de la localisation des récepteurs du glutamate dans les populations de synapse diverses 29, 30. En outre, la sensibilité de détection de la technique de FRIL pour AMPA-R a été estimée aussi élevée que une particule immunomarquage par une AMPA fonctionnelle canal -R 29. Ainsi, cette approche est globalement très utile de quantifier et d'analyser le profil d'expression postsynaptique de AMPA-R et NMDA-R au niveau des synapses centrales. Ici, nous avons démontré son applicabilité au niveau des synapses PIN / MGN-ITC, un site très probablement important pour nous relayer l'information au cours de conditionnement de la peur. En utilisant un anticorps dirigé contre les résidus d'acides aminés hautement conservés extracellulaires des sous-unités du récepteur de l'AMPA GluA1-GluA4, nous avons trouvé une répartition uniforme des particules d'or dans les grappes IMP correspondant aux spécialisations membranaires postsynaptiques. La densité de AMPA-R dans les épines de l'ITC était significativement plus élevée par rapport aux synapses d'arbre ciblés par PIN / MGN afférences thalamiques. Dans les deux synapses de la colonne vertébrale et de l' arbre, une corrélation positive entre l' étiquetage des AMPA-R et la zone postsynaptique a été détectée, une caractéristique commune à d' autres synapses glutamatergiques 25. La faible variance de la densité de AMPA-R en synapses PIN / MGN-ITC indique une distribution homogène similaire à d' autres synapses formées par efférents thalamiques 7, mais différent de synapses corticales 25. A l'inverse, la densité de NMDA-R était plus variable et ne différait pas entre la colonne vertébrale et l'arbre synapses suggérant une régulation différente de AMPA-R. À l'avenir, la grande reproductibilité de la technique de FRIL permettra non seulement d'évaluer la composition moléculaire basale des synapses centrales, mais peut faciliter la détection de changements en nombre de récepteurs ionotropiques du glutamate et de la distribution subsynaptic après l' apprentissage de la peur, en complément des enregistrements ex-vivo des propriétés pré- et post - synaptiques de ces entrées.
En conclusion, cette approche pourrait être utilisée par d'autres chercheurs pour mieux comprendre les relations structure-fonction des synapses excitateurs spécifiques entrée dans de nombreux autres circuits neuronaux dans lequel démêlage l'origine des entrées et de la nature et la composition des éléments postsynaptiques est cruciale mais problématique .
Déclarations de divulgation
The authors declare that they have no competing financial interests.
Remerciements
Funding was provided by the Austrian Science Fund FWF grant No. P-22969-B11 to F. Ferraguti, and by the Charitable Hertie Foundation and the Werner Reichardt Centre for Integrative Neuroscience and by the DFG (CIN-Exc. 307) to I. Ehrlich.
matériels
| Name | Company | Catalog Number | Comments |
| Surgery | |||
| Stereotactic frame | Stoelting, USA | 51670 | can be replaced by other stereotactic frame for mice |
| Steretoxic frame mouse adaptor | Stoelting, USA | 51625 | |
| Gas anesthesia mask for mice | Stoelting, USA | 50264 | no longer available, replaced by item no. 51609M |
| Pressure injection device, Toohey Spritzer | Toohey Company, USA | T25-2-900 | other pressure injection devices (e.g. Picospritzer) can be used |
| Kwik Fill glass capillaries | World Precision Instruments, Germany | 1B150F-4 | |
| Anesthesia machine, IsoFlo | Eickemeyer, Germany | 213261 | |
| DC Temperature Controler and heating pad | FHC, USA | 40-90-8D | |
| Horizontal Micropipette Puller Model P-1000 | Sutter Instruments, USA | P-1000 | |
| Surgical tool sterilizer, Sterilizator 75 | Melag, Germany | 08754200 | |
| rAAV-hSyn-ChR2(H134R)-eYFP (serotype 2/9) | Penn Vector Core, USA | AV-9-26973P | |
| fast green | Roth, Germany | 0301.1 | |
| Isoflurane Anesthetic, Isofuran CP (1ml/ml) | CP Pharma, Germany | ||
| Antiseptic, Betadine (providone-iodine) | Purdure Products, USA | BSOL32 | can be replaced by other disinfectants |
| Analgesic, Metacam Solution (5mg/ml meloxicam) | Boehringer Ingelheim, Germany | can be replaced by other analgesics | |
| Bepanthen eye ointment | Bayer, Germany | 0191 | can be replaced by other eye ointments |
| Drill NM3000 (SNKG1341 and SNIH1681) | Nouvag, Switzerland | ||
| Sutranox Suture Needle | Fine Science Tools, Germany | 12050-01 | |
| Braided Silk Suture | Fine Science Tools, Germany | 18020-60 | |
| Name | Company | Catalog Number | Comments |
| Tissue preparation | |||
| Paraformaldehyde EM grade | Agar Scientific Ltd., United Kingdom | AGR1018 | |
| Saturated picric acid solution | Sigma-Aldrich, USA | P6744-1GA | |
| Na2HPO4-2H20 | Merck Millipore, Germany | 1065860500 | |
| NaH2PO4-2H2O | Merck Millipore, Germany | 1063451000 | |
| NaCl | Merck Millipore, Germany | 1064041000 | |
| 4N NaOH | Carl Roth, Germany | T198.1 | |
| Thiopental | Sandoz, Austria | 5,133 | |
| Glycerol | Sigma-Aldrich, USA | G5516-500ML | |
| GenPure ultrapure water system | Thermo Fisher Scientific, USA | 50131235 | |
| Peristaltic pump | ISMATEC, Germany | ISM 930C | |
| Filter Paper | MACHEREY-NAGEL, Germany | MN 615 1/4 | |
| Vibroslicer, VT1000S | Leica Microsystems, Austria | ||
| Ophthalmic scalpel | Alcon Laboratories, USA | can be replaced by other ophthalmic scalpels | |
| Perfusion cannula | Vieweg, Germany | F560088-1 | can be replaced by similar items from other companies |
| Name | Company | Catalog Number | Comments |
| High-pressure Freezing | |||
| Copper carriers | Engineering Office M. Wohlwend, CH | 528 | |
| Sidol Polish | Henkel, Germany | can be replaced by same item from other companies | |
| Chamois skin | Household supply store | ||
| Hole punch, 1,5mm | Stubai, Austria | can be replaced by same item from other companies | |
| Denatured ethanol | Donauchem, Austria | can be replaced by same item from other companies | |
| Aceton | Roth, Germany | 9372.5 | CAUTION! |
| High Pressure Freezing Machine HPM 010 | BalTec, CH; now Leica Microsystems | HPM010 | not produced any more, substituted by LeicaEM HPM100 |
| Stereo-microscope | Olympus, Japan | SZX10 | |
| Liquid nitrogen | CAUTION! | ||
| Cryo-vials | Roth, Germany | E309.1 | can be replaced by same item from other companies |
| CryoCane | Nalge Nunc International,USA | 5015-0001 | can be replaced by same item from other companies |
| CryoSleeve | Nalge Nunc International,USA | 5016-0001 | can be replaced by same item from other companies |
| Liquid nitrogen storage vessel | Cryopal, France | GT38 | can be replaced by same item from other companies |
| Non-ionic detergent (Lavocid) | Werner & Mertz Professional, Germany | ||
| Name | Company | Catalog Number | Comments |
| Freeze-fracture and Replication | |||
| Sandblaster, Mikromat 200-1 | JOKE Joisten & Kettenbaum, Germany | SANDURET 2-K | can be replaced by same item from other companies |
| Siliciumcarbid SIC 360, grain size 25 - 21µ | JOKE Joisten & Kettenbaum, Germany | 955932 | |
| Freeze Fracture System BAF 060 | BalTec, CH; now Leica Microsystems | BAF060 | |
| Ceramic 12 well plate | Gröpel, Austria | 14511 | can be replaced by same item from other companies |
| Trizma base | SIGMA, USA | T1503 | can be replaced by same item from other companies |
| Trizma hydrochloride | SIGMA, USA | T3253 | can be replaced by same item from other companies |
| Sodium chloride | Merck, Germany | 1,064,041,000 | can be replaced by same item from other companies |
| SDS, Sodium lauryl sulfate | Roth, Germany | 5136.1 | CAUTION! ; can be replaced by same item from other companies |
| Sucrose | Merck, Germany | 1,076,871,000 | can be replaced by same item from other companies |
| TRIS | Roth, Germany | 5429.3 | can be replaced by same item from other companies |
| Universal Hybridization Oven | Binder, Germany | 7001-0050 | can be replaced by same item from other companies |
| Name | Company | Catalog Number | Comments |
| Immunolabelling | |||
| BSA | SIGMA, USA | A9647 | can be replaced by same item from other companies |
| Anti-GFP Antibody | Molecular Probes, USA | A11122 | |
| Anti-pan-AMPAR Antibody | Frontier Institute, Japan | pan AMPAR-GP-Af580-1 | |
| Anti-NMDAR1 Antibody, clone 54.1 | Merck Millipore, Germany | MAB363 | |
| Opioid Receptor-Mu (MOR) Antibody | ImmunoStar, USA | 24216 | |
| EM goat anti-guinea pig, 5nm; secondary antibody | BBInternational, | EM.GAG5 | |
| EM goat anti-rabbit, 15nm; secondary antibody | BBInternational, | EM.GAR15 | |
| Donkey anti-rabbit, 10nm, secondary antibody | AURION, Netherlands | DAR 10nm | |
| Copper grids, 100 Parallel Bar | Agar scientific, UK | G2012C | |
| Incubator | Major Science, USA | MO-RC | can be replaced by same item from other companies |
| Pioloform Powder | Agar scientific, UK | R1275 | |
| Chloroform | Roth, Germany | 3313.1 | CAUTION! ; can be replaced by same item from other companies |
| Name | Company | Catalog Number | Comments |
| EM analysis | |||
| Philips CM120 TEM | Philips/FEI | ||
| Morada CCD camera | Soft Imaging Systems, Germany | ||
| iTEM Ver. 5.2, imaging software | Soft Imaging Systems, Germany | ||
Références
- Fujimoto, K. SDS-digested freeze-fracture replica labeling electron microscopy to study the two-dimensional distribution of integral membrane proteins and phospholipids in biomembranes: practical procedure, interpretation and application. Histochem Cell Biol. 107 (2), 87-96 (1997).
- Masugi-Tokita, M., Shigemoto, R. High-resolution quantitative visualization of glutamate and GABA receptors at central synapses. Curr Opin Neurobiol. 17 (3), 387-393 (2007).
- Rash, J. E., Yasumura, T. Direct immunogold labeling of connexins and aquaporin-4 in freeze-fracture replicas of liver, brain, and spinal cord: factors limiting quantitative analysis. Cell Tissue Res. 296 (2), 307-321 (1999).
- Emes, R. D., Grant, S. G. Evolution of synapse complexity and diversity. Annu Rev Neurosci. 35, 111-131 (2012).
- Matsuzaki, M., et al. Dendritic spine geometry is critical for AMPA receptor expression in hippocampal CA1 pyramidal neurons. Nat Neurosci. 4 (11), 1086-1092 (2001).
- Rollenhagen, A., Lübke, J. H. The morphology of excitatory central synapses: from structure to function. Cell Tissue Res. 326 (2), 221-237 (2006).
- Tarusawa, E., et al. Input-specific intrasynaptic arrangements of ionotropic glutamate receptors and their impact on postsynaptic responses. J Neurosci. 29 (41), 12896-12908 (2009).
- Nusser, Z., et al. Cell type and pathway dependence of synaptic AMPA receptor number and variability in the hippocampus. Neuron. 21 (3), 545-559 (1998).
- Nyìri, G., Stephenson, F. A., Freund, T. F., Somogyi, P. Large variability in synaptic N-methyl-D-aspartate receptor density on interneurons and a comparison with pyramidal-cell spines in the rat hippocampus. Neuroscience. 119 (2), 347-363 (2003).
- Nicholson, D. A., Geinisman, Y. Axospinous synaptic subtype-specific differences in structure, size, ionotropic receptor expression, and connectivity in apical dendritic regions of rat hippocampal CA1 pyramidal neurons. J Comp Neurol. 512 (3), 399-418 (2009).
- Millhouse, O. E. The intercalated cells of the amygdala. J Comp Neurol. 247 (2), 246-271 (1986).
- Busti, D., et al. Different fear states engage distinct networks within the intercalated cell clusters of the amygdala. J Neurosci. 31 (13), 5131-5144 (2011).
- Amano, T., Unal, C. T., Paré, D. Synaptic correlates of fear extinction in the amygdala. Nat Neurosci. 13 (4), 489-494 (2010).
- Duvarci, S., Pare, D. Amygdala microcircuits controlling learned fear. Neuron. 82 (5), 966-980 (2014).
- Jüngling, K., et al. Neuropeptide S-mediated control of fear expression and extinction: role of intercalated GABAergic neurons in the amygdala. Neuron. 59 (2), 298-310 (2008).
- Asede, D., Bosch, D., Lüthi, A., Ferraguti, F., Ehrlich, I. Sensory inputs to intercalated cells provide fear-learning modulated inhibition to the basolateral amygdala. Neuron. 86 (2), 541-554 (2015).
- Maren, S. Neurobiology of Pavlovian fear conditioning. Annu Rev Neurosci. 24, 897-931 (2001).
- Pape, H. C., Pare, D. Plastic synaptic networks of the amygdala for the acquisition, expression, and extinction of conditioned fear. Physiol Rev. 90 (2), 419-463 (2010).
- Sigurdsson, T., et al. Long-term potentiation in the amygdala: a cellular mechanism of fear learning and memory. Neuropharmacology. 52 (1), 215-227 (2007).
- Bosch, D., Asede, D., Ehrlich, I. Ex-vivo optogenetic dissection of fear circuits in brain slices. J. Vis. Exp. (110), e53628 (2016).
- Fenno, L., Yizhar, O., Deisseroth, K. The development and application of optogenetics. Annu Rev Neurosci. 34, 389-412 (2011).
- Bienvenu, T. C. M., et al. Large intercalated neurons of amygdala relay noxious sensory information. J. Neurosci. 35 (5), 2044-2057 (2015).
- Sandri, C., Akert, K., Livingston, R. B., Moor, H. Particle aggregations at specialized sites in freeze-etched postsynaptic membranes. Brain Res. 41 (1), 1-16 (1972).
- Likhtik, E., Popa, D., Apergis-Schoute, J., Fidacaro, G. A., Paré, D. Amygdala intercalated neurons are required for expression of fear extinction. Nature. 454 (7204), 642-645 (2008).
- Fukazawa, Y., Shigemoto, R. Intra-synapse-type and inter-synapse-type relationships between synaptic size and AMPAR expression. Curr Opin Neurobiol. 22 (3), 446-452 (2012).
- Amiry-Moghaddam, M., Ottersen, O. P. Immunogold cytochemistry in neuroscience. Nat Neurosci. 16 (7), 798-804 (2013).
- Fukazawa, Y., Masugi-Tokita, M., Tarusawa, E., Hagiwara, A., Shigemoto, R., Cavalier, A., et al. SDS-digested Freeze-fracture replica labelling (SDS-FRL). Handbook of Cryo-Preparation Methods for Electron Microscopy. , 567-586 (2007).
- Severs, N. J. Freeze-fracture electron microscopy. Nat Protoc. 2 (3), 547-576 (2007).
- Tanaka, J., et al. Number and density of AMPA receptors in single synapses in immature cerebellum. J Neurosci. 25 (4), 799-807 (2005).
- Mansouri, M., et al. Distinct subsynaptic localization of type 1 metabotropic glutamate receptors at glutamatergic and GABAergic synapses in the rodent cerebellar cortex. Eur J Neurosci. 41 (2), 157-167 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon