Method Article
Комбинированный оптогенетика и сублимационной перелом реплики иммунноокрашивания по анализу Устройство ввода специфических рецепторов глутамата у мышей Amygdala
В этой статье
Резюме
This article illustrates how the expression of neurotransmitter receptors can be quantified and the pattern analyzed at synapses with identified pre and postsynaptic elements using a combination of viral transduction of optogenetic tools and the freeze-fracture replica immunolabeling technique.
Аннотация
Замораживание-Перелом электронная микроскопия была основным методом в ультраструктурным исследований на протяжении более 40 лет. Тем не менее, отсутствие эффективных средств для изучения молекулярного состава мембран получают значительное снижение его использования. В последнее время было основным возрождение в сублимационной разрушения электронной микроскопии благодаря разработке эффективных методов выявления интегральных мембранных белков с помощью метки антител. Одним из таких методов известен как моющее средство солюбилизированных ПРОТИВООБЛЕДЕНИТЕЛЬНОЕ перелом реплики иммунноокрашивания (FRIL).
Сочетание метода FRIL с оптогенетика позволяет коррелированный анализ структурных и функциональных свойств центральных синапсах. Используя этот подход, можно идентифицировать и охарактеризовать как до, так и постсинаптические нейроны их соответствующим выражением помеченной channelrhodopsin и специфических молекулярных маркеров. Отличительная появление постсинаптической мембраны специализации glutamatергическая синапсы в дальнейшем позволяет, при маркировке ионотропных глутаматных рецепторов, для количественного определения и анализа intrasynaptic распределение этих рецепторов. Здесь мы даем шаг за шагом описание процедур, необходимых для подготовки спаренных реплики и как immunolabel их. Мы также будем обсуждать предостережения и ограничения метода FRIL, в частности те, которые связаны с потенциальными уклонов выборки. Высокая воспроизводимость и универсальность метода FRIL, в сочетании с оптогенетика, предлагает очень эффективный подход для характеристики различных аспектов синаптической передачи при определенных нейрональных микросхемами в головном мозге.
Здесь мы приведем пример того, как этот подход был использован, чтобы получить понимание структурно-функциональных отношений возбуждающих синапсов на нейронах интеркалирован- клеточных масс миндалине мыши. В частности, мы исследовали экспрессию рецепторов глутамата ионотропных на определенных входов илиiginated от таламуса задней интраламинарных и медиальных ядер коленчатых. Эти синапсы были показаны для передачи сенсорной информации, имеющей отношение к обучению и страха пройти пластические изменения на страхе кондиционирования.
Введение
Определение функциональной архитектуры биомембран в нанометровом масштабе была поставлена под сомнение в последние годы с развитием целого ряда методов иммунноокрашивания, пригодных для просвечивающей электронной микроскопии. Тем не менее, эти методы, например, до и после вложения immunogold, имеют ряд важных ограничений, которые включают плохое обнаружение антигенов и / или ограниченной количественной оценки связанных с мембраной белков. Эти ограничения становятся особенно важно при исследовании тонкой структуры нервной системы, которая характеризуется высокой степенью разнообразия клеток и синапсов гетерогенности. Эта гетерогенность является результатом как структурного и функционального разнообразия, диктуемого пре- и постсинаптические элементов и дифференциальным выражением, обогащение, или взаимодействие сигнальных белков, таких как рецепторы, транспортеров и эффекторных молекул.
Предложен новый подход для прямого immunolabeлин интегральных или сшитых мембранных белков в детергентов солюбилизированный замораживанием перелом репликами (FRIL) первоначально был введен Фудзимото два десятилетия назад 1. Этот оригинальный метод был, однако, некоторые ограничения, то есть, тяжелая фрагментация репликах, что затрудняло значимые корреляции меченых молекул с индивидуально отображенных клетками в сложных тканей , таких как мозг. Около 10 лет назад, Shigemoto и Fukazawa постепенно усовершенствовали технику 2. Это было параллельно с усилиями другой группой ученых в лабораториях глыбой Университета штата Колорадо, которые также значительно улучшили технику, в частности , для изучения щелевых контактов 3.
Улучшение протоколов сублимационной разрыва пласта и машин, а также введение быстрого замораживания (под высоким давлением), теперь позволяет исследователям производить сплошную точные копии образцов относительно большого размера и приветСТГ качество изображения большинства клеточных компонентов без ограничений и артефактов, производимых сильными химическими фиксаций.
Техника FRIL предлагает большое преимущество высоко количественного идентификации на месте одного или нескольких белков (одновременно) в гистологически нанесены на карту и цитологическое идентифицированных клеток в сложных тканей , таких как мозг , в, с дополнительным преимуществом плоского зрения пред- и постсинаптической элементы в одной реплики. Таким образом, метод FRIL, несмотря на многочисленные технические препятствия, держит обещание для ряда очень важных научных открытий, в частности, для корреляции структурных и функциональных свойств отдельных синапсов. В течение последних нескольких десятилетий, большая часть информации была получена на структуре, молекул составляют, и физиологические функции синапсов; пока синапсы морфологически и молекулярно весьма разнообразны в зависимости от предварительной и постсинаптической рааренда нейроны 4. Только для нескольких типов синапсов были структурно-функциональные исследования выполнены до сих пор 5-7. Это объясняется в основном из-за технических ограничениями, которые не позволили точное определение природы пред- и постсинаптических элементов.
Ультраструктурный анализ предоставил критически взглянуть на изменчивость постсинаптических мембранных специализаций через различных синаптических контактов как с точки зрения синаптической размера и содержания в рецепторов нейромедиаторов 6, который имеет большое влияние на прочность и пластичность синаптической передачи. Кроме того, большое количество исследований указывает на то, что число ионотропных глутаматных рецепторов , выраженных в различных типах синапсов регулируется в afferent- и целевой зависимой моды 7-10.
Здесь метод изложен, что позволяет провести анализ структуры и состава рецепторов постсинаптических мембран с специализаций определяютг пресинаптические элементы и функции. Этот подход использует преимущества пресинаптической выражение недавно разработанных светочувствительных водорослевые белков, таких как channelrhodopsin2 (ChR2), и методики FRIL проанализировать структуру постсинаптических экспрессии α-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты (AMPA-R) и N-метил-D-аспартата (NMDA-R) глутаматных рецепторов. Это проявляется в синапсах, образованных аксонов, происходящих из задних таламическая-медиальных ядер коленчатых (PIN / MGN) на нейроны вставочных клеточных масс миндалине (ITC). ITC нейроны являются небольшие ГАМКергических клетки колючий организованы в кластеры вокруг базолатеральная миндалевидного комплекса (BLA) 11, 12. КВТ нейроны , как известно, получают возбуждающие входы от Bla главных нейронов и целевой центральное ядро (СЕА), таким образом , функционирует в качестве тормозящего ворот для информационного потока между BLA и CeA 12-15.
Недавно мы показали, что ИТНейроны C , расположенные в медио-дорсальные кластера между BLA и CeA также получают прямые и конвергентные возбуждающие входы от сенсорных таламуса и височной областях коры, которые модифицированы на страх в процессе обучения павловской слуховом кондиционирования страха 16. Страх кондиционирования является одним из наиболее понятных форм ассоциативного обучения в терминах механизмов мозга. В страхе кондиционирования, первоначально нейтральный условный раздражитель (CS, например, тон) в паре с аверсивного безусловным раздражителем (США, например, мягкий нога шок) , что приводит к ассоциации с CS-США и условная реакция страха 17, 18. Возбуждающих входы от обоих таламуса и неокортекса областях, которые несут информацию , представляющую CS и США, соответственно, были известны сходиться на пирамидальных нейронов латерального ядра миндалины (LA) и пройти пластичность 19. Наша предыдущая работа показала, что сенсорное входная информация также параллельно ретранслируется КВТ нейронов 16.
В качестве первого шага на пути к механистической молекулярного анализа индивидуального сенсорного ввода синапсы на нейронах КВТ, мы использовали аденоассоциированный вирус (AAV), чтобы выразить ChR2 помечены желтым флуоресцентным белком (YFP). ААВ вводили в PIN / MGN и терминалы аксона были идентифицированы по их экспрессии ChR2-YFP. Мы использовали оба лица, сгенерированные методом FRIL для оценки плотности постсинаптических AMPA-R и NMDA-R в синапсах, образованных с КВТ нейронах аксонов PIN / MGN.
протокол
Процедуры с участием субъектов животных были одобрены Regierungspraesidium Тюбинген, Баден-Вюртемберг, Германия, и Совет по австрийской экспериментирования животных по вопросам этики, и были в соответствии с директивой ЕС по использованию животных в научных исследованиях.
1. Стереотактическая Инъекции ААВ-Channelrhodopsin2-YFP
Примечание: Стереотаксические инъекции были проведены в соответствии с ранее опубликованного протокола 20.
- Готовят стерильные инструменты путем их нагревания при 180 ° С в течение 1,5 ч.
- Потяните острые (диаметром ~ 50 мкм) стеклянные пипетки для инъекций с использованием горизонтального микроэлектродного съемник набор со следующими параметрами: Heat = значение Ramp - 20, Pull = 0, скорость = 100, Время = 200, давление = 200.
Примечание: Значение Ramp должно быть определено для каждой партии купленных стеклянных пипеток в соответствии с инструкциями, предоставленными производителем микропипетка съемника. - Премикс 1 мкл раствора вируса и 0,2 мкл 0,1% раствора быстрого зеленого (для лучшей видимости раствора в стеклянной пипетке) в стерильном фосфатно-солевом буфере (PBS; 25 мМ, 0,9% NaCl, рН 7,4). Заполните стеклянную пипетку с помощью 10 мкл пипетки и гель-FIL советы. Для вирусной конструкции, использовать Раав-hSyn-ChR2 (H134R) -eYFP (серотип 2/9).
- Обезболить мышь с помощью небольшого животного анестезии устройство (3% изофлуран в кислороде для индукции). Используйте. Для этого исследования используют 3 мышей дикого типа в возрасте ~ 6 недель.
- Бритье головы между ушами и глазами и дезинфицируют раствором на основе повидон-йод.
- Нанесите мазь для глаз, чтобы предотвратить высыхание глаза во время анестезии. Подкожно вводят мышь с обезболивающим (мелоксикам основе, 0,1 мл 5 мг раствора / мл).
- Поместите мышь в стереотаксической рамы и поддержания анестезии с помощью газовой анестезии устройства (2% изофлуран в кислороде для технического обслуживания). Проверьте анестезии глубину отсутствием вывода конечностирефлекс перед продолжением.
- Поддержание стерильных условий как можно лучше в течение всей хирургической процедуры. Носите одноразовую лицевую маску, хирургический халат и перчатки.
- Делают кожу надрезать приблизительно 1 см на верхней части головы с помощью ножниц 20. Осторожно потяните кожу в сторону , используя тупой пинцет, зафиксировать с помощью зажимов , чтобы разоблачить поверхности черепа и очистить череп с H 2 O 2.
- Места инъекций Все на черепе с помощью тонкого наконечника перманентным маркером. Просверлить маленькое отверстие (примерно 1 мм в диаметре) в череп в отмеченном месте. Для одностороннего PIN / MGN инъекции в этом шпилькой, используйте следующие координаты: от темени (мм): 3,0 задние, боковые ± 1,8, брюшные 3,8.
- Маунт заполнены стеклянной пипетки на стереотаксической рамы, соединенного с инъекционной давления устройства и довести пипетку брегмы позицию.
- Оторвать кончик стеклянной пипетки с использованием тонких прямых наконечников щипцов. Убедитесь, что кончик пипетки открыт applyinга импульсы мало давления и наблюдения за экструзия капель раствора вируса.
- Перейти к требуемым координатам впрыска и вводят половину содержания пипетки (~ 0,5 мкл), используя следующие настройки на устройстве впрыска под давлением: давление 20 фунтов на квадратный дюйм, средняя длительность импульса 30 мс, среднее число импульсов 50.
- Оставьте пипеткой на месте в течение ~ 1 мин, прежде чем медленно (1 мм / мин) его втягивания.
- Чистый череп с PBS (рН 7,4) и снимите зажимы. Осторожно потяните кожу вместе, и сшивать разрез (3 - 4 узла). Применение дезинфицирующего средства (повидон-йода на основе) вокруг раны.
- Прекратить анестезию и не откладывайте мышь без присмотра, пока полностью просыпаются. Держите мышей одной размещались. В послеоперационном периоде продолжают следить за состоянием здоровья; при необходимости анальгетик Администрируйте.
- Держите животных за 4 недели до начала фиксации мозга, чтобы обеспечить соответствующие уровни экспрессии вирусного.
2. Изготовление образцов
- Мозг фиксации </ Сильный>
- Приготовление закрепителя
- Для получения 1 л закрепителя, весят 10 г параформальдегида и добавить его в 300 мл деионизированной H 2 O. Нагревают до 55 - 60 ° С в течение ~ 10 мин при непрерывном перемешивании.
- Выключить огонь и добавить 7 - 8 капель 4 N NaOH. Решение должно быть ясно, в ~ 10 мин.
- Дать ему остыть до комнатной температуры, добавляют 150 мл насыщенного раствора пикриновой кислоты и довести его до 500 мл деионизированной H 2 O.
- Добавить 500 мл 0,2 М фосфатного буфера (PB). Фильтр с фильтровальной бумагой. Доведения рН до 7,4 с помощью NaOH.
- Охлаждают закрепитель до 6 ° С, храните его в темных стеклянных бутылках не более чем на один день при 6 ° С.
- Transcardiac перфузия
- Обезболить мышей с внутрибрюшинного введения тиопентала (120 мг / кг массы тела). Убедитесь, что животное глубоко под наркозом путем проверки вывода педали Reflех, которые должны отсутствовать. Место животное на спине на столе перфузионного с четырех конечностей связаны вниз.
- Открыть брюшной стенки в продольном направлении с тупым концом ножниц и сделать два дополнительных сокращений в боковом направлении вдоль хвостового границы грудной клетки, чтобы выставить диафрагму. Срежьте диафрагму и разрезать грудную стенку на osteocartilageneous границе с обеих сторон. Поднимите Хвостовой конец центральной плиты грудной стенки, содержащей грудину, чтобы разоблачить сердце.
- Удалить перикарда, сделать небольшой разрез в точный кончик левого желудочка признать канюлю перфузионной аппарата. С помощью тупого канюлю с внутренним диаметром 0,6 мм. Пропустите полую иглу мягко через желудочек до кончик появляется в восходящей части аорты и закрепить канюлю с зажимом. Для того чтобы кровь и perfusates к выходу из потока крови, сделать разрез в правом предсердии.
- Мыши обрызгивать транскардиальную с использованием перистальтического насоса при скорости потока5 мл / мин сначала с PBS (25 мМ, 0,9% NaCl, рН 7,4) в течение приблизительно 1 мин, а затем охлажденный льдом фиксаторе в течение 7 мин.
- После фиксации, разъединить голову мыши с ножницами, а затем порезать кожу через среднюю линию от шеи до носа. Удалите мышцы, чтобы полностью разоблачить череп.
- Используя острые ножницы, сделать продольный разрез через затылочной и interparietal костей, начиная от затылочного отверстия. Использование тонких пинцеты удалить эти кости, чтобы выставить весь мозжечок. Затем сделайте еще один продольный разрез через теменной и лобной кости до носовой кости и удалить их с помощью пинцета, чтобы разоблачить весь мозг.
- С помощью шпателя удалить мозг, не повредив его, и поместить его в ледяной 0,1 М PB.
- Приготовление закрепителя
- Секционирование и обрезке образцов
- Вырезать корональной блок примерно 5 - 6 мм с лезвиями, содержащих интересующую область. Клей его на держательvibroslicer с цианакриловым клеем. Сориентируйте блок ткани таким образом, что неокортекс сталкивается с вибрирующим лезвием. Разрез Коронарные срезы, содержащие миндалины, при 140 мкм с vibroslicer (рисунок 1А) в охлажденном льдом 0,1 М PB, и собирает их в 6-луночного блюдо в том же самом буфере.
- Под стереомикроскопа, отсечь область интереса (здесь медио-дорсальные paracapsular скопление КВТ см Фигура 1В) от среза. Делайте это в чашку Петри, покрытую силиконового эластомера и, заполненного 0,1 М PB, используя глазную скальпель. Убедитесь , что обрезанные блоки укладываются в отверстие проставки (примерно 1,5 мм) (рис 1В).
- Перемещение обрезанные блоков в раствор криозащиты (30% глицерина в 0,1 М PB) O / N при 6 ° С.
3. Высокая Замораживание давления
Примечание: FRIL состоит из 6 существенных шагов (Рисунок 2): 1) быстрое замораживание с высоким давлением (при 2,300 - 2,600 бар) образца. 2) растрескивание образца. Плоскость перелома в целом соответствует центральной гидрофобного ядра замороженных мембран, разделив их на две половины мембраны листков: а половина, которая находится рядом с протоплазмы (Р-лица) и половину, которая находится рядом с внеклеточной или exoplasmic пространства (E- лицо). 3) тиражирование образца методом вакуумного осаждения платины и углерода. 4) моюще-переваривание ткани. 5) метки антител. 6) Анализ реплики с использованием просвечивающего электронного микроскопа.
- Получение медных носителей
Примечание: Для того, чтобы быть обработаны через последовательные этапы процедуры FRIL, образцы должны быть смонтированы на металлической (золота или меди) носителей. Эти носители различаются по размеру и конструкции в соответствии с режимом трещиноватости и типа машин, используемых. Здесь мы использовали медные носители (рис 1B, Е) и шарнирной "двойной стол реплики"; (см Рисунок 3B), который при открытии производит растяжение трещины через замерзшие образца (рисунок 2). Это позволяет сохранять и копировать обе стороны сломанных образца.- Польские медные носители с окалины для удаления с использованием листа замшевой кожи.
- Место носителей в стеклянном чайнике и чистый дважды с неионогенного детергента (рН ~ 1,5) в ультразвуковую водяной бани, а затем интенсивно промыть в проточной воде, затем деионизированной водой, а затем промыть дважды этанолом.
- Разрушать ультразвуком медные носители в ацетоне в течение 15 мин.
- Поместите носители на фильтровальную бумагу, чтобы высушить.
- Приложите кольцо двухсторонней ленты к медной носителя (Рисунок 1С), который будет служить в качестве удерживающего хорошо для отделан блок (холдинг носителя).
- Замораживание образца
Примечание: Обращаться с жидким азотом с осторожностью и носить соответствующие очки.- Включите высокого давления свободногоБлок Zing (рис 1F) , по меньшей мере 1,5 ч , прежде чем начать с образцом замораживания.
- Начните нагрев, нажав на кнопку "Воздухонагреватель", и выпекать в течение 50 мин. Заданное значение температуры воздуха до 80 ° C.
- Подключите баллон с азотом с морозильный блок высокого давления и нажмите кнопку "АЗОТА", чтобы заполнить внутреннюю Дьюара с жидким азотом. В "АЗОТ LEVEL" лампочка. Начало охлаждения, нажав на кнопку "охлаждение".
- Нажмите кнопку "IN-ДРАЙВ" кнопку, когда "АЗОТ LEVEL" гаснет. Убедитесь, что гидравлическая система перемещает поршень назад и вперед 3 раза.
- Нажмите кнопку "AUTO", а кнопка "АЗОТА". Как только "ГОТОВ" загорается, блок замораживания высокого давления готов к замораживанию высокого давления.
- Поместите обрезанную блок в отверстие двусторонней клейкой ленты (рисунок 1б) с использованием цикла из платиновой проволоки , который был расплавлен в AGдеваха пипетку.
- Удалите избыток криопротектора раствора с использованием фильтровальной бумаги или кистью.
Примечание: Эта процедура также имеет важное значение, чтобы удалить пузырьки воздуха, которые могут образовываться вокруг ткани и которые могут привести к искажению формы ткани и / или ультраструктуры. - Под стереомикроскопа, покрывают несущую удерживающую с другим носителем, таким образом, что блок ткань зажата между двумя несущими.
- Вставьте носитель многослойными в держатель образца блока замораживания высокого давления (рис 1D). Вставьте держатель образца в морозильный блок высокого давления (наклонить вниз) и закрепите его при помощи винтов в держателе образца.
- Инициировать цикл заморозки, нажав на кнопку "Джет-Авто". Работая как можно быстрее, снимите держатель образца и погрузите наконечник с жидким азотом в изолированный ящик. Погрузить кончики двух пар щипцов в жидком азоте, чтобы охладить их.
- Осторожно удалите юе несущей бутерброд из держателя образца и поместить его в предварительно охлажденный криопробирку. Убедитесь в том, что носители обрабатываются только с охлаждаемой жидким азотом щипцов. Криопробирок должна быть перфорирована , чтобы позволить азот вытекать из флакона (рис 1G).
- Повторите шаги 3.2.6 для 3.2.11, пока все нужные образцы не были заморожены. Множественные ОПЕРАТОРСКОГО сэндвичи, содержащие один и тот же тип образца можно хранить в одном флаконе.
- Хранить криопробирки не содержащих носителей в CryoTank до репликации (рис 1H).

Рисунок 1. Подготовка ткани и морозильное высокого давления. (A) Vibroslicer используется для секции ткани. (B) раздел мозга в результате корональных мышь , содержащая миндалины показаны бок о бок с асинхроннымОппер носитель оснащен кольцом двухсторонней ленты. Пунктирная окно указывает интересующую область, содержащую медиальной paracapsular кластер КВТ. Диаметр отверстия в двусторонней клейкой ленты составляет около 1,5 мм. (C) Инструменты для подготовки медных носителей. От верхнего левого по часовой стрелке: двухсторонняя лента, пинцет, перфоратор, медных носителей и ножниц. (D) , вставка-носителя сэндвича в держатель образца для замораживания под высоким давлением. Носителем многослойный композитный материал помещается в отверстие держателя образца. (Е) медные носители без и с кольцом двухсторонней ленты и "Монтажно-сэндвича". (F) морозильный блок высокого давления с баком под давлением подачи жидкого азота к нему. (G) криопробирку запасти замороженных тканей. Обратите внимание на отверстия в верхнем среднем положении флакона, позволяющего газообразный азот вытекать из флакона (стрелки). (H) CryoTank для хранения замороженной ткани. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
4. Замораживание-трещины и репликации
- Подготовка пушек электронно - лучевых
- Перед установкой пушки электронно-лучевые, удалите защитный экран с "дефлектора". Поместите "настройки" датчик для центровки нити в цанговый патрон через нижнюю крышку катода.
Примечание: Чем больше диаметр конца датчика настройка используется для углеродсодержащего пушки в то время как меньший конец диаметр платиновых пушки. - Задвиньте новую нить над датчиком до "пластинками давления" может зажимать концы нити, убедившись, что катушка нити не лежит под углом.
- Снимите датчик установки и вставьте угольный стержень. Зафиксируйте его, затянув сотрудничествоLLET патрон реечник испарителя, гарантируя, что высота конца стержня находится в середине второй катушки со дна. Платиновых пушки, высота конца платинового стержня должна быть в середине второй катушки нити сверху.
- Заменить дефлектора и вставьте оружие в блок сублимационной разрушения. Очистите пушки с песчано-бластер после использования.
- Перед установкой пушки электронно-лучевые, удалите защитный экран с "дефлектора". Поместите "настройки" датчик для центровки нити в цанговый патрон через нижнюю крышку катода.
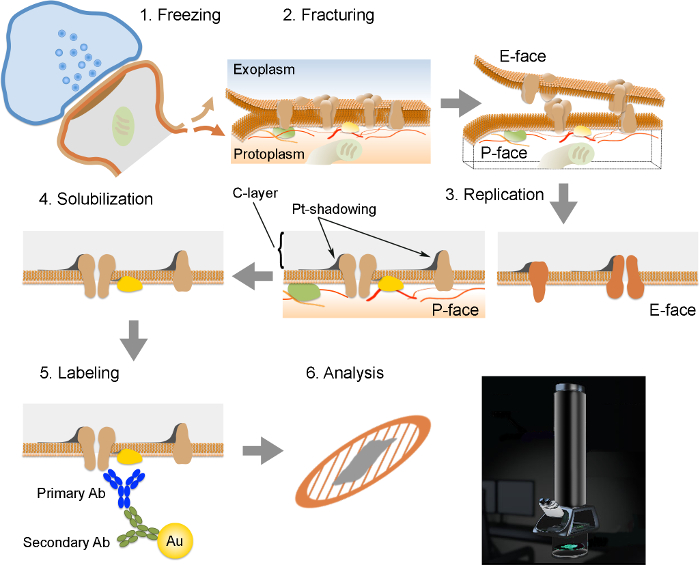
Рисунок 2. Иллюстрация из ключевых шагов в FRIL техники.
Схема различных этапов, необходимых для подготовки и анализа реплик. (1) замораживание высокого давления ткани. (2) гидроразрыва. Во время гидроразрыва замороженной ткани, липидный бислой плазматических мембран разделяется на две половинки в гидрофобной интерфейс. Белки в плазматической мембране выделяются на либо exoplasmic (E-лицо) или протомембраны (плазменные P-лица). (3) репликации. Испарение углерода (С) ловушки липидов и белков на поверхности излома ткани. Материал покрыт 2 нм платина / углерод для затенения под углом 60 °, а затем с другим 15 нм углеродного слоя, который укрепляет структуру реплики (С-слой Pt-затенение). (4) Растворение. Ткань не улавливаются реплики мембраны затем солюбилизировали с SDS-раствором. (5) Этикетировочное. Белки интерес могут быть визуализированы на реплику с использованием комплекса, сделанный из специфических первичных антител (первичная Ab) и вторичными антителами (вторичный AB), конъюгированных с золотой частицей (Au). Использование различных размеров частиц золота позволяет обнаружить более чем одного белка на той же самой реплики. (6) После того, как иммунноокрашивания, точные копии собираются на медной сетки сетки и проанализированы с помощью просвечивающего электронного микроскопа при 80 -. 100 кВ Пожалуйста КлиКK здесь, чтобы посмотреть большую версию этой фигуры.
- Настройка блока замораживания разрушения
- Включите блок замораживания трещины (рис 3А), повернув на отводе 1. Подробное описание процедур замораживания-разрушения и репликации, смотрите инструкцию по эксплуатации , предоставляемых производителем.
- Перед охлаждением устройства сублимационной излом, выпекать из всей системы охлаждения блока с теплым воздухом. Нажмите кнопку «оттепели» в 010 устройстве MTC (блок контроля температуры) (рис 3A) , и пусть пекут из процесса в течение 45 мин.
- Включите вакуумный станцию. Блок сублимационной излом обычно работает в вакуумном диапазоне ~ 10 -6 - 10 -7 мбар.
- Заполнить резервуар с азотом и подключить его к блоку сублимационной разрушения. Убедитесь, что держатель клапана сухой, а также очистить запись резервуара перед вставкой держателя клапана (влажность может помешать VACUUм и индикация N 2 наполнение резервуара).
- Начало охлаждения путем установки температуры до -115 ° С. Охлаждение занимает около 45 мин.
- Вставьте пушки электронно-лучевые и регулировки тока и напряжения для достижения следующих параметров для испарения:
Углеродные пистолет: вращение на, положение 90 °, скорость накопления углерода 0,1 - 0,2 нм / сек
Углерод-платиновый пистолет: вращение прочь, положение 60 °, скорость накопления 0,06 - 0,1 нм / сек
Примечание: Если пистолет используется в первый раз после того, как обмен на углероде или платины стержня, деаэрации в течение 3 мин перед использованием.
- Гидроразрыв и репликации
- Вставьте замороженные несущие-сэндвичи в двойной стол реплики убедившись все манипуляции производятся в жидком азоте.
- Передача двойной стол реплики в сосуд Дьюара и закрепить его на сцену приемника образца под углом 45 °. Уровень жидкого азота всегда должна быть выше двойной таблицы реплик.
- Возьмите двойной стол реплики с таблицей манипулятором и вставьте его в блок сублимационной разрушения на холодную стадию. Подождите примерно 20 минут, чтобы дать температуре двойной таблицы реплики, чтобы приспособиться к -115 ° C.
- Убедитесь , что вакуум ниже 10 -6 мбар и температуре -115 ° С.
- Раздробить ткани путем ручного вращения против часовой стрелки, колеса, соединенного с бандажом, расположенной над столом двойной реплики. Когда пелена поворачивается, он заставляет двойную таблицу реплик, чтобы открыть, гидроразрыва ткани.
- Нажмите кнопку "Высокое напряжение" в (блок управления электронным лучом испарения) +030 устройство EVM блока замораживания разрушения (рис 3А).
- Повторные открытые поверхности излома ткани (рис 3C) путем испарения углерода (ротационный) с помощью электронно - лучевой пушки , расположенной под углом к толщиной 5 нм 90 °, а затем однонаправленное Shadoкрыло с платиной-на-угле под углом 60 ° по отношению к толщине 2 нм. И, наконец, применить толщиной 15 нм слой углерода с углом 90 ° (вращение).
- Используйте следующие параметры для испарения:
Первый углерода: вращение на, положение 90 °; Скорость 0,1 - 0,2 нм / сек; 5 нм
Второй углерод-платиновый: положение 60 °; Скорость 0,06 - 0,1 нм / с; 2 нм
3-й углерод: вращение на, положение 90 °; Скорость 0,3 - 0,5 нм / с; 15 нм - Удалите реплицировать образцы из блока сублимационной разрушения и передавать их на керамическую 12-луночного планшета (рисунок 4A) , заполненный TBS (Трис - солевой буфер, рН 7,4).
- Используя катанку платиновую петлю, удалите реплицированную ткани из образца носителя (рис 4а).
- Повторите шаги 4.3.1 4.3.10, пока все образцы не были воспроизведены.
 г /> Рисунок 3. Замораживание-гидроразрыва и репликации.
г /> Рисунок 3. Замораживание-гидроразрыва и репликации.
(А) Устройство сублимационной разрушения. Машина содержит несколько блоков управления и монитор. Образцы вводят в камеру через входное отверстие на левой стороне камеры. Нагнетанием контейнер с жидким азотом соединен с блоком сублимационной разрушения для охлаждения ступени. Изображения ниже показывают увеличенные виды двух блоков (СКП 010 и MDC 010) и монитора отображаются параметры во время испарения второго слоя углерода. (В) был открыт (слева) и закрытые (справа) вид двойной таблицы реплик. «Несущей-сэндвичи" вставляются в пазы таблицы (указаны стрелками). Стрелковое оружие предотвратить "носитель-сэндвичи" от падения во время манипуляций. (C) ломаются и реплицировать образец. Реплики появляются как тонкие черные пленки на верхней части раздробленной ткани.53 / 53853fig3large.jpg "целевых =" _blank "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
- SDS-переваривание реплики
- Передача реплики в стеклянную пробирку емкостью 4 мл, заполненную 1 мл SDS-буфера пищеварения (2,5% лаурилсульфата натрия, 20% сахарозы в 15 мМ Трис, рН 8,3). Дайджест в течение 18 часов при 80 ° C при встряхивании (45 ходов / мин).
- Передача репликами в новую пробирку, заполненную ДСН-сбраживания буфера и хранят при комнатной температуре.
5. иммунноокрашивания
ПРИМЕЧАНИЕ: Все инкубацию проводят при комнатной температуре при осторожном встряхивании, для инкубирования с антителами, за исключением.
- Вымойте реплику в течение 10 минут в свежем буфере SDS-переваривания.
- Промывают реплику один раз с 2,5% БСА (бычий сывороточный альбумин) в TBS в течение 5 мин, а затем 3 х 10 мин с 0,1% БСА в TBS.
- Блок неспецифические сайты связывания в TBS с 5% BSA в течение 1 часа.
- Применение первичного антиорганы разводят в 2% БСА-TBS. Выполните инкубацию в 30 мкл капли (фиг.4В) во влажной камере при 15 ° С в течение 72 ч (фиг.4С).
- Для этого исследования процесса как точные копии из раздробленной ткани. Выдержите в одну реплику с морской свинки поликлональных антител, выработанном против аминокислоты 717 - 754 мыши GluR1 общей для всех субъединиц АМРА-R (разведение: 1: 200) или мышиных моноклональных антител, выработанных против рекомбинантного слитого белка, охватывающих аминокислоты 660 - 811 из NR1 субъединицей рецептора NMDA-R (разведение: 1: 500) и поликлональное антитело кролика, выработанном против зеленого флуоресцентного белка (разведение: 1: 300).
- Выдержите другой реплики с поликлональное антитело кролика, выработанном против синтетического пептида, соответствующего аминокислотам 384 - 398 мю-опиоидных рецепторов крысы (разбавление: 1: 500).
- Промыть в TBS с 0,05% бычьего сывороточного альбумина (3 х 5 мин.).
- Применение вторичных антител. Для этого исследования Uсебе золото (5 нм для ионотропных рецепторов глутамата, 10 для μ-опиоидных рецепторов и / или 15 нм для ChR2-YFP) конъюгированные антитела, разбавленные в TBS с 2% BSA. Развести вторичными антителами 1:30 и инкубировать в капле 30 мкл при 15 ° CO / N.
- Вымойте 3 х 5 мин в 0,05% BSA-TBS при комнатной температуре.
- Вымойте 2 х 5 мин в сверхчистой воде.
- Маунт реплики на 100-линии параллельные брусья сетки формвар покрытием (рис 4D).
6. Анализ реплики
- Реплики изображение с помощью просвечивающего электронного микроскопа (ПЭМ) при 80 или 100 кВ. Приобретайте цифровые изображения с помощью CCD (ПЗС) камеры.
- Offline, найти соответствующие области на изображениях с обеих репликах с использованием ориентиров (Рисунок 4E). Анализ цифровых изображений с использованием изображения J. Определение постсинаптического площадь и число частиц immunogold-меченого, направленных против рецептора анализируемого.

Рисунок 4. иммунноокрашивания реплики.
(A) Инструменты для обработки и мытья реплик. Керамический 12-луночного планшета (справа вверху) и 2 вида стеклянных пипеток (вверху слева). Стеклянная пипетка с круглым наконечником (внизу слева) используется для передачи реплики, и пипетка с платиновым стержнем (внизу в центре) используется, чтобы развернуть точные копии. Копия в промывочном буфере (внизу справа). (Б) иммунноокрашивания репликами осуществляется в виде капель (30 мкл) , размещенные на небольшой кусочек парафином в лунку для культуры ткани 6-луночный планшет. Обратите внимание, что копия покрыта каплю буфера, содержащего антитела. Для того, чтобы предотвратить испарение, смоченного папиросную бумагу установлен вокруг внутреннего края колодца. (C) Инкубатор для стадии иммунноокрашивания. Инкубацию проводят при 15 ° С. (D) Копия установленный на формвар покрытием 100-линия, параллельная бар сетки. (Е) Низкая увеличением микрофотографии от пары реплик. Пунктирные квадраты указывают три типичных ориентиры для определения местоположения в соответствующих реплик. Шкала бар: 10 мкм. Все данные представлены в виде среднего значения ± СЭМ Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Результаты
Техника FRIL, в сочетании с экспрессией оптогенетика исполнительных механизмов микробного происхождения 21, то есть, каналов , интегрированных в плазматической мембране и эффективно транспортируемых anterogradely вдоль аксонов, позволяет исследовать количественно постсинаптической экспрессию AMPA-R и NMDA-R в определенной подгруппе синапсов. Это показано здесь аксонов , происходящих из отдельного ядра таламуса (например, PIN / MGn) на КВТ нейронов в миндалине. Такой подход позволяет молекулярный анализ отдельных сенсорных входных синапсов на КВТ нейроны, группы клеток, которые были резистентны к детальным анатомическим и молекулярной характеристики до сих пор.
Через четыре недели после того, как стереотаксической инъекции Раав-ChR2-YFP в PIN / MGN, ChR2-YFP-позитивные аксоны плотно иннервированы в LA, область amygdalostriatal перехода (Astria) и медиальной paracapsular I TC кластера в миндалине, картина полностью соответствует предыдущим отслеживании исследования 16, 22. Мы также обнаружили интенсивное золото иммунноокрашивания для ChR2-YFP на P-грани аксонов и терминалов в реплики сублимационной разрушения от Раав-ChR2-YFP- вводили мышам (рис 5а), но не в репликах из неинъекционные мышей. Постсинаптической мембраны специализации глутаматэргических синапсов в реплике можно наблюдать в виде кластера внутримембранных частиц (ИПУ) на E-поверхности плазменной мембраны 2, 23, а часто сопровождается Р-лицом его пресинаптического плазменной мембраны 7 (Рисунок 5Б-С). Эти особенности позволили идентифицировать постсинаптической специализации глутаматергической синапсов , образованных аксонов PIN / MGN (Рисунок 5 и 6). Мы немеченого АМРА-R с антителом, которое распознает все четыре субъединицы (GluA1-4), тогда как NMDA-R были обнаружены с использованием антитела против существенной субъединицы NR1.
ntent "ВОК: Keep-together.within-страницу =" 1 "> Из-за отсутствия средств для обнаружения на той же реплики, были ли сделаны эти синапсы с дендритных шипиков или валах КВТ нейронов, мы пометили соответствующую реплику лицо при ц -opioid рецепторы, как МИАНЗ нейроны экспрессируют постсинаптически высокие уровни этих рецепторов 24. Это требует идентификации тех же постсинаптических профилей в двух репликах (5С-F и 6А-D) использует стратегию , которая использует ориентиры (рис 4Е) ,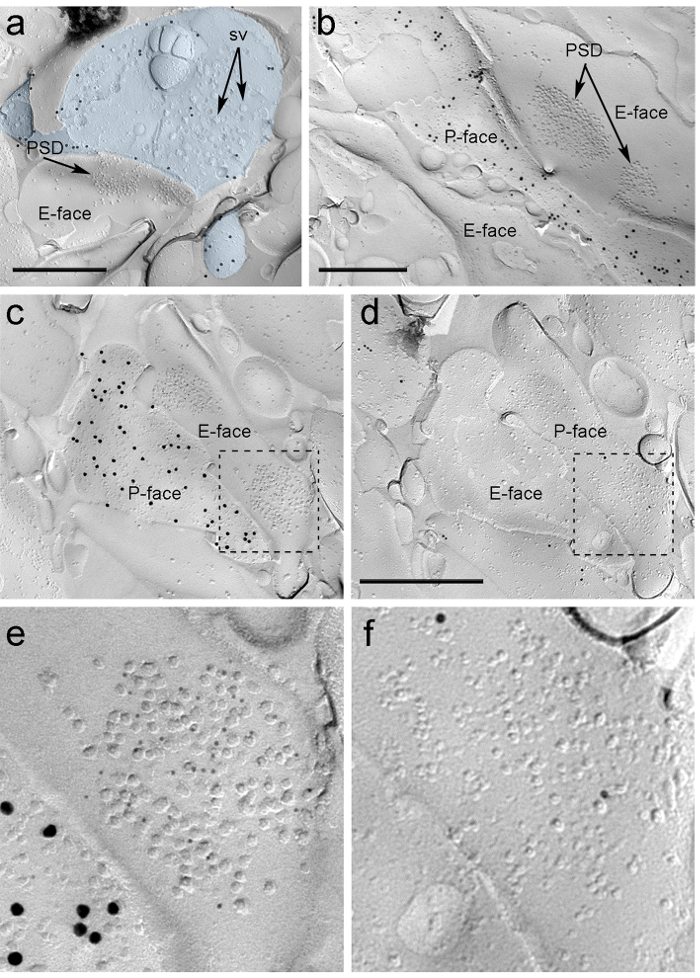
Рисунок 5. Обнаружение ChR2-YFP и ИОНОТРОПНЫХ Рецепторы глутамата на реплики по Immunogold частиц. (A) Поперечное сломана терминал аксона (светло - голубой) и небольшие порции его P-лица , помеченный 15 нм золотых частиц регистрирующих ChR2-YFP. В терминале, мембрана OF многочисленные синаптические пузырьки можно наблюдать (УО). Обратите внимание на специфичность иммунного мечения в значительной степени ограничивается плазматической мембраной. Маркировка для ChR2 идентифицирует терминал как исходящие от PIN / MGN. Терминал формирует асимметричный синапс с позвоночника. Постсинаптической мембраны специализации (PSD) на E-грани показывает характерный кластер внутримембранных частиц и метят 5 нм золотых частиц, раскрывающих АМРА-R. (B) P-лицо ChR2-выражающей аксона (меченного 15 нм золотых частиц) показан на границе с двумя дендриты, один из них , обладающий двумя РСП , меченные 5 нм золотых частиц , раскрывающих NMDA-R. (CD) противоположные грани пре- и постсинаптических мембранах синапса PIN / MGN-ITC. (C) P-лицо терминала выражает ChR2 (маркированный с частицами золота 15 нм) и проходит по E-грани двух дендритные валов, один из которых содержит два PSDs меченые для АМРА-R (5 нм частицы золота). ( D) Соответствующая P-грань двух дендритов помечена для μ-опиоидных рецепторов (10 нм частицы золота). (EF) Увеличенные виды на областях , обозначенных пунктирными линиями. Шкала баров:. 500 нм Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Immunoparticles для AMPA-R в синапсах PIN / MGN-ИВЦ были найдены во всем кластере IMP, что предполагает равномерное распределение в пределах постсинаптической специализации (рис 5E). Значительно более высокий (непарный т-тест р <0,018) плотность АМРА-R маркировки наблюдалась в PIN / MGN синапсы на КВТ колючками (715 ± 38 золотых частиц / мкм 2, п = 32) по сравнению с синапсами на КВТ дендритов (590 ± 44 золотых частиц / мкм 2, N = 32). В целом, плотность АМРА-R в PIN / MGN-ITC синапсов показал относительно низкоедисперсия (коэффициент дисперсии, CV = 0,37), в соответствии с однородным распределением.
Immunoparticles для NMDA-R в синапсах PIN / MGN-ITC часто наблюдались неравномерно распределены в пределах постсинаптической кластеров IMP (рис 5б). Плотность NMDA-R маркировки была одинаковой (непарный т-тест р = 0,39) между штырьком / MGn синапсы на КВТ колючками (1070 ± 153 золотых частиц / мкм 2, N = 8) и ITC дендриты (812 ± 183 частиц золота / мкм 2, п = 9). В отличие от того, что наблюдалось для AMPA-R, плотность NMDA-R в PIN / MGN-ITC синапсов был сильно варьирует (CV = 0,54).

Рисунок 6. AMPA-R и NMDA-Rs иммунноокрашивания на идентифицированных PIN / MGN-ITC синапсов.
(AB) противоположные грани пре- и постсинаптических мембранах PIN / MGN-ITCсинапс сделаны на дендритных позвоночника, в котором Р-грань терминала выражающего ChR2 (метили 15 нм золотых частиц) и СПМ на дендритных позвоночника помечена для AMPA-R (5 нм частицы золота). (Компакт - диск) в увеличенном масштабе виды областях , указанных пунктирной линией. Эти районы были повернуты примерно на 45 ° против часовой стрелки, чтобы лучше видеть СДП. (Е) диаграммы рассеяния от числа частиц АМРА-R по сравнению с синаптической области в ИТК колючками и дендриты. В обеих структурах наблюдается положительная корреляция. (F) , диаграммы рассеяния от числа частиц NMDA-R против синаптической области в ИТК колючками и дендриты. Значительная положительная корреляция была обнаружена только в дендритных шипиков. Шкала баров:. 500 нм Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Потому какР-поверхность пресинаптических плазменной мембраны часто обложенных в части постсинаптической кластера IMP, мы могли бы оценить синаптическую площадь только 30% синапсов (колючки: средняя площадь 0,032 мкм 2, диапазон: от 0,007 до 0,063 мкм 2, п = 8; дендриты: 0,047 мкм 2, диапазон: 0,024 до 0,166 мкм 2, п = 11). Они были в таком же диапазоне , как ранее проанализирован глутаматергическая синапсы конечного мозга 25.
В обоих колючками и дендритов, количество золотых immunoparticles для AMPA-R в отдельных синапсов положительно коррелирует с синаптической области (Спирмена, колючек: г = 0,88, дендриты: г = 0,60, р <0,0001) (рис 6E). С другой стороны , было обнаружено , что количество золота immunoparticles для NMDA-Rs коррелирует с синаптической области в колючки (Спирмена, шипа: г = 0,90, р <0,002) , но не в дендритов (г = 0,21, р = 0,29) (рис 6F ).
Обсуждение
Замораживание-Перелом электронная микроскопия была основным методом в ультраструктурным исследований на протяжении более 40 лет. Тем не менее, отсутствие эффективных средств для изучения молекулярного состава мембран получают значительное снижение его использования. В последнее время было главным возрождение в сублимационной излома электронной микроскопии в связи с развитием эффективных методов выявления интегральных мембранных белков с помощью метки антител 1, 2, а именно : метод FRIL.
Техника FRIL обладает несколькими преимуществами по сравнению с другими методами immunogold ультраструктурным. Во-первых, белки легко доступны для антител повышения чувствительности. Во-вторых, воздействие на большой части плазменной мембраны специализаций, таких как постсинаптической мембраны, на двумерной поверхности реплики позволяет контролировать пространственное распределение и физической смежности интересующих молекул без кропотливого и трудоемкого реконструкции сериразделы аль ультратонкий. В-третьих, наличие обеих половинах плазматической мембраны увеличивает количество белков, которые могут быть помечены для каждой отдельной структуры, при условии, подходящие антитела доступны. После разрыва пласта, гидрофобная поверхность расщепленной мембраны покрыта углерод-платиной, направленных на утверждение белковые домены, остающиеся на поверхности излома. Это предотвращает доступ антител к антигенам в этих доменах. Например , на Р-лицевой реплики только эпитопы , с которыми сталкивается протоплазмы пространство могут быть обнаружены с помощью антител, в то время как на E-лице только эпитопы , обращенной к exoplasmic пространства могут быть связаны антител (см рисунок 2).
С другой стороны, метод FRIL также страдает от определенных ограничений 2. Как переломы происходят случайным образом, это может быть трудно ориентироваться на конкретные элементы или структуры. Это также может привести к смещению выборки, например, в коллекции синапсов, учитывая разные вероятность ОЛРcturing вдоль мембраны структур с различной кривизны (например, в сравнении с шипами валов). Кроме того, выделение мембранных белков к одной из двух граней непредсказуема. Таким образом, распределение белка к P-лица или E-лица, в частности, для количественных исследований, должны быть тщательно изучены с помощью антител к внутриклеточных и внеклеточных доменов. И, наконец, определение в точной копии определенных структур, таких как пресинаптических окончаний аксонов, может быть трудным, когда основаны только на морфологических признаков. Тем не менее, использование специфических антител для белков-маркеров или трансдукции меченых интегральных мембранных белков или каналов с использованием вирусных векторов предлагает дополнительные инструменты для облегчения идентификации трещиноватых мембран. Например, это исследование воспользовались трансдукции ChR2-YFP в таламических нейронов, чтобы определить их аксонов эфферентах в миндалине или нанесение знаков μ-опиоидных рецепторов, чтобы показать мне постсинаптическогоmbranes КВТ нейронов.
Для того, чтобы успешно выполнять технику FRIL, особое внимание следует принять в отношении фиксации ткани. Фиксация Сильные ткани (> 2% параформальдегидом) может привести к высокой скорости поперечных трещин и снижению чувствительности маркировки. С другой стороны, слабые фиксаций делают обработку тканей и подготовки (например, резка секций) трудно. Важно также, чтобы контролировать, что толщина обрезанными блоков соответствует толщине двухсторонней ленты. Если толщина образца ниже, чем у ленты, поверхности ткани, не могли бы прикрепить к поверхности двух металлических носителей, следовательно Замороженные пробы не сломана. Если ткань толще, то он будет сжат с неизбежными структурными искажениями, когда сэндвич из двух медных носителей производится. Температуру, при которой образец сломана (в данном протоколе, -115 ° С), играет также важную рольо структуре реплики. При более высоких температурах может привести к более высокую скорость передачи артефактов, таких, как конденсация паров воды на поверхности ткани, перед или во время выпаривания. При более низких температурах (<-125 ° C), может увеличить риск отщеплением материала во время гидроразрыва. Этот материал может упасть на поверхность образца или оставаться подключенным к нему. Эти хлопья материала также с покрытием и контрастируют производить темные пятна на изображении. Гидроразрыва при более низких температурах может также влиять на частоту поперечных трещин, особенно для маленьких тонких структур, таких как дендритные колючек. Еще одним важным шагом в подготовке точных копий является детергентом пищеварение. Если пищеварение является неполным, непереваренной ткани выглядит как темные пятна на реплики, не оправдав анализ структуры в ПЭМ. Кроме того, непереваренной ткани может неспецифически ловушку или связывания антител, повышение фона маркировки. С другой стороны, использование моющих средствs для пищеварения ткани может денатурации молекулы, связанные с репликой изменения их вторичной и третичной структуры. Таким образом, для некоторых антигенов может быть необходимо, чтобы постепенно разбавить концентрацию SDS с помощью дополнительных стадий промывки.
Для иммунноокрашивания, наличие различных размеров частиц золота, конъюгированного с помощью вторичных антител, позволяет обнаружить в то же время, но только в качественном отношении, несколько белков, даже в специфических микродоменных плазматической мембраны, такие как постсинаптической специализации. Тем не менее, из-за стерических затруднений, количественных исследований, как правило, ограничено обнаружением только одной молекулы. Размер частиц золота также может влиять на эффективность маркировки.
Для интерпретации маркировки в FRIL, следует иметь в виду, что частица immunogold может быть расположена в любом месте в пределах полусферы с радиусом 20-25 нм от антигена за счет гибкой сложной формыред первичным и вторичным антителом 26. Для получения дополнительной информации по теории и практике FRIL и связанных с ними методов, мы отсылаем читателя также других методологических статей 27, 28.
Метод FRIL был недавно использован для высокого разрешения количественного анализа локализации рецепторов глутамата в различных популяциях синапсов 29, 30. Кроме того, чувствительность обнаружения методики FRIL для АМРА-R была оценена так высоко , как один immunogold частицы на одну функциональную АМФК -R 29 канала. Таким образом, этот подход в целом весьма полезным для количественного определения и анализа картины постсинаптической экспрессии АМРА-R и NMDA-R в центральных синапсах. Здесь мы показали его применимость на PIN / MGN-ITC синапсов, сайт, скорее всего, важную для передачи информации США во время страха кондиционирования. С использованием антитела, возникающие против высококонсервативных внеклеточных аминокислотных остатков субъединиц рецептора АМРА GluА1-GluA4, мы обнаружили, равномерное распределение частиц золота в пределах кластеров IMP, соответствующих постсинаптической мембране специализации. Плотность AMPA-R в ИТК колючками была значительно выше по сравнению с валом синапсов мишенью PIN / MGN таламуса афферентов. На обоих позвоночника и вала синапсов, была обнаружена положительная корреляция между мечения для АМРА-R и постсинаптической области, особенность , общую для других глутаматэргических синапсов 25. Низкая дисперсия плотности AMPA-R в PIN / MGN-ITC синапсов указывает на однородное распределение , аналогичную другим синапсов , образованных таламуса эфферентах 7, но отличную от корковых синапсов 25. С другой стороны, плотность NMDA-R была более изменчивыми и не отличались между позвоночника и валом синапсов, предполагающих различное регулирование, чем АМРА-R. В будущем, высокая воспроизводимость техники FRIL не только позволит оценить базальную молекулярный состав центральных синапсах, но может облегчить обнаружение Changes числа рецепторов ионотропический глутамата и subsynaptic распределения после обучения страха, дополняя экс-естественных условиях записи пред- и постсинаптической свойств этих входов.
В заключение, этот подход может быть использован другими исследователями, чтобы получить представление о структурно-функциональных взаимосвязей входных конкретных возбуждающих синапсов во многих других нейронных цепей, в которых распутывания происхождение входов и характер и состав постсинаптических элементов имеет решающее значение, но проблематично ,
Раскрытие информации
The authors declare that they have no competing financial interests.
Благодарности
Funding was provided by the Austrian Science Fund FWF grant No. P-22969-B11 to F. Ferraguti, and by the Charitable Hertie Foundation and the Werner Reichardt Centre for Integrative Neuroscience and by the DFG (CIN-Exc. 307) to I. Ehrlich.
Материалы
| Name | Company | Catalog Number | Comments |
| Surgery | |||
| Stereotactic frame | Stoelting, USA | 51670 | can be replaced by other stereotactic frame for mice |
| Steretoxic frame mouse adaptor | Stoelting, USA | 51625 | |
| Gas anesthesia mask for mice | Stoelting, USA | 50264 | no longer available, replaced by item no. 51609M |
| Pressure injection device, Toohey Spritzer | Toohey Company, USA | T25-2-900 | other pressure injection devices (e.g. Picospritzer) can be used |
| Kwik Fill glass capillaries | World Precision Instruments, Germany | 1B150F-4 | |
| Anesthesia machine, IsoFlo | Eickemeyer, Germany | 213261 | |
| DC Temperature Controler and heating pad | FHC, USA | 40-90-8D | |
| Horizontal Micropipette Puller Model P-1000 | Sutter Instruments, USA | P-1000 | |
| Surgical tool sterilizer, Sterilizator 75 | Melag, Germany | 08754200 | |
| rAAV-hSyn-ChR2(H134R)-eYFP (serotype 2/9) | Penn Vector Core, USA | AV-9-26973P | |
| fast green | Roth, Germany | 0301.1 | |
| Isoflurane Anesthetic, Isofuran CP (1ml/ml) | CP Pharma, Germany | ||
| Antiseptic, Betadine (providone-iodine) | Purdure Products, USA | BSOL32 | can be replaced by other disinfectants |
| Analgesic, Metacam Solution (5mg/ml meloxicam) | Boehringer Ingelheim, Germany | can be replaced by other analgesics | |
| Bepanthen eye ointment | Bayer, Germany | 0191 | can be replaced by other eye ointments |
| Drill NM3000 (SNKG1341 and SNIH1681) | Nouvag, Switzerland | ||
| Sutranox Suture Needle | Fine Science Tools, Germany | 12050-01 | |
| Braided Silk Suture | Fine Science Tools, Germany | 18020-60 | |
| Name | Company | Catalog Number | Comments |
| Tissue preparation | |||
| Paraformaldehyde EM grade | Agar Scientific Ltd., United Kingdom | AGR1018 | |
| Saturated picric acid solution | Sigma-Aldrich, USA | P6744-1GA | |
| Na2HPO4-2H20 | Merck Millipore, Germany | 1065860500 | |
| NaH2PO4-2H2O | Merck Millipore, Germany | 1063451000 | |
| NaCl | Merck Millipore, Germany | 1064041000 | |
| 4N NaOH | Carl Roth, Germany | T198.1 | |
| Thiopental | Sandoz, Austria | 5,133 | |
| Glycerol | Sigma-Aldrich, USA | G5516-500ML | |
| GenPure ultrapure water system | Thermo Fisher Scientific, USA | 50131235 | |
| Peristaltic pump | ISMATEC, Germany | ISM 930C | |
| Filter Paper | MACHEREY-NAGEL, Germany | MN 615 1/4 | |
| Vibroslicer, VT1000S | Leica Microsystems, Austria | ||
| Ophthalmic scalpel | Alcon Laboratories, USA | can be replaced by other ophthalmic scalpels | |
| Perfusion cannula | Vieweg, Germany | F560088-1 | can be replaced by similar items from other companies |
| Name | Company | Catalog Number | Comments |
| High-pressure Freezing | |||
| Copper carriers | Engineering Office M. Wohlwend, CH | 528 | |
| Sidol Polish | Henkel, Germany | can be replaced by same item from other companies | |
| Chamois skin | Household supply store | ||
| Hole punch, 1,5mm | Stubai, Austria | can be replaced by same item from other companies | |
| Denatured ethanol | Donauchem, Austria | can be replaced by same item from other companies | |
| Aceton | Roth, Germany | 9372.5 | CAUTION! |
| High Pressure Freezing Machine HPM 010 | BalTec, CH; now Leica Microsystems | HPM010 | not produced any more, substituted by LeicaEM HPM100 |
| Stereo-microscope | Olympus, Japan | SZX10 | |
| Liquid nitrogen | CAUTION! | ||
| Cryo-vials | Roth, Germany | E309.1 | can be replaced by same item from other companies |
| CryoCane | Nalge Nunc International,USA | 5015-0001 | can be replaced by same item from other companies |
| CryoSleeve | Nalge Nunc International,USA | 5016-0001 | can be replaced by same item from other companies |
| Liquid nitrogen storage vessel | Cryopal, France | GT38 | can be replaced by same item from other companies |
| Non-ionic detergent (Lavocid) | Werner & Mertz Professional, Germany | ||
| Name | Company | Catalog Number | Comments |
| Freeze-fracture and Replication | |||
| Sandblaster, Mikromat 200-1 | JOKE Joisten & Kettenbaum, Germany | SANDURET 2-K | can be replaced by same item from other companies |
| Siliciumcarbid SIC 360, grain size 25 - 21µ | JOKE Joisten & Kettenbaum, Germany | 955932 | |
| Freeze Fracture System BAF 060 | BalTec, CH; now Leica Microsystems | BAF060 | |
| Ceramic 12 well plate | Gröpel, Austria | 14511 | can be replaced by same item from other companies |
| Trizma base | SIGMA, USA | T1503 | can be replaced by same item from other companies |
| Trizma hydrochloride | SIGMA, USA | T3253 | can be replaced by same item from other companies |
| Sodium chloride | Merck, Germany | 1,064,041,000 | can be replaced by same item from other companies |
| SDS, Sodium lauryl sulfate | Roth, Germany | 5136.1 | CAUTION! ; can be replaced by same item from other companies |
| Sucrose | Merck, Germany | 1,076,871,000 | can be replaced by same item from other companies |
| TRIS | Roth, Germany | 5429.3 | can be replaced by same item from other companies |
| Universal Hybridization Oven | Binder, Germany | 7001-0050 | can be replaced by same item from other companies |
| Name | Company | Catalog Number | Comments |
| Immunolabelling | |||
| BSA | SIGMA, USA | A9647 | can be replaced by same item from other companies |
| Anti-GFP Antibody | Molecular Probes, USA | A11122 | |
| Anti-pan-AMPAR Antibody | Frontier Institute, Japan | pan AMPAR-GP-Af580-1 | |
| Anti-NMDAR1 Antibody, clone 54.1 | Merck Millipore, Germany | MAB363 | |
| Opioid Receptor-Mu (MOR) Antibody | ImmunoStar, USA | 24216 | |
| EM goat anti-guinea pig, 5nm; secondary antibody | BBInternational, | EM.GAG5 | |
| EM goat anti-rabbit, 15nm; secondary antibody | BBInternational, | EM.GAR15 | |
| Donkey anti-rabbit, 10nm, secondary antibody | AURION, Netherlands | DAR 10nm | |
| Copper grids, 100 Parallel Bar | Agar scientific, UK | G2012C | |
| Incubator | Major Science, USA | MO-RC | can be replaced by same item from other companies |
| Pioloform Powder | Agar scientific, UK | R1275 | |
| Chloroform | Roth, Germany | 3313.1 | CAUTION! ; can be replaced by same item from other companies |
| Name | Company | Catalog Number | Comments |
| EM analysis | |||
| Philips CM120 TEM | Philips/FEI | ||
| Morada CCD camera | Soft Imaging Systems, Germany | ||
| iTEM Ver. 5.2, imaging software | Soft Imaging Systems, Germany | ||
Ссылки
- Fujimoto, K. SDS-digested freeze-fracture replica labeling electron microscopy to study the two-dimensional distribution of integral membrane proteins and phospholipids in biomembranes: practical procedure, interpretation and application. Histochem Cell Biol. 107 (2), 87-96 (1997).
- Masugi-Tokita, M., Shigemoto, R. High-resolution quantitative visualization of glutamate and GABA receptors at central synapses. Curr Opin Neurobiol. 17 (3), 387-393 (2007).
- Rash, J. E., Yasumura, T. Direct immunogold labeling of connexins and aquaporin-4 in freeze-fracture replicas of liver, brain, and spinal cord: factors limiting quantitative analysis. Cell Tissue Res. 296 (2), 307-321 (1999).
- Emes, R. D., Grant, S. G. Evolution of synapse complexity and diversity. Annu Rev Neurosci. 35, 111-131 (2012).
- Matsuzaki, M., et al. Dendritic spine geometry is critical for AMPA receptor expression in hippocampal CA1 pyramidal neurons. Nat Neurosci. 4 (11), 1086-1092 (2001).
- Rollenhagen, A., Lübke, J. H. The morphology of excitatory central synapses: from structure to function. Cell Tissue Res. 326 (2), 221-237 (2006).
- Tarusawa, E., et al. Input-specific intrasynaptic arrangements of ionotropic glutamate receptors and their impact on postsynaptic responses. J Neurosci. 29 (41), 12896-12908 (2009).
- Nusser, Z., et al. Cell type and pathway dependence of synaptic AMPA receptor number and variability in the hippocampus. Neuron. 21 (3), 545-559 (1998).
- Nyìri, G., Stephenson, F. A., Freund, T. F., Somogyi, P. Large variability in synaptic N-methyl-D-aspartate receptor density on interneurons and a comparison with pyramidal-cell spines in the rat hippocampus. Neuroscience. 119 (2), 347-363 (2003).
- Nicholson, D. A., Geinisman, Y. Axospinous synaptic subtype-specific differences in structure, size, ionotropic receptor expression, and connectivity in apical dendritic regions of rat hippocampal CA1 pyramidal neurons. J Comp Neurol. 512 (3), 399-418 (2009).
- Millhouse, O. E. The intercalated cells of the amygdala. J Comp Neurol. 247 (2), 246-271 (1986).
- Busti, D., et al. Different fear states engage distinct networks within the intercalated cell clusters of the amygdala. J Neurosci. 31 (13), 5131-5144 (2011).
- Amano, T., Unal, C. T., Paré, D. Synaptic correlates of fear extinction in the amygdala. Nat Neurosci. 13 (4), 489-494 (2010).
- Duvarci, S., Pare, D. Amygdala microcircuits controlling learned fear. Neuron. 82 (5), 966-980 (2014).
- Jüngling, K., et al. Neuropeptide S-mediated control of fear expression and extinction: role of intercalated GABAergic neurons in the amygdala. Neuron. 59 (2), 298-310 (2008).
- Asede, D., Bosch, D., Lüthi, A., Ferraguti, F., Ehrlich, I. Sensory inputs to intercalated cells provide fear-learning modulated inhibition to the basolateral amygdala. Neuron. 86 (2), 541-554 (2015).
- Maren, S. Neurobiology of Pavlovian fear conditioning. Annu Rev Neurosci. 24, 897-931 (2001).
- Pape, H. C., Pare, D. Plastic synaptic networks of the amygdala for the acquisition, expression, and extinction of conditioned fear. Physiol Rev. 90 (2), 419-463 (2010).
- Sigurdsson, T., et al. Long-term potentiation in the amygdala: a cellular mechanism of fear learning and memory. Neuropharmacology. 52 (1), 215-227 (2007).
- Bosch, D., Asede, D., Ehrlich, I. Ex-vivo optogenetic dissection of fear circuits in brain slices. J. Vis. Exp. (110), e53628 (2016).
- Fenno, L., Yizhar, O., Deisseroth, K. The development and application of optogenetics. Annu Rev Neurosci. 34, 389-412 (2011).
- Bienvenu, T. C. M., et al. Large intercalated neurons of amygdala relay noxious sensory information. J. Neurosci. 35 (5), 2044-2057 (2015).
- Sandri, C., Akert, K., Livingston, R. B., Moor, H. Particle aggregations at specialized sites in freeze-etched postsynaptic membranes. Brain Res. 41 (1), 1-16 (1972).
- Likhtik, E., Popa, D., Apergis-Schoute, J., Fidacaro, G. A., Paré, D. Amygdala intercalated neurons are required for expression of fear extinction. Nature. 454 (7204), 642-645 (2008).
- Fukazawa, Y., Shigemoto, R. Intra-synapse-type and inter-synapse-type relationships between synaptic size and AMPAR expression. Curr Opin Neurobiol. 22 (3), 446-452 (2012).
- Amiry-Moghaddam, M., Ottersen, O. P. Immunogold cytochemistry in neuroscience. Nat Neurosci. 16 (7), 798-804 (2013).
- Fukazawa, Y., Masugi-Tokita, M., Tarusawa, E., Hagiwara, A., Shigemoto, R., Cavalier, A., et al. SDS-digested Freeze-fracture replica labelling (SDS-FRL). Handbook of Cryo-Preparation Methods for Electron Microscopy. , 567-586 (2007).
- Severs, N. J. Freeze-fracture electron microscopy. Nat Protoc. 2 (3), 547-576 (2007).
- Tanaka, J., et al. Number and density of AMPA receptors in single synapses in immature cerebellum. J Neurosci. 25 (4), 799-807 (2005).
- Mansouri, M., et al. Distinct subsynaptic localization of type 1 metabotropic glutamate receptors at glutamatergic and GABAergic synapses in the rodent cerebellar cortex. Eur J Neurosci. 41 (2), 157-167 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены