Method Article
مضان الوقت الفاصل بين التصوير من كامل
In This Article
Erratum Notice
Summary
Streptomyces are characterized by a complex life cycle that has been experimentally challenging to study by cell biological means. Here we present a protocol to perform fluorescence time-lapse microscopy of the complete life cycle by growing Streptomyces venezuelae in a microfluidic device.
Abstract
Live-cell imaging of biological processes at the single cell level has been instrumental to our current understanding of the subcellular organization of bacterial cells. However, the application of time-lapse microscopy to study the cell biological processes underpinning development in the sporulating filamentous bacteria Streptomyces has been hampered by technical difficulties.
Here we present a protocol to overcome these limitations by growing the new model species, Streptomyces venezuelae, in a commercially available microfluidic device which is connected to an inverted fluorescence widefield microscope. Unlike the classical model species, Streptomyces coelicolor, S. venezuelae sporulates in liquid, allowing the application of microfluidic growth chambers to cultivate and microscopically monitor the cellular development and differentiation of S. venezuelae over long time periods. In addition to monitoring morphological changes, the spatio-temporal distribution of fluorescently labeled target proteins can also be visualized by time-lapse microscopy. Moreover, the microfluidic platform offers the experimental flexibility to exchange the culture medium, which is used in the detailed protocol to stimulate sporulation of S. venezuelae in the microfluidic chamber. Images of the entire S. venezuelae life cycle are acquired at specific intervals and processed in the open-source software Fiji to produce movies of the recorded time-series.
Introduction
Streptomycetes هي البكتيريا التي تعيش في التربة التي تتميز بها دورة التنموية المعقدة التي تنطوي على تمييز الصرفي من ذلك، أفطورة متعددة الخلايا، مسح المغذيات إلى نائمة، جراثيم unigenomic 1-3.
في ظل ظروف النمو المواتية، يبدأ بوغ نموذجية السبحية لتنبت قذف واحد أو اثنين من أنابيب الجرثومية (الشكل 1). هذه الأنابيب استطال استطرادا طرف وتنمو لتصبح شبكة خوطي متفرعة المعروفة باسم أفطورة الخضري. يتم توجيه النمو القطبي والمتفرعة خوطي من قبل DivIVA البروتين ضروري. هذا البروتين ملفوف لفائف هو جزء من مجمع حشوية كبير يسمى polarisome، وهو أمر حاسم لإدخال مواد جديدة خلية المغلف في الطرف تمتد 4-7. خلال النمو الخضري، وخيوط خوطي تصبح مجزأة عن طريق تشكيل نادرة من ما يسمى عبر الجدران 8. تشكيل هذه الجدران عبر إعادة ملازم بروتين زد، البروتين مثل تويولين هيكل الخلية التي لا غنى عنها لانقسام الخلايا في معظم البكتيريا 9. في السبحية، ولكن هذه الخضري عبر الجدران لا تؤدي إلى انقباض وخلية خلية الانفصال، وبالتالي يبقى كتلة فطر كشبكة من المقصورات المخلوي مترابطة. وردا على الحد من المغذيات والإشارات الأخرى التي ليست مفهومة جيدا، خيوط جوي متخصص كسر بعيدا عن أفطورة الخضري وتنمو في الهواء 3. تشييد هذه الهياكل يبدأ المرحلة الإنجابية للتنمية، وخلالها خيوط الجوي متعدد الجيني طويلة تصبح مقسمة إلى عشرات متساوية الحجم مقصورات prespore unigenomic. هو الدافع وراء هذا الحدث انقسام الخلايا الهائل من انقباض متزامن من حلقات بروتين زد متعددة داخل واحد 2،10 خيوط مولد الأبواغ. اكتمال التمايز الصرفي من قبل الافراج عن نائمة، وجراثيم المصطبغة سميكة الجدران.
ر "FO: المحافظة على together.within الصفحات =" 1 ">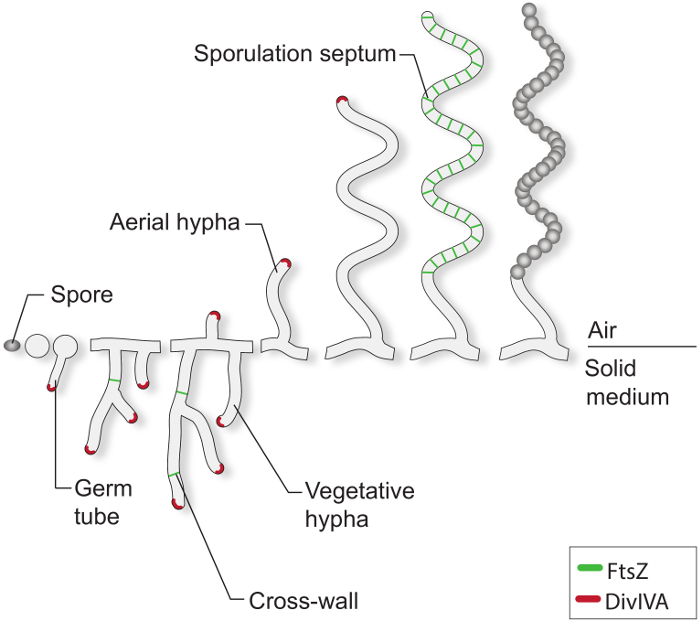
الشكل 1: والسبحية دورة الحياة على وسائل الاعلام الصلبة وهذا هو نموذج من دورة الحياة تقوم على أساس الدراسات الكلاسيكية من S. coelicolor المتزايد على لوحات أجار. تطوير الخلوية من الجراثيم تبدأ مع تشكيل واحد أو اثنين من أنابيب الجرثومية، التي تنمو استطرادا طرف لتشكيل شبكة من خيوط المتفرعة. يتم توجيه النمو القطبي والمتفرعة من خيوط الخضري بواسطة DivIVA (الحمراء). تشكيل الخضري الجدران عبر يتطلب بروتين زد (الخضراء). وردا على قيود المغذيات وإشارات أخرى، تقام خيوط الجوي. ويتم تنسيق القبض على النمو الجوي بشكل وثيق مع الجمعية من سلم من بروتين زد الحلقات، التي تؤدي إلى الحاجز تبوغ أن تجزئة للخيوط مولد الأبواغ إلى مربع يشبه المقصورات prespore. هذه المقصورات تجميع جدار بوغ سميكة وهي relea في نهاية المطافالحوار الاقتصادي الاستراتيجي جراثيم المصطبغة الناضجة.
أحداث التنموية الرئيسية في دورة الحياة السبحية تتميز بشكل جيد 1،3. ومع ذلك، ما يزال نادرة هي الخلايا البيولوجية الدراسات التي تستخدم مضان الوقت الفاصل بين المجهري لتوفير نظرة ثاقبة على العمليات التي تقوم عليها التحت خلوية التمايز، مثل ديناميات البروتين التوطين والحركة كروموسوم وانقسام الخلايا تسيطر تنمويا. وقد تم التصوير تعيش خلايا التنمية السبحية صعبة بسبب تعقيد دورة الحياة والخصائص الفسيولوجية للكائن الحي. وقد استخدمت الدراسات السابقة على النمو الخضري والمراحل الأولى من تحوجز تبوغ غرف التصوير الأكسجين منفذة، أو نمو المدعومة الاغاروز من السبحية coelicolor على خشبة المسرح المجهر 11-15. هذه الطرق، ومع ذلك، محدودة بسبب عدد من العوامل. بعض الأنظمة لا تسمح التصوير على المدى القصير من النمو الخلويد البروتينات الفلورية قبل خلايا تعاني من عدم كفاية إمدادات الأوكسجين أو تنمو من طائرة الوصل بسبب نمط ثلاثي الأبعاد للتنمية خوطي. في الحالات التي يكون فيها التصوير على المدى الطويل هو ممكن، وزراعة الخلايا على منصات الاغاروز حدود المرونة التجريبية لأن الخلايا لا يمكن أن تتعرض لظروف النمو أو الإجهاد البديلة، ومضان الخلفية من المتوسط في منصات الاغاروز يحد بشدة من قدرة على رصد أضعف الفلورسنت إشارات.
نحن هنا تصف بروتوكول للتصوير الخلايا الحية من دورة الحياة الكاملة السبحية بدقة ممتازة وحساسية. من خلال زراعة السبحية في جهاز ميكروفلويديك متصلة مضان widefield المجهر (الشكل 2)، ونحن الآن قادرون على رصد الإنبات والنمو الخضري وتحوجز تبوغ على مدى فترة زمنية تصل إلى 30 ساعة. ومما يسهل هذا كثيرا من استخدام السبحية نموذج حي الجديدة venezuelae لأنه sporulates إلى قرب الانتهاء في الثقافة المغمورة، وبالتالي يتغلب على الحد من الأنواع النموذج الكلاسيكي س. coelicolor، التي sporulates فقط على وسائل الاعلام الصلبة 16-20. للمساعدة في تصور النمو الخضري وتبوغ، شاركنا في التعبير عن الموسومة fluorescently إصدارات DivIVA علامة الخلية القطبية والمفتاح البروتين انقسام الخلايا بروتين زد.
نحن نستخدم جهاز ميكروفلويديك المتاحة تجاريا التي استخدمت بنجاح لالمتفطرات، كولاي، الوتدية glutamicum، العصوية الرقيقة والخميرة 21-25. نظام الفخاخ الخلايا في المستوى البؤري واحدة، وتتيح للسيطرة نضح المستمر من مستنبت من مختلف الخزانات. في بروتوكول مفصلة علينا أن نستفيد من هذه الميزة لفضح س. venezuelae أفطورة الخضري إلى بالاستعداد الغذائية لتعزيز تبوغ.
بروتوكول ديمكتوب هو للتصوير الخلايا الحية من دورة حياة السبحية بأكملها، ولكن الظروف وسائل الإعلام البديلة أو إعدادات المجهر ويمكن اختيار إذا مراحل نمو محددة ذات أهمية خاصة.
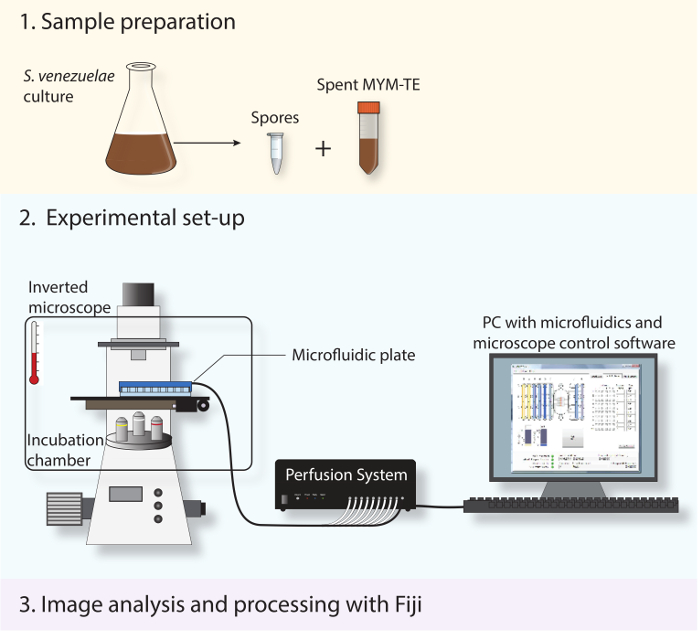
الشكل 2: رسم تخطيطي تصور التجريبي تدفق العمل. وتظهر الخطوات الرئيسية الثلاثة المذكورة في البروتوكول. أولا، يتم إعداد الجراثيم والمتوسطة أمضى من ثقافة مرحلة ثابتة. ثانيا، يتم تحميل جراثيم جديدة في نظام ميكروفلويديك وس. والتقط venezuelae طوال دورة حياتها التنموية باستخدام المجهر المقلوب مؤتمتة بالكامل مع غرفة الحضانة للحفاظ على درجة حرارة النمو المثلى. ثالثا، تحليل السلاسل الزمنية الفاصل بين الحصول على ومعالجتها باستخدام برمجيات المصدر المفتوح فيجي.
Protocol
1. عزل الطازجة س. venezuelae الجراثيم وإعداد المتوسطة ثقافة المستهلك
- تطعيم 30 مل المالتوز وخلاصة الخميرة و استخراج الشعير (حركة الشباب المجاهدين) المتوسطة، على أن تستكمل مع 60 ميكرولتر R2 حل العناصر النزرة (TE)، مع 10 ميكرولتر من الجراثيم SV60 سلالة [attB φ BT1 :: pSS209 (P divIVA - divIVA-mcherry ف بروتين زد -ftsZ-ypet)]. للنمو ثابت وتبوغ من الخلايا، واستخدام قارورة حيرة أو قارورة تحتوي على الربيع للسماح للتهوية كافية.
- الخلايا ثقافة 35-40 ساعة عند 30 درجة مئوية و 250 دورة في الدقيقة.
- دراسة الخلايا عن طريق السائل شنت المجهر على النقيض من المرحلة. عند هذه النقطة شظايا فطر وجراثيم سوف تكون واضحة.
- الطرد المركزي 1 مل الخلايا في جهاز للطرد المركزي فوق المنضدة في 400 x ج لمدة 1 دقيقة لتكوير المشيجة وشظايا خلية أكبر.
- نقل ما يقرب من 300 ميكرولتر طاف التعاونntaining تعليق الجراثيم إلى أنبوب 1.5 مل جديد والحفاظ على الجليد. الحفاظ على مستنبت المتبقية للخطوة 1.7.
- تمييع جراثيم 01:20 في حركة الشباب المجاهدين-TE (تركيز النهائي: 0،5-5 × 10 7 أبواغ / مل)، والحفاظ على الجليد لحين الحاجة إليها (راجع الخطوة 2.3).
ملاحظة: على الرغم من أن الظروف الدقيقة التي تؤدي تبوغ في السبحية غير مفهومة، وذلك باستخدام قضى المتوسطة حركة الشباب المجاهدين-TE، بما في ذلك أية إشارات الخلية غير معروف من ثقافة sporulating، ويحفز تكاثر. - فلتر تعقيم 10 مل من مستنبت المتبقية للحصول قضى حركة الشباب المجاهدين-TE خالية من الجراثيم وشظايا فطر. استخدام معقم 0.22 ميكرون تصفية المحاقن ونقل قضى حركة الشباب المجاهدين-TE إلى أنبوب 15 مل العقيمة.
- حافظ على استعداد قضى حركة الشباب المجاهدين-TE لبضعة أيام في 4 درجات مئوية إذا تجارب إضافية باستخدام ظروف النمو المماثلة التي ستجرى.
2. إعداد الجهاز ميكروفلويديك
ملاحظة: كل جيش التحرير الشعبى الصينى ميكروفلويديكالشركة المصرية للاتصالات تمكن ما يصل إلى أربعة تجارب مستقلة التي يتعين الاضطلاع بها. لتجنب التلوث من الدوائر تدفق غير المستخدمة، واستخدام الحلول العقيمة وظروف العمل عند إعداد التجربة.
- إزالة حل الشحن من لوحة ميكروفلويديك وشطف الآبار العقيمة مع حركة الشباب المجاهدين-TE.
- إضافة 300 ميكرولتر حركة الشباب المجاهدين-TE إلى مدخل جيدا 1 و 300 ميكرولتر قضى حركة الشباب المجاهدين-TE إلى الآبار 2-6.
- تحميل 40 ميكرولتر المخفف جراثيم من الخطوة 1.6 في الخلية تحميل جيدا 8 من حارة "A" وختم متعددة لوحة وفقا لتعليمات بتصنيع.
- إطلاق برنامج للتحكم على microfluidics، حدد نوع لوحة المناسب ووضع برنامج تدفق لرئيس قناة تدفق وغرفة الثقافة التي تتدفق المتوسطة من الآبار مدخل 1-5 في 6 رطل لمدة 2 دقيقة لكل بئر.
- في برنامج للتحكم على microfluidics، إنشاء بروتوكول تدفق للتجربة: تدفق حركة الشباب المجاهدين-TE من مدخل جيد 1 ل6 ساعات للسماح للإنبات والنمو الخضري للخلايا. تحولثم نضح من قضى حركة الشباب المجاهدين-TE من بئر 2-5 للمرة المتبقية من التجربة. خلال التجربة حفاظ على تدفق ضغط ثابت في 6 رطل (المقابل لحوالي 9 ميكرولتر المتوسطة / ساعة). بدء برنامج التدفق بعد خطوة 3.5.
3. إعداد للمجهر وبروتوكول الوقت الفاصل
ملاحظة: تم تنفيذ هذا الأسلوب على المجهر widefield مقلوب بمحركات تماما والآلية مزودة بكاميرا sCMOS، مصباح المعادن هاليد، وضبط تلقائي للصورة الأجهزة، حامل مرحلة لوحات 96-جيدا والغرفة البيئية.
- قبل تدفئة الغرفة البيئية إلى 30 درجة مئوية في وقت مبكر من أجل منع حدوث مشاكل مع ضبط تلقائي للصورة بعد بدء التجربة. الوقت اللازم يعتمد على غرفة البيئية المستخدمة، والمجهر ونظام التدفئة. بدء لتسخين النظام في الليلة التي سبقت التجربة.
- بدوره على المجهر وأتمتة الفحص المجهري والسيطرة softwaإعادة. استخدام الفتحة العددية (NA) هدف عالية الغمر النفط لجمع إشارة الأمثل والقرار المكانية، مثل 100X، 1.46 NA النفط هدف مدينة دبي للإنترنت. اختيار المرشحات المناسبة والمرايا مبصر اللونين للحصول على فرق تدخل النقيض (DIC) الصور والصور من اندماج البروتين أصفر فلوري والأحمر الفلورسنت.
- وضع قطرة من زيت الغمر على الهدف وإضافة الغمر السائل إلى الجزء السفلي من الإطار التصوير على لوحة ميكروفلويديك لتحسين التركيز الخلية خلال الحصول على الصور. بعناية تركيب جهاز ميكروفلويديك مختومة (الخطوة 2.5) على خشبة المسرح من مجهر مقلوب. تأكد من أن لوحة وضعت بشكل آمن في حامل مرحلة ولا تحول على مدى التجربة.
- جعل نافذة التصوير من غرفة الثقافة ميكروفلويديك إلى التركيز باستخدام علامات موقف جزءا لا يتجزأ من لالتوجه. التركيز على جزء أقصى اليسار من غرفة التدفق الأول (المسمى "A") مع حجم فخ 5، المقابلة لارتفاع فخ 0.7 ميكرون.
- في البرنامج على microfluidics، خلايا الحمل من مدخل جيد 8 في 4 رطل لمدة 15 ثانية. تحقق من كثافة الخلايا في غرفة الثقافة عن طريق تحريك المرحلة عبر نافذة التصوير. إذا حوصر أي جراثيم، كرر الخطوة خلية التحميل أو بدلا من ذلك زيادة الضغط تحميل و / أو الوقت حتى يتم تحقيق كثافة الخلية المطلوبة (1-10 الجراثيم في نافذة التصوير مع 2048 س 2048 بكسل). تجنب إثقال غرفة الثقافة.
ملاحظة: نحن عادة استخدام فخ حجم 5 لتصوير السبحية، ولكن لدينا أيضا الحصول على نتائج جيدة مع فخ أحجام 4 و 3. يرجى الرجوع إلى دليل المورد للحصول على اقتراحات إضافية على تحسين عملية خلية التحميل. - بدء تشغيل البرنامج التدفق في برنامج حاسوبي لمراقبة من الخطوة 2.5 والسماح لوحة ميكروفلويديك لتسخين-تتوازن لمدة 1 ساعة في المرحلة المجهر قبل البدء في الحصول على الصور.
- في برنامج حاسوبي لمراقبة المجهر، وتشكيل لاكتساب متعدد الأبعاد لاتخاذ موصور ltiple في مواقع متعددة المراحل على مر الزمن:
- لالحفظ التلقائي: تحديد دليل على الحفظ التلقائي للملفات الصور.
- للحصول على ضبط الإضاءة، تحديد إعدادات الإضاءة المثلى لكل بناء محددة مسبقا. للتجربة المذكورة، استخدم مرات التعرض التالية: مدينة دبي للإنترنت 150 ميللي ثانية، YFP 250 ميللي ثانية، طلب تقديم العروض 100 ميللي ثانية.
- لالسلاسل الزمنية: إنشاء سلسلة الوقت للحصول على الصور عند نقاط زمنية محددة في التسلسل. لتصوير دورة حياة س. venezuelae، حدد الفاصل الزمني 40 دقيقة على مدى 24 ساعة.
- لشغل وظائف المرحلة وضبط تلقائي للصورة: مسح غرفة الثقافة عن طريق تحريك المواقف مرحلة ومرحلة مخزن لكل وظيفة التصوير من الفائدة. تأكد من أن مواقف مرحلة واحدة تقع بعيدا بما فيه الكفاية لتقليل photobleaching من وphototoxicity.Typically استخدام ما يصل إلى 12 وظيفة. تشغيل روتين أوتوفوكس عن كل نقطة زمنية لتصحيح الانحراف البؤري بطيئة. إذا كان متوفرا في برنامج حاسوبي لمراقبة المجهر، على وضع الاستراتيجيات ضبط تلقائي للصورة إلى "تحديث سطح المحلي من خلال ضبط تلقائي للصورة الأجهزة". وحالما يتم التحقق من الإحداثيات Z من المواقف مرحلة محددة، تفعيل خاصية التركيز التلقائي الأجهزة.
- بدء التجربة مرور الزمن في برنامج حاسوبي لمراقبة المجهر.
- تأكد من أن جميع المناصب مرحلة لا تزال في التركيز على نقاط في وقت لاحق. للتجارب الوقت الفاصل بين تشغيل أكثر من عدة ساعات، وأحيانا نلاحظ الانجراف المرحلة حتى عند استخدام ضبط تلقائي للصورة. إذا تحتاج إلى تركيز وظائف المرحلة، إيقاف التجربة في أي نقطة زمنية مناسبة، وضبط التركيز وإعادة التجربة ضمن فترة زمنية محددة التصوير (الخطوة 3.7.3). راجع الخطوة 4.3 لكيفية لسلسلة السلاسل الزمنية.
- وقف الحصول على الصور بعد 24-30 ساعة أو عند خيوط في المنطقة من اهتمام ومتباينة في جراثيم (انظر مدينة دبي للإنترنت سلسلة صورة). وقف برنامج التدفق في البرنامج وتفكيك الجهاز ميكروفلويديك.
- إعداد لوحة ميكروفلويديك تستخدم لستو على المدى القصيرالغضب. إزالة حركة الشباب المجاهدين-TE المتبقية وقضى حركة الشباب المجاهدين-TE من بئر 1-6، وأيضا النفايات فارغة 7 وكذلك خلية تحميل 8. تحت ظروف معقمة، وإعادة ملء تستخدم آبار حارة "A" والآبار الممرات غير المستخدمة ( "B" ل "D") على لوحة مع معقم الفوسفات مخزنة المالحة (PBS). ختم لوحة مع بارافيلم لمنعها من الجفاف وتخزينها في 4 درجات مئوية.
4. الجيل الأفلام الوقت الفاصل عن طريق فيجي البرمجيات
ملاحظة: نلاحظ أن تختلف حزم البرمجيات التجارية والمجانية المتاحة لمعالجة الوقت الفاصل بين الصور المجهر بما في ذلك ZenBlue، Metamorph، الجليدية، ImagePro أو يماغيج. نحن هنا نركز على فيجي، وهو برنامج معالجة الصور مفتوح المصدر على أساس يماغيج، والذي يوفر عددا من الإضافات المثبتة مسبقا مفيدة.
- نقل البيانات التصوير من تجربتك مرور الزمن إلى الكمبيوتر الذي فيجي تثبيت.
- إطلاق برنامج واستيراد ملف التصوير باستخدام و# 34؛ ملف> استيراد> بيو تنسيقات ". أو ببساطة عن طريق سحب الملف التصوير في فيجي في" بيو تنسيقات خيارات استيراد "، وضع علامة في مربع" قنوات تقسيم "للحصول على صورة كومة منفصلة لكل قناة الإضاءة (DIC ، طلب تقديم العروض، YFP).
- اختياري: لدمج منفصلة السلاسل الزمنية الناتجة عن كسر في في الحصول على الصور بسبب إعادة تركيز (الخطوة 3.9)، فتح مداخن صورة منها، وتشغيل "صورة> الأكوام> أدوات> سلسلة" لكل قناة (DIC، طلب تقديم العروض، YFP ).
- تقييم جودة البيانات في الوقت الفاصل بين طريق التمرير من خلال مداخن صورة. بحث عن خيوط التي بقيت في التركيز على مر الزمن، وتظهر نمو فطر وتشكل في نهاية المطاف جراثيم (DIC كومة). دراسة توطين التحت خلوية المتوقع لDivIVA-mCherry في نصائح خوطي (RFP كومة) وبروتين زد-YPet تشكيل عصابات واحد أو عدة هياكل، مثل سلم في الخضري أو خيوط مولد الأبواغ (YFP كومة)، على التوالي.
- عزل المنطقة التي تهم اللازم المصبنانوغرام من الصور. الوقت الفاصل بين المجهري غالبا ما تنتج الملفات الكبيرة التي قد تبطئ المعالجة من قبل فيجي. لذا فمن المستحسن لتحديد وعزل المنطقة ذات الاهتمام (ROI) ولأداء المزيد من الخطوات لمعالجة الصور على هذا الإصدار أصغر من المكدس صورة.
- حدد أداة "اختيار مستطيلة" في القائمة ورسم العائد على الاستثمار مستطيلة في كومة صورة مدينة دبي للإنترنت في مثل هذه الطريقة التي يتم تضمينه في خيوط النامية عن طريق العائد على الاستثمار في جميع أنحاء سلسلة صورة.
- تكرار العائد على الاستثمار كومة مع "السيطرة" + "التحول" + "D".
- انقر على شريط اسم كومة صورة YFP واختر "تحرير> اختيار> استعادة التحديد" في القائمة لاستعادة اختيار مستطيلة السابقة من مدينة دبي للإنترنت الأصلي كومة إلى نفس positon في كومة YFP وتكرار العائد على الاستثمار مع "السيطرة" + "التحول" + "D".
- كرر هذه العملية لكومة طلب تقديم العروض.
- محاذاة الصور في صورة ثلاثية مداخن رس إزالة الانجرافات مرحلة في الطائرة س ص مع مرور الوقت. انتقل إلى الإطار الأخير في كومة مدينة دبي للإنترنت وحدد "المساعد> التسجيل> StackReg> RigedBody" من القائمة. كرر هذه الخطوة لطلب تقديم العروض وكومة صورة YFP. إذا لزم الأمر، والمحاصيل العائد على الاستثمار بتكرار الخطوة 4.5.1-4.5.3.
- اختياري: ضبط السطوع والتباين يدويا لكل كومة صورة مع "ضبط أداة السطوع والتباين" ( "السيطرة" + "التحول" + "C") أو حدد "عملية> تعزيز التباين" من القائمة وتطبيق "تطبيع" الأوامر لجميع الصور في المكدس. وتجدر الإشارة إلى أن الأمر الأخير سوف يغير القيم بكسل، وبالتالي قد تؤثر على تحليل الصور المصب.
- اختياري: الجمع بين أكوام الفردية (تحويلها إلى تنسيق ملف RGB، انظر 4.11) أفقيا أو رأسيا باستخدام البرنامج المساعد "صورة> الأكوام> أدوات> الجمع بين".
- إضافة شريط مقياس ( "تحليل> أدوات> مقياس بار") والختام الوقت (&# 34؛ صورة> الأكوام> الوقت الختام ").
- حفظ مداخن صورة تعديلها حسب تسلسل الصورة في شكل "TIFF.". لإنتاج الفيلم، حفظ باسم "افي". بدلا من ذلك، سلسلة صورة التصدير في شكل كويك تايم باستخدام "بيو تنسيقات> بيو تنسيقات مصدر" المساعد وحدد "وسائل التحقق" نوع الملف.
- للحصول على الصور من الأطر واحد، حدد الإطار من الاهتمام وتكرار الصورة على "السيطرة" + "التحول" + "D". تغيير نوع الصورة الناتجة إلى "RGB" أو "8 بت" تحت عنوان "صورة> نوع> لون RGB أو 8 بت" وحفظ الصورة باسم "و tiff".
ملاحظة: تقدم فيجي عددا من وظائف إضافية لمواصلة تعليم أو سلسلة عملية مرور الزمن. الذهاب إلى دعم فيجي على الانترنت للحصول على معلومات تفصيلية (http://fiji.sc/Fiji).
النتائج
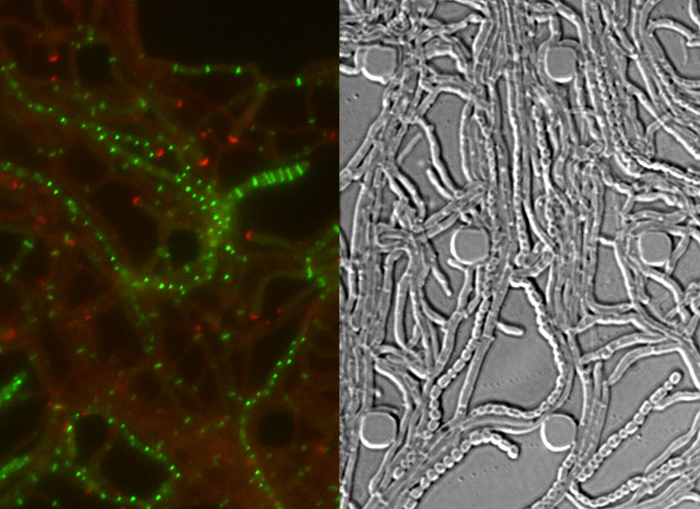
الناجح التصوير الخلية الحية من S. كامل دورة الحياة venezuelae غلة مستمر السلاسل الزمنية بما في ذلك مراحل النمو الرئيسية للإنبات والنمو الخضري وتبوغ (الشكل 3، فيلم 1). ومما يعزز التصور للتطور من خلال دورة حياة أبعد من ذلك توطين التحت خلوية متميزة من DivIVA-mCherry وبروتين زد-YPet. أثناء الإنبات والنمو الخضري، DivIVA-mCherry يتراكم على وجه الحصر في تزايد نصائح خوطي أو علامات تشكيل حديثا نقاط فرع الشكل (4A). هذه النتائج تتماشى مع المواقع التحت خلوية ذكرت سابقا من DivIVA 12،26. في المقابل، بروتين زد-YPet تشكل هياكل تشبه حلقة واحدة على فترات غير منتظمة في المشيجة تبعها (الشكل 4B). وتوفر هذه الهياكل السقالة لتركيب غير التضييقية الخضري الجدران عبر، مما يؤدي إلى تشكيل interconnالمقصورات خوطي ECTED 8. وتمايز الخلايا على النمو خيوط في خيوط مولد الأبواغ تصبح مرئية من قبل اختفاء القطبية بؤر DivIVA-mCherry، القبض على النمو القطبي ويصاحب ذلك زيادة في بروتين زد-YPet مضان (الشكل 4C). في sporulating خيوط، ونمط توطين بروتين زد-YPet يتغير بشكل كبير. الأولى حلزونية خيوط بروتين زد-YPet تعثر على طول خوط وبعد ذلك، في المفاجئ، حدث متزامن تقريبا، وهذه اللوالب تتجمع في سلم متباعدة بصورة منتظمة حلقات بروتين زد-YPet. في ظل الظروف التجريبية الموصوفة هنا، هذه موزعة بالتساوي سلالم بروتين زد-YPet تستمر لحوالي 2 ساعة. وأخيرا، تبوغ الحاجز تصبح مميزا في المقابل تدخل الفرق (DIC) صور (الشكل 4D) وفي النهاية يتم الافراج عن جراثيم جديدة.
بروتوكول لاحق واصفا معالجة الصور باستخدام تنص على البرنامج فيجي تيب بخطوة شرح لكيفية إنتاج فيلم للنشر من سلسلة مرور الزمن المكتسب (فيلم 1).
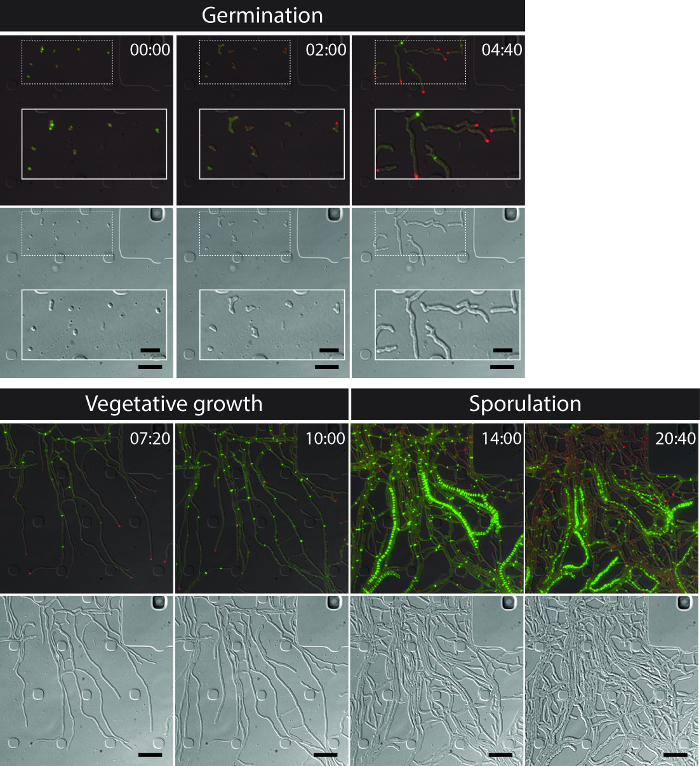
الشكل (3): صور لقطة من ممثل الوقت الفاصل بين مضان المجهر سلسلة من س. venezuelae إنتاج fluorescently المسمى بروتين زد (الخضراء) وDivIVA (الأحمر) أظهرت هي إطارات مختارة من الصور المدمجة (أعلى لوحة: طلب تقديم العروض-YFP-مدينة دبي للإنترنت، أسفل لوحة: DIC). تصور دورة حياة السبحية بما في ذلك الإنبات والنمو الخضري والتجرثم. وقد أخذت صور من الفيلم 1. الوقت في ساعة: دقيقة. على نطاق والحانات = 5 ميكرون. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
د / 53863 / 53863fig4.jpg "/>
الشكل 4: نتائج الممثل لنجاح سلسلة الوقت الفاصل بين دورة حياة السبحية (A) توطين DivIVA-mCherry. المعروضة هي لقطات من يومين النقاط الزمنية اللاحقة من الفيلم 1 مع الصور المدمجة من طلب تقديم العروض والقنوات مدينة دبي للإنترنت. يصادف DivIVA-mCherry مواقع فرع خوطي الجديدة (شغل في رأس السهم) ويموضع في الطرف خوطي لتوجيه النمو القطبي (مفتوحة رأس السهم). شريط مقياس = 10 ميكرومتر (ب) بروتين زد-YPet توطين خلال النمو الخضري (رأس السهم). بروتين زد-YPet تشكل هياكل تشبه حلقة واحدة (لوحة العليا) التي لا انقباض (DIC، اللوحة السفلى). (C) بروتين زد-YPet (الأخضر) توطين خلال تحوجز تبوغ. وتظهر بؤر DivIVA-mCherry باللون الأحمر، مع الوقت المنقضي يصور أدناه (ساعة: دقيقة). مقياس شريط: 5 ميكرون. (D) الموافق صور مدينة دبي للإنترنت من خيوط sporulating من (C) والتي تبين شكلأوجه من المقصورات prespore مع الحاجز تبوغ مرئية (الصورة اليسرى)، والتي تستحق في نهاية المطاف إلى سلسلة من الجراثيم (الصورة اليمنى). الوقت في ساعة: دقيقة. مقياس شريط = 5 ميكرون. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
فيلم 1: الوقت الفاصل بين مضان المجهر سلسلة من السبحية venezuelae دورة الحياة ويتكون الفيلم من صور-طلب تقديم العروض YFP المدمجة (يسار) والمقابلة تدخل الفرق المقابل (DIC) صور (يمين). يظهر DivIVA-mCherry في الحمراء وبروتين زد-YPet باللون الأخضر. الفاصل الزمني بين الإطارات واحدة 40 دقيقة. شريط النطاق = 10 ميكرون. الرجاء انقر هنا لعرض ثيالصورة الفيلم.
Discussion
كان الوقت الفاصل بين المجهري دورة حياة السبحية تحديا تقنيا في الماضي. هنا نقدم بروتوكول قوية لأداء التصوير الخلية الحية من دورة حياة كاملة باستخدام اندماج بروتين فلوري إلى DivIVA علامة الخلية القطبية والبروتين انقسام الخلايا بروتين زد للمساعدة في تصور وتتبع التقدم من خلال البرنامج التنموي (الشكل 2).
المركزية إلى هذا الأسلوب هو زراعة س. venezuelae في جهاز ميكروفلويديك التي تسمح نضح المتوسط المستمر وتبادل المتوسطة النمو الطبيعي (حركة الشباب المجاهدين-TE) مع المتوسط أمضى (قضى حركة الشباب المجاهدين-TE). تغيير حالة الثقافة مهم للبروتوكول وصفها لأن بالاستعداد الغذائية والآبار وأي إشارات الخلية لم تحدد هويتهم بعد (على سبيل المثال النصاب الاستشعار إشارات) في مستنبت قضى، وتعزيز تبوغ، في حين أن إمدادات مستمرة من المتوسط الغنية بالمغذيات يحفز growt الخضريح مع أي تشكيل بوغ (لا تظهر البيانات). وهكذا، زراعة الخلايا في هذا النظام ميكروفلويديك متفوقة لزراعة الخلايا على الاغاروز لأنه يوفر مرونة أكثر التجريبية ويتيح رصد طويل الأجل للتغيرات في نمو البكتيريا في استجابة لتغير الظروف والثقافة. على الرغم من أن لوحات ميكروفلويديك مصممة للاستخدام مرة واحدة فقط، وتدفق القنوات التي لم يتم تلقيح مع خلايا يمكن استخدامها في تجارب لاحقة. ننصحك باستخدام جميع قنوات لوحة ميكروفلويديك في غضون أسبوع، ونحن قد واجهت مشاكل ختم متعددة للوحات التي تم فتحها لمرات أطول.
عند إعداد التجربة، وجدنا أن طازجة جراثيم نبتت في غضون سنتين ساعة من يجري تحميلها في غرفة التدفق، في حين جراثيم المستمدة من المخزون الجلسرين المجمدة المطلوبة لا يقل عن 6 ساعة قبل ظهر الأنابيب الجرثومية (لا تظهر البيانات). هذا التأخير في إنبات يمتد طول التجربة ويمكن أن تتداخل معتوافر المعدات والظروف التجريبية. ومن المهم أيضا أن تبدأ التجربة مع نضح من حركة الشباب المجاهدين-TE لا يقل عن 3 ساعة لتوفير المواد الغذائية الكافية لتطوير ونمو أنابيب الجرثومية. نضح مع حركة الشباب المجاهدين-TE ويمكن تمديد يتجاوز 3 ساعة الأولية إذا تم تصميم التجربة لدراسة النمو الخضري. بينما توفر جراثيم الخيار المفضل البدء المواد، شظايا القصير خوطي كما يمكن تحميلها في لوحة ميكروفلويديك. ومع ذلك، فإن كفاءة التحميل عند استخدام أفطورة المنفصمة مهم أقل، وغالبا ما يتطلب عدة أشواط التحميل والتي قد تشكل القيد عند فحص المسوخ غير sporulating. بغض النظر عن نوع اللقاح المستخدم، فمن المهم أن لا تفرط في غرفة الثقافة بجراثيم أو شظايا خوطي لأن ذلك سوف يؤدي إلى اكتظاظ السريع التي يمكن أن تتداخل مع انتشار وسائل الإعلام وتعقيد تحليل الصور.
من المهم التخطيط لبناء البروتينات مراسل يتنبهLLY للاستخدام في مضان الوقت الفاصل بين التصوير في السبحية. طول رابط بين بروتين الهدف ومراسل الفلورسنت واختيار N- أو اندماج C-محطة يمكن أن تكون حاسمة. وعلاوة على ذلك، الظروف التجريبية الأمثل، بما في ذلك تردد التصوير ووقت التعرض، ويجب أن يتم تحديد مقدما لكل البروتين fluorescently الموسومة. س. venezuelae خيوط معرض لصناعة السيارات في مضان في القناة أخضر / أصفر التي قد تصبح مشكلة عندما التصوير البروتين fluorescently المسمى التي يتم التعبير عند مستويات منخفضة. وبالإضافة إلى ذلك، تجدر الإشارة إلى أنه خلال إنبات ومرحلة النمو الخضري الأولية، S. venezuelae حساسة بشكل خاص للضوء الطول الموجي القصير (على سبيل المثال عند استخدام اندماج البروتين لCFP).
وعلى الرغم من التقدم المستمر في تقنيات التصوير وأنظمة مراسل الفلورية للتصوير الخلايا الحية من البكتيريا، أكثر من حزم البرامج (مثل MicrobeTracker، Schnitzelcملتعلمي اللغة اإلنكليزية، CellProfiler) للمعالجة الآلية لاحق من هذه الأنواع من مجموعات البيانات لا تدعم تحليل الصور المستمدة من البكتيريا الخيطية مع نمط الحياة متعددة الخلايا 27-29. وبالتالي، هناك حاجة إلى تطوير الخوارزمية المناسبة لتحليل الإنتاجية العالية الكمي للبيانات التصوير من السبحية والبكتيريا الخيطية أخرى.
وباختصار، فإن العمل الموصوفة هنا يوضح الإمكانات الهائلة س venezuelae كنظام التنموي نموذج جديد للجنس، بسبب قدرتها على sporulate في السائل. الجهاز زراعة ميكروفلويديك بسيط الاستخدام حتى بالنسبة للمستخدمين عديمي الخبرة. أنه يوفر منصة ممتازة لدراسة العمليات البيولوجية الخلية المركزية لدورة الحياة السبحية، بما في ذلك توطين دينامية البروتين والنمو الاستقطاب، والتفريق الصرفي من أفطورة متعددة الخلايا في سلاسل من الجراثيم unigenomic. وبالإضافة إلى ذلك وضعت هذا التجريبية شكما يوفر ص نقطة انطلاق مغرية للتحقيق في الأحداث في التنمية التي تتطلب بالتناوب الظروف والثقافة، أو استخدام الأصباغ الفلورية مثل الأحماض D الفلورسنت -amino لمراقبة تركيب ببتيدوغليكان أو يوديد propidium و 4 "، 6 diamidino-2-phenylindole (دابي) لتصور منظمة كروموسوم 30،31.
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors thank Grant Calder for technical assistance with the microscope, Matt Bush for comments on the protocol, and the John Innes Centre for purchase of the Zeiss widefield microscope. This work was funded by BBSRC grant BB/I002197/1 (to M.J.B), by BBSRC Institute Strategic Programme Grant BB/J004561/1 to the John Innes Centre, by Swedish Research Council grant 621-2010-4463 (to K.F.), and by a Leopoldina Postdoctoral Fellowship (to S.S.).
Materials
| Name | Company | Catalog Number | Comments |
| B04A CellAsic ONIX plate for bacteria cells | Merck-Millipore | B04A-03-5PK | Microfluidic culture plates |
| CellAsic ONIX Microfluidic Perfusion System and ONIX FG (version 5.0.2) | Merck-Millipore | EV-262 | The latest ONIX vesion (July 2015) and instructions on how to use the programme can be found here: http://www.merckmillipore.com |
| Axio Observer.Z1 Microscope | Zeiss | 431007-9902-000 | Fully automated and motorized inverted widefield microscope |
| Incubator XL multi S1 with Temperature Module S1 and Heating unit XL S2 | Zeiss | 411857-9061-000 | Environmental chamber surrounding the microscope |
| Plan-Apochromat 100x/1.46 Oil DIC objective | Zeiss | 420792-9800-000 | |
| Ocra FLASH 4 V2 | Hamamatsu Photonics K.K. | C11440-22CU | |
| Illuminator HXP 120V | Zeiss | 423013-9010-000 | |
| FL Filter Set 46 HE YFP shift free | Zeiss | 489046-9901-000 | Fluorescent filter set, excitation 500/25 nm, emission 535/30 nm |
| FL Filter Set 63 HE RFP shift free | Zeiss | 489063-0000-000 | Fluorescent filter set, excitation 572/25 nm, emission 629/30 nm |
| Mounting frame K-M for multiwell plates | Zeiss | 000000-1272-644 | Stage holder for microfluidic plate |
| ZEN pro 2012 | Zeiss | 410135-1002-120 | Microscope control software |
| ZEN Module Time Lapse | Zeiss | 410136-1031-110 | Software module to set up time-lapse microscopy experiments |
| ZEN Module Tiles/Positions | Zeiss | 410136-1025-110 | Software module to save specific stage positions (xzy) |
| Fiji | open-source software package | http://fiji.sc/Fiji | Generation of time-lapse movies |
| Maltose-Yeast Exctract-Malt Extract (MYM) 4 g Maltose 4 g Yeast extract 10 g Malt extract add 1 L H2O using 50 % tap water and 50 % reverse osmosis water and supplement with 200 ml of R2 trace element solution per 100 ml after autoclaving | Sporulation medium used to culture S. venezuelae SV60 | ||
| R2 Trace element solution (TE) 8 mg ZnCl2 40 mg FeCl3-6H2O 2 mg CuCl2-2H2O 2 mg MnCl2-4H2O 2 mg Na2B4O7-10H2O 2 mg (NH4)6Mo7O24-4H2O add 200 ml H2O Autoclave and store at 4 oC | Add 0.002 volumes to MYM | ||
| PBS (phosphate buffered saline) | Sigma | P4417-100TAB | Used to refill inlet wells of unused lanes in B04A plates in order to prepare plate for short-term storage. |
| 0.22 µm syringe filters | Satorius stedim | 16532-K | Preparation of spent MYM-TE |
| SV60 | John Innes Centre strain collection | S. venezuelae strain expressing divIVA-mcherry and ftsZ-ypet |
References
- Bush, M. J., Tschowri, N., Schlimpert, S., Flärdh, K., Buttner, M. J. c-di-GMP signalling and the regulation of developmental transitions in streptomycetes. Nat. Rev. Microbiol. 13, 749-760 (2015).
- Jakimowicz, D., van Wezel, G. P. Cell division and DNA segregation in Streptomyces.: how to build a septum in the middle of nowhere? Mol. Microbiol. 85, 393-404 (2012).
- McCormick, J. R., Flärdh, K. Signals and regulators that govern Streptomyces development. FEMS Microbiol. Rev. 36, 206-231 (2012).
- Flärdh, K., Richards, D. M., Hempel, A. M., Howard, M., Buttner, M. J. Regulation of apical growth and hyphal branching in Streptomyces. Curr. Opin. Microbiol. 15, 737-743 (2012).
- Hempel, A. M., et al. The Ser/Thr protein kinase AfsK regulates polar growth and hyphal branching in the filamentous bacteria Streptomyces. Proc. Natl. Acad. Sci. U S A. 109, E2371-E2379 (2012).
- Fuchino, K., et al. Dynamic gradients of an intermediate filament-like cytoskeleton are recruited by a polarity landmark during apical growth. Proc. Natl. Acad. Sci. U S A. 110, E1889-E1897 (2013).
- Holmes, N. A., et al. Coiled-coil protein Scy is a key component of a multiprotein assembly controlling polarized growth in Streptomyces. Proc. Natl. Acad. Sci. U S A. 110, E397-E406 (2013).
- McCormick, J. R., Su, E. P., Driks, A., Losick, R. Growth and viability of Streptomyces coelicolor. mutant for the cell division gene ftsZ. Mol. Microbiol. 14, 243-254 (1994).
- Margolin, W. FtsZ and the division of prokaryotic cells and organelles. Nat. Rev. Mol. Cell Biol. 6, 862-871 (2005).
- Grantcharova, N., Lustig, U., Flärdh, K. Dynamics of FtsZ assembly during sporulation in Streptomyces coelicolor A3(2). J. Bacteriol. 187, 3227-3237 (2005).
- Richards, D. M., Hempel, A. M., Flärdh, K., Buttner, M. J., Howard, M. Mechanistic basis of branch-site selection in filamentous bacteria. PLoS Comput. Biol. 8, e1002423(2012).
- Hempel, A. M., Wang, S. B., Letek, M., Gil, J. A., Flärdh, K. Assemblies of DivIVA mark sites for hyphal branching and can establish new zones of cell wall growth in Streptomyces coelicolor. J. Bacteriol. 190, 7579-7583 (2008).
- Wolanski, M., et al. Replisome trafficking in growing vegetative hyphae of Streptomyces coelicolor A3(2). J. Bacteriol. 193, 1273-1275 (2011).
- Jyothikumar, V., Tilley, E. J., Wali, R., Herron, P. R. Time-lapse microscopy of Streptomyces coelicolor.growth and sporulation. Appl. Environ. Microbiol. 74, 6774-6781 (2008).
- Willemse, J., Borst, J. W., de Waal, E., Bisseling, T., van Wezel, G. P. Positive control of cell division: FtsZ is recruited by SsgB during sporulation of Streptomyces. Genes. Dev. 25, 89-99 (2011).
- Glazebrook, M. A., Doull, J. L., Stuttard, C., Vining, L. C. Sporulation of Streptomyces venezuelae. in submerged cultures. J. Gen. Microbiol. 136, 581-588 (1990).
- Bibb, M. J., Domonkos, A., Chandra, G., Buttner, M. J. Expression of the chaplin and rodlin hydrophobic sheath proteins in Streptomyces venezuelae.is controlled by sigma(BldN) and a cognate anti-sigma factor, RsbN. Mol. Microbiol. 84, 1033-1049 (2012).
- Al-Bassam, M. M., Bibb, M. J., Bush, M. J., Chandra, G., Buttner, M. J. Response regulator heterodimer formation controls a key stage in Streptomyces development. PLoS Genet. 10, e1004554(2014).
- Bush, M. J., Bibb, M. J., Chandra, G., Findlay, K. C., Buttner, M. J. Genes required for aerial growth, cell division, and chromosome segregation are targets of WhiA before sporulation in Streptomyces venezuelae. MBio. 4, e00684-e00613 (2013).
- Tschowri, N., et al. Tetrameric c-di-GMP mediates effective transcription factor dimerization to control Streptomyces development. Cell. 158, 1136-1147 (2014).
- Mirouze, N., Ferret, C., Yao, Z., Chastanet, A., Carballido-Lòpez, R. MreB-Dependent Inhibition of Cell Elongation during the Escape from Competence in Bacillus subtilis. PLoS Genet. 11, e1005299(2015).
- Zopf, C. J., Maheshri, N. Acquiring fluorescence time-lapse movies of budding yeast and analyzing single-cell dynamics using GRAFTS. J. Vis. Exp. (e50456), (2013).
- Meniche, X., et al. Subpolar addition of new cell wall is directed by DivIVA in mycobacteria. Proc. Natl. Acad. Sci. U S A. 111, E3243-E3251 (2014).
- Donovan, C., Schauss, A., Kramer, R., Bramkamp, M. Chromosome segregation impacts on cell growth and division site selection in Corynebacterium glutamicum. PLoS One. 8, e55078(2013).
- Rojas, E., Theriot, J. A., Huang, K. C. Response of Escherichia coli. growth rate to osmotic shock. Proc. Natl. Acad. Sci. U S A. 111, 7807-7812 (2014).
- Flärdh, K. Essential role of DivIVA in polar growth and morphogenesis in Streptomyces coelicolor A3(2). Mol. Microbiol. 49, 1523-1536 (2003).
- Sliusarenko, O., Heinritz, J., Emonet, T., Jacobs-Wagner, C. High-throughput subpixel precision analysis of bacterial morphogenesis and intracellular spatio-temporal dynamics. Mol. Microbiol. 80, 612-627 (2011).
- Young, J. W., et al. Measuring single-cell gene expression dynamics in bacteria using fluorescence time-lapse microscopy. Nat. Protoc. 7, 80-88 (2012).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7, R100(2006).
- Kuru, E., Tekkam, S., Hall, E., Brun, Y. V., Van Nieuwenhze, M. S. Synthesis of fluorescent D-amino acids and their use for probing peptidoglycan synthesis and bacterial growth in situ. Nat. Protoc. 10, 33-52 (2015).
- Szafran, M., et al. Topoisomerase I (TopA) is recruited to ParB complexes and is required for proper chromosome organization during Streptomyces coelicolor. sporulation. J. Bacteriol. 195, 4445-4455 (2013).
Erratum
Formal Correction: Erratum: Fluorescence Time-lapse Imaging of the Complete S. venezuelae Life Cycle Using a Microfluidic Device
Posted by JoVE Editors on 7/01/2016. Citeable Link.
A correction was made to: Fluorescence Time-lapse Imaging of the Complete S. venezuelae Life Cycle Using a Microfluidic Device
The author's name was updated from:
Mark Buttner
to:
Mark J. Buttner
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved