Method Article
Fluorescencia-lapse de imágenes de la completa
En este artículo
Resumen
Streptomyces are characterized by a complex life cycle that has been experimentally challenging to study by cell biological means. Here we present a protocol to perform fluorescence time-lapse microscopy of the complete life cycle by growing Streptomyces venezuelae in a microfluidic device.
Resumen
Live-cell imaging of biological processes at the single cell level has been instrumental to our current understanding of the subcellular organization of bacterial cells. However, the application of time-lapse microscopy to study the cell biological processes underpinning development in the sporulating filamentous bacteria Streptomyces has been hampered by technical difficulties.
Here we present a protocol to overcome these limitations by growing the new model species, Streptomyces venezuelae, in a commercially available microfluidic device which is connected to an inverted fluorescence widefield microscope. Unlike the classical model species, Streptomyces coelicolor, S. venezuelae sporulates in liquid, allowing the application of microfluidic growth chambers to cultivate and microscopically monitor the cellular development and differentiation of S. venezuelae over long time periods. In addition to monitoring morphological changes, the spatio-temporal distribution of fluorescently labeled target proteins can also be visualized by time-lapse microscopy. Moreover, the microfluidic platform offers the experimental flexibility to exchange the culture medium, which is used in the detailed protocol to stimulate sporulation of S. venezuelae in the microfluidic chamber. Images of the entire S. venezuelae life cycle are acquired at specific intervals and processed in the open-source software Fiji to produce movies of the recorded time-series.
Introducción
Estreptomicetos son bacterias viven en el suelo que se caracterizan por un ciclo de desarrollo complejo que implica la diferenciación morfológica de una multicelular, micelio de nutrientes de barrido a, esporas unigenomic latentes 1-3.
En condiciones de crecimiento favorables, una espora típicos Streptomyces empieza a germinar mediante la extrusión de uno o dos tubos germinales (Figura 1). Estos tubos se alargan por extensión de la punta y se convierten en una red de hifas ramificadas conocido como el micelio vegetativo. el crecimiento de las hifas Polar y ramificación es dirigida por el DivIVA proteína esencial. Esta proteína espiral de la bobina es parte de un gran complejo citoplasmática llamada la polarisome, que es crucial para la inserción de material de nueva dotación de células en la punta que se extiende 4-7. Durante el crecimiento vegetativo, los filamentos de hifas se convierten en compartimientos por la formación poco frecuente de las llamadas paredes transversales 8. La formación de estas paredes transversales re requiere FtsZ, la proteína del citoesqueleto tubulina-como que es esencial para la división celular en la mayoría de las bacterias 9. En Streptomyces, sin embargo, estos vegetativas paredes transversales no conducen a la constricción y célula-célula separación y por lo tanto la masa del micelio permanece como una red de compartimentos sincitiales interconectados. En respuesta a la limitación de nutrientes y otras señales que no se entiende bien, las hifas aéreas especializado romper con el micelio vegetativo y crecer en el aire 3. La construcción de estas estructuras inicia la fase reproductiva de desarrollo, durante el cual el largo hifas aéreas multi-genómica ser dividido en compartimentos de preespora unigenomic de igual tamaño decenas. Este evento masivo división celular es impulsado por la constricción sincrónica de múltiples anillos FtsZ dentro de solo 2,10 hifas esporogénica. diferenciación morfológica se completa con el lanzamiento de paredes gruesas esporas pigmentadas latentes,,.
t "fo: keep-together.within-page =" 1 ">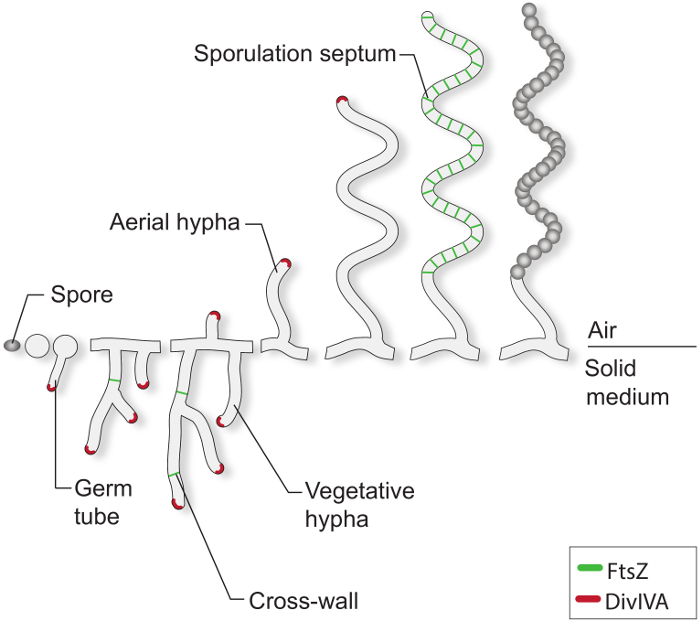
Figura 1:. El ciclo de vida-Streptomyces en medios sólidos Este es un modelo del ciclo de vida basado en los estudios clásicos de S. coelicolor que crecen en placas de agar. El desarrollo celular de una espora comienza con la formación de uno o dos tubos germinativos, que crecen por extensión punta para formar una red de ramificación hifas. crecimiento Polar y la ramificación de las hifas vegetativas es dirigida por DivIVA (rojo). La formación de vegetativas paredes transversales requiere FtsZ (verde). En respuesta a las limitaciones de nutrientes y otras señales, las hifas aéreas son erigidos. Detención del crecimiento aéreo está estrechamente coordinado con el montaje de una escalera de FtsZ tóricas, que dan lugar a la esporulación septos que compartimentar las hifas esporogénico en compartimentos prespore en forma de caja. Estos compartimentos se reúnen una pared de la espora de espesor y son finalmente RELEAsed esporas pigmentadas como maduros.
Los eventos de desarrollo claves del ciclo de vida de Streptomyces están bien caracterizados 1,3. Sin embargo, lo que es aún escasa son células biológicas estudios que emplean la microscopía de fluorescencia de lapso de tiempo para dar una idea de los procesos que sustentan la diferenciación subcelulares, tales como la dinámica de localización de proteínas, movimiento de los cromosomas y la división celular controlada desarrollo. Imágenes de células vivas de Streptomyces desarrollo ha sido difícil debido a la complejidad del ciclo de vida y las características fisiológicas del organismo. Estudios anteriores sobre el crecimiento vegetativo y las etapas iniciales de la tabicación esporulación han empleado cámaras de formación de imágenes permeables al oxígeno, o el crecimiento de agarosa-compatible de Streptomyces coelicolor en una platina del microscopio 11-15. Estos métodos, sin embargo, están limitados por una serie de factores. Algunos sistemas sólo permiten imágenes de corto plazo de un crecimiento celulard proteínas fluorescentes antes que las células sufren de suministro de oxígeno insuficiente o crecen fuera del plano focal debido al patrón tridimensional de desarrollo de hifas. En los casos en que sea posible formación de imágenes a largo plazo, el cultivo de células en agarosa almohadillas límites de flexibilidad experimental porque las células no pueden estar expuestos a condiciones de crecimiento o estrés alternativos, y la fluorescencia de fondo del medio en las almohadillas de agarosa limita severamente la capacidad de supervisar fluorescente más débil señales.
Aquí se describe un protocolo para imágenes de células vivas del ciclo de vida completo de Streptomyces con una excelente precisión y sensibilidad. Con el cultivo de Streptomyces en un dispositivo de microfluidos conectado a un microscopio de fluorescencia de campo amplio (Figura 2), que ahora son capaces de controlar la germinación, el crecimiento vegetativo y la tabicación esporulación durante un período de tiempo de hasta 30 horas. Esto se facilita en gran medida por el uso de las nuevas Streptomyces organismo modelo venezuelae porque esporula a punto de terminar en cultivo sumergido y por lo tanto supera la limitación de la especie modelo clásico S. coelicolor, que esporula sólo en medios sólidos 16-20. Para ayudar a visualizar el crecimiento vegetativo y la esporulación, que co-Express marcado con fluorescencia versiones del DivIVA marcador de la polaridad celular y la clave de la proteína de división celular FtsZ.
Estamos utilizando un dispositivo de microfluidos disponible en el mercado que ha sido empleado con éxito para micobacterias, Escherichia coli, Corynebacterium glutamicum, Bacillus subtilis y levaduras 21-25. El sistema atrapa las células en un único plano focal y permite el control de la perfusión continua de medio de cultivo de diferentes depósitos. En el protocolo detallado tomamos ventaja de esta característica para exponer S. venezuelae micelio vegetativo a un cambio hacia abajo nutricional para promover la esporulación.
El protocolo dedescribirán es para imágenes de células vivas de todo el ciclo de vida de Streptomyces, pero las condiciones de los medios de comunicación alternativos o ajustes del microscopio se puede elegir si determinadas etapas del desarrollo son de particular interés.
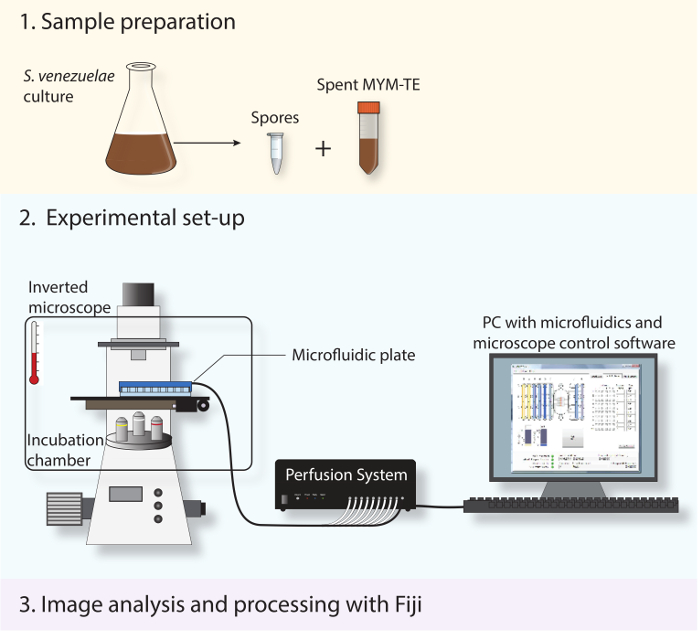
Figura 2: Esquema que representa el flujo de trabajo experimental. Se muestran los tres principales pasos descritos en el protocolo. En primer lugar, las esporas y el medio gastado se preparan a partir de un cultivo en fase estacionaria. En segundo lugar, las esporas frescas se cargan en un sistema de microfluidos y S. venezuelae es proyectado a lo largo de su ciclo de vida de desarrollo utilizando un microscopio invertido completamente automatizado con una cámara de incubación para mantener una temperatura óptima de crecimiento. En tercer lugar, la serie de lapso de tiempo obtenida es analizada y procesada utilizando el software de código abierto Fiji.
Protocolo
1. Aislamiento de Fresh S. venezuelae esporas y Preparación de medio de cultivo gastado
- Inocular 30 ml de maltosa-extracto de levadura-extracto de malta (MYM) medio, suplementado con 60 l R2 solución de elementos traza (TE), con 10 l de esporas de la cepa SV60 [attB φ BT1 :: pSS209 (P DivIVA - DivIVA-P mCherry FtsZ -ftsZ-ypet)]. Para el crecimiento consistente y la esporulación de las células, utilizar un matraz con deflectores o un matraz que contiene un resorte para permitir una aireación suficiente.
- células de cultivo durante 35-40 horas a 30 ° C y 250 rpm.
- Se examinan las células de líquido montado en un microscopio de contraste de fase. En este punto fragmentos de micelio y esporas serán visibles.
- Centrifugar 1 ml de células en una centrífuga de sobremesa a 400 xg durante 1 min para sedimentar el micelio y fragmentos de células más grandes.
- Transferir aproximadamente 300 l sobrenadante containing una suspensión de esporas a un nuevo tubo de 1,5 ml y mantener en hielo. Mantener el medio de cultivo restante para el paso 1.7.
- Diluir 1:20 en esporas MYM-TE (concentración final: 0,5-5 x 10 7 esporas / ml) y mantener en hielo hasta que sea necesario (véase el paso 2.3).
Nota: Aunque las condiciones exactas que provocan la esporulación en Streptomyces no se entienden, utilizando medio MYM-TE pasado, incluidas las señales extracelulares desconocidos de una cultura de esporulación, estimula la esporulación. - Filtro-esterilizar 10 ml del medio de cultivo restante para obtener pasado MYM-TE que está libre de esporas y fragmentos de micelio. Use un filtro de jeringa de 0,22 micras estéril y transferencia pasó MYM-TE a un tubo estéril de 15 ml.
- Mantenga el pasado preparada MYM-TE durante unos días a 4 ° C si los experimentos adicionales usando condiciones de crecimiento similares se llevarán a cabo.
2. Preparación del dispositivo de microfluidos
Nota: Cada pla microfluidoste permite hasta cuatro experimentos independientes para ser llevado a cabo. Para evitar la contaminación de las cámaras de flujo no utilizados, utilizar soluciones estériles y las condiciones de trabajo cuando la creación de un experimento.
- Retire la solución de embalaje de la placa de microfluidos y enjuagar los pocillos con estéril MYM-TE.
- Añadir 300 l MYM-TE para entrada de pozo 1 y 300 l pasado MYM-TE para pozos de 2 a 6.
- Carga de 40 l diluyeron esporas desde el paso 1.6 en el pozo de carga de 8 celdas de carril "A" y sellar el colector a la placa de acuerdo con las instrucciones del fabricante.
- Poner en marcha el software de control de microfluidos, seleccione el tipo de placa apropiada y establecer un programa de flujo para cebar el canal de flujo y la cámara de cultivo por medio que fluye de los pozos de entrada de 1 a 5 a 6 psi durante 2 minutos por pocillo.
- En el software de control de la microfluídica, crear un protocolo de flujo para el experimento: fluye MYM-TE de bien de entrada 1 durante 6 horas para permitir la germinación y el crecimiento vegetativo de las células. Cambiara continuación, para la perfusión del pasado MYM-TE de bien 2-5 durante el tiempo restante del experimento. Durante el curso del experimento mantener constante la presión de flujo a 6 psi (correspondiente a aproximadamente 9 l de medio / hr). Ejecutar el programa de flujo después del paso 3.5.
3. Configuración del microscopio y el Protocolo de lapso de tiempo
Nota: Este método se llevó a cabo en un microscopio de campo amplio invertida completamente motorizado y automatizado equipado con una cámara sCMOS, una lámpara de haluro de metal, un enfoque automático hardware, un soporte de escenario para placas de 96 pocillos y una cámara ambiental.
- Pre-calentar la cámara ambiental a 30 ° C con antelación con el fin de evitar problemas con el enfoque automático después de comenzar el experimento. El tiempo requerido depende de la cámara ambiental utilizado, el microscopio y el sistema de calefacción. Empezar a calentar el sistema de la noche antes del experimento.
- Encienda el microscopio y la automatización y el control de la microscopía software. Utilice una alta apertura numérica (NA) objetivo de inmersión en aceite para la recolección óptima de la señal y la resolución espacial, tales como 100X, 1,46 aceite de NA objetivo DIC. Seleccionar filtros adecuados y espejos dicroicos para adquirir imágenes de contraste de interferencia diferencial (DIC) y las imágenes de fusiones de proteína amarilla fluorescente y rojo fluorescente.
- Colocar una gota de aceite de inmersión sobre el objetivo y añadir fluido de inmersión para la parte inferior de la ventana de imagen en la placa de microfluidos para mejorar célula de enfoque durante la adquisición de imagen. Colocar con cuidado el dispositivo para microfluidos de sellado (paso 2.5) sobre la platina del microscopio invertido. Asegúrese de que la placa se coloca de forma segura en el soporte de fase y no se desplaza durante el transcurso del experimento.
- Coloque la ventana de imagen de la cámara de cultivo de microfluidos en el foco usando los marcadores de posición integrados para la orientación. Enfoque sobre la parte más a la izquierda de la cámara de flujo primero (con la etiqueta "A") con el tamaño de la trampa 5, correspondiente auna altura de 0,7 m trampa.
- En el software de la microfluídica, células de carga desde bien entrada 8 a 4 psi durante 15 s. Comprobar la densidad celular en la cámara de cultivo moviendo la etapa a través de la ventana de imagen. Si estaban atrapados no hay esporas, repetir la etapa de carga de células o, alternativamente, aumentar la presión y / o el tiempo de carga hasta que se alcanza la densidad celular deseada (1-10 esporas por ventana de imagen con 2.048 x 2.048 pixels). Evitar la sobrecarga de la cámara de cultivo.
Nota: Normalmente utilizamos el tamaño de trampa 5 para obtener imágenes de Streptomyces, pero también hemos obtenido buenos resultados con el desvío de los tamaños 4 y 3. Consulte el manual del proveedor para obtener sugerencias adicionales en la optimización del proceso de carga de las células. - Iniciar el programa de flujo en el software de control del paso 2.5 y dejar que la placa de microfluidos para calentar-equilibre durante 1 hora en la platina del microscopio antes de iniciar la adquisición de imágenes.
- En el software de control del microscopio, configure una adquisición multidimensional para tomar multiple imágenes en múltiples posiciones de platina con el tiempo:
- Para guardado automático: especificar el directorio para el guardado automático de los archivos de imagen.
- Para los ajustes de iluminación, determinar ajustes de iluminación óptimas para cada construcción específica de antemano. Para el experimento descrito, utilice los siguientes tiempos de exposición: DIC 150 ms, 250 ms YFP, RFP 100 ms.
- Para series de tiempo: establecer una serie de tiempo para adquirir imágenes en los puntos de tiempo deseados en la secuencia. Para obtener imágenes del ciclo de vida de S. venezuelae, seleccione un intervalo de tiempo de 40 minutos durante un período de 24 horas.
- Para las posiciones de la etapa y de enfoque automático: escanear la cámara de cultivo moviendo las posiciones y estadio almacén para cada posición de imagen de interés. Asegúrese de que las posiciones de una sola etapa se encuentran lo suficientemente separados para minimizar photobleaching y phototoxicity.Typically utilizan hasta 12 posiciones. rutina de enfoque automático de gestión para cada punto de tiempo para corregir la deriva lenta focal. Si está disponible en el software de control del microscopio, Fijar la estrategia de enfoque automático para "actualizar superficial local por el enfoque automático de hardware". Una vez que se verifican las coordenadas Z de las posiciones de platina seleccionados, activar el enfoque automático de hardware.
- Iniciar el experimento de lapso de tiempo en el software de control de microscopio.
- Compruebe que todas las posiciones de platina están todavía en el foco en los puntos posteriores. Para los experimentos de lapso de tiempo que se ejecutan durante varias horas, de vez en cuando observamos una deriva fase incluso cuando se utiliza el enfoque automático. Si posiciones de platina Es necesario replantear, detener el experimento en un punto de tiempo apropiado, ajustar el enfoque y vuelva a iniciar el experimento dentro del intervalo de tiempo definido de imágenes (paso 3.7.3). Ver el paso 4.3 para saber cómo concatenar las series de tiempo.
- Deja de adquisición de la imagen después de 24-30 horas o cuando las hifas en la región de interés se han diferenciado en esporas (véase la serie de imágenes DIC). Detener el programa de flujo en el software y desmontar el dispositivo de microfluidos.
- Preparar la placa de microfluidos usados para sto corto plazorabia. Eliminar restante MYM-TE y pasó MYM-TE del pozo 1 a 6, así residuos vacío 7 y así la carga de células 8. En condiciones estériles, vuelva a llenar los pozos de carril "A" y los pozos de carriles no utilizados ( "B" utiliza para "D") en el plato con estéril salina tamponada con fosfato (PBS). Sellar la placa con parafilm para evitar que se reseque y se almacena a 4 ° C.
4. Generación de Time-lapse películas usando software Fiji
Nota: Observamos que los diferentes paquetes de software comercial y libre están disponibles para procesar imágenes de microscopía de lapso de tiempo que incluye ZenBlue, Metamorph, helado, ImagePro o ImageJ. Aquí nos centramos en Fiji, que es un programa de procesamiento de imágenes de código abierto basado en ImageJ, y que ya ofrece una serie de plugins preinstalados útiles.
- los datos de impresión por transferencia desde el experimento de lapso de tiempo a un equipo que ha instalado Fiji.
- Poner en marcha el programa e importar el archivo de imagen utilizando &# 34; Archivo> Importar> Bio-Formatos ". O simplemente arrastrando el archivo de imagen en Fiji en el" Bio-Formatos Opciones de importación ", marque la casilla" Los canales divididos "para obtener una pila separada para cada canal de iluminación (DIC , RFP, YFP).
- Opcional: Para combinar series de tiempo separados como resultado de una ruptura en la en la adquisición de la imagen debido a la reorientación (paso 3.9), abra respectivas pilas de imágenes y ejecutar "Imagen> Pilas> Herramientas> Concatene" para cada canal (CID, RFP, YFP ).
- Evaluar la calidad de los datos de lapso de tiempo desplazándose a través de las pilas de imágenes. Busque hifas que se mantuvo en el enfoque con el tiempo, el crecimiento del micelio espectáculo y, finalmente, formar esporas (DIC) de la pila. Examinar la localización subcelular esperado para DivIVA-mCherry en las puntas de las hifas (pila RFP) y FtsZ-YPet formando anillos individuales o múltiples estructuras, escalera-como en las hifas vegetativas o esporogénico (pila YFP), respectivamente.
- Aislar una región de interés para processi aguas abajong de las imágenes. La microscopía de lapso de tiempo a menudo produce archivos de gran tamaño que puede ralentizar el procesamiento por Fiji. Por ello se recomienda para identificar y aislar una región de interés (ROI) y para llevar a cabo otros pasos de procesamiento de imágenes en esta versión más pequeña de la pila de imagen.
- Seleccione la herramienta "Selección rectangular" en el menú y dibujar un ROI rectangular en la imagen pila DIC de tal manera que las hifas en desarrollo están encerrados por la ROI a lo largo de la serie de imágenes.
- Duplicar ROI-pila con la tecla "Ctrl", "Shift" + + "D".
- Haga clic en la barra de nombre de la imagen pila YFP y seleccione "Editar> Cambios> Restaurar selección" en el menú para restaurar la selección rectangular anterior de la DIC original de la pila a la misma positon en la pila de YFP y duplicar el rendimiento de la inversión con la tecla "Ctrl" + "Shift" + "D".
- Repita este proceso para la pila RFP.
- Alinear las imágenes en la imagen en tres pilas de to eliminar las derivas de la etapa en el plano xy con el tiempo. Desplazarse hasta el último fotograma de la pila DIC y seleccione "Plugin> Registro> StackReg> RigedBody" en el menú. Repita este paso para el PP y la pila de YFP. Si es necesario, recortar la ROI repitiendo el paso 4.5.1-4.5.3.
- Opcional: Ajusta el brillo y el contraste manualmente para cada pila de imágenes con el ( "Shift" "Ctrl" + + "C") "ajusta la herramienta de brillo y contraste" o seleccione "Proceso> Mejorar contraste" en el menú y aplicar la "Normalizar" comando para todas las imágenes de la pila. Cabe señalar que este último comando alterará los valores de píxel y por lo tanto puede afectar el análisis de imágenes de aguas abajo.
- Opcional: Combinar pilas individuales (convertidos al formato de archivo RGB, véase 4.11) horizontal o verticalmente usando el plugin "Imagen> Pilas> Herramientas> Combinar".
- Añadir una barra de escala ( "Análisis> Herramientas> Barra de escala") y una estampadora de tiempo (y# 34; Imagen> Pilas> Time Stamper ").
- Guarde las pilas de imágenes modificadas como una secuencia de imágenes en el formato "tiff". Para producir una película, guardar como ".avi". Por otra parte, una serie de imágenes de exportación en el formato QuickTime utilizando el "Bio-Bio-> Formatos Formatos exportador" plugin y seleccione la opción ".mov" tipo de archivo.
- Para obtener las imágenes de cuadros individuales, seleccione el marco de interés y duplicar la imagen "Ctrl", "Shift" + + "D". Cambiar el tipo de la imagen resultante en "RGB" o "8 bits" en "Imagen> Tipo> de color RGB o de 8 bits" y guardar la imagen como ".tiff".
Nota: Fiji ofrece una serie de funciones adicionales para anotar más o series proceso de lapso de tiempo. Ir a la ayuda en línea para obtener información detallada Fiji (http://fiji.sc/Fiji).
Resultados
El éxito de imágenes de células vivas de todo el S. ciclo de vida venezuelae produce una serie de tiempo continuo que incluye las etapas clave del desarrollo de la germinación, el crecimiento vegetativo y la esporulación (Figura 3, Película 1). La visualización de la progresión a través del ciclo de vida es aún mayor por la localización subcelular distinta de DivIVA-mCherry y FtsZ-YPet. Durante la germinación y el crecimiento vegetativo, DivIVA-mCherry acumula exclusivamente en las puntas o marcas de nueva formación puntos de ramificación (Figura 4A) de hifas en crecimiento. Estos resultados están en línea con el posicionamiento ya se ha informado subcelular de DivIVA 12,26. Por el contrario, FtsZ-YPet forma estructuras individuales en forma de anillo a intervalos irregulares en el crecimiento del micelio (Figura 4B). Estas estructuras proporcionan el armazón para la síntesis de la no constrictiva vegetativas paredes transversales, lo que lleva a la formación de interconncompartimientos de hifas ejadas 8. La diferenciación celular de crecimiento hifas en hifas esporogénica se hace visible por la desaparición de polar focos DivIVA-mCherry, la detención del crecimiento polar y el aumento concomitante de la fluorescencia FtsZ-YPet (Figura 4C). En esporulación hifas, el patrón de localización de FtsZ-YPet cambia radicalmente; primeros filamentos helicoidales FtsZ-YPet caen a lo largo de la hifa y luego, en un evento repentino, casi síncrona, estas hélices se unen en una escalera de anillos FtsZ-YPet regularmente espaciados. Bajo las condiciones experimentales descritas aquí, estas escaleras FtsZ-YPet uniformemente distribuidos persisten durante aproximadamente 2 h. Por último, los septos esporulación convertirse discernible en las imágenes de contraste de interferencia diferencial (DIC) (Figura 4D) y, finalmente, nuevas esporas son liberadas.
El protocolo posterior que describe el procesamiento de imágenes utilizando el software de Fiji dispone lo TEP a paso la explicación de cómo producir una película para la publicación de la serie de lapso de tiempo adquirida (película 1).
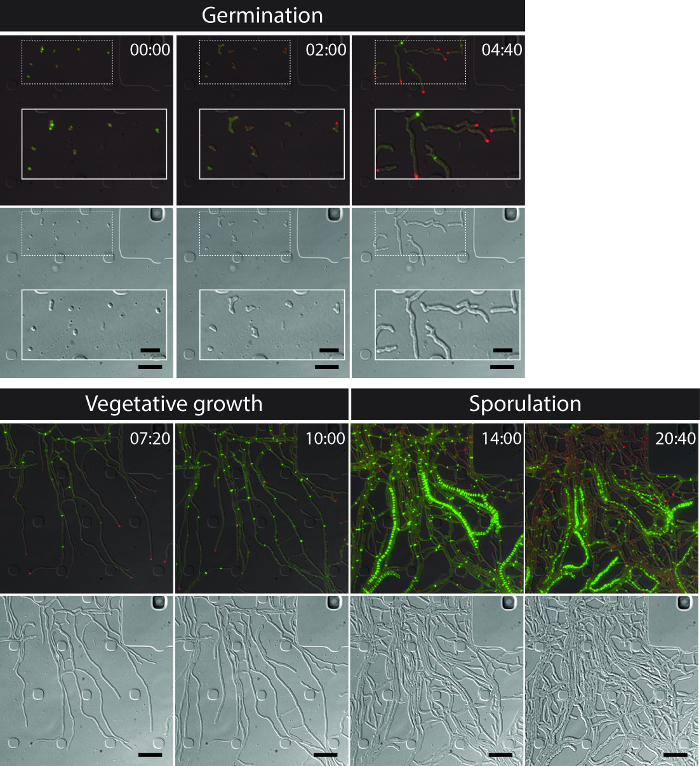
Figura 3: Capturas de imagen de microscopía de fluorescencia serie representativa de lapso de tiempo de S. venezuelae producir la etiqueta fluorescente FtsZ (verde) y DivIVA (rojo) Se muestran las imágenes seleccionadas de las imágenes fusionadas (panel superior: RFP-YFP-DIC, panel inferior: DIC). visualizar el ciclo de vida de Streptomyces incluyendo la germinación, el crecimiento vegetativo y la esporulación. Las imágenes fueron tomadas de la película 1. El tiempo está en h: min. Las barras de escala = 5 micras. Haga clic aquí para ver una versión más grande de esta figura.
d / 53863 / 53863fig4.jpg "/>
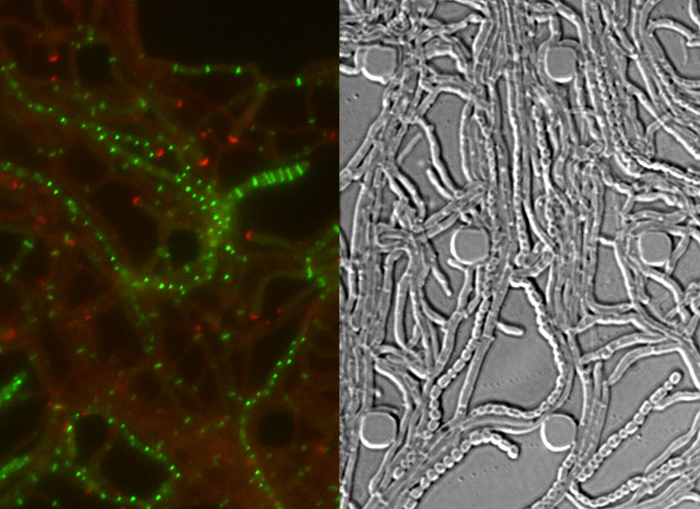
Figura 4: Los resultados representativos para el éxito de la serie de lapso de tiempo del ciclo de vida de Streptomyces (A) La localización de DivIVA-mCherry.. Se muestran las instantáneas de dos puntos de tiempo posteriores de la película 1 con imágenes fusionadas de la RFP y canales DIC. DivIVA-mCherry marca nuevos sitios de ramificación de las hifas (lleno cabeza de flecha) y se localiza en la punta de las hifas para dirigir el crecimiento polar (cabeza de flecha abierta). Barra de escala = 10 micras (B) FtsZ-YPet localización durante el crecimiento vegetativo (cabeza de flecha). FtsZ-YPet forma estructuras similares a anillos individuales (panel superior) que no constriñen (DIC, panel inferior). (C) FtsZ-YPet (verde) de localización durante la tabicación esporulación. focos DivIVA-mCherry se muestran en rojo, con el tiempo transcurrido se muestra a continuación (hr: min). Barra de escala: 5 micras. (D) correspondiente DIC imágenes de las hifas de esporulación (C) muestra la formaación de compartimentos prespore con septos esporulación visible (imagen izquierda), que finalmente maduran en una cadena de esporas (imagen de la derecha). El tiempo está en h: min. Barra de escala = 5 micras. Haga clic aquí para ver una versión más grande de esta figura.
Película 1: Time-lapse serie microscopía de fluorescencia de los Streptomyces venezuelae ciclo de vida La película consiste en imágenes de RFP-YFP fusionadas (izquierda) y las imágenes correspondientes contraste de interferencia diferencial (DIC) (derecha).. DivIVA-mCherry se muestra en rojo y FtsZ-YPet en verde. El intervalo de tiempo entre cuadros individuales es de 40 min. Barra de escala = 10 micras. Haga clic aquí para ver This película.
Discusión
La microscopía de lapso de tiempo del ciclo de vida de Streptomyces ha sido técnicamente difícil en el pasado. Aquí se presenta un protocolo robusto para realizar las imágenes en vivo de células del ciclo de vida completo usando fusiones de proteínas fluorescentes a la DivIVA marcador de la polaridad celular y la proteína de división celular FtsZ para ayudar a visualizar y rastrear la progresión a través del programa de desarrollo (Figura 2).
Central de este método es el cultivo de S. venezuelae en un dispositivo de microfluidos que permite constante perfusión del medio y el intercambio de medio de crecimiento normal (MYM-TE) con medio gastado (pasado MYM-TE). El cambio de condiciones de cultivo es importante para el protocolo descrito debido a que el cambio hacia abajo nutricional como también, cualquier señales extracelulares aún no identificados (señales por ejemplo de percepción de quórum) en el medio de cultivo gastado, promover la esporulación, mientras que un suministro continuo de medio rico en nutrientes estimula growt vegetativoh sin apenas formación de esporas (datos no mostrados). Por lo tanto, el cultivo de células en este sistema de microfluidos es superior a el cultivo de células en agarosa, ya que ofrece flexibilidad experimental más y permite la monitorización a largo plazo de cambios en el crecimiento de bacterias en respuesta a las cambiantes condiciones de cultivo. Aunque las placas de microfluidos están diseñados para un solo uso, el flujo a los canales que no han sido inoculados con células pueden ser utilizadas en experimentos posteriores. Recomendamos el uso de todos los canales de microfluidos una placa dentro de una semana, ya que hemos experimentado problemas de estanqueidad del colector de placas que han sido abiertas por más tiempo.
Al configurar un experimento, se encontró que las esporas recién preparada germinaron dentro de dos horas de ser cargado en la cámara de flujo, mientras que las esporas derivados de un stock de glicerol congelado requieren al menos 6 horas antes de que surgieran tubos germinales (datos no mostrados). Este retraso en la germinación se extiende la duración del experimento y puede interferir condisponibilidad de los equipos y de las condiciones experimentales. También es importante comenzar el experimento con la perfusión de MYM-TE durante al menos 3 horas para proporcionar los nutrientes suficientes para el desarrollo y el crecimiento de los tubos germinales. La perfusión con MYM-TE puede extenderse más allá de la inicial de 3 horas si el experimento se diseñó para estudiar el crecimiento vegetativo. Mientras esporas proporcionan la opción preferida de material de partida, los fragmentos de hifas corto también pueden ser cargados en la placa de microfluidos. Sin embargo, la eficacia de carga cuando se utiliza el micelio esquilada es significativamente menor y con frecuencia requiere varias operaciones de carga que pueden representar una limitación al examinar los mutantes no esporuladas. Independientemente del tipo de inóculo utilizado, es importante no sobrecargar la cámara de cultivo con esporas o fragmentos de hifas, ya que esto llevaría a la sobrepoblación rápida que puede interferir con la difusión de los medios de comunicación y complicar el análisis de imágenes.
Es importante planificar la construcción de proteínas reportero carefuLLY para su uso en la fluorescencia de imagen de lapso de tiempo en Streptomyces. longitud del engarce entre la proteína diana y el reportero fluorescente y la elección de N- o fusiones C-terminal puede ser crítica. Por otra parte, las condiciones experimentales óptimas, incluida la frecuencia de imagen y el tiempo de exposición, tienen que ser fijados de antemano para cada proteína fluorescente con etiquetas. S. venezuelae hifas exposición auto-fluorescencia en el canal verde / amarillo que puede llegar a ser problemático cuando la imagen de una proteína marcada con fluorescencia que se expresa en niveles bajos. Además, hay que señalar que, durante la germinación y la fase de crecimiento vegetativo inicial, S. venezuelae es particularmente sensible a la luz de onda corta (por ejemplo, cuando se utiliza fusiones de proteínas para PPC).
A pesar de los continuos avances en las técnicas de imagen y sistemas indicadores fluorescentes para imágenes de células vivas de las bacterias, la mayoría de los paquetes de software (por ejemplo, MicrobeTracker, Schnitzelcells, CellProfiler) para el tratamiento automatizado posterior de estos tipos de conjuntos de datos no son compatibles con el análisis de las imágenes derivadas de bacterias filamentosas con un estilo de vida multicelular 27-29. Por lo tanto, hay una necesidad de desarrollar un algoritmo adecuado para el análisis de alto rendimiento cuantitativo de los datos de imagen a partir de Streptomyces y otras bacterias filamentosas.
En resumen, el trabajo que se describe aquí demuestra el inmenso potencial de S. venezuelae como un nuevo sistema de desarrollo modelo para el género, debido a su capacidad de esporular en líquido. El dispositivo de cultivo de microfluidos es fácil de usar incluso para usuarios sin experiencia. Proporciona una plataforma excelente para estudiar los procesos biológicos celulares centrales para el ciclo de vida de Streptomyces, incluyendo la localización dinámica de proteínas, el crecimiento polarizado, y la diferenciación morfológica de un micelio pluricelular en las cadenas de esporas unigenomic. Además, este juego experimental up también proporciona un punto de partida atractivo para investigar los acontecimientos en el desarrollo que requieren condiciones de cultivo se alternan, o el uso de colorantes fluorescentes tales como ácidos -amino D fluorescentes para controlar la síntesis del peptidoglicano o yoduro de propidio y 4 ', 6-diamidino-2-fenilindol (DAPI) para visualizar organización de los cromosomas 30,31.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
The authors thank Grant Calder for technical assistance with the microscope, Matt Bush for comments on the protocol, and the John Innes Centre for purchase of the Zeiss widefield microscope. This work was funded by BBSRC grant BB/I002197/1 (to M.J.B), by BBSRC Institute Strategic Programme Grant BB/J004561/1 to the John Innes Centre, by Swedish Research Council grant 621-2010-4463 (to K.F.), and by a Leopoldina Postdoctoral Fellowship (to S.S.).
Materiales
| Name | Company | Catalog Number | Comments |
| B04A CellAsic ONIX plate for bacteria cells | Merck-Millipore | B04A-03-5PK | Microfluidic culture plates |
| CellAsic ONIX Microfluidic Perfusion System and ONIX FG (version 5.0.2) | Merck-Millipore | EV-262 | The latest ONIX vesion (July 2015) and instructions on how to use the programme can be found here: http://www.merckmillipore.com |
| Axio Observer.Z1 Microscope | Zeiss | 431007-9902-000 | Fully automated and motorized inverted widefield microscope |
| Incubator XL multi S1 with Temperature Module S1 and Heating unit XL S2 | Zeiss | 411857-9061-000 | Environmental chamber surrounding the microscope |
| Plan-Apochromat 100x/1.46 Oil DIC objective | Zeiss | 420792-9800-000 | |
| Ocra FLASH 4 V2 | Hamamatsu Photonics K.K. | C11440-22CU | |
| Illuminator HXP 120V | Zeiss | 423013-9010-000 | |
| FL Filter Set 46 HE YFP shift free | Zeiss | 489046-9901-000 | Fluorescent filter set, excitation 500/25 nm, emission 535/30 nm |
| FL Filter Set 63 HE RFP shift free | Zeiss | 489063-0000-000 | Fluorescent filter set, excitation 572/25 nm, emission 629/30 nm |
| Mounting frame K-M for multiwell plates | Zeiss | 000000-1272-644 | Stage holder for microfluidic plate |
| ZEN pro 2012 | Zeiss | 410135-1002-120 | Microscope control software |
| ZEN Module Time Lapse | Zeiss | 410136-1031-110 | Software module to set up time-lapse microscopy experiments |
| ZEN Module Tiles/Positions | Zeiss | 410136-1025-110 | Software module to save specific stage positions (xzy) |
| Fiji | open-source software package | http://fiji.sc/Fiji | Generation of time-lapse movies |
| Maltose-Yeast Exctract-Malt Extract (MYM) 4 g Maltose 4 g Yeast extract 10 g Malt extract add 1 L H2O using 50 % tap water and 50 % reverse osmosis water and supplement with 200 ml of R2 trace element solution per 100 ml after autoclaving | Sporulation medium used to culture S. venezuelae SV60 | ||
| R2 Trace element solution (TE) 8 mg ZnCl2 40 mg FeCl3-6H2O 2 mg CuCl2-2H2O 2 mg MnCl2-4H2O 2 mg Na2B4O7-10H2O 2 mg (NH4)6Mo7O24-4H2O add 200 ml H2O Autoclave and store at 4 oC | Add 0.002 volumes to MYM | ||
| PBS (phosphate buffered saline) | Sigma | P4417-100TAB | Used to refill inlet wells of unused lanes in B04A plates in order to prepare plate for short-term storage. |
| 0.22 µm syringe filters | Satorius stedim | 16532-K | Preparation of spent MYM-TE |
| SV60 | John Innes Centre strain collection | S. venezuelae strain expressing divIVA-mcherry and ftsZ-ypet |
Referencias
- Bush, M. J., Tschowri, N., Schlimpert, S., Flärdh, K., Buttner, M. J. c-di-GMP signalling and the regulation of developmental transitions in streptomycetes. Nat. Rev. Microbiol. 13, 749-760 (2015).
- Jakimowicz, D., van Wezel, G. P. Cell division and DNA segregation in Streptomyces.: how to build a septum in the middle of nowhere?. Mol. Microbiol. 85, 393-404 (2012).
- McCormick, J. R., Flärdh, K. Signals and regulators that govern Streptomyces development. FEMS Microbiol. Rev. 36, 206-231 (2012).
- Flärdh, K., Richards, D. M., Hempel, A. M., Howard, M., Buttner, M. J. Regulation of apical growth and hyphal branching in Streptomyces. Curr. Opin. Microbiol. 15, 737-743 (2012).
- Hempel, A. M., et al. The Ser/Thr protein kinase AfsK regulates polar growth and hyphal branching in the filamentous bacteria Streptomyces. Proc. Natl. Acad. Sci. U S A. 109, E2371-E2379 (2012).
- Fuchino, K., et al. Dynamic gradients of an intermediate filament-like cytoskeleton are recruited by a polarity landmark during apical growth. Proc. Natl. Acad. Sci. U S A. 110, E1889-E1897 (2013).
- Holmes, N. A., et al. Coiled-coil protein Scy is a key component of a multiprotein assembly controlling polarized growth in Streptomyces. Proc. Natl. Acad. Sci. U S A. 110, E397-E406 (2013).
- McCormick, J. R., Su, E. P., Driks, A., Losick, R. Growth and viability of Streptomyces coelicolor. mutant for the cell division gene ftsZ. Mol. Microbiol. 14, 243-254 (1994).
- Margolin, W. FtsZ and the division of prokaryotic cells and organelles. Nat. Rev. Mol. Cell Biol. 6, 862-871 (2005).
- Grantcharova, N., Lustig, U., Flärdh, K. Dynamics of FtsZ assembly during sporulation in Streptomyces coelicolor A3(2). J. Bacteriol. 187, 3227-3237 (2005).
- Richards, D. M., Hempel, A. M., Flärdh, K., Buttner, M. J., Howard, M. Mechanistic basis of branch-site selection in filamentous bacteria. PLoS Comput. Biol. 8, e1002423 (2012).
- Hempel, A. M., Wang, S. B., Letek, M., Gil, J. A., Flärdh, K. Assemblies of DivIVA mark sites for hyphal branching and can establish new zones of cell wall growth in Streptomyces coelicolor. J. Bacteriol. 190, 7579-7583 (2008).
- Wolanski, M., et al. Replisome trafficking in growing vegetative hyphae of Streptomyces coelicolor A3(2). J. Bacteriol. 193, 1273-1275 (2011).
- Jyothikumar, V., Tilley, E. J., Wali, R., Herron, P. R. Time-lapse microscopy of Streptomyces coelicolor.growth and sporulation. Appl. Environ. Microbiol. 74, 6774-6781 (2008).
- Willemse, J., Borst, J. W., de Waal, E., Bisseling, T., van Wezel, G. P. Positive control of cell division: FtsZ is recruited by SsgB during sporulation of Streptomyces. Genes. Dev. 25, 89-99 (2011).
- Glazebrook, M. A., Doull, J. L., Stuttard, C., Vining, L. C. Sporulation of Streptomyces venezuelae. in submerged cultures. J. Gen. Microbiol. 136, 581-588 (1990).
- Bibb, M. J., Domonkos, A., Chandra, G., Buttner, M. J. Expression of the chaplin and rodlin hydrophobic sheath proteins in Streptomyces venezuelae.is controlled by sigma(BldN) and a cognate anti-sigma factor, RsbN. Mol. Microbiol. 84, 1033-1049 (2012).
- Al-Bassam, M. M., Bibb, M. J., Bush, M. J., Chandra, G., Buttner, M. J. Response regulator heterodimer formation controls a key stage in Streptomyces development. PLoS Genet. 10, e1004554 (2014).
- Bush, M. J., Bibb, M. J., Chandra, G., Findlay, K. C., Buttner, M. J. Genes required for aerial growth, cell division, and chromosome segregation are targets of WhiA before sporulation in Streptomyces venezuelae. MBio. 4, e00684-e00613 (2013).
- Tschowri, N., et al. Tetrameric c-di-GMP mediates effective transcription factor dimerization to control Streptomyces development. Cell. 158, 1136-1147 (2014).
- Mirouze, N., Ferret, C., Yao, Z., Chastanet, A., Carballido-Lòpez, R. MreB-Dependent Inhibition of Cell Elongation during the Escape from Competence in Bacillus subtilis. PLoS Genet. 11, e1005299 (2015).
- Zopf, C. J., Maheshri, N. Acquiring fluorescence time-lapse movies of budding yeast and analyzing single-cell dynamics using GRAFTS. J. Vis. Exp. (e50456), (2013).
- Meniche, X., et al. Subpolar addition of new cell wall is directed by DivIVA in mycobacteria. Proc. Natl. Acad. Sci. U S A. 111, E3243-E3251 (2014).
- Donovan, C., Schauss, A., Kramer, R., Bramkamp, M. Chromosome segregation impacts on cell growth and division site selection in Corynebacterium glutamicum. PLoS One. 8, e55078 (2013).
- Rojas, E., Theriot, J. A., Huang, K. C. Response of Escherichia coli. growth rate to osmotic shock. Proc. Natl. Acad. Sci. U S A. 111, 7807-7812 (2014).
- Flärdh, K. Essential role of DivIVA in polar growth and morphogenesis in Streptomyces coelicolor A3(2). Mol. Microbiol. 49, 1523-1536 (2003).
- Sliusarenko, O., Heinritz, J., Emonet, T., Jacobs-Wagner, C. High-throughput subpixel precision analysis of bacterial morphogenesis and intracellular spatio-temporal dynamics. Mol. Microbiol. 80, 612-627 (2011).
- Young, J. W., et al. Measuring single-cell gene expression dynamics in bacteria using fluorescence time-lapse microscopy. Nat. Protoc. 7, 80-88 (2012).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7, R100 (2006).
- Kuru, E., Tekkam, S., Hall, E., Brun, Y. V., Van Nieuwenhze, M. S. Synthesis of fluorescent D-amino acids and their use for probing peptidoglycan synthesis and bacterial growth in situ. Nat. Protoc. 10, 33-52 (2015).
- Szafran, M., et al. Topoisomerase I (TopA) is recruited to ParB complexes and is required for proper chromosome organization during Streptomyces coelicolor. sporulation. J. Bacteriol. 195, 4445-4455 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados