Method Article
Fluorescence Imaging Time-lapse de la complète
Dans cet article
Résumé
Streptomyces are characterized by a complex life cycle that has been experimentally challenging to study by cell biological means. Here we present a protocol to perform fluorescence time-lapse microscopy of the complete life cycle by growing Streptomyces venezuelae in a microfluidic device.
Résumé
Live-cell imaging of biological processes at the single cell level has been instrumental to our current understanding of the subcellular organization of bacterial cells. However, the application of time-lapse microscopy to study the cell biological processes underpinning development in the sporulating filamentous bacteria Streptomyces has been hampered by technical difficulties.
Here we present a protocol to overcome these limitations by growing the new model species, Streptomyces venezuelae, in a commercially available microfluidic device which is connected to an inverted fluorescence widefield microscope. Unlike the classical model species, Streptomyces coelicolor, S. venezuelae sporulates in liquid, allowing the application of microfluidic growth chambers to cultivate and microscopically monitor the cellular development and differentiation of S. venezuelae over long time periods. In addition to monitoring morphological changes, the spatio-temporal distribution of fluorescently labeled target proteins can also be visualized by time-lapse microscopy. Moreover, the microfluidic platform offers the experimental flexibility to exchange the culture medium, which is used in the detailed protocol to stimulate sporulation of S. venezuelae in the microfluidic chamber. Images of the entire S. venezuelae life cycle are acquired at specific intervals and processed in the open-source software Fiji to produce movies of the recorded time-series.
Introduction
Streptomycètes sont des bactéries vivant dans le sol qui sont caractérisés par un cycle de développement complexe impliquant la différenciation morphologique à partir d' un multicellulaire, nutriment piégeant mycélium en dormance, les spores unigenomic 1-3.
Dans des conditions de croissance favorables, une spores de Streptomyces typique commence à germer par extrusion d' un ou deux tubes de germes (figure 1). Ces tubes allongés par extension de la pointe et de grandir dans un réseau hyphes ramifié connu sous le mycélium végétatif. la croissance polaire et hyphes ramification est dirigé par le divIVA de protéine essentielle. Cette protéine superhélice fait partie d'un grand complexe cytoplasmique appelé polarisome, ce qui est crucial pour l'insertion d' un nouveau matériau de l' enveloppe cellulaire à la pointe étendant 4-7. Au cours de la croissance végétative, les filaments deviennent des hyphes cloisonnées par la formation fréquente de ce qu'on appelle des parois transversales 8. La formation de ces parois transversales re exige FtsZ, la protéine du cytosquelette tubuline-like qui est essentiel pour la division cellulaire dans la plupart des bactéries 9. Dans Streptomyces, cependant, ces parois transversales végétatives ne conduisent pas à une constriction des cellules et la cellule de séparation et donc la masse mycélienne reste en tant que réseau de compartiments reliés entre eux syncytial. En réponse à la limitation des nutriments et d' autres signaux qui ne sont pas bien compris, hyphes aériens spécialisés rompre avec le mycélium végétatif et de grandir dans l'air 3. La construction de ces structures initie la phase de reproduction, du développement, au cours desquels la longue hyphes aériennes multi génomique se divise en plusieurs dizaines de taille égale compartiments présporale unigenomic. Cet événement massif de la division cellulaire est entraîné par l'étranglement synchrone de plusieurs anneaux de FtsZ à l' intérieur même des hyphes 2,10 sporogène. la différenciation morphologique est complétée par la libération de dormance, spores pigmentées à paroi épaisse.
t "fo: keep-together.within-page =" 1 ">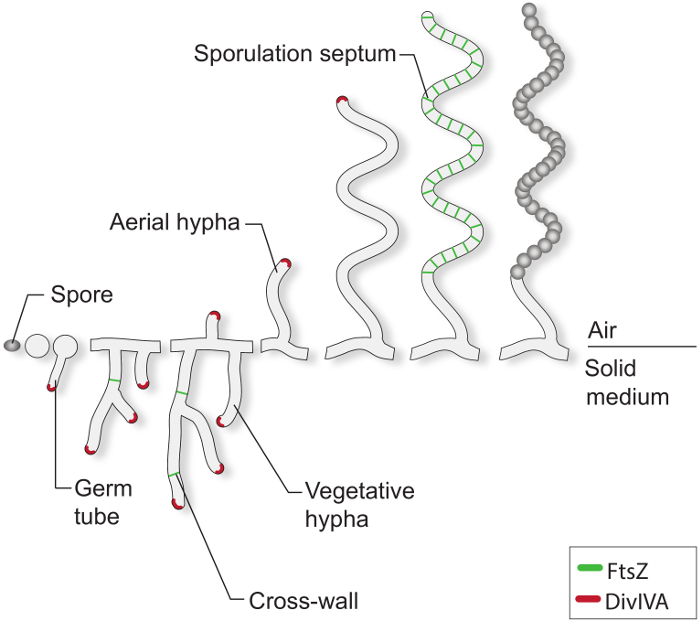
Figure 1:. Le cycle de vie Streptomyces sur des supports solides Ceci est un modèle du cycle de vie basée sur les études classiques de S. coelicolor de plus en plus sur des plaques d' agar - agar. Le développement cellulaire d'une spore commence par la formation d'un ou deux tubes de germes qui se développent par extension de pointe pour former un réseau de ramification des hyphes. croissance polaire et la ramification des hyphes végétatifs est dirigé par divIVA (rouge). La formation de parois transversales végétatives nécessite FtsZ (vert). En réponse à des limitations de nutriments et d'autres signaux, hyphes aériens sont érigés. Arrestation de croissance aérienne est étroitement coordonné avec l'ensemble d'une échelle de FtsZ anneaux, qui donnent lieu à la septa de sporulation que compartimenter les hyphes sporogène dans des compartiments de présporale box-like. Ces compartiments assemblent un mur de spores d'épaisseur et sont Relea éventuellementsed spores pigmentées comme matures.
Les événements clés du développement du cycle de vie Streptomyces sont bien caractérisés 1,3. Cependant, ce qui est encore rare sont des études de cellules biologiques qui emploient fluorescence time-lapse microscopie pour donner un aperçu des processus qui sous-tendent la différenciation subcellulaire, comme la dynamique des protéines de localisation, mouvement des chromosomes et division cellulaire de développement contrôlé. Imagerie des cellules vivantes du développement Streptomyces a été difficile en raison de la complexité du cycle de vie et les caractéristiques physiologiques de l'organisme. Des études antérieures sur la croissance végétative et les premières étapes de la sporulation septation ont utilisé des chambres d'imagerie perméables à l' oxygène, ou la croissance d'agarose soutenu par des Streptomyces coelicolor sur une platine de microscope 15/11. Ces méthodes sont toutefois limitées par un certain nombre de facteurs. Certains systèmes permettent seulement l'imagerie à court terme d'une croissance cellulaired protéines fluorescentes avant que les cellules souffrent d'une alimentation insuffisante en oxygène ou se développent hors du plan focal en raison de la configuration tridimensionnelle du développement des hyphes. Dans les cas où l'imagerie à long terme est possible de cultiver des cellules sur des tampons d'agarose limites de flexibilité expérimentale, car les cellules ne peuvent pas être exposés à des conditions de croissance ou de contraintes de remplacement, et la fluorescence d'arrière-plan à partir du milieu dans les tampons d'agarose limite considérablement la possibilité de surveiller fluorescent faible signaux.
Nous décrivons ici un protocole d'imagerie des cellules vivantes du cycle de vie Streptomyces complets avec une excellente précision et de sensibilité. En faisant croître Streptomyces dans un dispositif microfluidique relié à un microscope à fluorescence widefield (Figure 2), nous sommes maintenant en mesure de contrôler la germination, la croissance végétative et sporulation septation sur une période de temps allant jusqu'à 30 heures. Ceci est grandement facilité par l'utilisation du nouveau modèle de l' organisme Streptomyces venezuelae parce qu'il sporule à proximité de la fin de la culture submergée et surmonte la limitation du modèle classique des espèces S. ainsi coelicolor, qui sporule uniquement sur des supports solides 16-20. Pour aider à visualiser la croissance végétative et sporulation, nous co-exprimer par fluorescence étiqueté versions de la polarité cellulaire marqueur divIVA et la clé protéine de division cellulaire FtsZ.
Nous utilisons un dispositif microfluidique disponible dans le commerce qui a été utilisé avec succès pour les mycobactéries, Escherichia coli, Corynebacterium glutamicum, Bacillus subtilis et la levure 21-25. Le système piège les cellules dans un plan focal unique et permet le contrôle de la perfusion continue de milieu de culture à partir de différents réservoirs. Dans le protocole détaillé nous profitons de cette fonctionnalité pour exposer S. venezuelae mycélium végétatif à un rétrogradage nutritionnel de promouvoir la sporulation.
Le protocole deDÉCRITS est pour l' imagerie des cellules vivantes du cycle de vie Streptomyces ensemble, mais les conditions de médias alternatifs ou les paramètres du microscope peut être choisie si les stades de développement spécifiques sont particulièrement intéressants.
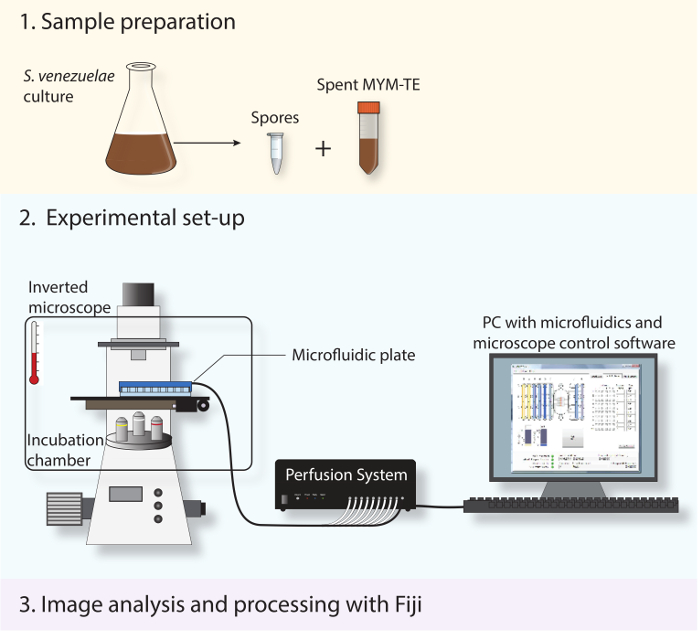
Figure 2: Schéma illustrant le flux de travail expérimental. Les trois principales étapes décrites dans le protocole sont présentés. D'abord, les spores et milieu usé sont préparés à partir d'une culture en phase stationnaire. En second lieu , les spores fraîches sont chargées dans un système microfluidique et S. venezuelae est imagée tout au long de son cycle de vie du développement au moyen d' un microscope inversé entièrement automatisé avec une chambre d'incubation pour maintenir une température optimale de croissance. Troisièmement, la série time-lapse obtenu est analysé et traité en utilisant le logiciel open-source Fidji.
Protocole
1. Isolement des frais de S. venezuelae Spores et Préparation du passé Culture Medium
- Inoculer 30 ml maltose-Levure Extrait de l' extrait de malt (PMJ) supplémenté avec R2 solution d'oligo - éléments 60 pi (TE), avec 10 spores pi de la souche SV60 [BT1 :: pSS209 de attB (P de divIVA - divIVA-mcherry P ftsZ -ftsZ-ypet)]. Pour une croissance constante et la sporulation des cellules, utilisez un flacon à chicanes ou un flacon qui contient un ressort pour permettre une aération suffisante.
- les cellules de la culture pendant 35-40 heures à 30 ° C et à 250 tours par minute.
- Examiner les cellules par liquide monté à contraste de phase microscopie. A ce stade, les fragments et les spores de mycélium seront visibles.
- Centrifugeuse 1 ml de cellules dans une centrifugeuse de table à 400 g pendant 1 min à culot du mycélium et des fragments de cellules plus grandes.
- Transférer environ 300 ul surnageant containing une suspension de spores dans un nouveau tube de 1,5 ml et garder sur la glace. Gardez le milieu de culture restant pour l'étape 1.7.
- Diluer spores à 1:20 dans MYM-TE (concentration finale: 0,5-5 x 10 7 spores / ml) et de garder sur la glace jusqu'à ce que nécessaire (voir étape 2.3).
Note: Bien que les conditions exactes qui déclenchent la sporulation chez Streptomyces ne sont pas compris, en utilisant milieu épuisé MYM-TE, y compris les signaux extracellulaires inconnus provenant d' une culture de sporulation, stimule la sporulation. - Filtre-stériliser 10 ml du milieu de culture restant pour obtenir passé MYM-TE qui est exempt de spores et les fragments de mycélium. Utilisez un filtre à seringue de 0,22 um stérile et transfert passé MYM-TE à un tube de 15 ml stérile.
- Gardez le MYM-TE préparé passé quelques jours à 4 ° C si des expériences supplémentaires en utilisant des conditions de croissance similaires doivent être menées.
2. Préparation du dispositif microfluidique
Remarque: Chaque pla microfluidiquete permet jusqu'à quatre expériences indépendantes à effectuer. Pour éviter la contamination des chambres d'écoulement non utilisées, utiliser des solutions stériles et les conditions de travail lors de la mise en place d'une expérience.
- Retirer la solution de transport de la plaque microfluidique et rincer les puits avec stérile MYM-TE.
- Ajouter 300 ul MYM-TE à l'entrée du puits 1 et 300 ul passé MYM-TE dans les puits 2 à 6.
- Charger 40 pl dilués spores de l'étape 1.6 dans la cellule de chargement et 8 de la voie "A" et sceller le collecteur de la plaque selon les instructions du fabricant.
- Lancez le logiciel de contrôle de la microfluidique, sélectionnez le type de plaque approprié et mettre en place un programme d'écoulement pour amorcer le canal d'écoulement et la chambre de culture par fluide circulant dans des puits d'entrée 1 à 5 à 6 psi pendant 2 min par puits.
- Dans le logiciel de contrôle de la microfluidique, créer un protocole de flux pour l'expérience: l'écoulement MYM-TE de puits d'entrée 1 pendant 6 heures pour permettre la germination et la croissance végétative des cellules. Interrupteurpuis perfusion de passé MYM-TE du puits 2 à 5 pour la durée restante de l'expérience. Au cours de l'expérience maintenir constante la pression d'écoulement à 6 psi (correspondant à environ 9 pi de milieu / h). Démarrer le programme d'écoulement après l'étape 3.5.
3. Mise en place du microscope et le protocole Time-lapse
Remarque: Cette méthode a été appliquée sur un microscope inversé à grand champ entièrement motorisé et automatique équipé d'une caméra sCMOS, une lampe aux halogénures métalliques, une mise au point automatique du matériel, un support de scène pour des plaques à 96 puits et une chambre environnementale.
- Préchauffer l'enceinte climatique à 30 ° C à l'avance afin d'éviter les problèmes de mise au point automatique après le début de l'expérience. Le temps requis dépend de la chambre d'environnement utilisé, le microscope et le système de chauffage. Commencez à chauffer le système la nuit avant l'expérience.
- Allumez le microscope et l'automatisation de la microscopie et de contrôle softwaré. Utilisez une ouverture numérique (NA) objectif haute immersion dans l'huile pour la collecte optimale du signal et la résolution spatiale, comme un 100X, 1,46 huile NA objectif DIC. Sélectionnez les filtres appropriés et des miroirs dichromatique pour acquérir différentiel contraste d'interférence (DIC) des images et des images de fusions de protéines jaune fluorescent et rouge fluorescent.
- Placer une goutte d'huile à immersion sur l'objectif et ajouter du liquide d'immersion au bas de la fenêtre de formation d'image sur la plaque microfluidique pour améliorer la cellule de mise au point lors de l'acquisition d'image. monter avec précaution le dispositif microfluidique étanche (étape 2.5) sur la scène du microscope inversé. Faire en sorte que la plaque est correctement placé dans le support de la scène et ne se déplace pas au cours de l'expérience.
- Amener la fenêtre d'imagerie de la chambre de culture microfluidique dans le foyer en utilisant les marqueurs de position intégrés pour l'orientation. Focalisation sur la partie gauche de la première chambre d'écoulement (étiqueté «A») avec la taille du piège 5, correspondant àune hauteur de piège de 0,7 pm.
- Dans le logiciel de la microfluidique, les cellules de charge à partir de puits d'entrée 8 à 4 psi pendant 15 sec. Vérifier la densité des cellules dans la chambre de culture en déplaçant la scène à travers la fenêtre d'imagerie. En l'absence de spores ont été piégés, répéter l'étape consistant à cellule de charge ou encore augmenter la pression et / ou le temps de chargement jusqu'à ce que la densité cellulaire souhaitée soit obtenue (1-10 spores par fenêtre d'imagerie à 2,048 x 2,048 pixels). Évitez de surcharger la chambre de culture.
Note: Nous utilisons normalement la taille du piège 5 pour l' imagerie Streptomyces, mais nous avons également obtenu de bons résultats avec un piège tailles 4 et 3. Reportez - vous au manuel du fournisseur pour des suggestions supplémentaires sur l' optimisation du processus de cellule de charge. - Démarrer le programme d'écoulement dans le logiciel de contrôle à l'étape 2.5 et laisser la plaque microfluidique à la chaleur équilibrer pendant 1 h dans l'étage de microscope avant de commencer l'acquisition d'image.
- Dans le logiciel de commande de microscope, mis en place une acquisition multi-dimensionnelle à prendre muimages ltiple à des positions de plusieurs étages au fil du temps:
- Pour Autosave: spécifier répertoire sauvegarde automatique des fichiers d'image.
- Pour les réglages d'éclairage, de déterminer les paramètres d'éclairage optimales pour chaque construction spécifique à l'avance. Pour l'expérience décrite, utilisez les durées d'exposition suivantes: DIC 150 msec, YFP 250 msec, RFP 100 msec.
- Pour des séries chronologiques: mettre en place une série de temps pour acquérir des images au niveau des points de temps souhaités dans l'ordre. Pour imager le cycle de vie de S. venezuelae, sélectionner un intervalle de temps de 40 min sur une période de 24 heures.
- Pour les postes de Scène et autofocus: balayer la chambre de culture en déplaçant les positions de la scène et la scène du magasin pour chaque position d'imagerie d'intérêt. Veiller à ce que les positions à un seul étage sont situés suffisamment à part pour minimiser photoblanchiment et phototoxicity.Typically utilisent jusqu'à 12 positions. Exécutez la routine de mise au point pour chaque point de temps pour corriger la dérive focale lente. Si elle est disponible dans le logiciel de commande de microscope, Définissez la stratégie de mise au point de «mise à jour de la surface locale par autofocus du matériel". Une fois les coordonnées Z des positions de scène sélectionnés sont vérifiées, activer l'autofocus du matériel.
- Commencez l'expérience time-lapse dans le logiciel de commande de microscope.
- Vérifier que toutes les positions de la scène sont encore au point à des points plus tard. Pour les expériences time-lapse en cours d'exécution sur plusieurs heures, on observe parfois une dérive de scène, même en utilisant l'autofocus. Si les positions de scène doivent être recentrées, arrêter le test à un point de temps approprié, la mise au point et redémarrez l'expérience dans l'intervalle de temps d'imagerie défini (étape 3.7.3). Voir l'étape 4.3 pour savoir comment concaténer la série chronologique.
- Arrêtez l'acquisition d'image après 24-30 h ou lorsque les hyphes dans la région d'intérêt ont différencié en spores (voir DIC série d'images). Arrêtez programme de flux dans le logiciel et démonter le dispositif microfluidique.
- Préparer la plaque microfluidique utilisé pour sto court termerage. Retirer le reste MYM-TE et a passé MYM-TE du puits 1 à 6, vide déchets ainsi 7 et cellules puits de chargement 8. Dans des conditions stériles, re-remplissage utilisé puits de voie "A" et les puits de voies inutilisées ( "B" "D") sur la plaque avec une solution saline tamponnée au phosphate stérile (PBS). Sceller la plaque avec du parafilm pour l'empêcher de sécher et conserver à 4 ° C.
4. Génération de Time-lapse Films Utilisation Fiji Software
Note: Nous notons que différents logiciels commerciaux et libres sont disponibles pour traiter les images de microscopie time-lapse y compris ZenBlue, Metamorph, ICY, ImagePro ou ImageJ. Ici nous nous concentrons sur les Fidji, qui est un programme de traitement d'image open-source basé sur ImageJ, et qui fournit déjà un certain nombre de plugins préinstallés utiles.
- données d'imagerie de transfert à partir de votre expérience time-lapse à un ordinateur qui a installé Fidji.
- Lancez le programme et importer le fichier d'imagerie utilisant &# 34; Fichier> Importer> Bio-Formats ". Ou tout simplement en faisant glisser le fichier d'imagerie en Fidji Dans le" Bio-formats Options d'importation ", cochez la case" canaux split "pour obtenir une pile d'images séparées pour chaque canal d'éclairage (DIC , RFP, YFP).
- Facultatif: Pour fusionner le temps des séries distinctes résultant d'une rupture dans la dans l'acquisition de l'image en raison de recentrage (étape 3.9), ouvrir des piles d'images respectives et exécuter "Image> Piles> Outils> Concaténez" pour chaque canal (DIC, RFP, YFP ).
- Évaluer la qualité des données time-lapse en faisant défiler les piles d'images. Rechercher des hyphes qui sont restés au point au fil du temps, la croissance du mycélium de spectacle et éventuellement former des spores (DIC pile). Examiner la localisation subcellulaire attendue pour divIVA-mCherry au bout des hyphes (pile de RFP) et FtsZ-YPet formant des anneaux simples ou multiples structures, de l'échelle comme dans végétative ou hyphes sporogène (YFP pile), respectivement.
- Isoler une région d'intérêt pour traitemen avalng des images. Vidéomicroscopie produit souvent de gros fichiers qui peuvent ralentir le traitement par les Fidji. Il est donc recommandé d'identifier et d'isoler une région d'intérêt (ROI) et pour effectuer d'autres étapes de traitement d'image sur cette version plus petite de la pile d'images.
- Sélectionnez l'option "Sélection rectangulaire" outil dans le menu et d'en tirer un retour sur investissement rectangulaire dans l'image pile DIC de manière à ce que les hyphes en développement sont entourés par le retour sur investissement tout au long de la série d'images.
- Dupliquer ROI-pile avec "Ctrl", "Shift" + + "D".
- Cliquez sur la barre de nom de l'image pile YFP et sélectionnez "Edition> Sélection> Restaurer la sélection" dans le menu pour restaurer la sélection rectangulaire précédente de la DIC originale pile à la même positon dans la pile YFP et dupliquer le retour sur investissement avec "Ctrl" + "Shift" + "D".
- Répétez ce processus pour la pile de DP.
- Aligner les images dans les trois piles d'images to éliminer les dérives de la scène dans le plan xy au fil du temps. Faites défiler jusqu'à la dernière image dans la pile DIC et sélectionnez "Plugin> Enregistrement> StackReg> RigedBody" dans le menu. Répétez cette étape pour la DP et l'image pile YFP. Si nécessaire, recadrer la ROI par étape 4.5.1-4.5.3 répéter.
- Facultatif: Régler la luminosité et le contraste manuellement pour chaque pile d'images avec le "Ajuster l'outil Luminosité et Contraste" ( "Ctrl" + "Shift" + "C") ou sélectionnez «Processus> Améliorer Contraste" dans le menu et appliquer la "Normaliser" commande à toutes les images de la pile. Il convient de noter que cette dernière commande modifie des valeurs de pixel et peut donc influer sur l'analyse d'images en aval.
- Facultatif: Combiner piles individuelles (convertis au format de fichier RVB, voir 4.11) horizontalement ou verticalement à l'aide du plug-in "Image> Piles> Outils> Fusionner".
- Ajouter une barre d'échelle ( "Analyse> Outils> Barre d'échelle") et un horodateur (&# 34; Image> Stacks> Time Stamper ").
- Enregistrer des piles d'images modifiées comme une séquence d'images dans le format ".tiff". Pour produire un film, enregistrer en tant que ".avi". Alternativement, une série d'images à l'exportation au format QuickTime en utilisant le "Bio-Formats> Bio-Formats Exportateur" plug-in et sélectionnez l'option ".mov" type de fichier.
- Pour obtenir des images à partir des images uniques, sélectionnez le cadre de l'intérêt et dupliquer l'image "Ctrl", "Shift" + + "D". Modifier le type de l'image résultante sur "RVB" ou "8 bits" sous "Image> Type> couleur RVB ou 8 bits" et enregistrez l'image sous ".tiff".
Remarque: Fidji offre un certain nombre de fonctions supplémentaires pour annoter plus ou séries processus time-lapse. Allez à Fidji support en ligne pour obtenir des informations détaillées (http://fiji.sc/Fiji).
Résultats
L'imagerie des cellules vivantes avec succès de l'ensemble S. cycle de vie venezuelae donne une série chronologique continue comprenant les étapes clés du développement de la germination, la croissance végétative et sporulation (Figure 3, Film 1). Visualisation de la progression à travers le cycle de vie est encore renforcée par la localisation subcellulaire distincte de divIVA-mCherry et FtsZ-YPet. Pendant la germination et la croissance végétative, divIVA-mCherry accumule exclusivement au niveau des pointes ou des marques nouvellement formant des points de branchement (figure 4A) hyphes en croissance. Ces résultats sont en ligne avec le positionnement subcellulaire précédemment rapporté des divIVA 12,26. En revanche, FtsZ-YPet forme des structures en forme d'anneau unique à intervalles irréguliers dans le mycélium (figure 4B). Ces structures offrent l'échafaudage pour la synthèse des parois transversales végétales non constrictive, ce qui conduit à la formation de interconncompartiments hyphes échies 8. La différenciation cellulaire de la croissance des hyphes en hyphes sporogène devient visible par la disparition des foyers polaires divIVA-mCherry, l'arrestation de la croissance polaire et l'augmentation concomitante de FtsZ-YPet fluorescence (figure 4C). Dans sporulation hyphes, le motif de localisation de FtsZ-YPet change radicalement; premiers hélicoïdaux filaments FtsZ-YPet dégringolent le long de la hypha puis, dans un événement soudain, presque synchrone, ces hélices se fondent en une échelle de régulièrement espacés anneaux FtsZ-YPet. Dans les conditions expérimentales décrites ici, ces échelles FtsZ-YPet répartis uniformément persistent pendant environ 2 heures. Enfin, sporulation septa devenir perceptible dans le contraste d'interférence différentiel (DIC) des images (Figure 4D) et , éventuellement , de nouvelles spores sont libérées.
Le protocole ultérieur décrivant le traitement de l'image en utilisant le logiciel Fidji dispose Tep par étape explication de la façon de produire un film pour la publication de la série time-lapse acquise (film 1).
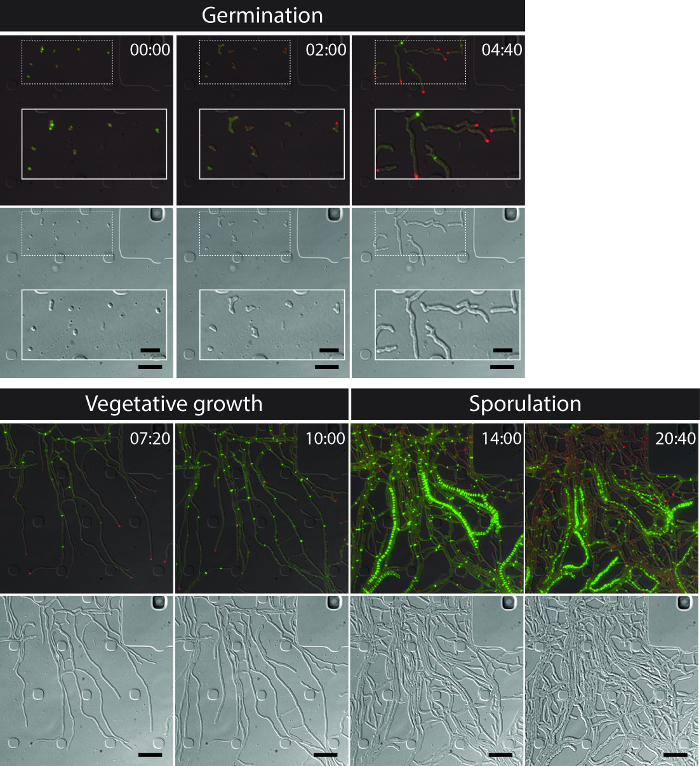
Figure 3: des images instantanées d'une fluorescence série de microscopie représentant time-lapse de S. venezuelae production marqué par fluorescence FtsZ (vert) et divIVA (Rouge) Montré sont des images sélectionnées d'images fusionnées (panneau supérieur: DP-YFP-DIC, panneau de fond: DIC). visualiser le cycle de vie Streptomyces y compris la germination, la croissance végétative et sporulation. Les images ont été prises à partir du film 1. Le temps est en h: min. Barres d'échelle = 5 um. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
d / 53863 / 53863fig4.jpg "/>
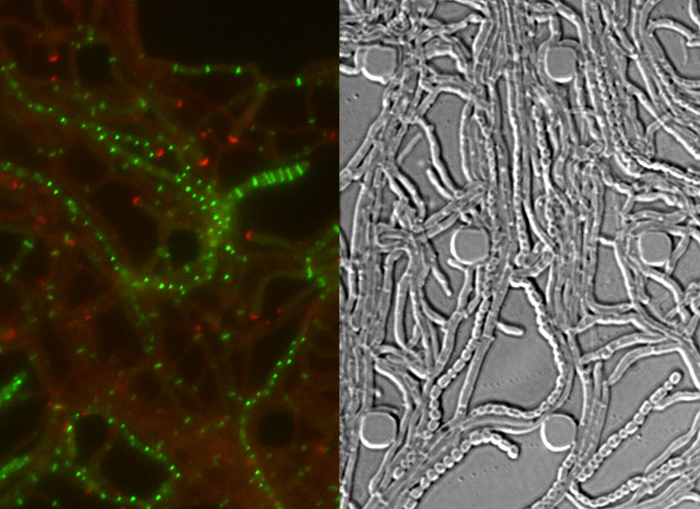
Figure 4: Les résultats représentatifs pour une série time-lapse réussie du cycle de vie Streptomyces (A) Localisation de divIVA-mCherry.. Montré sont des instantanés de deux points de temps ultérieurs de film 1 avec des images fusionnées de la DP et les canaux DIC. DivIVA-mCherry marque de nouveaux sites hyphes de branche (tête de flèche) rempli et localise à la pointe des hyphes pour diriger la croissance polaire (ouverte de la tête de flèche). Barre d'échelle = 10 pm (B) FtsZ-YPet localisation pendant la croissance végétative (tête de flèche). FtsZ-YPet forme des structures en forme d'anneau unique (panneau supérieur) qui ne compriment pas (DIC, panneau inférieur). (C) FtsZ-YPet (vert) localisation lors de la sporulation septation. foyers divIVA-mCherry sont indiquées en rouge, avec le temps écoulé illustré ci-dessous (h: min). Barre d'échelle: 5 um. (D) correspondant images DIC des hyphes de sporulation de (C) montrant la formeation des compartiments présporale avec septa sporulation visible (image de gauche), qui viennent à échéance, éventuellement, dans une chaîne de spores (image de droite). Le temps est en h: min. Barre d' échelle = 5 um. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Film 1: Time-lapse série de microscopie de fluorescence des Streptomyces venezuelae cycle de vie Le film est constitué d'images de la DP-YFP fusionnées ( à gauche) et les images correspondant contraste d'interférence différentiel (DIC) ( à droite).. DivIVA-mCherry est représenté en rouge et FtsZ-YPet en vert. L'intervalle de temps entre les images individuelles est de 40 min. Barre d'échelle = 10 pm. S'il vous plaît cliquer ici pour voir this film.
Discussion
Vidéomicroscopie du cycle de vie Streptomyces a été techniquement difficile dans le passé. Nous présentons ici un protocole robuste pour effectuer l' imagerie des cellules vivantes du cycle de vie complet en utilisant des fusions de protéines fluorescentes à la polarité cellulaire marqueur divIVA et la protéine de la division cellulaire FtsZ pour aider à visualiser et tracer la progression dans le programme de développement (Figure 2).
Au centre de cette méthode est la culture de S. venezuelae dans un dispositif microfluidique qui permet à perfusion moyenne constante et l'échange de milieu de croissance normal (MYM-TE) avec le milieu passé (passé MYM-TE). Le changement de l' état de la culture est importante pour le protocole décrit parce que le rétrogradage nutritionnel que les puits que tous les signaux extracellulaires non encore identifiés (signaux par exemple quorum de détection) dans le milieu de culture usé, promouvoir la sporulation, alors qu'un approvisionnement continu en milieu riche en nutriments stimule growt végétativeh avec très peu de formation de spores (données non présentées). Ainsi, la culture de cellules dans ce système microfluidique est supérieure à la culture de cellules sur agarose, car il offre une flexibilité plus expérimental et permet une surveillance à long terme des changements dans la croissance bactérienne en réponse à l'évolution des conditions de culture. Bien que les plaques microfluidiques sont conçus pour un usage unique, le débit des canaux qui ne sont pas inoculées avec des cellules peuvent être utilisées dans les expériences suivantes. Nous vous recommandons d'utiliser tous les canaux d'une plaque microfluidique dans une semaine, comme nous l'avons connu des problèmes d'étanchéité du collecteur à des plaques qui ont été ouverts pour des durées plus longues.
Lors de la mise en place d'une expérience, nous avons constaté que les spores fraîchement préparés à germer dans les deux heures d'être chargé dans la chambre d'écoulement, alors que les spores issues d'un stock de glycérol congelé requis au moins 6 heures avant des tubes de germes apparus (données non présentées). Ce retard dans la germination prolonge la durée de l'expérience et peut interférer avecla disponibilité du matériel et des conditions expérimentales. Il est également important de commencer l'expérience avec la perfusion de MYM-TE pendant au moins 3 heures pour fournir suffisamment d'éléments nutritifs pour le développement et l'excroissance des tubes de germes. Perfusion avec MYM-TE peut être prolongée au-delà de la première 3 heures si l'expérience a été conçue pour étudier la croissance végétative. Bien que les spores offrent le choix préféré de matériau de départ, des fragments courts hyphes peuvent également être chargés dans la plaque microfluidique. Cependant, l'efficacité de chargement lors de l'utilisation de mycélium cisaillé est significativement plus faible et nécessite souvent plusieurs cycles de chargement qui peut présenter une limitation lors de l'examen des mutants non-sporulantes. Quel que soit le type d'inoculum utilisé, il est important de ne pas surcharger la chambre de culture avec des spores ou des fragments hyphes que cela conduira à la surpopulation rapide qui peut interférer avec la diffusion des médias et de compliquer l'analyse d'image.
Il est important de prévoir la construction de protéines rapporteurs savoully pour l' utilisation de la fluorescence imagerie time-lapse dans Streptomyces. la longueur du groupe de liaison entre la protéine cible et le rapporteur fluorescent et le choix du N- ou des fusions C-terminales peut être critique. De plus, les conditions expérimentales optimales, y compris la fréquence d'imagerie et le temps d'exposition, doivent être déterminées à l' avance pour chaque protéine fluorescente marquée. S. venezuelae hyphes exposition auto-fluorescence dans le canal vert / jaune qui peut devenir problématique lorsque l' image d' une protéine marquée par fluorescence qui est exprimée à des niveaux faibles. En outre, il convient de noter que, au cours de la germination et de la phase de croissance végétative initiale, S. venezuelae est particulièrement sensible à la lumière de courte longueur d' onde (par exemple lors de l' utilisation des protéines de fusion de la PCP).
Malgré les progrès continus des techniques d'imagerie et des systèmes de rapporteurs fluorescents pour l' imagerie des cellules vivantes de bactéries, la plupart des logiciels (par exemple MicrobeTracker, Schnitzelcaunes, CellProfiler) pour le traitement automatisé ultérieur de ces types d'ensembles de données ne prennent pas en charge l'analyse des images issues de bactéries filamenteuses avec un style de vie multicellulaire 27-29. Ainsi, il existe un besoin de développer un algorithme approprié pour l'analyse quantitative à haut débit de données d'imagerie à partir de Streptomyces et d' autres bactéries filamenteuses.
En résumé, le travail décrit ici démontre l'immense potentiel de S. venezuelae comme un nouveau système de développement de modèle pour le genre, en raison de sa capacité à sporuler dans un liquide. Le dispositif de culture microfluidique est simple à utiliser, même pour les utilisateurs inexpérimentés. Il offre une excellente plateforme pour étudier des processus biologiques cellulaires centraux pour le cycle de vie de Streptomyces, y compris la localisation dynamique des protéines, la croissance polarisée, et la différenciation morphologique d'un mycélium multicellulaire dans les chaînes de spores unigenomic. En outre ce dispositif expérimental u réglép fournit également un point de départ attrayante pour enquêter sur les événements dans le développement qui nécessitent une alternance des conditions de culture, ou l'utilisation de colorants fluorescents tels que les acides fluorescents D -amino pour surveiller la synthèse du peptidoglycane ou l'iodure de propidium et 4 ', 6-diamidino-2-phénylindole (DAPI) pour visualiser l' organisation des chromosomes 30,31.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
The authors thank Grant Calder for technical assistance with the microscope, Matt Bush for comments on the protocol, and the John Innes Centre for purchase of the Zeiss widefield microscope. This work was funded by BBSRC grant BB/I002197/1 (to M.J.B), by BBSRC Institute Strategic Programme Grant BB/J004561/1 to the John Innes Centre, by Swedish Research Council grant 621-2010-4463 (to K.F.), and by a Leopoldina Postdoctoral Fellowship (to S.S.).
matériels
| Name | Company | Catalog Number | Comments |
| B04A CellAsic ONIX plate for bacteria cells | Merck-Millipore | B04A-03-5PK | Microfluidic culture plates |
| CellAsic ONIX Microfluidic Perfusion System and ONIX FG (version 5.0.2) | Merck-Millipore | EV-262 | The latest ONIX vesion (July 2015) and instructions on how to use the programme can be found here: http://www.merckmillipore.com |
| Axio Observer.Z1 Microscope | Zeiss | 431007-9902-000 | Fully automated and motorized inverted widefield microscope |
| Incubator XL multi S1 with Temperature Module S1 and Heating unit XL S2 | Zeiss | 411857-9061-000 | Environmental chamber surrounding the microscope |
| Plan-Apochromat 100x/1.46 Oil DIC objective | Zeiss | 420792-9800-000 | |
| Ocra FLASH 4 V2 | Hamamatsu Photonics K.K. | C11440-22CU | |
| Illuminator HXP 120V | Zeiss | 423013-9010-000 | |
| FL Filter Set 46 HE YFP shift free | Zeiss | 489046-9901-000 | Fluorescent filter set, excitation 500/25 nm, emission 535/30 nm |
| FL Filter Set 63 HE RFP shift free | Zeiss | 489063-0000-000 | Fluorescent filter set, excitation 572/25 nm, emission 629/30 nm |
| Mounting frame K-M for multiwell plates | Zeiss | 000000-1272-644 | Stage holder for microfluidic plate |
| ZEN pro 2012 | Zeiss | 410135-1002-120 | Microscope control software |
| ZEN Module Time Lapse | Zeiss | 410136-1031-110 | Software module to set up time-lapse microscopy experiments |
| ZEN Module Tiles/Positions | Zeiss | 410136-1025-110 | Software module to save specific stage positions (xzy) |
| Fiji | open-source software package | http://fiji.sc/Fiji | Generation of time-lapse movies |
| Maltose-Yeast Exctract-Malt Extract (MYM) 4 g Maltose 4 g Yeast extract 10 g Malt extract add 1 L H2O using 50 % tap water and 50 % reverse osmosis water and supplement with 200 ml of R2 trace element solution per 100 ml after autoclaving | Sporulation medium used to culture S. venezuelae SV60 | ||
| R2 Trace element solution (TE) 8 mg ZnCl2 40 mg FeCl3-6H2O 2 mg CuCl2-2H2O 2 mg MnCl2-4H2O 2 mg Na2B4O7-10H2O 2 mg (NH4)6Mo7O24-4H2O add 200 ml H2O Autoclave and store at 4 oC | Add 0.002 volumes to MYM | ||
| PBS (phosphate buffered saline) | Sigma | P4417-100TAB | Used to refill inlet wells of unused lanes in B04A plates in order to prepare plate for short-term storage. |
| 0.22 µm syringe filters | Satorius stedim | 16532-K | Preparation of spent MYM-TE |
| SV60 | John Innes Centre strain collection | S. venezuelae strain expressing divIVA-mcherry and ftsZ-ypet |
Références
- Bush, M. J., Tschowri, N., Schlimpert, S., Flärdh, K., Buttner, M. J. c-di-GMP signalling and the regulation of developmental transitions in streptomycetes. Nat. Rev. Microbiol. 13, 749-760 (2015).
- Jakimowicz, D., van Wezel, G. P. Cell division and DNA segregation in Streptomyces.: how to build a septum in the middle of nowhere?. Mol. Microbiol. 85, 393-404 (2012).
- McCormick, J. R., Flärdh, K. Signals and regulators that govern Streptomyces development. FEMS Microbiol. Rev. 36, 206-231 (2012).
- Flärdh, K., Richards, D. M., Hempel, A. M., Howard, M., Buttner, M. J. Regulation of apical growth and hyphal branching in Streptomyces. Curr. Opin. Microbiol. 15, 737-743 (2012).
- Hempel, A. M., et al. The Ser/Thr protein kinase AfsK regulates polar growth and hyphal branching in the filamentous bacteria Streptomyces. Proc. Natl. Acad. Sci. U S A. 109, E2371-E2379 (2012).
- Fuchino, K., et al. Dynamic gradients of an intermediate filament-like cytoskeleton are recruited by a polarity landmark during apical growth. Proc. Natl. Acad. Sci. U S A. 110, E1889-E1897 (2013).
- Holmes, N. A., et al. Coiled-coil protein Scy is a key component of a multiprotein assembly controlling polarized growth in Streptomyces. Proc. Natl. Acad. Sci. U S A. 110, E397-E406 (2013).
- McCormick, J. R., Su, E. P., Driks, A., Losick, R. Growth and viability of Streptomyces coelicolor. mutant for the cell division gene ftsZ. Mol. Microbiol. 14, 243-254 (1994).
- Margolin, W. FtsZ and the division of prokaryotic cells and organelles. Nat. Rev. Mol. Cell Biol. 6, 862-871 (2005).
- Grantcharova, N., Lustig, U., Flärdh, K. Dynamics of FtsZ assembly during sporulation in Streptomyces coelicolor A3(2). J. Bacteriol. 187, 3227-3237 (2005).
- Richards, D. M., Hempel, A. M., Flärdh, K., Buttner, M. J., Howard, M. Mechanistic basis of branch-site selection in filamentous bacteria. PLoS Comput. Biol. 8, e1002423 (2012).
- Hempel, A. M., Wang, S. B., Letek, M., Gil, J. A., Flärdh, K. Assemblies of DivIVA mark sites for hyphal branching and can establish new zones of cell wall growth in Streptomyces coelicolor. J. Bacteriol. 190, 7579-7583 (2008).
- Wolanski, M., et al. Replisome trafficking in growing vegetative hyphae of Streptomyces coelicolor A3(2). J. Bacteriol. 193, 1273-1275 (2011).
- Jyothikumar, V., Tilley, E. J., Wali, R., Herron, P. R. Time-lapse microscopy of Streptomyces coelicolor.growth and sporulation. Appl. Environ. Microbiol. 74, 6774-6781 (2008).
- Willemse, J., Borst, J. W., de Waal, E., Bisseling, T., van Wezel, G. P. Positive control of cell division: FtsZ is recruited by SsgB during sporulation of Streptomyces. Genes. Dev. 25, 89-99 (2011).
- Glazebrook, M. A., Doull, J. L., Stuttard, C., Vining, L. C. Sporulation of Streptomyces venezuelae. in submerged cultures. J. Gen. Microbiol. 136, 581-588 (1990).
- Bibb, M. J., Domonkos, A., Chandra, G., Buttner, M. J. Expression of the chaplin and rodlin hydrophobic sheath proteins in Streptomyces venezuelae.is controlled by sigma(BldN) and a cognate anti-sigma factor, RsbN. Mol. Microbiol. 84, 1033-1049 (2012).
- Al-Bassam, M. M., Bibb, M. J., Bush, M. J., Chandra, G., Buttner, M. J. Response regulator heterodimer formation controls a key stage in Streptomyces development. PLoS Genet. 10, e1004554 (2014).
- Bush, M. J., Bibb, M. J., Chandra, G., Findlay, K. C., Buttner, M. J. Genes required for aerial growth, cell division, and chromosome segregation are targets of WhiA before sporulation in Streptomyces venezuelae. MBio. 4, e00684-e00613 (2013).
- Tschowri, N., et al. Tetrameric c-di-GMP mediates effective transcription factor dimerization to control Streptomyces development. Cell. 158, 1136-1147 (2014).
- Mirouze, N., Ferret, C., Yao, Z., Chastanet, A., Carballido-Lòpez, R. MreB-Dependent Inhibition of Cell Elongation during the Escape from Competence in Bacillus subtilis. PLoS Genet. 11, e1005299 (2015).
- Zopf, C. J., Maheshri, N. Acquiring fluorescence time-lapse movies of budding yeast and analyzing single-cell dynamics using GRAFTS. J. Vis. Exp. (e50456), (2013).
- Meniche, X., et al. Subpolar addition of new cell wall is directed by DivIVA in mycobacteria. Proc. Natl. Acad. Sci. U S A. 111, E3243-E3251 (2014).
- Donovan, C., Schauss, A., Kramer, R., Bramkamp, M. Chromosome segregation impacts on cell growth and division site selection in Corynebacterium glutamicum. PLoS One. 8, e55078 (2013).
- Rojas, E., Theriot, J. A., Huang, K. C. Response of Escherichia coli. growth rate to osmotic shock. Proc. Natl. Acad. Sci. U S A. 111, 7807-7812 (2014).
- Flärdh, K. Essential role of DivIVA in polar growth and morphogenesis in Streptomyces coelicolor A3(2). Mol. Microbiol. 49, 1523-1536 (2003).
- Sliusarenko, O., Heinritz, J., Emonet, T., Jacobs-Wagner, C. High-throughput subpixel precision analysis of bacterial morphogenesis and intracellular spatio-temporal dynamics. Mol. Microbiol. 80, 612-627 (2011).
- Young, J. W., et al. Measuring single-cell gene expression dynamics in bacteria using fluorescence time-lapse microscopy. Nat. Protoc. 7, 80-88 (2012).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7, R100 (2006).
- Kuru, E., Tekkam, S., Hall, E., Brun, Y. V., Van Nieuwenhze, M. S. Synthesis of fluorescent D-amino acids and their use for probing peptidoglycan synthesis and bacterial growth in situ. Nat. Protoc. 10, 33-52 (2015).
- Szafran, M., et al. Topoisomerase I (TopA) is recruited to ParB complexes and is required for proper chromosome organization during Streptomyces coelicolor. sporulation. J. Bacteriol. 195, 4445-4455 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon