Method Article
전체의 형광 시간 경과 영상
요약
Streptomyces are characterized by a complex life cycle that has been experimentally challenging to study by cell biological means. Here we present a protocol to perform fluorescence time-lapse microscopy of the complete life cycle by growing Streptomyces venezuelae in a microfluidic device.
초록
Live-cell imaging of biological processes at the single cell level has been instrumental to our current understanding of the subcellular organization of bacterial cells. However, the application of time-lapse microscopy to study the cell biological processes underpinning development in the sporulating filamentous bacteria Streptomyces has been hampered by technical difficulties.
Here we present a protocol to overcome these limitations by growing the new model species, Streptomyces venezuelae, in a commercially available microfluidic device which is connected to an inverted fluorescence widefield microscope. Unlike the classical model species, Streptomyces coelicolor, S. venezuelae sporulates in liquid, allowing the application of microfluidic growth chambers to cultivate and microscopically monitor the cellular development and differentiation of S. venezuelae over long time periods. In addition to monitoring morphological changes, the spatio-temporal distribution of fluorescently labeled target proteins can also be visualized by time-lapse microscopy. Moreover, the microfluidic platform offers the experimental flexibility to exchange the culture medium, which is used in the detailed protocol to stimulate sporulation of S. venezuelae in the microfluidic chamber. Images of the entire S. venezuelae life cycle are acquired at specific intervals and processed in the open-source software Fiji to produce movies of the recorded time-series.
서문
Streptomycetes는 휴면, unigenomic 포자 1-3 다세포, 영양 청소 균사체에서 형태 적 분화를 포함하는 복합 개발 사이클을 특징으로 토양에 서식하는 박테리아입니다.
양호한 성장 조건 하에서 전형적인 스트렙토 포자는 하나 또는 두 개의 배아 튜브 (도 1)를 돌출시켜 발아하기 시작한다. 이 튜브는 팁 확장에 의해 신장과 식물 균사체로 알려진 분기 균사 네트워크로 성장. 폴라 성장과 균사 분기는 필수 단백질 DivIVA로 이동합니다. 이 꼬인 코일 단백질은 세포질 큰 복합체의 일부가 연장되는 선단 4-7에서 새로운 세포 외피 재의 삽입 중요 polarisome를 불린다. 식물 성장 동안, 균사 필라멘트 소위 크로스 벽 (8)의 형성에 의해 간헐적으로 구획화된다. 다시 이러한 가교 벽 형성 첩 FtsZ, 대부분의 세균 9 세포 분열에 필수적인 튜 불린과 같은 세포 골격 단백질. 스트렙토 그러나 이러한 식물 간 벽 수축 및 세포 - 세포 분리를 유도하지 않고 따라서 균사 덩어리 상호 접속 포체 구획 네트워크로서 유지된다. 잘 이해되지 않는 영양소 제한 및 다른 신호에 응답하여, 전문 공중 균사는 식물 균사체에서 이탈 공기 3로 성장한다. 이러한 구조의 발기가 긴 멀티 게놈 공중 균사가 동일한 크기의 unigenomic prespore 구획 수십으로 나누어 그 동안 개발의 생식 단계를 시작합니다. 이 거대한 세포 분열 이벤트는 하나의 sporogenic 균사의 2,10 내에서 여러 FtsZ 반지의 동기 수축에 의해 구동된다. 형태 학적 분화는 휴면, 두꺼운 벽, 착색 포자의 방출에 의해 완성된다.
t "FO : 유지-together.within 페이지 ="1 ">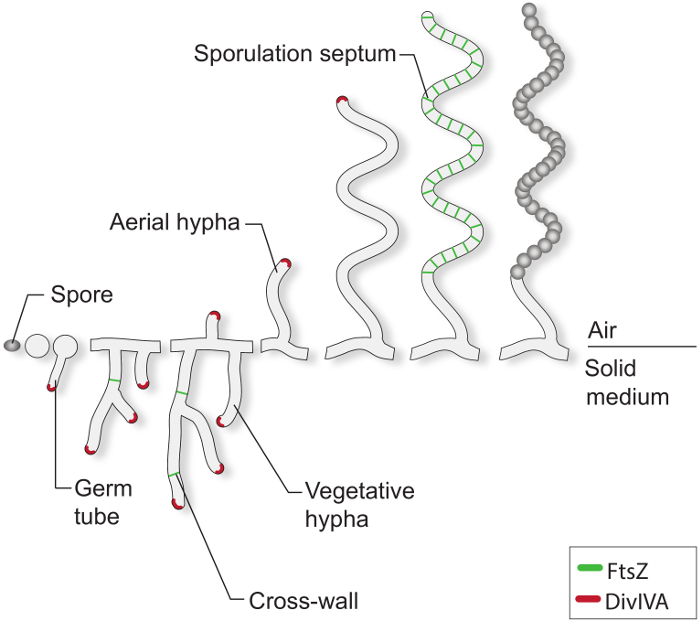
그림 1. 고체 배지에 스트렙토 라이프 사이클 이것은 S. 고전 연구에 기초하여 라이프 사이클 모델 한천 플레이트에 성장 coelicolor. 포자의 세포 발달 균사 분지 네트워크를 형성하도록 팁 확장 성장 하나 또는 두 생식 관의 형성으로 시작된다. 폴라 성장과 식물 균사의 분기는 DivIVA (빨간색)으로 이동합니다. 식물 교차 벽의 형성은 FtsZ (녹색)가 필요합니다. 영양 제한 및 다른 신호에 응답하여, 공중 균사가 건립된다. 공중 성장의 체포 단단히 상자 같은 prespore 구획에 sporogenic 균사를 구획 포자의 격막을 야기 할 FtsZ 링, 사다리의 조립과 조정됩니다. 이 구획은 두꺼운 포자 벽을 조립하고 결국 relea 있습니다성숙 색소 포자를 나오지.
스트렙토 라이프 사이클의 키 이벤트가 잘 발달 1,3- 특징으로한다. 그러나 아직 어떤 부족한 단백질 현지화 역학, 염색체의 움직임과 발달 제어 세포 분열로 차별화를 뒷받침 세포 내 프로세스에 대한 통찰력을 제공하기 위해 형광 시간 경과 현미경을 사용하는 세포 생물학적 연구이다. 스트렙토 개발의 라이브 세포 이미징 때문에 라이프 사이클의 복잡성과 유기체의 생리 학적 특성에 도전하고있다. 식물 성장 이전 연구 및 포자의 격막의 초기 단계에서는 산소 투과성 촬상 챔버 또는 현미경 단계 11-15에서 스트렙토 coelicolor의 아가 성장을 지원 채용했다. 이러한 방법은 그러나, 여러 가지 요인에 의해 제한된다. 일부 시스템은 세포 성장의 단기 촬상 허용세포 전에 D 형광 단백질은 산소 공급 부족으로 고생하거나 인해 균사 개발의 3 차원 패턴에 초점면에서 성장한다. 장기 이미징 세포 대체 성장 또는 응력 조건에 노출하고, 아가로 오스 패드의 매체로부터 배경 형광이 심각 강한 형광을 모니터링하는 능력을 제한 할 수 없기 때문에 아가 패드 한계 실험 유연성에 세포를 배양하는 것이 가능하다 경우 신호.
여기에서 우리는 우수한 정밀도와 감도 완전한 스트렙토 마이 라이프 사이클의 라이브 세포 이미징을위한 프로토콜을 설명합니다. 위드 형광 현미경 (도 2)에 접속 된 마이크로 유체 장치 스트렙토을 성장시킴으로써, 우리는 지금까지 30 시간의 기간 동안 발아, 식물의 성장과 포자의 격막을 모니터링 할 수있다. 이것은 크게 새로운 모델 생물의 스트렙토 마이 세스 (Streptomyces)의 사용에 의해 촉진된다 venezuelae 그것은 침수 문화에 거의 완성 단계에 sporulates하여 클래식 모델 종 S.의 한계를 극복 할 수 있기 때문에 고체 배지 16 ~ 20에만 sporulates coelicolor. 식물의 성장과 포자 형성을 시각화하기 위해, 우리는 공동 명시 형광 셀 극성 마커 DivIVA와 키 세포 분열 단백질 FtsZ 버전의 태그.
우리는 성공적 마이코 박테리아, 대장균, 코리 네 박테 리움 글루 타미 쿰, 고초균, 효모 및 21-25에 이용 된 상업적으로 이용 가능한 미세 유동 장치를 이용하고있다. 시스템은 단일 초점 평면 셀 트랩 상이한 저장조로부터 배지 연속 관류의 제어를 허용한다. 상세한 프로토콜에서는 S. 노출이 기능을 활용할 포자 형성을 촉진하는 영양 하향 변속에 식물 균사체를 venezuelae.
프로토콜 드스크라이브 전체 스트렙토 라이프 사이클의 라이브 세포 이미징을위한,하지만, 특정 발달 단계가 특히 관심이 있다면 다른 미디어 환경이나 현미경 설정이 선택 될 수있다.
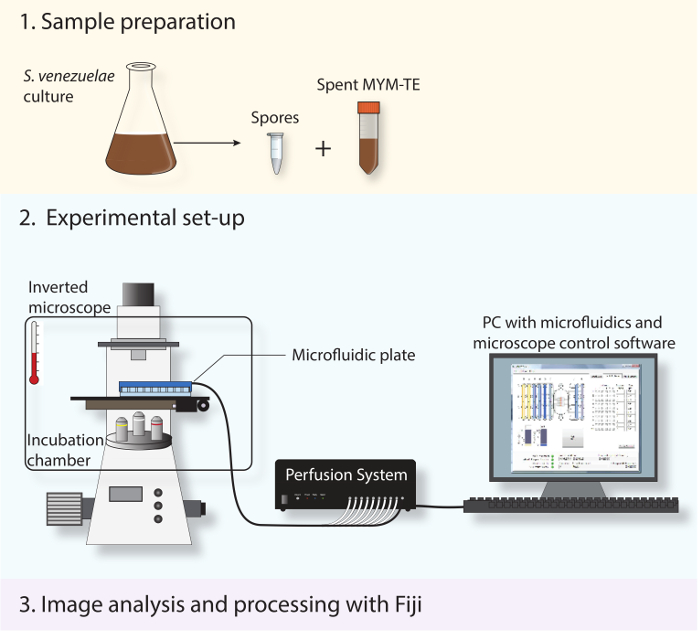
그림 2 : 회로도 실험적인 작업 흐름을 묘사. 프로토콜에서 설명하는 세 가지 주요 단계가 표시됩니다. 첫째, 포자 및 소비 매체는 고정 상 문화에서 제조된다. 둘째, 새로운 포자 마이크로 유체 시스템 및 S.로로드 venezuelae는 발달주기가 최적 성장 온도를 유지하기 위해 배양 챔버 전자동 도립 현미경을 사용하여 전체에 결상된다. 셋째, 얻어진 시간 경과 시리즈 분석 및 오픈 소스 소프트웨어 피지를 사용하여 처리됩니다.
프로토콜
신선한 S. 1. 분리 venezuelae 포자와 소비 문화 매체의 준비
- divIVA-mcherry의 P의 ftsZ - 변형 SV60 [attB φ BT1 :: pSS209 (P의 divIVA 10 μl의 포자로, 60 μL R2 미량 원소 용액 (TE)로 보충 된 30 ml의 말토오스 - 효모 추출물 - 맥아 추출물을 접종 (MYM) 매체, -ftsZ-ypet)]. 일관된 성장과 세포의 포자를 들어, 당황 플라스크 또는 충분한 통기 수 있도록 스프링이 들어있는 플라스크를 사용합니다.
- 30 ° C에서 35 ~ 40 시간, 250 rpm으로 문화에 대한 세포.
- 액체 장착 된 위상차 현미경으로 세포를 검사합니다. 이 시점에서 균사 조각과 포자 볼 수 있습니다.
- 원심 분리기는 1 분 400 XG에 테이블 탑 원심 분리기 1 ml의 세포는 균사체 큰 세포 조각을 펠렛합니다.
- 약 300 ㎕의 상층 액을 공동으로 이동새로운 1.5 ML 튜브에 포자 현탁액을 ntaining과 얼음에 보관하십시오. 단계 1.7에 대한 나머지 배지를 유지합니다.
- 포자에게 MYM-TE에서 1시 20분 희석 (최종 농도 : 0.5 × 10 7 포자 / ㎖) 및 필요할 때까지 얼음에 보관 (단계 2.3 참조).
주 : 스트렙토에서 포자를 트리거 정확한 조건은 포자 배양에서 알 수없는 세포 외 신호에 포함 소비 MYM-TE 매체를 이용하여 이해되지 않지만, 포자 형성을 자극한다. - 포자와 균사 조각 무료 MYM-TE 지출을 구하는 나머지 배지 10 ㎖를 필터 - 소독. 멸균 0.22 μm의 주사기 필터를 사용하여 전송 멸균 15 ML 튜브에 MYM-TE를 보냈다.
- 유사한 성장 조건을 사용하여 추가 실험을 수행 할 경우 39 ° C에서 몇 일 동안 제조 소요 MYM-TE 유지.
미세 유체 장치 2. 준비
참고 : 각 미세 유체 괞 찮아테가 수행하는 네 개의 독립적 인 실험까지 할 수 있습니다. 실험을 설정할 때 사용되지 않는 흐름 챔버의 오염을 방지하기 위해 멸균 솔루션과 근로 조건을 사용합니다.
- 미세 유체 플레이트에서 운송 솔루션을 제거하고 멸균 MYM-TE로 우물을 씻어.
- 300 ㎕의 MYM-TE는 6 우물 2에 잘 1 300 μl를 보냈다 MYM-TE 입구에 추가.
- 부하 40 μL는 레인 "A"의 셀 로딩 잘 8 단계 1.6에서 포자를 희석에 따른 플레이트에 매니 폴드 지침을 제조 밀봉.
- , 미세 유체 제어 소프트웨어를 실행 적절한 플레이트 유형을 선택하고 잘 당 2 분 6 psi에서 5 입구 우물에서 흐르는 매체에 의해 1 주요 유동 채널과 문화 챔버로 흐름 프로그램을 설정합니다.
- 발아 및 식물 세포의 성장을 허용하기 위해 6 시간 동안 흡입 웰 1 MYM-TE 흐르는 : 미세 유체 제어 소프트웨어, 실험 유량 프로토콜을 생성한다. 스위치다음 실험의 나머지 기간 동안 잘 2~5에서 소비 MYM-TE의 관류에 관한 것이다. 실험 과정 동안 (약 9 μL 매체 / 시간에 상응 함) 6 psi에서 유동 압력을 일정하게 유지한다. 단계 3.5 이후 흐름 프로그램을 시작합니다.
현미경 및 시간 경과 프로토콜의 3. 최대
주 :이 방법은 sCMOS 카메라, 메탈 할라이드 램프, 하드웨어 자동 초점, 96 웰 플레이트 단계 홀더 환경 챔버를 구비 한 완전 자동화 된 동력 위드 도립 현미경상에서 구현되었다.
- 실험 시작 후 오토 포커스 문제를 방지하기 위해서 사전에 30 ° C의 환경 챔버를 미리 가온. 필요한 시간은 사용 환경 챔버, 현미경 및 가열 시스템에 의존한다. 실험 전에 시스템을 밤을 가열하기 시작합니다.
- 현미경 및 현미경 자동화 및 제어 softwa를 켭니다레. 이러한 100X, 1.46 NA 오일 DIC 목표로 최적의 신호 수집 및 공간 해상도에 대한 높은 개구 수 (NA) 오일 침지 목표를 사용합니다. 노란색 형광과 빨간색 형광 단백질 융합의 미분 간섭 대비 (DIC) 이미지와 이미지를 수집하기 위해 적절한 필터 및 이색 거울을 선택합니다.
- 목적에 침지 기름 방울을 놓고 이미지 획득 동안 셀 초점을 개선하는 미세 플레이트 촬상 창 아래쪽에 침지 유체를 추가한다. 조심스럽게 거꾸로 현미경의 스테이지로 밀봉 된 미세 유체 소자 (단계 2.5)를 탑재합니다. 판 안전하게 무대 홀더에 넣고 실험의 과정을 통해 이동하지 않는 것을 확인합니다.
- 방향에 대한 매립 위치 마커를 사용하여 초점 미세 배양 챔버의 촬상 창을 가지고. 제 1 유동 챔버의 왼쪽 부분에 초점에 해당하는 트랩 크기 5 ( "A"를 표시)0.7 ㎛의 트랩 높이입니다.
- 마이크로 유체 소프트웨어, 입구도 8에서로드 셀 15 초 4 PSI에. 촬상 창에 걸쳐 스테이지를 이동하여 배양 챔버에서 세포 밀도를 확인한다. 포자가 트랩되지 않은 경우, 셀 로딩 단계를 반복 또는 다른 원하는 세포 밀도 (2048 X 2048 픽셀 촬상 창 당 1-10 포자)에 도달 할 때까지 하중 압력 및 / 또는 시간을 증가시킨다. 문화 챔버를 과부하하지 마십시오.
우리는 일반적으로 스트렙토 마이 세스 (Streptomyces) 이미징을위한 트랩 크기 5를 사용하지만, 우리는 4와 3 셀로드 프로세스를 최적화 추가 제안에 대한 공급 업체의 설명서를 참조하십시오 크기 트랩 좋은 결과를 얻었다 :합니다. - 단계 250에서 제어 흐름 소프트웨어 프로그램을 시작하고 미세 플레이트 화상 취득을 시작하기 전에 현미경 단계에서 1 시간 동안 평형을 가열 할 수있다.
- 현미경 제어 소프트웨어에서 뮤를 취할 다차원 인수를 설정시간이 지남에 따라 여러 단계의 위치에서 ltiple 이미지 :
- 자동 저장의 경우 : 이미지 파일의 자동 저장을위한 디렉토리를 지정합니다.
- 조명 설정에 대해서는 사전에 각 특정 구조에 대한 최적의 조명 설정을 결정합니다. DIC 150 밀리 초, YFP 250 밀리 초, RFP 100 밀리 : 설명 실험을 위해, 다음과 같은 노출 시간을 사용합니다.
- 시계열 들어 : 시퀀스에서 원하는 시점에서 영상을 획득하는 시계열을 설정. S.의 수명을 이미징 venezuelae는 24 시간 동안 40 분의 시간 간격을 선택합니다.
- 스테이지 위치 및 자동 초점 : 관심있는 각각의 결상 위치의 단계 및 저장 단계의 위치를 이동하여 배양 챔버를 검사한다. 단일 단계의 위치가 충분히 떨어져 광표백과 phototoxicity.Typically (12)의 위치까지 사용할 최소화하기 위치되어 있는지 확인합니다. 각 시점에 대한 실행 자동 초점 루틴은 느린 초점 드리프트를 보정합니다. 만약 현미경 제어 소프트웨어에서 사용할"하드웨어 자동 초점으로 지역의 표면 업데이트"로 설정 자동 초점 전략. 선택한 스테이지 위치의 Z 좌표가 확인되면, 하드웨어 자동 초점을 활성화합니다.
- 현미경 제어 소프트웨어의 시간 경과 실험을 시작합니다.
- 모든 단계의 위치가 나중에 지점에서 초점이 아직도 있는지 확인합니다. 자동 초점을 사용할 때 몇 시간에 걸쳐 실행 시간 경과 실험을 위해, 우리는 때때로 심지어 무대 드리프트를 관찰합니다. 스테이지 위치가 재 집중해야하는 경우, 적절한 시점에서 실험을 중지 포커스 조정 정의 묘화 시간 간격 (단계 3.7.3) 내에 실험을 재시작. 시계열을 연결하는 방법에 대한 단계 4.3를 참조하십시오.
- 24-30 시간 후 이미지 수집을 중지 또는 관심의 영역에서 균사가 포자로 분화 한 경우 (DIC 이미지 시리즈 참조). 소프트웨어 흐름 프로그램을 중지하고 미세 유체 장치를 분해.
- 단기 석재 중고 미세 유체 플레이트를 준비합니다격노. MYM-TE 나머지 제거하고 6도 1에서 MYM-TE를 보냈다 빈 폐기물도 7 및 멸균 조건에서 세포로드 웰 (8), 다시 채우기에 레인 "A"의 우물과 사용하지 않은 차선의 우물 ( "B"를 사용 멸균 인산 완충 식염수와 함께 접시에 "D") (PBS). 4 ° C에서 출력 및 저장 건조되는 것을 방지하기 위해 파라 필름과 판을 밀봉합니다.
피지 소프트웨어를 사용하여 시간 경과 영화의 4 세대
참고 : 우리는 다른 상용 및 무료 소프트웨어 패키지가 ZenBlue, MetaMorph로부터, ICY, ImagePro 또는 ImageJ에 포함 시간 경과 현미경 이미지를 처리 할 수 있음을 유의하십시오. 여기에서 우리는 오픈 소스 영상 처리 ImageJ에 기반으로 프로그램 및있는 이미 유용한 사전 설치된 플러그인을 제공합니다이다 피지에 초점을 맞 춥니 다.
- 피지가 설치되어있는 컴퓨터로 시간 경과 실험에서 전송 영상 데이터입니다.
- 프로그램을 실행 및 사용하여 이미지 파일을 가져옵니다# 34; 파일> 가져 오기> 바이오 형식 ". 또는에서 단순히 피지로 이미지 파일을 드래그하여"바이오 형식 가져 오기 옵션 각 조명 채널에 대한 별도의 이미지 스택을 얻기 위해 분할 채널 ""확인란을 선택 "(DIC , RFP, YFP).
- 옵션 : (DIC, RFP, YFP 각 채널에 의한 재 초점 (단계 3.9)에 이미지 수집에서의 휴식으로 인한 별도의 시계열을 병합 각각의 이미지 스택을 열고 실행 "이미지> 스택> 도구> 연결하여"하려면 ).
- 화상 스택 스크롤하여 저속 데이터의 품질을 평가한다. 시간이 지남에 초점에 머물렀다 균사, 쇼 균사 생장을 찾아 결국 포자 (DIC 스택)을 형성한다. 각각 식물 또는 sporogenic 균사 (YFP 스택)에 하나의 고리 또는 여러 사다리 형 구조를 형성 균사 끝을 DivIVA-mCherry (RFP 스택)과 FtsZ-YPet의 예상 세포 내 현지화를 검사합니다.
- 다운 스트림 플라스틱 가공에 대한 관심의 영역을 분리이미지의 NG. 시간 경과 현미경은 종종 피지에 의해 처리 속도가 느려질 수 있습니다 큰 파일을 생성합니다. 이는 따라서 식별하고 ROI (region of interest)를 분리하고 화상 스택의 작은 버전이 상기 화상 처리 단계를 수행 할 것을 권장한다.
- 메뉴의 "사각형 선택"툴을 선택하고 현상 균사가 이미지 시리즈에 걸쳐 ROI 둘러싸인되는 방식으로 DIC 화상 스택 직사각형 ROI를 그린다.
- "Ctrl 키"+ "시프트"+ "D"와 ROI 스택 중복.
- YFP 이미지 스택의 이름 표시 줄을 클릭하고 "편집> 선택> 선택 복원"YFP 스택의 동일한 배치하기 위해서만 스택 원래 DIC부터 사각형 선택을 복원하고 "Ctrl 키"로 ROI를 복제하기 위해 메뉴에서 + "시프트"+ "D".
- RFP 스택에 대해이 과정을 반복합니다.
- 세 개의 이미지가 t 스택의 이미지를 맞 춥니 다오 시간이 지남에 xy 평면에서 무대 드리프트를 제거합니다. DIC 스택의 마지막 프레임에 스크롤 메뉴에서 "플러그인> 등록> StackReg> RigedBody"를 선택합니다. RFP와 YFP 이미지 스택에 대해이 단계를 반복합니다. 필요한 경우, 단계 4.5.1-4.5.3를 반복하여 투자 수익 (ROI)을 잘라.
- 옵션 : "> 프로세스 대비 강화" "밝기 및 대비 도구를 조정"( "Ctrl 키"+ "시프트"+ "C") 또는 선택 각 이미지 스택 수동으로 밝기와 대비를 조정 메뉴에서하고 "표준화"를 적용 스택의 모든 이미지에 대한 명령. 이 후자의 명령 하류 화상 해석에 영향을 미칠 수 있으므로, 화소 값을 변경하고 것을 주목해야한다.
- 옵션 : 가로 또는 세로로 "이미지> 스택> 도구> 겸용"플러그인을 사용하여 (RGB 파일 형식으로 변환 4.11 참조) 개별 스택을 결합합니다.
- (한 번 스탬퍼 ( ">> 스케일 바 도구 분석") 규모 바 추가# 34; 이미지> 스택> 시간 스탬퍼 ").
- "티파니"형식의 이미지 시퀀스로 수정 된 이미지 스택을 저장합니다. 동영상을 제작하려면, "아비"로 저장합니다. 또한, "바이오 형식> 바이오 포맷 수출 '플러그인하고".MOV "파일 형식을 선택을 사용하여 QuickTime 포맷 수출 이미지 시리즈.
- 하나의 프레임에서 사진을 얻으려면 + "D"관심있는 프레임을 선택하고 이미지 "Ctrl 키"+ "시프트"중복. "이미지> 유형> RGB 색상 또는 8 비트"의 결과 이미지에 "RGB"또는 "8 비트"의 유형을 변경하고 "티파니"로 이미지를 저장합니다.
참고 : 피지 추가로 더 주석을 기능이나 처리 시간 경과 시리즈의 번호를 제공합니다. 자세한 내용은 (http://fiji.sc/Fiji) 피지 온라인 지원으로 이동합니다.
결과
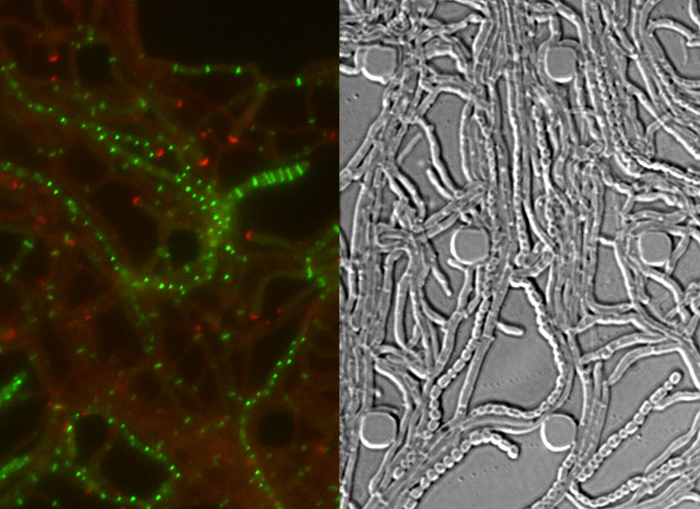
전체 S.의 성공적인 라이브 세포 이미징 venezuelae 라이프 사이클 발아, 식물의 성장과 포자 형성 (도 3, 영화 1)의 주요 발달 단계를 포함하는 연속 시계열을 산출한다. 수명주기를 통해 진행의 시각화는 더 DivIVA-mCherry 및 FtsZ-YPet의 별개의 세포 내 지역화에 의해 강화된다. 발아 및 식물 성장하는 동안, DivIVA-mCherry 독점적으로 성장 균사 조언, 새로 분기점을 (그림 4A)을 형성 마크에 축적한다. 이러한 결과는 DivIVA 12,26의 이전에보고 된 세포 내 위치와 일치한다. 반대로 FtsZ-YPet은 균사 성장 (도 4b)에 불규칙한 간격으로 단일 고리 형 구조를 형성한다. 이러한 구조는 interconn의 형성으로 이어지는 비 협착 식물 간 벽의 합성 지지체를 제공반사된다 균사 구획 8. sporogenic 균사로 균사 성장의 세포 분화가 극성 DivIVA-mCherry의 초점의 실종에 의해 표시되고, 극성 성장의 체포와 FtsZ-YPet 형광의 동반 증가 (그림 4C). 균사를 포자에서 FtsZ - YPet의 현지화 패턴이 크게 변화; 제 1 나선형 FtsZ-YPet 필라멘트는 균사 함께 공중제비 다음, 갑자기, 거의 동기 이벤트에서,이 나선 정기적 간격 FtsZ-YPet 반지의 사다리로 합체. 여기에 설명 된 실험 조건 하에서, 이들 고르게 분포 FtsZ-YPet 사다리 약 2 시간 동안 유지. 마지막으로, 포자의 격막은 미분 간섭 대비 (DIC) 이미지 (그림 4D) 결국 새로운 포자가 출시에 식별됩니다.
로 제공 피지 소프트웨어를 사용하여 화상 처리를 설명 후속 프로토콜 TEP 단계별 획득 시간 경과 시리즈 (동영상 1)에서 게시를 위해 동영상을 제작하는 방법을 설명합니다.
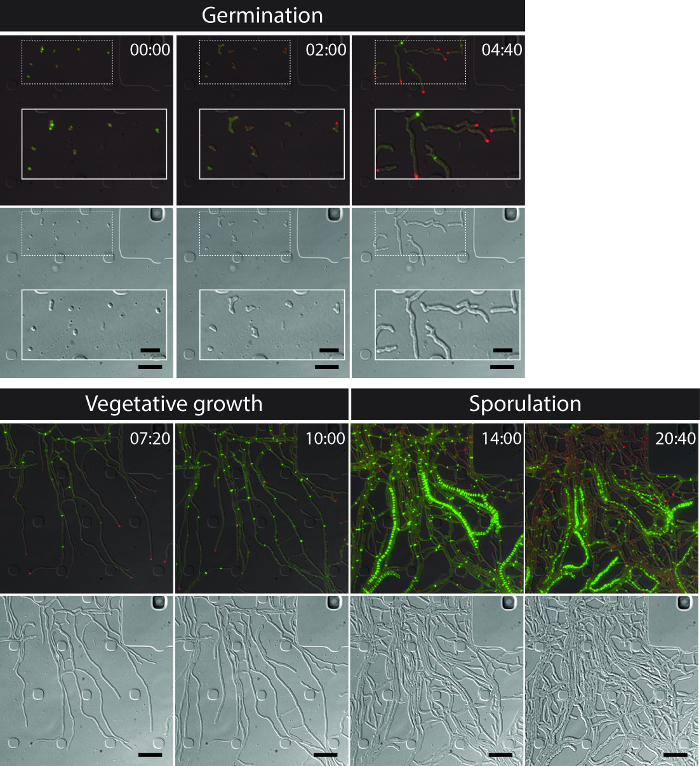
그림 3 : S.의 대표 시간 경과 형광 현미경 시리즈에서 스냅 샷 이미지 venezuelae 생산 형광 표지 FtsZ (녹색) 및 DivIVA (적색) 병합 된 이미지의 선택된 프레임이 보이고있는 바와 같다 (상단 패널 : RFP-YFP-DIC, 하단 패널 : DIC). 발아, 식물의 성장과 포자를 포함하여 스트렙토 마이 세스 라이프 사이클을 시각화. 이미지가 영화 1 시간에서 찍은이 시간에 : 분. 스케일 바 = 5 μm의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
D / 53863 / 53863fig4.jpg "/>
그림 4 : 스트렙토 마이 라이프 사이클의 성공적인 시간 경과 시리즈의 대표 결과 DivIVA-mCherry의 (A) 버전.. RFP 및 DIC 채널의 병합 된 이미지와 함께 영화 1에서 두 개의 연속적인 시간 지점의 스냅 샷을 보이고있는 바와 같다. DivIVA-mCherry 새로운 균사 분기 사이트 (채워진 화살표 머리)를 표시하고 극성 성장 (오픈 화살표 머리)를 지시하는 균사의 끝에 지역화. 스케일 바 = 10 식물 성장 (화살표 머리) 동안 μm의 (B) FtsZ-YPet 현지화. FtsZ-YPet은 (DIC, 낮은 패널)을 수축하지 않는 하나의 고리 형 구조 (상판)를 형성한다. 포자의 격막시 (C) FtsZ-YPet (녹색) 지역화. (: 분 시간) DivIVA-mCherry의 초점은 아래에 묘사 된 경과 시간, 빨간색으로 표시됩니다. 스케일 바 : 5 μm의. (C)에서 포자의 균사의 DIC 이미지를 대응 (D) 양식을 보여주는결국 포자의 체인 (오른쪽 이미지)로 성숙 볼 수 포자 격막 (왼쪽 이미지)와 prespore 구획의 ATION. 시간은 시간에 : 분. 스케일 바 = 5 μm의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
영화 1 : 라이프 사이클 venezuelae 스트렙토 마이 세스 (Streptomyces)의 시간 경과 형광 현미경 시리즈 영화가 병합 된 RFP-YFP 이미지 (왼쪽)와 해당 미분 간섭 대비 (DIC) 이미지 (오른쪽)으로 구성되어 있습니다.. DivIVA-mCherry 녹색에서 빨간색과 FtsZ - YPet에 표시됩니다. 단일 프레임 사이의 시간 간격은 40 분이다. 스케일 바 = 10 μm의. 생을 보려면 여기를 클릭하십시오의 영화.
토론
스트렙토 마이 세스 (Streptomyces) 수명주기의 시간 경과 현미경은 과거에 기술적으로 도전하고있다. 여기에서는 (도 2)를 시각화하고 개발 과정을 통해 진행을 추적 할 수 있도록 셀 극성 마커 DivIVA 및 세포 분열 단백질 FtsZ에 형광 단백질 융합체를 사용하여 전체 라이프 사이클의 라이브 세포 이미징을 수행하기 위해 강력한 프로토콜을 제시한다.
이 방법의 핵심은 S.의 재배입니다 (MYM-TE을 보냈다) 소비 매체와 일정한 매체 관류 정상적인 성장 매체 (MYM-TE)의 교환을 할 수있는 미세 유체 장치에 venezuelae. 배양 조건의 변화는 영양이 풍부한 매체의 지속적인 공급이 식물 growt을 자극하는 반면, 포자 형성을 촉진하기 때문에 폐 배지에서 어떤 아직 알 수없는 세포 외 신호로 우물 (예 : 쿼럼 센싱 신호)로 영양 하향 변속 설명 프로토콜 중요하다거의 모든 포자 형성 시간 (데이터는 보이지 않음). 따라서,이 마이크로 유체 시스템의 세포를 배양하는 실험 더 유연성을 제공하며, 배양 조건의 변화에 따라 변화 세균 성장을 장기간 모니터링을 허용하므로, 아가 로스에 세포를 배양 우수하다. 미세 플레이트를 하나의 사용을 위해 설계되지만 단지 이후 실험에 이용 될 수있는 셀을 접종하지 않은 채널을 흐른다. 우리는 긴 시간을 위하여 개방 된 판에 매니 폴드를 밀봉 문제를 경험으로 우리는 주일 이내에 미세 유체 플레이트의 모든 채널을 사용하는 것이 좋습니다.
실험 설정하면, 우리는 생식 관 (데이터 미도시) 출현 전에 냉동 글리세롤 스톡으로부터 유도 포자는 적어도 6 시간 필요한 반면, 새로 제조 된 포자가 유동 챔버로 로딩되는 두 시간 내에 발아하였습니다. 발아의 이러한 지연은 실험의 길이 연장을 방해 할장비의 가용성 및 실험 조건. 이 세균 튜브 개발 및 생장에 충분한 영양분을 제공하기 위해 적어도 3 시간 동안 MYM-TE의 재관류로 실험을 시작하는 것이 중요하다. 실험은 식물의 성장을 연구 설계된다면 MYM-TE와 관류 초기 3 시간 이상 확장 할 수있다. 포자 출발 물질 선호를 제공하는 반면, 짧은 균사 단편은 미세 플레이트에 장착 될 수있다. 그러나, 전단 균사체를 이용하여 적재 효율이 낮은 중요하다 종종 비 포자 돌연변이를 검사 할 때 제한을 제시 할 수있다 여러로드 실행이 필요합니다. 에 관계없이 사용 접종의 종류, 미디어의 확산을 방해하고 이미지 분석을 복잡하게 할 수 급속한 인구 과잉으로 이어질 것입니다이 같은 포자 또는 균사 조각과 문화 실에 과부하를하지 않는 것이 중요합니다.
이 기자 단백질의 구조를 계획하는 것이 중요합니다 carefu에서야 베드로 스트렙토 마이 세스 (Streptomyces)에서 형광 시간 경과 영상에 사용. 표적 단백질과 형광 리포터 및 N- 또는 C- 말단 융합체의 선택 사이의 링커의 길이는 매우 중요 할 수있다. 또한, 촬상 주파수 및 노출 시간을 포함하여 최적의 실험 조건은, 각각의 형광 표지 된 단백질을 미리 결정되어야한다. S.을 낮은 수준으로 발현되는 형광 표지 된 단백질을 이미징 할 때 문제가 될 수 있습니다 녹색 / 노란색 채널 venezuelae 균사 전시 자동 형광. 또한,이 발아 및 식물 성장의 초기 단계에서, S. 동안 주목해야한다 venezuelae 짧은 파장 광 (예 CFP로 융합 단백질을 사용하는 경우)에 특히 민감하다.
박테리아의 라이브 세포 이미징을위한 이미징 기술 및 형광 리포터 시스템의 연속 발전에도 불구하고, 소프트웨어 패키지의 대부분 (예 MicrobeTracker, Schnitzelc데이터 세트의 이러한 종류의 후속 처리를위한 자동 학습 학생, CellProfiler)는 다세포 라이프 스타일 27-29으로 사상균 유래의 영상 분석을 지원하지 않는다. 따라서, 스트렙토 다른 사상균로부터 촬상 데이터의 정량적 고 처리량 분석에 적합한 알고리즘을 개발하는 것이 필요하다.
요약하면, 여기에 설명 된 작업은 S.의 엄청난 잠재력을 보여줍니다 때문에 액체에 sporulate 할 수있는 능력의 속을위한 새로운 모델 개발 시스템으로 venezuelae. 미세 유체 배양 장치는 경험이없는 사용자도 사용하기 간단합니다. 그것은 동적 단백질 지역화, 편광 성장, 그리고 unigenomic 포자의 체인에 다세포 균사의 형태 분화를 포함하여 스트렙토 마이 라이프 사이클에 중앙 세포 생물학적 과정을 연구 할 수있는 훌륭한 플랫폼을 제공합니다. 또한이 실험 유를 설정P은 또한 펩티도 글리 칸 합성 또는 프로피 듐 요오다 이드 및 4를 모니터링하는 형광 D 아미노 산 '6 diamidino -2- 페닐 인돌 등의 배양 조건을 교대 필요한 개발 이벤트 또는 형광 염료의 사용을 조사 유혹 시작점을 제공 (DAPI)는 염색체 조직 (30, 31)를 시각화합니다.
공개
The authors have nothing to disclose.
감사의 말
The authors thank Grant Calder for technical assistance with the microscope, Matt Bush for comments on the protocol, and the John Innes Centre for purchase of the Zeiss widefield microscope. This work was funded by BBSRC grant BB/I002197/1 (to M.J.B), by BBSRC Institute Strategic Programme Grant BB/J004561/1 to the John Innes Centre, by Swedish Research Council grant 621-2010-4463 (to K.F.), and by a Leopoldina Postdoctoral Fellowship (to S.S.).
자료
| Name | Company | Catalog Number | Comments |
| B04A CellAsic ONIX plate for bacteria cells | Merck-Millipore | B04A-03-5PK | Microfluidic culture plates |
| CellAsic ONIX Microfluidic Perfusion System and ONIX FG (version 5.0.2) | Merck-Millipore | EV-262 | The latest ONIX vesion (July 2015) and instructions on how to use the programme can be found here: http://www.merckmillipore.com |
| Axio Observer.Z1 Microscope | Zeiss | 431007-9902-000 | Fully automated and motorized inverted widefield microscope |
| Incubator XL multi S1 with Temperature Module S1 and Heating unit XL S2 | Zeiss | 411857-9061-000 | Environmental chamber surrounding the microscope |
| Plan-Apochromat 100x/1.46 Oil DIC objective | Zeiss | 420792-9800-000 | |
| Ocra FLASH 4 V2 | Hamamatsu Photonics K.K. | C11440-22CU | |
| Illuminator HXP 120V | Zeiss | 423013-9010-000 | |
| FL Filter Set 46 HE YFP shift free | Zeiss | 489046-9901-000 | Fluorescent filter set, excitation 500/25 nm, emission 535/30 nm |
| FL Filter Set 63 HE RFP shift free | Zeiss | 489063-0000-000 | Fluorescent filter set, excitation 572/25 nm, emission 629/30 nm |
| Mounting frame K-M for multiwell plates | Zeiss | 000000-1272-644 | Stage holder for microfluidic plate |
| ZEN pro 2012 | Zeiss | 410135-1002-120 | Microscope control software |
| ZEN Module Time Lapse | Zeiss | 410136-1031-110 | Software module to set up time-lapse microscopy experiments |
| ZEN Module Tiles/Positions | Zeiss | 410136-1025-110 | Software module to save specific stage positions (xzy) |
| Fiji | open-source software package | http://fiji.sc/Fiji | Generation of time-lapse movies |
| Maltose-Yeast Exctract-Malt Extract (MYM) 4 g Maltose 4 g Yeast extract 10 g Malt extract add 1 L H2O using 50 % tap water and 50 % reverse osmosis water and supplement with 200 ml of R2 trace element solution per 100 ml after autoclaving | Sporulation medium used to culture S. venezuelae SV60 | ||
| R2 Trace element solution (TE) 8 mg ZnCl2 40 mg FeCl3-6H2O 2 mg CuCl2-2H2O 2 mg MnCl2-4H2O 2 mg Na2B4O7-10H2O 2 mg (NH4)6Mo7O24-4H2O add 200 ml H2O Autoclave and store at 4 oC | Add 0.002 volumes to MYM | ||
| PBS (phosphate buffered saline) | Sigma | P4417-100TAB | Used to refill inlet wells of unused lanes in B04A plates in order to prepare plate for short-term storage. |
| 0.22 µm syringe filters | Satorius stedim | 16532-K | Preparation of spent MYM-TE |
| SV60 | John Innes Centre strain collection | S. venezuelae strain expressing divIVA-mcherry and ftsZ-ypet |
참고문헌
- Bush, M. J., Tschowri, N., Schlimpert, S., Flärdh, K., Buttner, M. J. c-di-GMP signalling and the regulation of developmental transitions in streptomycetes. Nat. Rev. Microbiol. 13, 749-760 (2015).
- Jakimowicz, D., van Wezel, G. P. Cell division and DNA segregation in Streptomyces.: how to build a septum in the middle of nowhere?. Mol. Microbiol. 85, 393-404 (2012).
- McCormick, J. R., Flärdh, K. Signals and regulators that govern Streptomyces development. FEMS Microbiol. Rev. 36, 206-231 (2012).
- Flärdh, K., Richards, D. M., Hempel, A. M., Howard, M., Buttner, M. J. Regulation of apical growth and hyphal branching in Streptomyces. Curr. Opin. Microbiol. 15, 737-743 (2012).
- Hempel, A. M., et al. The Ser/Thr protein kinase AfsK regulates polar growth and hyphal branching in the filamentous bacteria Streptomyces. Proc. Natl. Acad. Sci. U S A. 109, E2371-E2379 (2012).
- Fuchino, K., et al. Dynamic gradients of an intermediate filament-like cytoskeleton are recruited by a polarity landmark during apical growth. Proc. Natl. Acad. Sci. U S A. 110, E1889-E1897 (2013).
- Holmes, N. A., et al. Coiled-coil protein Scy is a key component of a multiprotein assembly controlling polarized growth in Streptomyces. Proc. Natl. Acad. Sci. U S A. 110, E397-E406 (2013).
- McCormick, J. R., Su, E. P., Driks, A., Losick, R. Growth and viability of Streptomyces coelicolor. mutant for the cell division gene ftsZ. Mol. Microbiol. 14, 243-254 (1994).
- Margolin, W. FtsZ and the division of prokaryotic cells and organelles. Nat. Rev. Mol. Cell Biol. 6, 862-871 (2005).
- Grantcharova, N., Lustig, U., Flärdh, K. Dynamics of FtsZ assembly during sporulation in Streptomyces coelicolor A3(2). J. Bacteriol. 187, 3227-3237 (2005).
- Richards, D. M., Hempel, A. M., Flärdh, K., Buttner, M. J., Howard, M. Mechanistic basis of branch-site selection in filamentous bacteria. PLoS Comput. Biol. 8, e1002423 (2012).
- Hempel, A. M., Wang, S. B., Letek, M., Gil, J. A., Flärdh, K. Assemblies of DivIVA mark sites for hyphal branching and can establish new zones of cell wall growth in Streptomyces coelicolor. J. Bacteriol. 190, 7579-7583 (2008).
- Wolanski, M., et al. Replisome trafficking in growing vegetative hyphae of Streptomyces coelicolor A3(2). J. Bacteriol. 193, 1273-1275 (2011).
- Jyothikumar, V., Tilley, E. J., Wali, R., Herron, P. R. Time-lapse microscopy of Streptomyces coelicolor.growth and sporulation. Appl. Environ. Microbiol. 74, 6774-6781 (2008).
- Willemse, J., Borst, J. W., de Waal, E., Bisseling, T., van Wezel, G. P. Positive control of cell division: FtsZ is recruited by SsgB during sporulation of Streptomyces. Genes. Dev. 25, 89-99 (2011).
- Glazebrook, M. A., Doull, J. L., Stuttard, C., Vining, L. C. Sporulation of Streptomyces venezuelae. in submerged cultures. J. Gen. Microbiol. 136, 581-588 (1990).
- Bibb, M. J., Domonkos, A., Chandra, G., Buttner, M. J. Expression of the chaplin and rodlin hydrophobic sheath proteins in Streptomyces venezuelae.is controlled by sigma(BldN) and a cognate anti-sigma factor, RsbN. Mol. Microbiol. 84, 1033-1049 (2012).
- Al-Bassam, M. M., Bibb, M. J., Bush, M. J., Chandra, G., Buttner, M. J. Response regulator heterodimer formation controls a key stage in Streptomyces development. PLoS Genet. 10, e1004554 (2014).
- Bush, M. J., Bibb, M. J., Chandra, G., Findlay, K. C., Buttner, M. J. Genes required for aerial growth, cell division, and chromosome segregation are targets of WhiA before sporulation in Streptomyces venezuelae. MBio. 4, e00684-e00613 (2013).
- Tschowri, N., et al. Tetrameric c-di-GMP mediates effective transcription factor dimerization to control Streptomyces development. Cell. 158, 1136-1147 (2014).
- Mirouze, N., Ferret, C., Yao, Z., Chastanet, A., Carballido-Lòpez, R. MreB-Dependent Inhibition of Cell Elongation during the Escape from Competence in Bacillus subtilis. PLoS Genet. 11, e1005299 (2015).
- Zopf, C. J., Maheshri, N. Acquiring fluorescence time-lapse movies of budding yeast and analyzing single-cell dynamics using GRAFTS. J. Vis. Exp. (e50456), (2013).
- Meniche, X., et al. Subpolar addition of new cell wall is directed by DivIVA in mycobacteria. Proc. Natl. Acad. Sci. U S A. 111, E3243-E3251 (2014).
- Donovan, C., Schauss, A., Kramer, R., Bramkamp, M. Chromosome segregation impacts on cell growth and division site selection in Corynebacterium glutamicum. PLoS One. 8, e55078 (2013).
- Rojas, E., Theriot, J. A., Huang, K. C. Response of Escherichia coli. growth rate to osmotic shock. Proc. Natl. Acad. Sci. U S A. 111, 7807-7812 (2014).
- Flärdh, K. Essential role of DivIVA in polar growth and morphogenesis in Streptomyces coelicolor A3(2). Mol. Microbiol. 49, 1523-1536 (2003).
- Sliusarenko, O., Heinritz, J., Emonet, T., Jacobs-Wagner, C. High-throughput subpixel precision analysis of bacterial morphogenesis and intracellular spatio-temporal dynamics. Mol. Microbiol. 80, 612-627 (2011).
- Young, J. W., et al. Measuring single-cell gene expression dynamics in bacteria using fluorescence time-lapse microscopy. Nat. Protoc. 7, 80-88 (2012).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7, R100 (2006).
- Kuru, E., Tekkam, S., Hall, E., Brun, Y. V., Van Nieuwenhze, M. S. Synthesis of fluorescent D-amino acids and their use for probing peptidoglycan synthesis and bacterial growth in situ. Nat. Protoc. 10, 33-52 (2015).
- Szafran, M., et al. Topoisomerase I (TopA) is recruited to ParB complexes and is required for proper chromosome organization during Streptomyces coelicolor. sporulation. J. Bacteriol. 195, 4445-4455 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유