Method Article
Флуоресцентная Покадровый Визуализация Complete
В этой статье
Резюме
Streptomyces are characterized by a complex life cycle that has been experimentally challenging to study by cell biological means. Here we present a protocol to perform fluorescence time-lapse microscopy of the complete life cycle by growing Streptomyces venezuelae in a microfluidic device.
Аннотация
Live-cell imaging of biological processes at the single cell level has been instrumental to our current understanding of the subcellular organization of bacterial cells. However, the application of time-lapse microscopy to study the cell biological processes underpinning development in the sporulating filamentous bacteria Streptomyces has been hampered by technical difficulties.
Here we present a protocol to overcome these limitations by growing the new model species, Streptomyces venezuelae, in a commercially available microfluidic device which is connected to an inverted fluorescence widefield microscope. Unlike the classical model species, Streptomyces coelicolor, S. venezuelae sporulates in liquid, allowing the application of microfluidic growth chambers to cultivate and microscopically monitor the cellular development and differentiation of S. venezuelae over long time periods. In addition to monitoring morphological changes, the spatio-temporal distribution of fluorescently labeled target proteins can also be visualized by time-lapse microscopy. Moreover, the microfluidic platform offers the experimental flexibility to exchange the culture medium, which is used in the detailed protocol to stimulate sporulation of S. venezuelae in the microfluidic chamber. Images of the entire S. venezuelae life cycle are acquired at specific intervals and processed in the open-source software Fiji to produce movies of the recorded time-series.
Введение
Стрептомицеты являются почвенные бактерии, которые характеризуются сложным циклом развития с участием морфологической дифференциации из многоклеточного, питательного удаляющее мицелия к покоящихся, unigenomic спор 1-3.
При благоприятных условиях роста, типичный Streptomyces Спора начинает прорастать путем экструдирования одного или двух ростовых трубок (рисунок 1). Эти трубки удлиняются расширением наконечника и расти в разветвленной сети гиф, известной как вегетативного мицелия. Полярный рост и ветвление гиф руководит существенной белковой DivIVA. Этот белок биспиральных является частью большого цитоплазматического комплекса называется polarisome, что очень важно для вставки новой ячейки материала оболочки при удлинительной наконечника 4-7. Во время вегетативного роста, гифов стали разобщенным по нечастым образованию так называемых поперечных стенок 8. Формирование этих поперечных стенок повторно п.л. FtsZ, тубулина, как цитоскелета белок , который необходим для деления клеток в большинстве бактерий 9. В Streptomyces, однако, эти вегетативные поперечные стенки не приводят к сократительной и межклеточной разделения и , следовательно , мицелия масса остается как сеть взаимосвязанных синцитиального отсеков. В ответ на ограничение питательных веществ и других сигналов , которые не до конца понятны, специализированные антенны гифы отрываться от вегетативного мицелия и расти в воздух 3. Возведение этих структур инициирует репродуктивную фазу развития, в ходе которого долго мульти-геномных антенны гифы разделился на десятки одинаковых по размеру unigenomic prespore отсеков. Это массовое событие деление клеток приводится в движение синхронным сужением нескольких FtsZ колец в пределах одного спорогенной гиф 2,10. Морфологические дифференциация завершается выпуском покоящихся, толстостенные, пигментных спор.
т "ВОК: Keep-together.within-страница =" 1 ">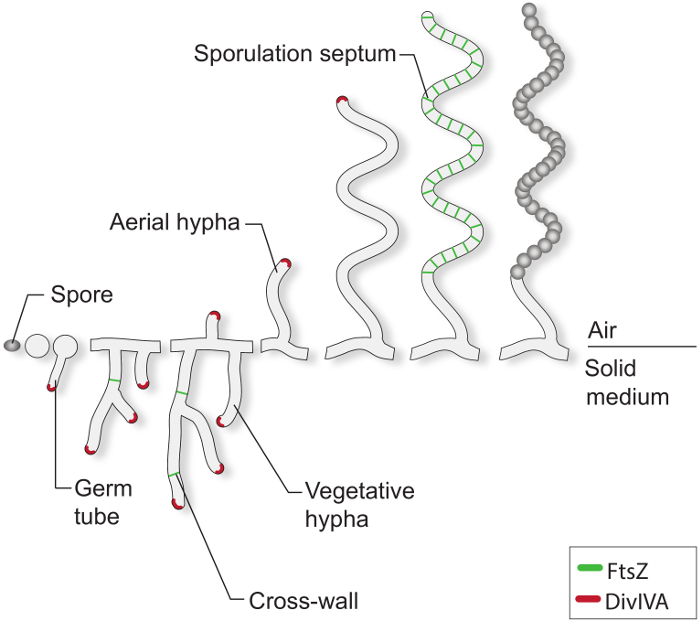
Рисунок 1:. Streptomyces жизненного цикла на твердых средах Это модель жизненного цикла на основе классических исследований С. coelicolor произрастающих на чашках с агаром. Клеточный развитие споровой начинается с образованием одного или двух ростовых трубок, которые растут в расширительном наконечника, чтобы сформировать сеть ветвления гиф. Полярный рост и ветвление вегетативных гиф направляется DivIVA (красный). Формирование вегетативных поперечных стен требует FtsZ (зеленый). В ответ на ограничения питательных веществ и других сигналов, воздушные гифы возводятся. Арест воздушного роста тесно координироваться с монтажом лестницы из FtsZ колец, которые приводят к спорообразования перегородками, что полочкам в спорогенной гифы в коробчатых prespore отсеков. Эти отсеки собрать толстую спорами стену и в конечном итоге releaСЭД, как зрелые пигментные споры.
Ключевые события развития жизненного цикла Streptomyces хорошо охарактеризованы 1,3. Однако то, что до сих пор мало клеточные биологические исследования, которые используют флуоресцентную покадровой микроскопии обеспечить понимание субклеточных процессов, лежащих в основе дифференциации, таких как динамика локализации белка, движение хромосом и онтогенетически контролируемого клеточного деления. Live-ячейки изображения развития Streptomyces является сложной задачей из - за сложности жизненного цикла и физиологических особенностей организма. Предыдущие исследования вегетативного роста и начальные стадии спорообразования перегородок использовали кислород проницаемой камеры томографию или рост агарозы при поддержке из Streptomyces coelicolor на предметное стадии 11-15. Эти методы, однако, ограничены рядом факторов. Некоторые системы позволяют только кратковременное визуализации клеточного роста апD флуоресцентные белки до клетки страдают от недостаточного снабжения кислородом или вырастают из фокальной плоскости из-за трехмерной модели развития гиф. В тех случаях, когда долгосрочное отображение возможно, культивирование клеток на границах агарозы колодки экспериментальную гибкость, потому что клетки не могут подвергаться воздействию альтернативных роста или стрессовых условиях, а фон флуоресценции от среды в агарозном колодки резко ограничивает возможность контролировать более слабую флуоресцентную сигналы.
Здесь мы опишем протокол для живых клеток визуализации жизненного цикла полных Streptomyces с отличной точностью и чувствительностью. Выращивая Streptomyces в микрожидком устройства , подключенного к флуоресцентным микроскопом Widefield (рисунок 2), теперь мы можем контролировать всхожесть, вегетативный рост и споруляции перегородок в течение периода времени до 30 часов. Это в значительной степени способствует использованию новых Streptomyces модельного организма venezuelae , потому что он спорулирует почти до завершения в погруженной культуре и тем самым преодолевает ограничение классического вида модели S. coelicolor, который спорулирует только на твердых средах 16-20. Для того, чтобы помочь визуализировать вегетативный рост и спорообразование, мы совместно выражают флуоресцентно меченый версии клеточной полярности маркера DivIVA и ключевого белка клеточного деления FtsZ.
Мы используем коммерчески доступного микрожидкостных устройство , которое успешно применяется для микобактерий, кишечной палочки, Corynebacterium glutamicum, Сенная палочка и дрожжи 21-25. Система улавливает клеток в одной фокальной плоскости и позволяет контролировать непрерывной перфузии культуральной среды из различных резервуаров. В подробном протоколе мы воспользоваться этой функцией , чтобы выставить S. venezuelae вегетативный мицелий к пищевой пониженную для содействия споруляцию.
Протокол десана для живых клеток визуализации всего жизненного цикла Streptomyces, но условия альтернативных средств массовой информации или настройки микроскопа могут быть выбраны , если определенные этапы развития, представляют особый интерес.
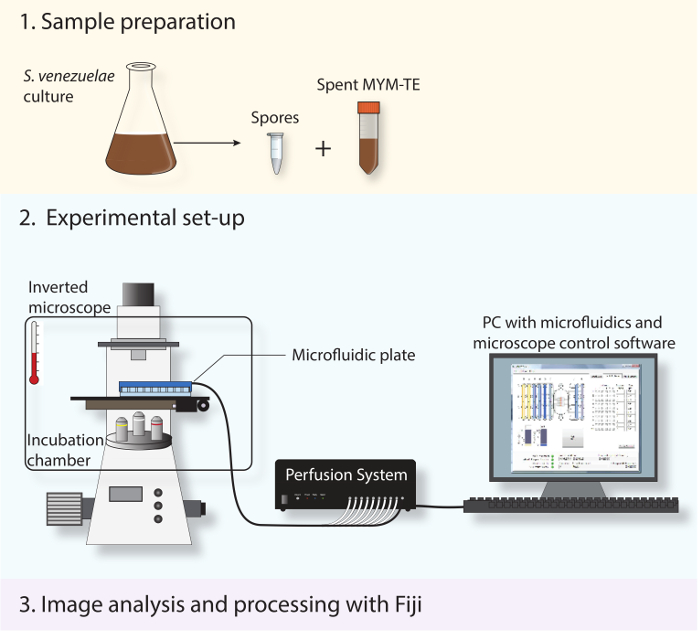
Рисунок 2: Схема с изображением экспериментальной работы потока. Три основные шаги, описанные в протоколе показаны. Во-первых, споры и отработанными среда получают из стационарной фазы культуры. Во- вторых, свежие спорами загружаются в микрожидком систему и S. venezuelae проецируется на протяжении всей своей развития жизненного цикла с использованием полностью автоматизированный инвертированный микроскоп с инкубационным камеры для поддержания оптимальной температуры роста. В-третьих, ряд покадровой, полученный анализируется и обрабатывается с использованием открытого программного обеспечения на Фиджи.
протокол
1. Выделение S. Fresh venezuelae Spores и подготовка отработавшим культуральной среде
- Привить 30 мл мальтоза-дрожжевой экстракт-солодовый экстракт (MYM) среде, с добавлением 60 мкл R2 раствора с микроэлементами (TE), с 10 мкл спор штамма SV60 [attB ф BT1 :: pSS209 (P divIVA - divIVA-mcherry P FtsZ -ftsZ-ypet)]. Для последовательного роста и спорообразования клеток, используют перегородками колбу или колбу, содержащую пружину для обеспечения достаточной аэрации.
- Культуры клеток в течение 35-40 ч при температуре 30 ° C и 250 оборотов в минуту.
- Осмотрите клетки конными жидкой фазово-контрастной микроскопии. На этом этапе фрагменты мицелия и споры будут видны.
- Центрифуга 1 мл клеток в настольной центрифуге при 400 мкг в течение 1 мин для осаждения мицелий и более крупные клеточные фрагменты.
- Передача приблизительно 300 мкл супернатанта COntaining суспензии спор на новый 1,5 мл трубки и держать на льду. Держите оставшуюся питательную среду для стадии 1.7.
- Развести спорами 1:20 в MYM-TE (конечная концентрация: 0,5-5 х 10 7 спор / мл) и держать на льду до тех пор , пока это необходимо (см шаг 2.3).
Примечание: Хотя точные условия , которые вызывают споруляцию в Streptomyces не поняты, используя истощенной средой MYM-TE, включая любые неизвестные внеклеточных сигналов от спорообразующих культуры, стимулирует споруляцию. - Фильтр-стерилизовать 10 мл оставшейся культуральной среды для получения отработавшего MYM-TE, свободной от спор и мицелия фрагментов. Используйте стерильный шприц 0,22 мкм фильтр и перенос провел MYM-TE в стерильный 15 мл трубки.
- Держите подготовленный проведенное MYM-TE в течение нескольких дней при температуре 4 ° С, если дополнительные эксперименты с использованием аналогичных условий роста должны быть проведены.
2. Подготовка микрожидкостных устройств
Примечание: Каждый микрожидкостных плаТЕ позволяет до четырех независимых экспериментов, которые будут проводиться. Во избежание загрязнения неиспользованных проточных камер, использовать стерильные растворы и условия работы при настройке эксперимента.
- Удалить доставки раствора из микрожидком пластины и промыть лунки стерильной MYM-TE.
- Добавить 300 мкл MYM-TE к входному отверстию и 1 и 300 мкл, затрачиваемое MYM-TE в лунки 2 до 6.
- Нагрузка 40 мкл разбавили спор со стадии 1.6 в ячейку загрузки скважины 8 полосы движения "А" и запечатать многообразие к пластине согласно инструкции производителя.
- Запустите программу управления микрофлюидики, выберите соответствующий тип плиты и установить программу потока для простого канала потока и культуры камере протекающей среды из впускных скважин от 1 до 5 в 6 фунтов на квадратный дюйм в течение 2 мин на лунку.
- В программном обеспечении управления микрофлюидики, создать потоковый протокол для эксперимента: пропуская MYM-TE от впускного скважины 1 в течение 6 часов, чтобы позволить для прорастания и вегетативного роста клеток. переключательзатем перфузией отработанного MYM-TE от хорошо 2 до 5 в течение оставшегося времени эксперимента. В ходе эксперимента поддерживать постоянным давление потока в 6 фунтов на квадратный дюйм (что соответствует примерно 9 мкл среды / ч). Запустить программу потока после шага 3.5.
3. Установите микроскопа и Протокол Интерв
Примечание: Этот метод был реализован на полностью моторизованных и автоматизированной перевернутой Widefield микроскоп оснащен камерой sCMOS, металл-лампа, аппаратный автофокус, держатель для ступени 96-луночные планшеты и климатическую камеру.
- Предварительно нагреть климатическую камеру до 30 ° C заранее, для того, чтобы предотвратить проблемы с автофокусировкой после начала эксперимента. Время, необходимое зависит от камеры, окружающей среды, используемой, микроскопом и отопительной системы. Начните разогревать систему ночь перед экспериментом.
- Включите микроскопа и автоматизации микроскопии и управления Softwaчисло рейнольдса Использование высокой числовой апертурой (NA) цель иммерсионным для оптимального сбора сигналов и пространственным разрешением, например, 100X, 1,46 Н.А. нефти DIC цели. Выберите соответствующие фильтры и двухцветные зеркала для получения дифференциального интерференционного контраста (DIC) изображения и изображения желто-флуоресцентный и красно-флуоресцентных слитых белков.
- Поместите каплю иммерсионного масла на цель и добавить иммерсионной жидкости в нижней части окна изображения на пластине микрожидком улучшить клеточное фокус во время захвата изображения. Осторожно установите запечатанный микрожидкостных устройство (шаг 2.5) на стадии инвертированного микроскопа. Убедитесь, что пластина надежно закреплен в держателе ступени и не смещается в течение эксперимента.
- Откройте окно формирования изображения микрожидкостных культуры камеры в фокус, используя встроенные позиции маркеров для ориентации. Фокус на крайней левой части камеры первого потока (обозначенный «А») с размером ловушки 5, что соответствуетвысота ловушки 0,7 мкм.
- В программном обеспечении микрофлюидики, тензодатчики от впускного отверстия скважины 8 при 4 атм в течение 15 сек. Проверьте плотность клеток в культуре камере путем перемещения платформы поперек окна визуализации. Если ни один спор не попали в ловушку, повторите шаг нагрузки сотовой ячейки или в качестве альтернативы увеличения давления нагрузки и / или время, пока нужная плотность клеток не достигается (1-10 спор в окне изображения с 2,048 х 2,048 пикселей). Избегайте перегрузки культуральной камеры.
Примечание: Обычно мы используем размер ловушки 5 для визуализации Streptomyces, но мы также получили хорошие результаты с ловушкой размером 4 и 3. Обратитесь к руководству поставщика для получения дополнительных предложений по оптимизации процесса загрузки клеток. - Запустите программу потока в управления программным обеспечением от шага 2.5 и позволяют Микрожидкостных пластины к теплу-уравновешиваться в течение 1 часа на стадии микроскопа перед началом захвата изображения.
- В программном обеспечении управления микроскопом, создать многомерную приобретение взять мюltiple изображения на нескольких позициях этапе с течением времени:
- Для Autosave: указать каталог для автоматического сохранения файлов изображений.
- Для настройки освещения, определить оптимальные параметры освещения для каждой конкретной конструкции заранее. Для описанной эксперимента используют следующие времена экспозиции: DIC 150 мс, 250 мс YFP, RFP 100 мс.
- Для временных рядов данных: настройка временных рядов для получения изображений в нужных точках времени в последовательности. Для визуализации жизненного цикла S. venezuelae, выберите временной интервал 40 мин в течение периода 24 ч.
- Для позиций сцене и автоматической фокусировки: сканирование культуры камеры, перемещая позиции стадии и хранить этапе для каждой позиции формирования изображения, представляющего интерес. Убедитесь в том, что позиции одноступенчатый расположены достаточно обособленно, чтобы свести к минимуму фотообесцвечивание и phototoxicity.Typically использовать до 12 позиций. Запуск автоматической фокусировки обычной для каждого момента времени для коррекции медленного фокальной дрейфа. При наличии в программном обеспечении управления микроскопом, Установить стратегию автоматической фокусировки на «обновление локальной поверхности с помощью аппаратных средств автоматической фокусировки". После того, как Z-координаты выбранных позиций этапе проверяются, активировать аппаратную автофокусировку.
- Начало покадровой эксперимент в программном обеспечении управления микроскопом.
- Убедитесь, что все позиции стадии все еще находятся в центре внимания на более поздние моменты. Для экспериментов с покадровой работает в течение нескольких часов, мы иногда наблюдаем дрейф стадии даже при использовании автофокуса. Если позиции этапа должны быть переориентированы, остановить эксперимент в подходящий момент времени, настроить фокус и перезапустить эксперимент в течение заданного интервала времени формирования изображения (этап 3.7.3). См шаг 4.3 для того, как сцепить временных рядов.
- Остановка захвата изображения после 24-30 ч или когда гифы в интересующей нас области дифференцировались в спор (см серию изображений DIC). Остановка программы потока в программном обеспечении и разобрать микрожидкостных устройство.
- Подготовьте подержанные микрожидкостных пластины для кратковременного STOярости. Удалите оставшиеся MYM-TE и провел MYM-TE от скважины 1 до 6, пустой тратой хорошо 7 и нагрузки сотовой ячейки хорошо 8. В стерильных условиях, повторное заполнение используются колодцы полосы движения "А" и колодцы неиспользованных полос ( "В" "D") на пластинке с стерильном фосфатно-буферном солевом растворе (ФБР). Уплотнение плита с парафином, чтобы предотвратить его от высыхания и хранить при температуре 4 ° С.
4. Генерация ЗАМЕДЛЕННАЯ Фильмы Использование Фиджи Программное обеспечение
Примечание: Следует отметить, что различные пакеты коммерческих и свободного программного обеспечения доступны для обработки покадровой микроскопии изображений, включая ZenBlue, Metamorph, ледяная, ImagePRO или ImageJ. Здесь мы сосредоточимся на Фиджи, который является программа обработки изображений с открытым исходным кодом на основе ImageJ, и которая уже предоставляет ряд полезных предустановленных плагинов.
- Данные изображений Передача из вашего покадровой эксперимента к компьютеру, который установил Фиджи.
- Запустите программу и импортировать файл изображения с помощью &# 34; Файл> Импорт> Био-форматы ". Или просто путем перетаскивания файла изображения на Фиджи В" Био-форматов Параметры импорта ", установите флажок" Разделить каналы ", чтобы получить отдельный стек изображения для каждого канала освещения (ДВС-синдром , RFP, YFP).
- Необязательно: Чтобы объединить отдельные временные ряды в результате перерыва в в приобретении изображения из-за переориентацию (шаг 3.9), откройте соответствующие стеки изображения и запустить "Image> Стеки> Инструменты> Объединить" для каждого канала (DIC, RFP, YFP ).
- Оценка качества данных покадровой путем прокрутки стеков изображения. Посмотрите на гиф, которые остались в центре внимания в течение долгого времени, показывают роста мицелия и в конечном итоге формируют споры (DIC) стека. Изучить ожидаемую внутриклеточную локализацию для DivIVA-mCherry в гифальных наконечниками (стек RFP) и FtsZ-YPet образуя одиночные кольца или множественные, лестницы-подобные структуры в растительном или спорогенной гиф (стек YFP), соответственно.
- Изолировать области, представляющей интерес для нисходящего переработнг изображений. Покадровый микроскопии часто производит большие файлы, которые могут замедлить обработку Фиджи. Поэтому рекомендуется, чтобы идентифицировать и выделить область интереса (ROI) и для выполнения дальнейших шагов обработки изображений на этой уменьшенной версии стека изображения.
- Выберите "прямоугольное выделение" инструмент в меню и нарисуйте прямоугольную ROI в стеке изображения DIC таким образом, чтобы развивающиеся гифы охваченной ROI всей серии изображений.
- Дубликат ROI-стек с "Ctrl" + "Shift" + "D".
- Нажмите на название бара стека изображения YFP и выберите "Edit> Selection> Восстановить выбор" в меню, чтобы восстановить предыдущее прямоугольное выделение из исходного DIC стек к тому же positon в стеке YFP и дублировать ROI с "Ctrl" + "Shift" + "D".
- Повторите этот процесс для стека RFP.
- Совместите изображения в трех изображений стеки тO удалить стадии дрейфует в плоскости ху с течением времени. Выделите последний кадр в стеке DIC и выберите "Plugin> Регистрация> StackReg> RigedBody" из меню. Повторите этот шаг для ЗП и стека изображений YFP. При необходимости, обрезать ROI, повторяя шаг 4.5.1-4.5.3.
- Дополнительно: Отрегулируйте яркость и контрастность вручную для каждого стека изображений с "отрегулировать яркость и контрастность Tool" ( "Ctrl" + "Shift" + "C") или выберите "Process> Повышение контрастности" из меню и примените "Normalize" команда для всех изображений в стеке. Следует отметить, что последняя команда будет изменять значения пикселей и, следовательно, может повлиять вниз по течению анализа изображения.
- Дополнительно: Объединить отдельные стеки (преобразованные в формат RGB, см 4.11) по горизонтали или по вертикали, используя плагин "Image> Стеки> Инструменты> Объединить".
- Добавьте масштабную линейку ( "Анализ> Инструменты> Scale Bar") и времени штампа (&# 34; Image> Стеки> Время Стампер ").
- Сохранить измененные стеки изображений в виде последовательности изображений в формате ".tiff". Для создания фильма, сохранить как ".avi". В качестве альтернативы, серия экспорт изображений в формате QuickTime с использованием "Био-форматов> Био-форматы экспортер" плагин и выбрать ".mov" тип файла.
- Для получения изображений из отдельных кадров, выберите кадр интереса и дублировать изображение "Ctrl" + "Shift" + "D". Измените тип результирующего изображения на "RGB" или "8-бит" в разделе "Image> Type> цвета RGB или 8-бит" и сохранить изображение как ".tiff".
Примечание: Фиджи предлагает ряд дополнительных функций для дальнейшего аннотировать или серии процессов в заданный промежуток времени. Перейти на Фиджи онлайн-поддержки для получения детальной информации (http://fiji.sc/Fiji~~HEAD=pobj).
Результаты
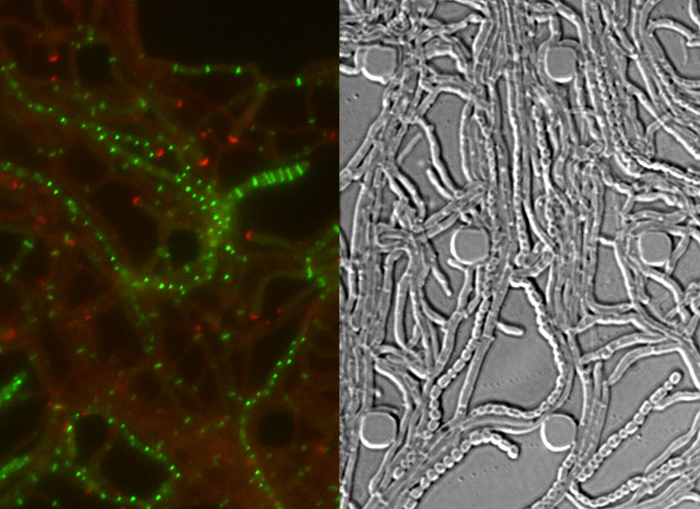
Успешное живых клеток визуализации всей S. venezuelae жизненный цикл дает непрерывный временной ряд , включая ключевые стадии развития всходов, вегетативного роста и спорообразования (рисунок 3, Movie 1). Визуализация прогрессии через жизненного цикла дополнительно повышается за счет отличной внутриклеточной локализации DivIVA-mCherry и FtsZ-YPet. Во время прорастания и вегетативного роста, DivIVA-mCherry исключительно накапливается в растущих кончиках гиф или меток формирующихся точек ветвления (рис 4а). Эти результаты согласуются с ранее представленными субклеточном позиционирования DivIVA 12,26. В противоположность этому , FtsZ-YPet образует одиночные кольцевые структуры с нерегулярными интервалами в растущем мицелия (рис 4В). Эти структуры обеспечивают каркас для синтеза без Констриктивные вегетативных поперечных стенок, что приводит к образованию Интерконected гифов отсеки 8. Клеточная дифференцировка выращивания гифы в спорогенной гиф становится видимым исчезновением полярных DivIVA-mCherry очагов, арест полярного роста и сопутствующее увеличение FtsZ-YPet флуоресценции (рис 4C). В спорообразующих гифы, локализация модель FtsZ-YPet резко меняется; Первые спиральные нити FtsZ-YPet падать вдоль гифы, а затем, в неожиданном, почти синхронном случае, эти спиралей сливаются в лестнице регулярно расположенных колец FtsZ-YPet. В экспериментальных условиях, описанных здесь, эти равномерно распределены FtsZ-YPet лестницы сохраняются в течение приблизительно 2 ч. И, наконец, споруляция перегородками становятся заметными в дифференциальный интерференционный контраст (DIC) изображений (рис 4D) и в конечном счете новые споры освобождены.
Последующий протокол, описывающий обработку изображений, используя программное обеспечение Fiji предусматривает ТЭП за шагом объяснение того, как создавать фильмы для публикации из приобретаемой серии покадровой (Фильм 1).
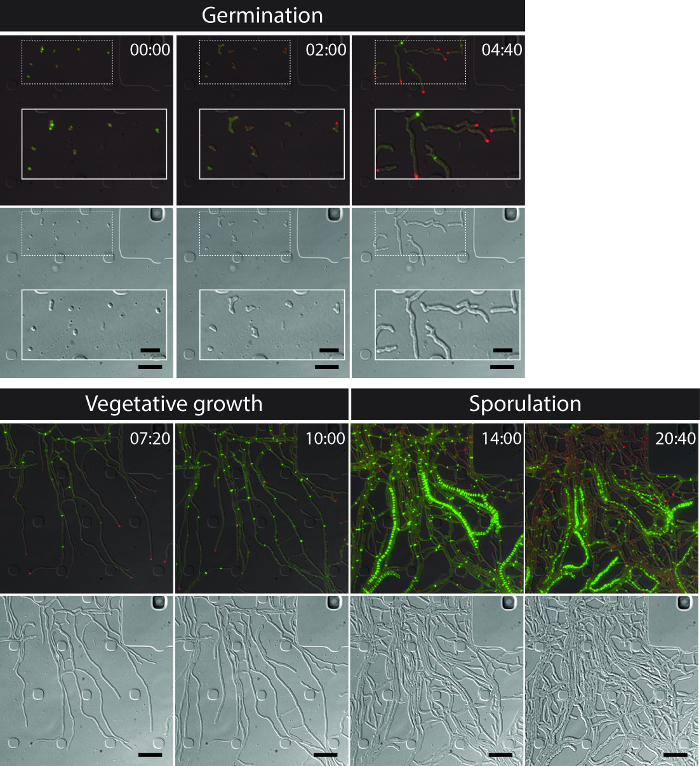
Рисунок 3: Снимок изображений с представителем покадровой флуоресцентной микроскопии серии S. venezuelae производства флуоресцентно меченных FtsZ (зеленый) и DivIVA (красный) Показаны выбранные кадры из слившихся изображений (верхняя панель: RFP-YFP-ДИК, нижняя панель: DIC). визуализируя жизненный цикл Streptomyces включая всхожесть, вегетативного роста и спорообразования. Изображения были взяты из фильма 1. Время в час: мин. Масштабные полоски = 5 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
d / 53863 / 53863fig4.jpg "/>
Рисунок 4: Представитель результаты для успешного покадровой серии Streptomyces жизненного цикла (A) Локализация DivIVA-mCherry.. Показаны снимки двух последующих временных точках из фильма 1 с объединенными изображениями ЗП и каналов DIC. DivIVA-mCherry отмечает новые сайты гиф ветвь (заполняется стрелка головы) и локализуется на верхушке гиф направить полярный рост (открытая голова стрелка). Шкала бар = 10 мкм (B) Локализация FtsZ-YPet во время вегетативного роста (стрелка головы). FtsZ-YPet образует одиночные кольцевые структуры (верхняя панель), которые не сжимают (DIC, нижняя панель). (C) FtsZ-YPet (зеленый) локализация во время спорообразования перегородок. DivIVA-mCherry фокусы показаны красным цветом, с истекшим временем, изображенном ниже (час: мин). Шкала бар: 5 мкм. (D) , ДИК - корреспондент образы спорообразующих гиф из (C) , показывающий формуданию prespore отсеков с видимым спорообразования перегородками (левое изображение), который в конечном итоге созревают в цепочку спор (справа изображение). Время в час: мин. Шкала бар = 5 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Фильм 1: Покадровый флуоресцентной микроскопии серия Streptomyces venezuelae жизненного цикла Фильм состоит из слившихся RFP-YFP изображений (слева) и соответствующего дифференциального интерференционного контраста (DIC) изображений (справа).. DivIVA-mCherry показано в красном и FtsZ-YPet в зеленом цвете. Временной интервал между кадрами составляет одиночными 40 мин. Шкала бар = 10 мкм. Пожалуйста , нажмите здесь , чтобы увидеть Тхиs кино.
Обсуждение
Покадровый микроскопия жизненного цикла Streptomyces был технически сложным в прошлом. Здесь мы представляем надежный протокол для выполнения живых клеток визуализации полного жизненного цикла с использованием флуоресцентного белка слитые полярности клеток маркера DivIVA и белка клеточного деления FtsZ , чтобы помочь визуализировать и отслеживать прогресс в рамках программы развития (рисунок 2).
Центральное место в этом методе является выращивание S. venezuelae в микрожидком устройство , которое позволяет постоянной среды перфузию и обмен нормального среднего роста (MYM-TE) с истощенной средой (отработавшим MYM-TE). Изменение состояния культуры имеет важное значение для описанного протокола , поскольку пищевые понижающей передачи , как колодцы , как и любой пока неустановленных внеклеточные сигналы (например , кворум зондирования сигналов) в отработанной культуральной среде, способствуют споруляцию, в то время как непрерывная подача питательной среде стимулирует вегетативную growtч с едва любой спорообразования (данные не показаны). Таким образом, культивировании клеток в этой системе микрожидком превосходит культивировании клеток на агарозы, поскольку он предлагает более экспериментальную гибкость и позволяет долгосрочный мониторинг изменений бактериального роста в ответ на изменение условий культивирования. Хотя Микрожидкостных пластины предназначены только для одноразового использования, поток каналы, которые не были инокулировали клетками могут быть использованы в последующих экспериментах. Мы рекомендуем использовать все каналы микрожидком пластины в течение недели, как мы столкнулись с проблемами герметизации коллектора на пластины, которые были открыты в течение более длительного времени.
При проведении эксперимента, мы обнаружили, что свежеприготовленные споры прорастали в течение двух часов, чтобы быть загружены в проточную камеру, в то время как споры, полученные из замороженного раствора в глицерине требуется, по меньшей мере 6 ч до того ростовых трубок появились (данные не показаны). Эта задержка прорастания удлиняют эксперимента и может создавать помехиналичие оборудования и условий эксперимента. Кроме того, важно, чтобы начать эксперимент с перфузией MYM-TE в течение не менее 3 ч, чтобы получить достаточное количество питательных веществ для развития и разрастания ростовых трубок. Перфузия с MYM-TE может быть расширен за пределы первоначальной 3 ч, если эксперимент предназначен для изучения вегетативного роста. В то время как споры обеспечивают предпочтительный выбор исходного материала, фрагменты короткого гифов также могут быть загружены в микрожидком пластину. Тем не менее, эффективность загрузки при использовании стриженой мицелий значительна ниже и часто требует несколько прогонов загрузки, которые могут представлять собой ограничение при рассмотрении не-спорообразующих мутантов. Вне зависимости от типа используемого посевного материала, важно не перегружать камеру культуры спорами или гиф фрагментов, так как это приведет к быстрой перенаселенности, которая может помешать распространению СМИ и усложняют анализ изображения.
Важно планировать строительство репортерных белков сторожныLLY для использования в флуоресцентной покадровой визуализации в Streptomyces. длина линкера между белком-мишенью и флуоресцентного репортера и выбора N- или С-концевых слитых конструкций может иметь решающее значение. Кроме того, оптимальные условия проведения эксперимента, включая частоту формирования изображения и времени экспозиции, должны быть определены заранее для каждого флуоресцентно-меченого белка. S. venezuelae гифы демонстрируют автофлуоресценции в зеленый / желтый канал , который может стать проблематичным при визуализации флуоресцентно меченого белка , который экспрессируется на низких уровнях. Кроме того, следует отметить , что, во время прорастания и начальной фазе вегетативного роста, S. venezuelae особенно чувствительна к коротковолновым светом (например , при использовании слитых белков в CFP).
Несмотря на непрерывные достижения в области методов визуализации и флуоресцентных систем репортер живых клеток визуализации бактерий, большинство программных пакетов (например , MicrobeTracker, Schnitzelcгезов, CellProfiler) для последующей автоматизированной обработки этих видов наборов данных не поддерживают анализ изображений , полученных из нитчатых бактерий с многоклеточного образа жизни 27-29. Таким образом, существует необходимость разработать подходящий алгоритм для количественного анализа с высокой пропускной способностью данных изображений из Streptomyces и других нитчатых бактерий.
Таким образом, работа , описанная здесь , демонстрирует огромный потенциал S. venezuelae в качестве новой модели системы развития для рода, из - за его способности в жидкости образуют споры. Микрожидкостных устройство Культивирование проста в использовании даже для неопытных пользователей. Это обеспечивает отличную платформу для изучения биологических процессов клеточных играющих центральную роль в жизненном цикле Streptomyces, в том числе динамической локализации белка, поляризованного роста и морфологической дифференциации многоклеточный мицелий в цепи unigenomic спор. Кроме того, этот экспериментальный комплект Uр также обеспечивает заманчивые отправной точкой для расследования событий в развитии , которые требуют чередующиеся условий культивирования, или использование флуоресцентных красителей , таких как люминесцентные D -аминокислот для мониторинга синтеза пептидогликана или пропидий йодида и 4 ', 6-диамидино-2-фенилиндола (DAPI) для визуализации хромосом организации 30,31.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
The authors thank Grant Calder for technical assistance with the microscope, Matt Bush for comments on the protocol, and the John Innes Centre for purchase of the Zeiss widefield microscope. This work was funded by BBSRC grant BB/I002197/1 (to M.J.B), by BBSRC Institute Strategic Programme Grant BB/J004561/1 to the John Innes Centre, by Swedish Research Council grant 621-2010-4463 (to K.F.), and by a Leopoldina Postdoctoral Fellowship (to S.S.).
Материалы
| Name | Company | Catalog Number | Comments |
| B04A CellAsic ONIX plate for bacteria cells | Merck-Millipore | B04A-03-5PK | Microfluidic culture plates |
| CellAsic ONIX Microfluidic Perfusion System and ONIX FG (version 5.0.2) | Merck-Millipore | EV-262 | The latest ONIX vesion (July 2015) and instructions on how to use the programme can be found here: http://www.merckmillipore.com |
| Axio Observer.Z1 Microscope | Zeiss | 431007-9902-000 | Fully automated and motorized inverted widefield microscope |
| Incubator XL multi S1 with Temperature Module S1 and Heating unit XL S2 | Zeiss | 411857-9061-000 | Environmental chamber surrounding the microscope |
| Plan-Apochromat 100x/1.46 Oil DIC objective | Zeiss | 420792-9800-000 | |
| Ocra FLASH 4 V2 | Hamamatsu Photonics K.K. | C11440-22CU | |
| Illuminator HXP 120V | Zeiss | 423013-9010-000 | |
| FL Filter Set 46 HE YFP shift free | Zeiss | 489046-9901-000 | Fluorescent filter set, excitation 500/25 nm, emission 535/30 nm |
| FL Filter Set 63 HE RFP shift free | Zeiss | 489063-0000-000 | Fluorescent filter set, excitation 572/25 nm, emission 629/30 nm |
| Mounting frame K-M for multiwell plates | Zeiss | 000000-1272-644 | Stage holder for microfluidic plate |
| ZEN pro 2012 | Zeiss | 410135-1002-120 | Microscope control software |
| ZEN Module Time Lapse | Zeiss | 410136-1031-110 | Software module to set up time-lapse microscopy experiments |
| ZEN Module Tiles/Positions | Zeiss | 410136-1025-110 | Software module to save specific stage positions (xzy) |
| Fiji | open-source software package | http://fiji.sc/Fiji | Generation of time-lapse movies |
| Maltose-Yeast Exctract-Malt Extract (MYM) 4 g Maltose 4 g Yeast extract 10 g Malt extract add 1 L H2O using 50 % tap water and 50 % reverse osmosis water and supplement with 200 ml of R2 trace element solution per 100 ml after autoclaving | Sporulation medium used to culture S. venezuelae SV60 | ||
| R2 Trace element solution (TE) 8 mg ZnCl2 40 mg FeCl3-6H2O 2 mg CuCl2-2H2O 2 mg MnCl2-4H2O 2 mg Na2B4O7-10H2O 2 mg (NH4)6Mo7O24-4H2O add 200 ml H2O Autoclave and store at 4 oC | Add 0.002 volumes to MYM | ||
| PBS (phosphate buffered saline) | Sigma | P4417-100TAB | Used to refill inlet wells of unused lanes in B04A plates in order to prepare plate for short-term storage. |
| 0.22 µm syringe filters | Satorius stedim | 16532-K | Preparation of spent MYM-TE |
| SV60 | John Innes Centre strain collection | S. venezuelae strain expressing divIVA-mcherry and ftsZ-ypet |
Ссылки
- Bush, M. J., Tschowri, N., Schlimpert, S., Flärdh, K., Buttner, M. J. c-di-GMP signalling and the regulation of developmental transitions in streptomycetes. Nat. Rev. Microbiol. 13, 749-760 (2015).
- Jakimowicz, D., van Wezel, G. P. Cell division and DNA segregation in Streptomyces.: how to build a septum in the middle of nowhere?. Mol. Microbiol. 85, 393-404 (2012).
- McCormick, J. R., Flärdh, K. Signals and regulators that govern Streptomyces development. FEMS Microbiol. Rev. 36, 206-231 (2012).
- Flärdh, K., Richards, D. M., Hempel, A. M., Howard, M., Buttner, M. J. Regulation of apical growth and hyphal branching in Streptomyces. Curr. Opin. Microbiol. 15, 737-743 (2012).
- Hempel, A. M., et al. The Ser/Thr protein kinase AfsK regulates polar growth and hyphal branching in the filamentous bacteria Streptomyces. Proc. Natl. Acad. Sci. U S A. 109, E2371-E2379 (2012).
- Fuchino, K., et al. Dynamic gradients of an intermediate filament-like cytoskeleton are recruited by a polarity landmark during apical growth. Proc. Natl. Acad. Sci. U S A. 110, E1889-E1897 (2013).
- Holmes, N. A., et al. Coiled-coil protein Scy is a key component of a multiprotein assembly controlling polarized growth in Streptomyces. Proc. Natl. Acad. Sci. U S A. 110, E397-E406 (2013).
- McCormick, J. R., Su, E. P., Driks, A., Losick, R. Growth and viability of Streptomyces coelicolor. mutant for the cell division gene ftsZ. Mol. Microbiol. 14, 243-254 (1994).
- Margolin, W. FtsZ and the division of prokaryotic cells and organelles. Nat. Rev. Mol. Cell Biol. 6, 862-871 (2005).
- Grantcharova, N., Lustig, U., Flärdh, K. Dynamics of FtsZ assembly during sporulation in Streptomyces coelicolor A3(2). J. Bacteriol. 187, 3227-3237 (2005).
- Richards, D. M., Hempel, A. M., Flärdh, K., Buttner, M. J., Howard, M. Mechanistic basis of branch-site selection in filamentous bacteria. PLoS Comput. Biol. 8, e1002423 (2012).
- Hempel, A. M., Wang, S. B., Letek, M., Gil, J. A., Flärdh, K. Assemblies of DivIVA mark sites for hyphal branching and can establish new zones of cell wall growth in Streptomyces coelicolor. J. Bacteriol. 190, 7579-7583 (2008).
- Wolanski, M., et al. Replisome trafficking in growing vegetative hyphae of Streptomyces coelicolor A3(2). J. Bacteriol. 193, 1273-1275 (2011).
- Jyothikumar, V., Tilley, E. J., Wali, R., Herron, P. R. Time-lapse microscopy of Streptomyces coelicolor.growth and sporulation. Appl. Environ. Microbiol. 74, 6774-6781 (2008).
- Willemse, J., Borst, J. W., de Waal, E., Bisseling, T., van Wezel, G. P. Positive control of cell division: FtsZ is recruited by SsgB during sporulation of Streptomyces. Genes. Dev. 25, 89-99 (2011).
- Glazebrook, M. A., Doull, J. L., Stuttard, C., Vining, L. C. Sporulation of Streptomyces venezuelae. in submerged cultures. J. Gen. Microbiol. 136, 581-588 (1990).
- Bibb, M. J., Domonkos, A., Chandra, G., Buttner, M. J. Expression of the chaplin and rodlin hydrophobic sheath proteins in Streptomyces venezuelae.is controlled by sigma(BldN) and a cognate anti-sigma factor, RsbN. Mol. Microbiol. 84, 1033-1049 (2012).
- Al-Bassam, M. M., Bibb, M. J., Bush, M. J., Chandra, G., Buttner, M. J. Response regulator heterodimer formation controls a key stage in Streptomyces development. PLoS Genet. 10, e1004554 (2014).
- Bush, M. J., Bibb, M. J., Chandra, G., Findlay, K. C., Buttner, M. J. Genes required for aerial growth, cell division, and chromosome segregation are targets of WhiA before sporulation in Streptomyces venezuelae. MBio. 4, e00684-e00613 (2013).
- Tschowri, N., et al. Tetrameric c-di-GMP mediates effective transcription factor dimerization to control Streptomyces development. Cell. 158, 1136-1147 (2014).
- Mirouze, N., Ferret, C., Yao, Z., Chastanet, A., Carballido-Lòpez, R. MreB-Dependent Inhibition of Cell Elongation during the Escape from Competence in Bacillus subtilis. PLoS Genet. 11, e1005299 (2015).
- Zopf, C. J., Maheshri, N. Acquiring fluorescence time-lapse movies of budding yeast and analyzing single-cell dynamics using GRAFTS. J. Vis. Exp. (e50456), (2013).
- Meniche, X., et al. Subpolar addition of new cell wall is directed by DivIVA in mycobacteria. Proc. Natl. Acad. Sci. U S A. 111, E3243-E3251 (2014).
- Donovan, C., Schauss, A., Kramer, R., Bramkamp, M. Chromosome segregation impacts on cell growth and division site selection in Corynebacterium glutamicum. PLoS One. 8, e55078 (2013).
- Rojas, E., Theriot, J. A., Huang, K. C. Response of Escherichia coli. growth rate to osmotic shock. Proc. Natl. Acad. Sci. U S A. 111, 7807-7812 (2014).
- Flärdh, K. Essential role of DivIVA in polar growth and morphogenesis in Streptomyces coelicolor A3(2). Mol. Microbiol. 49, 1523-1536 (2003).
- Sliusarenko, O., Heinritz, J., Emonet, T., Jacobs-Wagner, C. High-throughput subpixel precision analysis of bacterial morphogenesis and intracellular spatio-temporal dynamics. Mol. Microbiol. 80, 612-627 (2011).
- Young, J. W., et al. Measuring single-cell gene expression dynamics in bacteria using fluorescence time-lapse microscopy. Nat. Protoc. 7, 80-88 (2012).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7, R100 (2006).
- Kuru, E., Tekkam, S., Hall, E., Brun, Y. V., Van Nieuwenhze, M. S. Synthesis of fluorescent D-amino acids and their use for probing peptidoglycan synthesis and bacterial growth in situ. Nat. Protoc. 10, 33-52 (2015).
- Szafran, M., et al. Topoisomerase I (TopA) is recruited to ParB complexes and is required for proper chromosome organization during Streptomyces coelicolor. sporulation. J. Bacteriol. 195, 4445-4455 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены