Method Article
Tam Floresans Zaman atlamalı Görüntüleme
Bu Makalede
Özet
Streptomyces are characterized by a complex life cycle that has been experimentally challenging to study by cell biological means. Here we present a protocol to perform fluorescence time-lapse microscopy of the complete life cycle by growing Streptomyces venezuelae in a microfluidic device.
Özet
Live-cell imaging of biological processes at the single cell level has been instrumental to our current understanding of the subcellular organization of bacterial cells. However, the application of time-lapse microscopy to study the cell biological processes underpinning development in the sporulating filamentous bacteria Streptomyces has been hampered by technical difficulties.
Here we present a protocol to overcome these limitations by growing the new model species, Streptomyces venezuelae, in a commercially available microfluidic device which is connected to an inverted fluorescence widefield microscope. Unlike the classical model species, Streptomyces coelicolor, S. venezuelae sporulates in liquid, allowing the application of microfluidic growth chambers to cultivate and microscopically monitor the cellular development and differentiation of S. venezuelae over long time periods. In addition to monitoring morphological changes, the spatio-temporal distribution of fluorescently labeled target proteins can also be visualized by time-lapse microscopy. Moreover, the microfluidic platform offers the experimental flexibility to exchange the culture medium, which is used in the detailed protocol to stimulate sporulation of S. venezuelae in the microfluidic chamber. Images of the entire S. venezuelae life cycle are acquired at specific intervals and processed in the open-source software Fiji to produce movies of the recorded time-series.
Giriş
Streptomycet'ler uykuda, unigenomic sporlar 1-3 bir çok hücreli, besin süpürücü misel gelen morfolojik farklılaşma içeren karmaşık bir gelişimsel döngüsünde ile karakterize edilir toprakta yaşayan bakteriler vardır.
Uygun büyüme koşulları altında, tipik bir Streptomyces spor bir ya da iki tohum tüpü (Şekil 1) haddelenmesiyle çimlenme başlar. Bu tüpler ucu uzantısı uzamış ve vejetatif misel olarak bilinen dallı hifal ağına büyür. Polar büyüme ve hifal dallanma temel protein DivIVA tarafından yönetilmektedir. Bu halkalı-halka proteini büyük sitoplazmik kompleks bir parçası olarak uzanan uç 4-7 yeni hücre kılıfı malzemesinin sokulması için çok önemlidir polarisome olarak adlandırılır. Vejetatif büyüme sırasında, hifal filamentler sözde çapraz duvarların 8 seyrek oluşumu ile bölümlere olur. yeniden bu çapraz duvarların oluşumu quires FtsZ, çoğu bakteri 9 hücre bölünmesi için gerekli olan tübülin gibi iskelet proteindir. Streptomyces, ancak, bu vejetatif çapraz duvarlar daralma ve hücre-hücre ayrımına neden olmayan ve bu nedenle de misel kütle birbiriyle bağlantılı sinsityal bölmelerin ağı olarak kalır. Iyi anlaşılmış değildir besin sınırlaması ve diğer sinyallere yanıt olarak, uzman bir anten hif vejetatif misel uzakta kırmaya ve havaya 3 dönüşebilir. Bu yapıların montajı haline uzun multi-genomik hava hifler eşit büyüklükte unigenomic Prospore bölmeleri onlarca bölünmüş sırasında gelişme üreme fazını başlatır. Bu büyük hücre bölünmesi olayı tek sporogenic hifler 2,10 içinde birden fazla FtsZ yüzük senkron daralma tarafından tahrik edilir. Morfolojik ayrım uykuda, kalın duvarlı, pigmentli sporların salınımı ile tamamlanır.
t "fo: keep-together.within-page =" 1 ">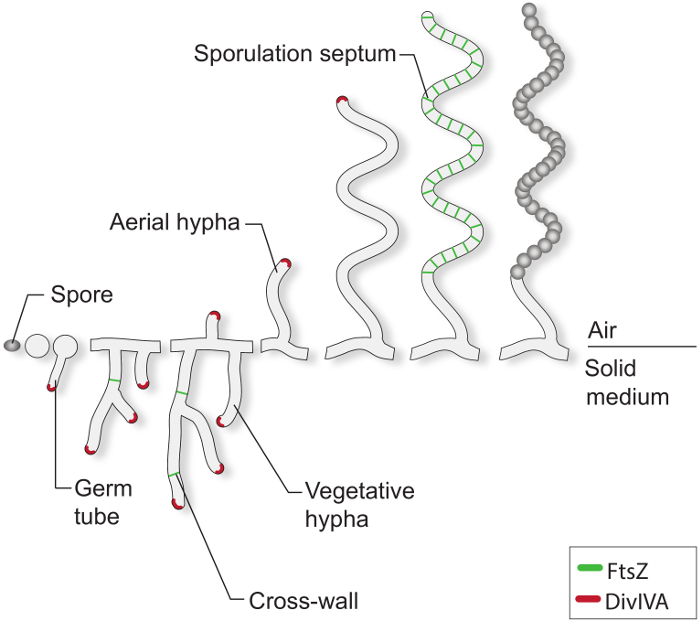
Şekil 1:. Katı ortam üzerinde Streptomyces yaşam döngüsü Bu S. klasik çalışmalara dayalı yaşam döngüsünün bir modeldir agar plakaları üzerinde büyüyen coelicolor. Bir sporun hücresel gelişim hif dallanma bir ağ oluşturmak üzere uç uzantısı büyür bir ya da iki germ tüpleri, oluşumu ile başlar. Polar büyüme ve bitkisel hiflerin dallanma DivIVA (kırmızı) tarafından yönetilmektedir. vejetatif çapraz duvarların oluşumu FtsZ (yeşil) gerektirir. besin sınırlamalar ve diğer sinyallere yanıt olarak, hava hif inşa edilmiştir. hava büyüme tutuklanması sıkıca kutu benzeri Prospore bölmeye sporogenic hif bölümlendirirse sporülasyon septa doğuran FtsZ-ringler, bir merdiven montaj ile koordine edilir. Bu bölmeler kalın spor Duvara montaj ve sonunda Relea vardırolgun pigmentli sporlar sed.
Streptomyces yaşam döngüsünün kilit gelişim olayları iyi 1,3 karakterize edilir. Ancak, yine de ne kıt, protein yerelleştirme dinamikleri, kromozom hareketi ve gelişimsel kontrollü hücre bölünmesi olarak farklılaşmasını destekleyen hücre içi süreçlere, içgörü sağlamak için floresan time-lapse mikroskobu kullanan hücre biyolojik çalışmalar vardır. Streptomyces gelişme Canlı hücre görüntüleme nedeniyle yaşam döngüsünün karmaşıklığı ve organizmanın fizyolojik özelliklerinin zorlu olmuştur. Bitkisel büyüme önceki çalışmaları ve sporlaşma septasyon başlangıç aşamaları oksijen geçirgen görüntüleme odaları veya mikroskop sahnede 11-15 Streptomyces coelicolor agaroz destekli büyüme istihdam var. Ancak bu yöntemler, bir dizi faktöre ile sınırlıdır. Bazı sistemler sadece hücresel büyümenin kısa vadeli görüntüleme izinhücreler önce d floresan proteinleri yetersiz oksijen kaynağı muzdarip veya bağlı hifal geliştirme üç boyutlu desen odak düzleminden dışarı büyür. Uzun vadeli görüntüleme hücreleri alternatif büyüme ya da stres koşullarına maruz ve agaroz pedleri ortamdan eşiğe ciddi zayıf floresan izlemek için yeteneği sınırlar olamaz çünkü agaroz pedleri sınırları deneysel esneklik üzerinde hücrelerin yetiştirilmesi mümkün olduğu durumlarda sinyaller.
Burada mükemmel hassasiyet ve duyarlılığı ile tam Streptomyces yaşam döngüsünün canlı hücre görüntüleme için bir protokol açıklar. Bir floresan geniş açılı mikroskobu (Şekil 2) bağlı olan bir mikro sıvısal tertibat Streptomyces büyüyerek, şimdi en fazla 30 saatlik bir süre boyunca çimlenme, vejetatif büyüme ve sporulizasyon septumu oluşumunu izlemek mümkündür. Bu büyük ölçüde, yeni bir model organizma Streptomyces kullanılmasıyla kolaylaştırılır venezuelae o batık kültürde yakın tamamlanması için sporulates ve böylece klasik bir model türlerinin S. sınırlama üstesinden gelir, çünkü Katı ortam 16-20 sadece sporulates coelicolor. vejetatif gelişmesi ve spor görselleştirmek yardımcı olmak için, birlikte express floresan hücre polarite işaretleyici DivIVA ve anahtar hücre bölünmesi proteini FtsZ sürümlerini etiketledi.
Başarıyla mikobakteriler, Escherichia coli Corynebacterium glutamicum, Bacillus subtilis ve maya 21-25 için kullanılan olan bir ticari olarak temin edilebilir mikroakışkan cihaz kullanmaktadır. Sistem tek bir odak düzlemi hücreleri yakalar ve farklı haznelerden kültür ortamının sürekli perfüzyon kontrol edilmesini sağlar. Ayrıntılı protokolde S. ortaya çıkarmak için bu özellikten yararlanmak sporulasyonunu tanıtmak için bir beslenme downshift için bitkisel misel venezuelae.
protokol deScribed tüm Streptomyces yaşam döngüsünün canlı hücre görüntüleme için, ancak belirli gelişim evreleri özel ilgi ise alternatif medya koşulları veya mikroskop ayarları seçilebilir.
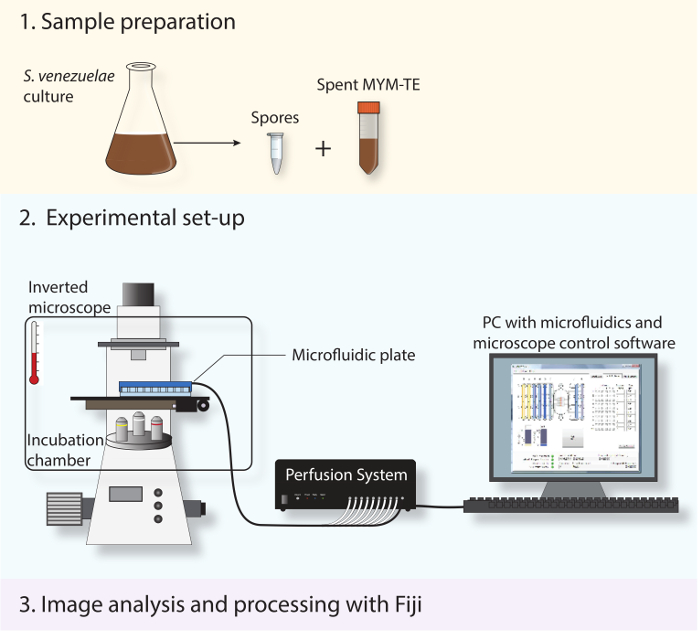
Şekil 2: Şematik deneysel iş akışı betimleyen. protokol açıklanan üç temel adım gösterilmiştir. İlk olarak, sporlar ve harcanan ortam sabit faz kültüründen hazırlanmıştır. İkincisi, taze sporlar mikroakışkan sistemi ve S. yüklenir venezuelae gelişimsel ömrü optimal büyüme sıcaklığı korumak için bir kuluçka hücresine sahip, tam otomatik bir ters mikroskop kullanılarak boyunca görüntüsü alınır. Üçüncü olarak, elde edilen time-lapse serisi analiz ve açık kaynak yazılımı Fiji kullanılarak işlenir.
Protokol
Taze S. 1. İzolasyonu venezuelae Sporlar ve kültür aracı maddesinin hazırlanması
- DivIVA mCherry P ftsZ - gerilme SV60 yanda sayılan [attB φ BT1 :: pSS209 (P divIVA 10 ul sporlarla, 60 ul R2 eser element solüsyonu (TE) ile desteklenmiş 30 ml maltoz-Maya Özü-Malt Extract aşılamak (MYM) orta, -ftsZ-ypet)]. istikrarlı büyüme ve hücre sporülasyonun için bir şaşkın şişeyi ya da yeterli havalandırma sağlamak için bir bahar içeren bir şişesi kullanın.
- 30 ° C'de 35-40 saat ve 250 rpm'de Kültür hücreleri.
- Sıvı monte faz-kontrast mikroskobu ile hücrelerin inceleyin. Bu noktada misel parçaları ve sporlar görünür olacaktır.
- Santrifüj 1 dakika boyunca 400 x g'de bir masa üstü santrifüjü içinde 1 ml hücre misel ve büyük hücre fragmanları pelet.
- Yaklaşık 300 ul süpernatant co aktarınyeni bir 1.5 ml'lik tübe bir spor süspansiyonunun ntaining ve buz üzerinde tutun. Aşama 1.7 kalan kültür ortamı tutun.
- Sporlar MYM-TE içinde 1:20 seyreltilir (nihai konsantrasyon: 0.5-5 x 10 7 spor / ml) ve gerektiği kadar buz üzerinde tutulur (adım 2.3).
Not: Streptomyces içinde sporlanmasını tetikleyen tam koşullar, bir sporlanan kültürden herhangi bir bilinmeyen hücre dışı sinyaller dahil olmak üzere, harcanan MYM-TE ortamı kullanılarak, anlaşılmamış olmakla birlikte, sporulasyonunu uyarır. - sporlar ve miselial parçalar içermez MYM-TE harcanan olarak ulaşmak için kalan kültür ortamında 10 ml filtre sterilize. steril 0.22 mikron şırınga filtresi kullanın ve transfer steril 15 ml tüp MYM-TE geçirdi.
- Benzer büyüme koşulları kullanılarak ek deneyler yapılacak ise 4 ° C'de birkaç gün için hazırlanan harcanan MYM-TE tutun.
Mikroakışkan Aygıt 2. Hazırlık
Not: Her mikroakışkan plaTe gerçekleştirilebilir dört bağımsız deneyde kadar sağlar. bir deney kurarken kullanılmayan akış odaları kirlenmesini önlemek için, steril çözümler ve çalışma koşullarını kullanın.
- mikroakışkan plakadan nakliye çözüm çıkarın ve steril MYM-TE ile kuyu durulayın.
- 300 ul MYM-TE 6 kuyular 2 iyi 1 ve 300 ul geçirdi MYM-TE girişine ekle.
- Yük 40 ul şerit "A" hücre yükleme oyuk 8 adım 1.6 sporların seyreltildi ve uygun plaka manifold üretici talimatlarına mühür.
- , Mikroakiskan kontrol yazılımı başlatmak uygun plaka türünü seçin ve oyuk başına 2 dakika süreyle 6 psi 5'e giriş kuyulardan akan ortamı tarafından 1 asal akış kanalı ve kültür odasına bir akış programı kurmak.
- Çimlenme ve hücrelerin vejetatif büyüme sağlamak için 6 saat süreyle giriş kuyusundan 1 MYM-TE akan: Mikroakiskan kontrol yazılımı olarak, deney için bir akış protokolü oluşturmak. anahtarDaha sonra deney kalan süre için de 2 ila 5 harcanan MYM-TE perfüzyon için. Deney sırasında (yaklaşık 9 ul ortam / saat karşılık gelir) 6 psi akış basıncı sabit tutmak. Adım 3.5 sonra akış programını başlatın.
Mikroskop ve Time-lapse Protokolün 3. Kurma
Not: Bu yöntem, bir sCMOS kamera, bir metal-halojen lamba, bir donanım otofokus, 96 oyuklu plakalar için bir sahne tutucu ve bir çevre bölmesi ile donatılmış bir tam motorlu ve otomatik ters Geniş açılı, mikroskop uygulanmıştır.
- deney başladıktan sonra otofokus sorunları önlemek amacıyla önceden 30 ° C çevre odasının ön ısıtmak. gerekli süre kullanılan çevre odasında, mikroskop ve ısıtma sistemine bağlıdır. deneyden önce sistem gece ısınmaya başlar.
- mikroskop ve mikroskop otomasyon ve kontrol softwa açınyeniden. Böyle bir 100X, 1.46 NA yağı DIC hedef olarak optimal sinyal toplama ve uzaysal çözünürlüğü, yüksek bir sayısal açıklık (NA) immersiyon yağı hedefi kullanın. Sarı-floresan ve kırmızı floresan proteini füzyonlarının diferansiyel girişim kontrast (DIC) görüntüleri ve görüntüleri elde etmek için uygun filtre ve iki renkli aynalar seçin.
- amaç üzerine daldırma petrol bir damla koyun ve görüntü alımı sırasında hücre odağı artırmak için mikroakışkan plaka üzerinde görüntüleme penceresinin altına daldırma sıvısı ekleyin. Dikkatle ters mikroskop sahneye mühürlü mikroakışkan cihaz (adım 2.5) monte edin. plaka güvenli sahne tutucu yerleştirilir ve deney boyunca kayma olmadığından emin olun.
- yönlendirme için gömülü pozisyon işaretlerini kullanarak odak haline mikroakışkan kültür odasının görüntüleme penceresini getirin. ilk akış odasının soldaki kısmına odaklanın karşılık, tuzak büyüklüğü 5 ile ( "A" etiketli)0.7 mikron bir tuzak yüksekliği.
- Mikroakiskan yazılımında, giriş kuyudan 8 den yük hücreleri 15 saniye boyunca 4 psi. görüntüleme penceresi boyunca sahne hareket ettirerek kültür odasında hücre yoğunluğu kontrol edin. Hiçbir sporların sıkışıp olsaydı, hücre yükleme adımı tekrarlayın veya alternatif istenilen hücre yoğunluğu (2.048 x 2.048 piksel görüntüleme penceresi başına 1-10 sporları) elde edilene kadar yükleme basıncı ve / veya süresini artırın. kültür odasını aşırı yüklemekten kaçının.
Biz normalde Streptomyces görüntüleme için tuzak boyutu 5 kullanın, ama biz de 4 ve 3 hücreli yükleme işlemini optimize etmek konusunda ek öneriler için tedarikçinin kılavuzuna başvurun boyutları tuzağı ile iyi sonuçlar elde edilmiştir: Not. - Adım 2.5 kontrol yazılımı akış programını başlatın ve mikroakışkan plaka görüntü toplama başlamadan önce mikroskop aşamasında 1 saat ısı-gelmesini sağlayınız.
- mikroskop kontrol yazılımı, mu almak için çok boyutlu bir satın kurmakzamanla çok kademeli pozisyonlarda ltiple görüntüleri:
- Autosave için: resim dosyalarının otomatik tasarrufu için dizini belirtin.
- Aydınlatma ayarları için, önceden her özel yapı için en uygun aydınlatma ayarlarını belirlemek. DIC 150 msn, YFP 250 msn, RFP 100 msn: özetlenen deney için aşağıdaki pozlama süreleri kullanın.
- Zaman serisi için: sırayla istenilen zaman noktalarında görüntüler elde etmek için bir zaman serisi kurdu. S. yaşam döngüsünü görüntülenmesi için venezuelae, 24 saatlik bir süre boyunca 40 dakikalık bir zaman aralığını seçin.
- Sahne pozisyonları ve otomatik odaklama için: ilgi her görüntüleme konumu için sahne ve mağaza sahne pozisyonları hareket ettirerek kültür odasına tarayın. tek kademeli pozisyonları yeterince ayrı photobleaching ve phototoxicity.Typically 12 pozisyonları kadar kullanabilirsiniz aza indirmek için yer olduğundan emin olun. Her zaman noktası için çalıştırın otomatik odaklama rutin yavaş odak kayması düzeltmek için. Eğer mikroskop kontrol yazılımı mevcut"Donanım otofokus yerel yüzey güncelleme" olarak ayarlayın otofokus stratejisi. Seçilen sahne pozisyonların Z koordinatları doğrulandıktan sonra, donanım otofokus etkinleştirin.
- mikroskop kontrol yazılımı time-lapse deney başlatın.
- Tüm sahne pozisyonları daha sonraki noktalarda odak hala olup olmadığını kontrol edin. otofokus kullanırken birkaç saat içinde çalışan time-lapse deneyler için, zaman zaman hatta bir sahne sürüklenme gözlemlemek. sahne pozisyonları odakladı gerekiyorsa, uygun bir zaman noktasında denemeyi durdurmak Odağı ayarlamak ve tanımlı görüntüleme zaman aralığının (adım 3.7.3) içinde denemeyi yeniden başlatın. Zaman serisi bağlamak için nasıl adım 4.3'e bakın.
- 24-30 saat sonra görüntü elde etme durdurmak veya ilgi bölgedeki hif sporları içine farklılaşmış zaman (DIC görüntü serisi bakınız). Yazılımın akış programı durdurmak ve mikroakışkan cihaz demonte.
- Kısa vadeli sto için kullanılan mikroakışkan tabak hazırlayınöfke. MYM-TE kalan çıkarın ve 6 kuyusundan 1 MYM-TE geçirdi boş atık kuyu 7 ve steril koşullar altında hücre yükleme kuyu 8. yeniden dolum için şeritli "A" kuyu ve kullanılmayan hatlarının kuyular ( "B" kullanılmıştır steril fosfat tamponlu salin ile plaka üzerinde, "D"), (PBS). 4 ° C'de ve mağaza kurumasını önlemek için parafilm plaka mühür.
Fiji Yazılım Kullanma Time-lapse Filmler 4. Nesil
Not: farklı ticari ve özgür yazılım paketleri ZenBlue, Metamorph, Icy, ImagePro veya ImageJ dahil time-lapse mikroskopi görüntüleri işlemek için kullanılabilir olduğunu unutmayın. Burada bir açık kaynak görüntü işleme ImageJ dayalı bir program ve hangi zaten yararlı önceden yüklenmiş eklentileri bir dizi sağlar olan Fiji, odaklanmak.
- Fiji yüklü olduğu bir bilgisayara time-lapse deney transfer görüntüleme verileri.
- programı başlatın ve & kullanarak görüntüleme dosyasını içe# 34; Dosya> İçe Aktar> Biyo-Biçimleri ". Ya da basitçe Fiji içine görüntüleme dosyasını sürükleyerek" Biyo-Biçimleri İthalat Seçenekleri her aydınlatma kanalı için ayrı bir görüntü yığını elde etmek için bölünmüş kanallar "", kutuyu işaretleyin "(DIC , RFP, YFP).
- İsteğe bağlı: (DIC, RFP, YFP her kanal için, bağlı refocusing (adım 3.9) görüntü edinimi bir mola kaynaklanan ayrı zaman serisi birleştirme ilgili görüntü yığınlarını açmak ve çalıştırmak "Image> Yığınlar> Araçlar> Concatenate" için ).
- görüntü yığınlarından gezinerek zaman atlamalı veri kalitesini değerlendirmek. zamanla odak kaldı hifler, gösteri misel büyüme için bakmak ve sonunda sporlar (DIC yığını) oluştururlar. sırasıyla, bitkisel ya da sporogenic hifler (YFP yığınında) tek halkaları veya birden fazla, merdiven benzeri yapılar oluşturan hifal ucunda DivIVA-mCherry (RFP yığını) ve FtsZ-YPet için beklenen hücre içi lokalizasyonu inceleyin.
- aşağı işlenme için ilgi bir bölge yalıtmakgörüntülerin ng. Time-lapse mikroskopi genellikle Fiji tarafından işlenmesini yavaşlatabilir büyük dosyaları üretir. Nedenle tespit ve faiz (ROI) bir bölge izole etmek ve görüntü yığınının bu küçük bir versiyonu hakkında daha fazla görüntü işleme adımları gerçekleştirmek için tavsiye edilir.
- Menüde "Dikdörtgen Seçim" aracını seçin ve gelişmekte olan hif görüntü dizi boyunca ROI çevrili olduğu şekilde DIC görüntü yığınında bir dikdörtgen ROI çizin.
- "Ctrl" + "Shift" + "D" ile YG-yığını çoğaltın.
- YFP görüntü yığını adı çubuğuna tıklayın ve "Düzenle> Seçim> Seçimi Restore" YFP yığınında aynı borudaki konumuna yığını özgün DIC önceki dikdörtgen seçim geri ve "Ctrl" ile ROI çoğaltmak için menüde + "Shift" + "D".
- RFP yığını için bu işlemi tekrarlayın.
- üç resim t yığınlarının görüntüleri hizalayıno zamanla xy düzleminde sahne sürüklenir kaldırın. DIC yığınında son kareye gidin ve menüden "Eklenti> Kayıt> StackReg> RigedBody" seçeneğini seçin. RFP ve YFP görüntü yığını için bu adımı yineleyin. Gerekirse, adım 4.5.1-4.5.3 yineleyerek ROI kırpın.
- İsteğe bağlı: "> Süreç Kontrast geliştirin" "Parlaklık ve Kontrast Aracı ayarlama" ( "Ctrl" + "Shift" + "C") ya da seçmek her görüntü yığını için elle parlaklık ve kontrast ayarlama menüden ve "Normale" uygulamak yığının tüm görüntüleri komut. Ikinci komut aşağı görüntü analizi etkileyebilir, bu nedenle piksel değerlerini değiştirebilir ve olacağı unutulmamalıdır.
- İsteğe bağlı: yatay veya dikey "Image> Yığınlar> Araçlar> birleştirin" eklentisi kullanarak (RGB dosya formatına dönüştürülmüş 4.11 bakınız) bireysel yığınları birleştirin.
- (& Ve bir süre Stamper ( ">> Ölçek Bar Araçlar Analiz") bir ölçek çubuğu ekleyin# 34; Image> Yığınları> Saat Stamper ").
- ".tiff" Formatında bir görüntü dizisi olarak değiştirilmiş görüntü yığınlarını kaydedin. Bir film üretmek için, ".avi" olarak kaydedin. Alternatif olarak, "Biyo-Biçimleri> Biyo-Biçimleri İhracatçı" eklentisi ve ".mov" dosya türünü seçin kullanarak QuickTime formatında ihracat görüntü serisi.
- tek kare resim elde etmek için, + "D" ilgi çerçeve seçin ve görüntü "Ctrl" + "Shift" yinelenen. "Görüntü> Type> RGB renk veya 8-bit" adı altında ortaya çıkan görüntü "RGB" veya "8-bit" türünü değiştirmek ve "tiff" olarak görüntüyü kaydetmek.
Not: Fiji ek daha açıklamak işlevleri veya işlem time-lapse serisi bir dizi sunuyor. Ayrıntılı bilgi (http://fiji.sc/Fiji) Fiji çevrimiçi destek gidin.
Sonuçlar
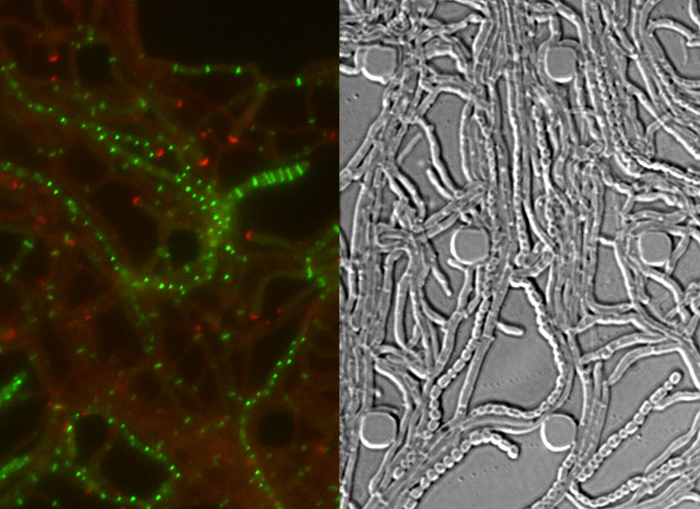
Tüm S. başarılı canlı hücre görüntüleme venezuelae yaşam döngüsü çimlenme, vejetatif büyüme ve sporlanma (Şekil 3, Film 1) en önemli gelişim aşamaları dahil olmak üzere, sürekli bir zaman serisi elde edilir. yaşam döngüsü boyunca ilerlemenin Görselleştirme daha DivIVA mCherry ve FtsZ-YPet ayrı hücre içi lokalizasyonu ile geliştirilmiştir. Çimlenme ve vejetatif büyüme sırasında, DivIVA mCherry sadece büyüyen hifal ipuçları ya da yeni şube noktaları (Şekil 4A) oluşturan işaretleri birikir. Bu sonuçlar DivIVA 12,26 önceden bildirilen hücre içi konumlandırma ile uyumludur. Bunun aksine, FtsZ-YPet artan misel (Şekil 4B) düzensiz aralıklarla tek halka-benzeri yapılar oluşturmaktadır. Bu yapılar İnterconn oluşumuna neden olmayan konstriktif bitkisel çapraz duvarlar sentezi için iskele temintutarları hifal bölmeleri 8. Sporogenic hif içine hif büyüyen hücre farklılaşması polar DivIVA mCherry odaklarının kaybolması ile görünür hale gelir, polar büyüme yakalanması ve FtsZ-YPet floresans birlikte artış (Şekil 4C). hif sporlanan olarak FtsZ-YPet lokalizasyonu deseni dramatik değişiklikler; İlk sarmal FtsZ-YPet filamentler hypha boyunca takla ve sonra aniden neredeyse eşzamanlı olay, bu helezonlar düzenli aralıklı FtsZ-YPet halkaların bir merdiven içine birleşmek. Burada tarif edilen deney koşulları altında, bu eşit olarak dağıtılmış FtsZ-YPet merdivenler yaklaşık 2 saat süre ile devam etmektedir. Son olarak, sporulasyon septa diferansiyel girişim kontrast (DIC) görüntüleri (Şekil 4D) ve en sonunda yeni sporlar yayımlanan içinde fark edilebilir hale gelir.
olarak sağlayan Fiji yazılımını kullanarak görüntü işleme açıklayan sonraki protokol TEP-adım edinilen time-lapse serisi (Film 1) den yayınlanması için bir film üretmek için nasıl bir açıklama.
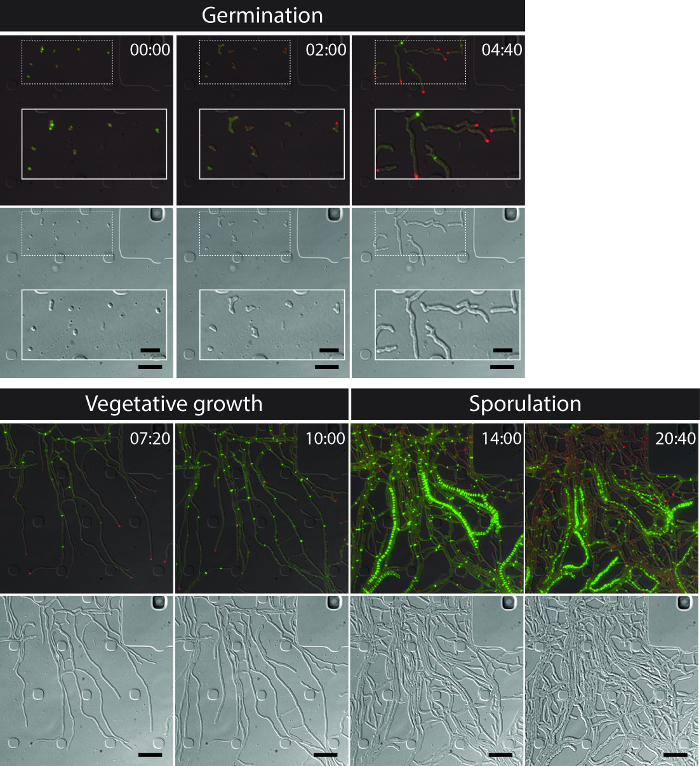
Şekil 3: S. temsili time-lapse floresan mikroskopi serisinden Anlık görüntüler venezuelae üreten floresan etiketli FtsZ (yeşil) ve DivIVA (Kırmızı) birleştirilmiş görüntülerin seçilen kareleri vardır Gösterildi (üst panel: RFP-YFP DIC, alt panel: DIC). çimlenme, vejetatif büyüme ve sporülasyonun dahil Streptomyces yaşam döngüsü görselleştirerek. Görüntüler Film 1. Zaman alınmıştır saat şöyledir: dk. Ölçek çubukları = 5 um. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
d / 53863 / 53863fig4.jpg "/>
Şekil 4: Streptomyces yaşam döngüsünün başarılı zaman atlamalı serisi için Örnek sonuçlar DivIVA mCherry (A) lokalizasyonu.. RFP ve DIC kanallarının birleştirilmiş görüntüleri ile Movie 1 iki sonraki zaman noktalarında anlık gösterilmiştir. DivIVA mCherry yeni hifal şube siteleri (dolu ok başı) işaretler ve polar büyüme (açık ok başı) doğrudan hifal ucunda lokalize. Ölçek çubuğu = 10 vejetatif büyüme (ok başı) sırasında um (B) FtsZ-YPet yerelleştirme. FtsZ-YPet (DIC, alt panel) sıkmak yok tek halka benzeri yapılar (üst panel) oluşturur. Sporlanma septasyon sırasında (C) FtsZ-YPet (yeşil) yerelleştirme. (Sa: dk) DivIVA mCherry odakları aşağıda gösterildiği geçen süre, kırmızı renkle gösterilmiştir. Ölçek çubuğu: 5 mikron. (C) den sporlanan hif DIC görüntüleri İlgili (D) şeklini gösterensonunda sporların bir zincir (sağ resim) içine olgun görünür sporlanma septa (sol resim) ile Prospore bölmeleri, bir tirme. Zaman saat şöyledir: dk. Ölçek çubuğu = 5 mikron. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Film 1: yaşam döngüsünün venezuelae Streptomyces Time-lapse floresan mikroskopi dizileri film birleştirilmiş RFP-YFP görüntüleri (solda) ve karşılık gelen diferansiyel girişim kontrast (DIC) görüntüleri (sağda) oluşur.. DivIVA mCherry yeşil, kırmızı ve FtsZ-YPet gösterilmiştir. tek kare arasındaki zaman aralığı 40 dk. Ölçek çubuğu = 10 mm. Thi görmek için buraya tıklayınızs film.
Tartışmalar
Streptomyces yaşam döngüsü time-lapse mikroskopi geçmişte teknik açıdan zorlayıcı olmuştur. Burada (Şekil 2) görselleştirmek ve gelişim programı aracılığıyla ilerlemesini iz yardımcı olmak için hücre polarite işaretleyici DivIVA ve hücre bölünmesi proteini FtsZ için floresan protein füzyonları kullanarak tüm yaşam döngüsünün canlı hücre görüntüleme gerçekleştirmek için sağlam bir protokol mevcut.
Bu yöntem Orta S. yetiştirme (MYM-TE harcanan) harcanan orta ile sürekli orta perfüzyon ve normal büyüme ortamı (MYM'nin-TE) alışverişini sağlayan bir mikroakışkan cihaz venezuelae. Kültür durumun değişim besin açısından zengin bir ortamda sürekli bir tedarik bitkisel growt uyarır, oysa sporulasyonunu teşvik nedeniyle harcanan kültür ortamında herhangi henüz tanımlanmamış hücre dışı sinyalleri olarak kuyu (örn nisap algılama sinyalleri) olarak beslenme vites açıklanan protokole önemlidirneredeyse hiç spor oluşumu H (veriler gösterilmemiştir). Bu nedenle, bu mikro-akışkan sistemi içinde kültürlenmesi daha deney esneklik sağlar ve kültür koşullarının değiştirilmesi yanıt olarak bakteri büyümesinin değişikliklerin uzun süreli izlenmesine olanak sağlar, çünkü agaroz üzerinde hücrelerin kültürlenmesi daha üstündür. mikroakışkan plakaları tek bir kullanım için tasarlanmıştır, ancak sadece sonraki deneylerde kullanılabilen hücre ile inoküle edilmemiş kanalları akar. Biz uzun zaman açılmıştır plakalara manifoldu sızdırmazlık problemleri yaşamış gibi, bir hafta içinde bir mikroakışkan plaka tüm kanallarını kullanmanızı öneririz.
Bir deney kurarken, biz mikrop tüpleri (veriler gösterilmemiştir) ortaya önce donmuş bir gliserol stoku türetilen sporlar en az 6 saat gerekli ise taze hazırlanmış sporlar, akış odasına yüklenen iki saat içinde çimlenmiş bulundu. çimlenme bu gecikme deney uzunluğunu uzatır ve engelleyebilirekipman kullanılabilirliği ve deneysel koşullar. Mikrop tüplerinin geliştirilmesi ve akıbet için yeterli besin sağlamak için en az 3 saat MYM-TE perfüzyon ile denemeyi başlatmak için de önemlidir. Deney vejetatif büyümeyi incelemek için tasarlanmış ise MYM-TE ile Perfüzyon ilk 3 saat ötesine uzatılabilir. sporların başlangıç malzemesinin tercih seçeneği sağlarken, kısa hifal parçaları da mikroakışkan plakaya yüklenebilir. Ancak, makaslanmış misel kullanarak yükleme verimi düşüktür önemli ve genellikle sigara sporlanan mutantlar incelerken bir sınırlama mevcut olabilecek çeşitli yükleme çalışır gerektirir. Ne olursa olsun kullanılan inokulum Çeşidi, medya difüzyon müdahale ve görüntü analizi komplike edebilir hızlı kalabalık yol açacaktır bu kadar sporların veya hifal fragmanları ile kültür odasını aşırı önemlidir.
Muhabir proteinlerin yapımını planlamak önemlidir dikkatli bir şekildLly Streptomyces floresan time-lapse görüntüleme kullanım için. Hedef protein ve flüoresan raportör ve N- veya C-terminali füzyonları seçimi arasındaki ekleyicinin boyu kritik öneme sahip olabilir. Ayrıca, görüntüleme frekansı ve maruz kalma süresi de dahil olmak üzere uygun deney koşulları, her bir floresan etiketli proteini için önceden tespit edilmesi gerekmektedir. S. düşük seviyelerde ifade edilen bir floresan etiketli protein görüntüleme sorunlu olabilir sarı / yeşil kanaldaki venezuelae hifler sergi otomatik floresans. Buna ek olarak, bu çimlenme ve ilk vejetatif büyüme fazı, S. sırasında dikkat edilmelidir venezuelae kısa dalga boylu ışığa (örneğin CFP protein füzyonları kullanırken) için özellikle duyarlıdır.
Bakterilerin canlı hücre görüntüleme için görüntüleme yöntemleri ve floresan muhabiri sistemlerinde sürekli ilerlemelere rağmen, yazılım paketleri çoğu (örneğin MicrobeTracker, Schnitzelcveri setleri bu tür sonraki otomatik işleme arşın, CellProfiler) bir çok hücreli yaşam tarzı 27-29 ile ipliksi bakteriler elde edilen görüntülerin analizini desteklemez. Bu nedenle, Streptomyces ve diğer lifli bakteri görüntüleme de niceliksel veri yüksek verimli bir analizi için uygun bir algoritma geliştirilmesi için bir ihtiyaç vardır.
Özetle, burada açıklanan çalışma S. muazzam potansiyelini göstermektedir Çünkü sıvı içinde sporlanmalanna kabiliyetini cinsi için yeni bir model gelişim sistem olarak venezuelae. Mikroakışkan kültür cihazı deneyimsiz kullanıcılar için bile kullanımı basittir. Bu dinamik protein lokalizasyonu, polarize büyüme ve unigenomic sporların zincirleri içine çok hücreli misel morfolojik farklılaşma dahil Streptomyces yaşam döngüsü, merkezi hücre biyolojik süreçleri incelemek için mükemmel bir platform sağlar. Buna ek olarak, bu deney u ayarlamakp ayrıca peptidoglikan sentezini veya propidium iyodür ve 4 izlemek için floresan D-amino asitler ', 6-diamidino-2-fenilindol olarak kültür koşulları alternatif gerektiren gelişme olayları, ya da floresan boyaların kullanımını araştırmak için cezbedici bir başlangıç noktası sağlar (DAPI) kromozom organizasyonu 30,31 görselleştirmek için.
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
The authors thank Grant Calder for technical assistance with the microscope, Matt Bush for comments on the protocol, and the John Innes Centre for purchase of the Zeiss widefield microscope. This work was funded by BBSRC grant BB/I002197/1 (to M.J.B), by BBSRC Institute Strategic Programme Grant BB/J004561/1 to the John Innes Centre, by Swedish Research Council grant 621-2010-4463 (to K.F.), and by a Leopoldina Postdoctoral Fellowship (to S.S.).
Malzemeler
| Name | Company | Catalog Number | Comments |
| B04A CellAsic ONIX plate for bacteria cells | Merck-Millipore | B04A-03-5PK | Microfluidic culture plates |
| CellAsic ONIX Microfluidic Perfusion System and ONIX FG (version 5.0.2) | Merck-Millipore | EV-262 | The latest ONIX vesion (July 2015) and instructions on how to use the programme can be found here: http://www.merckmillipore.com |
| Axio Observer.Z1 Microscope | Zeiss | 431007-9902-000 | Fully automated and motorized inverted widefield microscope |
| Incubator XL multi S1 with Temperature Module S1 and Heating unit XL S2 | Zeiss | 411857-9061-000 | Environmental chamber surrounding the microscope |
| Plan-Apochromat 100x/1.46 Oil DIC objective | Zeiss | 420792-9800-000 | |
| Ocra FLASH 4 V2 | Hamamatsu Photonics K.K. | C11440-22CU | |
| Illuminator HXP 120V | Zeiss | 423013-9010-000 | |
| FL Filter Set 46 HE YFP shift free | Zeiss | 489046-9901-000 | Fluorescent filter set, excitation 500/25 nm, emission 535/30 nm |
| FL Filter Set 63 HE RFP shift free | Zeiss | 489063-0000-000 | Fluorescent filter set, excitation 572/25 nm, emission 629/30 nm |
| Mounting frame K-M for multiwell plates | Zeiss | 000000-1272-644 | Stage holder for microfluidic plate |
| ZEN pro 2012 | Zeiss | 410135-1002-120 | Microscope control software |
| ZEN Module Time Lapse | Zeiss | 410136-1031-110 | Software module to set up time-lapse microscopy experiments |
| ZEN Module Tiles/Positions | Zeiss | 410136-1025-110 | Software module to save specific stage positions (xzy) |
| Fiji | open-source software package | http://fiji.sc/Fiji | Generation of time-lapse movies |
| Maltose-Yeast Exctract-Malt Extract (MYM) 4 g Maltose 4 g Yeast extract 10 g Malt extract add 1 L H2O using 50 % tap water and 50 % reverse osmosis water and supplement with 200 ml of R2 trace element solution per 100 ml after autoclaving | Sporulation medium used to culture S. venezuelae SV60 | ||
| R2 Trace element solution (TE) 8 mg ZnCl2 40 mg FeCl3-6H2O 2 mg CuCl2-2H2O 2 mg MnCl2-4H2O 2 mg Na2B4O7-10H2O 2 mg (NH4)6Mo7O24-4H2O add 200 ml H2O Autoclave and store at 4 oC | Add 0.002 volumes to MYM | ||
| PBS (phosphate buffered saline) | Sigma | P4417-100TAB | Used to refill inlet wells of unused lanes in B04A plates in order to prepare plate for short-term storage. |
| 0.22 µm syringe filters | Satorius stedim | 16532-K | Preparation of spent MYM-TE |
| SV60 | John Innes Centre strain collection | S. venezuelae strain expressing divIVA-mcherry and ftsZ-ypet |
Referanslar
- Bush, M. J., Tschowri, N., Schlimpert, S., Flärdh, K., Buttner, M. J. c-di-GMP signalling and the regulation of developmental transitions in streptomycetes. Nat. Rev. Microbiol. 13, 749-760 (2015).
- Jakimowicz, D., van Wezel, G. P. Cell division and DNA segregation in Streptomyces.: how to build a septum in the middle of nowhere?. Mol. Microbiol. 85, 393-404 (2012).
- McCormick, J. R., Flärdh, K. Signals and regulators that govern Streptomyces development. FEMS Microbiol. Rev. 36, 206-231 (2012).
- Flärdh, K., Richards, D. M., Hempel, A. M., Howard, M., Buttner, M. J. Regulation of apical growth and hyphal branching in Streptomyces. Curr. Opin. Microbiol. 15, 737-743 (2012).
- Hempel, A. M., et al. The Ser/Thr protein kinase AfsK regulates polar growth and hyphal branching in the filamentous bacteria Streptomyces. Proc. Natl. Acad. Sci. U S A. 109, E2371-E2379 (2012).
- Fuchino, K., et al. Dynamic gradients of an intermediate filament-like cytoskeleton are recruited by a polarity landmark during apical growth. Proc. Natl. Acad. Sci. U S A. 110, E1889-E1897 (2013).
- Holmes, N. A., et al. Coiled-coil protein Scy is a key component of a multiprotein assembly controlling polarized growth in Streptomyces. Proc. Natl. Acad. Sci. U S A. 110, E397-E406 (2013).
- McCormick, J. R., Su, E. P., Driks, A., Losick, R. Growth and viability of Streptomyces coelicolor. mutant for the cell division gene ftsZ. Mol. Microbiol. 14, 243-254 (1994).
- Margolin, W. FtsZ and the division of prokaryotic cells and organelles. Nat. Rev. Mol. Cell Biol. 6, 862-871 (2005).
- Grantcharova, N., Lustig, U., Flärdh, K. Dynamics of FtsZ assembly during sporulation in Streptomyces coelicolor A3(2). J. Bacteriol. 187, 3227-3237 (2005).
- Richards, D. M., Hempel, A. M., Flärdh, K., Buttner, M. J., Howard, M. Mechanistic basis of branch-site selection in filamentous bacteria. PLoS Comput. Biol. 8, e1002423 (2012).
- Hempel, A. M., Wang, S. B., Letek, M., Gil, J. A., Flärdh, K. Assemblies of DivIVA mark sites for hyphal branching and can establish new zones of cell wall growth in Streptomyces coelicolor. J. Bacteriol. 190, 7579-7583 (2008).
- Wolanski, M., et al. Replisome trafficking in growing vegetative hyphae of Streptomyces coelicolor A3(2). J. Bacteriol. 193, 1273-1275 (2011).
- Jyothikumar, V., Tilley, E. J., Wali, R., Herron, P. R. Time-lapse microscopy of Streptomyces coelicolor.growth and sporulation. Appl. Environ. Microbiol. 74, 6774-6781 (2008).
- Willemse, J., Borst, J. W., de Waal, E., Bisseling, T., van Wezel, G. P. Positive control of cell division: FtsZ is recruited by SsgB during sporulation of Streptomyces. Genes. Dev. 25, 89-99 (2011).
- Glazebrook, M. A., Doull, J. L., Stuttard, C., Vining, L. C. Sporulation of Streptomyces venezuelae. in submerged cultures. J. Gen. Microbiol. 136, 581-588 (1990).
- Bibb, M. J., Domonkos, A., Chandra, G., Buttner, M. J. Expression of the chaplin and rodlin hydrophobic sheath proteins in Streptomyces venezuelae.is controlled by sigma(BldN) and a cognate anti-sigma factor, RsbN. Mol. Microbiol. 84, 1033-1049 (2012).
- Al-Bassam, M. M., Bibb, M. J., Bush, M. J., Chandra, G., Buttner, M. J. Response regulator heterodimer formation controls a key stage in Streptomyces development. PLoS Genet. 10, e1004554 (2014).
- Bush, M. J., Bibb, M. J., Chandra, G., Findlay, K. C., Buttner, M. J. Genes required for aerial growth, cell division, and chromosome segregation are targets of WhiA before sporulation in Streptomyces venezuelae. MBio. 4, e00684-e00613 (2013).
- Tschowri, N., et al. Tetrameric c-di-GMP mediates effective transcription factor dimerization to control Streptomyces development. Cell. 158, 1136-1147 (2014).
- Mirouze, N., Ferret, C., Yao, Z., Chastanet, A., Carballido-Lòpez, R. MreB-Dependent Inhibition of Cell Elongation during the Escape from Competence in Bacillus subtilis. PLoS Genet. 11, e1005299 (2015).
- Zopf, C. J., Maheshri, N. Acquiring fluorescence time-lapse movies of budding yeast and analyzing single-cell dynamics using GRAFTS. J. Vis. Exp. (e50456), (2013).
- Meniche, X., et al. Subpolar addition of new cell wall is directed by DivIVA in mycobacteria. Proc. Natl. Acad. Sci. U S A. 111, E3243-E3251 (2014).
- Donovan, C., Schauss, A., Kramer, R., Bramkamp, M. Chromosome segregation impacts on cell growth and division site selection in Corynebacterium glutamicum. PLoS One. 8, e55078 (2013).
- Rojas, E., Theriot, J. A., Huang, K. C. Response of Escherichia coli. growth rate to osmotic shock. Proc. Natl. Acad. Sci. U S A. 111, 7807-7812 (2014).
- Flärdh, K. Essential role of DivIVA in polar growth and morphogenesis in Streptomyces coelicolor A3(2). Mol. Microbiol. 49, 1523-1536 (2003).
- Sliusarenko, O., Heinritz, J., Emonet, T., Jacobs-Wagner, C. High-throughput subpixel precision analysis of bacterial morphogenesis and intracellular spatio-temporal dynamics. Mol. Microbiol. 80, 612-627 (2011).
- Young, J. W., et al. Measuring single-cell gene expression dynamics in bacteria using fluorescence time-lapse microscopy. Nat. Protoc. 7, 80-88 (2012).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7, R100 (2006).
- Kuru, E., Tekkam, S., Hall, E., Brun, Y. V., Van Nieuwenhze, M. S. Synthesis of fluorescent D-amino acids and their use for probing peptidoglycan synthesis and bacterial growth in situ. Nat. Protoc. 10, 33-52 (2015).
- Szafran, M., et al. Topoisomerase I (TopA) is recruited to ParB complexes and is required for proper chromosome organization during Streptomyces coelicolor. sporulation. J. Bacteriol. 195, 4445-4455 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır