A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
توصيف وتطبيق العينات سلبية لمراقبة المبيدات في المياه
In This Article
Summary
A protocol about the characterization and application of five different passive sampling devices is presented.
Abstract
تم معايرة خمسة مختلف العينات سلبية الماء تحت ظروف المختبر لقياس 124 إرث والمبيدات المستخدمة حاليا. وتقدم هذه الدراسة على بروتوكول لإعداد العينات السالبة والمعايرة وطريقة استخراج والتحليل الآلي. تم حساب معدلات أخذ العينات (R S) والسلبي معاملات لفصل الماء عن العينات (K PW) للمطاط السيليكون، القطبي العضوية تكاملية الكيميائية العينات POCIS-A، POCIS-B، SDB-RPS وC 18 قرص. امتصاص المركبات اختيار يعتمد على خصائصها الفيزيائية، أي أظهر مطاط السيليكون لامتصاص أفضل للمركبات أكثر مسعور (سجل لفصل الماء عن الأوكتانول معامل (K OW)> 5.3)، في حين POCIS-A، POCIS-B وSDB- كان القرص RPS أكثر ملاءمة للمركبات المائية (تسجيل K OW <0.70).
Introduction
يتم إدخال المبيدات بشكل مستمر إلى البيئة المائية وقد تشكل خطرا على الكائنات الحية المائية 1. وعادة ما يتم تنفيذ مراقبة المبيدات في البيئة المائية باستخدام أخذ العينات انتزاع، ومع ذلك، فإن هذا الأسلوب أخذ العينات لا يأخذ في الحسبان تماما عن التغيرات الزمنية في تركيزات بسبب التقلبات في تدفق أو العرضية المدخلات (على سبيل المثال، وهطول الأمطار، جنبا إلى جنب تجاوزات الصرف الصحي، والإفراج عن بحيرة الصرف الصحي) 2 3. وبالتالي، لا بد من تحسين لتقدير أفضل للمخاطر البيئية المرتبطة المبيدات طرق الرصد. تتيح أخذ العينات سلبية المراقبة المستمرة على مدى فترة طويلة من الزمن مع الحد الأدنى من البنية التحتية وتركيزات الملوثات منخفضة 4،5.
وقد تبين أن العينات سلبية ليكون أداة قيمة لرصد المياه الجوفية في 6، والمياه العذبة 7-10 ومياه الصرف الصحي 11 و المياه البحرية 12. إلى جانب أغراض الرصد 13،14، كما تم استخدام العينات سلبية للتحليل غير المستهدفة 15، وعلم السموم اختبار 16،17، وكبديل لsediment- والرصد البيولوجي 18. العينات سلبية تتراكم المواد الكيميائية بشكل مستمر من المياه وتوفر الوقت المتوسط المرجح (TWA) تركيزات 14. امتصاص الملوثات يعتمد على معدل أخذ العينات (R S) والسلبي معامل فصل الماء عن العينات (K PW)، والذي يعتمد على تصميم السلبي العينات، المواد العينات، والخصائص الفيزيائية والكيميائية للملوثات، والظروف البيئية (على سبيل المثال، الماء الاضطراب، ودرجة الحرارة) 13،14،19،20.
يهدف فيديو مفصل لإظهار كيفية معايرة وتطبيق العينات السلبية للمبيدات في المياه. وتضمنت الأهداف المحددة ط) لإجراء إعداد والاستخراج والتحليل الآلي ل124 المبيدات الفردية باستخدام خمسة أنواع مختلفة من sampl الدراسي السلبيالمتطلبات البيئية، بما في ذلك المطاط سيليكون، القطبية العضوية تكاملية الكيميائية العينات (POCIS) -A، POCIS-B، SDB-RPS وC 18 القرص، والثاني) لتقييم R S و K PW للمبيدات في دراسة امتصاص المختبر، والثالث) لشرح كيفية اختيار العينات السالبة المناسبة للمجمع الهدف من الفائدة وكيفية حساب تركيزات TWA للالعينات السالبة منها.
المعايير المرجعية والأجهزة العينات السالبة
وتشمل المركبات المستهدفة 124 إرث والمبيدات المستخدمة حاليا بما في ذلك مبيدات الأعشاب والمبيدات الحشرية ومبيدات الفطريات (الجدول 1). وشمل خليط القياسي الداخلي (هو خليط) fenoprop (2،4،5-TP)، كلوثياندين-D 3، ethion وterbuthylazine-D 5. وتشمل المواد الكيميائية المستخدمة أخرى الميثانول (MeOH)، الأسيتونتريل (إيه سي)، والأسيتون (ACE)، ثنائي كلورو ميثان (DCM)، الهكسان الحلقي (CH)، خلات الإيثيل (EA)، وآخرون البتروللها (PE)، 2-بروبانول، 25٪ محلول الأمونيا وحامض الخليك (HAC) وحمض الفورميك (FA). واتسمت خمسة أجهزة أخذ العينات السلبية المختلفة، بما في ذلك المطاط سيليكون، POCIS-A وPOCIS-B، SDB-RPS، وC 18 القرص 1،21.
الجدول 1. معدل أخذ العينات العينات سلبية (R 'S، L يوم -1)، معامل لفصل الماء عن العينات (K' PW، L كجم -1) والمعادلات (المعادلة) المستخدمة لحساب التركيزات في العينات الميدانية للفرد المبيدات أ. (نقلا عن مجلة اللوني A، 1405، لوتز اهرنز Atlasi دانشور، آنا E. لاو، جيني Kreuger، توصيف خمسة أجهزة أخذ العينات السلبية لرصد المبيدات في الماء، 1-11، حقوق الطبع والنشر (2015)، بإذن من السيفير .) 22 يرجى النقر هنا لتحميل هذا الملف.
Protocol
1. السلبي عينات تصميم وإعداد
- أوراق سيليكون المطاط
- قطع ورقة سيليكون المطاط (600 مم × 600 مم، 0.5 مم) في المشارب 2.5 ملم × 600 ملم و 2.5 ملم × 314 ملم استخدام قطع الفولاذ المقاوم للصدأ وربطها باستخدام برشام الفولاذ المقاوم للصدأ أعمى (3.2 ملم × 10 ملم ) بمسدس برشام للحصول على الحجم الإجمالي العينات شريط من 2.5 مم × 914 مم (مساحة = 457 سم 2، المواد الماصة كتلة = 15.6 غرام، وحجم = 22.9 سم 3).
- وضع المطاط سيليكون في غرفة استخراج من جهاز سوكسليت. إضافة 50 مل EA في غرفة استخراج وإضافة 250 مل EA وثلاثة أحجار المغلي في 500 مل جولة قارورة زجاجة.
- ربط غرفة استخراج مع قارورة زجاجة ومكثف. تنظيف المطاط سيليكون عن طريق استخراج سوكسليت لمدة 96 ساعة على ما يقرب من 80 درجة مئوية، وتجفيفها بعد ذلك تحت غاز النيتروجين لطيف.
- إرفاق يتو سيليكون المطاطالمؤسسة العامة لصاحب العينة الفولاذ المقاوم للصدأ العنكبوت عن طريق لف الشريط سيليكون المطاط حول قضبان على حامل (الشكل 1). نعلق كل طرف من طرفي شريط مطاط السيليكون لقضيب على حامل باستخدام العلاقات كابل.

الشكل 1. رسم تخطيطي للمطاط السيليكون. التخطيطي العينات سلبية للمطاط السيليكون تبين الحجز على شريط مطاط السيليكون لالفولاذ المقاوم للصدأ عينة العنكبوت حامل أ) من أعلى وب) عرض الجانب. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- POCIS-A وPOCIS-B
- لPOCIS-A، وضع 220 ملغ من HLB الماصة السائبة (مساحة = 1.78 × 10 6 سم 2) بين اثنين من 9.0 سم في 9.0 سم squarالبريد polyethersulfone (PES) الأغشية (الشكل 2).
- لPOCIS-B، وضع 220 ملغ من خليط المواد الماصة (أي راتنج الهيدروكسيلية البوليسترين-divinylbenzene (80٪) ومكثف الكربونية فرقت على كوبوليمر الستايرين divinylbenzene (20٪)) (مساحة = 2.82 × 10 6 سم 2) بين اثنين من الأغشية PES (الشكل 2).
- ضغط المواد الماصة واثنين PES بين حلقتين الفولاذ المقاوم للصدأ يدويا (Ø الداخلي = 5.4 سم) وثبته على صاحب العينة الفولاذ المقاوم للصدأ (الشكل 2).

الشكل 2. تخطيطي من الأقراص العينات السالبة. التخطيطي العينات سلبية لPOCIS A، B POCIS، القرص SDB-RPS وC 18 قرص تظهر أ) تجميع العينات السالبة باستخدام حلقات الفولاذ المقاوم للصدأ، polyethersulfone PES) MEMBRAN (وفاق، ومرحلة الاستقبال، وب) تركيب على حامل عينة الفولاذ المقاوم للصدأ. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- SDB-RPS القرص وC 18 قرص
- وضع SDB-RPS (مساحة = 35 سم 2، المواد الماصة كتلة = 0.34 غرام، وحجم = 1.7 سم 3) وC 18 أقراص (مساحة = 35 سم 2، المواد الماصة كتلة = 0.58 غرام، وحجم = 1.7 سم 3) بين اثنين من الأغشية PES (الشكل 2). ضغط الأقراص واثنين PES بين حلقتين الفولاذ المقاوم للصدأ يدويا (Ø الداخلي = 5.4 سم) وثبته على صاحب العينة الفولاذ المقاوم للصدأ (الشكل 2).
2. التجارب المختبرية امتصاص
ملاحظة: تم إجراء تجارب امتصاص مختبر لتوصيف كمي لك امتصاصinetics 124 المبيدات الفردية لخمسة أجهزة العينات السالبة مختلفة تحت ظروف خاضعة للرقابة.
- إجراء دراسة امتصاص في العبوات الزجاجية المستطيلة (كل ~ 95 L): دبابات 1) مطاط السيليكون (ن = 16)، خزان 2) POCIS-A (ن = 16)، POCIS-B (ن = 16)، وخزان 3 ) زنة-RPS القرص (ن = 16)، C 18 قرص (ن = 16). تعبئة المياه الطبيعية في ثلاث دبابات.
- أداء جميع التجارب في درجة حرارة الماء ثابتة (~ 20 درجة مئوية) وفي ظل ظروف مضطربة المياه (~ 10 سم ثانية -1) باستخدام اثنين من مضخات كهربائية تعلق على الجدار على كل جانب. إجراء التجارب في الظلام للحد من تأثير الضوئي.
- ارتفاع كل إناء زجاجي مع خليط القياسية المبيدات التي تحتوي على 124 المبيدات باستخدام حقنة زجاجية (ج ≈ 400 نانوغرام L -1 لمبيدات الآفات الفردية في خزان الماء). إخراج العينات سلبية يدويا من الدبابات، في فترات زمنية من 5، 11، 20، و 26 دآيس، لتحديد معدلات أخذ العينات من المبيدات.
- مراقبة تركيزات المبيدات في كل خزان من خلال جمع 100 مل عينات من المياه في اليوم 0، 5، 11، 20، 26. وتحليل عينات المياه يتم تنفيذ كما هو موضح في أماكن أخرى 21.
- لمراقبة الجودة، وتعريض عينات فارغة لهواء الغرفة لمدة 1 ساعة في اليوم 0 وبعد ذلك تخزين ويعاملهم عينات حقيقية. تخزين جميع مقتطفات فضلا عن 100 مل عينات المياه التي تم جمعها من الدبابات في -18 درجة مئوية حتى مزيد من التحليل.
استخراج 3. عينة
- مطاط سيليكون
- قبل الاستخراج، وتجفيف شريط مطاط السيليكون تحت تيار من غاز النيتروجين عالية النقاء.
- الغاز الطيف اللوني الشامل تحليل (GC-MS)، تنفيذ استخراج الصلبة والسائلة باستخدام استخراج سوكسليت 22.
- ضع مطاط السيليكون في جهاز سوكسلت. إضافة 250 مل PE / ACE (50/50، ت / ت) و 3 المراجلالحجارة لينغ في قارورة زجاجة مستديرة.
- ارتفاع المطاط سيليكون مع 100 ميكرولتر من هو خليط (ج = 5 نغ مل -1) باستخدام حقنة زجاجية. إضافة 50 مل PE / ACE (50/50، ت / ت) في جهاز سوكسلت. التبديل على سخان وتشغيل استخراج سوكسليت لمدة 19 ساعة ثم إيقاف تشغيل جهاز التدفئة.
- تركيز مقتطفات عن طريق التبخر الدوارة تليها النيتروجين لطيف ضربة الى 1 مل. تبادل المذيب إلى CH / ACE (90/10، ت / ت) وذلك بإضافة ثلاث مرات 1 مل CH / ACE (90/10، ت / ت) خلال النيتروجين ضربة الى 1 مل.
- لالسائل اللوني، جنبا إلى جنب قياس الطيف الكتلي تحليل (LC-MS / MS)، تنفيذ عملية الاستخلاص باستخدام استخراج سوكسليت 22.
- ضع مطاط السيليكون في جهاز سوكسلت. إضافة 250 مل MeOH و 3 الحجارة غليان في قارورة زجاجة مستديرة و 50 مل MeOH في جهاز سوكسلت. ارتفاع المطاط سيليكون مع 100 ميكرولتر من هو خليط (ج = 5 نغ مل -1) باستخدام SYR الزجاجإنجي.
- التبديل على سخان وتشغيل استخراج سوكسليت لمدة 19 ساعة ثم إيقاف تشغيل جهاز التدفئة. تركيز مقتطفات عن طريق التبخر الدوارة تليها النيتروجين لطيف ضربة الى 1 مل. تبادل المذيب إلى إيه سي بإضافة 1 مل ACN خلال النيتروجين ضربة الى 1 مل.
- POCIS-A وPOCIS-B
- فتح العينات POCIS بعناية ونقل المواد الماصة مع الماء عالى النقاء باستخدام القمع في البولي بروبلين فارغة الصلبة مرحلة الاستخراج (SPE) خرطوشة تنظيف مسبقا (6 مل) تحتوي على اثنين من البولي إثيلين (PE) فريتس. تجفيف المواد الماصة التي كتبها فراغ لإزالة المياه. سجل وزن خرطوشة SPE فارغة ومعبأة في السيطرة على وزن المواد الماصة. يرجى ملاحظة أن يتم استخدام خراطيش مختلفة لGC-MS وتحليل LC-MS / MS.
- قبل شطف، ارتفاع المواد الماصة مع 100 ميكرولتر من IS خليط (ج = 5 نغ مل -1) باستخدام حقنة زجاجية. أزل POCIS-A وPOCIS-B مواد ماصة باستخدام 5مل EA لمدة 22 GC-MS.
- تركيز مقتطفات إلى 1 مل من لطيف النيتروجين ضربة إلى أسفل. تبادل المذيب إلى CH / ACE (90/10، ت / ت) وذلك بإضافة ثلاث مرات 1 مل CH / ACE (90/10، ت / ت) خلال النيتروجين ضربة الى 1 مل.
- أزل POCIS-A وPOCIS-B خراطيش باستخدام 1.5 مل MeOH تليها 8 مل DCM / MeOH (80/20، ت / ت) لتحليل LC-MS / MS 22. تركيز مقتطفات إلى 1 مل من لطيف النيتروجين ضربة إلى أسفل. تبادل المذيب إلى إيه سي بإضافة 1 مل ACN خلال النيتروجين ضربة الى 1 مل.
- SDB-RPS وC 18 قرص
- نقل الأقراص الفردية SDB-RPS وC 18 القرص في كوب زجاجي وتجفيفها تحت غاز النيتروجين. ارتفاع الأقراص مع 100 ميكرولتر من هو خليط (ج = 5 نغ مل -1) باستخدام حقنة زجاجية ويصوتن لهم مرتين في كوب زجاجي في درجة حرارة الغرفة، لأول مرة مع 5 مل من EA لمدة 10 دقيقة ثم مع 3 مل من EA لمدة 10 دقيقة.
- نقل بومقتطفات عشر إلى أنبوب زجاجي واحد، والتركيز عليها إلى 2 مل من ضربة النيتروجين لطيف إلى أسفل، وتقسيمها إلى قسمين 1 مل الكسور (للGC-MS وتحليل LC-MS / MS، على التوالي).
- تركيز مقتطفات إلى 0.5 مل من لطيف النيتروجين ضربة إلى أسفل وتبادل المذيب إلى CH / ACE (90/10، ت / ت) لتحليل GC-MS 22. تركيز مقتطفات إلى 0.5 مل من لطيف النيتروجين ضربة إلى أسفل وتبادل المذيب إلى إيه سي للتحليل LC-MS / MS 22.
4. عينات المياه
- ارتفاع 20 مل عينة المياه مع 100 ميكرولتر من هو خليط (ج = 5 نغ مل -1) باستخدام حقنة زجاجية، إضافة 3 مل من DCM، دوامة لمدة 3 دقائق، وصب في فاصل مرحلة لتحليل GC-MS 22.
- بعد يتم فصل المرحلتين، ترشح مرحلة DCM في أنبوبة زجاجية. كرر استخراج باستخدام 3 مل • قرار مجلس الوزراء، وشطف أنبوب مع 2 مل DCM. وأخيرا، والتركيز على مقتطفات إلى 0.5 مل من لطيف النيتروجين ضربة إلى أسفل وحجز النقدجنرال الكتريك المذيب إلى CH / ACE (90/10، ت / ت).
- تحليل عينات المياه باستخدام حقن كمية كبيرة، على غرار الطريقة الموصوفة في مواضع أخرى من LC-MS / MS 21.
5. التحليل الآلي
- تحليل GC-MS
- إجراء تحليل أساسي من مقتطفات CH / ACE باستخدام أنظمة GC-MS في التأين الإلكترون (EI) ووضع الكيميائية التأين السلبي (NCI)، على التوالي 22.
- للأسلوب GC-MS باستخدام EI، وضخ aliquots من 1 ميكرولتر مع طريقة الحقن splitless على عمود HP-5MS واجهة المستخدم (30 م، 0.25 مم القطر الداخلي، 0.25 ميكرون فيلم).
- لGC-MS طريقة استخدام CI، وضخ aliquots من 3 ميكرولتر على عمود HP-5MS واجهة المستخدم (30 م، 0.25 مم القطر الداخلي، 0.25 ميكرون فيلم).
- تحليل HPLC-MS / MS
- تفاعل إجراء تحليل أساسي من إيه سي مقتطفات باستخدام HPLC-MS / MS مع مصدر تأين بالإرذاذ الإلكتروني في السالب ((-) ESI) وإيجابي أيون مقصيدة ((+) ESI) 22.
- ل(+) ESI، وتمييع 100 ميكرولتر من إيه سي مقتطفات مع 900 ميكرولتر الماء عالى النقاء تعديلها لدرجة الحموضة 5 باستخدام كرة القدم.
- ل(-) ESI، وتمييع 100 ميكرولتر من إيه سي المستخلصات مع 900 حل ميكرولتر من 1٪ اتحاد كرة القدم في الماء عالى النقاء.
- ل(+) ESI، استخدم التدرج ثنائي يتكون من 2-بروبانول / الميثانول / 10 ملي فورمات الأمونيوم (6/2/92، ت / ت / ت) وMeOH بمعدل تدفق 0.3 مل دقيقة -1.
- ل(-) ESI، استخدم التدرج ثنائي يتكون من إيه سي / عالى النقاء المياه 0.1٪ HAC وإيه سي + 0.1٪ HAC بمعدل تدفق 0.3 مل دقيقة -1.
- حقن جميع العينات باستخدام حقن كمية كبيرة من 500 ميكرولتر باستخدام عمودين على الانترنت SPE (سواء 20 × 2 مم الهوية و20-25 ميكرومتر حجم الجسيمات)، والعمود التحليلي (C 18، 100 × 3 مم، 3.5 ميكرون) 21.
6. نظرية على أخذ العينات سلبية
ملاحظة: الملف الشخصي امتصاص المادة الكيميائية إلى جامعة المدينة العالمية العينات سلبيةينقسم م (PSM) إلى ثلاثة أقسام: خطي، منحني الأضلاع والتوازن (الشكل 3).
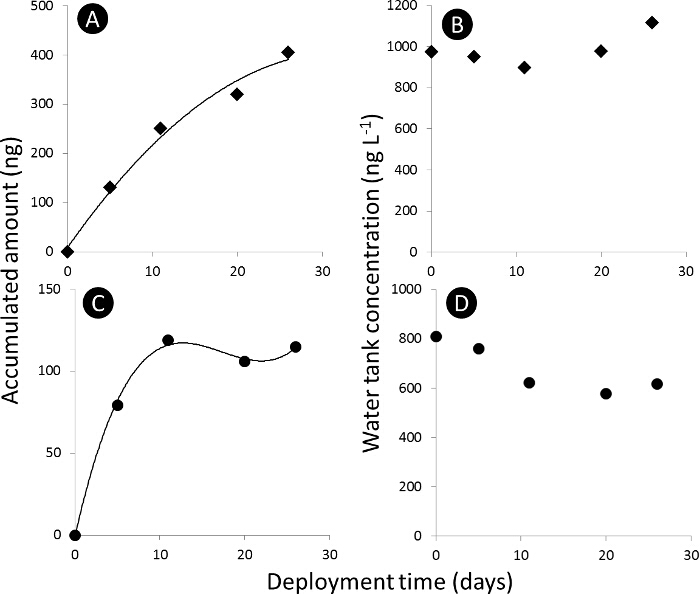
الرقم 3. السلبي منحنى العينات امتصاص. أ) و C) منحنى الامتصاص عن المبلغ المتراكم من أسيتامبريد ودايميثويت، على التوالي، في العينات سلبية (N ر) في نانوغرام المطلق، و B) وD) تركيز خزان مياه من أسيتامبريد ودايميثويت، على التوالي، في نانوغرام L - 1. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- حساب حجم المياه أي ما يعادل (V مكافئ L) لالعينات السالبة بقسمة المبلغ المتراكم من المركبات المستهدفة في العينات السالبة بعد أيام طن من التعرض (N 'ر ، نغ) من خلال التركيز في المرحلة المياه باستخدام انتزاع ووقت أخذ العينات نشطة متكاملة (ج ث، نغ L -1).
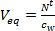 (1)
(1) - اشتقاق معدل أخذ العينات (R S، L يوم -1) من مرحلة امتصاص خطية من الشخصية امتصاص، من خلال اتخاذ المنحدر من الخامس مكافئ مقابل وقت التطبيق.
- حساب K PW (كلغ L -1) لمبيدات الآفات الفردية باستخدام المعادلة. 2.
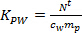 (2)
(2)
حيث م ع هي كتلة المواد الماصة في العينات (نانوغرام). - في مرحلة امتصاص الخطية، وحساب تركيز TWA الحليلة في المياه التي يحصل عليها في العينات السالبة (ج TWA، نانوغرام L -1) باستخدام المعادلة. 3.
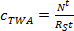 (3)
(3)
حيث R S هو سامعدل mpling (L يوم -1)، و t هو الوقت نشر (أيام). - في المرحلة المنحنية، وحساب ج TWA باستخدام المعادلة. 4.
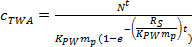 (4)
(4) - في مرحلة التوازن، وحساب ج TWA باستخدام المعادلة. 5.
 (5)
(5)
7. تحليل البيانات الإحصائية
- اختبار التوزيع غير العادي للبيانات باستخدام اختبار شابيرو-ويلك 23. استخدام غير حدودي سبيرمان ارتباط رتبة لK PW وR S مقابل الخصائص الفيزيائية للمبيدات المختبرة (رو سبيرمان تتراوح بين -1 و 1) 24.
النتائج
وتمت مقارنة خمس تقنيات العينات السالبة مختلفة لاستيعاب 124 إرث والمبيدات المستخدمة حاليا بما في ذلك المطاط سيليكون (الشكل 1)، وPOCIS A، B POCIS، SDB-RPS وC 18 القرص (الشكل 2). تم تحسين أداء طريقة استخراج والتحليل الآلي. نتائج التجارب المعم?...
Discussion
لمراقبة الجودة، وإجراءات موحدة، والفراغات المختبر، تم فحص حدود الكشف (اللد)، المبالغ المستردة، والتكرار 23. تم الكشف عن عدد قليل من المبيدات في عينات فارغة في مستويات تركيز منخفضة. وضعت LODs حيث بلغت قيمة أدنى نقطة على منحنى المعايرة التي تلبي معايير إشارة إلى نسب...
Disclosures
The authors have nothing to disclose.
Acknowledgements
The Swedish EPA (Naturvårdsverket) (agreement 2208-13-001) and Centre for Chemical Pesticides (CKB) are gratefully acknowledged for funding this project. We thank Märit Peterson, Henrik Jernstedt, Emma Gurnell and Elin Paulsson at the OMK-lab, SLU, for skillful assistance with analytical support and supply of pesticide standards.
Materials
| Name | Company | Catalog Number | Comments |
| Methanol | Merck Millipore | 1.06035.2500 | |
| Acetonitrile | Merck Millipore | 1.00029.2500 | |
| Acetone | Merck Millipore | 1.00012.2500 | |
| 2-propanol | Merck Millipore | 1.00272.2500 | |
| Dichloromethane | Merck Millipore | 1.06054.2500 | |
| Ammoniak | Merck Millipore | 1.05428.1000 | Purity 25% |
| Formic acid | Sigma-Aldrich | 94318-50ML-F | Purity ~98% |
| Ethyl acetate | Sigma-Aldrich | 31063-2.5L | for pesticide residue analysis |
| Petroleum ether | Sigma-Aldrich | 34491-4X2.5L | for pesticide residue analysis |
| Acetic acid | Sigma-Aldrich | 320099-500ML | Purity ≥99.7% |
| Cyclohexane | Fisher Chemicals | C/8933/17 | for residue analysis |
| Empty polypropylene SPE Tube with PE frits, 20 μm porosity, volume 6 ml | Supelco | 57026 | |
| Empore SPE Disks, C18, diam. 47 mm | Supelco | 66883-U | Passive sampler |
| Empore SPE Disks, SDB-RPS (Reversed-Phase Sulfonate), diam. 47 mm | Supelco | 66886-U | Passive sampler |
| POCIS-A | EST | POCIS-HLB | Passive sampler |
| POCIS-B | EST | POCIS-Pesticide | Passive sampler |
| Polyethersulfone (PES) membranes | EST | PES | |
| Silicone rubber sheet | Altec | 03-65-4516 | Passive sampler |
| Agilent 5975C | Agilent Technologies | 5975C | GC-MS |
| HP-5MS UI | J&W Scientific | HP-5MS | Analytical column for GC-MS |
| Agilent 6460 | Agilent Technologies | 6460 | HPLC-MS/MS |
| Strata C18–E, 20 x 2 mm id and 20–25 μm particle size | Phenomenex | Strata C18–E | Online SPE column for LC-MS/MS |
| Strata X, 20 x 2 mm id and 20–25 μm particle size | Phenomenex | Strata X | Online SPE column for LC-MS/MS |
| Zorbax Eclipse Plus C18 | Agilent Technologies | Zorbax Eclipse Plus C18 | Analytical column for LC-MS/MS |
| Isolute phase separator, 25 ml | Biotage | 120-1907-E | |
| Stainless steel blind rivet, 3.2x10 mm | Ejot & Avdel | 951222 |
References
- Rodney, S. I., Teed, R. S., Moore, D. R. J. Estimating the toxicity of pesticide mixtures to aquatic organisms: A review. Hum. Ecol. Risk Assess. 19 (6), 1557-1575 (2013).
- Kreuger, J. Pesticides in stream water within an agricultural catchment in southern Sweden, 1990-1996. Sci. Total Environ. 216 (3), 227-251 (1998).
- Carlson, J. C., Challis, J. K., Hanson, M. L., Wong, C. S. Stability of pharmaceuticals and other polar organic compounds stored on polar organic chemical integrative samplers and solid-phase extraction cartridges. Environ. Toxicol. Chem. 32 (2), 337-344 (2013).
- Alvarez, D. A., et al. Development of a passive, in situ, integrative sampler for hydrophilic organic contaminants in aquatic environments. Environ. Toxicol. Chem. 23 (7), 1640-1648 (2004).
- Vrana, B., et al. Passive sampling: An effective method for monitoring seasonal and spatial variability of dissolved hydrophobic organic contaminants and metals in the Danube river. Environ. Pollut. 184, 101-112 (2014).
- Dougherty, J. A., Swarzenski, P. W., Dinicola, R. S., Reinhard, M. Occurrence of herbicides and pharmaceutical and personal care products in surface water and groundwater around Liberty Bay, Puget Sound, Washington. J. Environ. Qual. 39 (4), 1173-1180 (2010).
- Muñoz, I., Martìnez Bueno, M. J., Agüera, A., Fernández-Alba, A. R. Environmental and human health risk assessment of organic micro-pollutants occurring in a Spanish marine fish farm. Environ. Pollut. 158 (5), 1809-1816 (2010).
- Wille, K., et al. Rapid quantification of pharmaceuticals and pesticides in passive samplers using ultra high performance liquid chromatography coupled to high resolution mass spectrometry. J. Chromatogr. A. 1218 (51), 9162-9173 (2011).
- Poulier, G., et al. Estimates of pesticide concentrations and fluxes in two rivers of an extensive French multi-agricultural watershed: application of the passive sampling strategy. Environ. Sci. Pollut. Res. 22 (11), 8044-8057 (2015).
- Moschet, C., Vermeirssen, E. L. M., Singer, H., Stamm, C., Hollender, J. Evaluation of in-situ calibration of chemcatcher passive samplers for 322 micropollutants in agricultural and urban affected rivers. Water Res. 71, 306-317 (2015).
- Petty, J. D., et al. An approach for assessment of water quality using semipermeable membrane devices (SPMDs) and bioindicator tests. Chemosphere. 41 (3), 311-321 (2000).
- Metcalfe, C. D., et al. Contaminants in the coastal karst aquifer system along the Caribbean coast of the Yucatan Peninsula, Mexico. Environ. Pollut. 159 (4), 991-997 (2011).
- Allan, I. J., et al. Field performance of seven passive sampling devices for monitoring of hydrophobic substances. Environ. Sci. Technol. 43 (14), 5383-5390 (2009).
- Vrana, B., et al. Passive sampling techniques for monitoring pollutants in water. TrAC - Trend. Anal. Chem. 24 (10), 845-868 (2005).
- Allan, I. J., Harman, C., Ranneklev, S. B., Thomas, K. V., Grung, M. Passive sampling for target and nontarget analyses of moderately polar and nonpolar substances in water. Environ. Toxicol. Chem. 32 (8), 1718-1726 (2013).
- Escher, B. I., et al. Evaluation of contaminant removal of reverse osmosis and advanced oxidation in full-scale operation by combining passive sampling with chemical analysis and bioanalytical tools. Environ. Sci. Technol. 45, 5387-5394 (2011).
- Pesce, S., Morin, S., Lissalde, S., Montuelle, B., Mazzella, N. Combining polar organic chemical integrative samplers (POCIS) with toxicity testing to evaluate pesticide mixture effects on natural phototrophic biofilms. Environ. Pollut. 159 (3), 735-741 (2011).
- Booij, K., Smedes, F., Van Weerlee, E. M., Honkoop, P. J. C. Environmental monitoring of hydrophobic organic contaminants: The case of mussels versus semipermeable membrane devices. Environ. Sci. Technol. 40 (12), 3893-3900 (2006).
- Harman, C., Allan, I. J., Vermeirssen, E. L. M. Calibration and use of the polar organic chemical integrative sampler-a critical review. Environ. Toxicol. Chem. 31 (12), 2724-2738 (2012).
- Jonker, M. T. O., Der Heijden, S. A. V. a. n., Kotte, M., Smedes, F. Quantifying the effects of temperature and salinity on partitioning of hydrophobic organic chemicals to silicone rubber passive samplers. Environ. Sci. Technol. 49 (11), 6791-6799 (2015).
- Jansson, C., Kreuger, J. Multiresidue analysis of 95 pesticides at low nanogram/liter levels in surface waters using online preconcentration and high performance liquid chromatography/tandem mass spectrometry. J. AOAC Int. 93 (6), 1732-1747 (2010).
- Ahrens, L., Daneshvar, A., Lau, A. E., Kreuger, J. Characterization of five passive sampling devices for monitoring of pesticides in water. J. Chromatogr. A. 1405, 1-11 (2015).
- Royston, P. Approximating the Shapiro-Wilk W-test for non-normality. Stat. Comput. 2 (3), 117-119 (1992).
- Gauthier, T. D. Detecting trends using Spearman's rank correlation coefficient. Environ. Forensics. 2 (4), 359-362 (2001).
- Morin, N., Miège, C., Coquery, M., Randon, J. Chemical calibration, performance, validation and applications of the polar organic chemical integrative sampler (POCIS) in aquatic environments. TrAC - Trend. Anal. Chem. 36, 144-175 (2012).
- . Water Quality - Sampling - Part 23: Guidance on Passive Sampling in Surface Waters. ISO 5667-23:2011. , (2011).
- Morin, N., Camilleri, J., Cren-Olivé, C., Coquery, M., Miège, C. Determination of uptake kinetics and sampling rates for 56 organic micropollutants using "pharmaceutical" POCIS. Talanta. 109, 61-73 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved