Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Caracterización y Aplicación de muestreadores pasivos para la vigilancia de plaguicidas en el agua
En este artículo
Resumen
A protocol about the characterization and application of five different passive sampling devices is presented.
Resumen
Cinco diferentes muestreadores pasivos de agua fueron calibrados bajo condiciones de laboratorio para la medición de 124 legado y los pesticidas usados actuales. Este estudio proporciona un protocolo para la preparación muestreador pasivo, calibración, el método de extracción y análisis instrumental. Frecuencias de muestreo (R S) y los coeficientes de reparto de muestras de agua pasivos (K PW) se calcularon para caucho de silicona, polar integradora química orgánica muestreador POCIS-A, POCIS-B, SDB-RPS y el disco C18. La absorción de los compuestos seleccionados depende de sus propiedades fisicoquímicas, es decir, caucho de silicona mostró un mejor absorción de los compuestos más hidrófobos (log coeficiente de reparto octanol-agua (K OW)> 5,3), mientras que POCIS-A, POCIS-B y SDB- RPS disco eran más adecuados para los compuestos hidrófilos (log K OW <0,70).
Introducción
Los pesticidas se introducen continuamente en el medio acuático y pueden suponer un riesgo para los organismos acuáticos 1. Control de los plaguicidas en el medio acuoso se realiza típicamente mediante toma de muestras puntuales, sin embargo, esta técnica de muestreo no tiene en cuenta plenamente las variaciones temporales en las concentraciones debido a las fluctuaciones en las entradas de flujo o esporádicos (por ejemplo, la precipitación, derrames de aguas negras combinadas, de liberación laguna de aguas residuales) 2 , 3. Por lo tanto, los métodos de monitoreo deben ser mejorados para una mejor estimación de los riesgos ambientales asociados a los plaguicidas. Muestreo pasivo permite la monitorización continua durante un período prolongado de tiempo con mínima infraestructura y las concentraciones de contaminantes de bajo 4,5.
Muestreadores pasivos han demostrado ser una herramienta valiosa para el monitoreo del agua subterránea 6, el agua dulce 7-10, aguas residuales y aguas marinas 11 12. Además de los propósitos de monitoreo 13,14, muestreadores pasivos también se han utilizado para el análisis no objetivo 15, las pruebas de toxicología 16,17, y como una alternativa a en sedimentos y biomonitorización 18. Muestreadores pasivos se acumulan productos químicos de forma continua a partir de agua y proporcionan el tiempo promedio ponderado (TWA) Las concentraciones 14. La absorción del contaminante depende de la frecuencia de muestreo (R S) y el coeficiente de reparto de muestras de agua pasiva (K PW), que depende del diseño pasivo de muestras, material de toma de muestras, las propiedades físico-químicas de los contaminantes y las condiciones ambientales (por ejemplo, agua turbulencia, temperatura) 13,14,19,20.
El detallada de vídeo tiene como objetivo mostrar cómo calibrar y aplicar muestreadores pasivos de pesticidas en el agua. Los objetivos específicos incluyen i) llevar a cabo la preparación, extracción y análisis instrumental para 124 plaguicidas individuales utilizando cinco tipos diferentes de sampl pasivaERS, incluyendo caucho de silicona, polar muestreador integradora química orgánica (POCIS) -A, B-POCIS, SDB-RPS y C 18 de disco, ii) evaluar R S y K PW de los pesticidas en un estudio de la absorción de laboratorio, y iii) para demostrar cómo seleccionar el muestreador pasivo apropiada del compuesto diana de interés y la forma de calcular las concentraciones TWA para el respectivo muestreador pasivo.
Los patrones de referencia y los dispositivos de muestreo pasivo,
Compuestos de interés incluyen 124 legado y los pesticidas utilizados en la actualidad, incluyendo herbicidas, insecticidas y fungicidas (Tabla 1). Mezcla estándar interno (IS mezcla) incluido fenoprop (2,4,5-TP), clotianidina-D 3, etión y terbutilazina D-5. Otros productos químicos utilizados incluyen metanol (MeOH), acetonitrilo (ACN), acetona (ACE), diclorometano (DCM), ciclohexano (CH), acetato de etilo (EA), et petróleosu (PE), 2-propanol, solución de amoníaco al 25%, ácido acético (HAc) y ácido fórmico (FA). Cinco dispositivos de muestreo pasivo se caracterizaron diferentes, incluyendo caucho de silicona, POCIS-A y B-POCIS, SDB-RPS, y C 18 1,21 disco.
Tabla 1. Tasa de muestreo de muestreo pasivo (R 'S, L día -1), los coeficientes de reparto de muestras de agua (K' PW, L kg -1) y las ecuaciones (Ec.) Utilizados para el cálculo de concentraciones en muestras de campo para particulares pesticidas a. (Reimpresión de la revista Journal of Chromatography A, 1405, Lutz Ahrens, Atlasi Daneshvar, Anna E. Lau, Jenny Kreuger, Caracterización de cinco dispositivos de muestreo pasivo para el monitoreo de plaguicidas en el agua, 1-11, Derechos de Autor (2015), con permiso de Elsevier .) 22 Haga clic aquí para descargar este archivo.
Protocolo
1. Pasivo Sampler Diseño y Preparación
- Láminas de caucho de silicona
- Cortar las hojas de caucho de silicona (600 mm x 600 mm, 0,5 mm de espesor) en tiras de 2,5 mm x 600 mm y 2,5 mm x 314 mm utilizando un cortador de acero inoxidable y la conexión mediante un remache ciego de acero inoxidable (3,2 mm x 10 mm ) con una pistola de remachar para obtener un tamaño total de muestras de banda de 2,5 mm x 914 mm (área de superficie = 457 cm 2, la masa de sorbente = 15,6 g, volumen = 22,9 cm 3).
- Coloque los cauchos de silicona en una cámara de extracción de un aparato de Soxhlet. Añadir 50 ml de EA en la cámara de extracción y añadir 250 ml de EA y tres piedras de ebullición en un matraz redondo de 500 ml botella.
- Conectar la cámara de extracción con el matraz de botella y un condensador. Limpiar los cauchos de silicona mediante extracción Soxhlet durante 96 horas a aproximadamente 80 ° C, y secarlos a partir de entonces bajo gas nitrógeno suave.
- Una los stri de caucho de siliconape a un soporte de muestra de acero inoxidable araña envolviendo la banda de caucho de silicona alrededor de las varillas en el soporte (Figura 1). Fije cada extremo de la banda de caucho de silicona a una varilla en el soporte mediante uniones de cable.

Figura 1. Esquema de caucho de silicona. Esquemática del muestreo pasivo de caucho de silicona que muestra la fijación de la banda de caucho de silicona a una muestra de acero inoxidable titular de la araña A) de la parte superior y B) la vista lateral. Haga clic aquí para ver una versión más grande de esta figura.
- POCIS-A y B-POCIS
- Para POCIS-A, colocar 220 mg de HLB mayor sorbente (área de superficie = 1,78 x 10 6 cm 2) entre dos 9,0 cm por 9,0 cm square polietersulfona (PES) membranas (Figura 2).
- Para POCIS-B, colocar 220 mg de una mezcla de sorbente (es decir, resina hidroxilada poliestireno-divinilbenceno (80%) y un adsorbente carbonoso dispersado sobre un copolímero de estireno-divinilbenceno (20%)) (área de superficie = 2,82 x 10 6 cm 2) entre dos membranas de PES (Figura 2).
- Comprimir el sorbente y dos de PSA entre dos anillos de acero inoxidable de forma manual (Ø interior = 5,4 cm) y fijarlo en un soporte de muestra de acero inoxidable (Figura 2).

Figura 2. Esquema de los discos del muestreo pasivo. Esquemática muestreador pasivo para POCIS A, B POCIS, disco SDB-RPS y C 18 en disco que muestra A) el montaje del muestreador pasivo utilizando anillos de acero inoxidable, polietersulfona Membranas (PES)ES, y la fase de recepción, y B) el montaje en un soporte de muestra de acero inoxidable. Haga clic aquí para ver una versión más grande de esta figura.
- Disco SDB-RPS y C 18 discos
- Coloque la SDB-RPS (superficie = 35 cm 2, la masa de sorbente = 0,34 g, volumen = 1,7 cm 3) y C 18 discos (Superficie = 35 cm 2, la masa de sorbente = 0,58 g, volumen = 1,7 cm3) entre dos membranas de PES (Figura 2). Comprimir los discos y dos PES entre dos anillos de acero inoxidable de forma manual (Ø interior = 5,4 cm) y fijarlo en un soporte de muestra de acero inoxidable (Figura 2).
2. Los experimentos de laboratorio de captación
NOTA: Se realizaron los experimentos de absorción de laboratorio para caracterizar cuantitativamente la absorción kinetics de 124 pesticidas individuales para cinco dispositivos diferentes del muestreo pasivo en condiciones controladas.
- Llevar a cabo el estudio de la absorción en recipientes de vidrio rectangulares (cada ~ 95 L): Tanque 1) de caucho de silicona (n = 16), el tanque 2) POCIS-A (n = 16), POCIS-B (n = 16), y el tanque 3 ) SDB-RPS disco (n = 16), C18 disco (n = 16). Llenar de agua natural en los tres tanques.
- Realizar todos los experimentos a una temperatura constante del agua (~ 20 ° C) y bajo condiciones de turbulencia de agua (~ 10 cm seg -1) usando dos bombas eléctricas unidas a la pared en cada lado. Realizar los experimentos en la oscuridad para minimizar el efecto de la fotodegradación.
- Pico de cada recipiente de vidrio con una mezcla estándar de pesticida que contiene 124 plaguicidas por medio de una jeringa de vidrio (c ≈ 400 ng L-1 para plaguicidas individuales en el tanque de agua). Sacar los muestreadores pasivos manualmente de los tanques, a intervalos de tiempo de 5, 11, 20, y 26 days, para determinar las velocidades de muestreo de los pesticidas.
- Monitorear las concentraciones de los pesticidas en cada tanque mediante la recopilación de 100 ml muestras de agua en días 0, 5, 11, 20, y 26. El análisis de las muestras de agua se realiza como se describe en otro lugar 21.
- Para el control de calidad, se expongan las muestras en blanco al aire ambiente durante 1 hora en el día 0 y luego almacenar y tratarlos como muestras reales. Almacenar todos los extractos, así como los 100 ml muestras de agua recogidas de los tanques a -18 ° C hasta su posterior análisis.
Extracción 3. Muestra
- Goma de silicona
- Antes de la extracción, se seca la banda de caucho de silicona bajo una corriente de gas nitrógeno de alta pureza.
- Para la espectrometría de masa de cromatografía de gas de análisis (GC-MS), llevar a cabo la extracción sólido-líquido mediante extracción Soxhlet 22.
- Coloque la goma de silicona en el extractor Soxhlet. Añadir 250 ml PE / ACE (50/50, v / v) y 3 boiling piedras en el frasco de la botella redonda.
- Pico de la goma de silicona con 100 l de una mezcla de ES (ml-1 c = 5 ng) utilizando una jeringa de vidrio. Añadir 50 ml PE / ACE (50/50, v / v) en el extractor Soxhlet. Encender el calentador y ejecutar la extracción Soxhlet durante 19 horas y luego apagar el calentador.
- Se concentran los extractos por evaporación rotatoria seguido de suave de nitrógeno por soplado hasta 1 ml. Intercambiar el disolvente a CH / ACE (90/10, v / v) mediante la adición de tres veces 1 ml CH / ACE (90/10, v / v) durante el nitrógeno soplado hasta 1 ml.
- Para la cromatografía líquida-espectrometría de masas en tándem análisis (LC-MS / MS), llevar a cabo la extracción mediante extracción Soxhlet 22.
- Coloque la goma de silicona en el extractor Soxhlet. Añadir 250 ml de MeOH y 3 piedras de ebullición en el matraz de la botella redonda y 50 ml de MeOH en el extractor Soxhlet. Pico de la goma de silicona con 100 l de una mezcla de ES (c = 5 ng ml-1) con un vaso SYRInge.
- Encender el calentador y ejecutar la extracción Soxhlet durante 19 horas y luego apagar el calentador. Se concentran los extractos por evaporación rotatoria seguido de suave de nitrógeno por soplado hasta 1 ml. Intercambiar el disolvente a ACN mediante la adición de 1 ml de ACN durante el nitrógeno soplado hasta 1 ml.
- POCIS-A y B-POCIS
- Abra el muestreador POCIS con cuidado y transferir el sorbente con agua ultrapura utilizando un embudo en un cartucho pre-limpiado polipropileno vacío sólido de extracción en fase (SPE) (6 ml) que contiene dos fritas de polietileno (PE). Secar el sorbente por vacío para eliminar el agua. Anotar el peso del cartucho de SPE vacío y lleno para controlar el peso del material sorbente. Tenga en cuenta que los diferentes cartuchos se utilizan para GC-MS y análisis LC-MS / MS.
- Antes de la elución, spike el sorbente con 100 l de una mezcla de SE (ml-1 c = 5 ng) utilizando una jeringa de vidrio. sorbentes eluyen POCIS-A y B usando POCIS-5EA ml de GC-MS 22.
- Se concentran los extractos a 1 ml por nitrógeno suave golpe hacia abajo. Intercambiar el disolvente a CH / ACE (90/10, v / v) mediante la adición de tres veces 1 ml CH / ACE (90/10, v / v) durante el nitrógeno soplado hasta 1 ml.
- Eluir cartuchos POCIS-A y POCIS-B utilizando 1,5 ml de MeOH, seguido de 8 ml de DCM / MeOH (80/20, v / v) para el análisis de LC-MS / MS 22. Se concentran los extractos a 1 ml por nitrógeno suave golpe hacia abajo. Intercambiar el disolvente a ACN mediante la adición de 1 ml de ACN durante el nitrógeno soplado hasta 1 ml.
- SDB-RPS y C 18 discos
- Transferir los discos individuales de SDB-RPS y C18 disco en un vaso de vidrio y secarlos bajo gas nitrógeno. Pico de los discos con 100 l de una mezcla de ES (c = 5 ng ml -1) usando una jeringa de vidrio y los sonicar dos veces en un vaso de vidrio a temperatura ambiente, primero con 5 ml de EA para 10 min y luego con 3 ml de EA durante 10 minutos.
- bo transferenciath extractos en un tubo de vidrio, se concentran a 2 ml por golpe suave de nitrógeno hacia abajo, y los dividieron en dos fracciones de 1 ml (por GC-MS y análisis LC-MS / MS, respectivamente).
- Se concentran los extractos a 0,5 ml por suave de nitrógeno soplado hacia abajo y cambiar el disolvente a CH / ACE (90/10, v / v) para el análisis GC-MS 22. Se concentran los extractos a 0,5 ml por suave de nitrógeno soplado hacia abajo y cambiar el disolvente a ACN para el análisis LC-MS / MS 22.
4. Las muestras de agua
- Pico de 20 ml de la muestra de agua con 100 l de una mezcla de ES (c = 5 ng ml -1) usando una jeringa de vidrio, añadir 3 ml de DCM, de vórtice durante 3 min, y se decanta en un separador de fases para el análisis de GC-MS 22.
- Después de las dos fases se separan, la fase de DCM filtrarse en un tubo de vidrio. Repetir la extracción usando 3 ml de DCM, y enjuague el tubo con 2 ml de DCM. Por último, concentrar los extractos de 0,5 ml por suave de nitrógeno soplado hacia abajo y exchange el disolvente a CH / ACE (90/10, v / v).
- Analizar las muestras de agua usando la inyección de gran volumen, de forma similar al método descrito en otra parte por LC-MS / MS 21.
5. Análisis Instrumental
- El análisis por GC-MS
- Realizar el análisis instrumental de los extractos de CH / ACE utilizando sistemas GC-MS en la ionización electrónica (EI) y el modo de ionización química negativa (NCI), respectivamente 22.
- Para el método GC-MS mediante la IE, se inyectan alícuotas de 1 l con el método de inyección sin fraccionamiento en una columna HP-5MS interfaz de usuario (30 m, 0,25 mm de diámetro interno, 0,25 m de película).
- Para el método que utiliza CG-EM CI, se inyectan alícuotas de 3 l en una columna HP-5MS interfaz de usuario (30 m, 0,25 mm de diámetro interno, 0,25 m de película).
- El análisis por HPLC-MS / MS
- Efectuar el análisis instrumental de la ACN extractos usando HPLC-MS / MS interconectado con una fuente de ionización por electrospray en negativo ((-) ESI) y de iones positivos moda ((+) ESI) 22.
- Para (+) ESI, diluir 100 l de la ACN extrae con 900 l de agua ultrapura se ajustó a pH 5 utilizando el FA.
- Para (-) ESI, diluir 100 l de la ACN extrae con 900 l de solución de 1% FA en agua ultrapura.
- Para (+) ESI, usar un gradiente binario que consta de formiato de amonio / metanol / 10 mM 2-propanol (02/06/92, v / v / v) y MeOH a un caudal de 0,3 ml min -1.
- Para (-) ESI, usar un gradiente binario que consiste en ACN / agua ultrapura 0,1% HAc y ACN + 0,1% HAc a un caudal de 0,3 ml min -1.
- Inyectar todas las muestras usando una inyección de gran volumen de 500 l usando dos columnas en línea SPE (tanto 20 x 2 mm id y tamaño de partícula de 20-25 micras), y una columna analítica (C 18, 100 x 3 mm, 3,5 micras) 21.
6. Teoría de muestreo pasivo
NOTA: El perfil de absorción de la sustancia en la mediu muestreador pasivom (PSM) se divide en tres secciones: lineal, curvilínea y de equilibrio (Figura 3).
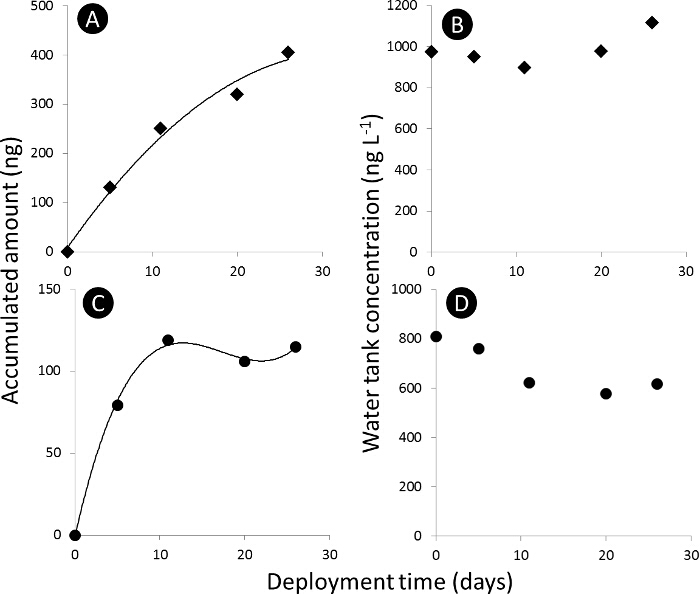
Figura 3. Curva de absorción del muestreo pasivo. A) y C) curva de absorción para la cantidad acumulada de acetamiprid y dimetoato, respectivamente, en los muestreadores pasivos (N t) en ng absoluta, y B) y D) la concentración tanque de agua de acetamiprid y dimetoato, respectivamente, en ng L - 1. Haga clic aquí para ver una versión más grande de esta figura.
- Calcular el volumen de agua equivalente (eq V L) para un muestreador pasivo dividiendo el importe acumulado de los compuestos de interés en el muestreador pasivo después de t días de exposición (N 't , ng) por la concentración en la fase acuosa usando agarrar y muestreo activo integrado tiempo (c w, ng L-1).
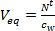 (1)
(1) - Derivar la frecuencia de muestreo (R S, L día -1) a partir de la fase de absorción lineal del perfil de captación, mediante la adopción de la pendiente de la ecuación V en función del tiempo de despliegue.
- Se calcula la K PW (L kg -1) para plaguicidas individuales utilizando la Ec. 2.
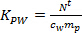 (2)
(2)
donde m es la masa p sorbente por muestreador (ng). - En la fase de absorción lineal, calcular la concentración TWA del analito en agua derivada por el muestreador pasivo (c TWA, ng L -1) usando la Ec. 3.
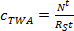 (3)
(3)
donde R S es la satasa mpling (L día -1), y T es el tiempo de despliegue (días). - En la fase curvilínea, calcular c TWA usando la Ec. 4.
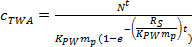 (4)
(4) - En la fase de equilibrio, calcular c TWA usando la Ec. 5.
 (5)
(5)
7. Análisis de datos estadísticos
- Prueba de distribución no normal de los datos mediante una prueba de Shapiro-Wilk 23. Utilice no paramétrico de correlación de Spearman para K PW S y R vs propiedades físico-químicas de los plaguicidas ensayados (rho de Spearman entre -1 y 1) 24.
Resultados
Cinco técnicas de muestreo pasivo, se compararon diferentes para la captación de 124 legado y los pesticidas usados actuales, incluyendo caucho de silicona (Figura 1), y POCIS A, B POCIS, SDB-RPS y C 18 de disco (Figura 2). El rendimiento del método de extracción y análisis instrumental se optimizó. El resultado de los experimentos de absorción de laboratorio se puede utilizar para calcular 'S y log K&#...
Discusión
Para el control de calidad, como procedimiento estándar, espacios en blanco de laboratorio, los límites de detección (LOD), las recuperaciones, y la repetibilidad fueron examinados 23. Unos pesticidas fueron detectados en las muestras de blanco a niveles de concentración bajos. LD se establecieron como el valor del punto más bajo de la curva de calibración que cumpla con los criterios de una relación señal a ruido de 3. Los límites de detección promedio fueron de 8,0 pg absoluta se inyecta en la col...
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
The Swedish EPA (Naturvårdsverket) (agreement 2208-13-001) and Centre for Chemical Pesticides (CKB) are gratefully acknowledged for funding this project. We thank Märit Peterson, Henrik Jernstedt, Emma Gurnell and Elin Paulsson at the OMK-lab, SLU, for skillful assistance with analytical support and supply of pesticide standards.
Materiales
| Name | Company | Catalog Number | Comments |
| Methanol | Merck Millipore | 1.06035.2500 | |
| Acetonitrile | Merck Millipore | 1.00029.2500 | |
| Acetone | Merck Millipore | 1.00012.2500 | |
| 2-propanol | Merck Millipore | 1.00272.2500 | |
| Dichloromethane | Merck Millipore | 1.06054.2500 | |
| Ammoniak | Merck Millipore | 1.05428.1000 | Purity 25% |
| Formic acid | Sigma-Aldrich | 94318-50ML-F | Purity ~98% |
| Ethyl acetate | Sigma-Aldrich | 31063-2.5L | for pesticide residue analysis |
| Petroleum ether | Sigma-Aldrich | 34491-4X2.5L | for pesticide residue analysis |
| Acetic acid | Sigma-Aldrich | 320099-500ML | Purity ≥99.7% |
| Cyclohexane | Fisher Chemicals | C/8933/17 | for residue analysis |
| Empty polypropylene SPE Tube with PE frits, 20 μm porosity, volume 6 ml | Supelco | 57026 | |
| Empore SPE Disks, C18, diam. 47 mm | Supelco | 66883-U | Passive sampler |
| Empore SPE Disks, SDB-RPS (Reversed-Phase Sulfonate), diam. 47 mm | Supelco | 66886-U | Passive sampler |
| POCIS-A | EST | POCIS-HLB | Passive sampler |
| POCIS-B | EST | POCIS-Pesticide | Passive sampler |
| Polyethersulfone (PES) membranes | EST | PES | |
| Silicone rubber sheet | Altec | 03-65-4516 | Passive sampler |
| Agilent 5975C | Agilent Technologies | 5975C | GC-MS |
| HP-5MS UI | J&W Scientific | HP-5MS | Analytical column for GC-MS |
| Agilent 6460 | Agilent Technologies | 6460 | HPLC-MS/MS |
| Strata C18–E, 20 x 2 mm id and 20–25 μm particle size | Phenomenex | Strata C18–E | Online SPE column for LC-MS/MS |
| Strata X, 20 x 2 mm id and 20–25 μm particle size | Phenomenex | Strata X | Online SPE column for LC-MS/MS |
| Zorbax Eclipse Plus C18 | Agilent Technologies | Zorbax Eclipse Plus C18 | Analytical column for LC-MS/MS |
| Isolute phase separator, 25 ml | Biotage | 120-1907-E | |
| Stainless steel blind rivet, 3.2x10 mm | Ejot & Avdel | 951222 |
Referencias
- Rodney, S. I., Teed, R. S., Moore, D. R. J. Estimating the toxicity of pesticide mixtures to aquatic organisms: A review. Hum. Ecol. Risk Assess. 19 (6), 1557-1575 (2013).
- Kreuger, J. Pesticides in stream water within an agricultural catchment in southern Sweden, 1990-1996. Sci. Total Environ. 216 (3), 227-251 (1998).
- Carlson, J. C., Challis, J. K., Hanson, M. L., Wong, C. S. Stability of pharmaceuticals and other polar organic compounds stored on polar organic chemical integrative samplers and solid-phase extraction cartridges. Environ. Toxicol. Chem. 32 (2), 337-344 (2013).
- Alvarez, D. A., et al. Development of a passive, in situ, integrative sampler for hydrophilic organic contaminants in aquatic environments. Environ. Toxicol. Chem. 23 (7), 1640-1648 (2004).
- Vrana, B., et al. Passive sampling: An effective method for monitoring seasonal and spatial variability of dissolved hydrophobic organic contaminants and metals in the Danube river. Environ. Pollut. 184, 101-112 (2014).
- Dougherty, J. A., Swarzenski, P. W., Dinicola, R. S., Reinhard, M. Occurrence of herbicides and pharmaceutical and personal care products in surface water and groundwater around Liberty Bay, Puget Sound, Washington. J. Environ. Qual. 39 (4), 1173-1180 (2010).
- Muñoz, I., Martìnez Bueno, M. J., Agüera, A., Fernández-Alba, A. R. Environmental and human health risk assessment of organic micro-pollutants occurring in a Spanish marine fish farm. Environ. Pollut. 158 (5), 1809-1816 (2010).
- Wille, K., et al. Rapid quantification of pharmaceuticals and pesticides in passive samplers using ultra high performance liquid chromatography coupled to high resolution mass spectrometry. J. Chromatogr. A. 1218 (51), 9162-9173 (2011).
- Poulier, G., et al. Estimates of pesticide concentrations and fluxes in two rivers of an extensive French multi-agricultural watershed: application of the passive sampling strategy. Environ. Sci. Pollut. Res. 22 (11), 8044-8057 (2015).
- Moschet, C., Vermeirssen, E. L. M., Singer, H., Stamm, C., Hollender, J. Evaluation of in-situ calibration of chemcatcher passive samplers for 322 micropollutants in agricultural and urban affected rivers. Water Res. 71, 306-317 (2015).
- Petty, J. D., et al. An approach for assessment of water quality using semipermeable membrane devices (SPMDs) and bioindicator tests. Chemosphere. 41 (3), 311-321 (2000).
- Metcalfe, C. D., et al. Contaminants in the coastal karst aquifer system along the Caribbean coast of the Yucatan Peninsula, Mexico. Environ. Pollut. 159 (4), 991-997 (2011).
- Allan, I. J., et al. Field performance of seven passive sampling devices for monitoring of hydrophobic substances. Environ. Sci. Technol. 43 (14), 5383-5390 (2009).
- Vrana, B., et al. Passive sampling techniques for monitoring pollutants in water. TrAC - Trend. Anal. Chem. 24 (10), 845-868 (2005).
- Allan, I. J., Harman, C., Ranneklev, S. B., Thomas, K. V., Grung, M. Passive sampling for target and nontarget analyses of moderately polar and nonpolar substances in water. Environ. Toxicol. Chem. 32 (8), 1718-1726 (2013).
- Escher, B. I., et al. Evaluation of contaminant removal of reverse osmosis and advanced oxidation in full-scale operation by combining passive sampling with chemical analysis and bioanalytical tools. Environ. Sci. Technol. 45, 5387-5394 (2011).
- Pesce, S., Morin, S., Lissalde, S., Montuelle, B., Mazzella, N. Combining polar organic chemical integrative samplers (POCIS) with toxicity testing to evaluate pesticide mixture effects on natural phototrophic biofilms. Environ. Pollut. 159 (3), 735-741 (2011).
- Booij, K., Smedes, F., Van Weerlee, E. M., Honkoop, P. J. C. Environmental monitoring of hydrophobic organic contaminants: The case of mussels versus semipermeable membrane devices. Environ. Sci. Technol. 40 (12), 3893-3900 (2006).
- Harman, C., Allan, I. J., Vermeirssen, E. L. M. Calibration and use of the polar organic chemical integrative sampler-a critical review. Environ. Toxicol. Chem. 31 (12), 2724-2738 (2012).
- Jonker, M. T. O., Der Heijden, S. A. V. a. n., Kotte, M., Smedes, F. Quantifying the effects of temperature and salinity on partitioning of hydrophobic organic chemicals to silicone rubber passive samplers. Environ. Sci. Technol. 49 (11), 6791-6799 (2015).
- Jansson, C., Kreuger, J. Multiresidue analysis of 95 pesticides at low nanogram/liter levels in surface waters using online preconcentration and high performance liquid chromatography/tandem mass spectrometry. J. AOAC Int. 93 (6), 1732-1747 (2010).
- Ahrens, L., Daneshvar, A., Lau, A. E., Kreuger, J. Characterization of five passive sampling devices for monitoring of pesticides in water. J. Chromatogr. A. 1405, 1-11 (2015).
- Royston, P. Approximating the Shapiro-Wilk W-test for non-normality. Stat. Comput. 2 (3), 117-119 (1992).
- Gauthier, T. D. Detecting trends using Spearman's rank correlation coefficient. Environ. Forensics. 2 (4), 359-362 (2001).
- Morin, N., Miège, C., Coquery, M., Randon, J. Chemical calibration, performance, validation and applications of the polar organic chemical integrative sampler (POCIS) in aquatic environments. TrAC - Trend. Anal. Chem. 36, 144-175 (2012).
- . Water Quality - Sampling - Part 23: Guidance on Passive Sampling in Surface Waters. ISO 5667-23:2011. , (2011).
- Morin, N., Camilleri, J., Cren-Olivé, C., Coquery, M., Miège, C. Determination of uptake kinetics and sampling rates for 56 organic micropollutants using "pharmaceutical" POCIS. Talanta. 109, 61-73 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados